变形链球菌(Streptococcus mutans)是口腔中典型的致龋细菌,能牢固地黏附在牙齿表面,代谢外源性糖产酸破坏牙釉质;又能与口腔中其他细菌共聚,逐渐形成一种结构复杂的牙菌斑生物膜,从而导致龋齿的发生[1-2]。所以,抑制S.mutans的生长或控制牙菌斑生物膜的形成,是预防龋齿发生的有效措施[3-4]。
类芽孢杆菌属(Paenibacillus)微生物具有增殖速率高、抗逆能力强、营养要求低的特点,其在生长代谢过程可产生抗菌肽、功能性小肽、蛋白水解酶以及胞外多糖等多种功能物质[5],因此具有重要的应用价值[6-9]。牛类芽孢杆菌(Paenibacillus bovis)BD3526是近期被发现的类芽孢杆菌属的新种,其代谢产物具有多种生物学功能,也是“下一代益生菌”潜在候选者[10-12]。各种研究表明益生菌可通过抑制致病菌生长,改善口腔微生物菌群,调节口腔免疫力等方式对各种口腔疾病产生积极的防治效果[13]。
研究发现,P.bovis BD3526以麦麸为发酵介质,能合成高活力的凝乳酶[14-15]和Fusaricidin类抗菌肽[16]等功能物质。本研究采用类似的发酵材料,以麦麸为培养基、P.bovis BD3526为发酵菌株,通过生长曲线、pH值变化和对S.mutans ATCC35668抑制活性的测定,再通过酶解处理、热稳定性和pH适用范围,以及对口腔中其他益生菌的影响等方面的研究,初步判定P.bovis BD3526所产对变形链球菌抑菌物质的类型及抑菌特性,为后续深入研究与产品开发提供理论基础。
1 材料与方法
1.1 材料与试剂
供试菌株:Paenibacillus bovis BD3526、唾液链球菌(Streptococcus salivarius)BD3900、植物乳杆菌(Lactobacillus plantarum)ST-III和干酪乳杆菌(Lactobacillus casei)LC2 W,乳业生物技术国家重点实验室提供; Streptococcus mutans ATCC35668,中国普通微生物菌种保藏管理中心。
脱脂乳(skimmed milk,SKM)培养基,配制质量浓度为40 g/L的脱脂乳液体培养基,于118 ℃灭菌15 min,冷却备用;麦麸培养基,配制质量浓度为30 g/L(装量为60 mL/250 mL三角瓶),先在电炉上糊化5~10 min,再于121 ℃灭菌20 min,冷却备用;脑心浸出液肉汤(brain heart infusion,BHI)培养基,英国OXIOD公司;TYC培养基,上海瑞楚生物科技有限公司;MRS培养基,默克化工技术(上海)有限公司。
将P.bovis BD3526划线于TYC固体平板上,30 ℃好氧培养72 h,活化2代后,挑取1~2个单菌落,接种于质量浓度40 g/L脱脂乳粉液体培养基中(装量为20 mL/100 mL三角瓶),30 ℃、180 r/min摇床中培养20 h,调整至活菌数1.0×108~2.0×108CFU/mL,即得P.bovis BD3526发酵种子液。
过氧化氢酶(来源于牛肝脏)、α-淀粉酶(来源于人类唾液)、胃蛋白酶(来源于猪胃黏膜)、胰蛋白酶(来源于猪胰腺)和链霉蛋白酶(来源于灰色链霉菌),西格玛奥德里奇(上海)贸易有限公司;脱脂乳粉,新西兰恒天然集团;麦麸,当地农贸市场;其他有机化学试剂均是分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
HVE-50型高压灭菌锅,日本HIRAYAMA公司;GNP-9270型隔水恒温培养箱,上海精宏实验设备有限公司;SG-402TX型超净工作台,美国BAKER公司;PB-100型pH计,德国赛多利斯公司;HZQ-X500C大型恒温振荡器,上海一恒科学仪器有限公司;BUGBOX型厌氧培养箱,英国Ruskinn公司;Millipore-Q超纯水仪,美国密理博公司;RW20.n高速电动搅拌机,德国IKA公司;LABOROTA 4000旋转蒸发仪,德国Heidolph公司;3-18K高速冷冻离心机,德国SIGMA离心机实验室公司;Micro 17R微量台式离心机,美国Thermo Fisher公司;MDF-U73V型医用超低温冰箱,日本松下电子公司。
1.3 实验方法
1.3.1 指示菌平板制备
将S.mutans ATCC35668从超低温冰箱中取出,划线于BHI固体平板上,37 ℃厌氧条件下培养48 h,活化2代后,挑取4~5个单菌落接种于BHI液体培养基中(装量为5 mL/10 mL),过夜培养,4 ℃,3 000×g离心10 min,弃上清液,用无菌生理盐水调整菌液浓度为0.5麦氏比浊标准[17],再制备1.0×106~2.0×106 CFU/mL的指示菌平板[18]。根据上述方法制备唾液链球菌BD3900、植物乳杆菌ST-III和干酪乳杆菌LC2 W的指示菌平板上,其中植物乳杆菌ST-III和干酪乳杆菌LC2 W是以MRS为培养基。
1.3.2 抑菌活性测定
将菌株P.bovis BD3526种子液接入麦麸培养基中,180 r/min摇床中培养,发酵36 h后收集发酵液,煮沸10 min,冷却至室温,pH调至5.60,4 ℃,9 000×g离心30 min,收集上清液,经无菌过滤后,移取100 μL加入牛津杯中,并放置于指示菌的平板上,37 ℃厌氧培养24 h,观察并用十字交叉法测定抑菌圈直径(mm),实验重复3次。同时以无菌发酵液(pH调至5.60)作为空白对照。
1.3.3 菌株P.bovis BD3526在麦麸培养基中的发酵特性
将菌株P.bovis BD3526种子液以3.0%(体积分数)接种量,接种于30 g/L麦麸培养基中(装量为60 mL/250 mL三角瓶),32 ℃、180 r/min摇床振荡培养,于0、3、6、9、12、24和36 h,测定P.bovis BD3526发酵体系的pH值、活菌数以及发酵上清液对S.mutan ATCC35668的抑菌圈直径。
1.3.4 酶敏感性测定
分别用20 mmol/L磷酸缓冲液配制8.0 mg/mL的过氧化氢酶、α-淀粉酶、胃蛋白酶、胰蛋白酶和链霉蛋白酶,调节至各酶的最适pH值(过氧化氢酶pH为7.0、α-淀粉酶pH为6.9、胃蛋白酶pH为2.0、胰蛋白酶和链霉蛋白酶pH为7.5)。分别将各酶溶液与P.bovis BD3526发酵上清液混合后(1∶3,体积比),在37 ℃水浴中(过氧化氢酶温度为35 ℃)保温3 h后,在沸水浴中处理15 min,冷却至室温,pH调至5.60,4 ℃,9 000×g离心30 min,无菌过滤后,测定对S.mutans ATCC35668的抑菌圈直径。以未经酶处理的样品为对照组,实验重复3次。
1.3.5 热稳定性测定
P.bovis BD3526发酵上清液分别在50、60、70、80和90 ℃水浴中加热1 h,在沸水浴中加热30 min,以及121 ℃温度下处理15 min,4 ℃,9 000×g离心30 min,无菌过滤后,以未经热处理的样品为对照组,测定抑菌圈直径,实验重复3次。
1.3.6 pH适用范围测定
分别用浓度1.0 mol/L的HCl溶液和NaOH溶液,调节发酵上清液pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,4 ℃,9 000×g离心30 min,无菌过滤后,以未处理的发酵液上清为对照组,测定抑菌圈直径,实验重复3次。
1.3.7 数据统计分析
利用GraphPad Prsim 7.00软件进行实验数据处理和图表绘制,并用SPSS 24.0 的单因素方差分析来统计分析显著性差异(P<0.05)。
2 结果与分析
2.1 菌株P.bovis BD3526在麦麸培养基中的发酵特性
菌株P.bovis BD3526在麦麸培养基中pH值和活菌数的变化如图1所示。在6~9 h时是菌株P.bovis BD3526对数生长期,在12 h时活菌数达到峰值1.56×109 CFU/mL。随着发酵时间的延长,活菌总数开始缓慢下降,直至发酵终点(36 h)的活菌数为4.58 ×108 CFU/mL。前期由于P.bovis BD3526快速生长,消耗了发酵体系中的营养物质,并积累了不利于菌体生长的代谢产物使活菌总数在后期发生降低。P.bovis BD3526发酵体系的pH值快速下降阶段与菌体对数生长期基本一致,至发酵终点时pH值为5.20。培养介质中碳水化合物发酵产生的有机酸,是导致发酵体系的pH变化的主因。
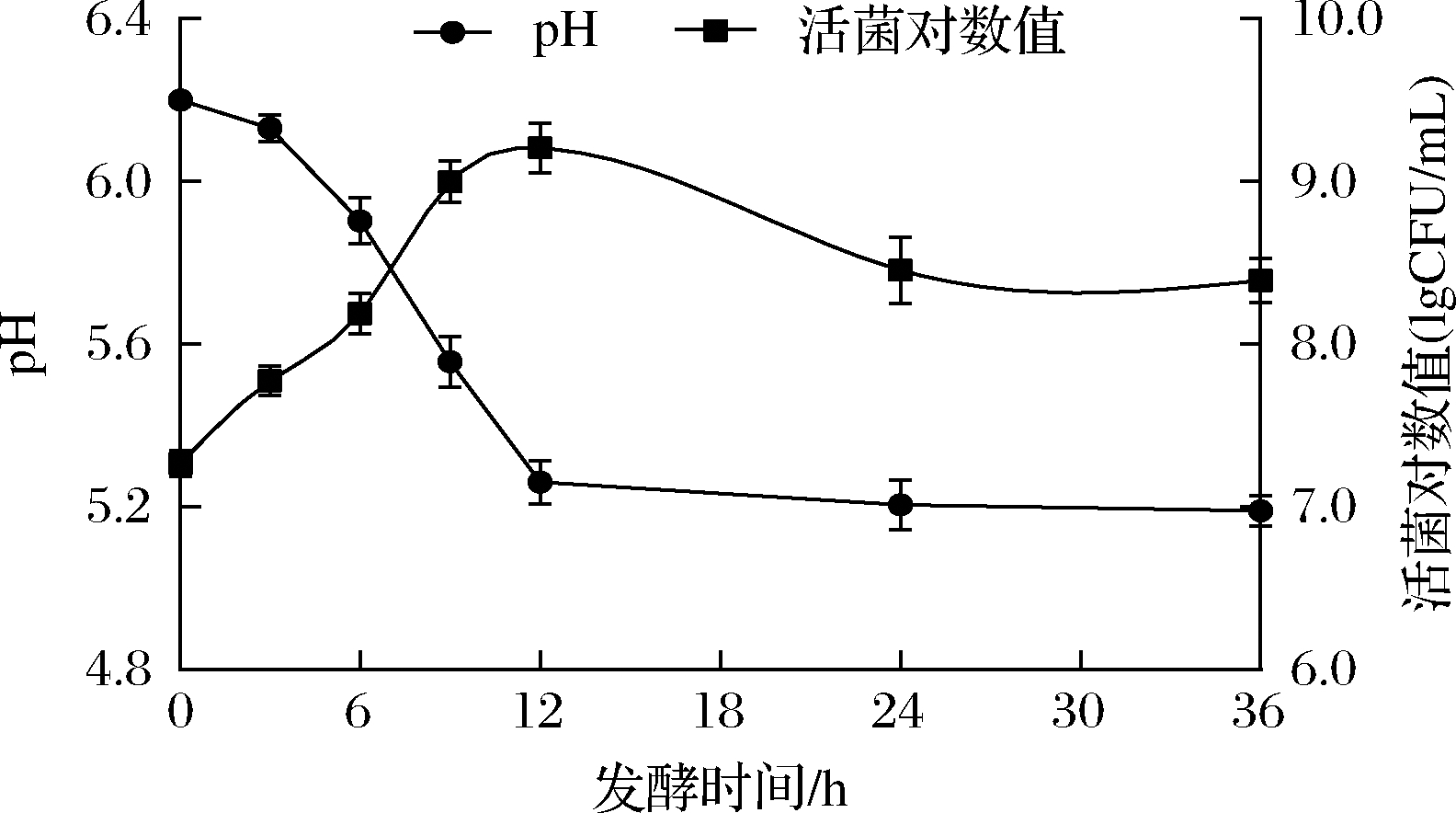
图1 菌株P.bovis BD3526在麦麸培养基中的生长曲线和发酵液pH值变化
Fig.1 Variation of pH and viable counts of strain P.bovis BD3526 grown in wheat bran culture
在发酵过程中P.bovis BD3526发酵上清液对S.mutans ATCC35668抑菌圈直径的变化如图2所示。随着发酵时间的延长(>12 h),发酵上清液抑菌活性依次增强。在36 h时发酵上清液的抑菌活性达到最大,其抑菌圈直径为(21.27±0.71)mm,属于极敏感程度。

图2 菌株P.bovis BD3526在麦麸培养基中的抑菌活性变化
Fig.2 Variation of antibacterial activity of strain P.bovis BD3526 grown in wheat bran culture
这种抑菌效果与发酵时间的正相关性表明P.bovis BD3526抑菌物质可能是其次级代谢产物,在营养物质相对充裕时,依然处于持续积累的状态。
2.2 菌株P.bovis BD3526抑菌物质对口腔中不同细菌的影响
益生菌可通过竞争性抑制口腔病原菌黏附、定植,阻止病原菌生物膜形成,以及调节宿主黏膜免疫系统,尤其可以减少唾液中病原菌S.mutants和牙龈卟啉单胞菌(Porphyromonas gingivalis)的数量[19-20]。P.bovis BD3526发酵上清液冻干粉,在不同浓度下对S.mutants ATCC35668的抑制效果如表1所示。P.bovis BD3526抑菌物质对植物乳杆菌和干酪乳杆菌无抑菌活性,仅对链球菌属细菌有强烈的抑制活性。前期的研究发现,类芽孢杆菌属微生物合成的Fusaricidin A对需氧型革兰氏阳性菌(金黄色葡萄球菌、藤黄微球菌、枯草芽孢杆菌等)具有显著的抑菌作用,但对变形链球菌的生长无影响[21]。本实验中P.bovis BD3526麦麸发酵液对S.mutans ATCC35668的特异性抑制结果,为类芽孢杆菌在防龋、治龋方面的应用提供了重要的理论依据。
表1 P.bovis BD3526发酵上清液对不同菌株的抑制效果
Table 1 Antibacterial activity of fermentation
supernatant of P.bovis BD3526 against different strains
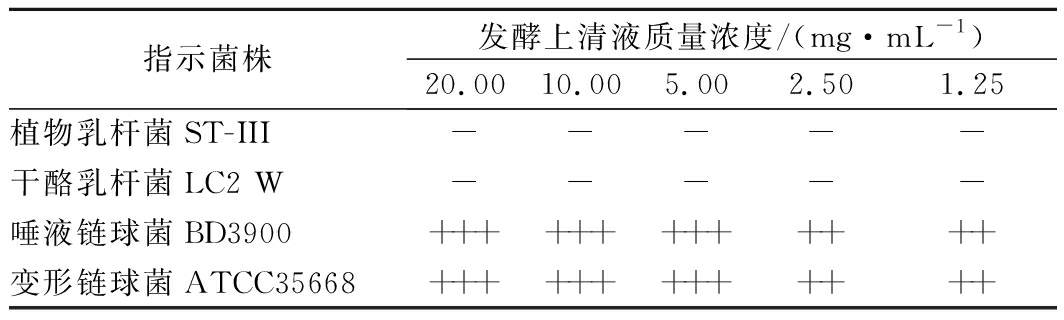
指示菌株发酵上清液质量浓度/(mg·mL-1)20.0010.005.002.501.25植物乳杆菌ST-III-----干酪乳杆菌LC2 W-----唾液链球菌BD3900+++++++++++++变形链球菌ATCC35668+++++++++++++
注:“-”表示无抑菌效果,“+++”表示极敏感,“++”表示高敏感
2.3 菌株P.bovis BD3526抑菌物质的酶敏感性
由图3可知,经过氧化氢酶处理后的P.bovis BD3526发酵上清液,其抑菌活性未发生显著变化,表明发酵液中抑菌活性非过氧化氢引起的。
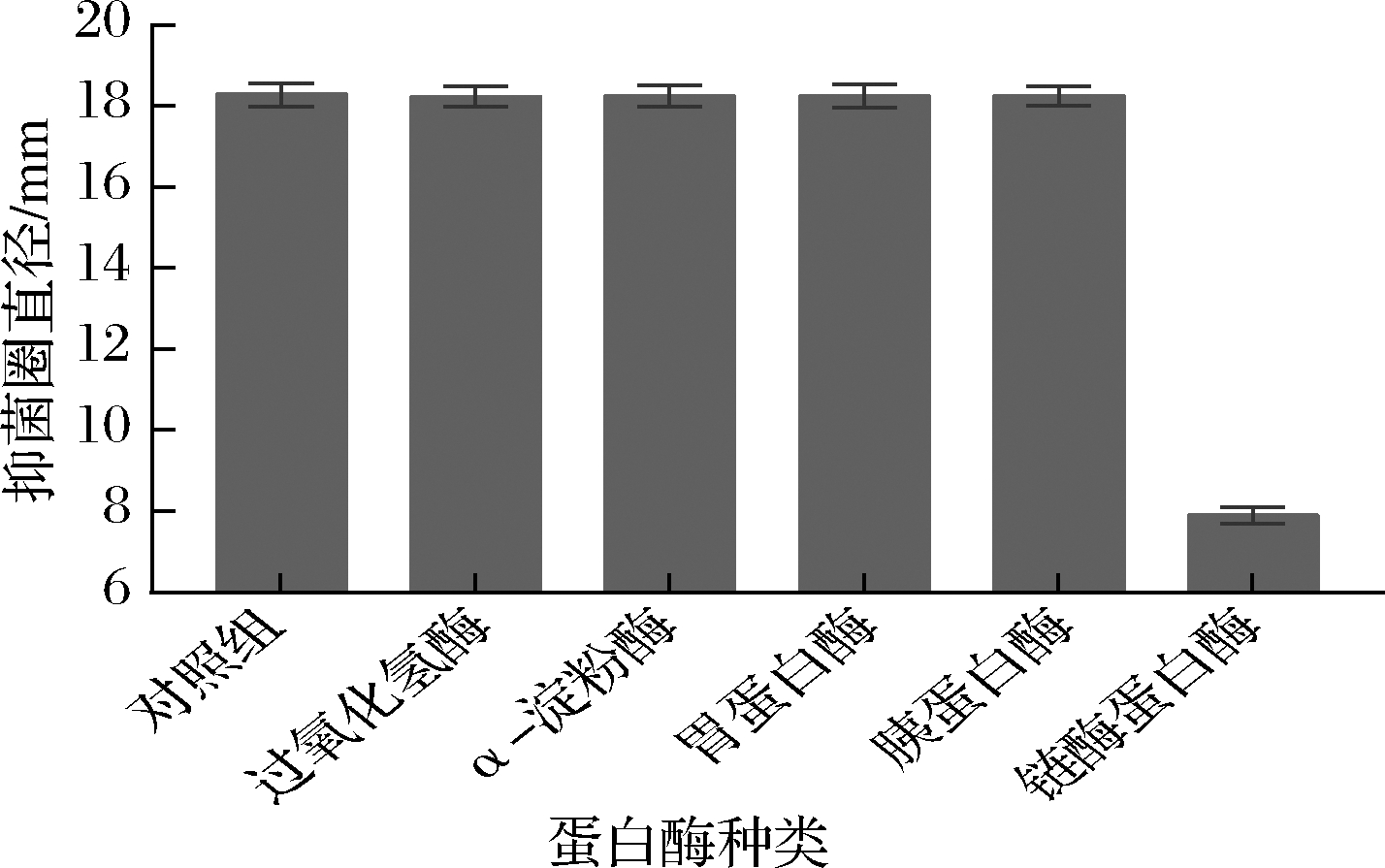
图3 不同酶处理后P.bovis BD3526发酵上清液的抑菌活性
Fig.3 Antibacterial activity of fermentation supernatant of
P.bovis BD3526 after being digested by different protease
经过α-淀粉酶、胃蛋白酶和胰蛋白酶处理后,发酵液上清的抑菌活性也未发生明显变化,预示着未来此抑菌物质在摄入体内后不会被口腔和消化道中蛋白酶分解而失活。发酵液上清经链酶蛋白酶处理后抑菌活性完全消失(7.88±0.14)mm,说明目标抑菌物质可能存在肽类结构[21-22]。
2.4 菌株P.bovis BD3526抑菌物质的适用pH范围
从图4可知,不同pH(2.0~10.0)的P.bovis BD3526发酵上清液对S.mutants ATCC35668的抑制效果维持在21 mm左右,且与对照组无显著差异,说明目标抑菌物质所具有较强的耐酸碱性能,宽泛的pH适应性极大地提高该物质的应用优势。
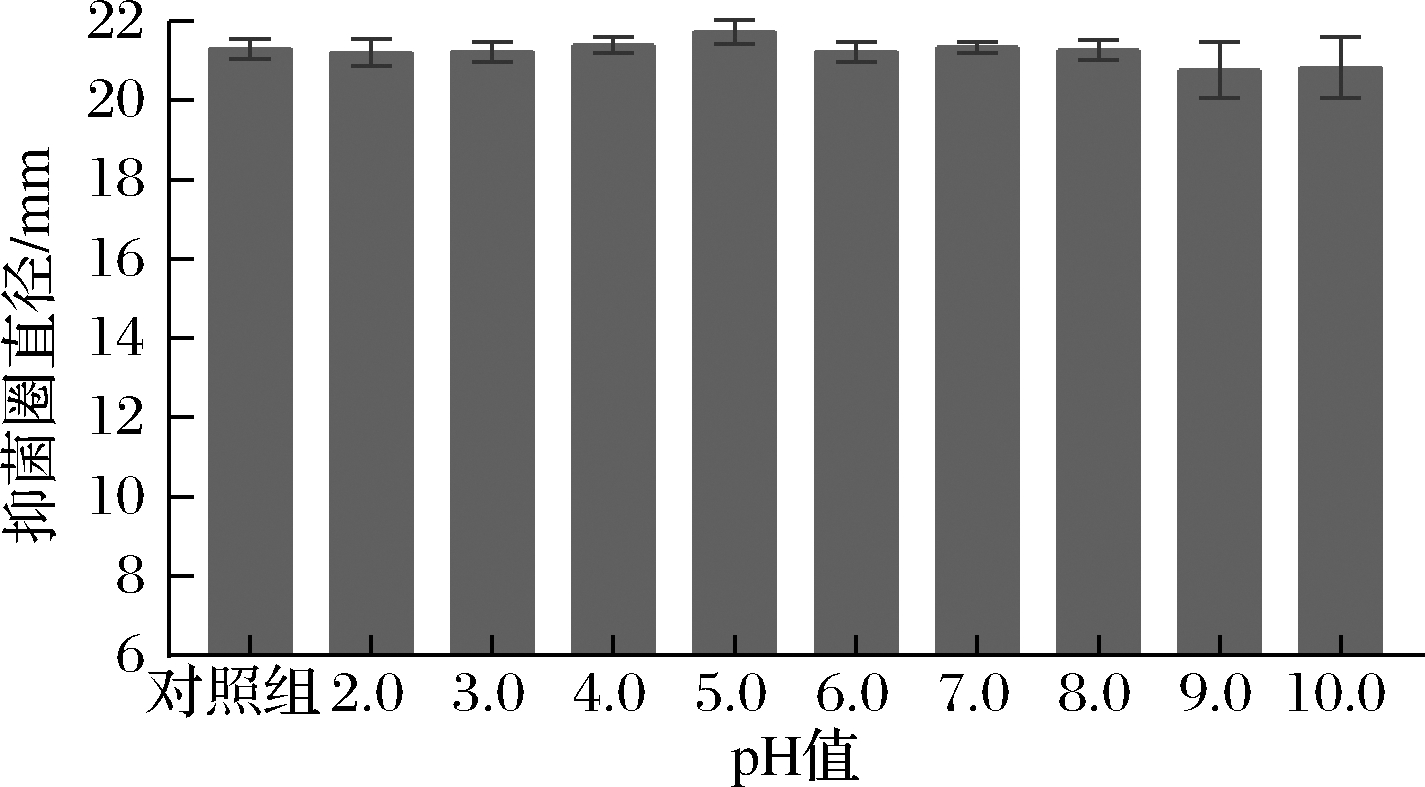
图4 不同pH条件下P.bovis BD3526发酵上清液的抑菌活性
Fig.4 Antibacterial activity of fermentation supernatant of
P.bovis BD3526 at different pH values
2.5 菌株P.bovis BD3526抑菌物质的热稳定性
由图5可知,P.bovis BD3526抑菌物质在100 ℃处理30 min后,仍能保持对S.mutants ATCC35668较好的抑菌活性。但在121 ℃温度下,其抑菌圈直径(19.77±0.25)mm,与对照组(21.33±0.32)mm相比,抑菌活性有所下降。这可能是在121 ℃超高温条件下,肽类物质中肽键更易发生部分断裂或者分子结构中某些官能团发生化学反应,从而导致抑菌活性降低。
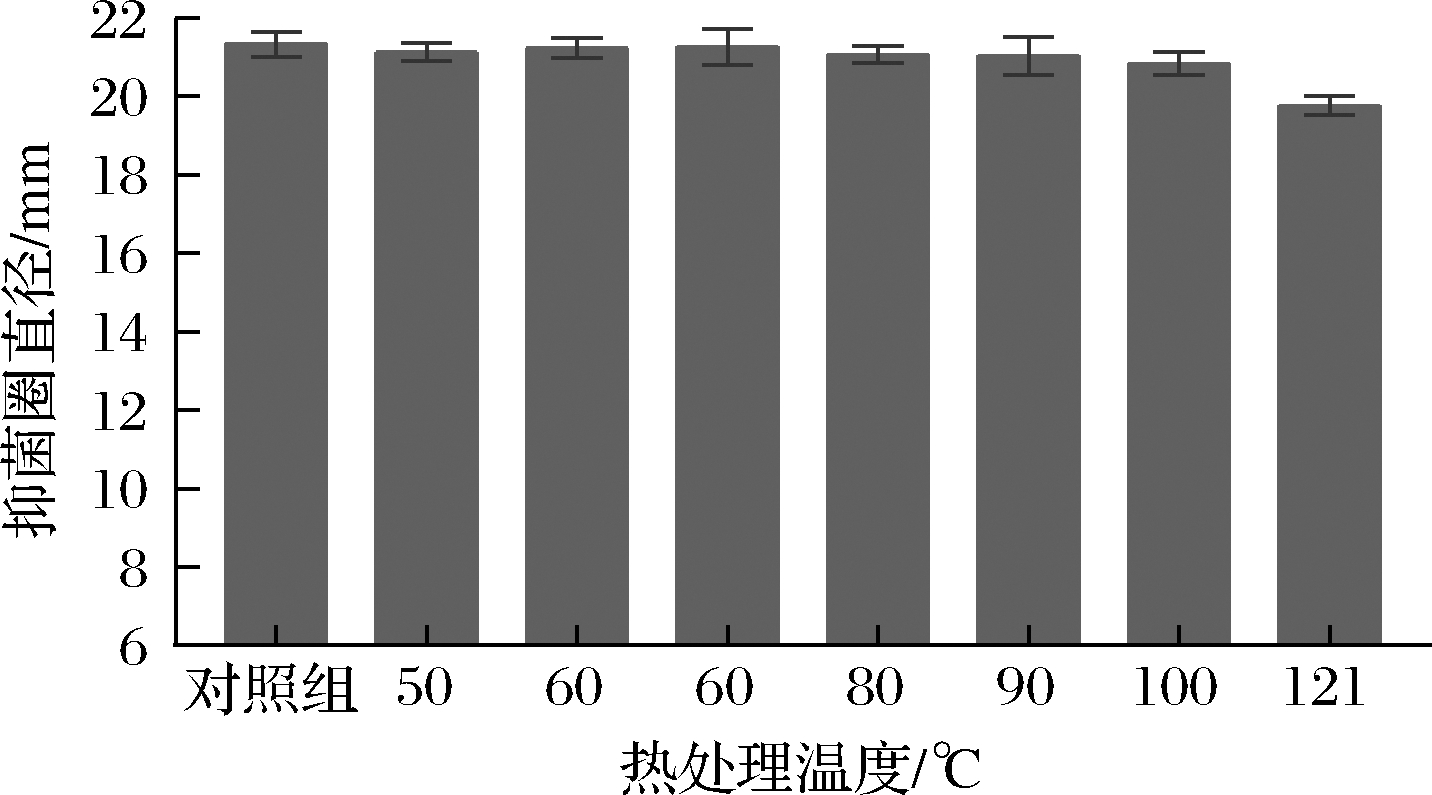
图5 不同温度处理后P.bovis BD3526发酵上清液的
抑菌活性
Fig.5 Antibacterial activity of fermentation supernatant of
P.bovis BD3526 after different heat treatments
3 结论
本文主要涉及牛类芽孢杆菌P.bovis BD3526发酵麦麸合成具有体外抑制S.mutants ATCC35668生长的研究。P.bovis BD3526以麦麸为培养介质,在发酵36 h时活性菌到4.58 ×108 CFU/mL、pH值5.20,抑菌圈直径为(21.27±0.71)mm。该发酵上清液对口腔中常见的有益菌(植物乳杆菌和干酪乳杆菌)无抑制活性,但对链球菌属的唾液链球菌和变形链球菌,有明显地抑制作用。进一步研究发现,目标抑菌物质具有良好的热稳定性和pH稳定性、对消化系统蛋白水解酶和过氧化氢酶不敏感;经链霉蛋白酶处理后抑菌活性消失,表明该抑菌物质的化学结构中含有肽类成分。唾液链球菌K12是世界公认的口腔益生菌,可以产生2种羊毛硫抗菌肽:唾液素A2和唾液素B,具有抑制多种口腔病原菌生长活性。同样,菌株P.bovis BD3526也具有合成多种抗菌肽或细菌素能力,但抑菌物质的分离、鉴定以及安全性评估还有待深入研究,为将来开发特异性功能食品配料或口腔护理产品奠定了重要的理论基础。
[1] ZERO D T.Dentifrices,mouthwashes,and remineralization/caries arrestment strategies[J].BMC Oral Health,2006,6(1):S9-S22.
[2] 杨健康,董文刚,方舟,等.龋病相关微生物的致龋性研究概况[J].医学综述,2011,17(8):1 134-1 137.
YANG J K,DONG W F,FANG Z,et al.Overview of the cariogenic characteristics of carierelated microorganisms[J].Medical Recapitulate,2011,17(8):1 134-1 137.
[3] 杨瑶瑶,赵洪岩,张志民.变形链球菌生物膜防治方法的研究进展[J].口腔生物医学,2018,9(4):226-229.
YANG Y Y,ZHAO Y H,ZHANG Z M.Advances in research on prevention and treatment of Streptococcus mutans biofilm[J].Oral Biomedicine,2018,9(4):226-229.
[4] 乌日汉,郭小娟,王怡,等.牙菌斑生物膜的形成与控制[J].微生物学报,2018,58(11):1 950-1 960.
WU R H,GUO X J,WANG Y,et al.Formation and control of dental plaque biofilm[J].Acta Microbiologica Sinica,2018,58(11):1 950-1 960.
[5] GRADY E N,MACDONALD J,LIU L,et al.Current knowledge and perspectives of Paenibacillus:A review[J].Microbial Cell Factories,2016,15(1):203-220.
[6] COCHRANE S A,VEDERAS J C.Lipopeptides from Bacillus and Paenibacillus spp.:A gold mine of antibiotic candidates[J].Medicinal Research Reviews,2014,36(1):4-31.
[7] 冯华峰.响应面法优化多黏类芽孢杆菌BD3736发酵脱脂乳产α-葡萄糖苷酶抑制剂的工艺条件[J].乳业科学与技术,2019,42(1):13-18.
FENG H F.Response surface methodology for optimization of fermentation conditions for α-glucosidase inhibitor production by Paenibacillus polymyxa BD3736 from skim milk[J].Journal of Dairy Science and Technology,2019,42(1):13-18.
[8] REIMANN M,SANDJO L P,ANTELO L,et al.A new member of the fusaricidin family-structure elucidation and synthesis of fusaricidin E[J].Beilstein Journal of Organic Chemistry,2017,13:1 430-1 438.
[9] 冯华峰.DPP-4抑制剂高产菌株的筛选、鉴定及发酵特性[J].食品工业科技,2019,40(23):81-87.
FENG H F.Screening,identification and fermentation characteristics of high-yield DPP-4 inhibitors[J].Science and Technology of Food Industry,2019,40(23):81-87.
[10] GAO C,HAN J,LIU Z,et al.Paenibacillus bovis sp.nov.,isolated from raw yak (Bos grunniens) milk[J].International Journal of Systematic and Evolutionary Microbiology,2016,66(3):1 413-1 418.
[11] 韩瑨,吴正钧,刘振民,等.一株产α-葡萄糖苷酶抑制剂的牛类芽孢杆菌BD3526[J].天然产物研究与开发,2019,31(9):1 585-1 590.
HAN J,WU Z J,LIU Z M,et al.An α-glucosidase inhibitor-producing strain Paenibacillus bovis BD3526[J].Natural Product Research and Development,2019,31(9):1 585-1 590.
[12] XU X,GAO C,LIU Z,et al.Characterization of the levan produced by Paenibacillus bovis sp.nov BD3526 and its immunological activity[J].Carbohydrate Polymers,2016,144:178-186.
[13] 艾连中,贾国超.口腔益生菌的研究现状[J].食品科学技术学报,2020,38(1):17-25.
AI L Z,JIA G C.Research progress on oral probiotic[J].Journal of Food Science and Technology,2020,38(1):17-25.
[14] HANG F,LIU P,WANG Q,et al.High milk-clotting activity expressed by the newly isolated Paenibacillus spp.strain BD3526[J].Molecules,2016,21(1):73-86.
[15] 杭锋,洪青,陶源,等.Paenibacillus spp.BD3526发酵小麦麸皮生产凝乳酶[J].食品与发酵工业,2016,42(2):35-40.
HANG F,HONG Q,TAO Y,et al.Study on milk-clotting enzyme produced by Paenibacillus spp.BD3526 in wheat bran broth[J].Food and Fermentation Industries,2016,42(2):35-40.
[16] 花榜清.Paenibacillus bovis sp.nov.BD3526抗菌物质的分离纯化、结构表征及其性质的研究[D].无锡:江南大学,2017.
HUA B Q.Purification,characterication and properity of antibacterial substances produced by Paenibacillus bovis sp.nov.BD3526[D].Wuxi:Jiangnan University,2017.
[17] WANG Y,WANG X,JIANG W,et al.Antimicrobial peptide GH12 suppresses cariogenic virulence factors of Streptococcus mutans[J].Journal of Oral Microbiology,2018,10(1):1 442 089-1 442 099.
[18] DASANAYAKE A P,CAUFIELD P W,CUTTER G R,et al.Differences in the detection and enumeration of mutans streptococci due to differences in methods[J].Archives of Oral Biology,1995,40(4):345-351.
[19] LAMONT R J,KOO H,HAJISHENGALLIS G.The oral microbiota:Dynamic communities and host interactions[J].Nature Reviews Microbiology,2018,16(12):745-759.
[20] LIM S M,LEE N K,PAIK H D.Antibacterial and anticavity activity of probiotic Lactobacillus plantarum 200661 isolated from fermented foods against Streptococcus mutans[J].LWT-Food Science and Technology,2020,118:108 840-108 845
[21] 花榜清,吴正钧.牛类芽孢杆菌BD3526发酵液中抗菌物质的特性及初步分离[J].乳业科学与技术,2019,42(4):16-20.
HUA B Q,WU Z J.Characterization and preliminary isolation of antimicrobial substances from fermentation broth of Paenibacillus bovis BD3526[J].Science and Technology of Food Industry,2019,42(4):16-20.
[22] XIONG K,CHEN X,HU H,et al.Antimicrobial effect of a peptide containing novel oral spray on Streptococcus mutans[J].BioMed Research International,2020,2020(2):6 853 652-6 853 665.