苯乳酸(phenyllactic acid,PLA)是一种安全无毒、对酸和热稳定、溶解性良好,能够在食品体系中均匀扩散的多功能性天然有机酸[1]。苯乳酸具有广谱抑菌作用,可有效抑制革兰氏阳性菌(如Staphylococcus aureus、Listeria monocytogenes、Bacillus subtilis等)、革兰氏阴性菌(如Escherichia coli、Salmonella enterica、Pseudomonas aeruginosa等)和真菌(如Colletotrichum gloeosporioides、Aspergillus flavus、Aspergillus niger、Botrytis cinerea 等)[2-4]。此外,苯乳酸还可以发挥抑制体外血小板聚集[5]、扩张冠状动脉[6]、治疗心肌梗死[7]以及激活免疫[8]等生理作用。因此,苯乳酸在食品防腐以及医药行业中具有广泛的应用前景。
苯乳酸可以通过微生物发酵产生[9],已报道能够产生苯乳酸的微生物主要有植物乳杆菌、希氏乳杆菌、明串珠菌属[10-11]、凝结芽孢杆菌、乳酸片球菌和戊糖片球菌[12-13]等乳酸菌,相关的含苯乳酸的食品有酸面团[14-15]、竹茶酒[16]、酸奶[17]、泡菜[7]、食醋[18]等乳酸菌发酵食品。我国传统发酵食品种类丰富,除泡菜、酸奶等食品外,发酵豆制品、发酵面制品(馒头、面包等)、特色发酵酒类等发酵过程均有乳酸菌的参与,因此有必要建立乳酸菌发酵食品中苯乳酸的检测方法,以全面分析苯乳酸在乳酸菌发酵食品中的分布情况,为菌株资源的挖掘提供科学依据。目前,食品中苯乳酸的检测主要有GC-MS、HPLC、LC-MS、2D-HPLC等方法,GC-MS法可以提高样品中苯乳酸的分辨率,但样品需要进行酯化和萃取等繁琐复杂的前处理[19-21];HPLC法分辨率与灵敏度较低,最低检出限为1.67 mg/L,对于一些苯乳酸含量较低的样品不能检出,且单个样品至少需要25 min,分析时间较长[17];LC-MS技术克服了选择性低的缺点,最低检出限可达0.16 mg/L,但单个样品检测需要25~30 min,相对耗时较长[14,18];而2D-HPLC对设备要求高,程序复杂不宜实施,单个样品检测时间20 min,其间还需控制色谱阀的切换[22]。因此,上述技术在复杂食品体系中苯乳酸定量分析方面均存在一定局限性,如何高效地测定食品体系中苯乳酸的含量有待进一步研究。超高效液相色谱(ultra performance liquid chromatography,UPLC)能在短时间内实现良好的分离效果,MS/MS中的多反应监测(multi-reaction monitoring,MRM)模式可以显著提高信噪比。UPLC-MS/MS兼具UPLC对复杂样品分离能力高效、分析检测时间短,以及质谱MS灵敏度高和特异性强等优点,可以作为发酵食品中苯乳酸定量分析的有效工具。
因此,为了快速而准确地分析发酵食品中苯乳酸的含量,本文建立了苯乳酸的UPLC-MS/MS检测方法,并用此方法对16种市售乳酸菌饮料、8种发酵乳、11种黄酒样品、发酵豆制品、米酒、奶酪、发酵香肠、馒头、面包等食品中苯乳酸的含量进行测定,以期扩大筛选高产苯乳酸菌株的原料范围,以及为发酵食品中优良菌株资源挖掘提供理论支持。
1 材料与方法
1.1 仪器
AB SCIEX QTRAP 6500质谱仪,美国AB公司;UPLC-20岛津超高效液相色谱仪,日本岛津公司;3-18 K冷冻离心机,德国Sigma公司;LABDANCER S25旋涡混合器,广州仪科实验室技术有限公司;恒温摇床,上海智城分析仪器制造公司;JJ1000电子分析天平,梅特勒-托利多仪器上海有限公司。
1.2 试剂和样品
标准品:D-苯乳酸,纯度98%(色谱纯),美国Sigma公司;甲醇、乙腈、甲酸(色谱纯),德国Merck公司;发酵食品均随机采购于石家庄多家大型超市。
1.3 实验方法
1.3.1 苯乳酸检测方法的建立
1.3.1.1 流动相与洗脱条件的选择
采用等度和梯度2种洗脱方式对苯乳酸进行分析,先后选用乙腈(A)和水(B)、0.1%甲酸-乙腈溶液(A)和0.1%甲酸-水溶液(B)、0.3%甲酸-乙腈溶液(A)和0.3%甲酸-水溶液(B)做为流动相。综合考虑分析时间、峰形对称度和离子丰度等因素,最终确定流动相及洗脱条件。
1.3.1.2 质谱条件的选择
质谱通过对目标化合物苯乳酸母离子、碎片子离子的识别实现对物质的定性和定量,采用电喷雾离子源进行离子化,考虑到苯乳酸是有机酸,分子量为166.17,离子模式选用了负离子模式。在全扫描模式下,确定[M-H]-作为PLA的母离子。子离子扫描时,选定2个丰度高并且稳定的子离子,在MRM模式下优化裂解电压和碰撞能。
1.3.1.3 苯乳酸标准曲线的绘制及检出限的测定
配制质量浓度为1 000 ng/mL的苯乳酸标准储备液,梯度稀释得到苯乳酸的浓度系列:1、10、50、100、200、300、500 ng/mL。在确定的色谱条件下进样1 μL,以峰面积的积分值为纵坐标,苯乳酸质量浓度(ng/mL)为横坐标,绘制标准曲线。取低质量浓度苯乳酸的标准溶液,用超纯水逐级稀释并测定,根据S/N=3和S/N=10确定检出限(LOD)和定量限(LOQ)。
1.3.1.4 样品的前处理
称取10 g(精确到0.01 g)样品于20 mL容量瓶中(固态食品经研磨至均匀细粉后称取),加去离子水定容。然后向上述混合液中再加入3 mL甲醇,240 r/min条件下振荡10 min,10 000 r/min离心10 min。最后取上清液过0.22 μm膜稀释到线性范围内待测。
1.3.1.5 精密度及稳定性实验
分别将1.4、2.8、4.2 mg/kg添加水平的苯乳酸标准样品添加到含有苯乳酸的发酵乳样品[苯乳酸含量(2.8±0.14)mg/kg]中,按照1.3.1.4小节进行样品前处理,每个浓度做3个平行,每个样品平行进样5次分析,计算平均回收率和相对标准偏差。同一个样品于一天内5个不同时段进样分析,连续3 d进行测定,取平均值并计算RSD值。
1.3.2 实际样品的测定
用已建立的UPLC-MS/MS检测法对采集于石家庄各超市的8种活菌型乳酸菌饮料、8种灭菌型乳酸菌饮料、8种发酵乳、11种黄酒、发酵豆制品、米酒、奶酪、发酵香肠、馒头、面包等食品中的苯乳酸进行测定。
1.4 数据处理
每个样品做3个独立平行,利用SPSS 19.0软件通过单因素方差分析法(P<0.05)对数据进行统计分析,并通过Origin Pro 8软件对实验结果进行作图。
2 结果与分析
2.1 苯乳酸检测方法的建立
2.1.1 流动相的选择
采用配备双泵和自动进样器的日本岛津高效液相色谱仪(UPLC-20)进行色谱分析,使用Shim-pack XR-ODS C18(3.0 mm×75 mm,2.2 μm)色谱柱。通过对等度与梯度洗脱程序及甲酸添加量的探索,确定洗脱条件为梯度洗脱:0~1 min,10%B;1~4 min,10%~90%B;4~6 min,90%B;6~6.1 min,90%~10%B;6.1~9 min,10% B,进样量:1 μL。对不同的柱温和流速进行探索后,确定最终条件为流速:0.4 mL/min;柱温:40 ℃。在此条件下,苯乳酸具有较好的分离效果,在5 min内出峰,且峰型良好。
2.1.2 质谱条件的选择
采用配有电喷雾电离源(ESI)的AB SCIEX QTRAP 6500三重四极杆-线性离子阱复合质谱仪进行分析,在全扫描模式下,确定[M-H]-作为苯乳酸的母离子。采用仪器的自动调谐功能,将响应强度最大的子离子设定为定量离子,响应强度较弱的子离子设定为定性离子,确定碰撞能质荷比(m/z)146.9和118.8分别为苯乳酸的定量子离子和定性子离子,在MRM模式下优化裂解电压均为-80 V,碰撞电压分别为-16 V和-23 V。最终确定质谱条件,离子源:电喷雾离子源(ESI);扫描方式:负离子模式;多反应监测(MRM);雾化气:氮气;雾化温度:500 ℃;雾化气压力:70 psi;辅助气压力:60 psi;气帘器:35 psi;喷雾电压:-4 500 V。由10 ng/mL标准样品的LC-MS色谱图(图1)和提取离子流量色谱图(图2)的检测结果可知,苯乳酸的出峰时间为3.11 min,目标峰峰型良好,说明优化的质谱条件适用于苯乳酸的检测。
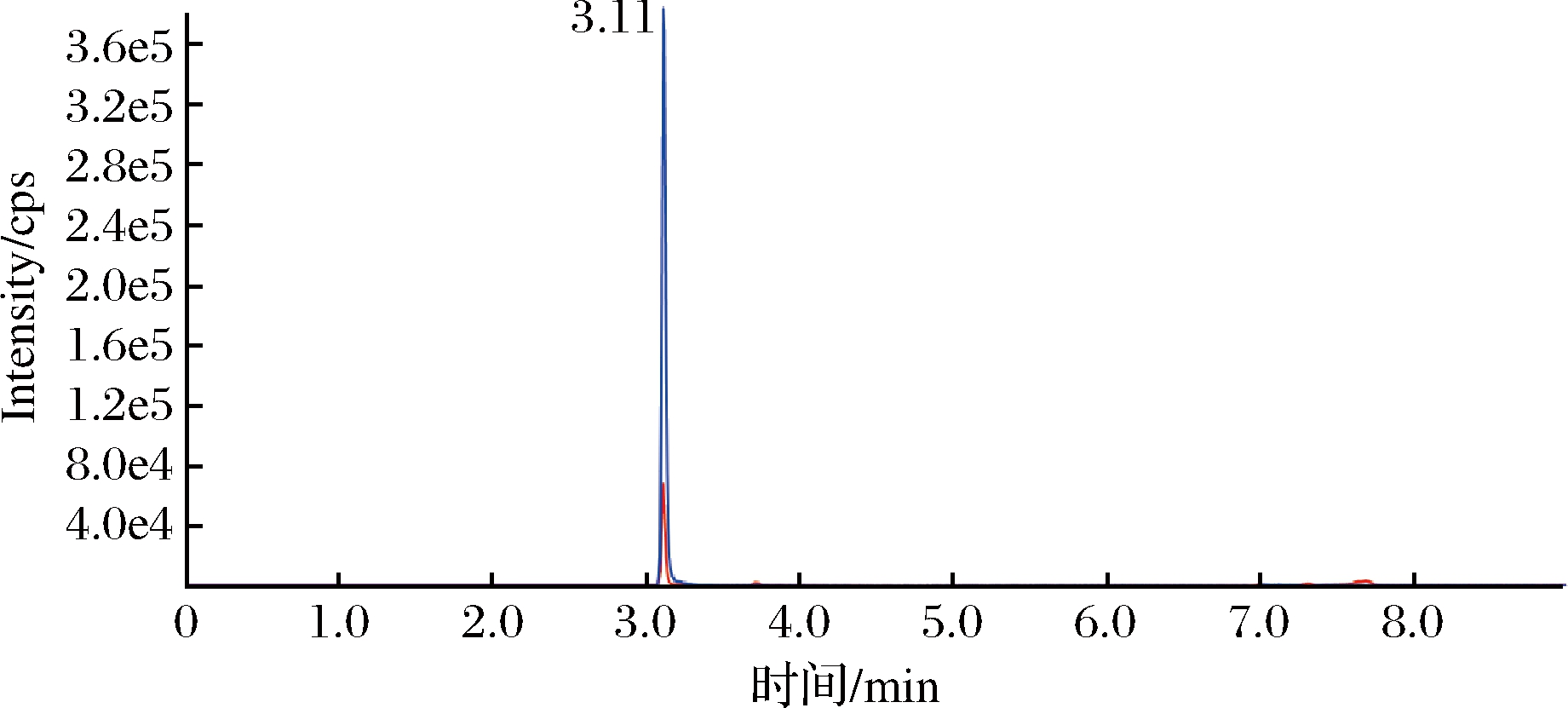
图1 标准品LC-MS色谱图
Fig.1 LC-MS chromatogram of standard
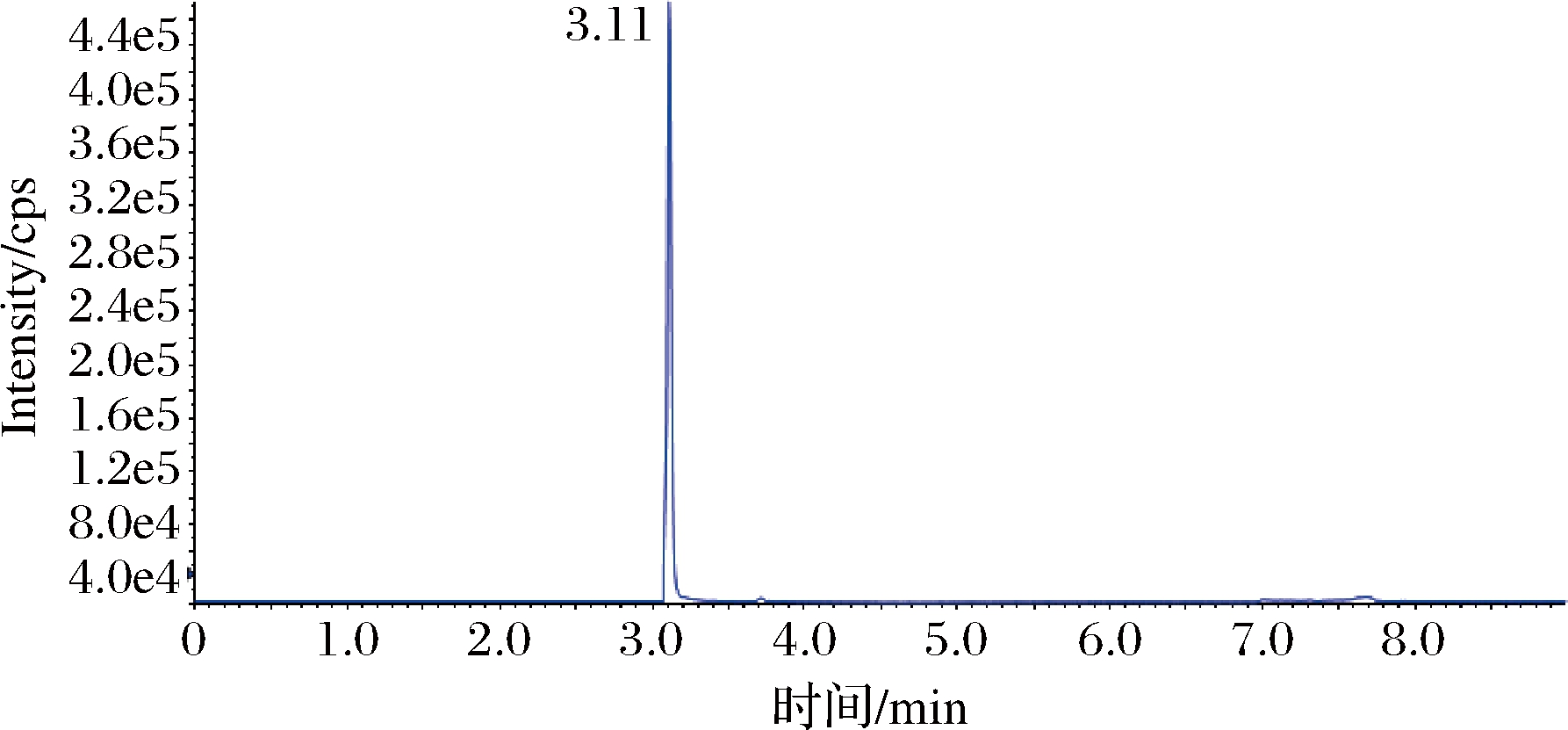
图2 标准品提取离子流量色谱图
Fig.2 Chromatogram of extract ion flow rate of standard substance
2.1.3 线性范围、检出限、定量限的确定
对1、10、50、100、200、300和500 ng/mL的苯乳酸标准溶液进行定量分析,以标准品质量浓度为X轴,以峰面积的积分值为Y轴,计算回归方程和相关系数。标准曲线Y=15 014X-9 784.1,相关系数R2为0.999 9,说明苯乳酸在1~500 ng/mL范围内线性关系良好。依据定量离子色谱峰的信噪比确定该方法下苯乳酸的检出限和定量限分别为0.3和1 ng/mL,显著低于2D-HPLC方法的检出限(0.16 μg/mL)和定量限(0.52 μg/mL)[22],表明该方法具有较高灵敏度,能够满足食品中苯乳酸的检测需要。
2.1.4 方法精密度测定
通过添加3个水平的苯乳酸标准样品到发酵乳中,每个添加浓度重复5次,测定回收率量化该方法的精密度。根据 GB/T 27404—2008《实验室质量控制规范食品理化检测》中回收率的相关规定,被测组分含量1~100 mg/kg时,回收率范围在90%~110%内实验结果可信。结果如表1所示,苯乳酸的平均回收率为90.5%~105.0%,日内相对标准偏差范围(RSDr)为1.2%~1.9%,日间相对标准偏差范围(RSDR)为1.3%~4.4%,说明该方法具有良好的精密度、重现性和稳定性,符合检测要求。发酵乳制品的UPLC-MS色谱图和提取离子流图分别见图3和图4,苯乳酸的出峰时间为3.11 min,峰型良好且附近没有杂质干扰,单个样品测定仅需要9 min,回收率测定结果具有较高的准确性和重复性。
表1 苯乳酸加标回收率
Table 1 Standard recovery of PLA
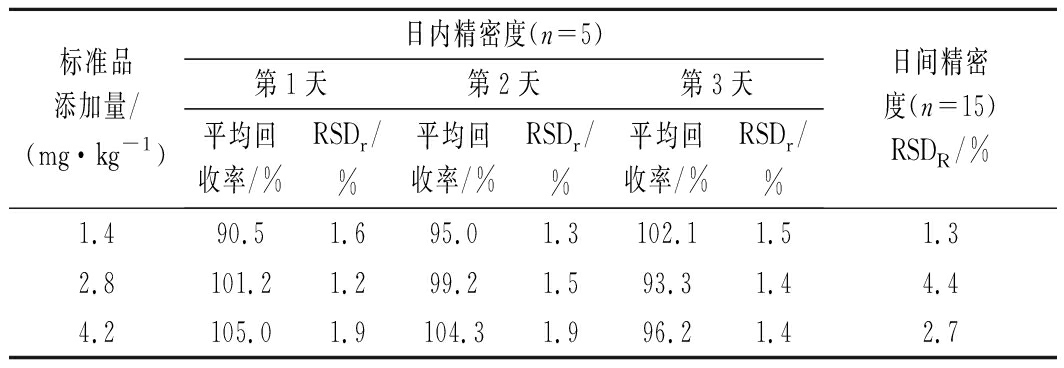
标准品添加量/(mg·kg-1)日内精密度(n=5)第1天第2天第3天平均回收率/%RSDr/%平均回收率/%RSDr/%平均回收率/%RSDr/%日间精密度(n=15)RSDR/%1.490.51.695.01.3102.11.51.32.8101.21.299.21.593.31.44.44.2105.01.9104.31.996.21.42.7
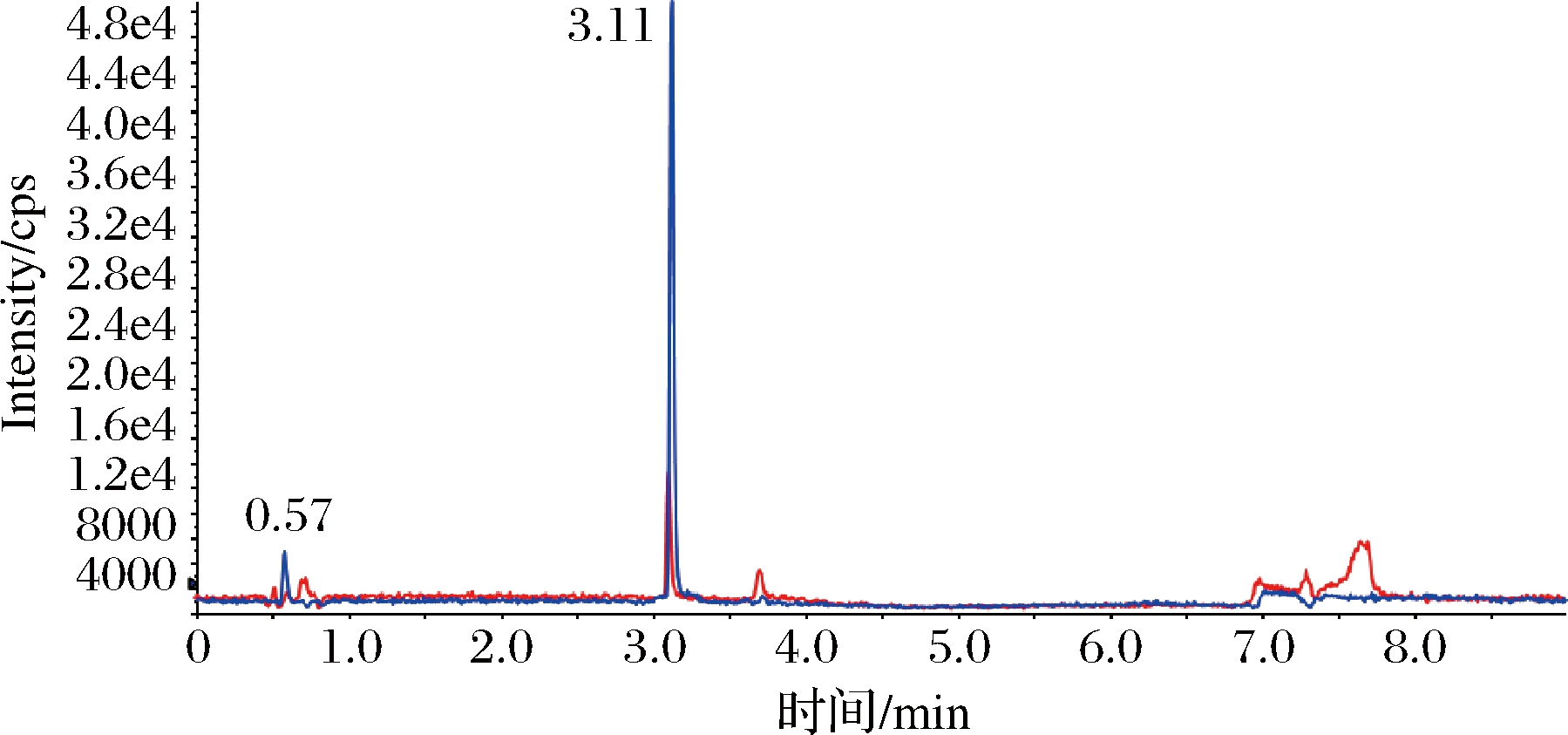
图3 发酵乳制品的UPLC-MS色谱图
Fig.3 UPLC-MS chromatogram of fermented dairy products
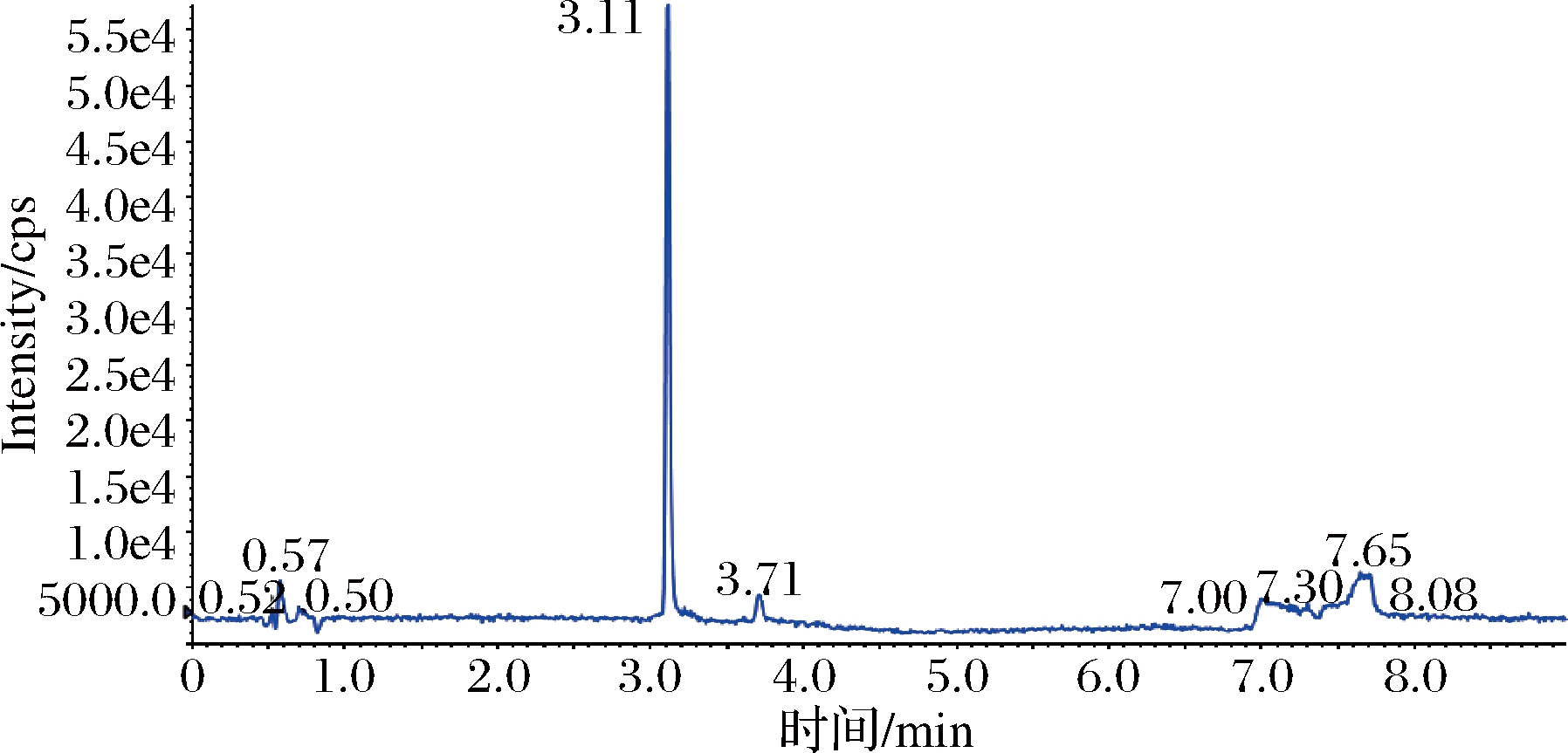
图4 发酵乳制品的提取离子流量图
Fig.4 Extract ionic flow of fermented dairy products
与GC-MS[19]测定蜂蜜中苯乳酸的方法相比,预处理简单;与LC-MS/MS[18]测定食醋中苯乳酸的方法相比,灵敏度高,且节省时间和有机溶剂。因此,该方法预处理简单、分析时间短、灵敏度高、准确性和重现性良好,可有效应用于发酵乳制品中苯乳酸的检测。
2.2 发酵食品中苯乳酸含量的分析
2.2.1 发酵乳及乳饮料中苯乳酸含量的分析
发酵乳通常是以羊乳或者牛乳等为发酵原料,通过乳酸菌发酵而成。推测发酵乳和乳酸菌饮料中可能含有乳酸菌代谢产物苯乳酸。因此,本研究采用已建立的UPLC-MS/MS法对8种市售活菌型乳酸菌饮料、8种灭菌型乳酸菌饮料和8种发酵乳制品中苯乳酸进行了测定,结果如表2所示:75%的样品苯乳酸含量低于4 mg/L,仅有3种样品苯乳酸含量高于18 mg/L。部分样品苯乳酸的含量为0.03~0.32 mg/L,低于高效液相色谱对苯乳酸的检出限,不能用高效液相色谱法检出。其中发酵乳中苯乳酸的含量明显高于乳酸菌饮料,而所测大部分乳酸菌饮料和发酵乳中苯乳酸含量较乳酸菌在乳酸菌MRS培养基中的产量低[10]。分析原因可能有2方面:发酵乳发酵时间通常较短,多数在4~6 h之间,尚未达到乳酸菌产苯乳酸高峰期;另外,尽管有些乳酸菌饮料在制备时发酵时间较长可以达到72 h,但乳酸菌饮料在制备过程中需要加入水及多种物质进行稀释和调味,因此苯乳酸浓度被高度稀释。苯乳酸具有广谱抑菌性,YU等[17]将高产苯乳酸的菌株Pediococcus pentosaceus SK25应用于发酵酸乳的研究,为产苯乳酸的乳酸菌作为酸奶发酵剂用于制作具有长保藏期的酸奶提供了科学依据。而发酵乳中苯乳酸含量的检测可为酸乳的品质控制提供技术支持。
表2 市售乳酸菌饮料和发酵乳中苯乳酸含量
Table 2 Content of PLA in commercial lactic acid bacteria
beverages and fermented milk
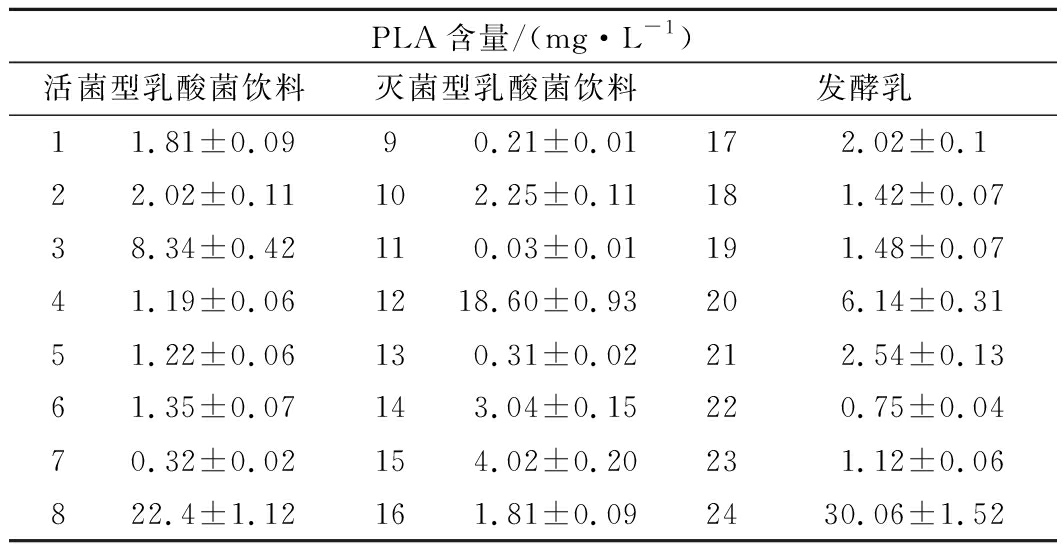
PLA含量/(mg·L-1)活菌型乳酸菌饮料灭菌型乳酸菌饮料发酵乳11.81±0.0990.21±0.01172.02±0.122.02±0.11102.25±0.11181.42±0.0738.34±0.42110.03±0.01191.48±0.0741.19±0.061218.60±0.93206.14±0.3151.22±0.06130.31±0.02212.54±0.1361.35±0.07143.04±0.15220.75±0.0470.32±0.02154.02±0.20231.12±0.06822.4±1.12161.81±0.092430.06±1.52
2.2.2 黄酒中苯乳酸的含量
黄酒是我国自古以来著名的传统粮食发酵酒,以富含氨基酸的糯米、黍米等粮食为原料,经过酒曲复式发酵方法酿造而成,且酒曲中除了酵母菌外还有乳酸菌参与风味的形成[23-25],由此推测黄酒中可能存在苯乳酸。采集了11种以糯米为原料的不同品牌黄酒,通过建立的UPLC-MS/MS方法,分析了黄酒中苯乳酸含量。结果由表3所示,可知11种黄酒样品中的8种样品中苯乳酸含量大于20 mg/L。包装标注陈酿时间对黄酒中苯乳酸含量的影响见图5,样品1和样品4、样品2和样品7之间均存在显著性差异(P<0.05),同种黄酒相比,包装上标注陈酿时间长的黄酒中苯乳酸的含量相对较低,5年陈的黄酒相对于3年陈的黄酒苯乳酸含量分别降低21.37%和33.81%。此外,有报道称苯乳酸是复合型保健黄酒竹茶酒的香气成分[16],主发酵后苯乳酸的相对含量为2.61%,陈酿后苯乳酸含量相对降低了1.8%,推测在陈酿过程中有机酸可能促进酯化反应,增加黄酒风味的酯香,从而使苯乳酸含量降低。但存在所测样品量少、批次不同等问题,后续将深入研究黄酒原料及发酵过程对苯乳酸含量的影响。
表3 黄酒中苯乳酸含量
Table 3 PLA content in Chinese rice wine

样品PLA/(mg·L-1)样品PLA/(mg·L-1)样品1(3年陈)36.91±1.62样品7(5年陈)21.55±0.76样品2(3年陈)32.56±1.54样品820.67±0.56样品331.61±1.02样品911.24±0.32样品4(5年陈)29.02±1.23样品108.38±0.21样品525.11±0.98样品118.05±0.30样品624.90±0.88
注:样品1和样品4,样品2和样品7属于同种品牌不同年份黄酒

图5 陈酿时间对黄酒中苯乳酸的影响
Fig.5 Influence of aging time on PLA content in Chinese rice wine
注:***,P≤0.001;**,0.001<P≤0.01;*,0.01<P≤0.05
2.2.3 其他乳酸菌发酵食品中苯乳酸的含量
本课题组前期已经证实泡菜、食醋等食品中含有苯乳酸[7],然而其他乳酸菌发酵食品中是否广泛存在苯乳酸,目前尚未有研究报道。因此,本研究通过建立的UPLC-MS/MS方法测定了发酵豆制品、米酒、奶酪、发酵香肠、馒头、面包等食品中苯乳酸的含量。结果如表4所示,所用发酵食品中均有苯乳酸的检出,其中发酵豆制品的苯乳酸含量相对较高,腐乳中苯乳酸含量最高(22.79 mg/kg)。推测原因为豆制品中富含苯丙氨酸,而乳酸菌可以利用苯丙氨酸代谢途径产生苯乳酸[26],因此发酵豆制品中苯乳酸含量较高,而发酵面制品中氨基酸含量低,且目前馒头、面包等发酵面制品生产中所用的微生物菌株以酵母菌为主,乳酸菌含量较少,因此苯乳酸含量相应也较低[27],如面包中苯乳酸含量最低(0.42 mg/kg)。该研究结果与已报道的采用酸面团生产的发酵面制品苯乳酸含量存在较大差异,如VAN等[14]研究显示酸面团中苯乳酸的含量最高可达33.47 mg/kg。由于苯乳酸具有抑菌、提高免疫等多种功能特性[28-29],因此建议发酵面制品中考虑回归传统的酸面团制作方式,即面制品制作中除添加酵母菌发酵外,增加功能性乳酸菌以提高发酵面制品的功能特性。此外,上述检测结果显示苯乳酸普遍存在于乳酸菌发酵食品中,可为发酵食品中优良乳酸菌资源的挖掘提供理论参考。
表4 其他乳酸菌发酵食品中苯乳酸含量
Table 4 Contents of PLA in other lactic acid bacteria
fermented foods
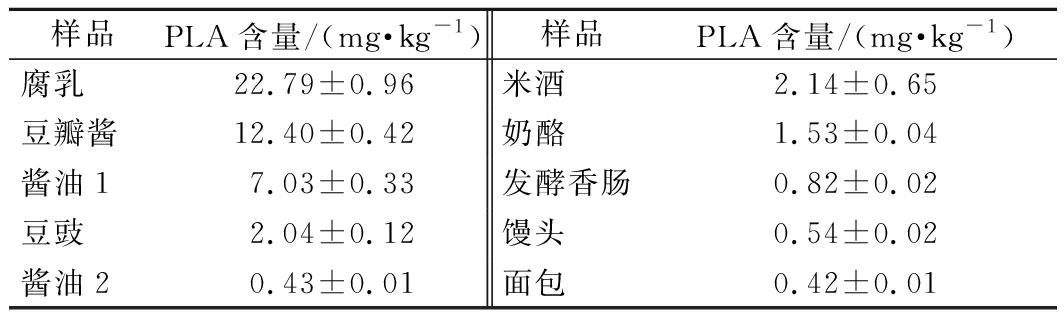
样品PLA含量/(mg·kg-1)样品PLA含量/(mg·kg-1)腐乳22.79±0.96米酒2.14±0.65 豆瓣酱12.40±0.42奶酪1.53±0.04 酱油17.03±0.33发酵香肠0.82±0.02豆豉2.04±0.12馒头0.54±0.02酱油20.43±0.01面包0.42±0.01
3 结论
建立UPLC-MS/MS方法对乳酸菌发酵食品中苯乳酸的含量进行测定,样品仅需有机溶剂预处理,操作简单,检测时间短,灵敏度高,准确性和重复性好,可用于基质复杂食品中苯乳酸的检测,并首次在黄酒、发酵豆制品和发酵面制品中检测到苯乳酸。用此方法测定出24种市售乳酸菌饮料和发酵乳中均含有苯乳酸,其中发酵乳中苯乳酸的含量显著高于灭菌型乳酸菌饮料;所检测的11种黄酒中,72.7%的样品苯乳酸含量大于20 mg/L,批次、陈酿时间可能对黄酒中苯乳酸含量产生影响;发酵豆制品、米酒、奶酪、发酵香肠、馒头、面包等发酵食品中均有苯乳酸的检出,说明苯乳酸可能普遍存在于乳酸菌发酵食品中。本研究扩大了筛选高产苯乳酸菌株的原料范围,为发酵食品中优良菌株的选育提供理论支撑,也为发酵食品的品质与营养功能进一步研究提供科学依据。
[1] 刘韵昕.苯乳酸的抑菌活性及抑菌机理研究[D].临汾:山西师范大学,2017.
LIU Y X.Antibacterial activity and mechanism of action of phenyllactic acid[D].Linfen:Shanxi Normal University,2017.
[2] DIEULEVEUX V,LEMARINIER S,GUÉGUEN M.Antimicrobial spectrum and target site of D-3-phenyllactic acid[J].International Journal of Food Microbiology,1998,40(3):177-183.
[3] LAVERMICOCCA P,VALERIO F,VISCONTI A.Antifungal activity of phenyllactic acid against molds isolated from bakery products[J].Applied and Environmental Microbiology,2003,69(1):634-640.
[4] 李兴峰,江波,潘蓓蕾.新型生物防腐剂——苯乳酸在食品中的研究与应用[J].食品与发酵工业,2007,33(5):87-91.
LI X F,JIANG B,PAN B L.Research and application in food of phenyllactic acid as a novel biopreservative:A review[J].Food and Fermentation Industries,2007,33(5):87-91.
[5] 金昔陆,陈滨凌,吴卫江,等.8种丹参素衍生物对兔血小板聚集性的影响[J].上海医科大学学报,2000,27(3):181-182.
JIN X L,CHEN B L,WU W J,et al.Effects of eight Danshensu’s derivatives on rabbit platelet aggregation[J].Journal of Shanghai Medical University,2000,27(3):181-182.
[6] 王珏英,邵以德,张渊博,等.β-苯基乳酸对心血管系统的实验研究[J].上海医科大学学报,1991,18(4):295-297.
WANG J Y,SHAO Y D,ZHANG Y B,et al.Experimental studies of β-phenyllactic acid on the coronary system[J].Journal of Shanghai Medical University,1991,18(4):295-297.
[7] LI X,NING Y,LIU D,et al.Metabolic mechanism of phenyllactic acid naturally occurring in Chinese pickles[J].Food Chemistry,2015,186(1):265-270.
[8] KIM D W,KIM J H,KANG H K,et al.Dietary supplementation of phenyllactic acid on growth performance,immune response,cecal microbial population,and meat quality attributes of broiler chickens[J].Journal of Applied Poultry Research,2014,23(4):661-670.
[9] NICOLINE V,G G M,F V R.Influence of peptide supply and cosubstrates on phenylalanine metabolism of Lactobacillus sanfranciscensis DSM20451(T) and Lactobacillus plantarum TMW1.468[J].Journal of Agricultural and Food Chemistry,2006,54(11):3 832-3 839.
[10] VALERIO F,LAVERMICOCCA P,PASCALE M,et al.Production of phenyllactic acid by lactic acid bacteria:An approach to the selection of strains contributing to food quality and preservation[J].FEMS Microbiology Letters,2004,233(2):289-295.
[11] 刘长建,刘秋,姜波,等.泡菜中乳酸菌的分离及其苯乳酸产量研究[J].大连民族学院学报,2014,16(3):245-248.
LIU C J,LIU Q,JIANG B,et al.Phenyllactic acid-producing activity of lactic acid bacteria from pickled vegetable[J].Journal of Dalian Nationalities University,2014,16(3):245-248.
[12] 郁书怀.片球菌属乳酸菌乳酸脱氢酶生物合成苯乳酸的研究[D].无锡:江南大学,2013.
YU S H.Research on phenyllactic acid production by lactate dehydrogenases from Pediococcus species of lactic acid bacteria[D].Wuxi:Jiangnan University,2013.
[13] MU W,YU S,ZHU L,et al.Recent research on 3-phenyllactic acid,a broad-spectrum antimicrobial compound[J].Applied Microbiology and Biotechnology,2012,95(5):1 155-1 163.
[14] VAN DER MEULEN R,SCHEIRLINCK I,VAN SCHOOR A,et al.Population dynamics and metabolite target analysis of lactic acid bacteria during laboratory fermentations of wheat and spelt sourdoughs[J].Applied and Environmental Microbiology,2007,73(15):4 741-4 750.
[15] MATTHEW R L A,FABIO D B,MICHAEL C,et al.Quantification of phenyllactic acid in wheat sourdough using high resolution gas chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry,2009,57(3):1 060-1 064.
[16] 李昱鼎.竹茶酒发酵工艺优化及抗氧化特性研究[D].福州:福建农林大学,2013.
LI Y D.Study on fermentation technique of bamboo-tea wine and its antioxidant activities[D].Fuzhou:Fujian Agriculture and Forestry University,2013.
[17] YU S,ZHOU C,ZHANG T,et al.Short communication:3-phenyllactic acid production in milk by Pediococcus pentosaceus SK25 during laboratory fermentation process[J].Journal of Dairy Science,2015,98(2):813-817.
[18] 吴仁蔚,陈亨业,郭俊陆,等.食醋中苯乳酸的提取、鉴定及含量比较[J].中国酿造,2020,39(1):66-70.
WU R W,CHEN H Y,Guo J L,et al.Extraction,identification and content comparison of phenyllactic acid in vinegar[J].China Brewing,2020,39(1):66-70.
[19] WILKINS A L,LU Y,MOLAN P C.Extractable organic substances from New Zealand unifloral manuka (Leptospermum scoparium) honeys[J].Taylor & Francis,2015,32(1):3-9.
[20] DIMITROVA B,GEVRENOVA R,ANKLAM E.Analysis of phenolic acids in honeys of different floral origin by solid-phase extraction and high-performance liquid chromatography[J].Phytochem Analysis,2007,18(1):24-32.
[21] ![]() P
P ![]() I,TUBEROSO C I G,et al.Cornflower (Centaurea cyanus L.) honey quality parameters:Chromatographic fingerprints,chemical biomarkers,antioxidant capacity and others[J].Food Chemistry,2014,142(1):12-18.
I,TUBEROSO C I G,et al.Cornflower (Centaurea cyanus L.) honey quality parameters:Chromatographic fingerprints,chemical biomarkers,antioxidant capacity and others[J].Food Chemistry,2014,142(1):12-18.
[22] 张雯,林毅侃,黄雨晴,等.在线二维高效液相色谱法测定发酵食品中的苯乳酸[J].食品与发酵工业,2020,46(9):243-249.
ZHANG W,LIN Y K,HUANG Y Q,et al.Establishment and application of a two dimensional high performance liquid chromatography method for phenyllactic acid in fermented food[J].Food and Fermentation Industries,2020,46(9):243-249.
[23] CAI H,ZHANG Q,SHEN L,et al.Phenolic profile and antioxidant activity of Chinese rice wine fermented with different rice materials and starters[J].LWT-Food Science and Technology,2019,111(1):226-234.
[24] ZHOU W,FANG R,CHEN Q.Effect of gallic and protocatechuic acids on the metabolism of ethyl carbamate in Chinese yellow rice wine brewing[J].Food Chemistry,2017,233:174-181.
[25] WANG P,MAO J,MENG X,et al.Changes in flavour characteristics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J].Food Control,2014,44:58-63.
[26] BUSTOS A Y,FONT DE VALDEZ G,GEREZ C L.Optimization of phenyllactic acid production by Pediococcus acidilactici CRL 1753.Application of the formulated bio-preserver culture in bread[J].Biological Control,2018,123:137-143.
[27] 张国华.不同地区传统面食发酵剂中菌群结构及优势菌种代谢的研究[D].杭州:浙江大学,2014.
ZHANG G H.Microbial communities in traditional sourdoughs from different areas of China and metabolic activity of dominant microorganism[D].Hangzhou:Zhejiang University,2014.
[28] WANG J P,YOO J S,LEE J H,et al.Effects of phenyllactic acid on production performance,egg quality parameters,and blood characteristics in laying hens[J].Journal of Applied Poultry Research,2009,18(2):203-209.
[29] COWLEY S,MAHONY J,VAN SINDEREN D.Current perspectives on antifungal lactic acid bacteria as natural bio-preservatives[J].Trends in Food Science & Technology,2013,33(2):93-109.