异构酶(isomerase)是七大酶类中的第五种,以EC5分类号命名,催化分子内的几何或者结构重排。可细分为差向异构酶(epimerase)、消旋酶(racemase)、互变异构酶(tautomerase)、变位酶(mutase)和顺反异构酶(cis-trans isomerase)等。自然界常见的物质如氨基酸和糖类都可能存在同分异构体,其分子质量相同,仅仅是原子空间排布不一致。它们彼此间常可通过异构酶来实现转化,异构酶催化的反应即异构反应(isomerization),这类反应往往是受到热力学影响的可逆反应,即酶对底物和产物都具有催化能力,在达到化学平衡后产物比例不再发生变化。异构反应最为人熟知的是果葡糖浆的生产过程,即利用葡萄糖异构酶(也称木糖异构酶、GIase)催化D-葡萄糖获得D-果糖,转化率一般为42%[1]。由于D-果糖的甜度较蔗糖高而D-葡萄糖又较之低,因此两者的混合物甜度与蔗糖接近(10%糖度下,55型果葡糖浆甜度与蔗糖一致、42型甜度为蔗糖的90%左右)。美国盛产玉米,因此大量的玉米淀粉可以水解为D-葡萄糖,进一步可以转化为果葡糖浆,果葡糖浆的推广解决了美国玉米产业的过剩问题,大型饮料企业如可口可乐在产品中广泛添加了果葡糖浆并为人熟知。早在2006年全球果葡糖浆产能就达到1 000万t,被誉为一项划时代的发明。果葡糖浆的成功证明了异构酶是具有重要产业价值的工业酶,然而许多异构酶催化的反应还没有得到深入的研究与重视,异构酶在工业酶中的占比仍比较低(约3%)。针对异构酶的挖掘改造以及应用研究还需要更加深入的总结与思考。本文结合自身的研究经历,综述了异构酶在生物制造领域尤其是食品、药品、药物中间体方向的研究现状并展望了未来发展方向,为异构酶的开发研究提供借鉴。
1 异构酶与生物制药
乳果糖(lactulose)也叫乳酮糖,是D-半乳糖基和D-果糖基通过β-1,4糖苷键连接而成的还原性二糖,具有治疗便秘、肝性脑病、调节肠道菌群等功效,是人类最早使用的益生元之一[2]。乳果糖在一百多个国家作为非处方药销售,2009年全球需求量就已突破5万t。乳果糖是乳糖的同分异构体,乳糖在碱性加热的条件下就可以自发异构为乳果糖。乳果糖的化学合成方法简单,使用硼酸或偏铝酸钠在碱性条件下催化即可得到且转化率较高(一般>75%)[3]。然而硼有毒性、铝是重金属,因此必须完全去除才可以作为食药产品销售[4]。但彻底去除较为困难,且食药领域对产品中硼含量的监管非常严格,因此实际产业化难度很大;相关技术被国外企业如苏威集团、雅培制药、韩美药业等公司垄断。近来发现乳果糖可以通过纤维二糖差向异构酶(cellobiose 2-epimerase,EC 5.1.3.11,CE酶)直接催化乳糖得到,另有一定的副产物依匹乳糖(epilactose)产生(图1)[5]。
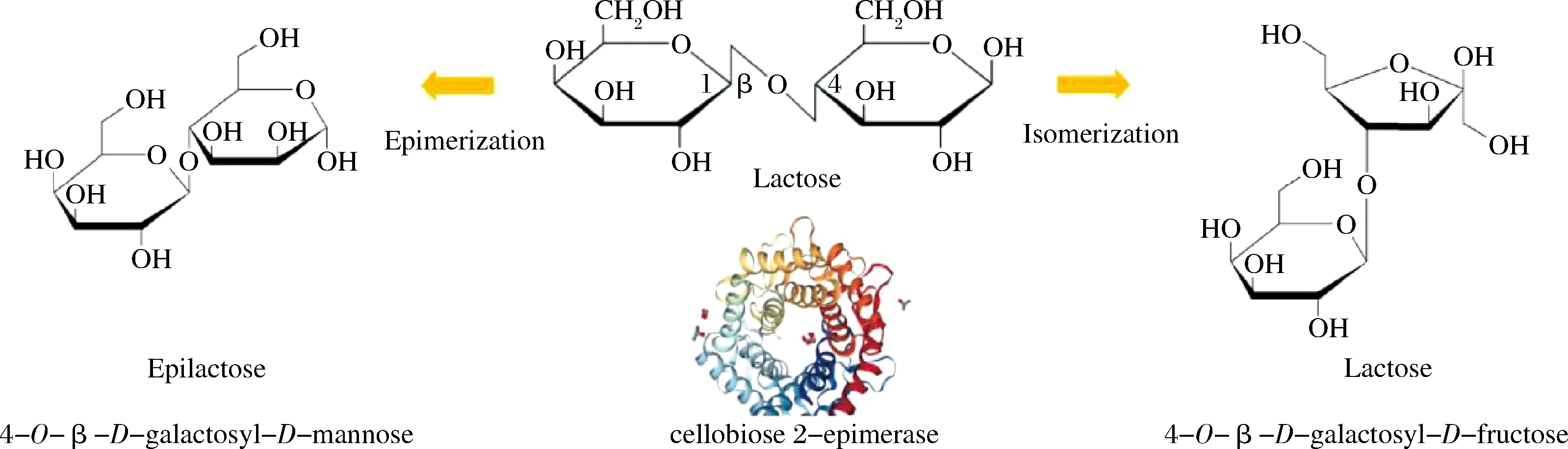
图1 CE酶催化乳糖产生乳果糖和依匹乳糖的示意图
Fig.1 Schematic diagram of CE enzyme catalyzing lactose to produce lactulose and epilose
此后,生物法制备乳果糖的技术路线得到了广泛重视,已发表文献中十多种不同来源的CE酶获得了研究。其中2012年报道的CE酶来源于极端嗜热纤维素降解菌Caldicellulosiruptor saccharolyticus菌株(CSCE酶),CSCE对乳糖的催化温度为80 ℃、pH 7.5,产率为58%,生产效率204 g/(L·h);依匹乳糖产率15%,生产效率54 g/(L·h),这项技术的出现使得生物异构制造乳果糖成为可能[6]。除了CSCE,已报道的其他CE酶还包括:Caldicellulosiruptor obsidiansis、Dictyoglomus turgidum、Thermoanaerobacterium saccharolyticum、Ruminococcus albus、Rhodothermus marinus、Spirochaeta thermophila、Bacteroides fragilis等[7]。然而其中多数来源的酶只产依匹乳糖,如R.albus、R.marinus、B.fragilis等,转化率约30%[8],而仅有几种高温型CE酶在催化底物数小时内产生乳果糖。以乳糖和硼酸的摩尔比1∶1来添加硼酸,CE酶对乳糖的底物转化率可以达到88%,副产物含量也较少,其中依匹乳糖不到2%[9]。然而硼酸的用量仍然偏高,彻底去除硼酸的难度很大。现有催化技术仍以大肠杆菌为主,大肠杆菌可产内毒素,因此不符合食品安全需求,对食品级或GRAS级宿主的开发是下一步努力的方向。WU等[10]成功将CE酶基因在食品级的枯草芽孢杆菌WB800中表达并制备了固定化酶反应器,结果表明该系统在表达量上能够达到较高水平;将CE酶固定化为酶膜反应器(enzyme membrane reactor,EMR)后可以重复催化10个批次。由于各国药典对乳果糖产品中依匹乳糖的含量有严格限定,因此如何控制依匹乳糖比例极为重要,实际操作难度很大。有研究表明依匹乳糖也能调节肠道菌群,是一种潜在的肠道益生元而对人体无害;这为放宽药典标准提供了可能,因此有必要对依匹乳糖进行充分的研究。这类研究的困难在于如何获取高纯度依匹乳糖:其在色谱分离过程中的出峰时间与乳糖极为接近,因此难以通过色谱法将两者分离。利用β-半乳糖苷酶可以水解未反应完的乳糖为D-半乳糖和葡萄糖,再通过酵母除去这些单糖;经色谱分离可以得到91.1%纯度的依匹乳糖,其缺点在于β-半乳糖苷酶的专一性不强,导致依匹乳糖有16%的损耗[11]。依匹乳糖在动物体内的初步验证表明:依匹乳糖对双歧杆菌的增值效果明显,但对厌氧菌和乳酸菌则一般,总体效果略逊于低聚果糖(fructooligosaccharides,FOS)[12]。
L-核糖(L-ribose)是D-核糖的同分异构体,它是可以通过异构酶制造的药物中间体[13]。天然的L-型单糖在自然界中含量很低,仅L-阿拉伯糖可以通过生物质大量获得,因此L-型单糖一直比较昂贵。L-核糖是非天然的L-型五碳糖,只在实验室中通过合成能够获得。L-核糖可以用作已上市的抗乙肝药替比夫定(telbivudine)的合成砌块,也可以作为其他几种尚未上市抗病毒药物的中间体,如:Clevudine、Levovirin、Maribavir等[14]。其中,英国制药商夏尔(Shire)宣布美国FDA已授予实验性抗病毒药物Maribavir(SHP620)治疗移植患者巨细胞病毒(cytomegalovirus,CMV)感染的突破性药物资格,表明了较好的应用前景。利用L-核糖还可以进一步制备得到2-脱氧-L-核糖,后者可用于生产多种核苷类似物药物,产品附加值较高。L-核糖的生物制备需要两步反应,出发底物为L-阿拉伯糖,中间产物为L-核酮糖(L-ribulose)。第一步反应由L-阿拉伯糖异构酶催化L-阿拉伯糖为L-核酮糖,转化率低于30%[15]。但由于酮糖可与硼酸结合形成络合物,因此可以在反应体系中加入硼酸,使得刚生成的L-核酮糖即与硼酸络合,脱离反应体系,造成化学平衡持续向生成L-核酮糖的方向移动;最终转化率可以提升至75%,生产强度375 g/(L·h)[16]。L-核酮糖-硼酸络合物可以通过树脂除去大部分的硼而释放出L-核酮糖,后者通过甘露糖-6-磷酸异构酶(mannose-6-phosphate isomerase,MPI)或L-核糖异构酶(L-ribose isomerase,L-RI)催化为L-核糖[17]。这步反应的转化率一般为70%,因此两步反应的最大理论转化率约为52.5%,高于大多数化学工艺。值得注意的是,L-核酮糖的稳定性与pH值和温度关系密切,在碱性和高温条件下L-核酮糖的损失很大[18],因此L-核酮糖在制造工艺中的稳定性需要考虑。比较第二步反应的2种酶,MPI多为嗜热酶,而L-RI均为常温酶,因此就稳定性而言,MPI用于工业催化的潜力更大,可与嗜热型L-AI搭配使用。XU等[19]利用固定化的Paenibacillus polymyxa来源的L-AI酶实现L-阿拉伯糖到L-核酮糖的转化,转化率为61.8%。玉米芯是玉米产业中常见的低值副产物,其中的半纤维素组分主要包含D-木糖、L-阿拉伯糖、D-葡萄糖三种单糖,L-阿拉伯糖占比可达35%。玉米芯常被水解后用于提取D-木糖制备木糖醇或低聚木糖,剩余废液中的L-阿拉伯糖完全可以用于制备L-核酮糖,这样的技术路线原料成本很低。即可通过浓缩先将水解液中含量较高的D-木糖结晶出来,剩下的L-阿拉伯糖用L-AI酶催化。由于大肠杆菌等宿主中含有阿拉伯糖操纵子,能够消耗一定比例的L-核酮糖,因此使用全细胞催化需要敲除阿拉伯糖操纵子相关基因。
2 异构酶与功能糖制造
肥胖可以导致多种衍生疾病,包括糖尿病、心脑血管病、呼吸系统疾病、癌症等,造成肥胖的主要原因在于糖和脂肪摄入过量以及缺乏运动。世界卫生组织统计体质指数(body mass index,BMI)显示,全球超重和肥胖的人数已超21亿,而中国的肥胖人口超越美国排在首位。低热量的蔗糖替代品将具有无比广阔的市场,功能糖是指一类具有低热量、调控血糖以及肠道益生功效的单糖、寡糖或糖醇,备受市场和研究者的关注。通过生物异构法能够制造的功能糖包括D-塔格糖(D-tagatose)、D-阿洛酮糖(D-psicose或D-allulose)、异麦芽酮糖(isomaltulose)或异麦芽酮糖醇(isomaltitol)、赤藓糖醇(erythritol)等。D-塔格糖通过L-阿拉伯糖异构酶(L-arabinose isomerase,L-AI)催化D-半乳糖获得,其甜度为蔗糖的92%,口感则相差无几,热量仅为蔗糖的38%[20]。D-塔格糖在烘焙中可以发生美拉德反应而产生引发食欲的焦糖色与香味,能够改善肠道微生物菌群进而促进益生菌生长[21]。由于大部分代糖甜味剂的口感与蔗糖有较大差异,因此在市场中常不受欢迎,而D-塔格糖是目前最适合替代蔗糖的天然甜味剂之一。D-塔格糖曾作为糖尿病药物进入三期临床实验,尽管最终失败(有研究者认为实验剂量设计错误导致了失败),但显示出在降血糖方面具有一定效果,这对糖尿病患者十分有利。至今已有数十种L-AI酶得到解析研究,包括常温、嗜热、超嗜热型L-AI。其中超嗜热酶Anoxybacillus flavithermus L-AI的催化温度能够达到95 ℃,Thermotoga maritima L-AI催化温度达到90 ℃[22]。超嗜热L-AI的稳定性非常好,不容易失活。但过高的反应温度或偏碱性的催化条件都会造成底物和产物的褐变反应,产生复杂的色素和副产物,因此嗜热型(最适反应温度60~70 ℃)条件下的L-AI酶更适于应用。例如Alicyclobacillus acidocaldarius、Lactobacillus plantarum NC8、Geobacillus stearothermophilus等来源[23]。而偏碱性条件也会带来褐变,最适反应pH偏微酸性(pH 6~7)最为有利。XU等[24]筛选到Lactobacillus fermentum CGMCC2921来源L-AI酶的最适反应温度为65 ℃、最适反应pH 6.5,恰好在这一范围内,具有产业化应用的潜力。几乎所有的L-AI酶都是金属酶(metalloenzyme),在EDTA处理后会丧失酶活性,金属离子尤其是二价阳离子对酶活性和热稳定性有很大的提高作用。添加Mn2+和Co2+都能够起到效果,其中Co2+的效果最好。但由于食品工业禁用Co2+,故添加Mn2+更为合适[25]。也有研究表明某些L-AI酶不需要额外添加金属离子,或添加量很小(<1 mmol/L)[26],可能的原因是活性中心与金属离子的结合能力较强,故金属离子不易脱落。D-塔格糖生物制备工艺的缺点在于底物D-半乳糖较为昂贵,由于通过乳糖水解可以获得D-半乳糖,因此开发乳糖至D-塔格糖的一步法工艺较有前途。XU等[27]通过共表达β-半乳糖苷酶(β-galactosidase)和L-阿拉伯糖异构酶,实现了从乳糖到D-塔格糖的一步生物法制备[27]。使用食品级宿主也是D-塔格糖生产亟待解决的问题,例如利用pEKEx2质粒可将L-AI基因在谷氨酸棒杆菌中表达,结果取得了较高的表达量[28]。D-塔格糖的纯化需要色谱分离,回收的D-半乳糖可以再利用以降低成本,回收工艺一般使用模拟移动床色谱法(simulated moving bed chromatography,SMBC)。由于D-半乳糖是醛糖而D-塔格糖是酮糖,这种差异使其分离效果相对较好,D-塔格糖可以达到很高纯度并能够结晶成为晶体[29]。又由于D-塔格糖的酮糖性质,它可以与硼酸结合形成络合物,然后脱离反应体系。这会打破反应平衡,使得反应继续朝产物生成方向进行,显著提升终产物含量[30]。
D-塔格糖于2014年在我国被批准为新食品原料,而早在2001年美国FDA即给予它普遍公认安全的GRAS(generally recognized as safe)认证[31]。因此D-塔格糖的应用前景光明,但国内目前仅见数家公司有相关产品且产能很低。其主要限制因素在于成本问题,蔗糖替代品一定是大宗产品,因此必须尽可能降低成本。由于D-半乳糖的产能较小,作为原料使用价格偏高,导致成品D-塔格糖的价格居高不下,达每公斤数百元人民币。就目前工艺来看,扩大D-半乳糖产能是一条有效的途径。D-半乳糖的制备一般通过乳糖酶水解乳糖(β-半乳糖苷酶处理),所得D-半乳糖和葡萄糖通过模拟移动床色谱分离,也可以培养不能消耗D-半乳糖但可以利用葡萄糖的微生物处理水解液获得高纯度的D-半乳糖。除此以外,近期也有报道通过合成生物学方法构建D-塔格糖的直接合成途径。例如LIU等[32]将2种外源性的氧化还原酶(XR和GDH)和一种乳糖酶gh1-1构建到酿酒酵母中,实现了乳糖直接转化为D-塔格糖。但这种方法所得D-塔格糖浓度不是特别高(37.7 g/L),发酵周期长(300 h),经济性还有待进一步考察。
D-阿洛酮糖(D-allulose或D-psicose)是D-果糖的C-3位差向异构体,天然的D-阿洛酮糖可见于无花果中,食用后热量近乎为零[33]。D-阿洛酮糖可以抑制脂肪肝酶和肠道α-糖苷酶,从而降低体内脂肪的积累和抑制血糖浓度的上升。2014年FDA认证D-阿洛酮糖为GRAS食品,标志其产业化前景光明。通过D-塔格糖-3-差向异构酶(D-tagatose-3-epimerase,DTE)或D-阿洛酮糖-3-差向异构酶(D-psicose-3-epimerase,DPE)催化D-果糖都可得到D-阿洛酮糖。D-果糖一般由D-葡萄糖经过葡萄糖异构酶催化后再分离获得,最高可达到90%纯度(F90型果葡糖浆);它的价格低于结晶果糖,作为底物具有成本优势。迄今已有十多种DTE被研究,包括Agrobacterium tumefaciens、Clostridium sp.、Clostridium cellulolyticum、Rhodobacter sphaeroides、Pseudomonas cichorii等,对高浓度D-果糖的最高转化率有32.9%(D-果糖质量浓度700 g/L)[34]。DTE酶已在谷氨酸棒杆菌中表达成功,利用20 mg/L青霉素和10%甲苯透性化处理重组谷氨酸棒杆菌,反应40 min对750 g/L D-果糖的转化率达到31%,实现了食品级宿主制备D-阿洛酮糖的应用[35]。目前的技术瓶颈在于D-塔格糖-3-差向异构酶催化D-果糖的转化率低,由于该反应是可逆反应,受化学平衡限制转化率难以提高。解决的方法是筛选具有不同反应机制的新酶,这存在很大的运气成分;或开发高效的底物—产物分离方法,使得未反应底物以高收率再利用,降低生产成本。D-阿洛酮糖还可以进一步催化获得D-阿洛糖,该催化反应使用L-鼠李糖异构酶,转化率30%[36]。通过模拟移动床技术可以将D-阿洛糖分离得到,纯度可达95%[37]。由于转化率较低,底物过于昂贵,D-阿洛糖的产业化还需要更多的研究。
异麦芽酮糖(isomaltulose)是蔗糖的同分异构体,它经过化学加氢后可制得异麦芽酮糖醇,也称帕拉金糖(商品名Palatinose),是FDA认证的GRAS级食品[38]。异麦芽酮糖通过蔗糖异构酶(sucrose isomerase,SI)催化蔗糖获得,该催化过程伴有副产物形成,包括海藻酮糖(trehalulose)、少量的单糖D-葡萄糖和D-果糖[39]。有趣的是某些SI酶催化蔗糖产物中海藻酮糖占主要成分,例如P.mesoacidophila MX-45和A.radiobacter MX-232来源[40-41];目前还没有发现海藻酮糖的用途,因此限制海藻酮糖的产生有实际意义。XU等[42]通过解析SI酶的高分辨率蛋白质晶体结构,发现活性口袋附近的一段无规卷曲结构对产物比例有较大影响。在这段loop区进行氨基酸残基的替换可以改变终产物中异麦芽酮糖与海藻酮糖的比例,由87%∶13%(海藻酮糖)变为44%∶56%。分子动力学模拟研究表明无规卷曲结构发生氨基酸残基替换后,残基R333与E428形成氢键,削弱了R333与呋喃型果糖基的作用。这将导致游离的呋喃型果糖基可以发生互变异构,形成吡喃型果糖后重新与葡萄糖基团结合产生海藻酮糖,使其比例大幅提升。表面展示是提升催化效率的有效方法,酿酒酵母表面展示技术可用于SI酶的应用,而且酿酒酵母是食品级宿主,因而更具有工业化前景;LEE等[43]将Enterobacter sp.FMB-1来源SI酶通过GPI型壁蛋白锚定在细胞表面,并通过FACS技术筛选高活力的细胞株,经过表面展示的SI酶还具有更好的热稳定性。
3 异构酶与小品种氨基酸制造
自然界常见的氨基酸均为L-构型、D-构型的氨基酸(包括D-与L-混合的DL-型)结构独特,较为罕见,因此具有特殊用途。DL-丙氨酸是L-丙氨酸的消旋产物,甜度较大可用做食品调味剂或营养强化剂;也可用于合成维生素B6或用作农药与医药中间体等。DL-丙氨酸可通过异构酶反应生产,利用丙氨酸消旋酶(L-alanine racemase)催化部分L-丙氨酸为D-丙氨酸(转化率50%),所获得产品即旋光度为零的DL-丙氨酸。已报道的丙氨酸消旋酶来源于Streptoccocus faecalis、Salmonella typhimurium、Bacillus subtilis等微生物[44],但利用食品级宿主表达丙氨酸消旋酶才能用于食品工业,DL-丙氨酸经微生物降解后还可以获得纯的D-丙氨酸可用于其他用途。与之类似,DL-谷氨酸也可以通过谷氨酸消旋酶(glutamate racemase)催化L-谷氨酸获得,DL-谷氨酸再经过谷氨酸脱羧酶(glutamate decarboxylase,GAD酶)作用产生γ-氨基丁酸(GABA)和D-谷氨酸,经过下游分离可以将两者分开[45];由于DL-和D-谷氨酸的价格昂贵,故由此工艺可以提高L-谷氨酸的产品附加值。以上研究表明,异构酶可以提升氨基酸的产品附加值,为小品种氨基酸的产业化制备提供了途径。
4 工业用异构酶的改造研究
学者们针对前述各类异构酶展开了大量研究,主要目的在于改造它们从而获得更好的催化性能和热稳定性(如表1总结),下面列举有代表性的案例。对CE酶的改造包括酶活力的提升、热稳定性增强、副产物降低等几个方面。对Ruminococcus albus CE的研究表明保守残基R52、H243、E246、W249、W304、E308和H374影响酶活力,其丙氨酸突变体均完全失活,F114和W303也对活性有很大影响。晶体结构研究表明,H243、W249、H374、H377和M378位于活性中心入口处,R52和F114在活性中心的底部,2个组氨酸H374和H243作为广义酸碱执行催化反应;活性口袋的整体疏水性较强,确保底物不被水解[46]。对CSCE的研究表明,双点突变E161D/N365P酶活性半衰期延长了4倍,最适反应温度由80 ℃上升到87.5 ℃,对乳糖的催化效率kcat/Km上升了29% [47]。通过4轮基于随机突变的定向进化筛选,SHEN等[48]又将CSCE的酶活性和催化效率分别提升了2.8和3倍,突变体酶有5个位点改变(R5M/I52V/A12S/K328I/F231L)。令人意外的是突变体酶不产依匹乳糖,使得乳果糖产率上升到76%。由于R5、A12、K328和F231都是位于CSCE酶表面的残基,因此它们对产物选择性的影响尚无法阐述。而I52距离活性中心仍然较远,因而需要晶体结构研究进一步揭示这些残基对催化产生的影响。对L-AI酶的改造包括酶活力提升、最适温度和pH改造等,G.thermonitrificans L-AI的突变体F280 N/C450S/N475K具有更高的转换数kcat值,达到6 245 min-1,催化效率kcat/Km达到4.7 L/(mmol·min)[49]。对MPI酶的改造包括定点突变获得R142 N突变体,其kcat值达到81 063 s-1,是野生型的1.6倍[50]。总结以上研究可得出结论,异构酶普遍缺乏高通量的突变体筛选方法,产物检测依赖高效液相色谱,因此常使用基于理性设计的定点突变方法以减少样品数量。
表1 针对工业异构酶的部分改造研究
Table 1 Summary of modifications on industrial isomerases

酶的名称用途产业化情况改造方式改造目的葡萄糖异构酶生产果葡糖浆规模化应用理性设计提高热稳定性、提高酶活性L-阿拉伯糖异构酶生产D-塔格糖规模化应用定向进化、理性设计提高酶活性、改变反应温度和pH蔗糖异构酶生产异麦芽酮糖规模化应用理性设计改变产物比例纤维二糖差向异构酶生产乳果糖中试定向进化、理性设计提高热稳定性、提高酶活性、减少副产物D-塔格糖-3-差向异构酶生产D-阿洛酮糖中试理性设计提高热稳定性、提高酶活性
5 异构酶在生物制造中的前景展望
异构酶是生物异构反应的关键,因此挖掘性能更好的异构酶或对现有酶源进行改造是研究的重点。异构酶多具有宽泛的底物谱,但对每一种底物的转化率可能都不高,筛选到优异的新酶常有赖于“运气”;盲目性比较大。因此基于定向进化或理性设计改造现有酶库是更加可行的手段,这需要建立一个简便的具有普适性的高通量筛选方法。近年来,基于流式细胞仪的荧光激活细胞分选术成功应用于多种工业酶的高通量筛选,该技术对于异构酶也应具有良好的效果,但设计异构产物相应的高特异性指示探针是先决条件。另一方面,由于工业化过程的环境较为苛刻,因此对酶的稳定性提出很高要求。解决这一问题的思路分以下几种:(1)筛选嗜热酶,嗜热酶具有较高的反应温度(一般达到60~90 ℃),这类酶在常温或低温下的稳定性十分优异,适合储存也适合重复利用;催化中一般采用略低于最适反应温度的条件,同时延长反应时间,可以达到最优效果并大幅提升活性半衰期,显著降低制备或购买酶带来的成本。(2)开发固定化酶技术,将新型材料与异构酶结合,近年来较热门的材料包括金属有机框架材料、磁性纳米微粒、无机杂化纳米花等。已发现的异构酶多数属于金属酶,需要金属离子参与反应或帮助稳定酶的三维构象,因此在反应或贮存过程中添加一定浓度的金属离子有助于提高酶的活性和稳定性。然而,离子的选择应当考虑到产品的应用场景,例如许多离子在食品行业中是禁止的,研发时应优先考察金属离子浓度需求较低的酶源。异构反应的一个优势在于很少需要辅因子或辅酶的介入,因此不需要添加非常昂贵的辅因子或辅酶,也无需使用完整细胞即可实现催化,这在很大程度上增加了异构酶产业化的可能性。当然我们要看到,异构反应也有其缺陷的一面,例如异构反应一般是可逆反应,底物在催化过程中无法实现全部转化;未得到利用的残留底物一方面降低了生产效率,另一方面增加了产物分离提取的难度。此外,异构反应的转化率受热力学影响很大,许多反应要在较高温度下才能获得满意的转化率,这对酶的来源(是否为嗜热酶)、酶的热稳定性、底物和产物的稳定性、高温是否产生副产物等都提出了一定要求。前述也提到可用两步氧化还原反应替代一步异构反应,并取得不错的效果。因此我们在生物制造的路线选择中应当灵活选用,以追求更低成本和更高效率作为最根本的标准。总的来说,异构酶在生物制造中的应用领域逐年拓宽,近十年来的技术积累已厘清了技术革新的方向,相信异构酶在新一代生物制造技术中将占有一席之地。
[1] ZHU F,DENG H,HE X,et al.High-level expression of Thermobifida fusca glucose isomerase for high fructose corn syrup biosynthesis[J].Enzyme and Microbial Technology,2020,135:109 494.
[2] SCHUMANN C.Medical,nutritional and technological properties of lactulose.An update[J].European Journal of Nutrition,2002,41(1):i17-i25.
[3] WANG M,GASMALLA M A,TESSEMA H A,et al.Lactulose production from efficient isomerization of lactose catalyzed by recyclable sodium aluminate[J].Food Chemistry,2017,233:151-158.
[4] SITANGGANG A B,DREWS A,KRAUME M.Recent advances on prebiotic lactulose production[J].World Journal of Microbiology and Biotechnology,2016,32(9):154.
[5] WANG H,YANG R,HUA X,et al.Enzymatic production of lactulose and 1-lactulose:Current state and perspectives[J].Applied Microbiology and Biotechnology,2013,97(14):6 167.
[6] KIM Y S,OH D K.Lactulose production from lactose as a single substrate by a thermostable cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus[J].Bioresource Technology,2012,104:668-672.
[7] 徐铮, 诸亚锋.纤维二糖差向异构酶的研究与应用进展[J].食品与发酵工业,2020,46(23):248-254.
XU Z,ZHU Y F.Recent advances in research and applications of cellobiose 2-epimerase[J],Food and Fermentation Industries,2020,46(23):248-254.
[8] AÏT-AISSA A,AÏDER M.Lactulose:production and use in functional food,medical and pharmaceutical applications.Practical and critical review[J].International Journal of Food Science and Technology,2014,49(5):1 245-1 253.
[9] KIM Y S,KIM J E,OH D K.Borate enhances the production of lactulose from lactose by cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus[J].Bioresource Technology,2013,128:809-812.
[10] WU L,XU C,LI S,et al.Efficient production of lactulose from whey powder by cellobiose 2-epimerase in an enzymatic membrane reactor[J].Bioresource Technology,2017,233:305-312.
[11] SABURI W,YAMAMOTO T,TAGUCHI H,et al.Practical preparation of epilactose produced with cellobiose 2-epimerase from Ruminococcus albus NE1[J].Bioscience Biotechnology and Biochemistry,2010,74(8):1 736-1 737.
[12] WATANABE J,NISHIMUKAI M,TAGUCHI H,et al.Prebiotic properties of epilactose[J].Journal of Dairy Science,2008,91(12):4 518-4 526.
[13] XU Z,SHA Y,LIU C,et al.L-Ribose isomerase and mannose-6-phosphate isomerase:Properties and applications for L-ribose production[J].Applied Microbiology and Biotechnology,2016,100(21):9 003-9 011.
[14] CHEN M,WU H,ZHANG W,et al.Microbial and enzymatic strategies for the production of L-ribose[J].Applied Microbiology and Biotechnology,2020,104(8):3 321-3 329.
[15] HELANTO M,KIVIHARJU K,LEISOLA M,et al.Metabolic engineering of Lactobacillus plantarum for production of L-ribulose[J].Applied and Environmental Microbiology,2007,73(21):7 083-7 091.
[16] ZHANG Y W,JEYA M,LEE J K.L-ribulose production by an Escherichia coli harboring L-arabinose isomerase from Bacillus licheniformis[J].Applied Microbiology and Biotechnology,2010,87(6):1 993-1 999.
[17] YEOM S J,JI J H,KIM N H,et al.Substrate specificity of a mannose-6-phosphate isomerase from Bacillus subtilis and its application in the production of L-ribose[J].Applied and Environmental Microbiology,2009,75(14):4 705-4 710.
[18] DE MUYNCK C,PEREIRA C,SOETAERT W,et al.Dehydrogenation of ribitol with Gluconobacter oxydans:Production and stability of L-ribulose[J].Journal of Biotechnology,2006,125(3):408-415.
[19] XU Z,WANG R,LIU C,et al.A new L-arabinose isomerase with copper ion tolerance is suitable for creating protein-inorganic hybrid nanoflowers with enhanced enzyme activity and stability[J].RSC Advances,2016,6(37):30 791-30 794.
[20] LU Y,LEVIN G V,DONNER T W.Tagatose,a new antidiabetic and obesity control drug[J].Diabetes Obesity and Metabolism,2008,10(2):109-134.
[21] LEVIN G V.Tagatose,the new GRAS sweetener and health product[J].Journal of Medicinal Food,2002,5(1):23-36.
[22] XU Z,LI S,FENG X,et al.L-Arabinose isomerase and its use for biotechnological production of rare sugars[J].Applied Microbiology and Biotechnology,2014,98(21):8 869-8 878.
[23] 沐万孟, 张涛,江波,等.D-塔格糖与L-阿拉伯糖异构酶的研究进展[J].食品与发酵工业,2007,33(6):84-90.
MU W M,ZHANG T,JIANG B,et al.Progress in researches on D-tagatose and L-arabinose isomerase[J].Food and Fermentation Industries,2007,33(6):84-90.
[24] XU Z,QING Y,LI S,et al.A novel L-arabinose isomerase from Lactobacillus fermentum CGMCC2921 for D-tagatose production:Gene cloning,purification and characterization[J].Journal of Molecular Catalysis B:Enzymatic,2011,70(1):1-7.
[25] LEE D W,JANG H J,CHOE E A,et al.Characterization of a thermostable L-arabinose (D-galactose) isomerase from the hyperthermophilic eubacterium Thermotoga maritima[J].Applied and Environmental Microbiology,2004,70(3):1 397-1 404.
[26] RHIMI M,ILHAMMAMI R,BAJIC G,et al.The acid tolerant L-arabinose isomerase from the food grade Lactobacillus sakei 23K is an attractive D-tagatose producer[J].Bioresource Technology,2010,101(23):9 171-9 177.
[27] XU Z,XU Z X,TANG B,et al.Construction and co-expression of polycistronic plasmids encoding thermophilic L-arabinose isomerase and hyperthermophilic β-galactosidase for single-step production of D-tagatose[J].Biochemical Engineering Journal,2016,109:28-34.
[28] SHIN K C,SIM D H,SEO M J,et al.Increased production of food-grade D-tagatose from D-galactose by permeabilized and immobilized cells of Corynebacterium glutamicum,a GRAS host,expressing D-galactose isomerase from Geobacillus thermodenitrificans[J].Journal of Agricultural and Food Chemistry,2016,64(43):8 146-8 153.
[29] 信成夫, 景文利,于丽,等.塔格糖结晶条件的优化[J].食品科技,2013,38(7):244-246.
XIN C F,JING W L,YU L,et al.Optimization of crystallization condition for Tagatose[J].Food Science and Technology,2013,38(7):244-246.
[30] SALONEN N,SALONEN K,LEISOLA M,et al.D-Tagatose production in the presence of borate by resting Lactococcus lactis cells harboring Bifidobacterium longum L-arabinose isomerase[J].Bioprocess and Biosystems Engineering,2013,36(4):489-497.
[31] OJAYAMUTHUNAGAI J,GAUTAM P,SRISOWMEYA G,et al.Biocatalytic production of D-tagatose:A potential rare sugar with versatile applications[J].Critical Reviews in Food Science and Nutrition,2017,57(16):3 430-3 437.
[32] LIU J J,ZHANG G C,KWAK S,et al.Overcoming the thermodynamic equilibrium of an isomerization reaction through oxidoreductive reactions for biotransformation[J].Nature Communications,2019,10(1):1-8.
[33] ZHANG W,YU S,ZHANG T,et al.Recent advances in D-allulose:physiological functionalities,applications,and biological production[J].Trends in Food Science and Technology,2016,54:127-137.
[34] 沈雪梅,王靖,张媛,等.D-阿洛酮糖的功能及其生物合成研究进展[J].生物工程学报,2018,34(9):1 419-1 431.
SHEN X M,WANG J,ZHANG Y,et al.Research progress of D-psicose:Function and its biosynthesis[J].Chinese Journal of Biotechnology,2018,34(9):1 419-1 431.
[35] PARK C S,KIM T,HONG S H,et al.D-allulose production from D-fructose by permeabilized recombinant cells of Corynebacterium glutamicum cells expressing D-allulose 3-epimerase Flavonifractor plautii[J].PLoS One,2016,11(7):e0 160 044.
[36] CHEN Z,CHEN J,ZHANG W,et al.Recent research on the physiological functions,applications,and biotechnological production of D-allose[J].Applied Microbiology and Biotechnology,2018,102(10):4 269-4 278.
[37] MORIMOTO K,PARK C S,OZAKI M,et al.Large scale production of D-allose from D-psicose using continuous bioreactor and separation system[J].Enzyme and Microbial Technology,2006,38(6):855-859.
[38] LINA B A,JONKER D,KOZIANOWSKI G.Isomaltulose (Palatinose®):A review of biological and toxicological studies[J].Food and Chemical Toxicology,2002,40(10):1 375-1 381.
[39] MU W,LI W,WANG X,et al.Current studies on sucrose isomerase and biological isomaltulose production using sucrose isomerase[J].Applied Microbiology and Biotechnology,2014,98(15):6 569-6 582.
[40] WATZLAWICK H,MATTES R.Gene cloning,protein characterization,and alteration of product selectivity for the trehalulose hydrolase and trehalulose synthase from “Pseudomonas mesoacidophila” MX-45[J].Applied and Environmental Microbiology,2009,75(22):7 026-7 036.
[41] NAGAI-MIYATA Y,TSUYUKI K I,SUGITANI T,et al.Isolation and characterization of a trehalulose-producing strain of Agrobacterium[J].Bioscience,Biotechnology,and Biochemistry,1993,57(12):2 049-2 053.
[42] XU Z,LI S,LI J,et al.The structural basis of Erwinia rhapontici isomaltulose synthase[J].PloS One,2013,8(9):e74 788.
[43] LEE G Y,JUNG J H,SEO D H,et al.Isomaltulose production via yeast surface display of sucrose isomerase from Enterobacter sp.FMB-1 on Saccharomyces cerevisiae[J].Bioresource Technology,2011,102(19):9 179-9 184.
[44] 蒋光玉.DL-丙氨酸生产工艺的研究进展[J].精细与专用化学品,2011,19(7):25-28.
JIANG G Y.Progress in production technology of DL-alanine[J].Fine and Specialty Chemicals,2011,19(7):25-28.
[45] XIONG Q,XU Z,XU L,et al.Efficient production of γ-GABA using recombinant E.coli expressing glutamate decarboxylase (GAD) derived from eukaryote Saccharomyces cerevisiae[J].Applied Biochemistry and Biotechnology,2017,183(4):1 390-1 400.
[46] FUJIWARA T,SABURI W,INOUE S,et al.Crystal structure of Ruminococcus albus cellobiose 2-epimerase:Structural insights into epimerization of unmodified sugar[J].FEBS Letters,2013,587(7):840-846.
[47] SHEN Q,ZHANG Y,YANG R,et al.Thermostability enhancement of cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus by site-directed mutagenesis[J].Journal of Molecular Catalysis B:Enzymatic,2015,120:158-164.
[48] SHEN Q,ZHANG Y,YANG R,et al.Enhancement of isomerization activity and lactulose production of cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus[J].Food Chemistry,2016,207:60-67.
[49] KIM B J,HONG S H,SHIN K C,et al.Characterization of a F280 Nvariant of L-arabinose isomerase from Geobacillus thermodenitrificans identified as a D-galactose isomerase[J].Applied Microbiology and Biotechnology,2014,98(22):9 271-9 281.
[50] YEOM S J,SEO E S,KIM B N,et al.Characterization of a mannose-6-phosphate isomerase from Thermus thermophilus and increased L-ribose production by its R142 N mutant[J].Applied and Environmental Microbiology,2011,77(3):762-767.