国务院办公厅印发的《国民营养计划(2017—2030年)》提出:近年来,我国人民生活水平不断提高,营养供给能力显著增强,国民营养健康状况明显改善。但仍面临居民营养不足与过剩并存、营养相关疾病多发、营养健康生活方式尚未普及等问题,成为影响国民健康的重要因素。
饮食中营养成分的消化吸收依赖着人体最重要的系统之一——消化系统。食物依次经过口腔咀嚼、胃的分解和肠道消化吸收提供给人体日常所需的能量和营养。人们日常摄入的食物种类繁多,有很多不被胃肠道分解消化吸收的食物,如复杂的膳食纤维、多糖、结构发生改变的蛋白质等,基本上靠肠道微生物来解决。因而,庞大的肠道微生物群体被称为人体独立的器官或者第二基因组,在食物消化、营养摄入和宿主健康维持等方面起到了重要作用,肠道菌群紊乱会引发肥胖、糖尿病、胰岛素抵抗等代谢疾病。木糖醇作为低热量的功能性甜味剂,仅有少量被人体直接吸收,同时只有5%被排出,大量的木糖醇被肠道微生物消化,其在肠道中通过微生物发挥的作用不容小觑。
1 概述
木糖醇是一种极易溶于水的五羟基糖醇,通常为白色或无色固体,化学式为C5H12O5。天然木糖醇广泛存在于水果、蔬菜、谷类中,但是含量非常低。人们最初从植物原料中提取木糖醇,但作为全球市场首要稀有糖醇,天然木糖醇的提取量远无法满足市场需求,因此工业上常用化学方法镍催化水解木糖得到大量木糖醇。如今也利用代谢工程菌如酿酒酵母、假丝酵母等生物技术方法改进生产[1]。
木糖醇基于本身的天然性质,在生物医药、食品和其他方面取得了巨大成功。木糖醇入口溶解吸热,往往伴有微微的清凉感,因此常被用作食品甜味剂替代者和新型冷却剂[2]。木糖醇无须胰岛素促进也能透过细胞膜,供细胞以营养和能量,且不会引起血糖值升高,还能够消除糖尿病人服用后的三多症状(多食、多饮、多尿),是最适合糖尿病患者食用的营养性的食用糖代替品。木糖醇与普通的白砂糖相比,甜度相当,还具有热量低的优势——1 g木糖醇仅含有2.4 cal热量,比其他大多数碳水化合物的热量少40%,因而木糖醇可被应用于各种减肥食品中,作为高热量白糖的代用品[3]。
尽管木糖醇在食品中应用范围广泛,但其在国内的应用水平却仍然较低。按照我国人均每年消耗食糖8 kg的标准,如果其中0.1%的糖料由木糖醇替代,则食品工业应该需要木糖醇1万多吨,累计医药工业(1.4万t)与轻化工业(0.2万t)年需求量预计,我国木糖醇的年需求量在2.6万t以上。而实际上,我国木糖醇产品的应用量(2.7万t以下)不足总产量(9万t以下)的30%[4-5]。由此可见,木糖醇在国内尚有很大的应用空间。
2 木糖醇的生物代谢
2.1 木糖醇在人体内的代谢
木糖醇是人体代谢的一个中间体,正常成年人每天身体内可以合成约15 g木糖醇,在人体正常血液中的质量浓度为0.03~0.06 mg/100 mL。木糖醇具有十分重要的生理、生物学性质,会对人体的各种机能产生积极的影响。木糖醇能参与机体核酸等的生理合成及机体解毒过程,纠正蛋白质、脂肪、类固醇异常代谢,有强大的抗酮体生成作用,因此可作为糖尿病人机体代谢异常的调节剂和营养剂,肝病的辅助治疗剂,手术前后的能量补充营养剂。
木糖醇在人体中的代谢速度相当快,体重70 kg的健康者每日可代谢木糖醇500~600 g,每小时每千克体重约为0.7 g,每克木糖醇全部代谢产生4.06 cal的热量。研究结果显示,木糖醇口服后通过肠道吸收,不受根皮苷及2,4-二硝基苯酚等相抑剂的影响。无论口服还是静脉注射,进入体内的木糖醇大约有85%通过肝脏,10%通过肾脏代谢,小部分被血液细胞、肾上腺皮质和其他组织利用。人体肝脏代谢木糖醇的能力约为0.37~0.5 g/kg体重。
根据13C示踪原子实验,服用木糖醇之后的12 h之内,摄入的木糖醇有50%~60%变成CO2,通过肺呼出体外,通过在尿液及粪便中排出各2%~10%,还有20%~30%转化成糖原或其他中间产物储存在细胞中,有相当好的生物利用率[6]。
市面上销售供食用的木糖醇是D-木糖醇,外源性木糖醇进入体内很快经细胞质中经艾杜糖醇脱氢酶脱氢转化成D-木酮糖,这一过程无需胰岛素促进而透过细胞膜,对血糖不产生影响。这是木糖醇用于糖尿病治疗的基础。如图1所示,木糖醇在体内主要参与了葡萄糖醛酸-木酮糖循环,是由6个碳的葡萄糖醛酸先转化成L-古洛糖酸,然后经3-酮L-古洛糖酸转化为L-木酮糖,再经木糖醇转化为D-木酮糖,人体中的木糖醇转化成D-木酮糖之后,反应生成5-磷酸木酮糖,再转化为5-磷酸核酮糖,这样葡萄糖醛酸-木酮糖支路就和磷酸戊糖及糖代谢的正常途径完全相联系。

图1 木糖醇在KEGG(Kyoto Encyclopedia of Genes and Genomes)上的代谢通路[8]
Fig.1 Metabolic pathways of xylitol in KEGG
生成6-磷酸果糖后进入糖酵解途径代谢成丙酮酸,最后进入三羧酸循环为机体提供能量,或者转化为其他物质如核糖、琥珀酸等供机体利用[7]。葡萄糖醛酸-木酮糖循环将人体不能用在合成反应和生化反应的葡萄糖醛酸通过一系列反应和木糖醇,与磷酸戊糖途径相连再次循环到葡萄糖代谢中去。部分木糖醇可代谢成D-木糖,再经过一系列反应后生成丙酮酸,与柠檬酸循环相联系,还可以往核糖醇、L-阿拉伯糖转化。
2.2 木糖醇的微生物代谢
微生物的木糖醇代谢途径与人体相似,主要直接或间接转化为木酮糖进入磷酸戊糖途径被代谢。很多微生物如大肠杆菌、酵母等是工业上以木糖为原料生产木糖醇的优良菌株,而肠道中的微生物除了产生能量维持自身或其他微生物的新陈代谢活动外,还产生益于肠道的次级代谢物。已知丙酮酸是碳水化合物代谢成短链脂肪酸的重要中间体,因此木糖醇被微生物代谢生成短链脂肪酸的主要代谢途径如图2所示。其中木糖醇脱氢酶(EC 1.1.1.14)和木糖醇氧化酶(EC 1.1.3.41)、木糖醇还原酶(EC 1.1.1.21)、木糖异构酶(EC 5.3.1.5)分别是将D-木糖醇转化为D-木酮糖的2个途径中的转化酶,木酮糖激酶(EC 2.7.1.17)和磷酸木酮糖异构酶(EC 5.1.3.1)是木酮糖进入磷酸戊糖代谢途径重要的2个酶。
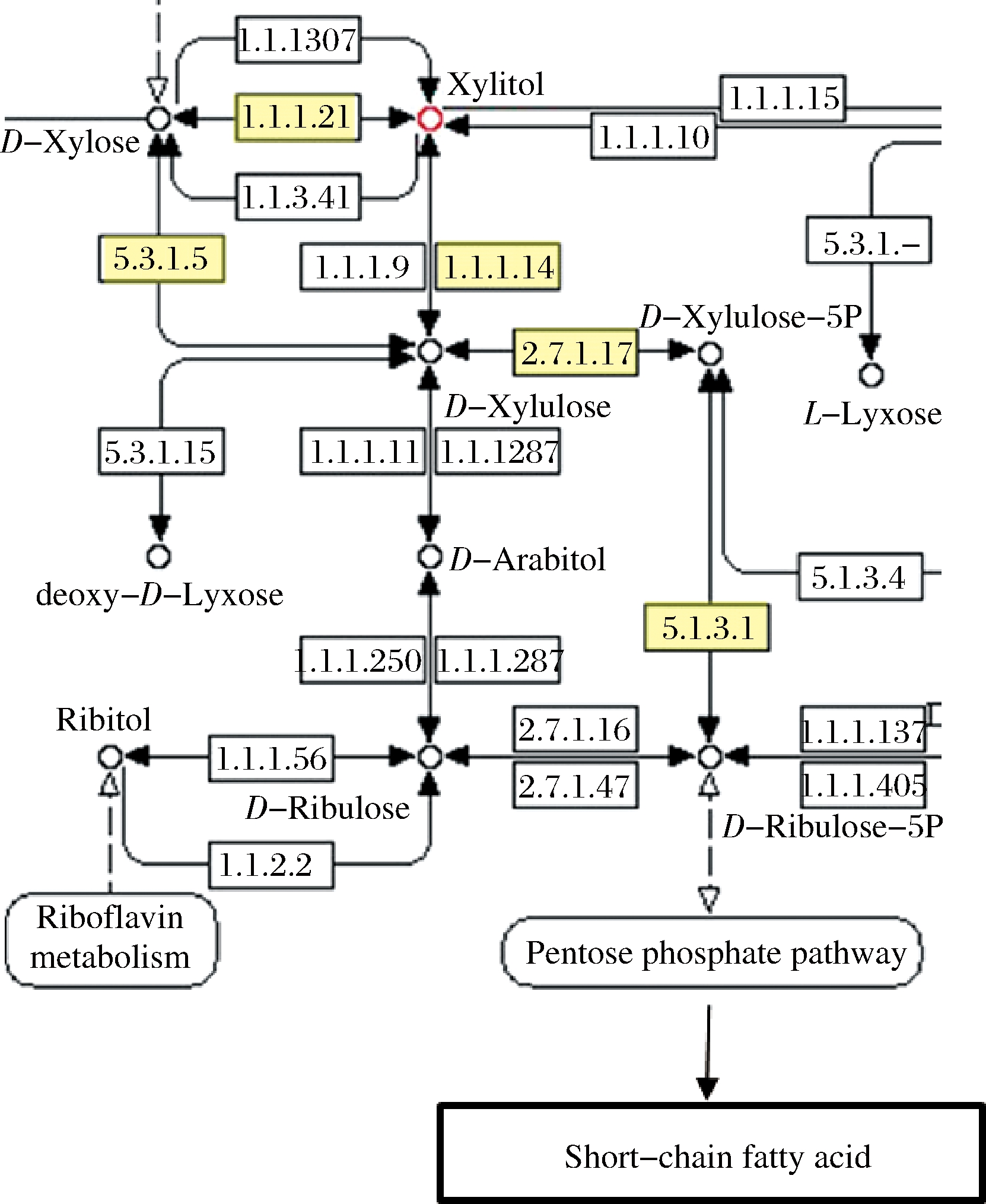
图2 木糖醇被微生物代谢生成短链脂肪酸的
已知代谢途径和酶[8]
Fig.2 Known metabolic pathways and enzymes metabolized by
microorganisms using xylitol to produce short-chain fatty acids
现有研究还没有发现木糖醇具有自己的运输系统,有人报道木糖醇可能与葡萄糖共用碳水化合物磷酸转移酶系统[9-10],KENTACHE等[11]通过插入一个转座子到单增李斯特菌磷酸转移酶系统中编码膜蛋白EIIC的基因上,发现可以阻止阿拉伯糖醇和木糖醇被利用,从而证实了这一可能。
3 木糖醇对微生物的作用
3.1 肠道微生物
结肠中生活着1013~1014个微生物,将近是人体所有细胞总量的100倍,因此肠道微生物也被称为人体独立的器官或者第二基因组。肠道微生物菌群具有许多基本功能,最重要的作用之一是能量获取。肠道微生物在食物消化中起到了重要作用,例如植物细胞壁上的几种多糖降解酶不是由宿主细胞编码,而是由肠道中某些菌基因的特异表达。部分摄入的食物经微生物分解之后才能被肠道细胞吸收,为宿主提供营养和能量,影响宿主的生理健康[12]。
肠道微生物还被报道参与致病菌感染的抑制、免疫系统的增强及维生素的合成,与胃炎、炎症性肠炎、肠易激综合征、肠乳糜泻等胃肠道疾病,肥胖、糖尿病、胰岛素抵抗等代谢疾病也有关,甚至还通过脑-肠轴影响老年痴呆、自闭症谱系障碍、帕金森病和临床抑郁症等神经性疾病[13-14]。同时,生病的机体也会反过来进一步加重肠道菌群的失调。
宿主与肠道微生物之间的对话影响着人体健康,但并不是只有机体出现问题时,肠道微生物与宿主才会交流。在健康的宿主中,生活在结肠中的数以万亿计的微生物也在勤勤恳恳地工作,维持自身平衡的同时,促进宿主摄取能量和营养、改善和维持宿主健康、预防各种疾病的发生。因此,近年来,肠道菌群已成为了食品消化和生物医药领域的研究热点。
3.2 木糖醇对肠道菌群的影响
作为一类难消化性碳水化合物,木糖醇与部分益生元相似的性质引起了科学家们的好奇,通过一系列实验探究木糖醇与肠道微生物、代谢标志物之间的关系。例如喂养大鼠高剂量木糖醇[1.5~4.0 g/(kg·d)]的高脂饮食可以促进脂质的代谢。补充低和中剂量的木糖醇[40和194 mg/(kg·d)],可以显著改变老鼠肠道微生物的组成,但是脂质代谢没有明显变化,因此推测肠道微生物通过来源于膳食纤维的短链脂肪酸抑制脂肪的积累[15]。葡聚糖和木糖醇组合增加了所有短链脂肪酸的浓度,特别是乙酸盐和丙酸盐,降低了支链脂肪酸水平,而生物胺水平基本保持不变[16]。木糖醇对小鼠肠道微生物群和尿液中异黄酮的分泌也有影响,喂养黄豆苷元的两组雄性小鼠中饮食添加木糖醇组,相比于对照组血浆中胆固醇浓度明显降低,尿液中异黄酮量升高,排泄物中脂质含量显著增加。这些结果说明木糖醇可能通过肠道微生物或肠道代谢活动影响大豆苷元的代谢[17]。木糖醇和山梨糖通过体外粪浆发酵可以显著促进丁酸盐的产生,可能与Anaerostipes hadrus 或者 Anaerostipes caccae 这2种菌代谢相关的微生物丰度升高有关,在人体结肠中有12种典型的丁酸盐产生菌,只有以上2种菌产生的丁酸盐来自于山梨糖和木糖醇,但是进一步研究发现A.hadrus DSM 3319体外纯培养并不能利用木糖醇[18]。还有一些研究发现木糖醇可以增加小鼠中肠道微生物有益微生物的生长,如双歧杆菌和乳杆菌。
此外木糖醇对许多致病菌都有抑制作用,如对口腔中的变形链球菌,可以影响其细胞结构、降低细胞膜上脂多糖水平、减少细菌在牙齿上的粘附性从而减少牙齿菌斑,起到预防和治疗龋齿发生的作用[19-20];还可以抑制肺炎链球菌的生长,从而可以预防婴幼儿急性中耳炎的发生[21],FERREIRA等[22]猜测木糖醇通过抑制微生物膜形成,进而通过抗黏附性来抑制微生物的生长。很多研究也证实木糖醇对致病菌生物膜的形成具有抑制作用。
4 研究手段
4.1 体内实验
体内实验通常指通过活的生物体测试各种物质对生物实体的整体影响,而不是一个部分或死亡的生物体。因此,动物试验和临床试验是体内研究的主要内容。体内实验通常以动物或人为实验对象。动物实验通常采用小鼠为模型。目前,小鼠模型仍然是绝大多数微生物组学方面研究的首选。通过在饲料中添加不同剂量的木糖醇饲喂实验用小鼠,收集小鼠的粪便和盲肠,测定肠道菌群变化。小鼠实验可以初步探究肠道微生物组成、短链脂肪酸、微生物代谢及小鼠生理健康的有何变化。魏涛等[23]以1月龄雄性小鼠为实验对象,采取灌胃法,每日灌胃一定剂量,研究木糖醇调节胃肠道菌群的作用。UEBANSO等[15]采用成对喂食法控制小鼠木糖醇的摄取量。木糖醇浓度根据日摄水量和体重计算,每1~2 d调整1次饮用水中木糖醇的浓度,以调节木糖醇的消耗。探究了摄入低剂量或中等剂量木糖醇对小鼠的肠道菌群及脂质代谢的影响。但目前仍无通过给予肠道微生物移植小鼠模型以木糖醇的相关实验来研究木糖醇在微生物与相关疾病因果关系中的作用。
但小鼠与人的肠道微生物组成存在明显不同,无法很好地将小鼠模型的实验结果推论至人体。通过健康志愿者摄入木糖醇的人体体内实验能够相对更准确的评估木糖醇对人体肠道微生物的组成、代谢影响。SALMINEN等[24]研究了健康人志愿者中木糖醇对粪便微生物菌群数量和质量的影响。没有接触过膳食中的木糖醇补充剂的健康志愿者在禁食一夜后口服木糖醇溶液,采集粪便样本进行检测。探究了木糖醇对人粪便微生物的影响。然而,因为受试者的个体差异、饮食习惯等因素的差异,试验结果会产生一定的误差。
体内实验存在着伦理限制、在肠道不同区域取样、试验周期长等种种困难,且体内研究主要依靠终点数据,通常来自粪便样本,这意味着沿胃肠道动态监测肠道微生物群是难以实现的,因此很难确定特定干预措施在何处发挥作用。但体内实验通常比体外实验更适合观察活体实验的整体效果,能够更好地反映木糖醇对肠道菌群的影响。
4.2 体外实验
体外实验是指在体外使用从其通常的生物学环境中分离的生物体组分进行研究。体外肠道模型就是一种用来探究人体肠道菌群在疾病状态、饮食干预和药物治疗后的生长和代谢变化的体外实验模型。
体外肠道模型系统提供了一种快速、简单、经济的方法来研究一个或多个肠段,或沿着整个胃肠道的肠道微生物群。体外静态发酵模型和体外动态连续培养系统是2种常用的体外发酵模型。体外静态发酵模型受营养物质和细菌代谢产物的限制,不能反映整个肠道菌群。体外动态连续发酵模型可以模拟结肠的单个区域或整个结肠,其稳定的控制状态与人体肠道类似。SATO等[8]在体外人粪便培养物中研究木糖醇和山梨糖对肠道菌群的影响。胥媛媛等[25]通过单相连续发酵模型培养人粪便菌群,来模拟分析木糖醇补充下微生物群及其代谢产物的变化。MAKELAINEN等[16]则通过4个顺序连接的玻璃容器(分别代表升结肠、横结肠、降结肠、直肠末端)组成半连续厌氧培养系统来更精确地模拟人体结肠,以评估候选益生元菊葡萄糖和木糖醇的有益特征,并为其益生元特性提供证据。总体而言目前通过体外实验模拟木糖醇对人体的益生功能及其机制的研究成果较少,有待体外实验技术的发展来使得相关研究丰富与完善。
体外实验相比体内实验利用整个生物体进行实验,实现了更简单,更方便和更详细的分析且摆脱了体内实验的伦理道德限制。体外实验工作简化了正在研究的系统,因此研究者可以专注于少数组件的研究,来探索基本生物学功能。相比人体和小鼠实验体外肠道模型能够监测微生物群的变化,根据微生物数量和代谢活动,归因于特定疾病、底物或抑制物。正如在整个动物的研究逐渐取代人类实验,体外实验也正逐渐取代对整个动物的研究。但所有的体外肠道模型都有其局限性,主要与生理相关性降低有关。这样的系统也并不总是提供体内发生的准确模型,因为它们缺乏上皮黏膜、宿主免疫相互作用和神经内分泌系统功能[26]。从体外实验的结果外推到完整生物体的生物学也具有一定挑战性。进行体外实验的研究者必须小心避免对其结果的过度解释,否则可能导致关于有机体和系统生物学的错误结论。
5 研究的发展方向意义
根据近些年来对木糖醇的各类研究可知,其具有利于牙齿健康、减少脂肪累积、促进骨骼健康、提高机体免疫力等功能。故木糖醇作为功能性甜味剂,被广泛应用在各种食品中,是糖尿病患者、肥胖患者的优良食糖替代品。然而饮食中大部分被人体摄入的木糖醇是由肠道微生物消化的。木糖醇具有如膳食纤维、多糖等益生元一样,可被微生物选择性利用,产生有益于人体代谢物的益生功能。现有的木糖醇对肠道微生物的研究显示木糖醇对肠道菌群的调节及人类的健康具有有利的影响,尤其对于治疗和预防某些疾病起到辅助的作用,但对其深入的益生作用机理及作用效果研究缺乏。所以目前关于木糖醇研究的关键是通过现代生物学技术手段探讨木糖醇的益生作用、作用位点和作用方式。对其益生机制的研究,挖掘它更多的益生效应,有利于进一步拓宽其应用空间,充分发挥其巨大潜力。
[1] SILVA S S D,CHANDEL A K.D-Xylitol[M].Berlin:Springer,2012.
[2] GREMBECKA M.Sugar alcohols—their role in the modern world of sweeteners:A review[J].European Food Research and Technology,2015,241:1-14.
[3] MAKINEN K K.Sugar alcohol sweeteners as alternatives to sugar with special consideration of xylitol[J].Medical Principles and Practice:International Journal of the Kuwait University,Health Science Centre,2011,20:303-320.
[4] 王成福. 功能糖醇的发展趋势[C].中国食品添加剂和配料协会甜味剂专业委员会2009年行业年会论文集,2009:1-4.
WANG CF.The development of functional sugar alcohols[C].Proceedings of the 2009 Industry Annual Conference of the Sweetener Professional Committee of China Food Additives and Ingredients Association,2009:1-4.
[5] 马永娇. 甜蜜的“秘密”:功能糖发展与应用[J].食品安全导刊,2008(6):60-61.
MA YJ.The secret of honey:The development and application of functional sugar[J].China Food Safety Magazine,2008(6):60-61.
[6] 周昕.木糖醇的体内过程及临床应用[J].山东医药工业杂志,2002,21(4):29-30.
ZHOU X.The in vivo process and clinical application of xylitol[J].Shandong Pharmaceutical Industry,2002,21(4):29-30.
[7] 尤新. 木糖醇及其代谢[J].中国食品添加剂,1994(4):1-7.
YOU X.Xylitol and its metabolism[J].China Food Additives,1994(4):1-7.
[8] KANEHISA M,GOTO S.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research,2000,28:27-30.
[9] MACFADYEN L P,DOROCICZ I R,REIZER J,et al.Regulation of competence development and sugar utilization in Haemophilus influenzae Rd by a phosphoenolpyruvate:Fructose phosphotransferase system[J].Molecular Microbiology,2010,21:941-952.
[10] SALER M H,REIZER J.The bacterial phosphotransferase system:New frontiers 30 years later[J].Molecular Microbiology,1994,13(5):755-764.
[11] KENTACHE T,MILOHANIC E,CAO T N,et al.Transport and catabolism of pentitols by Listeria monocytogenes[J].Journal of Molecular Microbiology and Biotechnology,2016,26(6):369-380.
[12] BARRATT M J,LEBRILLA C,SHAPIRO H Y,et al.The gut microbiota,food science,and human nutrition:A timely marriage[J].Cell Host&Microbe,2017,22(2):134-141.
[13] VOGT N M,KERBY R L,DILL-MCFARLAND K A,et al.Gut microbiome alterations in Alzheimer’s disease[J].Scientific Reports,2017,7(1):13 537.
[14] THOMSON P,MEDINA D A,ORTUZAR V,et al.Anti-inflammatory effect of microbial consortia during the utilization of dietary polysaccharides[J].Food Research International,2018,109:14-23.
[15] UEBANSO T,KANO S,YOSHIMOTO A,et al.Effects of consuming xylitol on gut microbiota and lipid metabolism in mice[J].Nutrients,2017,9(7):756-767.
[16] MAKELAINEN H S,MAKIVUOKKO H A,SALMINEN S J,et al.The effects of polydextrose and xylitol on microbial community and activity in a 4-stage colon simulator[J].Journal of Food Science,2007,72:M153-M159.
[17] TAMURA M,HOSHI C,HORI S.Xylitol affects the intestinal microbiota and metabolism of daidzein in adult male mice[J].International Journal of Molecular Sciences,2013,14(12):23 993-24 007.
[18] SATO T,KUSUHARA S,YOKOI W,et al.Prebiotic potential of L-sorbose and xylitol in promoting the growth and metabolic activity of specific butyrate-producing bacteria in human fecal culture[J].FEMS Microbiology Ecology,2017,93(1).DOI:1093/femsec/fiw227.
[19] KONTIOKARI T,UHARI M,KOSKELA M.Effect of xylitol on growth of nasopharyngeal bacteria in vitro[J].Antimicrobe Agents Chemother,1995,39(8):1 820-1 823.
[20] NAYAK P A,NAYAK U A,KHANDELWAL V.The effect of xylitol on dental caries and oral flora[J].Clinical Cosmetic and Investigational Dentology,2014,6:89-94.
[21] UHARI M,KONTIOKARI T,NIEMELA M.A novel use of xylitol sugar in preventing acute otitis media[J].Pediatrics,1998,102:879-884.
[22] FERREIRA A S,SILVA-PAES-LEME A F,RAPOSO N R B,et al.By passing microbial resistance:xylitol controls microorganisms growth by means of its anti-adherence property[J].Current Pharmaceutical Biotechnology,2015,16(1):35-42.
[23] 魏涛,陈文,齐欣,等.木糖醇改善小鼠肠道功能的实验研究[J].食品工业科技,2001,22(5):23-25.
WEI T,CHEN W,QI X,et al.Study on xylitol improving mice’s gastrointestinal functions[J].Science and Technology of Food Industry,2001,22(5):23-25.
[24] SALMINEN S,SALMINEN E,KOIVISTOINEN P,et al.Gut microflora interactions with xylitol in the mouse,rat and man[J].Food&Chemical Toxicology,1985,23:985-990.
[25] XU Y Y,CHEN Y,XIANG S S,et al.Effect of xylitol on gut microbiota in an in vitro colonic simulation[J].Turk Biyokimya Dergisi/Turkish Journal of Biochemistry,2019,44(5):646-653.
[26] WILLIAMS C F,WALTON G E,JIANG L,et al.Comparative analysis of intestinal tract models[J].Annual Review Food Science Technology,2015,6(1):329-350.