谷氨酸脱羧酶(glutamate decarboxylase,GAD)是生物合成γ-氨基丁酸 (γ-aminobutyric acid,GABA)和拆分手性DL-谷氨酸(DL-glutamic acid,DL-Glu)的重要工业用酶[1-3]。已有研究表明,屎肠球菌(Enterococcus faecium)具有很强GAD活性,具有良好的应用前景[3-6]。然而,天然酶的纯化非常困难,如唾液链球菌嗜热亚种(Streptococcus salivarius ssp. thermophilus) GAD需要经过硫酸铵分级沉淀、等电点沉淀、DEAE-Sephadex A-50离子交换层析、HiPrep16/10 Phenyl FF疏水层析和Sephadex G-100凝胶层析等5步纯化才能达到电泳纯[7]。因此,研发快捷、低成本、高效、绿色的新型纯化技术,对纯酶制剂的生产具有重要意义。
纤维素结合域(cellulose-binding domain,CBD)是大多数纤维素降解酶的重要结构域之一,负责酶的识别和与底物的结合[8-10]。CBD利用能与纤维素发生特异结合的特性,已成为一种新型亲和标签,用于融合蛋白的纯化或固定化[11-13]。内含肽(intein)是类似内含子的一段多肽,蛋白质翻译后可通过内含肽自催化N-或C-末端剪切作用而实现与前体蛋白分离[14],已成功作为蛋白质连接的蛋白质构建块用于蛋白质的纯化[15-16]。如能综合CBD和内含肽的特性,在CBD和GAD之间插入内含肽,通过适宜的不溶性载体对CBD融合特异亲和吸附将融合酶与杂蛋白分离,再通过内含肽的自剪切作用使GAD脱离,即可在不使用蛋白酶的情况下制备出GAD纯酶。这一策略的实现将依赖于3个主要条件:① 纤维素结合域-内含肽-谷氨酸脱羧酶(CBD-intein-GAD)能否高效表达,这是获取优质酶源的关键和基础;② 载体对CBD是否具有较强特异性吸附,特异性不高则可能存在杂蛋白吸附,吸附力不强则可能在自剪切过程中出现CBD-intein-GAD与载体脱吸附,都会造成GAD不纯;③ 自剪切条件是否适宜,会直接影响GAD能否与载体-CBD-intein有效分离,与GAD纯度和产量密切相关。
本实验主要以来源于热纤维梭菌(Clostridium thermocellum)的家族3的CBD、集胞藻(Synechocystis sp.PCC6803)的内含肽DnaB和屎肠球菌GAD核苷酸序列,对融合酶CBD-DnaB-GAD的构建、GAD纯化及其酶学性质进行探讨,以期为GAD纯酶制剂的生产提供应用和理论依据。
1 材料与方法
1.1 材料与试剂
Escherichia coli DH5α用于融合酶的表达,由林谦博士提供。E.coli GDMCC60446为本实验构建的重组菌株,可高效表达融合酶CBD-DnaB-GAD,保藏于广东省微生物菌种保藏中心。
TransStart Fast Pfu DNA聚合酶,全式金生物技术公司;DNA胶回收试剂盒和细菌基因组提取试剂盒,康为世纪生物技术公司;Taq DNA聚合酶、pMD19 Simple T载体和In-fusion HD 基因克隆试剂盒,大连宝生物工程公司。GABA(质量分数≥99%)和5′-磷酸吡哆醛(pyridoxal 5′-phosphate,PLP),美国Sigma-Aldrich公司;氨苄青霉素(Ampicillin,Amp, 钠盐,美国药典级)和层析柱(60 mL,26.2 mm×134 mm),生工生物工程(上海)有限公司;超滤离心管(截留分子质量2 kDa),德国Sartorius集团;其他试剂为市售生化试剂、色谱纯或分析纯试剂。
pRPOCDN为自行构建的E.coli质粒,主要在pUC57质粒中插入了胁迫诱导型启动子PrpoS、CBD编码序列cbm3、内含肽DnaB编码序列dnaB和T7终止子序列。gadB基因为课题组前期研究以E.faecium GDMCC60203基因组DNA为模板,通过PCR扩增和纯化自行制备,大小为1 401 bp[17]。所用引物均委托生工生物工程(上海)股份有限公司合成。
Luria-Bertani(LB)培养基参照文献[18]配制。培养E.coli GDMCC60446的LB培养基含100 μg/mL Amp。
再生无定形纤维素(regenerated amorphous cellulose,RAC) 按照文献[19]的方法制备。
1.2 仪器与设备
1200 Series高效液相色谱仪,美国安捷伦公司;Auw120电子分析天平,日本岛津公司;HZQ-F100恒温振荡培养箱,金坛市精达仪器制造有限公司;TGL16M台式高速冷冻离心机,盐城市凯特实验仪器有限公司。
1.3 实验方法
1.3.1 E.coli DH5α和E.coli GDMCC60446培养
参照文献[17]进行培养。菌株 DH5α采用不含Amp的LB液体培养基进行培养,GDMCC60446重组菌株则以含Amp的LB液体培养基进行培养。
1.3.2 GAD酶活力测定
除特别说明外,GAD酶活力测定条件为:0.5 mL GAD酶液与1.5 mL 0.25 mol/L L-Glu溶液(pH 5.0,溶于0.2 mol/L乙酸-乙酸钠缓冲液,含0.2 mmol/L PLP)混合,40 ℃水浴反应1 h,加入4 mL无水乙醇,混匀、终止反应,8 500 r/min离心15 min,取上清液测定GABA含量。酶活力单位定义:测定条件下1 h生成1 μmol GABA所需要的酶量为1个酶活力单位(U)。除设置了对照组的实验以对照组平均GAD酶活力为100%外,其余均以酶活力最高的实验组平均GAD酶活力为100%计算相对酶活力(%)。
1.3.3 GABA分析
GABA参照文献[17]采用高效液相色谱进行分析。
1.3.4 CBD-DnaB-GAD重组E.coli的构建
1.3.4.1 表达载体及重组菌的构建
以5′-GCGGCCGCCCATGGCTCTTCCG-3′和5′-GAATTCCTCGAGGGCTCTTCCAG-3′为引物,以pRPOCDN作为模板,通过PCR扩增制备含有内含肽编码序列dnaB的4.2 kb线性化载体,电泳切胶,回收纯化线性化载体,与gadB进行组装,构建pRPOCDN-EfagadB重组质粒。PCR扩增和拼接组装参照文献[17]进行。以pRPOCDN-EfagadB转化感受态E.coli DH5α细胞。提取单菌落的质粒并经BamH I、EcoR I双酶切后进行电泳检测,已转化了pRPOCDN-EfagadB的菌株即为重组E.coli GDMCC60446。
1.3.4.2 CBD-DnaB-GAD的表达
将重组菌株GDMCC60446培养液于4 ℃、8 500 r/min 离心15 min,收集菌体。将湿菌体与生理盐水按1∶20(g∶mL)混合,搅拌分散洗涤菌体,再次离心收集菌体,然后将湿菌体与Tris-HCl 缓冲液(50 mmol/L,pH 8.0)按1∶15(g∶mL)混合,冰浴中超声波破碎细胞(400 W,工作5 s,冷却5 s,全程50 min),离心收集上清液即为CBD-DnaB-GAD粗酶液。将15 mL粗酶液与 0.9 g(湿质量)RAC混合,30 ℃、50 r/min振荡10 min,转入小层析柱,蠕动泵抽滤去除液体,固体基质即为RAC-CBD-DnaB-GAD。在小层析柱中,以40 mL 50 mmol/L Tris-HCl缓冲液(pH 8.0)分4次洗涤RAC-CBD-DnaB-GAD,蠕动泵抽滤去除洗涤液。取已洗涤的0.2 g RAC-CBD-DnaB-GAD,加入10 mL 0.25 mol/L L-Glu溶液(pH 5.0,溶于0.2 mol/L乙酸-乙酸钠缓冲液,含0.2 mmol/L PLP),混合,40 ℃水浴反应1 h,按体积比为1∶2的比例将反应液与无水乙醇混合终止反应, 8 500 r/min离心15 min,取上清液分析转化产物GABA。
1.3.5 GAD纯酶制备
分别以均含0.5 mol/L NaCl和1 mmol/L EDTA的pH 6.5 Tris-HCl缓冲液(50 mmol/L,记为A)、pH 6.5磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L,记为B)、pH 5.6乙酸-乙酸钠缓冲液(0.2 mol/L,记为C)作为自剪切液,通过比较剪切制备的酶液的GAD活性评价RAC-CBD-DnaB-GAD在不同自剪切液中的剪切效果。按照1.3.4.2小节的方法制备和洗涤RAC-CBD-DnaB-GAD,然后分别在层析柱中加入30 mL自剪切液浸泡RAC-CBD-DnaB-GAD,30 ℃保温12 h,蠕动泵抽滤,将滤出液用超滤离心管于3 000 r/min进行超滤,当管内剩余约1 mL液时加入5 mL 50 mmol/L EDTA醋酸-醋酸钠溶液(含0.2 mmol/L PLP),再次离心,如此重复超滤5次,然后用醋酸-醋酸钠溶液定容至10 mL,即为GAD纯酶液。
GAD纯度和分子质量采用SDS-PAGE电泳进行分析,浓缩胶质量分数为5%浓度,分离胶质量分数为8%,胶厚1.0 mm。蛋白质浓度按照试剂盒说明书采用Bradford法测定。分子质量根据标准蛋白质和GAD的SDS-PAGE电泳迁移率进行计算,并结合由gadB序列推算的理论分子质量判断GAD的亚基组成。
1.3.6 GAD酶学性质研究
1.3.6.1 pH对GAD的影响
pH对GAD反应活性的影响:分别以pH 4.0~5.8(梯度0.2)的0.25 mol/L L-Glu溶液(溶于0.2 mol/L乙酸-乙酸钠缓冲液,含0.2 mmol/L PLP)作为底物进行酶活力测定。pH对GAD稳定性的影响:先将GAD酶液通过离心超滤将原酶液的溶剂(乙酸-乙酸钠缓冲液)替换为含0.2 mmol/L PLP的生理盐水,再分别与pH 3.6~5.8 (梯度0.4)的50 mmol/L乙酸-乙酸钠缓冲液或0.2 mmol/L PLP的生理盐水按1∶1混合作为酶液;将pH 3.6~5.8组各酶液于40 ℃保温5 h,分别测定处理后的GAD酶液的残余酶活力,以4 ℃保存的生理盐水组酶液为对照。
1.3.6.2 温度对GAD的影响
温度对GAD反应活性的影响:分别在40~70 ℃(梯度5 ℃)下测定GAD酶活力。温度对GAD稳定性的影响:先将GAD酶液分别于-25、-20、-7、4、40、50、60和70 ℃ 保温3 h,室温静置1 h,然后再分别测定已恢复至室温的GAD酶液残余酶活力,以4 ℃处理组为对照。
1.3.6.3 化学试剂对GAD活性的影响
在GAD酶活力测定的反应体系中分别加入50 μL 0.2 mol/L 的ZnSO4、CuSO4、MnSO4、MgSO4、NaCl、KCl、CaCl2、FeCl2、FeCl3、AlCl3、Pb(CH3COO)2、AgNO3、EDTA-2 Na、乙二醇(ethylene glycol,EG)溶液,快速混匀,即各化合物的终浓度为5 mmol/L。以加蒸馏水50 μL作为对照。55 ℃水浴反应1 h。
1.3.6.4 GAD底物特异性
分别以溶于0.2 mol/L乙酸-乙酸钠缓冲液的0.25 mol/L L-Glu、D-Glu和L-Asp溶液(pH 5.0,均含0.2 mmol/L PLP)作为GAD底物,参照文献[17]于55 ℃测定GAD底物特异性。以121 ℃灭活10 min的GAD酶液作为对照。
1.3.6.5 GAD动力学常数
参照文献[17]分别以pH 5.0的不同浓度的 L-Glu溶液(溶于0.2 mol/L乙酸-乙酸钠缓冲液,含0.2 mmol/L PLP)作为底物于55 ℃反应5 min进行GAD酶活力测定,并计算GAD的Km 和 Vmax。
1.3.6.6 GABA对GAD活性的影响
以分别含0.1、0.2 mol/L GABA的0.25 mol/L L-Glu溶液作为底物于55 ℃水浴反应1 h,以新增GABA的量计算GAD酶活力。以不添加GABA的0.25 mol/L L-Glu溶液按同样操作作为对照。
1.4 数据分析
利用IBM SPSS Statistics 19.0软件采用单因素方差分析(ANOVA)的Duncan法进行统计分析。图表中不同的英文字母表示两组间差异显著(P<0.05)。
2 结果与分析
2.1 CBD-DnaB-GAD重组E.coli的构建
2.1.1 表达载体及重组菌的构建
经PCR扩增得到含有内含肽编码序列dnaB的4.2 kb线状载体骨架,将该线状载体骨架与gadB基因拼接后,得到pRPOCDN-EfagadB重组质粒(图1),该重组质粒全长为5 652 bp,包含了胁迫诱导型启动子PrpoS(743 bp)、CBD编码序列cbm3(480 bp)、DnaB编码序列dnaB(522 bp)和屎肠球菌GAD基因gadB(1401 bp)。经用BamH I和EcoR I双酶切,酶切产物电泳结果与pRPOCDN-EfagadB重组质粒的核苷酸序列理论推断(理论应得到3 723和1 929 bp两个片段)一致,说明pRPOCDN-EfagadB重组质粒成功构建。将pRPOCDN-EfagadB转化E.coli DH5α,获得携带CBD-DnaB-GAD表达载体的重组菌株E.coli GDMCC60446。
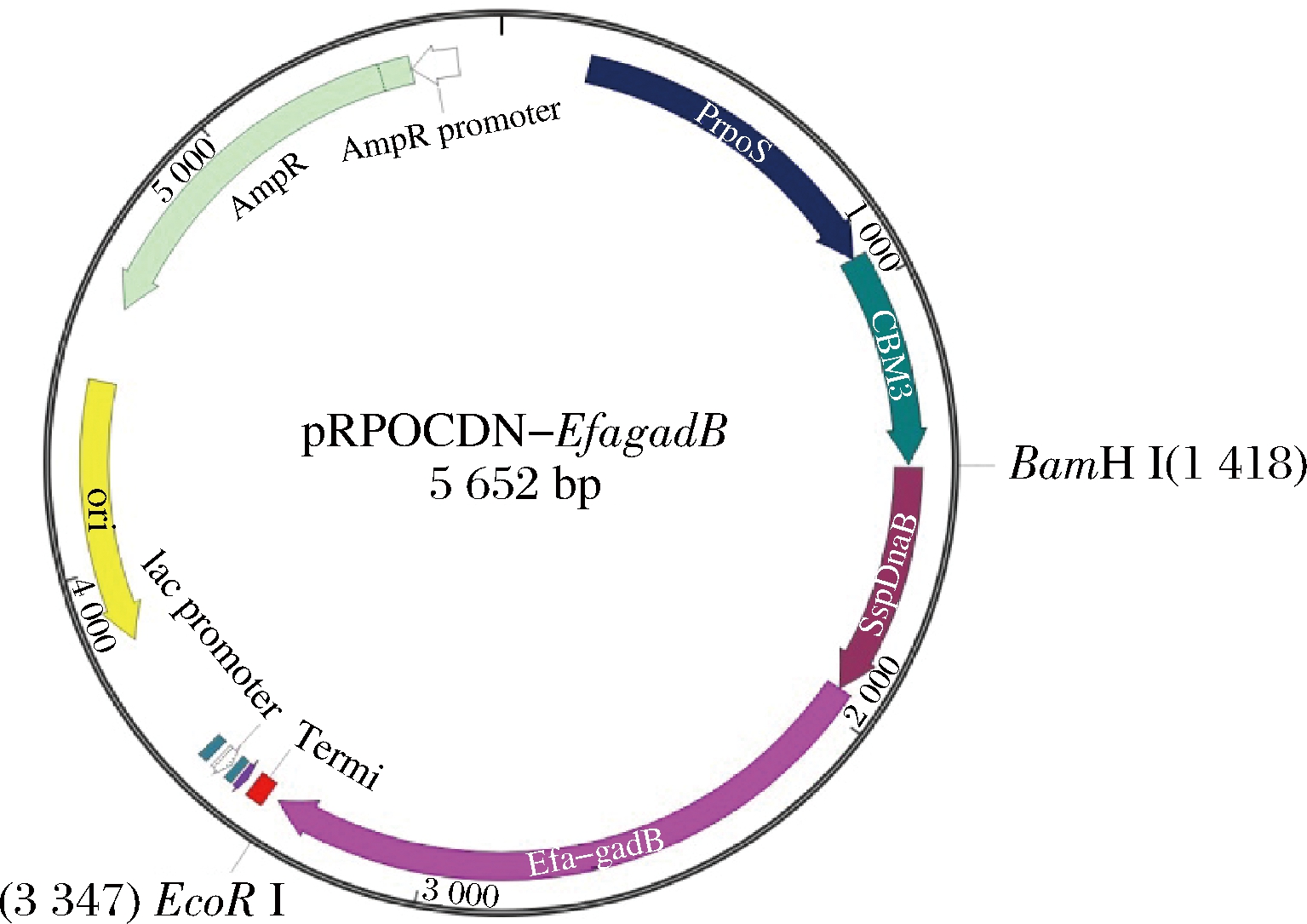
PrpoS-胁迫诱导型启动子,包含E.coli中 5′-非翻译区;cbm3-来自
Clostridium thermocellum家族3纤维素结合域的编码序列;
dnaB-来自Synechocystis sp.PCC6803的内含肽DnaB的
编码序列;gadB-来自E.faecium GAD的基因
图1 pRPOCDN-EfagadB示意图
Fig.1 Diagram of pRPOCDN-EfagadB
2.1.2 CBD-DnaB-GAD的表达
因E.coli自身基因组也可表达GAD[20],同时通过DnaB自剪切分离的GAD也可能会因发生高级结构的重折叠而失活,因此为了避免E.coli 自身GAD的干扰,精确反映是否成功表达具GAD活性的CBD-DnaB-GAD,故通过直接测定经RAC吸附分离后的RAC-CBD-DnaB-GAD的GAD酶活力反映CBD-DnaB-GAD的表达情况。经HPLC分析,转化液GABA浓度为(87.69±4.46) mmol/L。结果表明重组菌株GDMCC60446可表达具GAD酶活力的CBD-DnaB-GAD。
2.2 GAD纯酶的制备
通过RAC与CBD亲和吸附特性仅可实现将CBD-DnaB-GAD从粗酶液中分离出来,尚需进一步通过DnaB自剪切作用才能获得GAD。经对RAC-CBD-DnaB-GAD在不同剪切液中的自剪切效率进行探讨,结果如图2所示,在0.2 mol/L磷酸氢二钠-磷酸二氢钠缓冲液中自剪切效率最高,获得的酶液GAD活性最强。SDS-PAGE电泳结果(图3)表明GAD酶液为单一条带,说明制备获得的GAD达到电泳纯。根据SDS-PAGE电泳的相对迁移距离可求得GAD的分子质量为55.68 kDa,与由gadB核苷酸序列推算的GAD理论分子质量53.71 kDa基本相符,确认切割分离出了GAD,并表明GAD只由1个亚基组成。
剪切液是影响内含肽发生自剪切作用的重要因素,含NaCl和EDTA的Tris-HCl缓冲液常被用作内含肽DnaB的剪切液[15-16],然而图2显示在pH、NaCl和EDTA同等的条件下,0.2 mol/L磷酸氢二钠-磷酸二氢钠缓冲液的剪切效果显著优于Tris-HCl缓冲液(P<0.05),可能与不同缓冲液的离子强度存在差异有关。
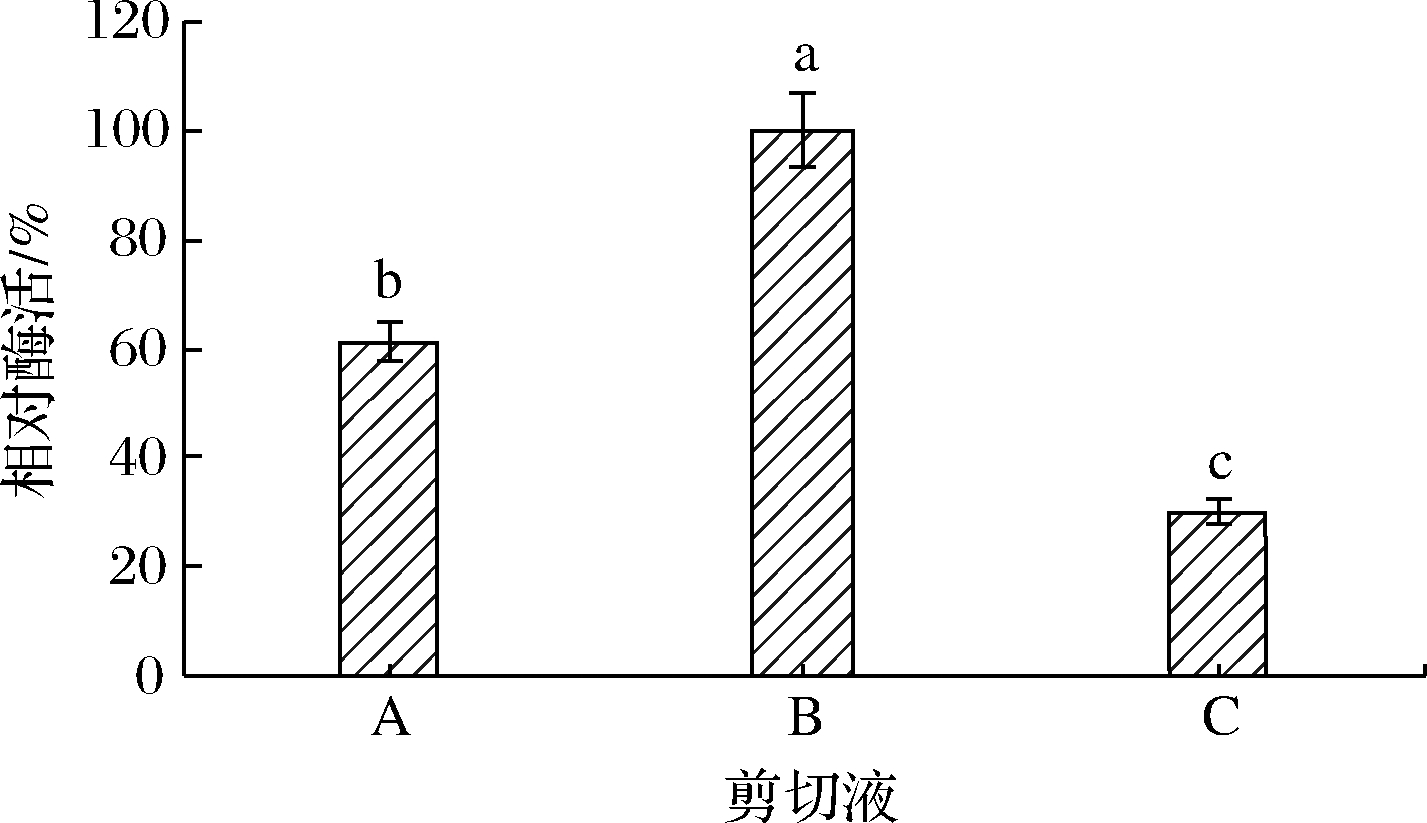
A-50 mmol/L Tris-HCl缓冲液;B-0.2 mol/L磷酸氢二钠-磷酸
二氢钠缓冲液;C-0.2 mol/L乙酸-乙酸钠缓冲液
图2 不同剪切液中RAC-CBD-DnaB-GAD的自剪切效率
Fig.2 Self-cleavage efficiency of RAC-CBD-DnaB-GAD
in different cleavage solutions
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
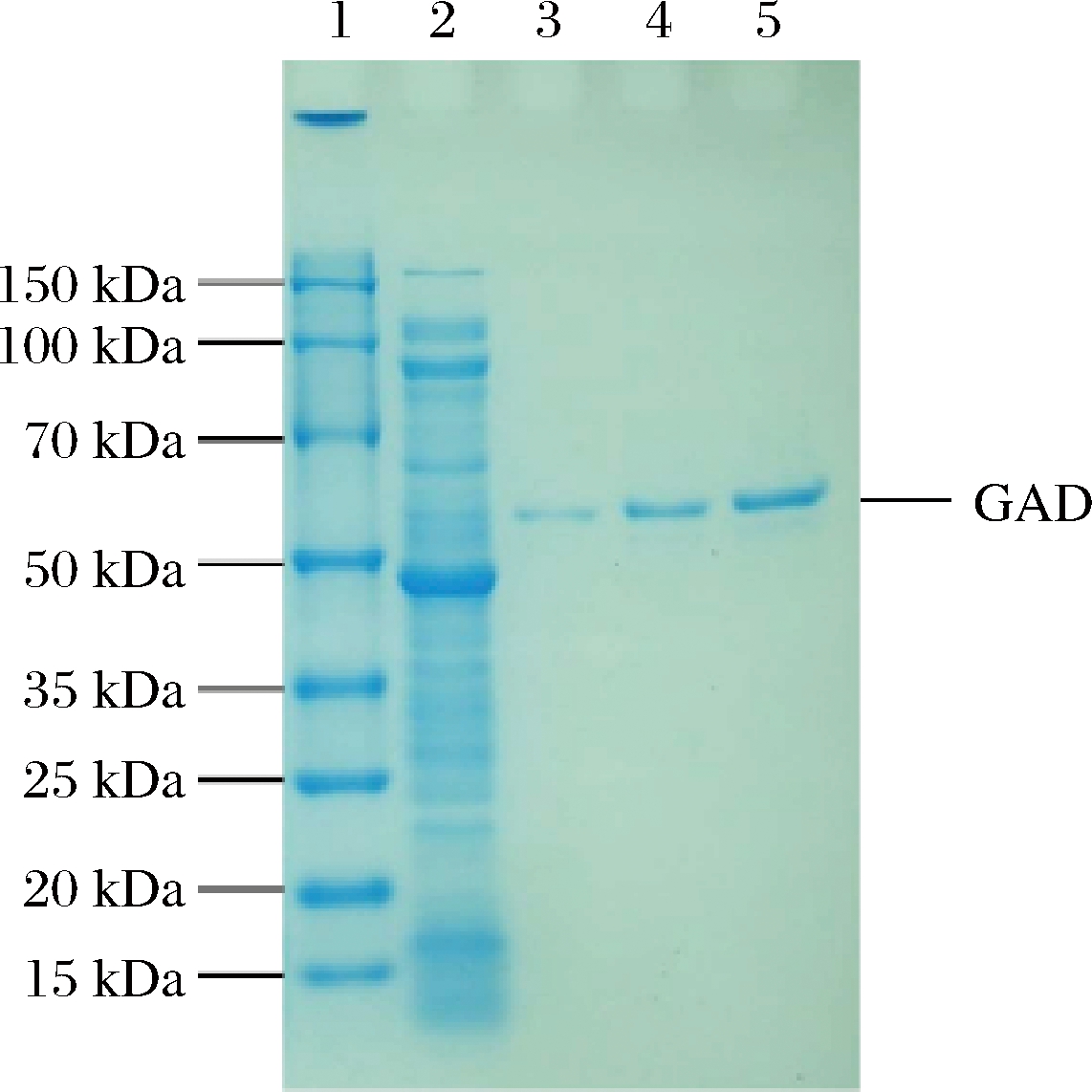
1-蛋白质Marker;2-CBD-DnaB-GAD粗酶液;3,4,5-纯化后GAD酶液
图3 SDS-PAGE电泳图
Fig.3 SDS-PAGE electrophorogram
2.3 GAD纯酶酶学性质
2.3.1 pH对GAD的影响
图4-a显示,当反应pH<5.0,GAD酶活力随pH增加而增强;当反应pH=5.0,GAD酶活力最强;当反应pH>5.0, GAD酶活力随反应pH增加而逐渐下降,但在pH 5.0~5.2,GAD酶活力变化不大,差异不显著(P>0.05)。结果表明,GAD最适反应pH为5.0。图4-b显示,当溶液pH为4.8~5.8时,40 ℃保温5 h仍较稳定,但当pH<4.8,则稳定性显著降低(P<0.05)。pH对GAD反应活性的影响较对CBD-GAD[22]的影响大,但对GAD和CBD-GAD[17]的稳定性影响较为相似,可能与CBD增大了蛋白质的分子量或轻微改变了酶蛋白的结构有关。
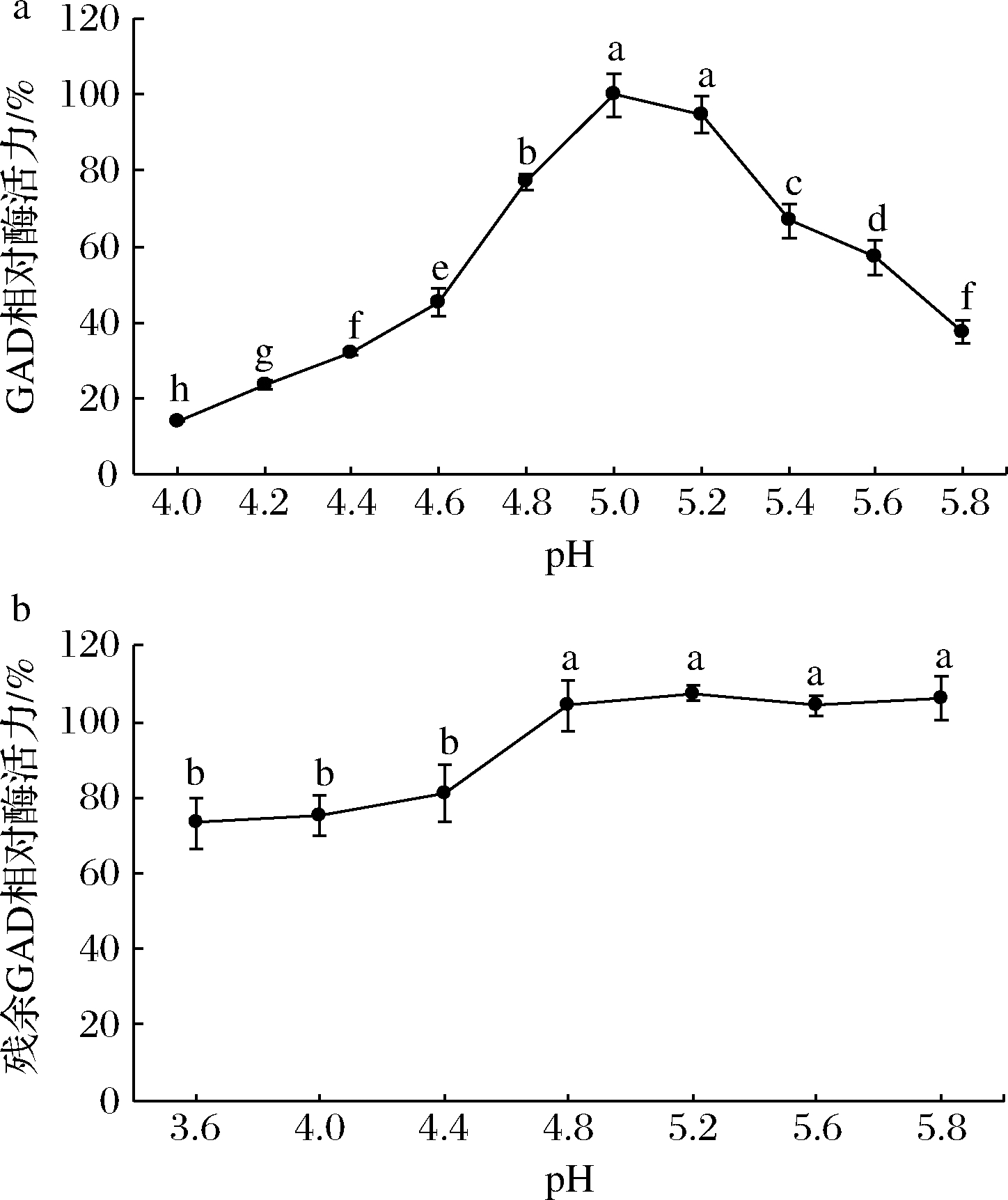
a-GAD反应活性;b-GAD稳定性
图4 pH对GAD反应活性和稳定性的影响
Fig.4 Effect of pH on the catalytic activity and stability of GAD
2.3.2 温度对GAD的影响
图5-a显示, GAD在55~60 ℃可保持95% 以上的酶活力,超出该温度范围,GAD反应活性快速下降。最适反应温度为55 ℃,但在55和60 ℃的GAD酶活力无显著性差异(P>0.05)。由图5-b可见,分别在-25~55 ℃的不同温度保温3 h,GAD残余酶活力与4 ℃处理组无显著性差异(P>0.05),孵育温度升高则GAD残余酶活力快速降低,说明GAD在-25~55 ℃相对较稳定。
文献表明,CBD-GAD的最适反应温度为60 ℃,在4~40 ℃较稳定,冰冻处理(低于-7 ℃)和高于50 ℃处理对CBD-GAD稳定性影响较大[17]。GAD与CBD-GAD对温度的依赖性存在一定差异,可能与CBD增大了蛋白质的分子质量或轻微改变了酶蛋白的结构有关。
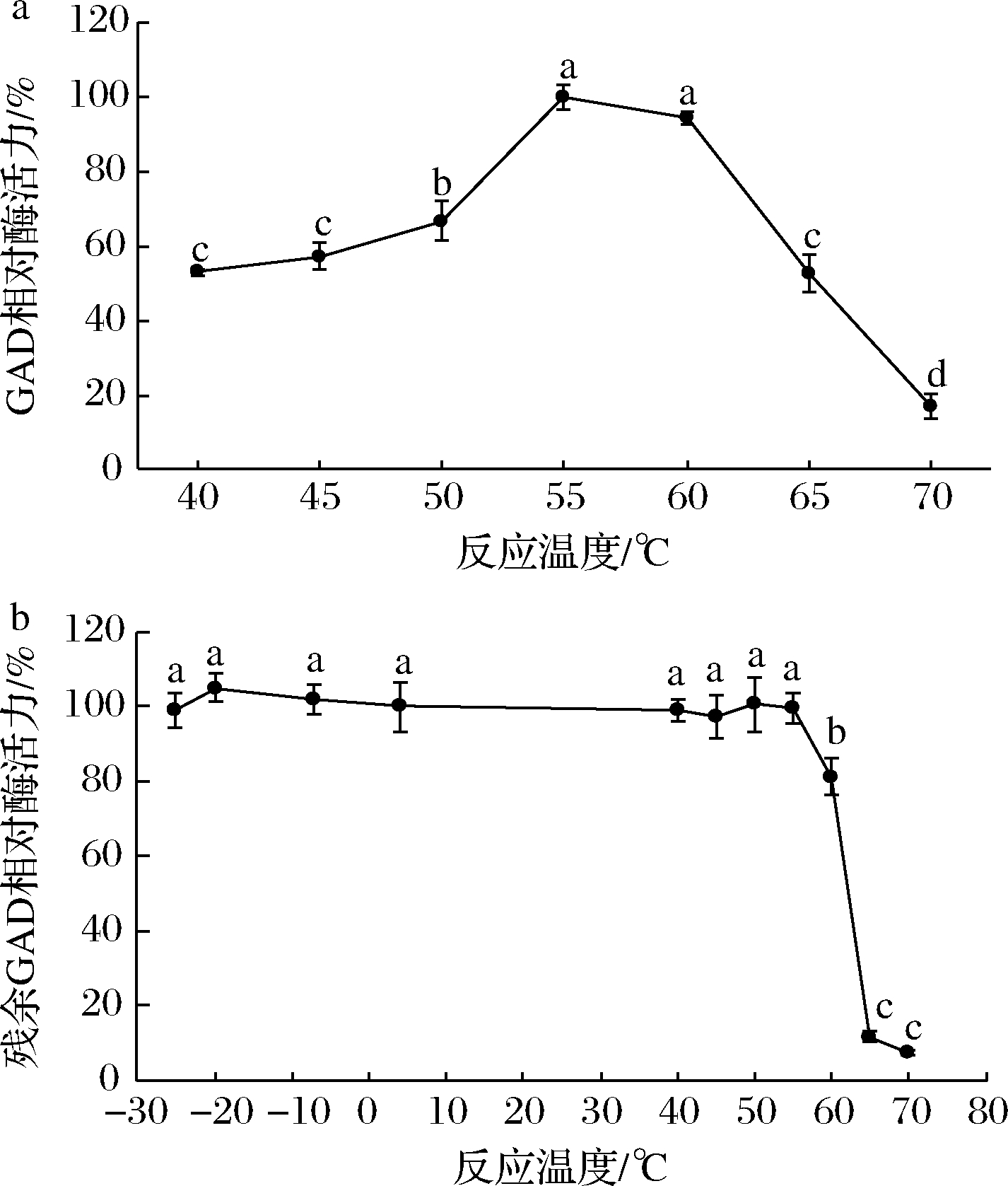
a-GAD反应活性;b-GAD稳定性
图5 温度对GAD反应活性和稳定性的影响
Fig.5 Effect of temperature on the catalytic activity and
stability of GAD
2.3.3 化学试剂对GAD活性的影响
由于酶的结构不同,化学因素对酶的影响是多种多样的。为了阐明化学因素对屎肠球菌GAD的影响,在反应体系中分别添加不同的化学试剂至终浓度为5 mmol/L。如图6所示,NaCl、CaCl2和乙二醇对GAD酶活力影响不大(P>0.05),KCl、EDTA-2Na、ZnSO4、CuSO4、MnSO4、MgSO4、FeCl2、FeCl3、AlCl3、AgNO3和Pb(CH3COO)2对GAD酶活力具有不同程度的抑制作用(P<0.05),其中KCl和EDTA-2Na抑制作用相对较弱,而AgNO3和Pb(CH3COO)2具有强抑制作用,在GAD应用中应避免存在这些化学物。

图6 化学试剂对GAD活力的影响
Fig.6 Effect of chemical reagents on the activity of GAD
反应液中的化学组分是影响酶活力的重要因素之一。文献表明,Ca2+对Lactobacillus fermentum YS2[13]、Lactobacillus brevis 877G[21]、Lactobacillus paracasei NFRI7415[22]和Lactobacillus sakei A156[23]的GAD酶活力具有促进作用,然而对S.salivarius ssp. thermophiles[7]和Bacillus megaterium[24]的GAD没有明显影响。本实验结果表明Ca2+对屎肠球菌GAD酶活力的影响与其对S.salivarius ssp. thermophiles[7]和Bacillus megaterium[24] GAD的影响基本一致。
2.3.4 GAD底物特异性
表1显示,GAD具有很强的底物专一性,仅对L-Glu具有催化活性,对L-Glu的异构体D-Glu和与仅有1个—CH2差异的L-Asp均无催化活性,与CBD-GAD[17]一致,说明CBD未改变GAD的底物特异性。
表1 GAD的底物特异性
Table 1 Substrate specificity of GAD
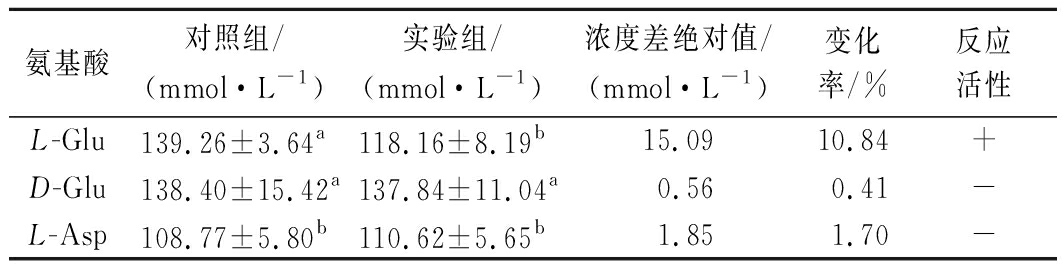
氨基酸对照组/(mmol·L-1)实验组/(mmol·L-1)浓度差绝对值/(mmol·L-1)变化率/%反应活性L-Glu139.26±3.64a118.16±8.19b15.0910.84+D-Glu138.40±15.42a137.84±11.04a0.560.41-L-Asp108.77±5.80b110.62±5.65b1.851.70-
注:底物浓度的平均变化率=|实验组浓度-对照组浓度|÷对照组浓度×100%;根据试验过程存在系统误差,将底物的平均变化率绝对值≤5%判定为阴性(-),变化率绝对值>5%判定为阳性(+)[22]
2.3.5 GAD动力学常数
图7显示,L-Glu浓度低于19.2 mmol/L时,反应呈一级反应;L-Glu浓度在19.2~76.8 mmol/L,反应呈混合级反应;L-Glu浓度高于76.8 mmol/L,反应呈零级反应。结果表明,GAD催化反应没有底物抑制现象,符合Michaelis-Menten的快速平衡学说。通过Lineweaver-Burk作图法进行计算,GAD的Km 和 Vmax 分别为10.51 mmol/L和3.41 μmol/(mL·min)。底物浓度对GAD的影响和GAD动力学常数均与CBD-GAD[17]相似。
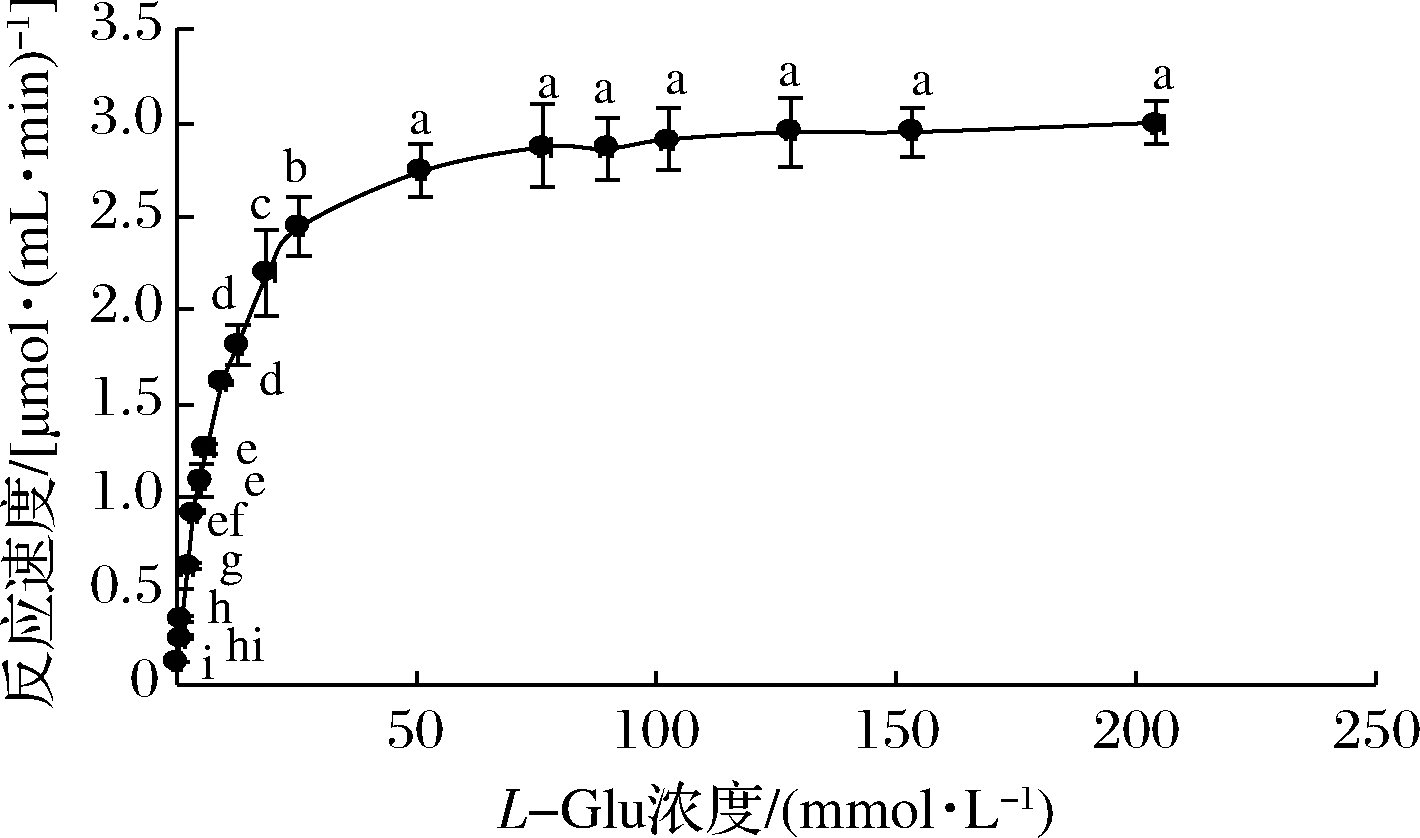
图7 L-Glu浓度对GAD催化反应速度的影响
Fig.7 Effect of L-Glu concentration on the catalytic
reaction rate of GAD
2.3.6 GABA对GAD活性的影响
图8显示,当在初始L-Glu底物溶液中添加 0.1 mol/L 和0.2 mol/L 的GABA时,GAD酶活力与未添加GABA的对照组无显著性差异(P>0.05),说明GABA对GAD催化活性无抑制效应。结果与CBD-GAD[17]一致。
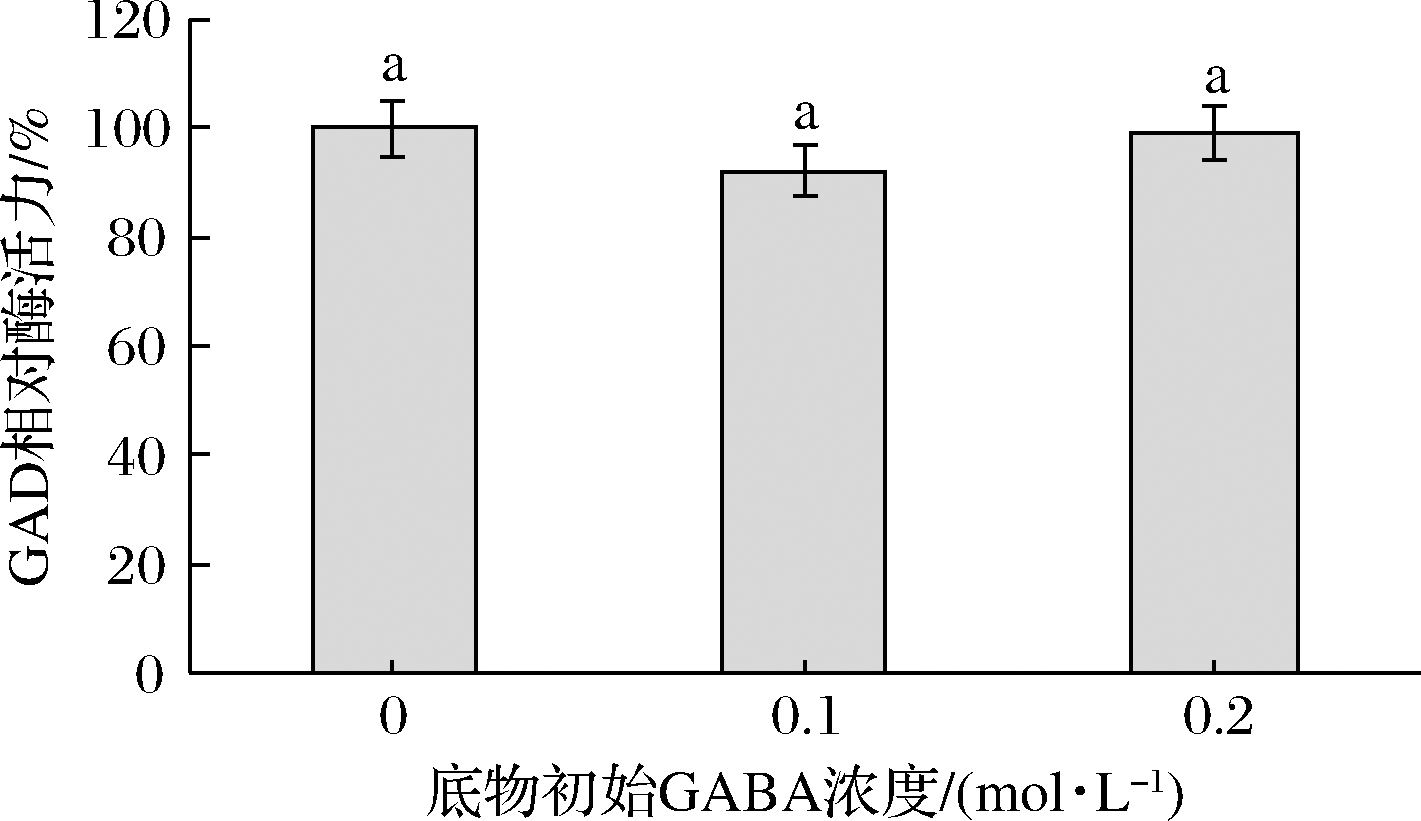
图8 GABA对GAD活性的影响
Fig.8 Effects of GABA on GAD activity
3 结论与讨论
微生物通过GAD催化L-Glu的α-羧基发生脱羧作用生成GABA,提高细胞微环境的pH值,抵抗酸性环境对其生长繁殖的不利影响,这是微生物的耐酸机制之一[25],即野生株GAD在生理上是为了满足抗酸需要,通常表达量不高,远不能满足工业用酶需求,因此通过基因工程技术构建重组菌高效表达GAD将是解决工业用酶的重要途径。同时,GAD是胞内酶,细胞破碎提取液的杂蛋白多,酶的分离纯化困难,也是限制GAD的研究和应用的重要原因。本实验通过以CBD作为亲和标签,并利用内含肽DnaB的自剪切作用,构建和表达融合酶CBD-DnaB-GAD,通过RAC一步纯化即可获得屎肠球菌GAD纯酶,操作简便、成本低。由于通过DnaB自剪切作用,去除了CBD-DnaB序列,可避免CBD和DnaB对GAD酶学性质的影响,GAD性质更接近于天然酶。
[1] VILLEGAS J M,BROWN L,DE GIORI G S,et al.Optimization of batch culture conditions for GABA production by Lactobacillus brevis CRL 1942,isolated from quinoa sourdough[J].LWT-Food Science and Technology,2016,67:22-26.
[2] 杨成丽, 马子玉,胡晓丽,等.化学-酶催化法制备D-谷氨酸与γ-氨基丁酸[J].化学与生物工程,2013,30(11):55-56.
YANG C L,MA Z Y,HU X L,et al.Production of D-glutamic acid and γ-aminobutyric acid using chem-enzymic method[J].Chemistry and Bioengineering,2013,30(11):55-56.
[3] ZHU H,SADIQ F A,LI Y,et al.Application of ion-exchange resin as solid acid for buffer-free production of γ-aminobutyric acid using Enterococcus faecium cells[J].LWT-Food Science and Technology,2018,98:341-348.
[4] 杨胜远,李云.双向单因素与田口法优化屎肠球菌产谷氨酸脱羧酶培养基[J].食品科学,2018,39(4):90-98.
YANG S Y,LI Y.Optimization of fermentation medium for glutamate decarboxylase production by Enterococcus faecium by bidirectional One-Factor-at-a-Time and Taguchi methods[J].Food Science,2018,39(4):90-98.
[5] YANG S Y,LIU S M,JIANG M,et al.Enhancing effect of macroporous adsorption resin on gamma-aminobutyric acid production by Enterococcus faecium in whole-cell biotransformation system[J].Amino Acids,2020,52(5):771-780.
[6] DIVYASHRI G,PRAPULLA S G.An insight into kinetics and thermodynamics of gamma-aminobutyric acid production by Enterococcus faecium CFR3003 IN batch fermentation[J].Annals of Microbiology,2015,65:1 109-1 118.
[7] YANG S Y,LIN Q,LU Z X,et al.Characterization of a novel glutamate decarboxylase from Streptococcus salivarius ssp.thermophilus Y2[J].Journal of Chemical Technology & Biotechnology,2008,83(6):855-861.
[8] CHEN K J,WU Y T,LEE C K.Cellulose binding domain fusion enhanced soluble expression of fructosyl peptide oxidase and its simultaneous purification and immobilization[J].International Journal of Biological Macromolecules,2019,133:980-986.
[9] JONES R W,PEREZ F G.A small cellulose-binding-domain protein (CBM1) in Phytophthora is highly variable in the non-binding amino terminus[J].Current Microbiology,2017,74:1 287-1 293.
[10] MÉNDEZ-L TER J A,GIL-MU
TER J A,GIL-MU OZ J,NIETO-DOM
OZ J,NIETO-DOM NGUEZ M,et al.A novel,highly efficient β-glucosidase with a cellulose-binding domain:characterization and properties of native and recombinant proteins[J].Biotechnology for Biofuels,2017,10:256-271.
NGUEZ M,et al.A novel,highly efficient β-glucosidase with a cellulose-binding domain:characterization and properties of native and recombinant proteins[J].Biotechnology for Biofuels,2017,10:256-271.
[11] BULAKHOV A G,GUSAKOV A V,ROZHKOVA A M,et al.Properties of chimeric polysaccharide monooxygenase with an attached cellulose binding module and its use in the hydrolysis of cellulose-containing materials in the composition of cellulase complexes[J].Catalysis in Industry,2018,10(2):152-158.
[12] RICHINS R D,MULCHANDANI A,CHEN W.Expression,immobilization,and enzymatic characterization of cellulose-binding domain-organophosphorus hydrolase fusion enzymes[J].Biotechnology and Bioengineering,2015,69(6):591-596.
[13] LIN Q,LI D,QIN H.Molecular cloning,expression,and immobilization of glutamate decarboxylase from Lactobacillus fermentum YS2[J].Electronic Journal of Biotechnology,2017,27:8-13
[14] MATHYS S,EVANS T C,CHUTE I C,et al.Characterization of self-splicing mini-intein and its conversion into autocatalytic N-and C-terminal cleavage elements:Facile production of protein building blocks for protein ligation[J].Gene,1999,231(1/2):1-13.
[15] HONG J,WANG Y,YE X,et al.Simple protein purification through affinity adsorption on regenerated amorphous cellulose followed by intein self-cleavage[J].Journal of Chromatography A,2008,1194:150-154.
[16] ZHAO Z L,LU W,DUN B Q,et al.Purification of green fluorescent protein using a two-intein system[J].Applied Microbiology and Biotechnology,2008,77(5):1 175-1 180.
[17] 杨胜远,林谦,赖丽萍,等.屎肠球菌纤维素结合域谷氨酸脱羧酶构建及其酶学性质[J].食品与发酵工业,2019,45(21):22-30.
YANG S Y,LIN Q,LAI L P,et al.Construction and characteristics of recombinant cellulose-binding domain-glutamate decarboxylase of Enterococcus faecium[J].Food and Fermentation Industries,2019,45(21):22-30.
[18] 杨胜远, 林谦,张晓宁,等.大肠杆菌高效表达屎肠球菌纤维素结合域谷氨酸脱羧酶的条件优化[J].食品与机械,2019,35(7):31-38.
YANG S Y,LIN Q,ZHANG X N,et al.Optimization of conditions for efficient expression of recombinant cellulose-binding domain-glutamate decarboxylase of Enterococcus faecium in Escherichia coli[J].Food and Machinery,2019,35(7):31-38.
[19] HONG J,YE X,WANG Y,et al.Bioseparation of recombinant cellulose-binding module-proteins by affinity adsorption on an ultra-high-capacity cellulosic adsorbent[J].Analytica Chimica Acta,2008,621(2):193-199.
[20] STRAUSBAUCH P H,FISCHER E H.Chemical and physical properties of Escherichia coli glutamate decarboxylase[J].Biochemistry,1970,9(2):226-232.
[21] SEO M J,NAM Y D,LEE S Y,et al.Expression and characterization of a glutamate decarboxylase from Lactobacillus brevis 877G producing γ-aminobutyric acid[J].Bioscience,Biotechnology,and Biochemistry,2013,77(4):853-856.
[22] KOMATSUZAKI N,NAKAMURA T,KIMURA T,et al.Characterization of glutamate decarboxylase from a high γ-aminobutyric acid (GABA)-producer,Lactobacillus paracasei[J].Bioscience,Biotechnology,and Biochemistry,2008,72(2):278-285.
[23] SA H D,PARK J Y,JEONG S J,et al.Characterization of glutamate decarboxylase (GAD) from Lactobacillus sakei A156 isolated from Jeot-gal[J].Journal of Microbiology & Biotechnology,2015,25(5):696-703.
[24] LIU Q,CHENG H,MA X,et al.Expression,characterization and mutagenesis of a novel glutamate decarboxylase from Bacillus megaterium[J].Biotechnology Letters,2016,38:1 107-1 113.
[25] DE BIASE D,TRAMONTI A,BOSSA F,et al.The response to stationary-phase stress conditions in Escherichia coli:Role and regulation of the glutamic acid decarboxylase system[J].Molecular Microbiology,1999,32(6):1 198-1 211.