蛋白质与多肽由可修饰的生物分子构成,能与其他结构单元相互自组装成为超分子结构,这种物理化学现象可通过配位键、离子键、亲水作用、疏水作用、静电作用、π-π堆积等作用实现[1]。矿质离子螯合肽是一类可通过配位键与矿质离子自发组织或聚集为稳定结构的一类肽[2],矿质离子不仅影响肽的空间结构,还与生物大分子识别、自组装、生物功能等特征有密切关系。
钙、铁、锌、硒、铜、铬等矿质元素对人体生长、发育、繁殖等必不可少,密切关系着机体健康。钙是人体必需元素,占体重1.5%~2.0%,对骨代谢、神经传递、肌肉收缩和凝血等功能至关重要[3];铬离子可协同葡萄糖耐受因子和增强胰岛素作用从而影响糖类、蛋白质、脂类核酸代谢[4];铁离子是实现和维持血红蛋白适当水平的重要底物[5];锌是大量酶的催化组分,在许多肽、蛋白质、细胞因子及激素中有生物学及构效作用[6];硒有抗癌、抗氧化、抗病毒、增强免疫和预防心血管疾病等方面的潜能,被誉为“生命的火种”[7]。传统的无机矿质元素补充剂和有机矿质补充剂存在刺激胃肠道、吸收率低等缺点。肽-矿质离子螯合物因其特有的组装模式和吸收机制,在机体中可持续解离,具有易吸收、安全无毒、稳定性好等优点[8]。近年研究表明,肽-矿质离子螯合物还具有抗氧化、抑菌、降血糖、免疫调节和保护肝脏等功能。因此,肽-矿质离子螯合物的应用涉及食品保健、医药、农业、畜牧业、抗菌添加等方面,具有巨大发展潜力。
1 多肽-矿质离子螯合物的来源及制备与生理活性
1.1 多肽-矿质离子螯合物的来源及制备
肽-矿质离子螯合物可从3个方面制备:人工制备的矿质离子螯合肽与各类矿质离子组装;天然蛋白质酶解获得的具有螯合能力的多肽与各类矿质离子组装;从动植物中直接提取天然肽-矿质离子螯合物[2]。富硒水稻就是硒直接与植物中多糖或蛋白质结合用于补充人体硒。BOYLE等[9]将组氨酸残基引入卷曲螺旋三聚体的疏水核心设计出一种肽,会在加入矿质离子时自组装。天然蛋白质酶解获得矿质离子螯合多肽与各类矿质离子配合来制备螯合物更易于获取与应用,且条件温和、成本低、安全易控制,是发展的必然趋势。有研究报道了来源于不同动植物、乳类、微生物和水产资源中获得的能与矿质离子组装的多种食物源多肽(表1、表2)。蛋白质水解产生的水解物具有不同的分子质量和不同的生物特性,不同的蛋白酶和作用蛋白的性质不同,酶切结果也不同,料液比、温度、pH、酶的添加量、时间等各因素间交互作用也对水解蛋白的过程有所影响。蛋白质可在微生物所产生的多种酶、酸及特定代谢的作用下进行水解,因此微生物发酵法也是制备多肽的基本方法。一些食品加工副产物为微生物生长提供营养来源,可实现资源高效利用。随着科学技术的发展,近年研究者倾向于从粗肽研究转向更高纯度多肽的研究,CANABADY-ROCHELLE等[10]建立了表面等离子体共振筛选多肽的方法,可定向得到高矿质螯合能力的肽。
1.2 矿质离子螯合多肽的生理活性
1.2.1 矿质元素递送活性
多肽矿质离子螯合物克服了矿质离子低浓度时的低生物利用度和高浓度时的生物毒性等两大限制。多肽和氨基酸螯合的矿质离子在人体消化道可溶且呈电中性,而矿质离子的吸收取决于其螯合配体,与氨基酸相比,小肽的吸收有输送速度快、载体不易饱和、耗能少等优点[11]。肽-矿质离子螯合物因其独特的组装形式和吸收机制,在肠道内结构更为稳定,可以避免矿质元素沉淀的形成,从而促进矿质离子的吸收和利用。CAI等[12]通过Caco-2细胞研究发现,多肽-钙螯合物与无机钙组相比,Caco-2细胞单层钙吸收要提高3倍以上。菅景颖等[13]发现与葡糖酸钙和CaCO3等补钙制剂相比,胶原多肽螯合钙在小鼠质量、股骨长度、骨钙、骨磷以及有机质含量方面均显著高于其他补钙剂。
1.2.2 抗氧化活性
机体内,物质氧化代谢会产生大量维持机体生命活动必需的自由基和活性氧,但当自由基过多,体内的自由基代谢就会失衡,导致细胞损伤而引发多种疾病[14]。抗氧化机制主要包括清除自由基、增强各种抗氧化酶以及降低或消除脂质过氧化酶。多肽-矿质离子螯合物抗氧化活性的发挥主要依赖于活性多肽,也有研究表明,螯合铁、硒等矿质离子可增强矿质离子螯合肽的抗氧化活性(表1)。不同结构的多肽-矿质离子螯合物对DPPH自由基![]() 显示出不同的抗氧化活性和还原能力[15],多肽-矿质离子螯合物在体内对超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和天门冬氨酸转氨酶(AST)等关键酶活性有积极的影响[16]。
显示出不同的抗氧化活性和还原能力[15],多肽-矿质离子螯合物在体内对超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和天门冬氨酸转氨酶(AST)等关键酶活性有积极的影响[16]。
表1 不同来源的矿质离子螯合肽与矿质离子螯合物的抗氧化活性
Table 1 Antioxidant activity of peptides and mineral ion chelates from different sources
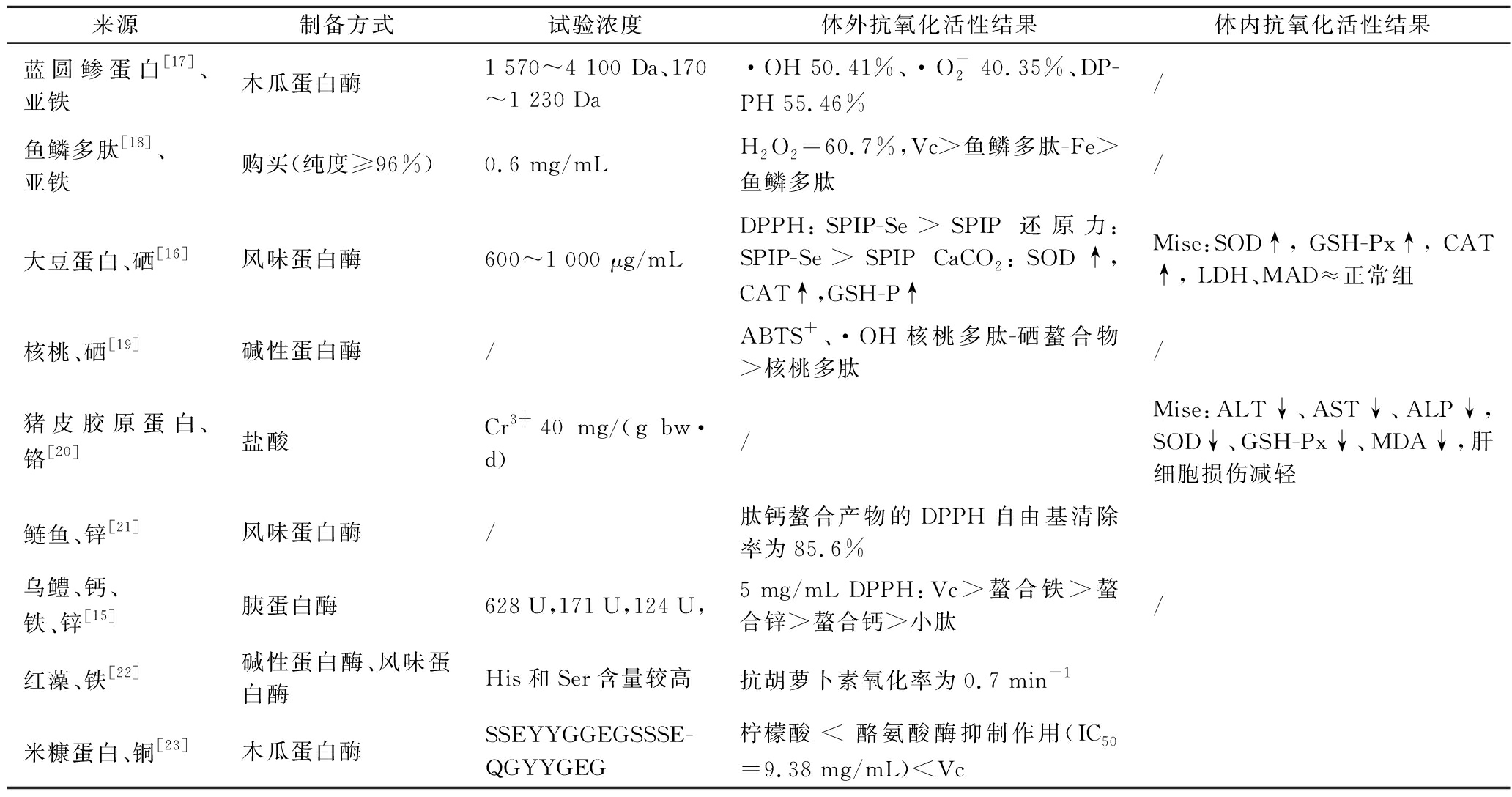
来源制备方式试验浓度体外抗氧化活性结果体内抗氧化活性结果蓝圆鲹蛋白[17]、亚铁木瓜蛋白酶1 570~4 100 Da、170~1 230 Da·OH 50.41%、·O-2 40.35%、DP-PH 55.46%/鱼鳞多肽[18]、亚铁购买(纯度≥96%)0.6 mg/mLH2O2=60.7%,Vc>鱼鳞多肽-Fe>鱼鳞多肽/大豆蛋白、硒[16]风味蛋白酶600~1 000 μg/mLDPPH:SPIP-Se>SPIP 还原力:SPIP-Se>SPIP CaCO2:SOD↑,CAT↑,GSH-P↑Mise:SOD↑, GSH-Px↑, CAT↑, LDH、MAD≈正常组核桃、硒[19]碱性蛋白酶/ABTS+、·OH核桃多肽-硒螯合物>核桃多肽/猪皮胶原蛋白、铬[20]盐酸Cr3+40 mg/(g bw·d)/Mise:ALT↓、AST↓、ALP↓,SOD↓、GSH-Px↓、MDA↓,肝细胞损伤减轻鲢鱼、锌[21]风味蛋白酶/肽钙螯合产物的DPPH自由基清除率为85.6%乌鳢、钙、铁、锌[15]胰蛋白酶628 U,171 U,124 U,5 mg/mL DPPH:Vc>螯合铁>螯合锌>螯合钙>小肽/红藻、铁[22]碱性蛋白酶、风味蛋白酶His和Ser含量较高抗胡萝卜素氧化率为0.7 min-1米糠蛋白、铜[23]木瓜蛋白酶SSEYYGGEGSSSE-QGYYGEG柠檬酸 < 酪氨酸酶抑制作用(IC50=9.38 mg/mL)
1.2.3 抑菌活性
小分子肽分子质量小,结构紧密,易于进入微生物细胞,因而能迅速地影响微生物的生长,近年研究表明多肽-矿质离子螯合物具有较强的抑菌活性。杨玉蓉等[24]研究表明小分子质量(≤5 kDa)桃仁多肽PKP3组分与亚铁离子螯合后的抑菌活性强于大分子质量(≥10 kDa)桃仁多肽亚铁螯合物,小麦多肽螯合亚铁和桃仁多肽螯合亚铁对金黄色葡萄球菌最小抑菌浓度分别为5.0、2.5 mg/mL,对大肠杆菌最小抑菌浓度均为5.0 mg/mL。蒲传奋等[25]制备的玉米醇溶蛋白肽钙通过破坏细胞膜影响大肠杆菌和金黄色葡萄球菌的正常生长曲线从而起到抑制作用。KESSLER等[26]则通过实验证明金属锌螯合肽衍生物对铜绿假单胞菌弹性蛋白酶具有体外抑制作用。
1.2.4 其他生物活性
肽-矿质离子螯合物还具有降血糖、保护肝脏、免疫调节等作用。PAULE等[27]发现多肽GHTD和ISF402与锌螯合后体内降血糖能力强于单独使用胰岛素,这是由于这类多肽锌可改变胰岛素的六聚体结构,增强胰岛素降血糖能力。王秀丽等[28]发现胶原肽铬可显著降低血糖,增加肝糖原的合成及葡糖糖激酶活性。王卫国等[29]用纳米小肽螯合铜喂养小鼠,测定小鼠血清中生长因子(IGF-1)、小鼠白介素(IL-2)及血清免疫蛋白IgG、IgM和IgA的含量,得出肽-铜螯合物可提高机体免疫力的结论。SUPATCHA等[23]从米糠蛋白中分离出了具有酪氨酸酶抑制活性与铜螯合活性的多肽SSEYYGGEGSSSEQGYYGEG,可在食品和化妆品中发挥作用。
2 矿质离子螯合多肽自组装模式
较多肽与矿质离子的螯合机理研究针对于磷酸盐基团结合模式和羧酸盐基团结合模式,矿质离子螯合肽的羧基、氨基以及侧链含具有孤对电子的氮、氧、硫原子可作为结合位点,在一定条件下可与矿质离子配位结合形成络合物。此外,外界环境、带电量及分子质量大小都会影响多肽与矿质元素的结合常数和结合位点,同时矿质螯合物的结构性质也相应发生改变[30],部分不同来源矿质离子螯合多肽与矿质离子螯合的结构表征分析见表2。
表2 不同来源多肽与矿质离子自组装结构表征
Table 2 Characterization of self-assembled structure of peptides and mineral ions from different sources
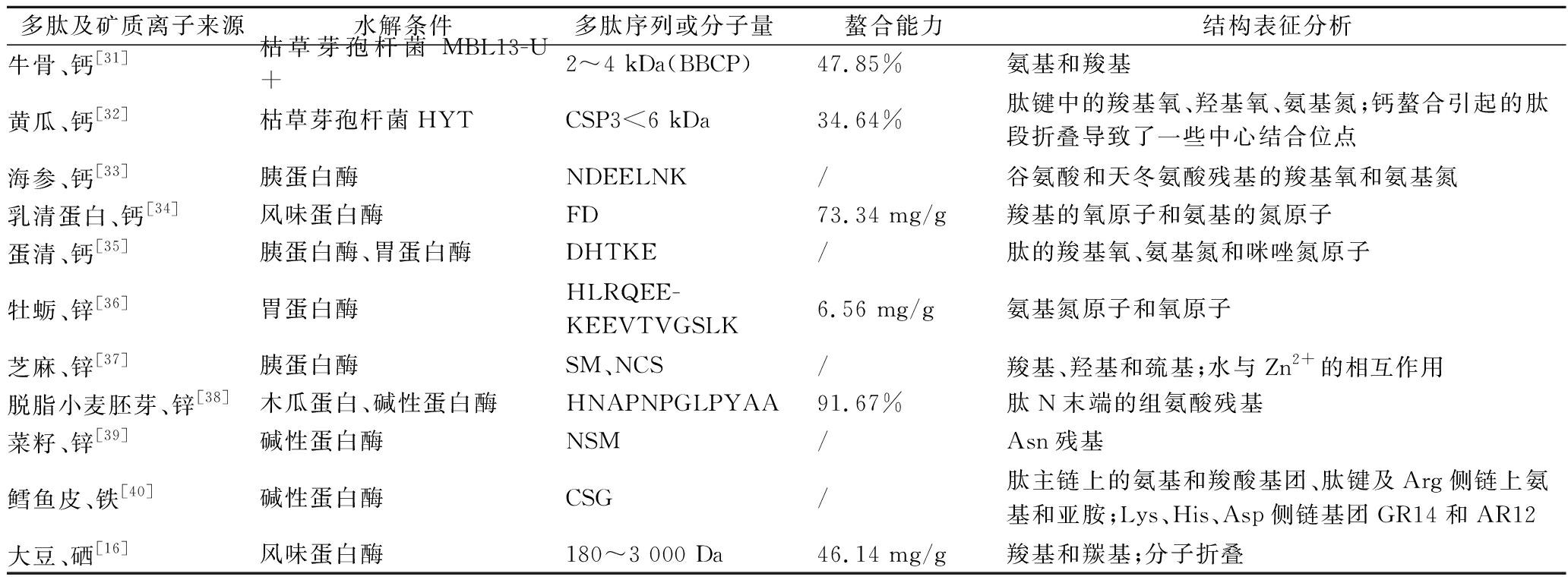
多肽及矿质离子来源水解条件多肽序列或分子量螯合能力结构表征分析牛骨、钙[31]枯草芽孢杆菌 MBL13-U+2~4 kDa(BBCP)47.85%氨基和羧基黄瓜、钙[32]枯草芽孢杆菌HYTCSP3<6 kDa34.64%肽键中的羧基氧、羟基氧、氨基氮;钙螯合引起的肽段折叠导致了一些中心结合位点海参、钙[33]胰蛋白酶NDEELNK/谷氨酸和天冬氨酸残基的羧基氧和氨基氮乳清蛋白、钙[34]风味蛋白酶FD73.34 mg/g羧基的氧原子和氨基的氮原子蛋清、钙[35]胰蛋白酶、胃蛋白酶DHTKE/肽的羧基氧、氨基氮和咪唑氮原子牡蛎、锌[36]胃蛋白酶HLRQEE-KEEVTVGSLK6.56 mg/g氨基氮原子和氧原子芝麻、锌[37]胰蛋白酶SM、NCS/羧基、羟基和巯基;水与Zn2+的相互作用脱脂小麦胚芽、锌[38]木瓜蛋白、碱性蛋白酶HNAPNPGLPYAA91.67%肽N末端的组氨酸残基菜籽、锌[39]碱性蛋白酶NSM/Asn残基鳕鱼皮、铁[40]碱性蛋白酶CSG/肽主链上的氨基和羧酸基团、肽键及Arg侧链上氨基和亚胺;Lys、His、Asp侧链基团GR14和AR12大豆、硒[16]风味蛋白酶180~3 000 Da46.14 mg/g羧基和羰基;分子折叠
2.1 磷酸盐基团组装模式
酪蛋白磷酸肽(casein phosphopeptides,CPP)和卵黄高磷磷酸骨桥蛋白肽(phosvitin phosphopeptides,PPP)是最早被发现的促钙吸收肽。CPP是乳中酪蛋白的酶解产物,活性中心结构为-Ser P-Ser P-Ser P-Glu-Glu-,能与多种矿质离子组装并促进其吸收[41]。PPP丝氨酸含量大于30%,磷占比达8.2%,由卵黄高磷蛋白酶解而得[42]。磷酸化丝氨酸能将钙离子包裹而形成可溶性复合物,避免了钙在人体肠道内与植酸盐形成沉淀[43]。SATO等[44]发现矿质离子螯合肽与钙离子的结合与磷酸化丝氨酸基团呈正相关,且酪蛋白分子的磷酸盐部分对增强人体小肠吸收钙离子有必要关联。
2.2 羧酸盐基团组装模式
多种不含磷酸基团的多肽可通过氨基酸残基中的天冬氨酸、谷氨酸、赖氨酸等羧基组装矿质离子,羧基上的氧原子可通过提供孤对电子与矿质离子形成配位键。BAO等[45]研究了大豆蛋白水解物中钙螯合能力和羧基含量之间的关系,结果表明,螯合钙的量随着羧基含量的增加而线性增加。LIU等[46]报道了来自小麦胚芽蛋白水解产物的谷氨酸和天冬氨酸羧基上的氧原子参与了多肽与钙离子之间的螯合。大豆肽的研究表明,与羧酸基团结合的肽需要较大分子质量(3~10 kDa),这种模式可能需要形成特定空间结构才能发挥活性[45]。
2.3 多肽-矿质离子螯合物空间结构
EF手性结构(图1-a)和C2结构域是常见的由-loop-环结构所组成多肽结合空间模式。loop环中分布含氧侧链的氨基酸,通过提供氧原子和氮原子的孤电子对与矿质离子配位形成新化合物,同时氨基酸侧链螺旋旋转改变空间位置,便于内部疏水基团暴露,获得更多的识别位点[43]。WANG等[47]设计了3组由不同手性氨基酸组成、互为对映异构体的短两亲肽,超分子纳米原纤维的扭曲手性由C末端的亲水性Lys头部的手性决定,而其特征圆二色谱信号则由疏水性Ile残基的手性决定。BOYLE等[9]将组氨酸残基引入到卷曲螺旋三聚体的疏水核中,产生了一种在添加金属离子后自动组装的HisAD肽,如图1-c所示,HisAD在与Cu(II)络合后折叠形成α-螺旋结构。C2结构域是在蛋白激酶C的钙依赖亚型中鉴定出来[48],如图1-f,C2-结构域顶端的3个1oop环里面分布有天冬氨酸可与钙离子形成β-三明治结构。也有研究提出钙螯合物在溶液中的构象,其中钙离子被4个共面碳原子缠绕在八面体型配合物中[49],图1-d为溶液中环[Glu(YOBzl)-Sar-Gly-(N-己基)Gly]z-钙络合物构象的Corey-Padi-Koltun分子模型。
WANG等[37]将Asn-Cys-Ser(NCS)和Ser-Met(SM)与Zn2+组装,发现在多肽羰基和水的协调作用下,多肽的羧基、羟基和巯基与锌离子形成稳固的配位键,图1-b为两种多肽的某一立体结构。有些多肽在酸性、受冷、受热等环境下可聚集,为探究肽聚集对钙结合能力的影响,LIU等[50]分离出了不同分子质量且具有不同钙结合能力的多肽F1和F2,分析了去羧酸化处理前后多肽与钙结合能力和表观分子重分布的变化。结果表明,酸性氨基酸的疏水相互作用是肽聚集和钙结合的主要驱动力,疏水氨基酸如Pro和Phe与钙结合氨基酸如Glu和Asp分别在肽的两侧,如图1-e所示,黄色箭头指向发生疏水聚集的区域,橙色箭头指向钙结合区域。当2个分子的肽相遇,疏水氨基酸倾向于聚集和埋藏在分子内,将钙结合氨基酸聚集在一起,在分子表面形成一个“钙结合区”而提高钙结合力。
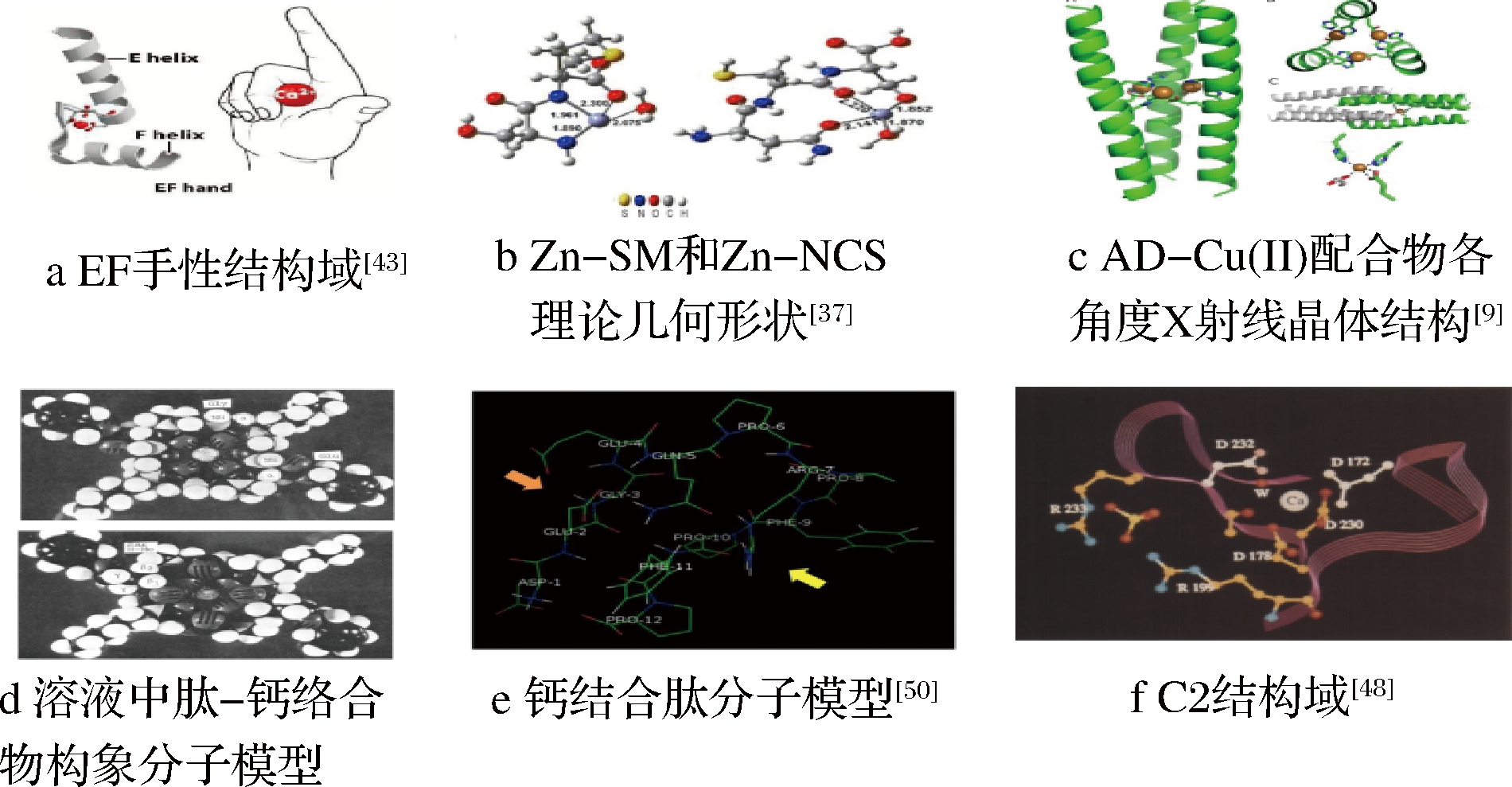
图1 多肽-矿质离子自组装体系空间结构图
Fig.1 Space structure diagram of peptide-metal ion
self-assembly system
2.4 矿质离子与肽的多元超分子结构
随着纳米生物技术的发展,生物活性分子构筑超分子组装体的概念备受重视。实现对聚合物的可控组装调控,对改进材料的效能和安全性意义重大。多糖类物质的组装可以提供更多的结合位点,且有利于金属离子或药物在胃肠道的缓释,同时可为机体提供活性成分。ZHU等[8]分别以脱盐鸭蛋清肽、CPP和壳寡糖为材料,成功组装了多种保护性钙缓释递送载体,结果表明,递送系统可促进钙内流,受试动物的血清和骨指标等显著增加,且有效促进肠道有益菌的增殖,促进代谢产物如丁酸含量提高。夏伟荣等[51]以马脾脱铁铁蛋白(horse spleen apoferrin,HSF)及海藻酸钠(sodium alginate,SA)为载体材料包埋血管紧张素转化酶(ACE)抑制肽Ala-His-Leu-Leu(AHLL),利用铁蛋白在强酸条件下可逆组装性质和多糖的控释作用,通过HSF和SA静电吸引形成良好的复合包埋载体制备均匀分散的HSF-ACE抑制肽及HSF-SA-ACE抑制肽纳米复合体系,提高了AHLL在消化系统中的吸收效果。
3 多肽-矿质离子螯合物自组装递送体系生物利用度研究进展
以往的观点认为,人体吸收的矿质离子取决于十二指肠和近端空肠在吸收位点处离子形式的可溶性矿质离子量,肽-矿质离子螯合物中的矿质离子通过竞争形式被吸收。随着研究的深入,有学者提出肽-矿质离子螯合物以完整的结构进人循环系统的假说,此时机体通过肽通道吸收螯合物,可避免与其他矿质离子吸收的拮抗竞争,从而提高其生物利用度。钙递送体系的主要体内活性研究路线如图2所示[8]:一般研究过程为构建矿质离子螯合肽的自组装体系,并研究其结构表征,然后细胞模型与动物模型研究其促矿质离子吸收活性。ZHU等[8]在Caco-2细胞单层模型、Caco-2细胞群体模型和外翻肠囊模型中发现脱盐鸭蛋白肽可增强钙离子转运,且可通过充当钙离子载体与细胞膜相互作用以打开特定吸收通道实现促钙吸收,且脱盐鸭蛋白肽可抵抗植酸的不良影响。
上皮生长因子受体(epidermal growth factor receptor,EGFR)信号可通过增加体内肥大软骨细胞中的β-连环蛋白(β-catenin)数量调节Wnt/catenin通路。YE等[52]对牦牛骨胶原衍生肽(GPAGPPGPIGNV,GP-12)体外稳定性研究表明,在模拟胃肠消化吸收(Caco-2细胞单层)实验后,GP-12消化成更小的肽,然而它们仍可通过细胞旁路途径实现Caco-2细胞单层完整吸收。如图3所示,GP-12通过激活Wnt /β-catenin途径与EGFR途径之间的通路,诱导从G0/G1到S期以及从S到G2/M期的细胞周期进程的改变来完成成骨细胞增殖和分化。
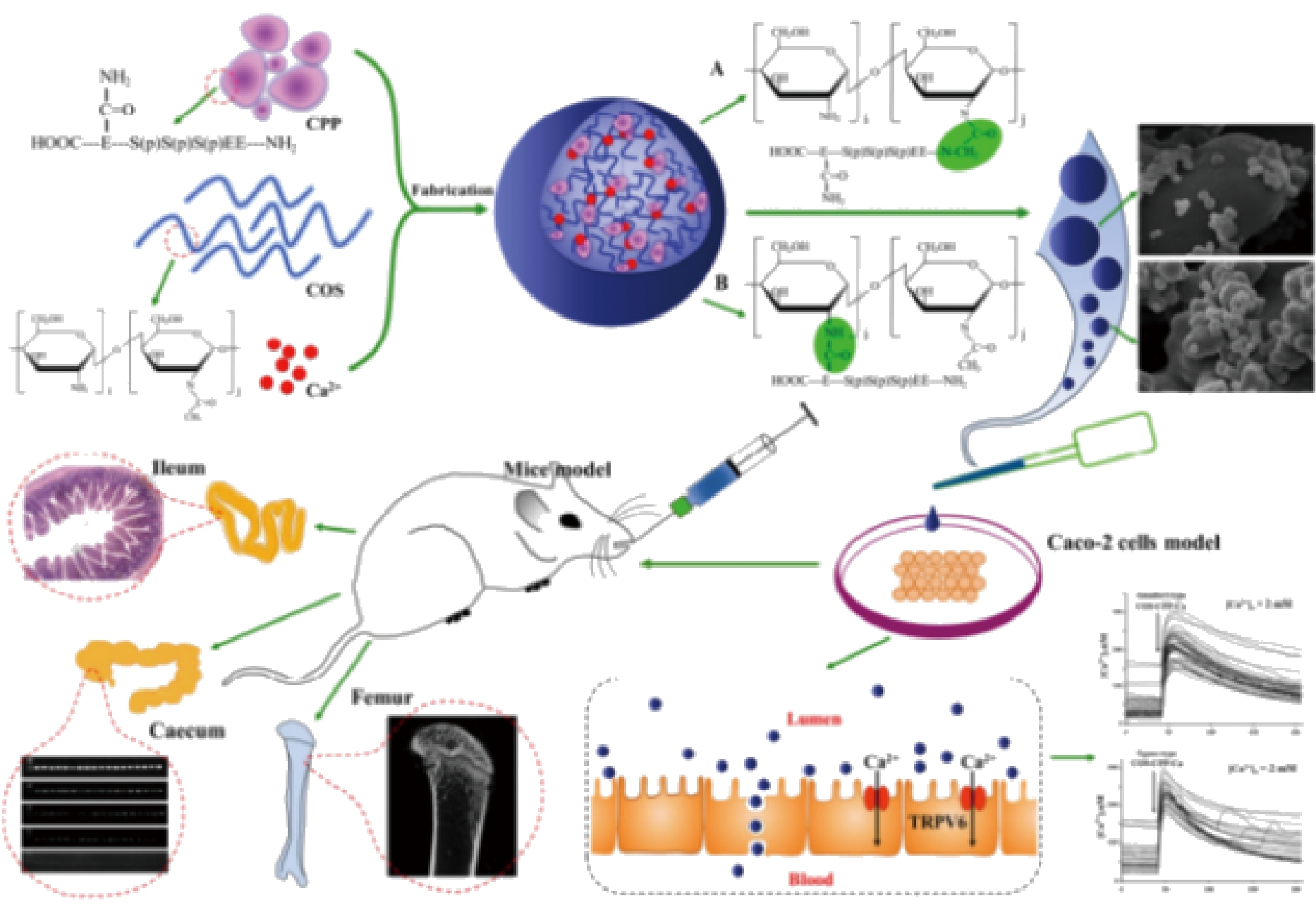
图2 钙递送体系的主要研究路线
Fig.2 Schematic representation of main research routes of
two calcium delivery systems.

图3 Wnt/β-catenin途径与EGFR途径参与GP-12的
成骨细胞增殖和分化相互作用模拟模型[52]
Fig.3 Proposed model of the cross-talk between Wnt/β-catenin
pathway and EGFR pathway involved in osteoblastic
proliferation and differentiation by GP-12
4 展望
多肽-矿质离子自组装递送体系不仅可解决矿质元素在人体内吸收差和生物活性低的问题,同时也具有抗氧化、抗菌、免疫调节和降血糖等作用,具有很高的应用价值和开发前景。但目前用于工业生产的矿质离子螯合肽仍只有CPPs和PPPs,其他来源的矿质离子螯合肽投入在实际生产中的少之又少。且目前的研究只处于实验室阶段,存在成本高、产量低、纯度不高等制约因素。关于多肽-矿质离子螯合物还存在系统安全性评估、活性机制、构效关系研究不全面的问题,近年来虽有较多细胞模型与小鼠活体模型为多肽-矿质离子螯合物在人体的转运与影响奠定了一定基础,但多肽-矿质离子螯合物对人体是否有同样的效用还有待进一步研究。此外,蛋白质或多肽在多元超分子自组装中有巨大潜力,蛋白质和多肽可以在水溶液分散纳米胶束中进行自组装,也可以通过静电和疏水作用负载活性化合物,如花色苷,姜黄素和β-胡萝卜素,且这些胶束在模拟胃肠液中具有很好的稳定性。将多糖、多酚、黄酮等生理活性物质与矿质离子螯合肽共建的复合自组装递送体系,构建膜、水凝胶、胶束、囊泡和纳米颗粒及皮克林乳液等,对于递送体系的稳定性及扩展更多活性具有重要意义,对促进矿质离子吸收和调节肠道微生物的食品材料以及药物递送和其他潜在功能等方面有广阔前景。随着对蛋白质及多肽自组装研究的继续深入,蛋白质和多肽的自组装递送体系的潜在功能也将被持续开发,在未来的食品领域中具有更广阔的应用前景。
[1] TOMADON B,CAPELLO C,VALENCIAB G A,et al.Self-assembled proteins for food applications:a review[J].Trends in Food ence & Technology,2020,101(7):1-16.
[2] 汪少芸. 功能肽的加工技术和活性评价[M].北京:科学出版社,2019.
WANG S.Y.Processing technology and activity evaluation of functional peptides[M].Beijing:Science press,2019.
[3] SUN N,WU H,DU M,et al.Food protein-derived calcium chelating peptides:a review[J].Trends in Food Science & Technology,2016,58:140-148.
[4] ERDEM T,FERAT A,NURDAN Y A,et al.Vitamin and mineral deficiency in children newly diagnosed with celiac disease[J].Turkish Journal of Medical Sciences,2015,45:833-836.
[5] YAO X L,YAO X X,XU K,et al.Iron encapsulated microstructured gel beads using an emulsification-gelation technique for an alginate-caseinate matrix[J].Food & Function,2020,11(5):3 811-3 822.
[6] UDECHUKWU M C,COLLINS S A,UDENIGWE C C.Prospects of enhancing dietary zinc bioavailability with food-derived zinc-chelating peptides[J].Food & Function,2016,7(10):4 137-4 144.
[7] 张勇胜, 李仁兰,刘妍,等.硒对人体健康作用的研究进展[J].内科,2018,13(4):89-91.
ZHANG Y S,LI R L,LIU Y.Research progress on effects of selenium on human health[J].Internal Medicine of China,2018,13(4):89-91.
[8] ZHU B,HE H,GUO D,et al.Two novel calcium delivery systems fabricated by casein phosphopeptides and chitosan oligosaccharides:preparation,characterization,and bioactive studies[J].Food Hydrocolloids.2019,102:105 567.
[9] BOYLE A,RABE M,CRONE N,et al.Selective coordination of three transition metal ions within a coiled-coil peptide scaffold[J].Chemical Science,2019,6:6-11.
[10] CANABADY-ROCHELLE L L S,SELMECZI K,COLLIN S,et al.SPR screening of metal chelating peptides in a hydrolysate for their antioxidant properties[J].Food Chemistry,2018,239(1):478-485.
[11] BRONNER F,PANSU D.Nutrition aspects of calcium absorption[J].Journal of Nutrition,1999,129:9-12.
[12] CAI X,LIN J,WANG S.Novel peptide with specific calcium-binding capacity from Schizochytrium sp.protein hydrolysates and calcium bioavailability in Caco-2 cells[J].Marine Drugs,2018,239(1):478-485.
[13] 菅景颖, 张志胜.胶原多肽螯合钙壮骨作用研究[J].河北农业大学学报,2010,33(5):94-97.
JIAN J Y,ZHANG Z S.Effect of collagen polypeptide calcium on the promotion of bone’s growing[J].Journal of Hebei Agricultural University,2010,33(5):94-97.
[14] 罗永康. 生物活性肽功能与制备[M].北京:中国轻工业出版社出版社,2019.
LUO Y K.Bioactive peptides function and preparation[M].Beijing:China Light Industry Press,2019.
[15] 汪婧瑜, 张业辉,张友胜,等.不同结构的乌鳢螯合肽对抗氧化活性的影响[J].中国食品学报,2019,19(10):93-99.
WANG J Y,ZHANG Y H,ZHANG Y S,et al.The effect of different structure of chelated peptides of Channa argus on antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology,2019,19(10):93-99.
[16] YE Q,WU X,ZHANG X,et al.Organic selenium derived from chelation of soybean peptide-selenium and its functional properties in vitro and in vivo[J].Food & Function,2019,10:4 761-4 770.
[17] 肖玉娟, 傅奇,何少贵,等.蓝圆鲹多肽亚铁螯合物制备及其抗氧化性[J].食品工业,2020,41(2):126-129.
XIAO Y J,FU Q,HE S G,et al.The preparation and antioxidant activity of iron chelating peptides from decaperus maruadsi[J].The Food Industry,2020,41(2):126-129.
[18] 覃宇. 鱼鳞多肽亚铁螯合物的氨基酸测定及体外抗氧化活性分析[J].武汉职业技术学院学报,2019,3:112-115.
QIN Y.Determination of amino acids and analysis of antioxidant activity in vitro[J].Journal of Wuhan Polytechnic,2019,3:112-115.
[19] 林栋, 孙倩,马立志,等.核桃多肽-硒螯合物制备工艺优化及其抗氧化活性研究[J].食品科技,2019,44(11):302-307.
LIN D,SUN Q,MA L Z,et al.Optimized preparation and antioxidant activity of selenium-chelating polypeptides from walnut protein hydrolysate[J].Food Science and Technology,2019,44(11):302-307.
[20] 刘安军, 王秀丽,陈影,等.胶原蛋白多肽-铬(Ⅲ)螯合物对四氧嘧啶致小鼠肝脏损伤的保护作用[J].营养学报,2006,28(6):487-489.
LIU A J,WANG X L,CHEN Y,et al.The protective effects of collegen peptide-chromium (Ⅲ) complex on alloxan-induced hepatic injury in mice[J].Acta Nutrimenta Sinica,2006,28(6):487-489.
[21] 姜良萍, 李博,罗永康,等.鲢鱼源多肽锌螯合物对冷藏草鱼的保鲜作用[J].食品科技,2013,38(12):144-149.
JIANG L P,LI B,LUO Y K,et al.Effect of complexes of Zn2+and peptides from silver carp (Hypophthalmichthys molitrix) proteins on the preservation of grass carp during cold storage[J].Food Science and Technology,2013,38(12):144-149.
[22] CIAN R E,GARZON A G,ANCONA D B,et al.Chelating properties of peptides from red seaweed pyropia columbina and its effect on iron bio-accessibility[J].Plant Foods for Human Nutrition,2016,71(1):96-101.
[23] SUPATCHA K,CHOCKCHAI T,REED R L,et al.Isolation and identification of tyrosinase inhibitory and copper-chelating peptides from hydrolyzed rice bran-derived albumin[J].Journal of Agricultural & Food Chemistry,2018,66(31):8 346-8 354.
[24] 杨玉蓉, 李安平,钟政昌,等.桃仁多肽螯合亚铁的抑菌活性及结构表征[J].食品科学,2019,40(5):57-62.
YANG Y R,LI A P,ZHONG Z C,et al.Antibacterial activity and structural characterization of peach kernel peptide-ferrous chelate[J].Food Science,2019,40(5):57-62.
[25] 蒲传奋, 唐文婷.玉米醇溶蛋白肽钙螯合物的制备及其抑菌性能研究[J].食品科技,2015,40(12):246-250.
PU C F,TANG W T.Preparation and antibacterial properties of zein peptide-calcium chelate[J].Food Science and Technology,2015,40(12):246-250.
[26] KESSLER E,ISRAEL M,LANDSHMAN N,et al.In vitro inhibition of Pseudomonas aeruginosa elastase by metal-chelating peptide derivatives[J].Infection & Immunity,1982,38(2):716-723.
[27] PAULE S G,NIKOLOVSKI B,LUDEMAN J,et al.Ability of GHTD-amide and analogs to enhance insulin activity through zinc chelation and dispersal of insulin oligomers[J].Peptides,2009,30(6):1 088-1 097.
[28] 王秀丽, 刘安军,李琨,等.胶原蛋白多肽-铬(Ⅲ)螯合物的降血糖机理探讨[J].食品研究与开发,2006,5:125-126.
WANG X L,LIU A J,LI K,et al.Study on the hypoglycemic effects of collagen peptide-chromium(Ⅲ) complex[J].Food Research and Development,2006,5:125-126.
[29] 王卫国, 张天勇.纳米级小肽螯合铜对小白鼠铜排泄和免疫指标的影响[J].饲料工业,2011,32(7):11-15.
WANG W G,ZHANG T Y.Effect of nano copper-small peptide chelate on excretion of copper and immune indexes of mice[J].Feed Industry,2011,32(7):11-15.
[30] 李雪芬, 杜斌,丁轲,等.金属螯合肽分离纯化及其抗氧化活性的研究进展[J].中国食物与营养,2016,22(3):35-39.
LI X F,DU B,DING K,et al.Research progress of separation and purification of metal chelating peptides and antioxidant activity[J].Food and Nutrition in China,2016,22(3):35-39.
[31] 刘丽莉. 牛骨降解菌的筛选及其发酵制备胶原多肽螯合钙的研究[D].武汉:华中农业大学,2010.
LIU L L.Rearch on screening the bovine bone-degraded bacteria and preparation of collagen-derived polypeptides chelated calcium by fermentation[D].Wuhan:Huazhong Agricultural University,2010.
[32] WANG X,GAO A,CHEN Y,et al.Preparation of cucumber seed peptide-calcium chelate by liquid state fermentation and its characterization[J].Food Chemistry,2017,229(15):487-494.
[33] CUI P,LIN S,JIN Z,et al.In vitro digestion profile and calcium absorption studies of a sea cucumber ovum derived heptapeptide-calcium complex[J].Food & Function,2018,9:4 582-4 592.
[34] ZHAO L,HUANG S,CAI X,et al.A specific peptide with calcium chelating capacity isolated from whey protein hydrolysate[J].Journal of Functional Foods,2014,10:46-53.
[35] SUN N,JIN Z,LI D,et al.An exploration of the calcium-binding mode of egg white peptide,Asp-His-Thr-Lys-Glu,and in vitro calcium absorption studies of peptide-calcium complex[J].Journal of Agricultural & Food Chemistry,2017,65:9 782-9 789.
[36] CHEN D,LIU Z,HUANG W,et al.Purification and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J].Journal of Functional Foods,2013,5(2):689-697.
[37] WANG C,WANG C,LI B,et al.Zn(Ⅱ) chelating with peptides found in sesame protein hydrolysates:Identification of the binding sites of complexes[J].Food Chemistry,2014,165(15):594-602.
[38] ZHU K X,WANG X P,GUO X N.Isolation and characterization of zinc-chelating peptides from wheat germ protein hydrolysates[J].Journal of Functional Foods,2015,12:23-32.
[39] XIE N,HUANG J,LI B,et al.Affinity purification and characterisation of zinc chelating peptides from rapeseed protein hydrolysates:possible contribution of characteristic amino acid residues[J].Food Chemistry,2015,173(15):210-217.
[40] WU W,LI B,HOU H,et al.Identification of iron-chelating peptides from pacific cod skin gelatin and the possible binding mode[J].Journal of Functional Foods,2017,35:418-427.
[41] RAFAEL B,SERGE C,JUILLERAT M A,et al.Tryptic phosphopeptides from whole casein.II.physicochemical properties related to the solubilization of calcium[J].Journal of Dairy Research,1989,56:335-341
[42] JIANG B,MINE Y.Phosphopeptides derived from hen egg yolk phosvitin:effect of molecular size on the calcium-binding properties[J].Bioscience Biotechnology & Biochemistry,2001,65(5):1 187-1 190.
[43] 黄海. 鲤鱼卵钙离子结合活性肽的制备及钙结合机制的研究[D].青岛:中国海洋大学,2014.
HUANG H.Study on the preparation of peptide withcalcium-binding activity from carp egg and its mechanism of binding calcium[D].Qingdao:Ocean Unversity of China,2014.
[44] SATO R,NOGUCHI T,NAITO H.The necessity for the phosphate portion of casein molecules to enhance ca absorption from the small intestine[J].Journal of the Agricultural Chemical Society of Japan,1983,47(10):2 415-2 417.
[45] BAO X L,LV Y,YANG B C,et al.A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J].Journal of Food Science,2008,73(3):117-121.
[46] LIU F R,WANG L,WANG R,et al.Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide-calcium complex[J].Journal of Agricultural & Food Chemistry,2013,61(31):7 537-7 544.
[47] WANG M,ZHOU P,WANG J,et al.Left or right:How does amino acid chirality affect the handedness of nanostructures self-assembled from short amphiphilic peptides?[J].Journal of the American Chemical Society,2017,139(11):4 185-4 194.
[48] SUTTON B R,DAVLETOV B A,BERGHUIS A M,et al.Structure of the first C2 domain of synaptotagmin I:A novel Ca2+/phospholipid-binding fold[J].Cell,1995,80(6):929-938.
[49] HUGHES D W,DEBER C M.Conformations of cyclic peptide/calcium complexes in solution[J].Biopolymers,1982,21(1):169-179.
[50] LIU H,YING L,XU J T,et al.Soybean peptide aggregates improved calcium binding capacity[J].Lwt Food Science & Technology,2016,67(4):174-180.
[51] 夏伟荣, 李莹,柴智,等.铁蛋白-海藻酸钠纳米包埋ACE抑制肽[J].食品科学,2020,41(8):77-82.
XIA W R, LI Y,CHAI Z,et al.Encapsulation of ACE inhibitory peptide with ferritin-sodium alginate nanoparticles[J].Food Science,2020,41(8):77-82.
[52] YE M,ZHANG C,ZHU L,et al.Yak (Bos grunniens) bones collagen-derived peptides stimulate osteoblastic proliferation and differentiation via the activation of Wnt/β-catenin signaling pathway[J].Journal of the Science of Food and Agriculture,2020,100(6):2 600-2 609.