灰树花(Grifola frondosa)是一种药食两用真菌[1-2],含有丰富的生物活性成分,如多糖、黄酮、多酚、蛋白质、麦角甾醇、真菌SOD酶等[3-5],尤其多糖组分具有很高的药用价值,如抗氧化[6]、抗肿瘤[7]、降血糖[8]、降血脂[8-9]、提高机体免疫活性[6,10]等。利用中药与真菌进行共发酵是一种新的生物转化技术,赵亮等[11]在灰树花发酵体系中,添加苦荞的乙醇提取液,对灰树花生物量和次级代谢产物有一定的促进作用;杨海龙等[12]探究筛选了不同中药提取液对灵芝深层发酵的影响;卢红云等[13]通过向灰树花液体培养基中加入天麻醇提物,促进了灰树花纤维素酶、淀粉酶、漆酶等酶的活性,其活性的大小与灰树花的生长和代谢产物积累具有一定的关联。本课题组前期研究显示,添加一定比例的天麻醇提物能够显著地提高灰树花生物量和多糖的产量,并且与未添加组相比,能够显著提高多糖的生物活性[6,14],如抗氧化、降血糖、降血脂、提高机体免疫力等[15]。
茯苓为多孔菌科真菌茯苓的干燥菌核,含β-茯苓聚糖和三萜类化合物(乙酰茯苓酸、茯苓酸、3β-羟基羊毛甾三烯酸)[3,16-18]。LI 等[19]喂食小鼠茯苓粗提物及茯苓三萜类化合物,能够改善糖尿病小鼠的血糖水平;TIAN 等[20]的研究表明,茯苓多糖能够通过调节TLR4/TRAF6/NF-κB信号通路进而表现出免疫调节作用。本实验的目的是向灰树花液态深层发酵培养基中添加不同比例、不同溶剂提取的茯苓提取物,探究对灰树花生物量及次级代谢产物的影响,以期探究一种茯苓提取物的最适添加比例,进而为茯苓参与真菌液态深层发酵提供思路及参考。
1 材料与方法
1.1 材料与试剂
灰树花(Grifola frondosa,菌种编号:5.404),中国普通微生物菌种保藏管理中心;茯苓,北京同仁堂参茸中药制品有限公司;芦丁标标准、牛血清白蛋白标标准、考马斯亮蓝G-250,北京索莱宝生物科技有限公司;没食子酸标准品,天津科密欧化学试剂有限公司;无水硝酸铝、亚硝酸钠,上海阿拉丁试剂有限公司;其他试剂均为市售分析纯。
斜面培养基为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。
液体种子培养基(g/L):葡萄糖 30,KH2PO4 0.5,蛋白胨 2,MgSO4·7H2O 0.5,酵母膏 6,pH 自然。
发酵培养基(g/L):葡萄糖 50,KH2PO4 0.5,蛋白胨 5,MgSO4·7H2O 2,酵母膏 10,pH 自然。
1.2 仪器与设备
BXM-30 R型立式灭菌锅,上海博讯实业有限公司医疗设备厂;RE—2000A型旋转蒸发器,上海亚荣生化仪器厂;SW-CJ-1D型净化工作台,苏州净化设备有限公司;TGL-20M型台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;ZWY-C2112 B型双层旋转式可编程恒温恒湿摇床,上海智诚分析仪器制造有限公司;CTFD-12S型真空冷冻干燥机,青岛永合创信电子科技有限公司。
1.3 实验方法
1.3.1 灰树花菌种培养方法
斜面种子培养:从母种试管中挑取黄豆粒大小菌丝块接种于PDA培养基斜面中部,25 ℃恒温培养,至菌丝长满整个斜面,转置4 ℃保存。
液体种子培养:用接种勺在斜面菌种管中刮取1勺细小菌丝体,接种于液体种子培养基中,250 mL三角瓶装液量为100 mL种子液,加入少许细小玻璃珠,于25 ℃、150 r/min摇床中培养6 d。
发酵培养:无菌条件下,按体积分数为10%的接种量,移取10 mL种子液接于发酵培养基中,250 mL三角锥形瓶装液量为100 mL发酵液,于25 ℃、150 r/min摇床中培养12 d。
1.3.2 茯苓提取液的制备
茯苓粉的制备:取茯苓菌核,50 ℃烘箱内烘干,粉碎机粉碎,过80目筛。
茯苓水提液的制备:取20 g茯苓粉末,加200 mL蒸馏水,90 ℃条件下回流提取4 h,抽滤得上清液,粉末继续回流提取,重复3次,合并上清液,减压浓缩蒸发至200 mL,即得0.1 g/mL的茯苓水提液。
茯苓醇提液的制备:取20 g茯苓粉末,加200 mL体积分数为75%的乙醇溶液,70 ℃条件下回流提取4 h,抽滤得上清液,粉末继续回流提取,重复3次,合并上清液,减压浓缩蒸发至200 mL,即得0.1 g/mL的茯苓醇提液。
1.4 分析方法
1.4.1 生物量的测定
灰树花生长以其菌丝体生物量为指标。将发酵培养后的培养基用滤纸过滤,收集菌丝体,蒸馏水冲洗3次并于60 ℃烘箱中烘干至恒重,称取质量,即为菌丝体生物量。
1.4.2 多糖含量的测定[21]
(1) 胞外多糖的测定:取5 mL上述滤液,加入4倍体积的95%乙醇,于4 ℃冰箱中静置24 h,6 000 r/min离心15 min后收集沉淀,用95%乙醇重复洗涤,最后于60 ℃烘干,加蒸馏水复溶,作为待测样品溶液,用苯酚硫酸法测定胞外多糖的含量。
(2) 胞内多糖的测定:精确称取1 g菌丝体粉末,加入50 mL蒸馏水,超声提取5 h,过滤收集滤液,加蒸馏水定容到50 mL,作为待测样品溶液,用苯酚硫酸法测定胞内多糖含量。
1.4.3 蛋白含量的测定[22]
(1) 胞外蛋白含量的测定:取100 mL上述滤液,浓缩后并加蒸馏水定容到10 mL,作为待测样品溶液,用考马斯亮蓝法测定蛋白含量。
(2) 胞内蛋白含量的测定:精确称取1 g菌丝体粉末,加入50 mL蒸馏水,超声提取5 h,过滤收集滤液,加蒸馏水定容到50 mL,作为待测样品溶液,用考马斯亮蓝法测定胞内蛋白含量。
1.4.4 总黄酮含量的测定[23]
(1) 胞外总黄酮含量的测定:取100 mL上述滤液,减压浓缩并加蒸馏水定容到10 mL,作为待测样品溶液,采用NaNO2、Al(NO3)3显色法测量,总黄酮含量以芦丁当量表示。
(2) 胞内总黄酮含量的测定:精确称取1 g菌丝体粉末,加入50 mL 70%的乙醇,超声提取5 h,过滤收集滤液,加70%乙醇定容50 mL作为待测样品溶液。
1.4.5 发酵液还原糖[24]及pH的测定
取1 mL上述过滤后的滤液,用蒸馏水定容至50 mL,取1 mL稀释液于25 mL的具塞比色皿中,加1 mL蒸馏水,再加入1.5 mL 3,5-二硝基水杨酸试剂,摇匀后,沸水浴加热5 min,冷却至室温定容至25 mL,于540 nm处测定吸光值。
1.5 数据处理与分析
实验数据用平均值±标准偏差(n±SD)表示(n=3)。使用Origin 10 软件画图,SPSS 19.0软件进行数据分析。使用单因素方差分析(ANOVA)和t检验进行显著性分析,P<0.05表示数据具有显著性差异。
2 结果与分析
2.1 不同茯苓提取物添加量对灰树花菌丝体的影响
向灰树花液态发酵培养基中添加不同比例的茯苓醇提物和水提物,两者添加比例对灰树花生物量的影响如图1所示。随着添加物质量浓度的增加,生物量表现先增大后减小的趋势,在茯苓醇提液添加量为5 g/L和茯苓水提液为7 g/L时对其生物量影响显著(P<0.05),达到最大生物量,分别为(1.505±0.03)g/L和(1.573±0.06)g/L,相较于空白组分别提高了24.28%和29.04%,说明一定质量浓度的茯苓醇提物和水提物参与灰树花发酵能够促进灰树花的生长。

图1 不同茯苓提取物添加量对灰树花生物量的影响
Fig.1 Effect of different additions of Poria cocos extract on
the biomass of Grifola frondosa
注:**P<0.05,##P<0.05;表示与空白组(0 g/L)相比具有显著差异
2.2 不同添加量的茯苓提取物对灰树花胞外和胞内多糖产量的影响
由图2可知,不同茯苓提取物的添加比例,对灰树花胞外多糖的分泌及胞内多糖的产生具有先升高后降低的趋势。
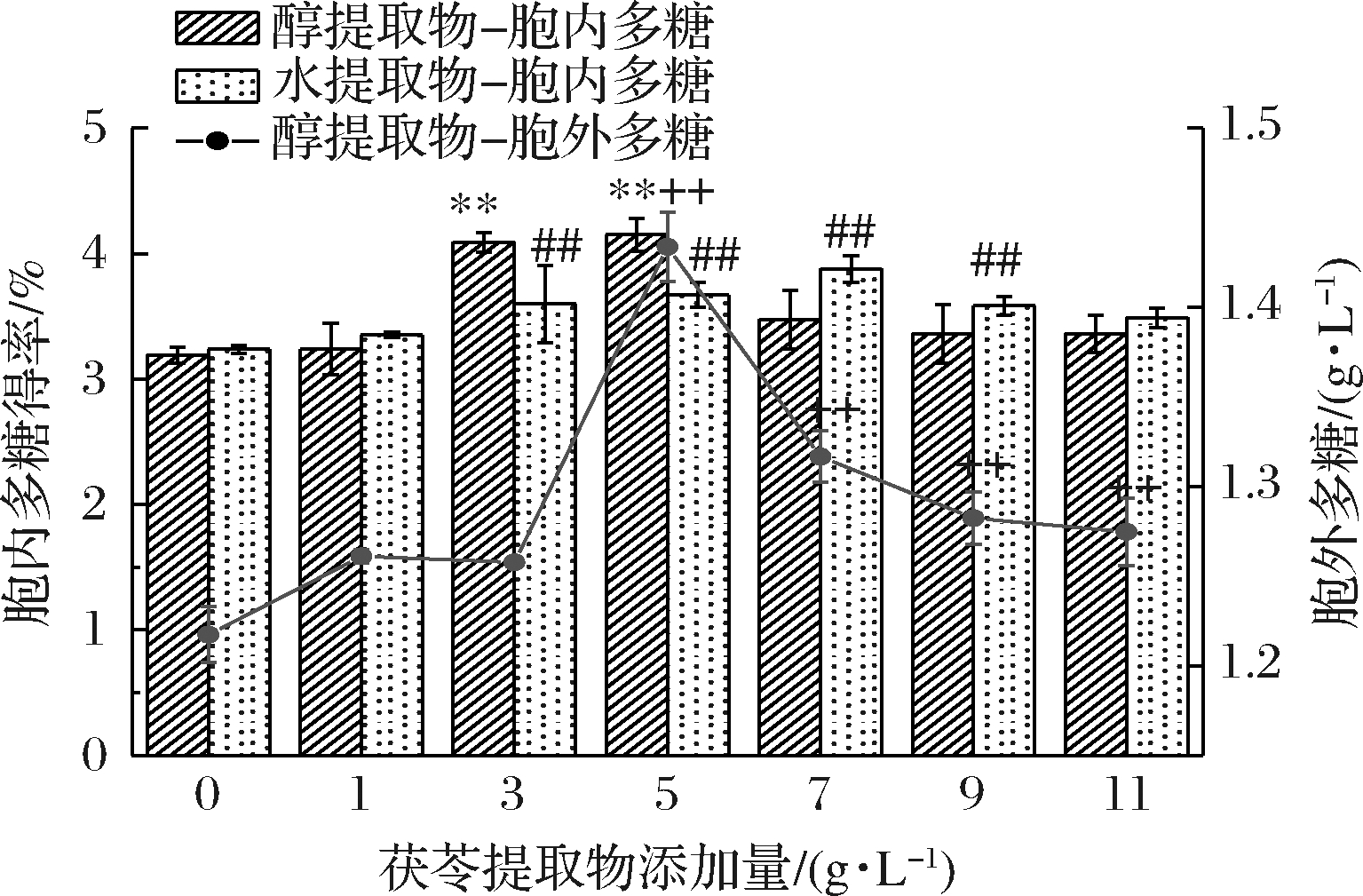
图2 不同茯苓提取物添加量对灰树花多糖产量的影响
Fig.2 Effect of different additions of Poria cocos extract on
the yield of polysaccharide of Grifola frondosa
注:**P<0.05,##P<0.05,++P<0.05,分别
表示与空白组(0 g/L)相比具有显著差异
在茯苓醇提物为5 g/L时,对灰树花胞内和胞外多糖的产生均有显著的促进作用(P<0.05),且醇提物的促进作用高于水提液,分别达到最大多糖产量[胞内(4.15±0.079)%和胞外(1.434±0.02) g/L],相较于空白组[胞内(3.19±0.066)%和胞外(1.217±0.016) g/L)]分别提高了30.09%和17.8%,多糖产量的增加可能是茯苓提取液中的某些成分影响了参与灰树花多糖合成代谢酶的活性,也可能是灰树花产生的胞外酶对提取液主要成分进行了分解,作为营养物质,提供自身生长代谢的需求。由于茯苓中含有大量的多聚糖,为了降低茯苓多糖对多糖检测造成干扰,故不把茯苓水提液作为影响胞外多糖产量的一个因素。茯苓水提物在7 g/L添加量时对胞内多糖分泌具有显著促进作用(P<0.05),胞内多糖产量为(3.88±0.106)%,与空白组(3.24±0.032)%相比提高了19.8%,所以适宜质量浓度的茯苓提取物参与灰树花发酵时,均能够促进多糖的产生,高质量浓度的茯苓提取物对其多糖产生具有抑制作用,这与本课题组的研究课题天麻参与灰树花液态发酵的促进趋势相类似[25]。
2.3 不同添加量的茯苓提取物对灰树花胞外和胞内蛋白产量的影响
由图3可知,茯苓提取物对灰树花胞外、胞内蛋白的产量均有一定的影响,与黄忠等[26]采用天麻参与灰树花发酵趋势相似。醇提物在5 g/L时与空白组相比,对其胞外和胞内蛋白产量均有最显著的促进作用(P<0.05),胞外和胞内蛋白产量分别为(55.28±0.219)mg/L和(4.597±0.172)%,相较于空白组胞内和胞外蛋白(50.03±0.006)mg/L和(4.17±0.056)%分别提高了10.49%和10.24%。水提液在添加量为7 g/L和9 g/L时,分别对胞外和胞内蛋白的产量具有显著的促进作用(P<0.05),在水提液最适添加量时,胞外和胞内蛋白的最佳产量为(55.152±0.029)mg/g和(4.536±0.029)%,相较于空白组胞内和胞外(50.026±0.014) mg/L和(4.17±0.056)%分别提高了10.24%和8.78%。总体来说,茯苓水提物促进效果略低于茯苓醇提物的效果,可能原因是茯苓里的药用活性成分更容易溶于有机溶剂,活性成分含量高于茯苓水提物。
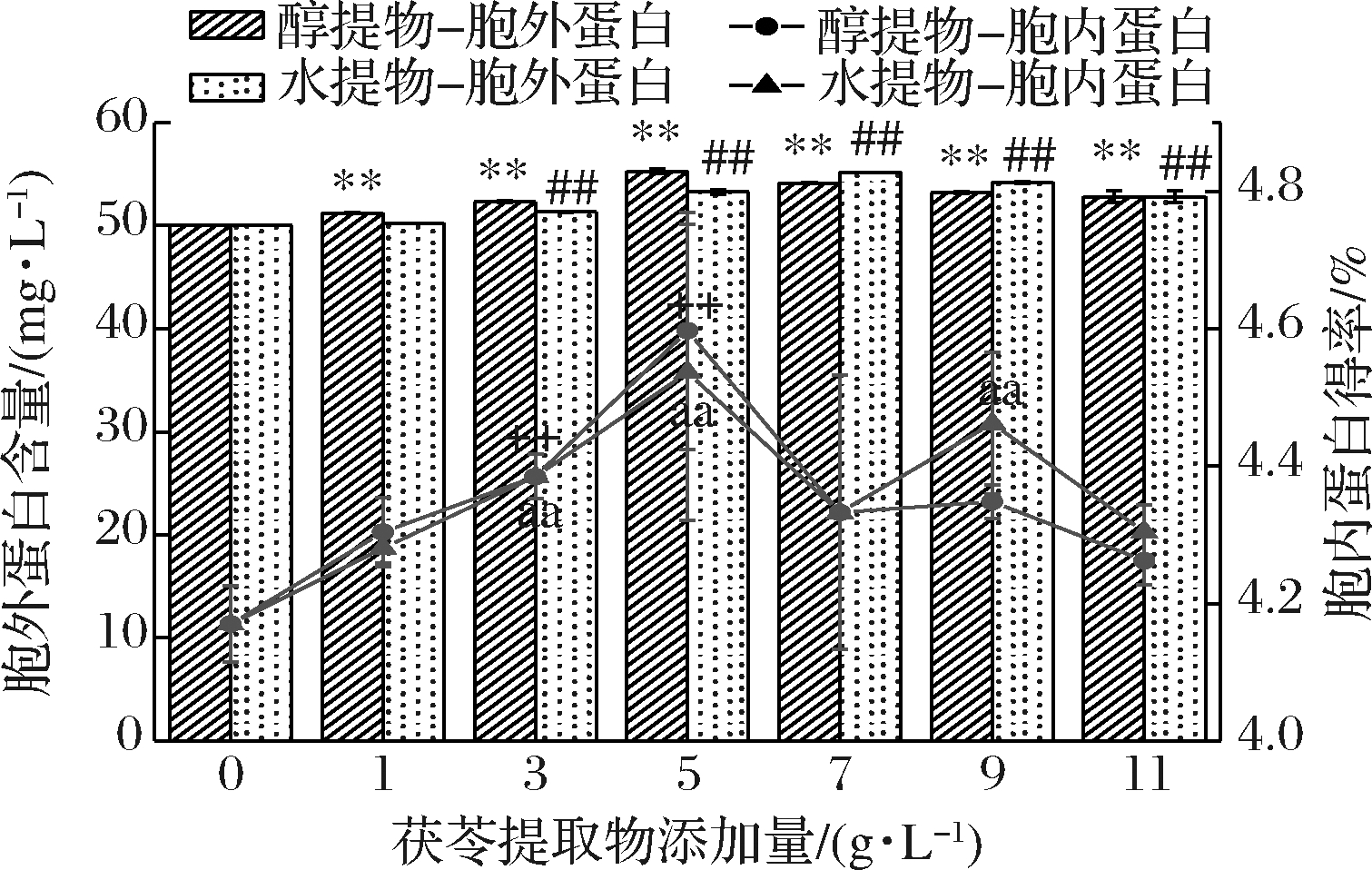
图3 不同茯苓提取物添加量对灰树花蛋白产量的影响
Fig.3 Effect of different additions of Poria cocos extract
on the yield of protein of Grifola frondosa
注:**P<0.05,##P<0.05,++P<0.05,aa P<0.05,分别
表示与空白组(0 g/L)相比具有显著差异(下同)
2.4 不同添加量的茯苓提取物对灰树花胞外和胞内总黄酮产量的影响
由图4可知,在茯苓提取物添加量在0~11 g/L范围内,对灰树花胞外和胞内总黄酮的产量均有一定的促进作用(P<0.05),且随着添加物质量浓度的升高,促进作用表现出先升高后降低的趋势。总体看来,在醇提物添加量为5 g/L时,对灰树花胞外和胞内总黄酮具有显著的促进效果(P<0.05),分别为胞外和胞内(11.279±0.473)mg/L和(2.5±0.02)%,相较于空白对照组胞外和胞内(10.413±0.278) mg/L和(2.27±0.03)%,分别提高了8.32%和10.13%。水提物在添加量为7 g/L时,对灰树花胞外和胞内总黄酮具有显著的促进作用(P<0.05),分别为胞外和胞内(10.55±0.03) mg/L和(2.47±0.01)%,相较于空白对照组胞外和胞内(10.227±0.09) mg/L和(2.26±0.07)%,分别提高了3.16%和9.29%,与醇提物在添加量为5 g/L时的促进作用相比,略低于5.16%和0.84%。
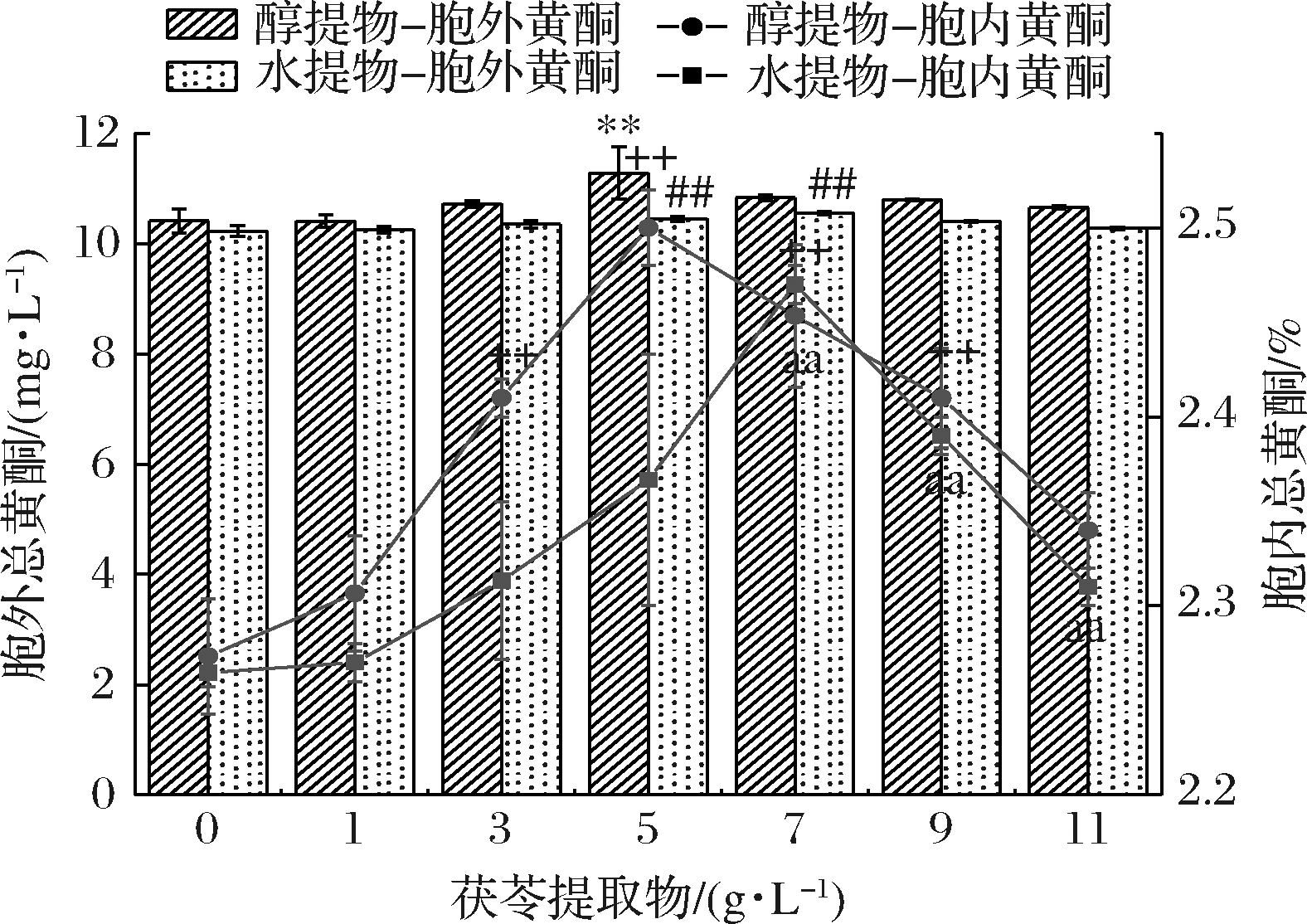
图4 不同茯苓提取物添加量对灰树花总黄酮产量的影响
Fig.4 Effect of different additions of Poria cocos extract
on the production of total flavonoids of Grifola frondosa
2.5 不同添加量的茯苓提取物对灰树花发酵液还原糖和pH的影响
由以上研究结果可知,茯苓醇提物和茯苓水提高物在添加量分别为5和7 g/L时,对灰树花生物量和胞外、胞内次级代谢产物的产量具有显著的促进作用,因此,分别选择这2种添加比例作为研究对象,对茯苓提取物参与灰树花液态深层发酵过程中发酵液中还原糖含量和pH的动态变化进行测定,可更好地反映灰树花在整个生长代谢过程中对外界营养物质吸收利用状况,为探究其代谢产物积累的条件提供一定的参考。由图5可知,在灰树花0~12 d的整个发酵过程中,发酵液的还原糖含量始终是减少的,且茯苓提取物添加组还原糖的减少速度略慢于空白对照组,可能是茯苓提取物的某些成分在其发酵过程中作为一部分碳源被菌丝吸收利用,从而减缓了发酵液中还原糖的利用。总的来看,在发酵初期(0~3 d),还原糖的降低趋势缓慢,说明在此段时间,菌丝体处于环境适应期,对葡萄糖的利用程度很小,在发酵的4~8 d,还原糖含量降低趋势加快,说明在此段时间,菌丝体处于快速生长阶段,此时是活性代谢产物积累最大的时期。在发酵的9~12 d,还原糖含量降低趋势缓慢,基本无变化,且发酵液开始变浑浊,部分菌丝体开始发生自溶现象,说明在此段时间,灰树花生长达到衰退期,对葡萄糖基本无吸收。

图5 5 g/L的茯苓提取物添加量对发酵液还原糖含量的影响
Fig.5 Effect of 5 g/L Poria cocos extract on the reducing
sugar content of fermentation broth
如图6所示,发酵液的pH变化趋势与还原糖变化趋势具有一定的相关性。原因是,灰树花利用还原糖进行自身生长代谢合成代谢产物时,通过糖酵解途径产酸(主要为乳酸、有机酸),使得发酵液酸度增大,pH值降低。外界pH通过影响细胞的膜渗透对细胞的生长代谢具有一定的影响效果[27-28],通过对灰树花发酵过程pH的动态监测,可以通过调节其发酵过程中pH值变化,更好地促进菌丝的生长和代谢产物的积累。

图6 5 g/L的茯苓提取物添加量对发酵液pH的影响
Fig.6 Effect of 5 g/L Poria cocos extract on the pH of
fermentation broth
3 结论
本实验将中药茯苓的不同溶剂提取物和不同添加比例加入到真菌灰树花的液态深层发酵液中,参与灰树花的生长代谢过程,将中药与药用真菌有机结合并探究茯苓对灰树花活性代谢产物积累的促进作用。结果表明,茯苓醇提物在5 g/L的添加比例及茯苓水提液在7 g/L的添加比例时对灰树花生物量、多糖、总黄酮、蛋白具有最显著的促进作用,其中多糖的增加率较高,而总黄酮和蛋白的增加率较低。具体为5 g/L醇提物添加条件下灰树花胞外多糖、胞内多糖、胞外黄酮、胞内黄酮、胞外蛋白、胞内蛋白与空白组相比具有显著促进作用(P<0.05),分别提高了17.8%、30.29%、8.32%、10.13%、10.49%和10.24%。7 g/L水提液添加条件下,灰树花胞内多糖、胞外黄酮、胞内黄酮、胞外蛋白、胞内蛋白与空白组相比具有显著促进作用(P<0.05),分别提高了19.8%、3.16%、9.29%、10.24%和8.78%。本文验证了茯苓提取物在适宜的添加比例下能在一定程度上促进灰树花某些活性产物的含量,为中药参与食用菌液态深层发酵促进代谢产物的产量提供理论指导,促进中医药新药制剂的创新和食用菌产业的深加工发展。后期将主要对茯苓提取物的具体化学组分参与灰树花深层发酵的机理及茯苓提取物参与灰树花发酵是否提高其代谢产物的生物活性方面进行研究。
[1] 张宗启,吴天祥,刘力萍.灰树花多糖结构特点及其生物活性研究进展[J].中国酿造,2018,37(5):10-16.
ZHANG Z Q,WU T X,LIU L P,Research progress on structural characteristics and bioactivities of polysaccharides from Grifola frondosa[J].China Brewing,2018,37(5):10-16.
[2] 季宏更,郑惠华,全卫丰,等.灰树花液体发酵及多糖提取优化研究[J].食用菌,2018,40(1):21-23;27.
JI H G,ZHENG H H,QUAN W F,et al.Research on liquid fermentation of Grifola frondosa and optimization of polysaccharide extraction[J].Edible Fungi,2018,40(1):21-23;27.
[3] 刘吉开.高等真菌中的天然产物与生物活性[C].北京:中国菌物学会2009学术年会论文摘要集,2009:2.
LIU J K,Natural products and biological activities in higher fungi[C].Beijing:Abstracts of Papers of the 2009 Academic Annual Meeting of the Chinese Society of Mycology,2009.
[4] HETLAND G,JON M T,FAIZA M,et al.Antitumor,anti-inflammatory and antiallergic effects of Agaricus blazei mushroom extract and the related medicinal basidiomycetes mushrooms,Hericium erinaceus and Grifola frondosa:A review of preclinical and clinical studies[J].Nutrients,2020,12(5):1 339.
[5] 吕旭聪,贾瑞博,李燕,等.灰树花抗氧化活性多酚的提取纯化及其鉴定[J].中国酿造,2016,35(3):74-79.
LV X C,JIA R B,LI Y,et al.Purification and identification of polyphenols with antioxidant activity from Grifola frondosa[J].China Brewing,2016,35(3):74-79.
[6] ZHANG Z Q LIU L P,LEI L,et al.Antioxidative and immunomodulatory activities of the exopolysaccharides from submerged culture of Hen of the woods or maitake culinary-medicinal mushroom,Grifola frondosa (Agaricomycetes) by addition of Rhizoma gastrodiae extract and its main components[J].International Journal of Medicinal Mushrooms,2019,21(8):825.
[7] JI H Y,YU J,CHEN X Y,et al.Extraction,optimization and bioactivities of alcohol-soluble polysaccharide from Grifola frondosa[J].Journal of Food Measurement and Characterization,2019,13(3):1 645-1 651.
[8] GUO W L,DENG J C,PAN Y Y,et al.Hypoglycemic and hypolipidemic activities of Grifola frondosa polysaccharides and their relationships with the modulation of intestinal microflora in diabetic mice induced by high-fat diet and streptozotocin[J].International Journal of Biological Macromolecules,2020,153:1 231-1 240.
[9] 周文斌,洪家丽,李路,等.灰树花中改善脂质代谢活性组分的筛选及其提取工艺优化[J].中国食品学报,2020,20(2):145-153.
ZHOU W B,HONG J L,LI L,et al.Screening of components from improving lipid metabolism in Grifola frondosa and optimization of its extraction technology[J].Journal of Chinese Institute of Food Science and Technology,2020,20(2):145-153.
[10] 朱晗,何欣,李长田.灰树花菌丝体胞内多糖对于小鼠的免疫调节作用[J].中国农业大学学报,2017,22(3):109-115.
ZHU H,HE X,LI C T.Regulating effect of intracellular polysaccharide extracted from Grifola frondosa fermentation on mice’s immune function[J].Journal of China Agricultural University,2017,22(3):109-115.
[11] 赵亮.以中药为基质的灰树花发酵工艺条件的研究[D].贵州:贵州大学,2008.
ZHAO L,Study on the fermentation process conditions of Grifola frondosa based on traditional Chinese medicine[D].Guizhou:Guizhou University,2008.
[12] 杨海龙, 吴天祥,章克昌.中药提取液对灵芝深层发酵的影响[J].微生物学报,2003(4):519-522.
YANG H L,WU T X,ZHANG K Z.Effects of extracts of Chinese medicines on Ganoderma lucidum in submerged culture[J].Acta Microbiologica Sinica,2003(4):519-522.
[13] 芦红云,吴天祥,钟敏.等.天麻提取物及其3种主要成分对灰树花产胞外漆酶和菌丝体的影响[J].食品科学,2018,39(6):101-106.
LU H Y,WU T X,ZHONG M,et al.Effect of Rhizoma gastrodiae extract and its three main components on production of laccase and mycelial biomass by submerged fermentation of Grifola frondosa[J].Food Science,2018,39(6):101-106.
[14] 刘力萍.天麻醇提成分参与灰树花发酵及其对胞外多糖降血糖能力的研究[D].贵阳:贵州大学,2019.
LIU L P.Hypoglycemic Effect of the exopolysaccharides from submerged cultural of Grifola frondosa by addition of Rhizoma gastrodiae extracts.[D].Guiyang:Guizhou University,2019.
[15] 张宗启.天麻提取物对灰树花胞外多糖理化特性、抗氧化及免疫活性影响的探究[D].贵阳:贵州大学,2019.
ZHANG Z Q.Study on the effect of Gastrodia elata extract on the physicochemical properties,antioxidant and immune activities of Grifola frondosa extracellular polysaccharide[D].Guiyang:Guizhou University,2019.
[16] 马传贵,张志秀.茯苓的中医药研究现状与临床治疗进展[J].食用菌,2020,42(4):4-8.
MA C G,ZHANG Z X,Research status and clinical treatment progress of Poria in traditional Chinese medicine[J].Edible Fungi,2020,42(4):4-8.
[17 ] 邓桃妹,彭代银,俞年军.等.茯苓化学成分和药理作用研究进展及质量标志物的预测分析[J].中草药,2020,51(10):2 703-2 717.
DENG T M,PENG D Y,YU N J,et.al.Research progress on chemical composition and pharmacological effects of Poria cocos and predictive analysis on quality markers[J].Chinese Traditional and Herbal Drugs,2020,51(10):2 703-2 717.
[18] RIOS J L.Chemical constituents and pharmacological properties of Poria cocos[J].Planta Med,2011,77(7):681-691.
[19] LI T H,HOU C C,CHANG C L T,et al.Anti-hyperglycemic properties of crude extract and triterpenes from Poria cocos[J].Evidence-Based Complementary and Alternative Medicine,2011,20(11):1-8.
[20] TIAN H,LIU Z J,PU Y W,et al.Immunomodulatory effects exerted by Poria Cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J].Biomedicine & Pharmacotherapy,2019,112.DOI:10.1016/j.biopha.2019.108709.
[21] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[22] 张永芳,原媛.微波萃取-考马斯亮蓝法提取大豆蛋白的工艺研究[J].食品工业,2018,39(9):44-48.
ZHANG Y F,YUAN Y.Study on the extraction process of soybean protein extraction-microwave assisted Kaumas Bradford method[J].The Food Industry,2018,39(9):44-48.
[23] HUANG R,ZHANG Y,SHEN S Y,et al.Antioxidant and pancreatic lipase inhibitory effects of flavonoids from different citrus peel extracts:An in vitro study[J].Food Chemistry,2020:326.DOI:10.1016/j.foodchem.2020.126785.
[24] 曾志恒,曾辉,程翊,等.双孢蘑菇发酵液还原糖和总糖的含量测定[J].中国食用菌,2018,37(6):40-43.
ZENG Z H,ZENG H,CHENG L,et al.Determination of reducing sugar and total sugar content in fermentation liquid of Agaricus bisporus[J].Edible Fungi of China,2018,37(6):40-43.
[25] 贺宗毅,吴天祥,徐晓宝.中药天麻成分对灰树花胞外多糖合成及相关关键酶的影响[J].食品科学,2013,34(11):199-202.
HE Z Y,WU T X,XU X B,Effect of Rhizoma Gastrodiae on key enzyme activities involved in the biosynthesis of exopolysaccharides from Grifola frondosa in submerged culture[J].Food Science,2013,34(11):199-202.
[26] 黄忠,吴天祥,杨祖滔,等.天麻提取物对灰树花深层发酵胞外蛋白合成的影响[J].食品与机械,2016,32(11):25-28.
HUANG Z,WU T X,YANG Z T,et,al.Effect of Gastrodia elata Bl.extracts on the biosynthesis extracellular proteins in the Grifola frondosa under submerged fermentation[J].Food & Machinery,2016,32(11):25-28.
[27] 郑永标,江枝和,雷锦桂.等.培养料pH对真姬菇生长的影响[J].食用菌,2001,23(5):9-10.
ZENG Y B,JIANG Z H,LEI J G,et al.The effect of culture medium pH on the growth of Hypsizygus mushroom[J].Edible Fungi,2001,23(5):9-10.
[28] 朱教君,许美玲,康宏樟,等.温度、pH及干旱胁迫对沙地樟子松外生菌根菌生长影响[J].生态学杂志,2005(12):1 375-1 379.
ZHU J J,XU M L,KANG H Z,et al.Effects of temperature,pH and drought stresses on ectomycorrhizal fungi growth in a Pinus sylvestris var.Mongolica plantation on sandy land[J].Chinese Journal of Ecology,2005 (12):1 375-1 379.