抗肿瘤药物在肿瘤治疗中占据重要地位,一些中药及其提取物具有明显抗癌效果。姜黄素是中药姜黄中含量最为丰富的多酚,作为抗癌药物具有很大潜力。但姜黄素水溶性较差、生物利用率低等缺点在很大程度上限制了其应用[1]。针对姜黄素的性质以及存在的问题,目前开发了许多递送系统来荷载姜黄素以提高其稳定性,其中使用最为广泛的是乳液体系[2]。由各种成分和加工条件形成的乳液具有广泛的物理和化学特性,一些合成乳化剂本身具有毒性,出于安全健康考虑,已逐渐被天然乳化剂取代[3]。乳清蛋白作为一种重要的食品成分,由于其高营养、广泛获得、易于消化和吸收的特性而被广泛用于食品工业,是最有希望的天然乳化剂候选者。
蛋白质位于界面处并在液滴之间产生静电相互作用和空间位阻,从而使乳液系统稳定。研究表明,通过添加多糖可进一步提高蛋白质乳液的稳定性[4]。XU等[5]利用酪蛋白和大豆多糖制得乳化稳定剂用于负载姜黄素,提高了乳液的物理和化学稳定性。ZHANG等[6]采用阿拉伯胶改善了白藜芦醇在油水界面的封装及其在乳液中的稳定性。SHAO等[7]研究发现油水界面处的乳清蛋白/阿拉伯树胶相互作用提高了乳液的稳定性和对白藜芦醇的包封。
目前,添加多糖的主要目的是增加乳液的稳定性。但是,通过添加生物活性多糖,可以在提高稳定性的同时利用多糖本身的生物活性丰富乳化剂的功能性质[8]。如提高乳清蛋白的乳化能力,可以利用其自身抗氧化活性等性质进一步增加乳液稳定性,还可以与荷载的活性成分共同发挥功能作用等。在先前的研究中,我们发现铁皮石斛多糖表现出良好的抗氧化、降血糖、抗肿瘤、增强免疫力等多种药理作用。并且据报道,降低多糖分子质量可以进一步提高生物活性多糖的活性和稳定乳液的能力[9-10]。因此,本项研究的主要目的是确定通过酶解得到的低分子质量的铁皮石斛多糖对乳清蛋白的乳化特性和对姜黄素乳液的其他功能特性的作用。
1 材料与方法
1.1 材料与仪器
乳清蛋白(whey protein, WP)、中链甘油三酯(medium chain triglycerides, MCT)、姜黄素(curcumin, Cur)、改良伊格尔培养基(dulbecco’s modified eagle medium, DMEM培养基)、胎牛血清(fetal bovine serum, FBS),美国Gibco公司;低分子质量铁皮石斛多糖(low-molecular-weight Dendrobium officinale polysaccharide, LDOP),自制;胃蛋白酶、磷酸二氢钾、胰酶、胆汁盐、pH 7.4磷酸缓冲盐溶液(phosphate buffer saline,PBS)、噻唑兰(thiazolyl blue tetrazolium bromide, MTT)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、青霉素、链霉素、非必须氨基酸(nonessential amino acid, NEAA)、二甲基亚砜(dimethyl sulfoxide, DMSO)、氯仿、盐酸、NaOH、NaCl,上海阿拉丁生化科技股份有限公司;人结直肠腺癌细胞(Caco-2),中科院上海细胞库。
高速剪切机(T10 basic型),德国IKA公司;高压均质机(NS100L型),意大利GEA-Niro公司;紫外灯(xpr-2251112型),涿州旭普瑞公司;流变仪(MCR52型),奥地利Anton Paar公司;视频光学接触角测量仪(OCA15EC型),德国Dataphysics公司;旋转蒸发仪(RE-2000A型),上海亚荣生化仪器厂;细胞培养箱(LHH.CP-100型),上海印溪仪器仪表有限公司;振荡培养箱(BS-1E型),苏州威尔实验用品有限公司;酶标仪(Multiskan FC型),美国Thermo公司;光学显微镜(Axiovert 25 CFL型),北京瑞科中仪科技有限公司;pH计(FE28型),梅特勒-托利多精密仪器制造公司;高速冷冻台式离心机(Bechman Allegra型),日本Hitachi公司;紫外-可见光分光光度计(N4型),上海棱光技术有限公司;色谱柱(WATERS Ultrahydrogel),美国Waters公司;真空冷冻干燥机(BTP-3XL型),美国Virtis 公司。
1.2 实验方法
1.2.1 铁皮石斛粗多糖的提取
铁皮石斛干条粉碎后过80目筛,加入4倍体积的95%乙醇浸泡12 h后离心沉淀风干得到铁皮石斛脱脂粉末。每50 g脱脂粉末和1 000 g的去离子水混合,100 ℃下提取3 h;离心后收集上清液,用旋转蒸发仪将提取液浓缩后定容至50 mL。向提取液中加入95%乙醇,最终使得提取液中的乙醇体积分数为80%。放置过夜后,离心(8 000 r/min,10 min),收集沉淀。沉淀复溶于水后旋蒸去除残留乙醇。冷冻干燥后得到铁皮石斛粗多糖(Dendrobium officinale polysaccharide,DOP),分子质量为1.53×105 Da。
1.2.2 铁皮石斛粗多糖的酶解
DOP按1∶50(g∶mL)的比例溶解在pH=4.7的乙酸-乙酸钠缓冲液中。以3∶1的质量比将糖化酶和纤维素酶混合加入溶液中,使得总酶活性为180 U/mL。溶液在50 ℃下搅拌2 h后加热终止反应,离心去除沉淀,上清液透析48 h(截留分子质量为8 000 Da),冷冻干燥后获得LDOP,经测量多糖分子质量为4.23×104 Da。
1.2.3 多糖流变特征测定
使用流变仪进行乳液的动态流变性能的测量。配制质量分数为1%的DOP和LDOP溶液,将新鲜的溶液均匀分散在板上,并在测试前静置10 min,以使仪器和系统达到平衡。两块板之间的间隔设置为1 mm。为了测定乳液的储能模量(G′)和损耗模量(G″),将频率设定为0.1~100 Hz。将实验温度控制在25 ℃。
1.2.4 多糖乳化特性测定
使用视频光学接触角测量仪对多糖在油-水界面的动态界面张力进行测试。在测试之前,制备多糖质量分数为0.1%的溶液,然后用针管吸入溶液,等待溶液温度达到25 ℃。在测试过程中,尖端将该针头插入到下面的玻璃容器的MCT中,并将一滴溶液送入油中并悬浮在针头上10 800 s。摄像机系统立即连续拍摄液滴的形状图像,软件通过分析液滴的形状获得界面张力的检测结果。
1.2.5 乳液的制备
配制质量分数分别4% WP和2% LDOP水溶液。搅拌2 h后分别在4 ℃储存12 h。将储备溶液以一定的比例混合,以制备WP/LDOP混合液,其中WP的质量分数为1%,LDOP质量分数分别为0%、0.1%、0.2%、0.3%和0.4%。将WP或WP/LDOP混合溶液与MCT以9∶1的质量比混合,将pH调节到7.0,高速剪切(10 000 r/min,1 min)得到粗乳液,粗乳液在50 MPa的压力下均质2次得到稳定的乳液。
1.2.6 乳液粒径的测量
乳液的流体动力学直径(DH)由动态光散射激光粒度仪测量。设置散射相位折射率为1.590,所有数据通过系统测量3次。试验前,用去离子水将样品稀释100倍。
1.2.7 乳液电位的测量
乳状液的Zeta电位测量使用先前描述的粒度分析仪的PALS-Zeta电位测量模式。仪器平衡10 min,样品在25 ℃下测量,所有数据通过系统测量3次。试验前,用去离子水将乳液稀释100倍。
1.2.8 乳化稳定性测定
取等量的乳液,放入30 mL的玻璃瓶中,密封后在4 ℃的冰箱中放置12 d。乳状液在贮存过程中分层,上层为不透明的“乳膏层”,下层为透明的“水析层”。乳液的乳化分层程度用乳化分层指数(creaming index,CI)表示,并按公式(1)计算:
(1)
式中:Hs,水析层的高度,mm;He,乳液的总高度,mm。
1.2.9 荷载姜黄素的乳液制备
制备质量分数4% WP和最佳质量分数的LDOP溶液,储存在4 ℃的冰箱中。12 h后取出,并以一定的比例混合,以制备WP/LDOP混合,其中WP的质量分数为1%,LDOP质量分数分别为0和本实验得出的稳定性最好的LDOP质量分数值,将pH调节到7.0。称取适量的姜黄素,溶解在MCT中,得到含量为2 mg/mL的姜黄素乳液。将WP和WP/LDOP混合液与姜黄素乳液以9∶1的质量比混合,高速剪切、高压均质后得到稳定的乳液,分别记为WP-Cur和WP/LDOP-Cur,不含姜黄素的乳液记为WP/LDOP。
1.2.10 乳液中姜黄素含量的测定
取适量乳液和甲醇混合破乳,然后使用高速离心机10 000 r/min条件下离心 10 min,取上清液旋干,加入5 mL氯仿溶解,检测其在418 nm处的吸光度值。根据所绘制姜黄素标准曲线Y=0.126 5X-0.039 5 (R2=0.994 4),计算得到姜黄素的含量。
1.2.11 乳液中姜黄素的抗辐照能力研究
将乳液样品和含有2 mg/mL姜黄素的MCT置于透明玻璃瓶中密封,放在紫外灯下照射,并在0.5、1、1.5、2、2.5、3、3.5、4 h时检测其中姜黄素含量。
1.2.12 乳液中姜黄素的抗氧化能力研究
将乳液样品和含有2 mg/mL姜黄素的MCT置于透明玻璃瓶中,不加盖,在25 ℃的黑暗环境中进行氧化实验。在第1、3、5、7、9、11、13、15和17天分别检测其中姜黄素的含量。
1.2.13 细胞毒性实验
(1)细胞培养。Caco-2细胞用含15%FBS的DMEM培养基培养,并在上述培养基中添加1% NEAA,100 U/mL青霉素和 100 μg/mL链霉素,细胞培养箱中恒温37 ℃,通入5% CO2,以1∶4传代。
(2)样品配制。考察乳液系统对癌细胞活力的抑制效果, 各组均使用培养基进行稀释,使姜黄素含量为20 μg/mL。
(3)细胞毒性测定。将Caco-2细胞接种于96孔培养板中使其贴壁过夜,加入200 μL各组样品,置于37 ℃、5% CO2细胞培养箱中培养,然后分别在24、48、72 h采用MTT法检测细胞活力。每个样品重复3次实验。
细胞活力![]()
(2)
式中:At是空白培养基吸光值;Ac是其他各组吸光值。
1.2.14 乳液的体外消化
本研究通过体外消化实验模拟乳液在人体胃肠道内的消化过程,考察姜黄素在胃、肠中的释放。
(1)模拟胃消化。将20 mL乳液与相同体积的人工胃液混合[11],置于 37 ℃恒温摇床中持续振荡2 h,转速为 95 r/min。在0.5、1、1.5、2 h时分别取样,使用光学显微镜观察乳液液滴形态。与此同时,将消化液在离心机中以 10 000 r/min离心分离10 min,移取上清液并记录体积。取5 mL 上清液和5 mL 氯仿,涡旋混合 1 min,离心后收集氯仿层。水层再用 5 mL氯仿提取,离心分离后合并氯仿层,测定姜黄素的含量。
(2)模拟肠消化。用NaOH溶液将胃消化物的pH调节至6.8,再将胃消化物和肠液以等体积混合,后续操作与模拟胃消化步骤相同,测定姜黄素的含量。
1.2.15 乳液的微观形态观察
乳液微观形态使用光学显微镜观察,观察前用吸管吸取少量样品,滴在载玻片上,盖上盖玻片,吸去多余乳液,在20倍物镜下观察形态。微观图像使用与系统连接的相机记录。
1.2.16 数据与分析
所有测试平行3次进行,采用 Origin 9.0 对实验结果作图分析,数据均以平均值±标准偏差形式表示,采用 SPSS 19.0统计软件进行数据分析。采用单因素方差分析(One-way ANOVA)进行多组平均值之间的显著性分析,P<0.05为差异显著有统计学意义。
2 结果与讨论
2.1 DOP和LDOP的流变学特性
多糖的流变学特征在图1中展示,模量G′和G″在0.01~100 Hz的振荡频率范围内总体呈增加趋势。在较低的频率下,多糖样品的储能模量G″高于弹性模量G′,表明多糖样品显示出更强的黏度特性。DOP和LDOP的储能模量和损耗模量的变化趋势是一致的,说明酶解不会改变DOP的流变学特征,但是从图1看出,LDOP的G′高于DOP,然而G″低于DOP。这表明酶解降低了多糖的黏性,增强了多糖的弹性。

a-G′;b-G″
图1 多糖的流变学特征
Fig.1 Rheological characteristics of polysaccharides
2.2 DOP和LDOP的乳化特性
为了判断LDOP和DOP相比是否更适用于乳化体系,本研究采用测量多糖在油-水界面的界面压力随时间的变化判断其乳化活性。由图2可知,从0~1 800 s,DOP的界面压力由4.4 mN/m上升至6.91 mN/m;LDOP的界面压力则从7.87 mN/m上升至11.43 mN/m。由此可见,LDOP界面压力随着时间变化增速更快,多糖分子能够快速吸附至油-水界面,这是由于较低分子质量的多糖链较短,不易受到分子链缠结的影响。最终,LDOP的界面压力远高于DOP的界面压力,证明酶解降低多糖分子质量能显著改善其乳化活性使其顺利吸附至油-水界面。

图2 多糖界面压力的变化
Fig.2 Changes of interfacial pressure of polysaccharides
2.3 DOP和LDOP含量对乳液包封率、粒径、电位和乳化分层率的影响
以不同含量DOP和LDOP与1%WP制备乳液,对其乳化能力进行分析。表1测试结果显示,乳液包封率均在70%以上,粒径在207~239 nm,所有乳液电位的绝对值均高于30 mV,这些结果表明乳液稳定性较强,并且从综合结果可以看出,DOP和 LDOP的加入均可改善乳液稳定性,可能归因于在pH=7时蛋白质和铁皮石斛多糖表面均带有负电荷,因此铁皮石斛多糖上的阴离子基团吸附到蛋白质的阳离子基团上,从而在液滴表面提供静电斥力和空间位阻[12]。铁皮石斛多糖酶解后的总体稳定性高于未酶解组,可能是由于酶解后多糖分子质量降低,移动速度高于高分子质量的多糖,能更快与油滴结合,从而降低表面张力,并且分子量低的多糖表面负电荷降低,静电作用和空间位阻也相应降低。从乳化分层率的测试结果可以看到所有样品均发生分层现象,并且所有浓度的DOP和LDOP都不能完全抑制乳液的不稳定性,只能在一定程度上改善乳液的稳定性。根据表1的结果,不含LDOP的乳液和含有0.4% LDOP的乳液分层最明显,水析层高度达到总高度的36%以上,这2个样品的粒径较大且电位绝对值较低,故稳定性最差;DOP和LDOP组中质量分数为0.2% 时在改善乳液稳定性方面具有最佳效果。因此选取0.2% LDOP与1%WP用于后续实验。
表1 含有不同浓度的DOP和LDOP的乳液的包封率、
粒径、ζ-电位和乳化分层率
Table 1 Encapsulation rate, particle size, zeta-potential
and emulsification delamination rate of emulsions
containing different concentrations of DOP and LDOP
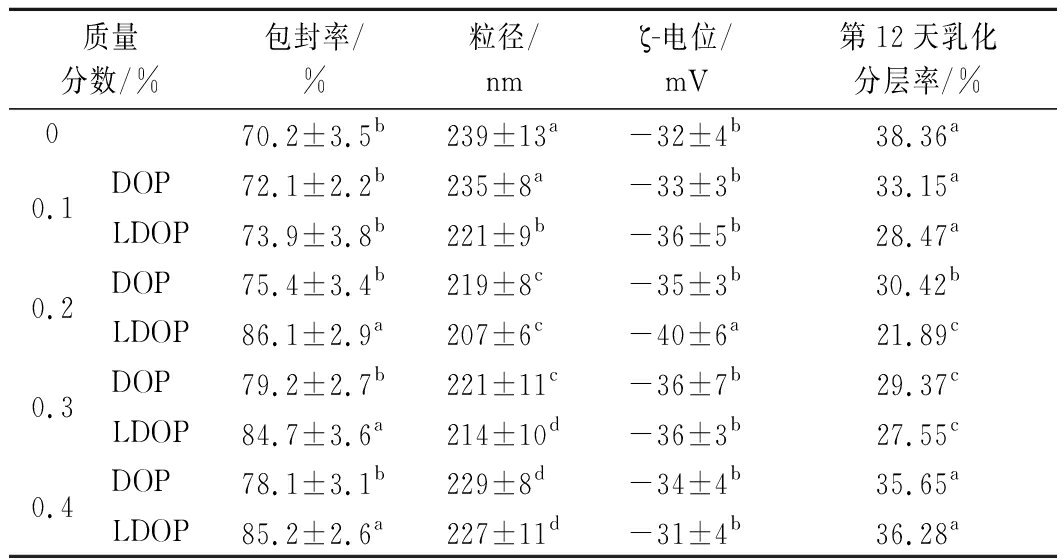
质量分数/%包封率/%粒径/nmζ-电位/mV第12天乳化分层率/%070.2±3.5b239±13a-32±4b38.36a0.1DOP72.1±2.2b235±8a-33±3b33.15aLDOP73.9±3.8b221±9b-36±5b28.47a0.2DOP75.4±3.4b219±8c-35±3b30.42bLDOP86.1±2.9a207±6c-40±6a21.89c0.3DOP79.2±2.7b221±11c-36±7b29.37cLDOP84.7±3.6a214±10d-36±3b27.55c0.4DOP78.1±3.1b229±8d-34±4b35.65aLDOP85.2±2.6a227±11d-31±4b36.28a
注:同一列的不同小写字母表示数值差异显著(P<0.05)
2.4 乳液的抗辐照和抗氧化能力
乳液作为递送姜黄素的系统,除了提高姜黄素在人体的利用率,还应考察其对姜黄素的保护作用[13]。鉴于荷载姜黄素的乳液在存放过程中可能受到紫外线和氧气的影响[14],故对样品进行了紫外线照射实验和氧化实验,以考察乳液体系对姜黄素的保护效果。如图3-a所示,仅将姜黄素溶解在MCT中时无任何保护,直接暴露在紫外光下,可获得大量降解所需能量[15],最不稳定,4 h后姜黄素的含量就下降至原本的54.4%。乳液中的姜黄素损失相对较少,尤其是WP/LDOP组在4 h后姜黄素含量仅下降了18.4%。这是因为大部分姜黄素溶解在油中,液滴表面由蛋白质和多糖包裹, LDOP促进WP在油-水界面的吸附,使得界面层增厚,减缓了由紫外线引起的姜黄素降解。但与此同时,部分存在于液滴油-水界面或者处于分散状态的姜黄素极易分解,会造成部分损失[16]。
氧化实验的结果如图3-b所示,随时间推移,溶解在MCT中的姜黄素降解速度很快,被乳液包封的姜黄素也存在一定损失,但损失速度有减缓的趋势。不同乳液姜黄素的最终保留率不同。仅由WP包封的乳液保留率为68.1%,含有DOP的乳液保留率为71.2%,含有LDOP的乳液保留率为76.9%。
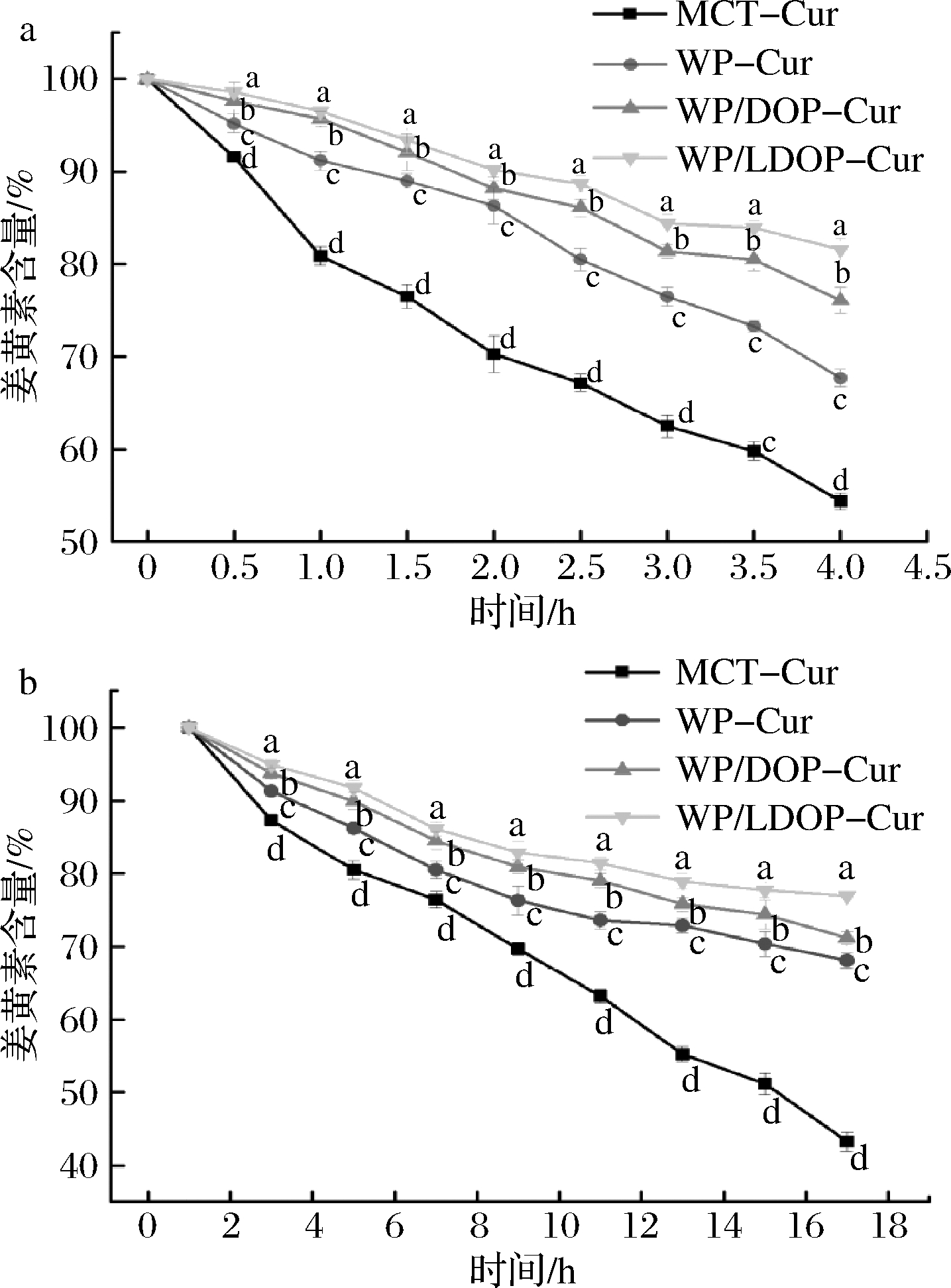
a-紫外照射;b-氧化
图3 样品分别经紫外线照射和氧化实验后姜黄素的含量
Fig.3 Curcumin content of the sample after UV irradiation and
oxidation test
注:不同小写字母表示差异性显著(P<0.05)(下同)
实验得出这样的结果可能是由于铁皮石斛多糖酶解前后均能够清除引发姜黄素降解的自由基或能够通过向姜黄素自由基提供更多的质子来再生姜黄素,最终保护作用得到增强[17];另外,DOP和LDOP分子能促进WP在界面的吸附,使得界面层厚度增加,从而液滴更加稳定[18]。而LDOP的抗氧化活性及促进吸附能力较DOP更强,故姜黄素保留率更高。17 d后,姜黄素降解过程持续,这是因为:(1)姜黄素具有由两侧均带有芳环的脂肪族链组成的疏水性骨架[19],且具有连接的极性基团,使分子具有两亲性而更易吸附到油-水界面;(2)氧化降解和水解反应可能在油水界面同时发生,导致一些相对亲水的降解产物移入水相[20],而更多的姜黄素分子为了恢复平衡则从油相迁移到界面。
2.5 乳液的抑制癌细胞生长能力
从图4的细胞毒性实验结果可以看出,所有样品处理的细胞活力均随时间变化呈下降趋势,DOP、LDOP和姜黄素均有抑制癌细胞增殖的能力[21],但DOP和LDOP对Caco-2的抑制作用有限。与荷载了姜黄素的乳液相比,未被包封的姜黄素组在24 h之内具有较强的细胞毒性,72 h后毒性减弱,这可能是因为初始阶段溶解在DMSO中的大量姜黄素通过简单的扩散直接被细胞吸收从而较快抑制了细胞增殖,而乳液系统中较多被包封在油相的姜黄素进入细胞内部发挥作用需要一个过程[22],后期包封则促进了细胞对姜黄素的摄取。72 h后WP/LDOP-Cur组细胞活力下降至27.4%,低于WP-Cur系统。这可能有3种解释:(1)WP/LDOP混合物提高了姜黄素稳定性,故姜黄素在细胞培养的过程中不易受环境影响而降解,从而提升了其抗癌效率;(2)LDOP具备抗癌活性[23],和姜黄素起到了共同抑制癌细胞生长的作用;(3)WP/LDOP-Cur系统较高的包封效率也可能是提高癌细胞抑制率的影响因素。
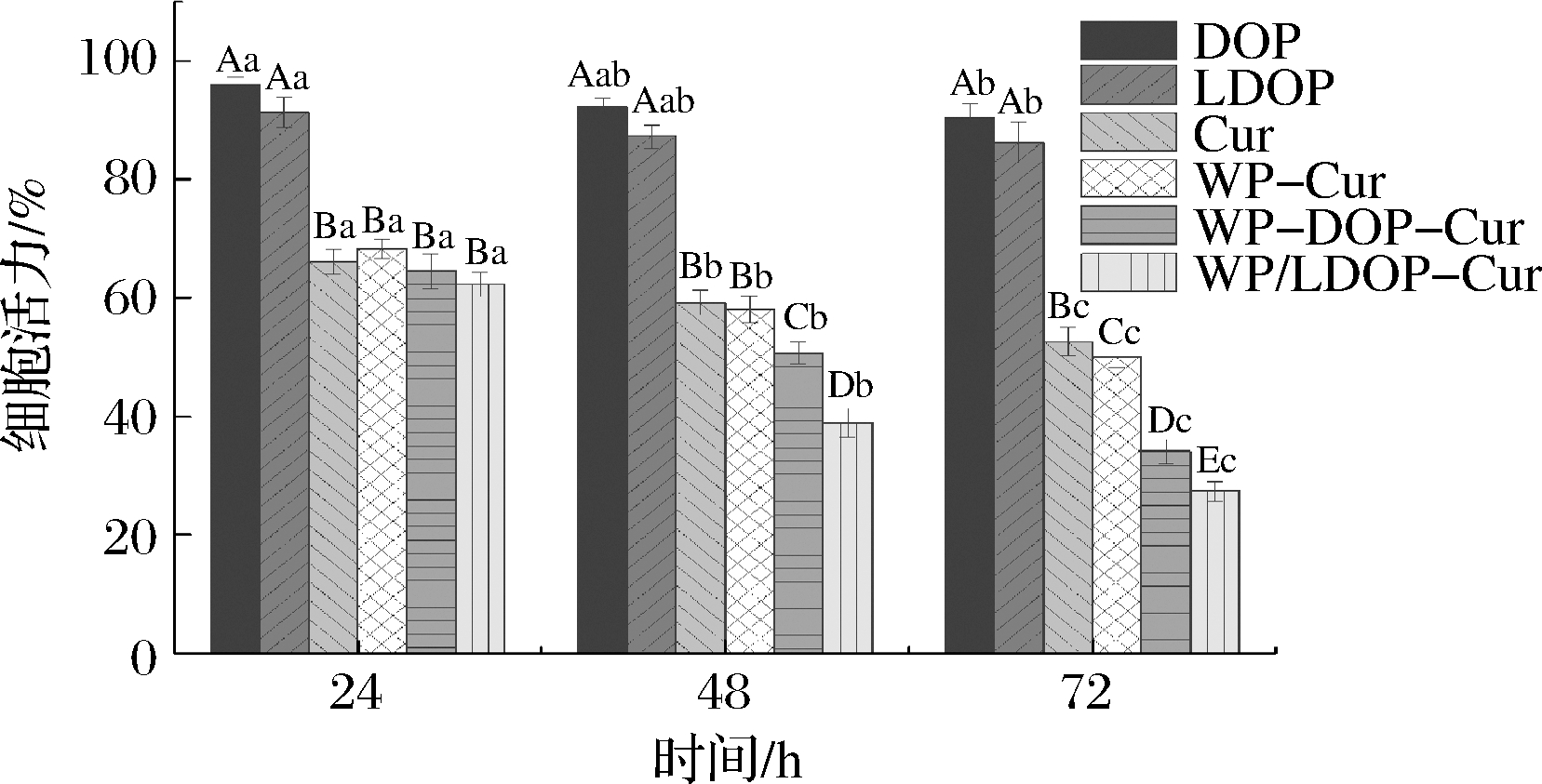
图4 Caco-2 细胞毒性实验
Fig.4 Cytotoxic experiment of Caco-2
2.6 乳液在胃、肠道稳定性研究
LDOP和WP形成的紧密界面膜的保护可能会使降低姜黄素的释放率,为了考察LDOP的加入是否会影响姜黄素在胃肠道的消化,通过体外消化实验模拟乳液在人体胃肠道内的消化过程,考察姜黄素在胃、肠中的释放。实验结果如图5所示,在胃液中2 h时,姜黄素释放率不足15%,进入肠液后,释放率显著上升,这是由于在肠消化液的pH值条件下,胰酶带正电荷, WP和LDOP所带负电荷可通过静电吸引吸附并富集在液滴表面,从而提高胰蛋白酶的水解效率[24]。可能是由于酶浓度不足的缘故,3 h后姜黄素的释放率逐渐减缓。并且最终可能由于LDOP的存在限制了脂肪酶和胆盐在脂质液滴表面反应的途径,抑制了胶束的形成,姜黄素仍保留在未消化的液滴中;或是由于LDOP与释放的姜黄素的结合导致致密分子复合物的形成[25-26]。
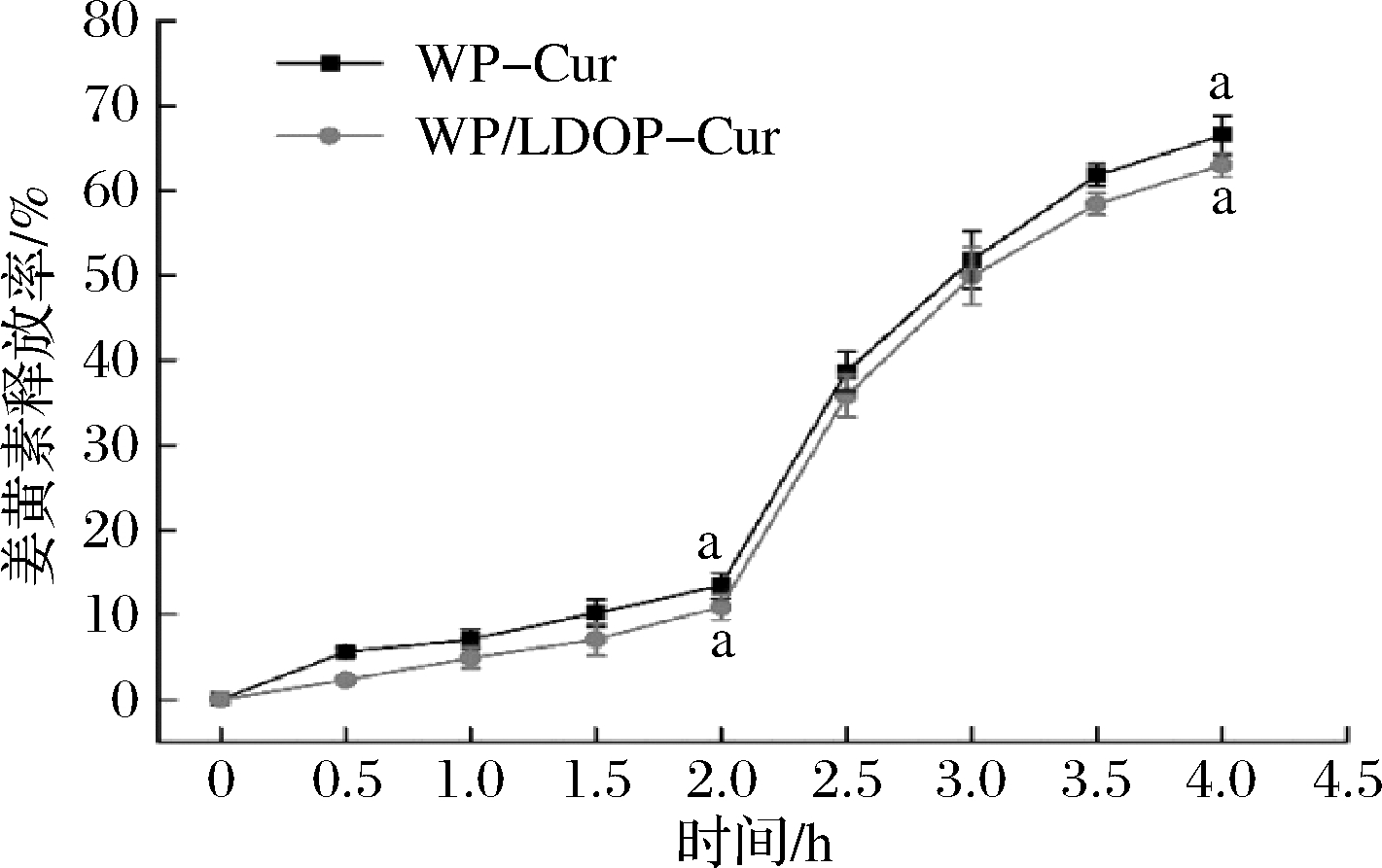
图5 姜黄素在体外消化过程中的释放
Fig.5 Curcumin release during in vitro digestion
总体而言,由WP/LDOP稳定的乳液中姜黄素释放率略低于由WP稳定的乳液,但对姜黄素在胃肠道的消化无显著影响,不会影响姜黄素的吸收利用。
从图6-a的胃液消化图来看,乳液初始有少量聚集和絮凝[27],且经胃蛋白酶消化后,聚集仍不明显。可能是胃蛋白酶对WP的水解有限,这也解释了姜黄素在胃消化过程中较少释放的原因。进入肠液0.5 h后,出现一些较大的液滴,明显发生聚集,证明部分WP被消化使得油滴进入到消化液中。随时间变化,更多更大的油滴出现,小油滴减少,脂质水解的速率和程度减小,暴露于脂肪酶的油滴的界面面积更小[28-29]。含有LDOP的乳液中油滴相对较小且数量更多,可能是由于LDOP的添加改变了水相的流动性并阻碍了胰酶进入油滴,油滴需要很长时间才能被胰酶水解[30]。从最终的结果来看,两种乳液姜黄素的释放率相差不大,LDOP不会对乳液中姜黄素的生物利用产生较大负面影响。

a-胃液消化;b-肠液消化
图6 乳液在胃液和肠液消化的微观图
Fig.6 Micrograph of emulsion digestion in gastric juice and intestinal juice
3 结论
本研究利用乳清蛋白和低分子质量铁皮石斛多糖作为乳化系统制备包封姜黄素的乳液,比较了铁皮石斛酶解多糖的加入对乳清蛋白稳定的姜黄素乳液的功能特性的影响。结果表明,LDOP的G′高于DOP, G″低于DOP,说明酶解降低了DOP的黏性,增强了DOP的弹性。油-水界面压力随时间的变化结果表明,酶解后的多糖因分子质量较低,能更快吸附至油-水界面,因此LDOP更具备在乳液中的应用潜力。各组相比,含有质量分数为0.2%的低分子质量铁皮石斛多糖的乳液体系稳定性最佳;含有低分子质量铁皮石斛的乳液保护姜黄素不被紫外线和氧气破坏的能力最强;和其他系统相比,可显著提高姜黄素抑制Caco-2细胞增殖的能力;模拟胃肠消化的结果证明,乳液包封使得姜黄素在胃部的释放较少,但在肠道中可以大量释放,铁皮石斛酶解多糖的加入不会影响姜黄素的吸收利用。因此,低分子质量铁皮石斛多糖可提高乳清蛋白稳定的荷载姜黄素的乳液的稳定性及抗癌活性,乳清蛋白/低分子质量铁皮石斛多糖混合物制备的乳液能够成为递送疏水抗癌药物姜黄素的适宜系统。此研究进一步扩大了铁皮石斛多糖在食品体系中的应用范围,为铁皮石斛多糖在食品领域中的应用提供了理论依据。
[1] SALEM M,ROHANI S,GILLIES E R.Curcumin,a promising anti-cancer therapeutic:A review of its chemical properties,bioactivity and approaches to cancer cell delivery[J].Rsc Advances,2014,4(21):10 815.
[2] 陶慧,余楚钦,黄劲恒,等.姜黄素的增溶及稳定性研究[J].食品与发酵工业,2016,42(8):160-165.
TAO H,YU C X,HUANG J H,et al.Study on the solubilization and stability of curcumin[J].Food and Fermentation Industries,2016,42(8):160-165.
[3] SHAO P,FENG J,SUN P L,et al.Recent advances in improving stability of food emulsion by plant polysaccharides[J].Food Research International,2020:109 376.
[4] DICKINSON E.Mixed biopolymers at interfaces:Competitive adsorption and multilayer structures[J].Food Hydrocolloids,2011,25(8):1 966-1 983.
[5] XU G R,WANG C N,YAO P.Stable emulsion produced from casein and soy polysaccharide compacted complex for protection and oral delivery of curcumin[J].Food Hydrocolloids,2017,71(8):108-117.
[6] HAI X Z,QI F,DI L,et al.Impact of gum Arabic on the partition and stability of resveratrol in sunflower oil emulsions stabilized by whey protein isolate[J].Colloids and Surfaces B:Biointerfaces,2019,181:749-755.
[7] PING S,JIE R F,PEI L S,et al.Improved emulsion stability and resveratrol encapsulation by whey protein/gum arabic interaction at oil-water interface[J].International Journal of Biological Macromolecules,2019,133:466-472.
[8] ZHANG R Y,BELWAL T,LI L,et al.Recent advances in polysaccharides stabilized emulsions for encapsulation and delivery of bioactive food ingredients:A review[J].Carbohydrate Polymers,2020:116 388.
[9] GARTI N,LESER M E.Emulsification properties of hydrocolloids[J].Polymers for Advanced Technologies,2001,12(1-2):123-135.
[10] 王丹,袁永俊,谭青云,等.铁皮石斛发酵前后主要成分、活性和多糖分子量的变化[J].包装与食品机械,2019,37(5):27-31.
WANG D,YUAN Y J,et al.Changes of dendrobium Offcinale Kimura et migo in main components,activities and molecular weight of polysaccharides before and after fermentation[J].Packaging and Food Machinery,2019,37(5):27-31.
[11] CHUNG H S,TOIVONEN P,MOON K D,Effect of Modified atmosphere packaging in microperforated film on maintenance of the quality of fresh-cut apples[J].L’antiquité Classique,2008,15(3):398.
[12] BOONLAO N,SHRESTHA S,SADIQ M B,et al.Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J].Journal of Food Engineering,2019,272:109 859.
[13] JI L,XUE Y,ZHANG T,et al.The effects of microwave processing on the structure and various quality parameters of Alaska pollock surimi protein-polysaccharide gels[J].Food Hydrocolloids,2017,63(12):77-84.
[14] 刘彬,赵莹,于思礼,等.微生物代谢工程发酵姜黄素研究进展[J].食品与发酵工业,2016,42(7):260-264;272.
LIU B,ZHAO Y,YU S L,et al.Research progress on fermentation of curcumin by microbial metabolism engineering[J].Food and Fermentation Industries,2016,42(7):260-264;272.
[15] 王永辉,杨晓泉,王金梅,等.蛋白水解物及多糖负载姜黄素制备纳米颗粒及其稳定性[J].农业工程学报,2015,31(10):296-302.
WANG Y H,YANG X Q,WANG J M,et al.Preparation of curcumin nanoparticles by protein hydrolysates and polysaccharids and its stabilization[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(10):296-302.
[16] MAHESH,KHARAT,ZHE Yuan,et al.Physical and chemical stability of curcumin in aqueous solutions and emulsions:Impact of pH,temperature,and molecular nnvironment[J].Journal of Agricultural & Food Chemistry,2016,65(8):1 525-1 532.
[17] MALIK P,AMETA R K,SINGH M.Preparation and characterization of bionanoemulsions for improving and modulating the antioxidant efficacy of natural phenolic antioxidant curcumin[J].Chemico-Biological Interactions,2014,222:77-86.
[18] 瞿瑗,侯晓艳,黎杉珊,等.魔芋葡甘露聚糖对酶解青花椒籽仁谷蛋白乳液稳定性的影响[J].食品与发酵工业,2019,45(1):113-118.
QU A,HOU X Y,LI S S,et al.Effect of Konjac Glucomannan on the stability of enzymatic hydrolysis of green pepper seed kernel glutenin emulsion[J].Food and Fermentation Industries,2019,45(1):113-118.
[19] WANG X N,IP M,LEUNG A W,et al.Sonodynamic inactivation of methicillin-resistant Staphylococcus aureus in planktonic condition by curcumin under ultrasound sonication[J].Ultrasonics,2014,54(8):2 109-2 114.
[20] SHARMA CP,KAMALASANAN K,DEEPA M K,et al.Supramolecular curcumin-barium prodrugs for formulating with ceramic particles[J].Colloids and Surfaces,B.Biointerfaces,2014,122:301-308.
[21] 鲍素华,查学强,郝杰,等.不同分子量铁皮石斛多糖体外抗氧化活性研究[J].食品科学,2009,30(21):118-122.
BAO S H,ZHA X Q,HAO J,et al.In vitro antioxidant activity of polysaccharides with different molecular weights from Dendrobium candidum[J].Food Science,2009,30(21):118-122.
[22] 刘冰雪.纳米粒子稳定Pickering乳液的机制及提高难溶药物生物利用率的研究[D].北京:北京化工大学,2018.
LIU B X.The mechanism of nano particles stabilizing pickering emulsion and the improvement of bioavailability of isoluble drugs[D].Beijing:Beijing University of Chemical Technology,2018.
[23] 刘亚娟,王诗豪,张铭,等.铁皮石斛多糖抗癌及免疫活性研究[J].广州化工,2014,042(10):58-60;65.
LIU Y J,WANG S H,ZHANG M,et al.Study on immune and antitumor activity of Dendrobium officinale polysaccharides[J].Guangzhou Chemical Industry,2014,042(10):58-60;65.
[24] YU H L,HUANG Q R.Improving the oral bioavailability of curcumin using novel organogel-based nanoemulsions[J].Journal of Agricultural & Food Chemistry,2012,60(21):5 373-5 379.
[25] MUN,SAEHUM,PARK,et al.Influence of methylcellulose on attributes of beta-carotene fortified starch-based filled hydrogels:Optical,rheological,structural,digestibility,and bioaccessibility properties[J].Food Research International,2016,87(12):18-24.
[26] HE S H,GU C,WANG D G,et al.The stability and in vitro digestion of curcumin emulsions containing konjac glucomannan[J].LWT-Food Science and Techology,2020.117:108672.
[27] JO M,BAN C,GOH K K T,et al.Influence of chitosan-coating on the stability and digestion of emulsions stabilized bv waxv maize starch crystals[J].Food Hydrocolloids,2019,94(12):603-612.
[28] SINGH H,YE A.Structural and biochemical factors affecting the digestion of protein-stabilized emulsions[J].Current Opinion in Colloid & Interface Science,2013,18(4):360-370.
[29] LI Y,MCCLEMENTS D J.New mathematical model for interpreting pH-Stat digestion profiles:Impact of lipid droplet characteristics on in vitro digestibility[J].Journal of Agricultural & Food Chemistry,2010,58(13):8 085-8 092.
[30] MAO L K,ROOS Y H,SONG M.Study on the rheological properties and volatile release of cold-set emulsion-filled protein gels[J].Journal of Agricultural & Food Chemistry,2014,62(47):11 420-11 428.