普鲁兰酶(EC 3.2.1.41)是淀粉脱支酶之一,能专一性地水解淀粉分支点上的α-1,6糖苷键,释放直链淀粉,有利于糖化酶的淀粉糖化与葡萄糖生成,从而显著提升淀粉糖化效率与淀粉到葡萄糖的转化率,是淀粉制糖工业中重要且不可或缺的辅助用酶[1-2]。
从20世纪80年代起,国外学者相继发现与性能解析了多种不同来源的普鲁兰酶[3-5]。但是至今为止,在淀粉制糖工业中,仅Ⅰ型普鲁兰酶呈现出较好的与糖化酶复配或复合的作用[6]。其中,长野芽胞杆菌(Bacillus naganoensis)普鲁兰酶(PulA)具有较高的催化活性,具备现实工业应用价值。但在应用中发现其最适作用温度为55 ℃、最适作用pH为5.0,与黑曲霉糖化酶的最适作用温度(60~62 ℃)和最适作用pH(pH 4.0~4.5)存在不一致性,是影响其在淀粉工业应用的重要限制因素[6-8]。
分子生物学和生物信息学技术已广泛应用于酶分子的定向进化[9-10]。已有研究表明,通过多种分子进化技术,可以有效改善普鲁兰酶的生化属性[11-12]。例如,王兵波等[13]利用DNA混编技术获得了在巴斯德毕赤酵母中高效表达的普鲁兰酶嵌合体WXP03,其最适作用温度为55 ℃,最适作用pH为4.5,基本满足糖化工艺的需求,但最适作用温度还有待进一步改进。再如,PANG等[14]采用定点突变方法,在Anoxybacillus sp.WB42普鲁兰酶分子的Thr 245和Ala 326及Trp 651和Val 707间引入2对二硫键,由此获得普鲁兰酶突变体的最适作用温度可提高到65 ℃,提高了约5 ℃,在67 ℃下的热稳定性得到显著提升,其最适作用pH虽稍有降低但未获得显著改善。因此,通过现有酶分子进化理论方法[15],进一步完善并优化普鲁兰酶PulA的酶学性质,使其具备与现有工业糖化酶的糖化条件的一致性,具有重要意义。
为此,本文通过定点突变PulA的N467并就酶学性质进行分析,所获得的N467G突变体的最适作用温度和最适作用pH获得明显改善,有利于其与黑曲霉糖化酶的复配使用。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
大肠杆菌(Escherichia coli)JM109用于目的基因克隆,为本实验室保藏菌种;地衣芽胞杆菌(Bacillus licheniformis)CBBD302用于普鲁兰酶的分泌表达,为本实验室前期构建并保藏[16];pHY-WZX为表达载体,用于介导目的基因在芽胞杆菌的分泌表达[17];pWB-PulB携带来自长野芽胞杆菌 ATCC 53909的普鲁兰酶基因,为本实验室前期构建并保藏[7]。
1.1.2 酶与主要试剂
限制性内切酶、T4 DNA连接酶及蛋白质分子量标准,美国Thermo Fisher Scientific公司;PyrobestTM DNA聚合酶,大连宝生物工程有限公司;PCR产物纯化试剂盒,Omega Bio-tek;硫酸卡那霉素,上海生工生物工程有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨10.0,酵母浸粉5.0,NaCl 10.0,加入20 mg/mL的琼脂为固体培养基。必要时,培养基中添加终质量浓度20 μg/mL硫酸卡那霉素。
普鲁兰酶鉴定培养基(g/L):普鲁兰多糖12.0,蛋白胨5.0,KH2PO4 0.5,MgSO4·7H2O 0.1,加入20 mg/mL的琼脂为固体培养基[18]。
1.2 实验方法
1.2.1 基于氨基酸序列折叠自由能差值和3D结构模拟预测普鲁兰酶突变位点
基于氨基酸序列折叠自由能差值,按照文献[19]介绍的方法进行计算。基本过程为:设定pH为4.0、温度为60 ℃的条件,依据普鲁兰酶氨基酸序列中氨基酸残基改变形成的蛋白质解折叠自由能的差值(ΔΔG),借助计算机辅助设计与计算获得可能的突变氨基酸位点。PulA及其突变体的3D结构模拟分析按照SWISS-MODEL方法[20]进行。
1.2.2 分子克隆操作
大肠杆菌质粒DNA的提取、酶切、转化及转化子筛选等按照实验室常规方法进行[21];地衣芽胞杆菌的遗传转化按文献[16]进行;DNA纯化按照试剂盒说明书进行。
1.2.3 PulA定点突变
采用引物介导的定点突变方法进行测定[21]。基本步骤为:以含有PulA编码基因的重组质粒pWB-PulB为模板,采用引物467F(5′-GGCCCTGACGGCGTAAAGAC-3′)和引物PulR(5′-CTATTTACCATCAGATGGGCTTACTT-3′),以及引物PulF(5′-ATAGGATCCGATGGGAACACCACA-3′)和引物467R(5′-GTCTTTACACCGTCAGGGCC-3′),分别扩增出普鲁兰酶编码基因部分片段;再以上述扩增片段的混合物为模板,在引物PulF和PulR的介导下扩增得到突变普鲁兰酶全长编码基因;突变位点采用Sanger核苷酸序列测定法,经核苷酸序列测定确认。
1.2.4 普鲁兰酶突变体的表达与制备
将突变后的普鲁兰酶编码基因片段用BamH I酶切后克隆到pHY-WZX的BamH I和Sma Ⅰ位点中,转化到大肠杆菌JM109中,构建获得含普鲁兰酶突变体基因序列的重组表达质粒,重组质粒进一步转化入地衣芽胞杆菌CBBD302中,在含20 μg/mL卡那霉素的普鲁兰酶鉴定平板上基于透明圈形成情况进行转化子的初步筛选,根据普鲁兰酶酶活性进一步对转化子提取质粒酶切进行验证,并对突变体的DNA进行核苷酸序列测定,获得正确的重组表达质粒与重组菌。
普鲁兰酶突变体的制备,采用摇瓶发酵方法进行。接种于50 mL LB培养基中,37 ℃和200 r/min条件下培养120 h,发酵结束后8 000 r/min离心10 min并收集上清液,为普鲁兰酶粗酶液。
1.2.5 普鲁兰酶突变体的纯化与SDS-PAGE鉴定
将普鲁兰酶粗酶液经50%~70%饱和硫酸铵溶液进行分级沉淀后,进一步使用AKTA Pure纯化系统,以0.05 mol/L磷酸缓冲液(pH 7.0)为流动相,采用Sephadex G-100凝胶柱(10 mm×500 mm)进行色谱分离,洗脱速度为0.5 mL/min,对色谱洗脱峰进行普鲁兰酶活力检测,收集普鲁兰酶活性峰。酶蛋白的分离纯度采用SDS-PAGE进行分析,采用12%的分离胶和5%的浓缩胶[21]。酶蛋白浓度测定参照文献[22]进行,以牛血清白蛋白为标准品绘制标准曲线。
1.2.6 普鲁兰酶酶活力测定
普鲁兰酶酶活力按照国标GB 1886.174—2016方法[23]进行测定。普鲁兰酶酶活力单位定义:在60 ℃,pH 4.5反应条件下,1 mL酶液每1 min反应产生相当于1 μmol葡萄糖,即为1个酶活力单位,以U/mL表示。
1.2.7 最适作用温度及热稳定性测定
在pH 4.5下,分别测定酶样在45、50、55、60、65和70 ℃下的酶活力,以最高酶活力为100%,计算其余温度下的相对酶活力,确定最适作用温度。将酶样分别在45、50、55和60 ℃下热处理1 h,每隔0.5 h取样,按1.2.6小节中酶活力的测定方法测定残余酶活力,以未经处理的酶样酶活力为100%,确定酶的热稳定性。
1.2.8 最适作用pH及pH稳定性测定
在最适反应温度下,用pH 3.5~7.0的缓冲液适当稀释酶液,测定对应pH条件下的酶活力,以最高酶活力为100%,计算其余pH条件下的相对酶活力,确定最适作用pH。将酶样加入不同的pH缓冲液中室温(25 ℃)放置1 h,然后按1.2.6小节中酶活力的测定方法测定残余酶活力,以未经处理的酶液酶活力为100%,确定其pH稳定性。
2 结果与讨论
2.1 PulA突变位点选择
通过对普鲁兰酶氨基酸序列中氨基酸残基改变形成的蛋白质解折叠自由能的差值(ΔΔG)分析,发现PulA分子中第467位的天冬酰胺残基突变可能会改变其酶学性质及其耐热耐酸性能。进一步借助PulA 3D模拟结构(图1-a),分析了PulA第467位的天冬酰胺残基突变为甘氨酸后的结构变化(图1-b),发现N467G突变后的普鲁兰酶分子,甘氨酸侧链基团为氢,是疏水基团,可以与周围氨基酸残基形成疏水相互作用,并主要影响蛋白质的构象熵,是蛋白质三级结构形成的驱动力,通过降低蛋白质表面的疏水性,增加内部的疏水性来维持蛋白质内部的稳定[24]。故第467位天冬酰胺残基突变后有可能提升酶分子的耐热性。
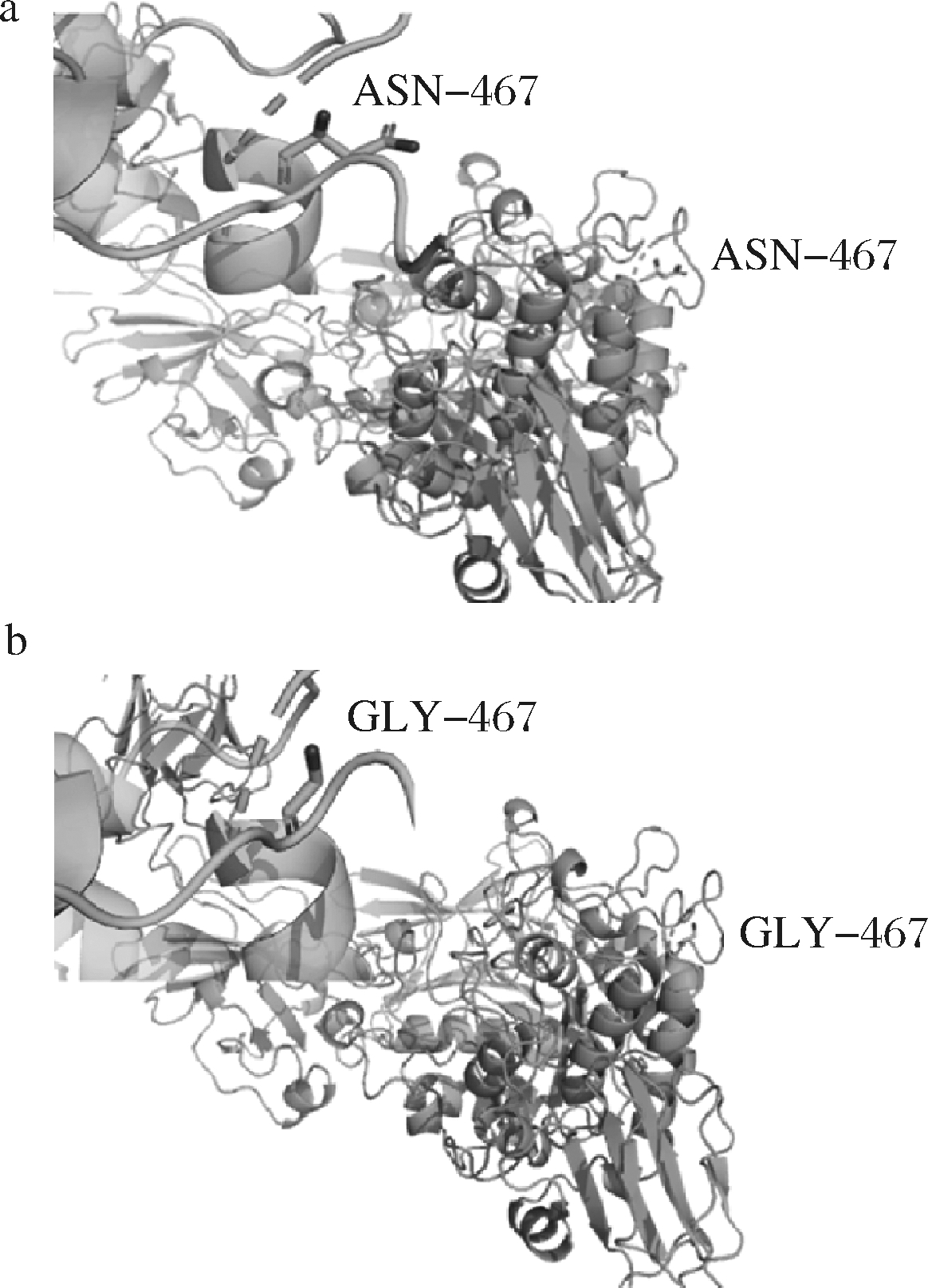
a-PulA;b-N467G突变体
图1 PulA第467位氨基酸位点突变前后结构比较
Fig.1 Deduced structure of PulA before and after mutation
of the Asn467 residue
注:a、b图的左上角均为突变位点放大图
2.2 N467G突变体的构建与制备
基于以上分析,普鲁兰酶PulA的第467位天冬酰胺残基突变对耐热耐酸性能可能产生影响,对此氨基酸残基进行定点突变,获得了相应的突变体N467G,其在相应宿主菌中具有普鲁兰酶活性。将此突变体编码基因在地衣芽胞杆菌中进行分泌表达,并通过摇瓶发酵进行酶液的制备并进一步纯化,纯化后的普鲁兰酶突变体N467G在SDS-PAGE图谱上呈现单一条带,条带位置与其理论分子质量大小101 kDa相吻合(图2),比酶活力较野生型PulA提高了约11%。
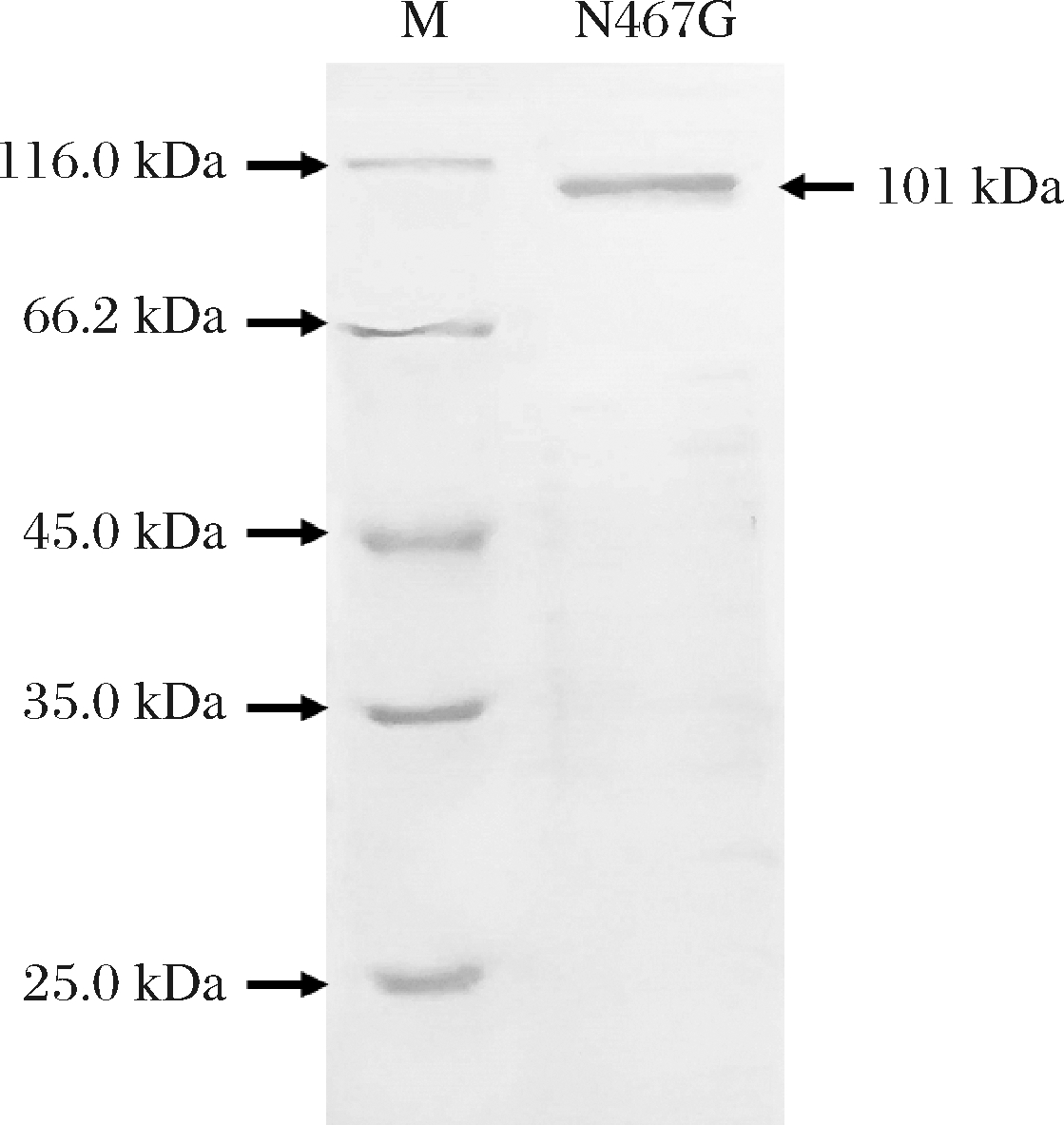
图2 突变体N467G纯化后的SDS-PAGE图谱
Fig.2 SDS-PAGE diagram of the purified mutant N467G
2.3 N467G突变体的酶学性质
2.3.1 最适作用温度和最适作用pH
在pH 4.5的条件下,测定45~70 ℃范围内普鲁兰酶突变体N467G的酶活力,结果如图3-a所示。

a-温度;b-pH
图3 温度和pH对普鲁兰酶突变体N467G活力的影响
Fig.3 Effects of temperature and pH on the activity of
the mutant N467G
突变体N467G在60 ℃时表现出最高酶活力,其最适作用温度较PulA提高了5 ℃,最适作用温度显著提高;在黑曲霉糖化酶的最适作用温度(60~62 ℃)附近,突变体N467G的相对酶活力为其最高水平,而此时PulA相对酶活力仅为70%左右,表明在作用温度层面突变体N467G更适合与黑曲霉糖化酶的配合使用。进一步评价了pH对普鲁兰酶突变体N467G酶活力的影响,结果如图3-b所示。突变体N467G的最适作用pH为4.5,较PulA降低了0.5个pH;在pH 4.0~5.0之间N467G的酶活力均保持在80%以上,PulA同样范围内仅有60%的酶活力,表明N467G比野生型更有利于在酸性条件下发挥催化作用。
2.3.2 热稳定性和pH稳定性
将酶液在55和60 ℃下保温3 h,定时取样分析剩余酶活力,结果如图4-a所示。突变体N467G在55和60 ℃孵育1.5 h后保留80%以上的酶活力,2.5 h后仍保留70%和50%以上的酶活力,而PulA在各取样点的相对酶活力均低于突变体N467G,在55和60 ℃下保温2.5 h后,其酶活力仅保留50%和40%,突变体N467G的热稳定性较PulA显著提升。进一步将酶液在不同pH缓冲液中室温放置1 h后测其剩余酶活力的结果如图4-b所示。突变体N467G在pH 3.5~6.0,皆具有良好的稳定性,酶活力均保留60%以上,N467突变后其分子的耐酸性得到了显著提升。
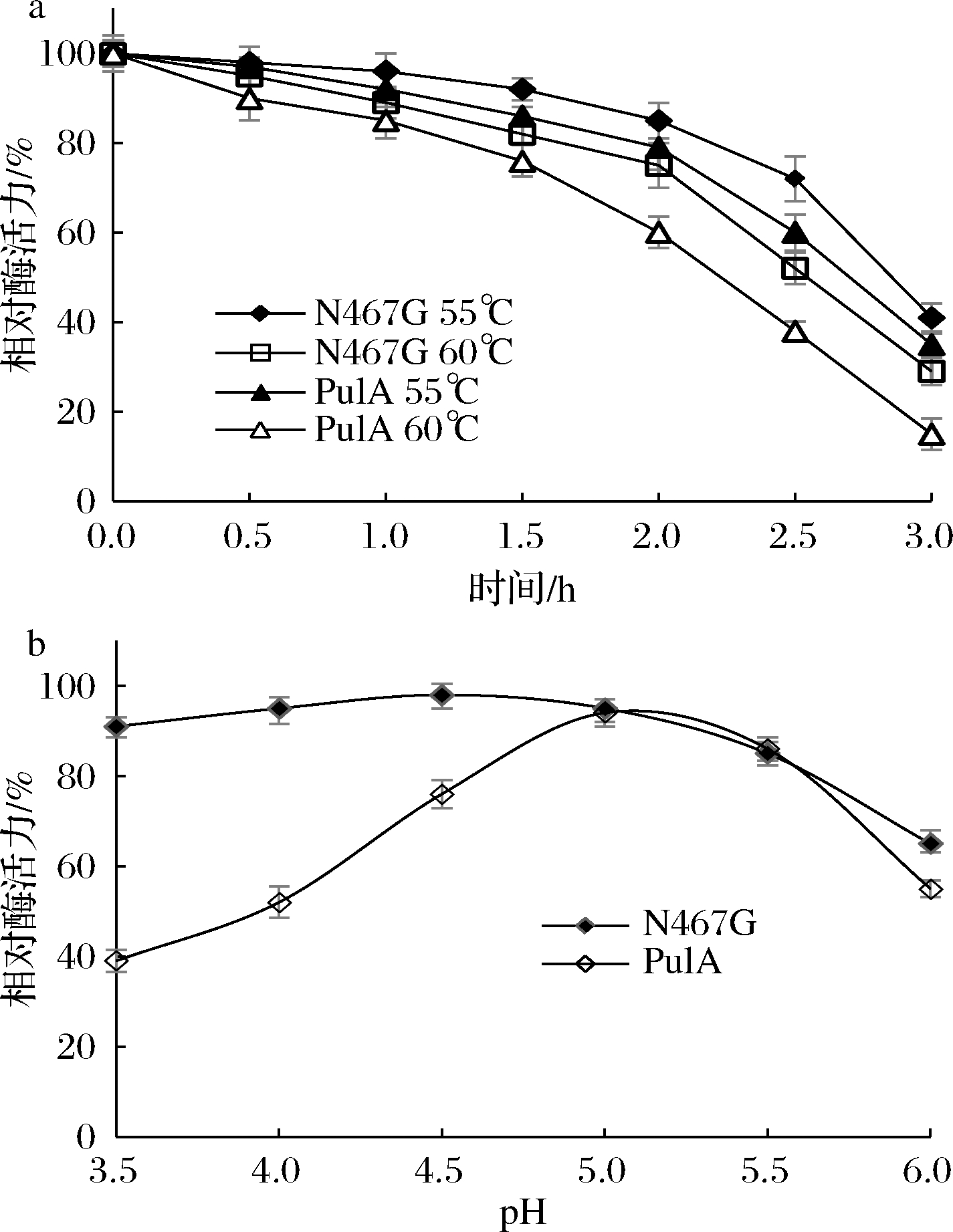
a-热稳定性;b-pH稳定性
图4 突变体N467G的热稳定性和pH稳定性
Fig.4 The thermostability and pH stability of the mutant N467G
本研究通过对长野芽胞杆菌普鲁兰酶的氨基酸序列分析与预测,以定点突变方法改造酶分子并制备相应的普鲁兰酶突变体,所获得的突变体N467G的最适作用温度较亲本提高了5 ℃,最适作用pH降低了0.5,其最适作用条件与现有糖化酶作用条件相吻合。此外,该突变体的pH稳定性和热稳定性也有显著提升。可见,本研究获得的普鲁兰酶新突变体具备了与糖化酶复合使用的基本条件。
已有研究揭示,酶分子特定部位的天冬酰胺残基在高温条件下发生脱酰胺作用,是导致酶蛋白热变性的重要原因之一[24]。本研究中普鲁兰酶PulA第467位的天冬酰胺残基定点突变为甘氨酸后,因甘氨酸侧链是疏水基团,可以与周围氨基酸残基通过疏水相互作用来维持蛋白质结构的稳定,从而显著提升了突变体的热稳定性。本研究同时发现,N467G突变后,其最适作用pH和pH稳定性也发生期望的突变,这一变化的可能机理尚不清楚,将在后续进一步阐明。
3 结论
通过对B.naganoensis普鲁兰酶第467位天冬酰胺残基的定点突变,获得了普鲁兰酶突变体,最适作用温度为60 ℃,最适作用pH为4.5,与现有工业化生产中使用的糖化酶的最适作用条件相吻合,其应用可改进现有淀粉制葡萄糖生产工艺。
[1] SHI J L,SWEEDMAN M C,SHI Y C.Structural changes and digestibility of waxy maize starch debranched by different levels of pullulanase[J].Carbohydrate Polymers,2018,194:350-356.
[2] VAN DER MAAREL M J,VAN DER VEEN B,UITDEHAAG J C,et al.Properties and applications of starch-converting enzymes of the α-amylase family[J].Journal of Biotechnology,2002,94(2):137-155.
[3] ROY A,MESSAOUD E B,BEJAR S.Isolation and purification of an acidic pullulanase type II from newly isolated Bacillus sp.US149[J].Enzyme and Microbial Technology,2003,33(5):720-724.
[4] ARA K,SAEKI K,IGARASHI K,et al.Purification and characterization of an alkaline amylopullulanase with both α-1,4 and α-1,6 hydrolytic activity from alkalophilic Bacillus sp.KSM-1378[J].Biochimica et Biophysica Acta,1995,1243(3):315-324.
[5] NIEHAUS F,PETERS A,GROUDIEVA T,et al.Cloning,expression and biochemical characterisation of a unique thermostable pullulan-hydrolysing enzyme from the hyperthermophilic archaeon Thermococcus aggregans[J].FEMS Microbiology Letters,2000,190(2):223-229.
[6] WANG X Y,NIE Y,XU Y.Industrially produced pullulanases with thermostability:Discovery,engineering,and heterologous expression[J].Bioresource Technology,2019,278:360-371.
[7] WANG Y P,LIU Y H,WANG Z X,et al.Infiuence of promoter and signal peptide on the expression of pullulanase in Bacillus subtilis[J].Biotechnology Letters,2014,36:1 783-1 789.
[8] DUFFNER F,BERTOLDO C,ANDERSEN J T,et al.A new thermoactive pullulanase from Desulfurococcus mucosus:Cloning,sequencing,purification,and characterization of the recombinant enzyme after expression in Bacillus subtilis[J].Journal of Bacteriology,2000,182(22):6 331-6 338.
[9] 王正祥,刘吉泉,诸葛健.微生物酶的分子改性和人工进化的研究进展[J].生物工程学报,2000,16(3):301-303.
WANG Z X,LIU J Q,ZHUGE J.Molecular modification and artificial evolution of microbial enzymes[J].Chinese Journal of Biotechnology,2000,16(3):301-303.
[10] CHAKRAVARTY S,VARADARAJAN R.Elucidation of determinants of protein stability through genome sequence analysis[J].FEBS Letters,2000,470 (1):65-69.
[11] DUAN X G,CHEN J,WU J.Improving the thermostability and catalytic efficiency of Bacillus deramificans pullulanase by site-directed mutagenesis[J].Applied and Environmental Microbiology,2013,79(13):4 072-4 077.
[12] YAMASHITA M.Random mutagenesis of pullulanase from Klebsiella aerogenes for studies of the structure and function of the enzyme[J].Journal of Biochemistry,1994,116(6):1 233-1 240.
[13] 王兵波,沈微,钱灵紫,等.一种密码子优化的酸性普鲁兰酶基因在巴斯德毕赤酵母中的高效表达[J].食品与发酵工业,2016,42(7):9-15.
WANG B B,SHEN W,QIAN L Z,et al.High expression of a codon-optimized acid-resistant pullulanase-enconding gene in Pichia pastoris[J].Food and Fermentation Industries,2016,42(7):9-15.
[14] PANG B,ZHOU L,CUI W J,et al.Improvement of the thermostability and activity of pullulanase from Anoxybacillus sp.WB42[J].Applied Biochemistry and Biotechnology,2020,191 (3):942-954.
[15] 王正祥.微生物遗传育种[M].北京:高等教育出版社,2020,136-139.
WANG Z X.Genetic breeding of microorganisms[M].Beijing:Higher Education Press,2020,136-139.
[16] NIU D D,ZUO Z R,SHI G Y,et al.High yield recombinant thermostable α-amylase production using an improved Bacillus licheniformis system[J].Microbial Cell Factories,2009,8(1):58.
[17] NIU D D,WANG Z X.Development of a pair of bifunctional expression vectors for Escherichia coli and Bacillus licheniformis[J].Journal of Industrial Microbiology and Biotechnology,2007,34(5):357-362.
[18] 谢银珠,沈微,王正祥.酸性普鲁兰酶基因在地衣芽胞杆菌中的表达[J].食品与发酵工业,2011,37(2):7-10.
XIE Y Z,SHEN W,WANG Z X.Expression of the acid pullulanase in Bacillus licheniformis[J].Food and Fermentation Industries,2011,37(2):7-10.
[19] SAQIB A A N,SIDDIQUI K S.How to calculate thermostability of enzymes using a simple approach[J].Biochemistry and Molecular Biology Education,2018,46(4):398-402.
[20] WATERHOUSE A,BERTONI M,BIENERT S,et al.SWISS-MODEL:Homology modelling of protein structures and complexes[J].Nucleic Acids Research,2018,46(1):296-303.
[21] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
ZHUGE J,WANG Z X.Handbook of industrial microbiology experiment[M].Beijing:China Light Industry Press,1994.
[22] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[23] 中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB 1886.174—2016 食品安全国家标准 食品添加剂 食品工业用酶制剂[S].北京:中国标准出版社,2016.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB 1886.174—2016 National standard of food safety food additives enzyme preparations for food industries[S].Beijing:China Standards Press,2016.
[24] SHAH P S,HOM G K,ROSS S A,et al.Full-sequence computational design and solution structure of a thermostable protein variant[J].Journal of Molecular Biology,2007,372(1):1-6.