近年来,以生物积累、生物转化或生物分子为基础的金属纳米粒子(如Ag、Au、Pd等)生物合成方法,因具有生态友好、安全高效等优点,正受到越来越多的关注[1]。其中,由蘑菇分泌物合成的纳米颗粒具有分散性好、稳定性高、保存期长等优点,因而在绿色制造、功能食品和医药材料等领域已经展现出巨大的潜力[2-3]。到目前为止,相关学者已在Pleurotus sp.,Ganoderma sp.,Lentinus sp.等多种蘑菇中通过细胞内和/或细胞外催化合成的方式,实现了金属/非金属纳米颗粒的生物合成[4]。研究表明,利用食用菌的无细胞滤液(cell-free filtrate,CFF)进行胞外合成,具有价格低廉、环境友好、反应条件温和可控以及易于分离等优点[5-6],因而更具应用潜力。例如,董丽娜等[7]利用秀珍菇菌丝体的CFF不仅实现了AgNPs的可控合成,并且证实产物具有优良的抑菌活性和广谱抗菌活性。利用蘑菇合成的银纳米颗粒(silver nanoparticles,AgNPs)在抗菌剂、废水处理和催化剂等领域有着广泛的应用,相关产品的需求量越来越大[4,8]。
金针菇(Flammulina velutipes)富含蛋白质、多糖、类黄酮和多酚等生物分子,不仅具有较高的营养价值[9],在金属/非金属元素的生物转化方面也表现出极好的潜力,如利用金针菇合成生物三聚体-金纳米颗粒(AuNPs),并作为一种多相催化剂用于减少有机污染物[10];利用金针菇自身的解毒机制实现SeNPs的胞内合成[11]。然而,利用金针菇进行纳米颗粒的胞外合成则鲜有报道,以金针菇发酵产物进行纳米银颗粒的合成也有待研究。
本研究利用金针菇的无细胞滤液(cell-free filtrate of Flammulina velutipes,FV-CFF)进行AgNPs的生物合成,进而通过反应动力学生成曲线探讨冻融和pH等因素对FV-CFF合成AgNPs的影响。最后,结合产物粒径和紫外可见(UV-Vis)吸收光谱的分析结果,讨论FV-CFF的成分及冻融和pH等不同处理条件对其还原力的影响。
1 材料与方法
1.1 材料与试剂
金针菇(Flammulina velutipes)CICC 50051,中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);AgNO3、CH3COOH、NaOH、3,5-二硝基水杨酸、铁氰化钾、三氯乙酸、FeCl3等,均为分析纯,国药集团化学试剂有限公司;BCA法蛋白浓度测定试剂盒(增强版),碧云天生物技术有限公司;纳米银(AgNPs)标准溶液,张家港耐尔纳米科技有限公司。
1.2 仪器与设备
H2-2型电热恒温振荡水浴箱,上海精宏实验设备有限公司;Enspire 2300型酶标仪,美国PerkinElmer 公司;FAl004型电子天平,上海舜宇恒平科学仪器有限公司;全温摇床柜HYG-A,太仓市实验设备厂;纳米激光粒度及zeta电位分析仪ZEN3700,马尔文仪器有限公司;透射电子显微镜(TEM,H-7650),日本日立株式会社。
1.3 实验方法
1.3.1 金针菇菌丝体生长曲线的测定
金针菇种子液配方(g/L):葡萄糖20,酵母20,KH2PO4 1,MgSO4·7H2O 0.5,VB1 0.5,装液量为200 mL/500 mL摇瓶。高压灭菌后,接入10片1 cm×1 cm金针菇PDA平板切片,于25 ℃,160 r/min摇床培养7 d后,按体积分数5%接种于发酵液中(配方与种子液一致),于160 r/min摇床中25 ℃培养。每天收集发酵产物,洗涤并烘干菌体至恒重,测定生长曲线,并用DNS法测定发酵液中的残糖含量(n=3)。
1.3.2 无细胞滤液FV-CFF制备
将金针菇菌丝体发酵7 d后无菌过滤,收集菌丝体,并用无菌水洗涤3~5次,转移到无菌去离子水(200 mL)中继续培养3 d。抽滤,去除菌丝体,即得无细胞滤液FV-CFF,保存于4 ℃冰箱中,待用。
1.3.3 FV-CFF合成纳米颗粒
配制浓度为6 mmol/L的AgNO3溶液,并按照FV-CFF∶AgNO3溶液以2.0∶0.6体积比混合,并以超纯水补足至4.0 mL,混合均匀,于100 ℃加热反应30 min。反应结束后,扫描415 nm处的吸光度值,以所购买的纳米银标准溶液做标准曲线,测定AgNPs的产率。
1.3.4 AgNPs的合成及影响因素
1.3.4.1 FV-CFF及AgNO3添加比例对AgNPs合成的影响
将FV-CFF与AgNO3溶液(6 mmol/L)以1∶3~12∶3的体积比混合(对应发酵液比例5%~60%),并以超纯水补足至4.0 mL,100 ℃水浴加热30 min,反应结束后迅速冰浴冷却至室温,测定OD415,并计算AgNPs产量。固定FV-CFF添加量为2.0 mL,测定AgNO3添加浓度对AgNPs生成的影响。
1.3.4.2 pH对FV-CFF合成 AgNPs的影响
经测定,初始FV-CFF的pH为7.22,分别用微量醋酸溶液和NaOH 溶液(均为100 g/L)将FV-CFF调节 pH 到 3、5、7、9、11,按1.3.3小节中所述条件进行反应,测定不同pH下FV-CFF合成纳米银的效果。
1.3.4.3 冻融对FV-CFF合成AgNPs的影响
根据确定的FV-CFF添加量及AgNO3浓度,测定50~100 ℃下FV-CFF冻融前后(冻融后离心除去不溶物)合成AgNPs的动力学生成曲线。
1.3.4.4 冻融前后的FV-CFF在pH 11时合成AgNPs效果
选择AgNO3终浓度为0.6 mmol/L(即0.4 mL),FV-CFF(pH 11)添加比例为15%(即0.6 mL),并以超纯水补足4.0 mL,测定FV-CFF冻融前后(pH 11)合成AgNPs的动力学生成曲线。
1.3.5 检测与分析方法
1.3.5.1 冻融前后FV-CFF中的主要成分及还原力测定
冻融前后FV-CFF中总蛋白、总糖和还原糖含量的测定分别采用BCA法[12]、苯酚-硫酸法[13]和DNS法,可溶性固形物含量的测定采用农业行业标准NY/T 2 637—2014[14]中的折射仪法。
冻融及pH对FV-CFF总还原力的影响采用铁氰化钾法评价[15]。取0.2 mL不同样品,分别加入1 mL pH 6.6的磷酸盐缓冲液(0.2 mol/L)和1 mL铁氰化钾溶液(1 g/mL)混合均匀,50 ℃加热反应20 min,再加10%三氯乙酸0.2 mL终止反应,以4 000 r/min离心10 min。吸取0.2 mL上清液加去离子水稀释1倍,加0.04 mL 1% FeCl3溶液,常温静置反应10 min,测定700 nm波长处的吸光度。吸光度值的大小代表铁离子还原力的大小,以20 mg/L的Vc溶液作为阳性对照。
1.3.5.2 AgNPs的表征
分别取冻融前后及不同pH下的样品与AgNO3在100 ℃反应30 min,吸取生成的产物溶液,分别扫描300~700 nm范围内的紫外-可见(UV-Vis)吸收光谱;将样品在铜网碳膜上制样,干燥后使用透射电子显微镜在80 kV的加速电压下获得产物的形貌特征;使用马尔文纳米激光粒度仪测定样品及产物的粒度分布。
1.3.6 数据处理
所有试验均采用三平行设计(n=3),试验数据采用Sigma plot 14.0软件进行统计分析和作图。
2 结果与讨论
2.1 金针菇菌丝体的生长曲线
如图1所示,金针菇菌丝接种后,生物量从第1~6天呈线性上升趋势,这是由于金针菇菌丝体在种子培养基中预培养7 d,因此转接后几乎没有滞后期;第6~8天进入快速的对数增长阶段,第8天以后进入平稳阶段。而金针菇发酵液中的残糖含量一直在下降,并在第7天降至最低。由图1可知,金针菇菌丝在转接后第7天时生长最为旺盛,之后随着碳源消耗殆尽,菌丝的生长进入稳定期,因此选择发酵至第7天的菌体进行之后的实验。
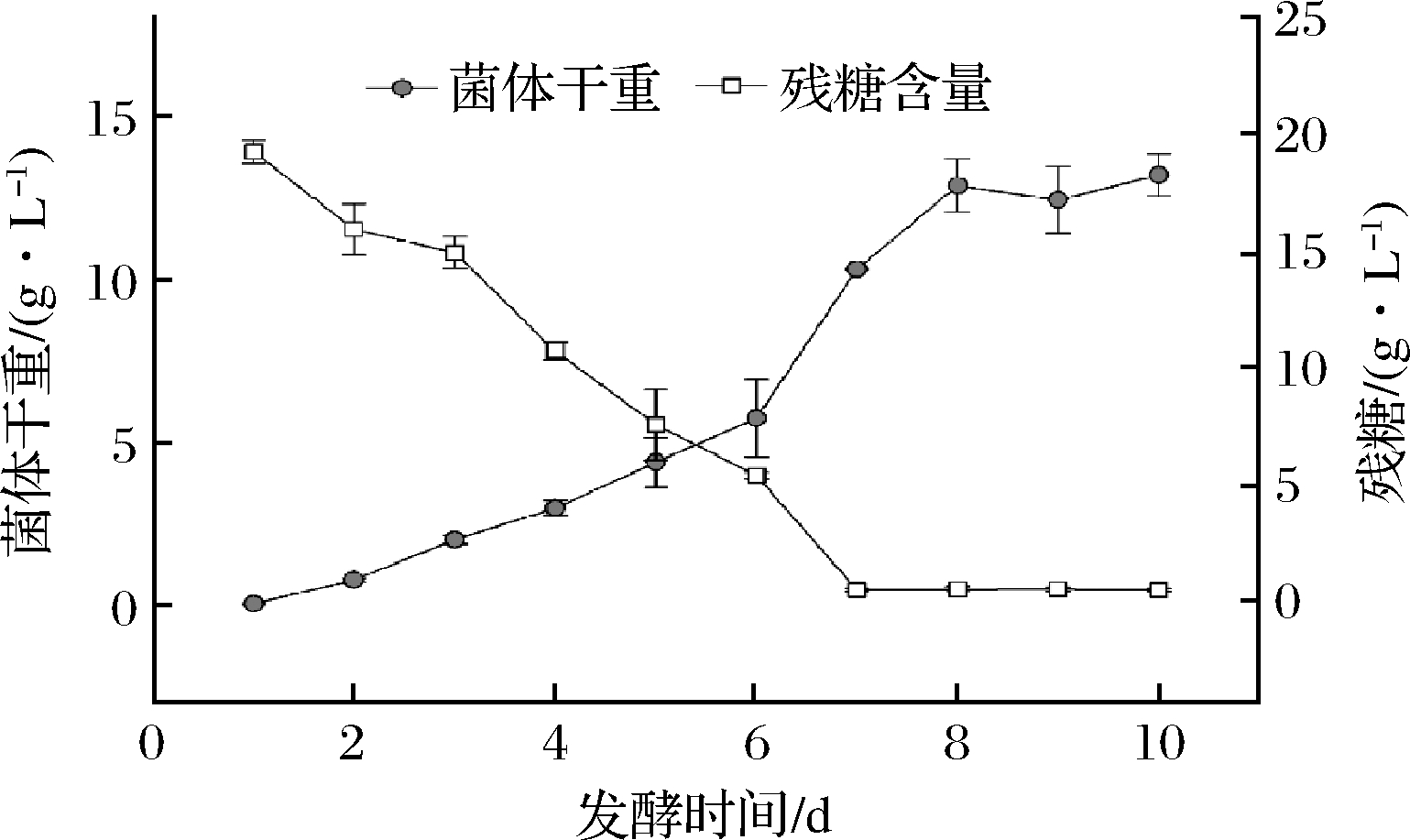
图1 金针菇菌体生长曲线及发酵液中残糖的变化
Fig.1 Growth curve of F.velutipes mycelia and the
change of residual sugar in fermentation broth
2.2 纳米银颗粒的合成
2.2.1 最大吸收波长及标准曲线
将FV-CFF与AgNO3溶液加热反应后出现明显的棕褐色(纳米银特征颜色),且溶液澄清。初步分析,FV-CFF具有一定的还原力,可以将Ag+还原为0价纳米银。此外,溶液中还具有可以起稳定作用的大分子成分,因此生成的溶液并无单质银沉淀产生。配制不同浓度的AgNPs标准溶液,扫描最大吸收波长为415 nm,测定415 nm处纳米银标准曲线为y=6.884 9x+0.043 6,R2=0.999 4。
2.2.2 FV-CFF及AgNO3添加比例的确定
如图2-a所示,在FV-CFF添加比例为5%~50%,合成的AgNPs浓度呈线性增加的趋势,在FV-CFF添加总比例50%时,AgNPs浓度为0.31 mmol/L;此后AgNPs增加趋势减缓。因此接下来的实验中,选用FV-CFF添加总比例为50%。固定FV-CFF添加比例为50%,探讨不同AgNO3添加浓度对AgNPs生成的影响,结果如图2-b所示,随反应体系中AgNO3浓度升高,AgNPs浓度逐步上升,当反应体系中AgNO3浓度达到0.9 mmol/L时,AgNPs产量达到0.30 mmol/L,之后AgNPs产量趋于稳定,增长不显著。因此,在后续实验中,选用AgNO3终浓度0.9 mmol/L。
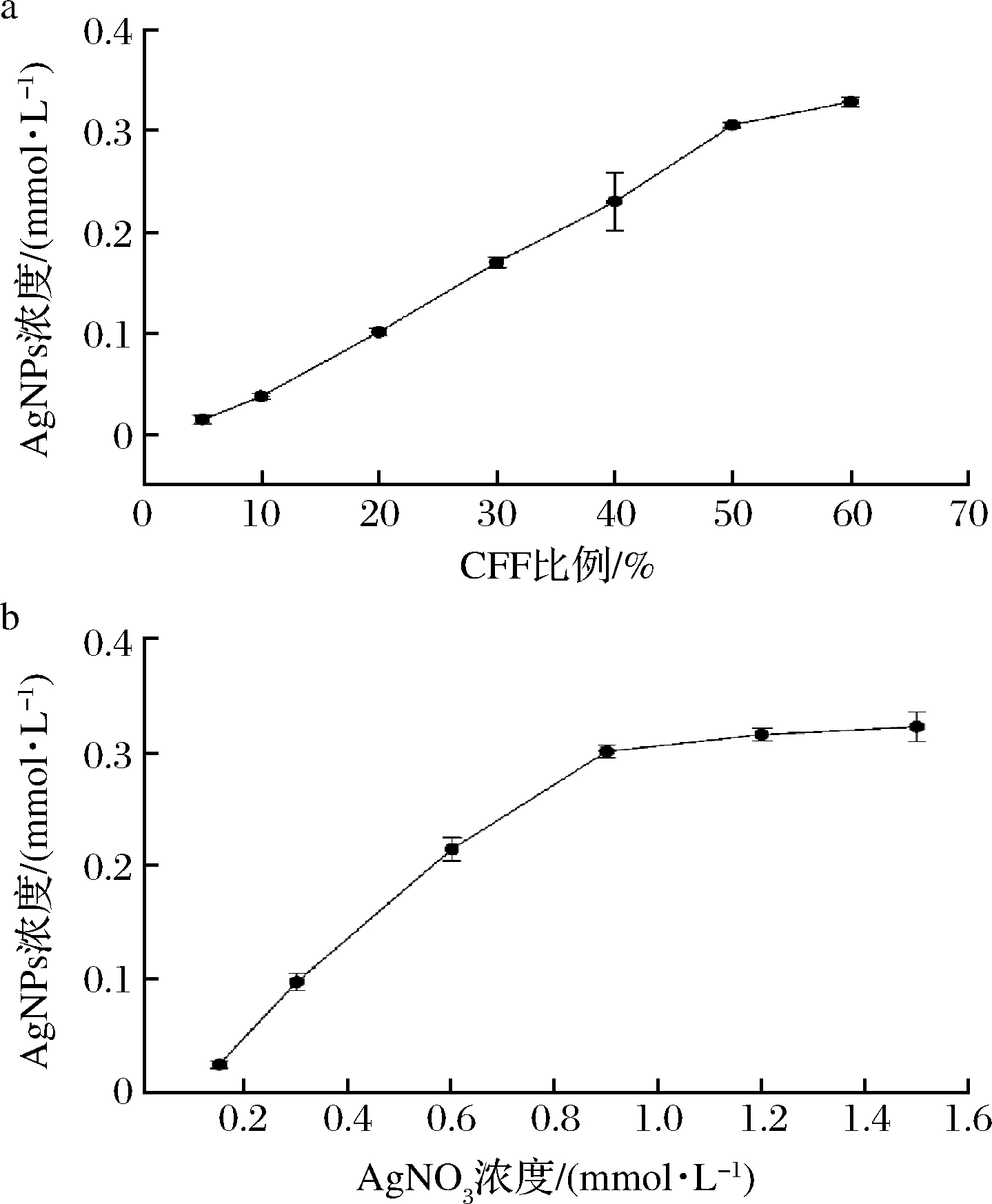
图2 FV-CFF添加比例对AgNPs合成的影响(a),
AgNO3浓度对合成AgNPs的影响(b)
Fig.2 Effect of FV-CFF addition ratio on AgNPs synthesis (a),
the effect of AgNO3 concentration on AgNPs synthesis (b)
2.2.3 pH对FV-CFF合成纳米银的影响
如图3-a所示,pH对FV-CFF合成AgNPs的效果影响显著,在pH低于5时,合成能力较弱,且随pH的增高,AgNPs增加幅度较小,而在pH 5~11,AgNPs的合成基本呈线性增加趋势,在pH 11时达到最高,为0.58 mmol/L。在pH 11.0条件下,于100 ℃加热,5~10 min内AgNPs产量迅速升高,10 min后AgNPs产量增长减缓,20 min时AgNPs产量便已达到最大值,之后趋于稳定(图3-b),但合成的纳米银溶液有较多黑色沉淀产生。
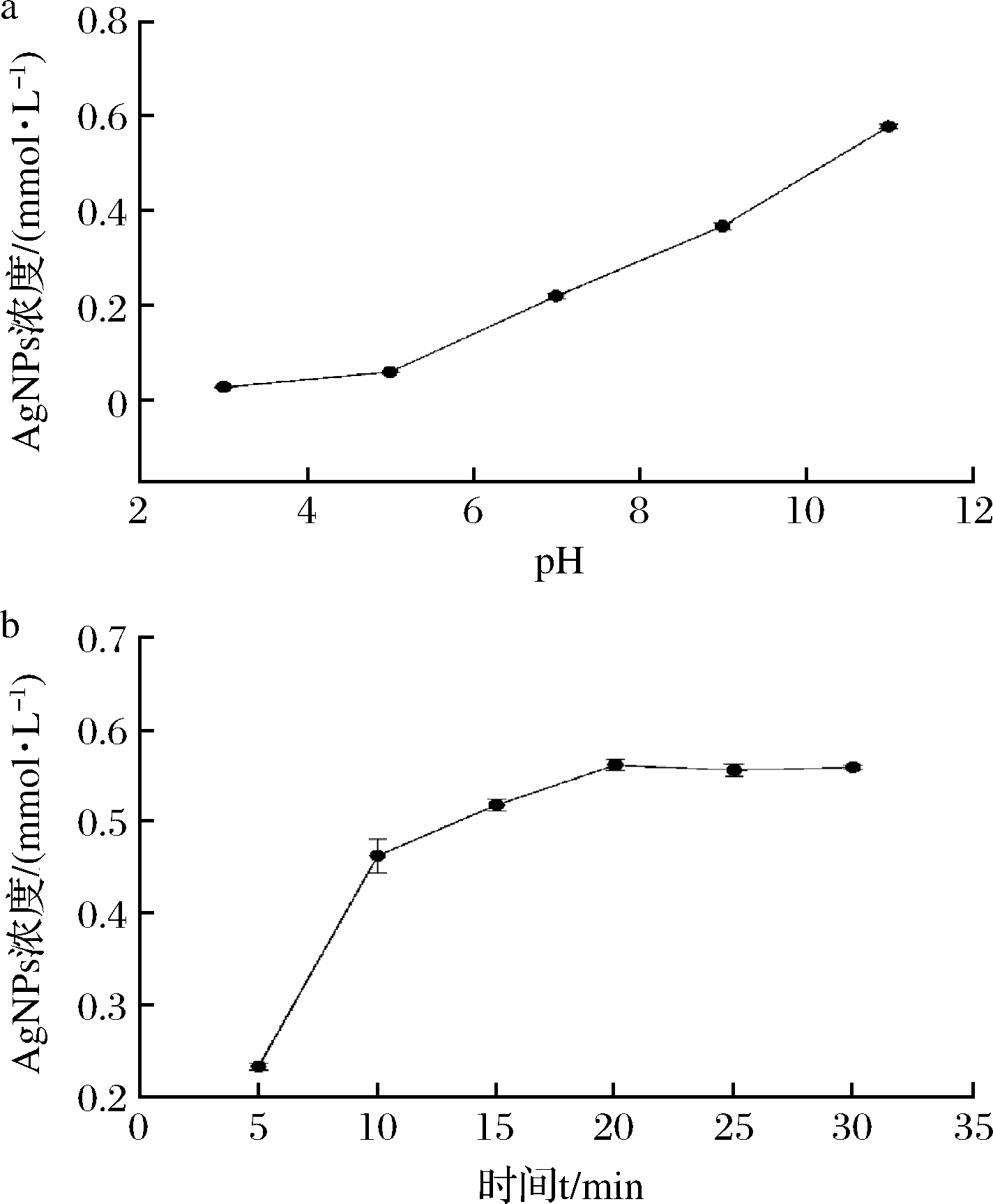
图3 pH对FV-CFF合成AgNPs的影响(a)及FV-CFF在
pH 11、100 ℃时合成AgNPs的动态曲线(b)
Fig.3 Effect of pH on mycosynthesis of AgNPs by
FV-CFF (a),dynamic changes of AgNPs formation
in FV-CFF at pH 11,100 ℃ (b)
进一步优化发现,在pH 11时反应体系的最佳添加量为:AgNO3浓度0.6 mmol/L,FV-CFF(pH 11)添加比例15%。
2.2.4 冻融前后FV-CFF合成纳米银的动力学生成曲线
根据2.2.2小节中确定的FV-CFF添加量及AgNO3浓度,测定初始pH下(即pH 7.22)AgNPs的动力学生成曲线,实验结果如图4-a所示。为了考察FV-CFF中成分对AgNO3还原效果的影响,将发酵液进行冷冻,融化后发现有絮状物漂浮于液面,离心除去絮状不溶物,取上清液依照上述实验条件测定AgNPs的动力学生成曲线,实验结果如图4-b所示。

a-冻融前;b-冻融后
图4 冻融前后FV-CFF生成AgNPs的动力学曲线
Fig.4 Kinetic curves of AgNPs produced by initial and thawed FV-CFF
由图4可知,等温热处理过程中,冻融前后样品中AgNPs含量均随热处理时间的延长而升高,其升高速率随热处理温度的升高而加快。2组样品中AgNPs的生成反应,表观上均遵循零级反应动力学模型Ct=C0+k·t,根据动力学曲线拟合方程得出各曲线的参数如表1所示。
表1 冻融前后FV-CFF(pH 7.22)生成AgNPs的动力学回归参数
Table 1 Kinetic regression parameters of AgNPs produced by initial and thawed FV-CFF (pH 7.22)
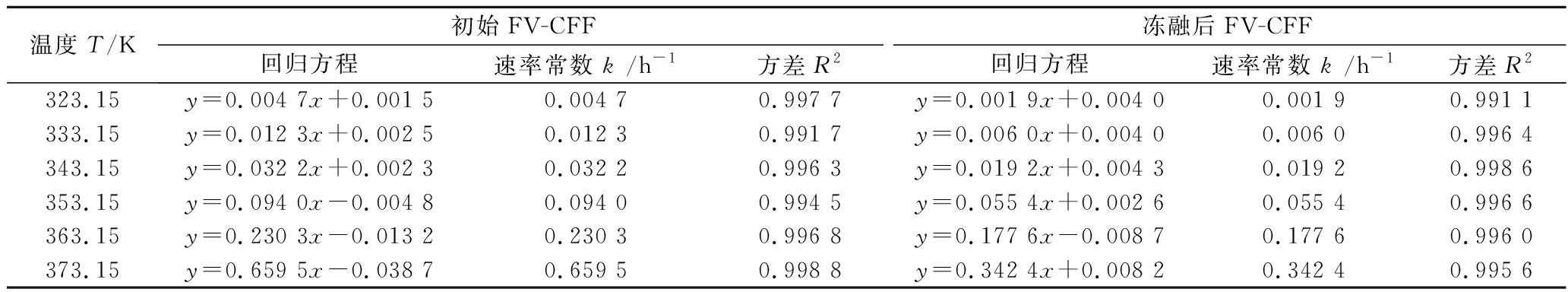
温度T/K初始FV-CFF冻融后FV-CFF回归方程速率常数 k /h-1方差R2回归方程速率常数 k /h-1方差R2323.15y=0.004 7x+0.001 50.004 70.997 7y=0.001 9x+0.004 00.001 90.991 1333.15y=0.012 3x+0.002 50.012 30.991 7y=0.006 0x+0.004 00.006 00.996 4343.15y=0.032 2x+0.002 30.032 20.996 3y=0.019 2x+0.004 30.019 20.998 6353.15y=0.094 0x-0.004 80.094 00.994 5y=0.055 4x+0.002 60.055 40.996 6363.15y=0.230 3x-0.013 20.230 30.996 8y=0.177 6x-0.008 70.177 60.996 0373.15y=0.659 5x-0.038 70.659 50.998 8y=0.342 4x+0.008 20.342 40.995 6
2.2.5 冻融前后FV-CFF在pH 11时合成纳米银的动力学反应
为考察pH 11时FV-CFF对AgNPs生成的影响,根据2.2.3小节实验中确定的FV-CFF添加量及AgNO3浓度(即AgNO3浓度0.6 mmol/L,FV-CFF添加比例15%),取冻融前后的FV-CFF调pH11后与AgNO3进行反应,测定AgNPs的动力学生成曲线。如图5所示,初始FV-CFF(pH 11)在50~90 ℃范围内合成AgNPs的反应均遵循零级动力学模型,即Ct=C0+k·t,而100 ℃时产物呈对数增长趋势。冻融除去絮状不溶物后,AgNPs的生成反应动力学则均遵循零级动力学模型。因此2组样品的动力学曲线仅按照50~90 ℃的数据拟合方程,得出各曲线的参数如表2所示。
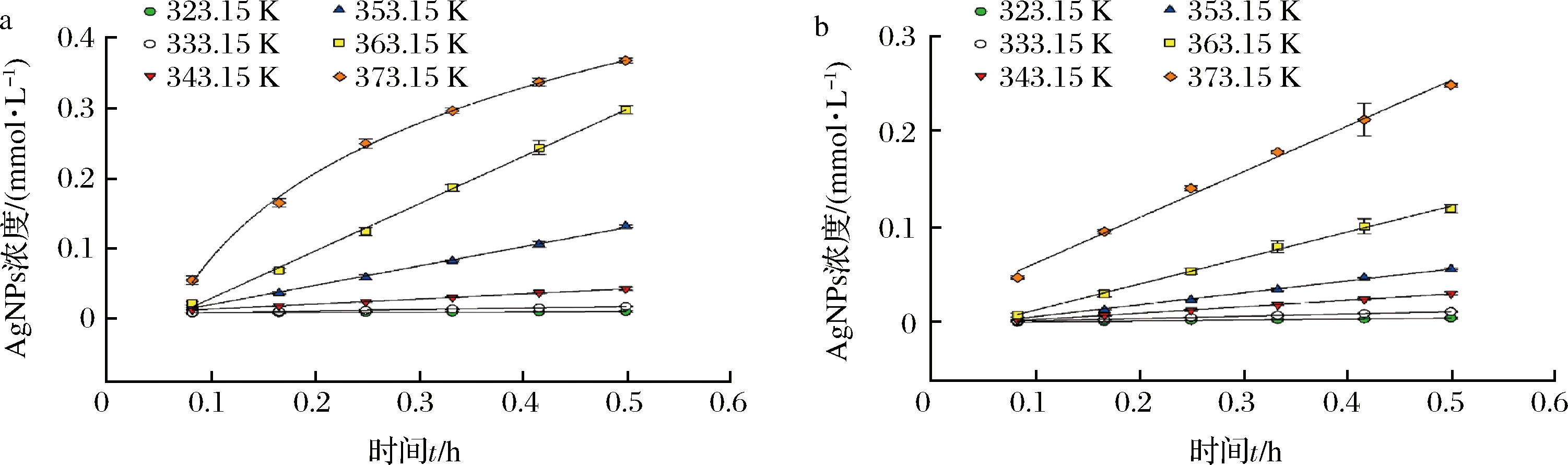
a-冻融前;b-冻融后
图5 冻融前后FV-CFF在pH 11生成AgNPs的动力学曲线
Fig.5 Kinetic curves of AgNPs produced by initial and thawed FV-CFF at pH 11
表2 冻融前后FV-CFF在pH 11时生成AgNPs的动力学回归参数
Table 2 Kinetic regression parameters of AgNPs generated by initial and thawed FV-CFF (pH 11.0)
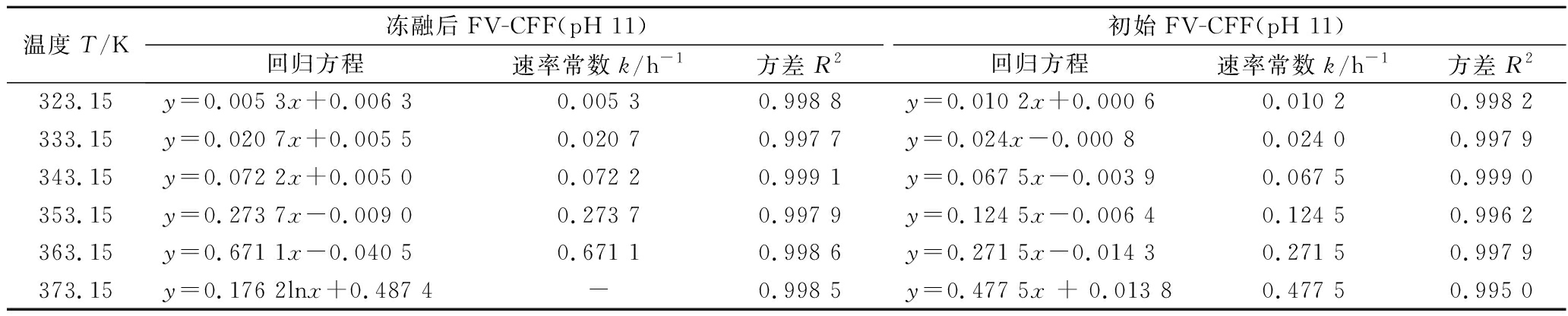
温度T/K冻融后FV-CFF(pH 11)初始FV-CFF(pH 11)回归方程速率常数k/h-1方差 R2回归方程速率常数k/h-1方差 R2323.15y=0.005 3x+0.006 30.005 30.998 8y=0.010 2x+0.000 60.010 20.998 2333.15y=0.020 7x+0.005 50.020 70.997 7y=0.024x-0.000 80.024 00.997 9343.15y=0.072 2x+0.005 00.072 20.999 1y=0.067 5x-0.003 90.067 50.999 0353.15y=0.273 7x-0.009 00.273 70.997 9y=0.124 5x-0.006 40.124 50.996 2363.15y=0.671 1x-0.040 50.671 10.998 6y=0.271 5x-0.014 30.271 50.997 9373.15y=0.176 2lnx+0.487 4-0.998 5y=0.477 5x + 0.013 80.477 50.995 0
根据阿累尼乌斯方程k=kf ·exp(-Ea/RT),将上述4种不同反应体系以1/T vs lnk作图,结果如图6和表3所示,其中,C0是AgNPs的初始含量,Ct是AgNPs的含量,单位为mmol/L;T是热力学温度,单位为K;R是摩尔气体常量,8.314472 J/(mol·K);k为速率常数,单位为h-1;kf是频率因子;Ea为活化能。以样品I为例(表3),AgNPs生成反应的速率常数与热处理温度的对数关系式为lnk=-11 902(1/T)+31.362,其对应的指数关系式为k=e31.362·exp(-11 902/T)=4.17×1013·exp(-98.96/RT),符合阿累尼乌斯方程k=kf ·exp(-Ea/RT),其表观频率常数kf = 4.17×1013h-1,表观活化能Ea=98.96 kJ/mol。
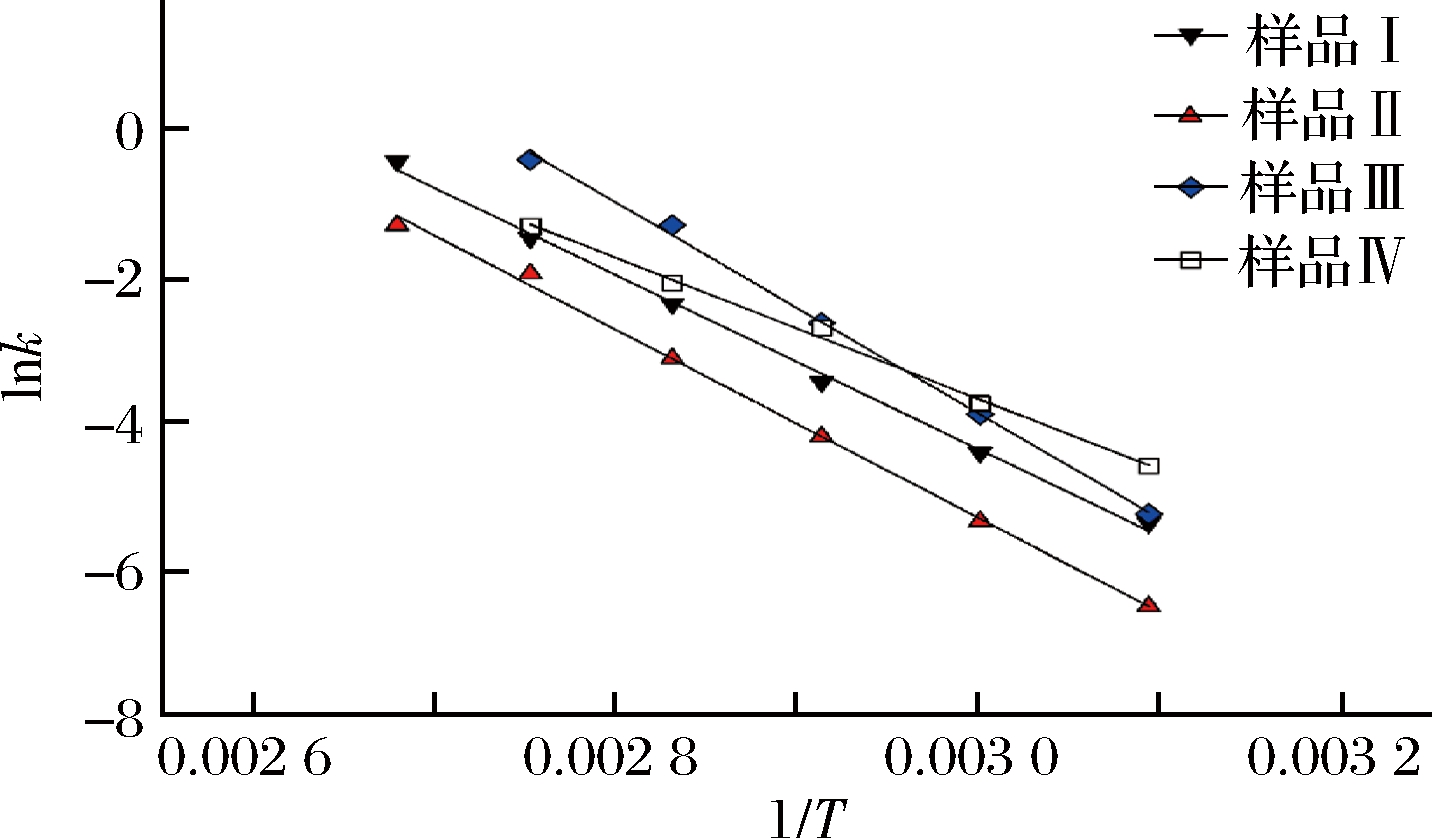
图6 不同处理条件下FV-CFF生成AgNPs的
阿累尼乌斯方程曲线图
Fig.6 The Arrhenius equation curve of AgNPs formation
using different processed FV-CFF
结果表明,4个反应体系都是零级反应(表3),此时,反应物浓度不是影响化学反应的决定因素。因此,虽然在pH提高到11时,降低了反应物的浓度,但不会影响AgNPs的生成速度。由此可知,造成4个样品中表观速率常数和表观活化能不同的因素,应当与冻融前后除去的成分以及pH的变化有关。
样品I比样品II活化能低,说明冻融前初始FV-CFF更容易生成AgNPs。初步推断,冻融后除去的絮状不溶物中含有对AgNPs生成起重要作用的成分。而通过pH对AgNPs生成的影响发现,pH 11条件下生成AgNPs的产率最高,但是此时(样品III)表观活化能却最高,为119.82 kJ/mol,说明pH的升高影响了FV-CFF中的还原成分,使其反应难度升高,但反应效率大大提升。而冻融后的样品尽管离心除去了絮状不溶物,但在pH 11(样品IV)时的表观活化能却是最低的,仅为80.21 kJ/mol,说明pH的提高大大增加了FV-CFF中剩余组分的还原力,使反应更容易发生。
表3 不同处理条件下FV-CFF反应生成AgNPs的动力学参数
Table 3 Kinetic parameters of AgNPs formation by CFF under different conditions
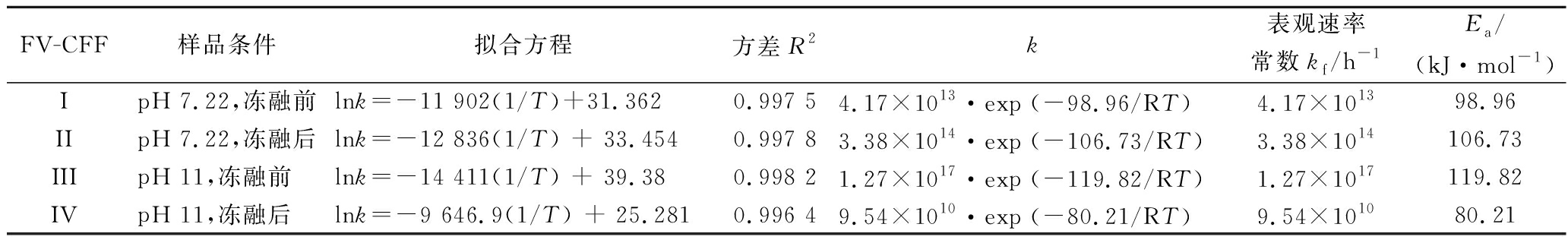
FV-CFF样品条件拟合方程方差R2k表观速率常数kf/h-1Ea/(kJ·mol-1)IpH 7.22,冻融前lnk=-11 902(1/T)+31.3620.997 54.17×1013·exp (-98.96/RT)4.17×101398.96IIpH 7.22,冻融后lnk=-12 836(1/T) + 33.4540.997 83.38×1014·exp (-106.73/RT)3.38×1014106.73IIIpH 11,冻融前lnk=-14 411(1/T) + 39.380.998 21.27×1017·exp (-119.82/RT)1.27×1017119.82IVpH 11,冻融后lnk=-9 646.9(1/T) + 25.2810.996 49.54×1010·exp (-80.21/RT)9.54×101080.21
注:样品编号与图6一致(下同)
2.3 FV-CFF的成分分析及还原力测定
2.3.1 冻融前后FV-CFF的成分分析
通过对冻融前后的FV-CFF样品进行成分分析可知(表4),初始FV-CFF样品(即样品I)中总蛋白、总糖及可溶性固形物含量均高于冻融后除去不溶物的FV-CFF样品(即样品II)。样品II中总蛋白和总糖含量降低明显,分别减少了22.24%和11.56%,结合可溶性固形物的含量变化(降低37.74%)可知,冻融后除去的絮状不溶物主要为蛋白质和多糖等大分子组分,这可能是导致样品II反应生成AgNPs活化能升高的主要原因。由表4还可看出,样品中还原糖含量较低,仅为4 μg/mL左右,且冻融对还原糖含量的影响不显著。
表4 冻融前后FV-CFF样品(pH 7.22)的成分分析
Table 4 Composition analysis of initial and thawed
FV-CFF (pH 7.22)
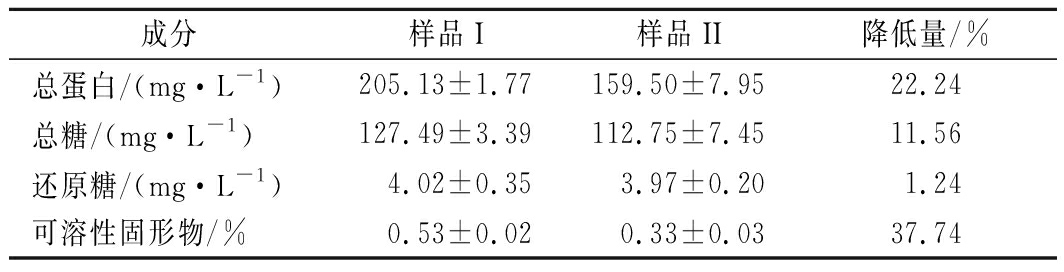
成分样品I样品II降低量/%总蛋白/(mg·L-1)205.13±1.77159.50±7.9522.24总糖/(mg·L-1)127.49±3.39112.75±7.4511.56还原糖/(mg·L-1)4.02±0.353.97±0.201.24可溶性固形物/%0.53±0.020.33±0.0337.74
2.3.2 冻融及pH对FV-CFF还原力的影响
冻融及pH对FV-CFF还原力的影响如图7所示,样品I和样品II的还原力分别为0.075和0.073,说明冻融实验虽然除去了较多蛋白和多糖等大分子可溶性固形物(表4),但起还原作用的主要成分并未受到显著影响,因此冻融前后FV-CFF样品(pH 7.22)的还原力几乎没有变化。但是,pH的升高则显著提升了FV-CFF样品的总还原力,在pH 11时样品III和样品IV的还原力分别提升至0.20和0.18,说明碱性pH显著激活了FV-CFF中起还原作用的成分,使其还原力大幅提升。

图7 不同处理条件下FV-CFF的总还原力
Fig.7 Total reducing power of FV-CFF under different conditions
注:Vc作为阳性对照,质量浓度为20 mg/L
2.4 产物AgNPs的表征
2.4.1 不同条件下生成AgNPs的UV-Vis光谱特征
由图8可知,冻融实验虽然会对FV-CFF生成AgNPs的能力产生显著影响,但不会改变产物的吸收波长,而pH的变化则可明显降低产物AgNPs的最大吸收波长。pH 11时,AgNPs的最大吸收波长由pH 7.22时的442 nm降低为411 nm,接近标品的UV-Vis吸收。
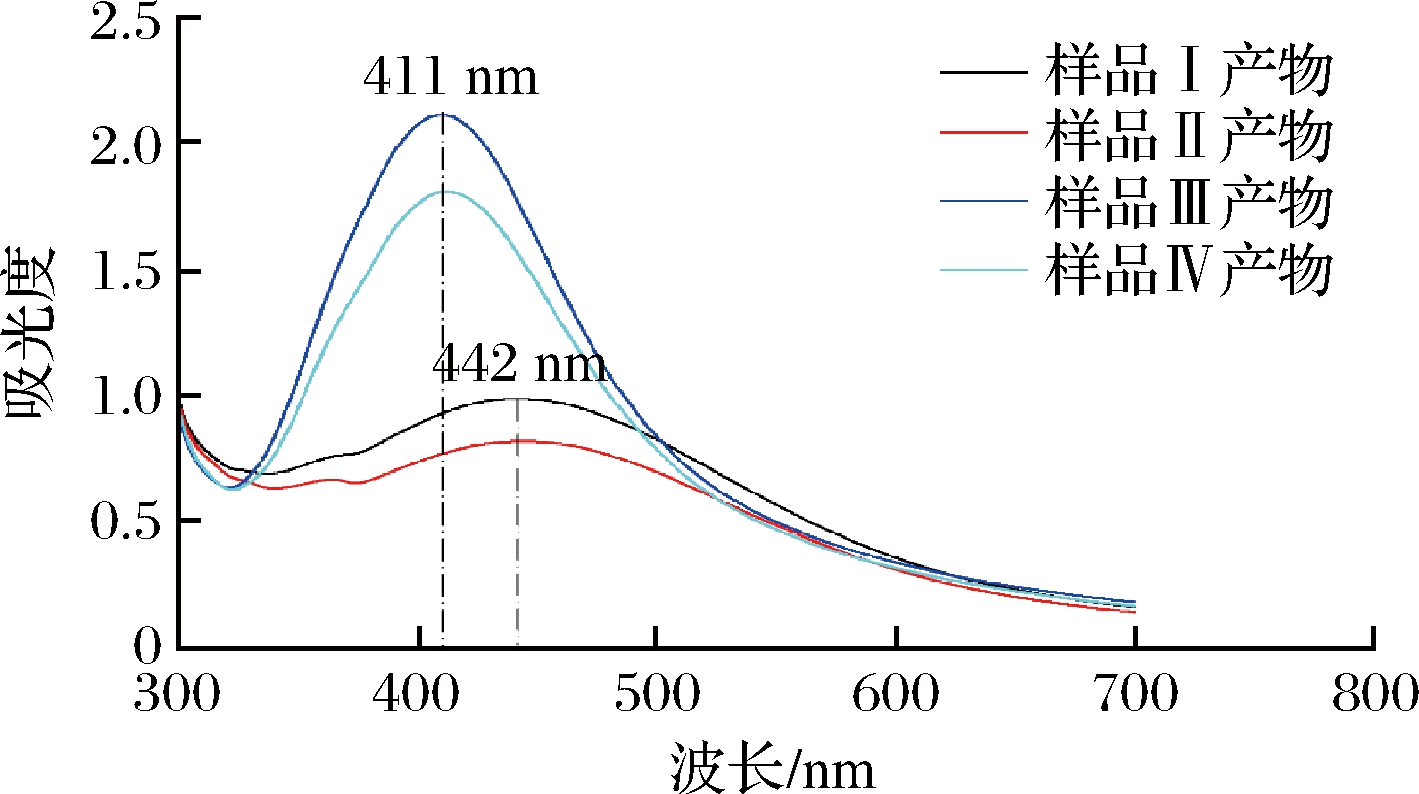
图8 不同处理条件下 FV-CFF生成AgNPs的
紫外-可见吸收光谱图
Fig.8 The UV-Vis absorption of AgNPs formation under
different processed FV-CFF
2.4.2 产物AgNPs的形貌
采用TEM观测不同条件下FV-CFF与AgNO3反应生成AgNPs的形貌特征,结果如图9所示。通过ImageJ软件分析图中颗粒尺寸可知,样品I和样品II反应产物的粒径范围均在2.2~10.5 nm,平均粒径分别为5.5和5.4 nm。样品III反应产物的平均粒径最大,为5.6 nm,但粒径范围相对较小,为2.9~9.4 nm;样品IV反应产物的平均粒径最小,为4.8 nm,但分布范围最广(1.5~10.1 nm)。此外,由图9可知,不同FV-CFF样品反应生成的AgNPs颗粒虽然多数为球形,但也有部分不规则的椭球形和多边形存在。这些纳米颗粒多数以少量聚集的状态存在,而且聚集颗粒的边缘可观测到明显的浅灰色暗影,推测是FV-CFF中的大分子成分起到了稳定剂的作用,使AgNPs在溶液中以聚集态存在。

图9 FV-CFF在不同条件下生成AgNPs的TEM图
Fig.9 TEM images of AgNPs formation under different
conditions in FV-CFF
2.4.3 样品及产物的粒度分布
产物溶液的粒径分析结果(表5)与TEM结果差异较大,这是由于FV-CFF中的大分子成分在溶液状态具有良好的分散和水化作用,使检测结果偏大。此外,由TEM分析可知,由于FV-CFF中大分子的包裹和稳定作用,AgNPs存在颗粒聚集的情况,在溶液状态下易被作为一个整体的颗粒测定,因此最终测定的粒径均大于TEM中观测到的单个纳米颗粒的粒径。
反应前不同FV-CFF溶液的平均粒径显著高于相应样品反应后的结果,说明FV-CFF在与AgNO3加热反应的过程中不仅生成了AgNPs,还使原来溶液中较大颗粒的成分紧密地包裹在银纳米颗粒的周围,起到了稳定作用,因此所生成的溶液无聚沉现象。反应后所生成的AgNPs溶液的平均粒径随pH升高而显著降低,而冻融实验则对产物平均粒径的影响不显著,说明碱性环境能降低FV-CFF中大分子成分之间的聚集,使溶液体系中的颗粒尺寸更低,也更为稳定。pH 11时FV-CFF反应生成AgNPs的Zeta电位值均高于pH 7.22时,颗粒之间存在更强的静电排斥[7],表明pH 11时制备的AgNPs具有更好的稳定性。此外,反应后生成的AgNPs溶液的多分散系数PDI均大于0.4,说明AgNPs溶液虽然具有良好的稳定性,但属于多分散体系[16],这与TEM分析结果(图9)一致。
表5 FV-CFF在不同处理条件下反应前后的粒度分布
Table 5 Size distribution of different processed FV-CFF
samples and the resulted AgNPs
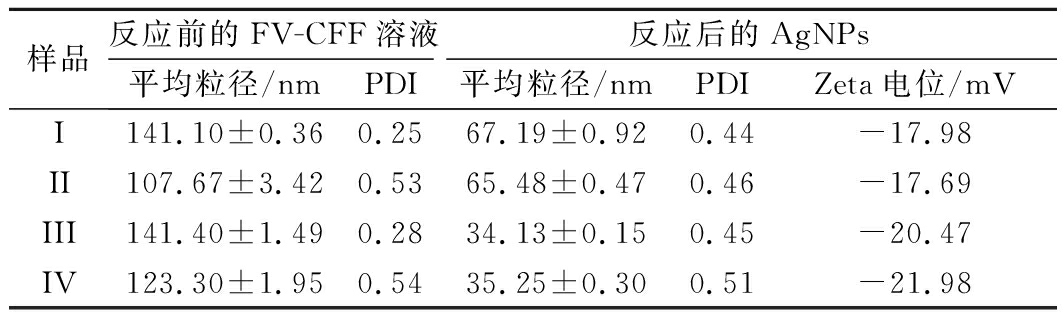
样品反应前的FV-CFF溶液反应后的AgNPs平均粒径/nmPDI平均粒径/nmPDIZeta电位/mVI141.10±0.360.2567.19±0.920.44-17.98II107.67±3.420.5365.48±0.470.46-17.69III141.40±1.490.2834.13±0.150.45-20.47IV123.30±1.950.5435.25±0.300.51-21.98
3 结论
本研究选用金针菇菌丝体作为研究对象,采用液态发酵的方式,探究AgNPs的合成效果及影响因素。结果显示,FV-CFF对AgNO3具有明显的还原效果,可生成棕褐色AgNPs稳定溶液。此外,pH对FV-CFF生成AgNPs具有显著的影响,在pH 5~11范围内,AgNPs的产量基本呈线性增加趋势。通过等温动力学实验发现,较高的pH对无菌水发酵液生成AgNPs具有显著的提高效果,而冻融后除去的絮状不溶物也对AgNPs的合成具有一定贡献。本实验合成AgNPs所用的还原剂及稳定剂为金针菇的无细胞滤液(FV-CFF),主要成分除蛋白质和碳水化合物外还含有许多未知组分,可采用可溶性固形物含量进行定量。冻融前后的成分分析及还原力测定结果显示,冻融后除去的絮状不溶物对还原力的影响有限。而pH升高至11时,还原力则大幅提升,使所生成的AgNPs具有较低的紫外可见吸收波长(411 nm)和较小的溶液粒径(~35 nm),而冻融实验对这两方面的影响较小。本研究合成AgNPs的方式简单、安全、环保,且具有反应条件温和、易于实现的优势,对于进一步解析金针菇发酵产物合成稳定AgNPs的机制具有重要的指导作用。然而,金针菇无细胞滤液中成分较为复杂,当前研究虽然发现其具有良好的AgNPs合成和稳定效果,但仍未能确认其中起还原作用的关键物质,今后需进一步分析并确认该成分,并解析其还原力受pH影响的机制。
[1] SINGH D K,KUMAR J,SHARMA V K,et al.Mycosynthesis of bactericidal silver and polymorphic gold nanoparticles:Physicochemical variation effects and mechanism[J].Nanomedicine,2018,13(2):191-207.
[2] ESKANDARI-NOJEDEHI M,JAFARIZADEH-MALMIRI H,RAHBAR-SHAHROUZI J.Hydrothermal green synthesis of gold nanoparticles using mushroom (Agaricus bisporus) extract:Physico-chemical characteristics and antifungal activity studies[J].Green Processing and Synthesis,2018,7(1):38-47.
[3] KUMAR S,LATHER V,PANDITA D.Green synthesis of therapeutic nanoparticles:An expanding horizon[J].Nanomedicine,2015,10(15):2 451-2 471.
[4] OWAID M N,IBRAHEEM I J.Mycosynthesis of nanoparticles using edible and medicinal mushrooms[J].European Journal of Nanomedicine,2017,9(1):5-23.
[5] FANG Y,ZHANG Y,WANG M,et al. In vitro bioaccessibility and speciation changes of selenium in Pleurotus eryngii during the growing stage[J].Food & Function,2018,9(8):4 493-4 499.
[6] YEHIA R S,AL-SHEIKH H.Biosynthesis and characterization of silver nanoparticles produced by Pleurotus ostreatus and their anticandidal and anticancer activities[J].World Journal of Microbiology and Biotechnology,2014,30(11):2 797-2 803.
[7] 董丽娜,刘学瑞,王慧杰,等.秀珍菇菌丝体无细胞滤液的应用:银纳米颗粒的生物合成及其抗菌活性[J].辐射研究与辐射工艺学报,2019,37(5):43-50.
DONG L,LIU X,WANG H,et al.Application of cell-free filtrate of Pleurotus geesteranus mycelium:Biosynthesis of silver nanoparticles and their antimicrobial activity[J].Journal of Radiation Research and Radiation Processing,2019,37(5):43-50.
[8] BANERJEE K,RAVISHANKAR R V.A review on mycosynthesis,mechanism,and characterization of silver and gold nanoparticles[J].BioNanoScience,2018,8(1):17-31.
[9] LIU Y,ZHANG B,IBRAHIM S A,et al.Purification,characterization and antioxidant activity of polysaccharides from Flammulina velutipes residue[J].Carbohydrate Polymers,2016,145:71-77.
[10] NARAYANAN K B,PARK H H,HAN S S.Synthesis and characterization of biomatrixed-gold nanoparticles by the mushroom Flammulina velutipes and its heterogeneous catalytic potential[J].Chemosphere,2015,141:169-175.
[11] WANG J,WANG B,ZHANG D,et al.Selenium uptake,tolerance and reduction in Flammulina velutipes supplied with selenite[J].Peer J,2016,4:e1993.
[12] LIU C,CHEUNG P.Structure and immunomodulatory activity of microparticulate mushroom sclerotial beta-glucan prepared from Polyporus rhinocerus[J].Journal of Agricultural and Food Chemistry,2019,67(32):9 070-9 078.
[13] SAMROT A V,ANGALENE J,ROSHINI S M,et al.Purification,characterization and utilization of polysaccharide of Araucaria heterophylla gum for the synthesis of curcumin loaded nanocarrier[J].International Journal of Biological Macromolecules,2019,140:393-400.
[14] NYT 2637—2014,水果和蔬菜可溶性固形物含量的测定 折射仪法[S].北京:中华人民共和国农业部,2014.
NYT 2637—2014,Refractometric Method for Determination of Total Soluble Solids in Fruits and Vegetables[S].Beijing:Ministry of Agriculture of the People’s Republic of China,2014.
[15] 唐思颉,涂传海,胡文秀,等.红茶菌发酵黄浆水的体外抗氧化活性[J].食品科学,2019,40(17):1-6.
TANG S,TU C,HU W,et al.Antioxidant activity of fermented soy whey with kombucha consortium[J].Food Science,2019,40(17):1-6.
[16] LIU B,ZHANG M,ZHOU C,et al.Synthesis of monodisperse,large scale and high solid content latexes of poly(n-butyl acrylate) by a one-step batch emulsion polymerization[J].Colloid and Polymer Science,2013,291(10):2 385-2 398.