枸杞(Lycium barbarum L.)作为传统药食两用植物,已逐渐成为健康食品并被国内外市场接受[1]。研究显示,枸杞除多糖、甜菜碱和维生素外,还富含多酚类物质,因此具有较强的抗氧化、降低胆固醇的能力[2]。枸杞中多酚类物质主要包括酚酸、花青素[3]、酚酸与多胺形成的酚酸酰胺等植物次生代谢物及其复合物[4-5]。枸杞酒作为枸杞深加工中发展最迅速的产品之一,逐渐被更多消费者接受[6]。枸杞发酵酒酒精含量低,在保留枸杞原有的营养成分基础上,还具有典型性香气特征,十分适合贫血、睡眠质量不佳的人群饮用[7]。酚酸在微生物的作用下转化为酒的重要香气成分,其中的芳香族化合物通过酵母菌发酵从儿茶素、绿原酸、阿魏酸和对羟基苯甲酸等物质中转化而来[8]。MATHEW等[9]研究显示,阿魏酸可以被酵母菌、霉菌和细菌转化为具有特殊香气的4-乙烯基苯酚和香兰素。
目前对枸杞中酚酸物质的研究多集中于酚酸物质的提取、鉴定和抗氧化能力等方面。吕海洋等[10]在宁夏枸杞中鉴定出28种多酚类物质,并首次鉴定出7种香豆酸糖苷衍生物;INBARAJ等[11]研究发现,宁夏枸杞含有槲皮素、酚酰胺及香豆酸化合物,其种类和含量都很丰富;而FORINO等[12]首次在枸杞中发现阿魏酸与酪胺形成的二聚体,并认为是枸杞中含量最高的酚类物质;ISABEL等[13]用四级杆串联飞行时间谱从宁夏枸杞中鉴定出包括绿原酸、对香豆酸、槲皮素及其衍生物等31种多酚类化合物;RODRIGUES等[14]测定了枸杞干果和枸杞胶囊中多酚的组成,发现共有8种具有生物活性的酚酸和2种黄酮类化合物,含量分别为55.5~83.7 mg/kg和172.3~2 982.4 mg/kg。目前,人们对酚酸单体物质在枸杞酒发酵过程中的变化研究较少,因此本实验通过研究不同预处理及发酵过程中酚酸的降解情况,探究枸杞酒酿造过程中酚酸含量的变化及其相应降解产物。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
枸杞,宁夏百瑞源枸杞股份有限公司;果胶酶(酶活力≥60 000 U/g),浙江博丹衡食品配料有限公司;偏重亚硫酸钠,食品级,河南千志商贸有限公司;白砂糖,食品级,当地超市;法国酿酒干酵母,法国Lamothe-Abiet公司。
1.1.2 实验试剂
环己醇(色谱纯)、无水乙醇(色谱纯)、甲醇(色谱纯)、乙腈(色谱纯)、正己烷(色谱纯)、二氯甲烷(色谱纯)、丙酮(色谱纯)、甲酸(色谱纯),美国Sigma-Aldrich公司;色谱级酚酸标准品包括儿茶酸、咖啡酸、香豆酸、绿原酸、丁香酸、阿魏酸和对羟基苯甲酸,阿拉丁(中国,上海)试剂公司。
1.1.3 仪器与设备
MS105DU电子天平,瑞士Mettler Toledo公司;DT35手持糖度仪,上海淋誉公司;SHJ-6AB磁力搅拌水浴锅,常州金坛良友仪器有限公司;3K15离心机,美国Sigma-Aldrich公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;Waters e2695高效液相色谱分析仪,美国Waters公司;手动固相微萃取(SPME)装置,美国Supelco公司;Agilent7890A-5975C气相色谱-质谱联用仪,美国Agilent公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SPX-250B-Z 生化培养箱,上海博迅实业有限公司;PB-LO pH计,赛多利斯科学仪器有限公司;JYK-C051九阳榨汁机,中国杭州九阳小家电有限公司。
1.2 实验方法
1.2.1 枸杞汁的制备
枸杞干果用蒸馏水冲洗干净,料液比为1∶5(g∶mL),加入54 mg/L的偏重亚硫酸钠,浸泡6 h后打浆,加入40 mg/L的果胶酶于40 ℃恒温水浴4 h,分装于锥形瓶中备用。
1.2.2 枸杞汁预处理条件设定
枸杞酒酿造前,必须对枸杞汁先进行预处理,即酶解、灭菌、调节pH。参考赵璐[15]的方法对5个不同预处理条件进行分析,实验均在避光以及充CO2隔氧的条件下进行,并立即分别取10 mL样品置于棕色瓶中封口待测。
对照组:将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后立即取样测定。
果胶酶处理组:将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后,按比例加入40 mg/L果胶酶酶解2 h后取样。在此期间保证烧杯充满CO2。
调节pH组:将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后,测得原汁的pH为4.8,用柠檬酸调整其pH为3.3后取样。
高压灭菌组:将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后,在0.10~0.15 MPa,121~126 ℃灭菌条件下灭菌30 min后立即取样测定。
偏重亚硫酸钠组(SO2灭菌组):将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后,加入54 mg/L偏重亚硫酸钠,使游离SO2的质量浓度达到60 mg/L,放置1 h后立即取样测定。
光照处理组:将枸杞干果和蒸馏水按1∶5(g∶mL)的料液比放入干净的榨汁机中,快速进行机械破碎后,然后放置在自然光下分别照射1、2、3、4 h,分别取样测定。
1.2.3 枸杞酒的酿造
取1.2.1小节中制备的枸杞汁,调节糖度为25°Bx,pH为3.3,接种酵母(0.20 g/L),18 ℃发酵,每天取样进行糖度、pH值和酒精度的测定,数值稳定时终止发酵。取发酵后的酒样存于-80 ℃冰箱待测。
1.2.4 酚酸含量测定
参考马先红等[16]和ADOM等[17]的方法,并做适当修改。准确称取10 mL枸杞汁或枸杞酒样品于50 mL离心管中,加入30 mL 体积分数为80%冰乙醇后于摇床振荡提取15 min。提取结束后在2 500 r/min离心10 min。移出上清液,残渣再提取2次,合并3次上清液,用0.45 μm滤膜过滤。将过滤后的上清液放置在旋转蒸发仪中,设置45 ℃,在真空条件下蒸干,并用甲醇定容至10 mL。使用0.22 μm滤膜过滤后保存于-80 ℃,用于酚酸物质含量的测定。
使用高效液相色谱(hight performance liguid chromatography,HPLC)系统测定枸杞汁或枸杞酒中酚酸含量:色谱条件参考WU等[18]的方法并作适当修改。取酚酸提取液与混和标准品溶液分别注射10 μL于HPLC系统中,反相C18柱(ZORABX SB-C18,250 mm×4.6 mm)用于色谱分离。使用双流动相梯度洗脱,包括甲醇(A相)和体积分数为0.1%甲酸水溶液(B相),洗脱程序为:0~8 min,15%~20% A;8~18 min,20%~60% A;18~30 min,60%~80% A;30~40 min,80% A;40~50 min,80%~15% A。流速1.0 mL/min,柱温30 ℃,检测波长设为288和330 nm。通过对比各标准品的保留时间和峰面积,确定样品中酚酸的组成和含量。
1.2.5 酚酸标准曲线绘制
避光准确称取儿茶素、绿原酸、咖啡酸、丁香酸、香豆酸、阿魏酸和对羟基苯甲酸标准品各2.00 mg,分别溶于冰乙醇中,待样品完全溶解,用甲醇定容到10 mL容量瓶中,4 ℃储存待用。进样前进行梯度稀释,并以各物质质量浓度为X轴,峰面积为Y轴建立线性回归方程,结果如表1所示。
表1 酚酸线性回归方程
Table 1 Phenolic acid linear regression equation

化合物名称标准曲线方程决定系数(R2)儿茶素Y=6×106X+10 6460.997 3对羟基苯甲酸Y=5×106X-427.570.999 6绿原酸Y=4×107X+99 5200.998 7咖啡酸Y=7×107X-105 8460.998 4丁香酸Y=5×107X+7 511.30.998 4香豆酸Y=1×108X+426 8220.991 6阿魏酸Y=7×107X+70 0920.999 3
1.2.6 建立模拟体系
以单纯的酵母菌在糖液中发酵做模拟体系,分别加入酚酸标准品进行酵母菌发酵,测定发酵后物质的变化与降解产物。参考文献[19]的方法配制与枸杞酒发酵环境相似的YPD培养基,准确称取蛋白胨20 g/L,加入1 000 mL蒸馏水,添加适量葡萄糖将培养基糖度调整为糖度25°Bx,调节培养基pH为3.3,121 ℃高压灭菌30 min后冷却到18 ℃左右。在无菌条件操作下,分别加入0.50 g各个酚酸标准品,接种酵母(0.2 g/L)于YPD培养基中,震荡摇匀后,于18 ℃恒温培养至培养液糖度不再变化,终止发酵,取样待测。
1.2.7 酚酸降解的挥发性物质测定
1.2.7.1 GC-MS分析[1]
色谱条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 μm),进样口温度为250 ℃,解吸时间5 min,用于GC-MS分析。载气为高纯氦气(99.999%),气体流量为1.5 mL/min,不分流。程序升温:起始温度35 ℃,保持3 min;以3 ℃/min的升温速度升至40 ℃,保持1 min;再以5 ℃/min的升温速度升至210 ℃,保持10 min。
质谱条件:接口温度270 ℃,离子源温度为230 ℃,EI为电离源,电子能量为70 eV,灯丝流量为0.20 mA,检测器电压为350 V,扫描范围为45~450 Amu。
1.2.7.2 定性定量分析
定性分析:分析结果运用NIST谱库进行初步检索和分析,再结合相关文献进行人工谱图解析,进而确认各个待测组分的化学组成。
定量分析:采用内标环己酮(质量浓度为0.285 μg/mL)进行相对定量分析。即假设各物质响应频率和内标物质相同,通过待测组分与内标物质峰面积之比,计算待测物质的含量(μg·mL-1)。计算方法如公式(1):
待测物质质量浓度=
(1)
1.3 数据处理与统计分析
采用SPSS 20.0和Excel分析和处理数据,单向方差分析(ANOVA)区分样品之间的显著差异,数据以平均值±标准差表示。
2 结果与分析
2.1 发酵过程中酚酸单体分析
通过对照标准品与高分辨质谱分析,从枸杞汁和枸杞酒色谱峰中共确定了7种酚类物质单体。根据相应化合物的标准曲线方程,计算7种酚酸单体的含量,如表2所示。
表2 枸杞酒中酚酸物质组成及显著性分析 单位:μg/mL
Table 2 Composition and significance analysis of
polyphenols acid in goji wine
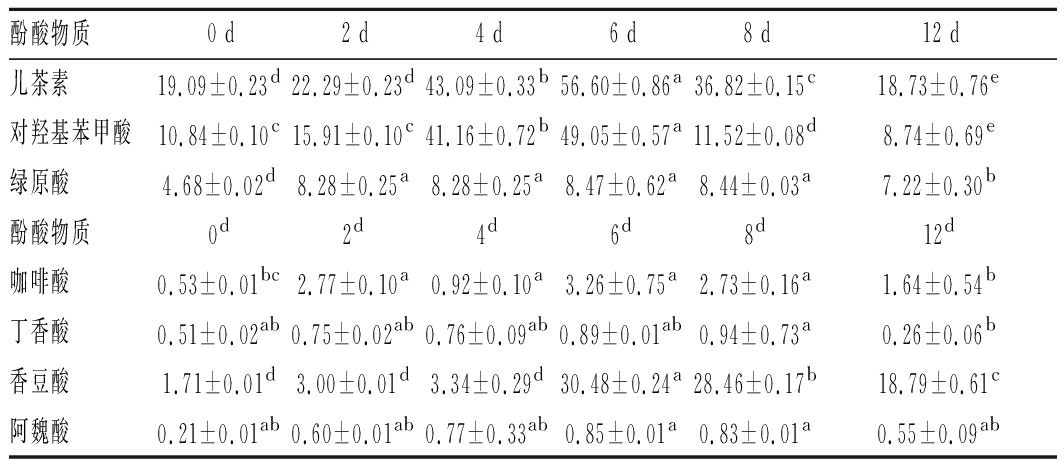
酚酸物质0 d2 d4 d6 d8 d12 d儿茶素19.09±0.23d22.29±0.23d43.09±0.33b56.60±0.86a36.82±0.15c18.73±0.76e对羟基苯甲酸10.84±0.10c15.91±0.10c41.16±0.72b49.05±0.57a11.52±0.08d8.74±0.69e绿原酸4.68±0.02d8.28±0.25a8.28±0.25a8.47±0.62a8.44±0.03a7.22±0.30b酚酸物质0d2d4d6d8d12d咖啡酸0.53±0.01bc2.77±0.10a0.92±0.10a3.26±0.75a2.73±0.16a1.64±0.54b丁香酸0.51±0.02ab0.75±0.02ab0.76±0.09ab0.89±0.01ab0.94±0.73a0.26±0.06b香豆酸1.71±0.01d3.00±0.01d3.34±0.29d30.48±0.24a28.46±0.17b18.79±0.61c阿魏酸0.21±0.01ab0.60±0.01ab0.77±0.33ab0.85±0.01a0.83±0.01a0.55±0.09ab
注:不同小写字母代表差异显著性,P<0.05
实验结果显示,7种酚酸单体物质在发酵前期(0~4 d)含量呈上升趋势,在发酵第4~5 天达到峰值。原因是发酵前期,酵母菌大量繁殖,释放出大量酶,使得枸杞汁中的酚酸物质释放出来,从而使得各单体酚酸含量上升。发酵中期(4~6 d)时,因为酚酸结构不稳定,极易受外界环境如发酵温度、光照、氧化等影响发生降解[21],且随着酚酸物质不断氧化缩合,各单体酚酸含量均出现下降趋势。而在发酵后期(6~12 d),发酵体系达到稳定状态,因此酚酸含量变化不大。
2.2 不同预处理对酚酸物质的影响
2.2.1 对酚酸含量的影响
由图1看出,与对照组相比,调节pH时,只有咖啡酸含量变化较为明显,增长约为3.06倍;果胶酶处理组中有咖啡酸、阿魏酸、对羟基苯甲酸和丁香酸的含量变化明显,其含量分别增长约为5.78、3.34、2.60和2.50倍;光照处理时,只有咖啡酸含量变化较为明显,增长约为2.67倍;高压灭菌处理时咖啡酸、阿魏酸和儿茶素的含量变化明显,其含量分别增长约为10.48、6.00和3.12倍;SO2灭菌时只有咖啡酸含量变化较为明显,增长约为3.37倍。
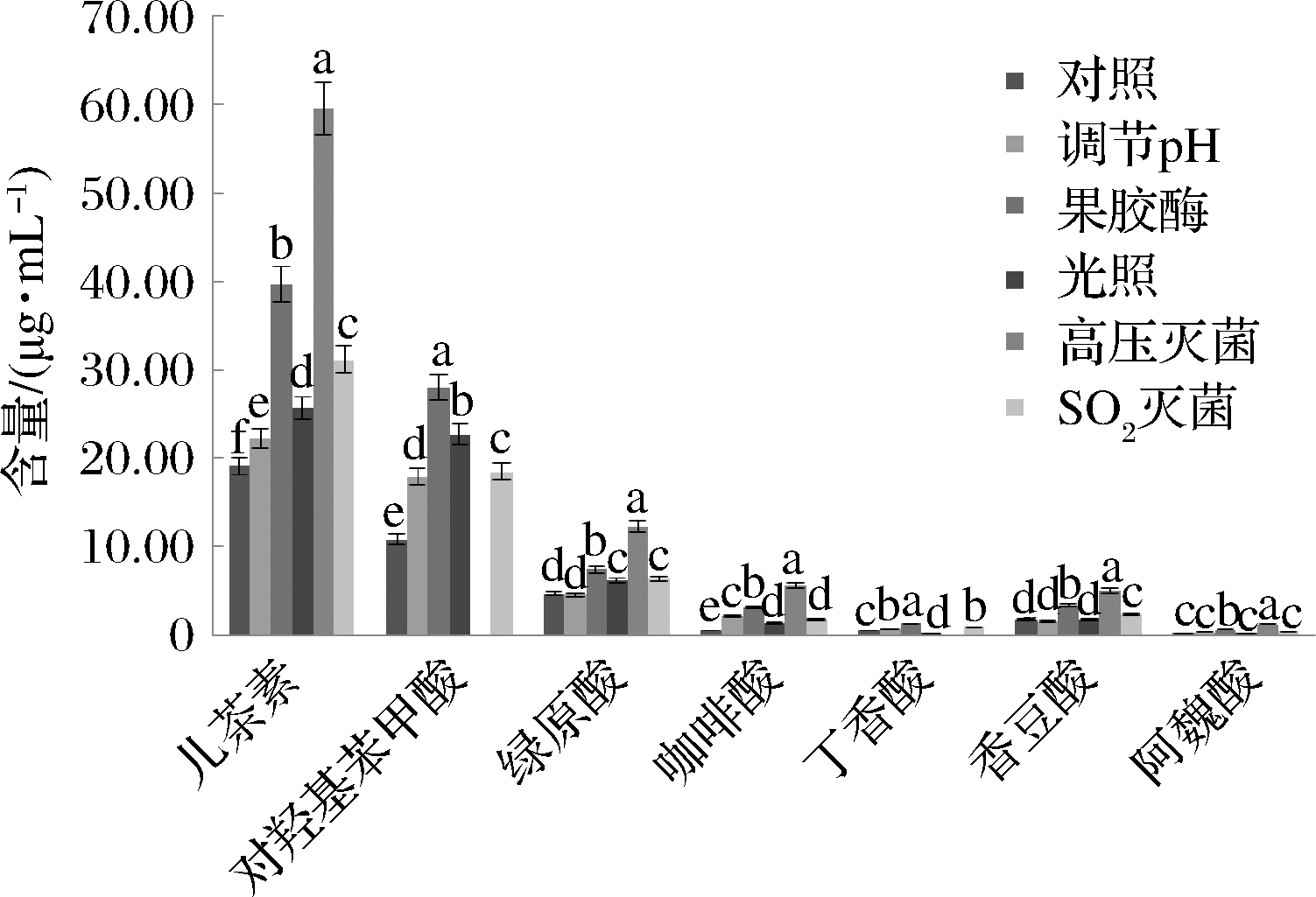
图1 不同预处理对枸杞汁中酚酸含量的影响
Fig.1 Effects of different pretreatments on phenolic
acid content in goji juice
综上所述,预处理对酚酸降解影响最大的是果胶酶处理,因为果胶酶是复杂的复合酶,其中的纤维素酶和半纤维素酶会使枸杞细胞壁发生酶解,包裹在细胞内部的酚酸得到进一步释放,因此酚酸含量会小幅度增加。绿原酸和香豆酸因其化学结构中所含C![]() C双键和苯环相结合,因此结构较为稳定,受预处理条件影响较小,但这2种酚酸在高压灭菌处理时,含量变化较明显。调节pH对酚酸降解影响最小,因为酸性条件对酚酸有保护作用,故酚酸含量相对稳定。
C双键和苯环相结合,因此结构较为稳定,受预处理条件影响较小,但这2种酚酸在高压灭菌处理时,含量变化较明显。调节pH对酚酸降解影响最小,因为酸性条件对酚酸有保护作用,故酚酸含量相对稳定。
2.2.2 枸杞汁中酚酸降解产物
由表3看出,5个不同条件下都测到了降解产物,其中酚酸经过果胶酶处理后生成的降解产物种类最多,分别为2,5-二甲基吡嗪、苯乙酮、4-乙基愈创木酚、苯乙酸乙酯、2,4-二叔丁基苯酚、丙酸和异丁酸乙酯。偏重亚硫酸钠组次之,产生了2,5-二甲基吡嗪苯乙酮4-乙基愈创木酚、2,4-二叔丁基苯酚、丙酸、异丁酸乙酯;高压灭菌处理后的枸杞汁,检测到的酚酸降解产物最少,只有2,5-二甲基吡嗪、苯乙酮和2,4-二叔丁基苯酚。说明果胶酶破坏分子键的化学作用和偏重亚硫酸钠的还原作用,比高压灭菌的物理作用强。
2.3 枸杞酒发酵中酚酸变化规律
由表4看出,发酵前后,酚酸中含量变化最大的是咖啡酸,其次是丁香酸,变化最小的是儿茶素。说明双键含量越多,越不稳定。实验测定含量相对较多的降解物有6种,分别为2,5-二甲基吡嗪、苯乙酮、4-
表3 不同预处理条件下酚酸降解产物 单位:μg/mL
Table 3 Phenolic acid degradation products under
different pretreatment conditions

预处理实验组降解产物含量对照组2,5-二甲基吡嗪0.42±0.014-乙基愈创木酚43.72±0.012,4-二叔丁基苯酚2.06±0.02丙酸0.37±0.01异丁酸乙酯0.32±0.02果胶酶处理组2,5-二甲基吡嗪0.74±0.02苯乙酮0.52±0.014-乙基愈创木酚35.75±0.01苯乙酸乙酯2.45±0.022,4-二叔丁基苯酚0.63±0.03丙酸0.85±0.02异丁酸乙酯0.52±0.01调节pH组4-乙基愈创木酚38.72±0.01苯乙酸乙酯0.86±0.012,4-二叔丁基苯酚2.06±0.02乙酸异戊酯0.87±0.03丙酸0.64±0.01高压灭菌组2,5-二甲基吡嗪0.32±0.01苯乙酮0.27±0.022,4-二叔丁基苯酚0.33±0.02SO2灭菌组2,5-二甲基吡嗪0.51±0.01苯乙酮0.63±0.024-乙基愈创木酚34.78±0.012,4-二叔丁基苯酚2.35±0.02丙酸0.37±0.01异丁酸乙酯0.28±0.02光照组2,5-二甲基吡嗪0.36±0.01苯乙酮0.19±0.024-乙基愈创木酚36.54±0.012,4-二叔丁基苯酚3.18±0.02
乙基愈创木酚、苯乙酸乙酯、2,4-二叔丁基苯酚和乙酸异戊酯。7种酚酸都在最不稳定的双键位置断裂,同时容易在羰基被还原、羟基被氧化,产生了降解物和与降解相关的物质。
枸杞酒发酵结束后阿魏酸含量下降了28.57%,阿魏酸的C3—C4键连接C![]() C和苯环,C6键则连接苯环和酯键,断裂后与苏氨酸发生缩合、氧化反应生成2,5-二甲基吡嗪;在C3—C4和C6键断裂,C7的羟基被氧化时会生成苯乙酮;而C2—C3 键断裂的阿魏酸则会降解成4-乙基愈创木酚。对于咖啡酸,发酵结束后含量下降了54.72%,当C2—C3键断裂时,会生成丙酸;当C2—C3键断裂,C2加氧氧化时会生成苯乙酸乙酯;当C2—C3键断裂,C6的羟基被还原时会生成2,4-二叔丁基苯酚。对于儿茶素,发酵结束后含量下降了1.89%,当C3—C4,C6—C7和C9—C10键断裂时,生成乙酸异戊酯;当C7—C8键断裂,C12的羟基被还原时,生成2,4-二叔丁基苯酚。发酵结束后香豆酸的含量下降了36.26%,当C1—C2键断裂,C7的羟基被氧化时,生成4-甲氧基苯乙烯。对于绿原酸,发酵结束后含量下降了14.10%,且当C5—C6,C6—C7和C9—C10键断裂时,生成异丁酸乙酯;当C3—C4和C6键断裂,C7的羟基被氧化时,生成2,5-二甲基吡嗪;当C10—C11和C13键断裂,C14的羟基被氧化时,生成苯乙酮。对羟基苯甲酸的含量在发酵结束后下降了19.37%,当C3—C4,C6—C7和C9—C10键断裂时,生成乙酸异戊酯。发酵结束后的丁香酸含量则下降了49.02%,且当C2—C3键断裂,C6的羟基被还原时,生成乙酸异戊酯。
C和苯环,C6键则连接苯环和酯键,断裂后与苏氨酸发生缩合、氧化反应生成2,5-二甲基吡嗪;在C3—C4和C6键断裂,C7的羟基被氧化时会生成苯乙酮;而C2—C3 键断裂的阿魏酸则会降解成4-乙基愈创木酚。对于咖啡酸,发酵结束后含量下降了54.72%,当C2—C3键断裂时,会生成丙酸;当C2—C3键断裂,C2加氧氧化时会生成苯乙酸乙酯;当C2—C3键断裂,C6的羟基被还原时会生成2,4-二叔丁基苯酚。对于儿茶素,发酵结束后含量下降了1.89%,当C3—C4,C6—C7和C9—C10键断裂时,生成乙酸异戊酯;当C7—C8键断裂,C12的羟基被还原时,生成2,4-二叔丁基苯酚。发酵结束后香豆酸的含量下降了36.26%,当C1—C2键断裂,C7的羟基被氧化时,生成4-甲氧基苯乙烯。对于绿原酸,发酵结束后含量下降了14.10%,且当C5—C6,C6—C7和C9—C10键断裂时,生成异丁酸乙酯;当C3—C4和C6键断裂,C7的羟基被氧化时,生成2,5-二甲基吡嗪;当C10—C11和C13键断裂,C14的羟基被氧化时,生成苯乙酮。对羟基苯甲酸的含量在发酵结束后下降了19.37%,当C3—C4,C6—C7和C9—C10键断裂时,生成乙酸异戊酯。发酵结束后的丁香酸含量则下降了49.02%,且当C2—C3键断裂,C6的羟基被还原时,生成乙酸异戊酯。
表4 枸杞酒发酵中酚酸变化规律
Table 4 Changes of phenolic acid in fermentation of goji wine

结构式下降率%保留指数降解产物及其结构式含量/(μg·mL-1)断键位点28.571 6480.61±0.01C3—C4和C6键断裂,与枸杞中苏氨酸发生缩合、氧化反应[22]1 7520.36±0.02C3—C4和C6键断裂,C7羟基被氧化2 20957.71±0.23C2—C3键断裂54.721 5510.22±0.03C2—C3键断裂1 7880.56±0.01C2—C3键断裂,C2加氧氧化1 6590.25±0.01C2—C3键断裂,C6羟基被还原1.891 1220.63±0.01C3—C4,C6—C7和C9—C10键断裂1 6594.66±0.02C7—C8键断裂,C12羟基被还原36.261 8060.37±0.01C1—C2键断裂,C7羟基被氧化14.101 5120.26±0.03C5—C6,C6—C7和C9—C10键断裂1 6480.23±0.02C3—C4和C6键断裂,C7羟基被氧化1 7520.15±0.01C10—C11和C13键断裂,C14羟基被氧化
续表4
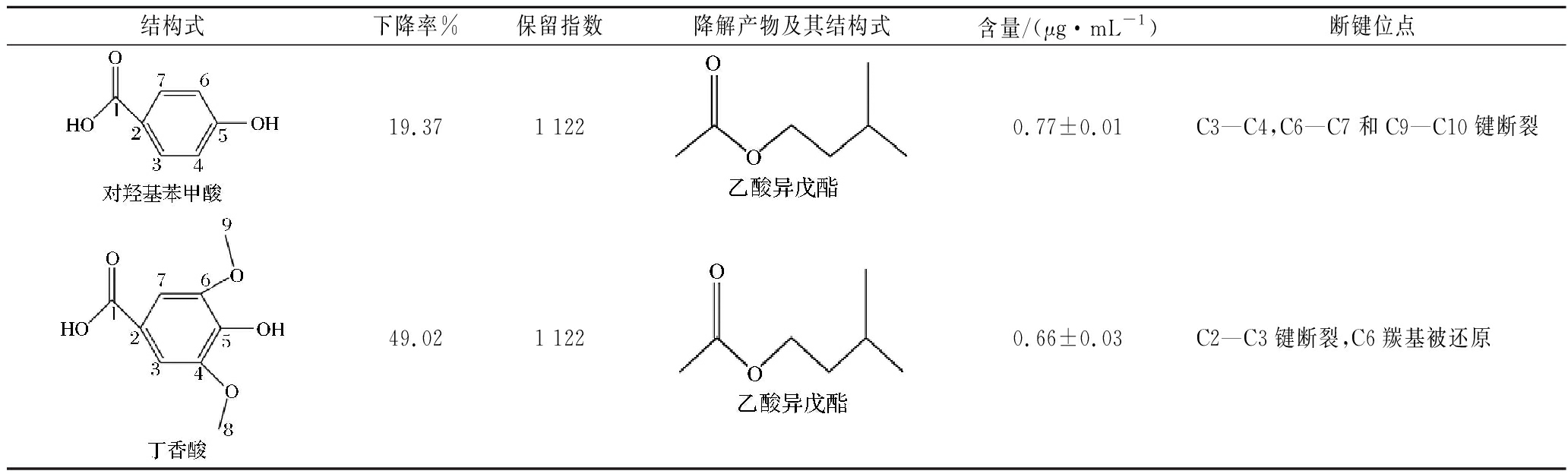
结构式下降率%保留指数降解产物及其结构式含量/(μg·mL-1)断键位点19.371 1220.77±0.01C3—C4,C6—C7和C9—C10键断裂49.021 1220.66±0.03C2—C3键断裂,C6羰基被还原
2.4 模拟体系中酚酸的降解产物分析
由表4和表5比较分析,发酵模拟体系与枸杞酒中酚酸单体降解产物种类相同,含量的数据基本吻合,模拟体系中酚酸降解产物有9种,枸杞酒发酵后的酚酸降解产物有8种,两者有差异的原因可能是枸杞酒发酵前预处理或发酵环境引起的。
表5 模拟体系中酚酸降解产物分析
Table 5 Analysis of phenolic acid degradation products
in simulated systems
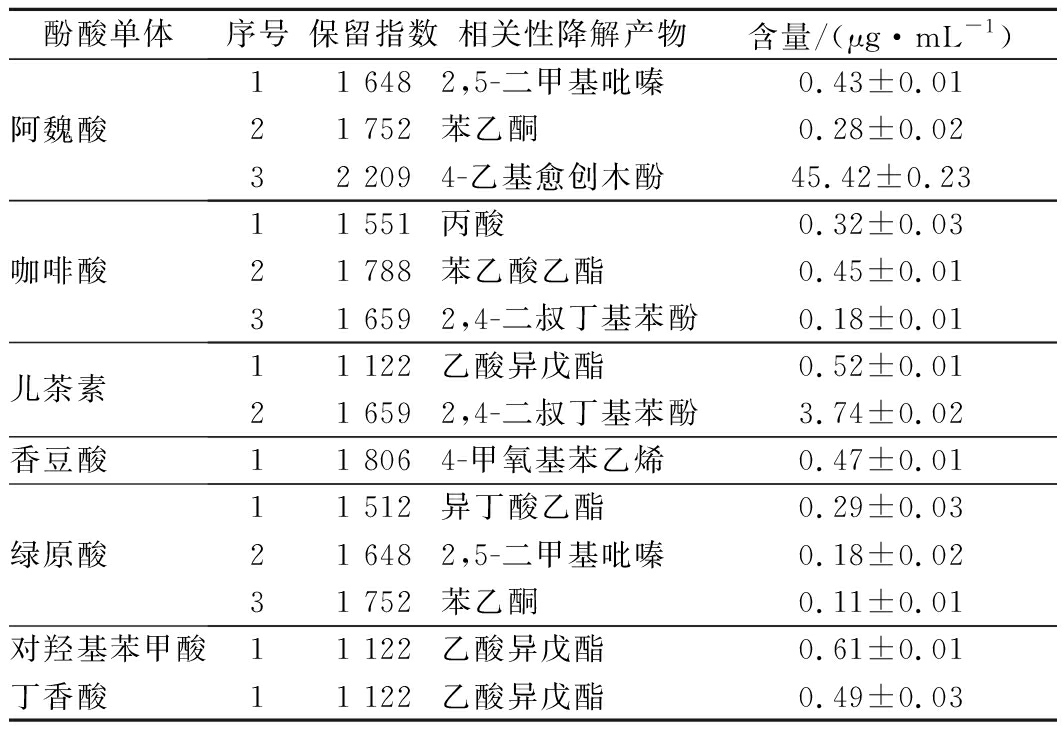
酚酸单体序号保留指数相关性降解产物含量/(μg·mL-1)阿魏酸11 6482,5-二甲基吡嗪0.43±0.0121 752苯乙酮0.28±0.0232 2094-乙基愈创木酚45.42±0.23咖啡酸11 551丙酸0.32±0.0321 788苯乙酸乙酯0.45±0.0131 6592,4-二叔丁基苯酚0.18±0.01儿茶素11 122乙酸异戊酯0.52±0.0121 6592,4-二叔丁基苯酚3.74±0.02香豆酸11 8064-甲氧基苯乙烯0.47±0.01绿原酸11 512异丁酸乙酯0.29±0.0321 6482,5-二甲基吡嗪0.18±0.0231 752苯乙酮0.11±0.01对羟基苯甲酸11 122乙酸异戊酯0.61±0.01丁香酸11 122乙酸异戊酯0.49±0.03
3 结论
本研究对枸杞酒酿造过程中不同预处理条件和发酵过程中酚酸含量及降解产物的变化进行测定,发现酚酸在枸杞酒酿造过程中,因其含有多不饱和双键、酯键、羟基基团,不稳定因素非常多,容易发生降解、氧化、还原反应,产生2,5-二甲基吡嗪、苯乙酮、4-乙基愈创木酚、丙酸、苯乙酸乙酯、2,4-二叔丁基苯酚、4-甲氧基苯乙烯和乙酸异戊酯。解析了枸杞中酚酸物质在枸杞发酵前后的变化规律,为进一步探究酚酸降解产物对枸杞酒品质的影响提供了基础。
[1] YAO R Y,HEINRICH M,WECKERLE C S.The genus Lycium as food and medicine:A botanical,ethnobotanical and historical review[J].Journal of Ethnopharmacology,2018,212:50-66.
[2] 武芸,王春林,王丽朋,等.黑果枸杞多酚吸附分离特性及抗氧化性研究[J].食品与发酵工业,2020.DOI:10.13995/j.cnki.11-1802/ts.025714.
WU Y,WANG C L,WANG L P,et al.Lycium ruthenicum Murr.polyphenols adsorption separation properties and oxidation resistance[J].Food and Fermentation Industries,2020.DOI:10.13995/j.cnki.11-1802/ts.025714.
[3] LI Y,ZOU X,SHEN T,et al.Determination of geographical origin and anthocyanin content of black goji berry (Lycium ruthenicum Murr.) using near-infrared spectroscopy and chemometrics[J].Food Analytical Methods,2017,10(4):1 034-1 044.
[4] DELGADO A M,ISSAOUI M,CHAMMEM N.Analysis of main and healthy phenolic compounds in foods[J].Journal of AOAC International,2019,102(5):1 356-1 364.
[5] HUANG W,CAI Y,ZHANG Y.Natural phenolic compounds from medicinal herbs and dietary plants:Potential use for cancer prevention[J].Nutrition and Cancer,2010,62(1):1-20.
[6] 万娜,戴国礼.枸杞深加工产业发展趋势的研究[J].食品安全质量检测学报,2018,9(20):5 328-5 332.
WAN N,DAI G L.Research on the development trend of deep processing industry of Lycium barbarum[J].Food Safety and Quality Detection Technology,2018,9(20):5 328-5 332.
[7] 梁颖,马蓉,李亚辉,等.枸杞酒酿造技术及香气分析研究进展[J].中国酿造,2019,38(2):16-20.
LIANG Y,MA R,LI Y H,et al.Research progress in brewing technology and aroma analysis of wolfberry wine[J].China Brewing,2019,38(2):16-20.
[8] 马宇,黄永光.清酱香型白酒挥发性风味组分及香气特征[J].食品科学,2019,40(20):241-248.
MA Y,HUANG Y G.Volatile components and aroma characteristics of Fen-Maotai-Flavored liquor[J].Food Science,2019,40(20):241-248.
[9] MATHEW S,ABRAHAM T E,SUDHEESH S.Rapid conversion of ferulic acid to 4-vinyl guaiacol and vanillin metabolites by Debaryomyces hansenii[J].Journal of Molecular Catalysis B,Enzymatic,2006,44(2):48-52.
[10] 吕海洋,幸岑璨,高梦笛,等.宁夏枸杞多酚Q-TOF/MSE分析及对细胞抗氧化能力的影响[J].核农学报,2017,31(2):298-306.
LV H Y,XING C C,GAO M D,et al.Analysis of Ningxia Lycium barbarum polyphenols by Q-TOF/MSE and its effect on cellular antioxidant capacity.[J].Journal of Nuclear Agriculture Sciences,2017,31(2):298-306.
[11] INBARAJ B S,LU H,KAO T H,et al.Simultaneous determination of phenolic acids and flavonoids in Lycium barbarum Linnaeus by HPLC-DAD-ESI-MS[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(3):549-556.
[12] FORINO M,TARTAGLIONE L,DELL’AVERSANO C,et al.NMR-based identification of the phenolic profile of fruits of Lycium barbarum (goji berries).Isolation and structural determination of a novel N-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries[J].Food Chemistry,2016,194:1 254-1 259.
[13] ISABEL B,OTTO S,RIITTA T R N,et al.Metabolic profiling of goji berry extracts for discrimination of geographical origin by non-targeted liquid chromatography coupled to quadrupole time-of-flight mass spectrometry[J].Food Research International,2014,63:132-138.
[14] RODRIGUES S R,DA C C J,DE ANDRADE S D,et al.Multielementar/centesimal composition and determination of bioactive phenolics in dried fruits and capsules containing Goji berries (Lycium barbarum L.)[J].Food Chemistry,2019,273:15-23.
[15] 赵璐.枸杞酒制作中类胡萝卜素降解产物降异戊二烯分析研究[D].银川:宁夏大学,2018.
ZHAO L.Analysis of isoprene degradation products of carotenoids in wolfberry wine during fermentation process[D].Yinchuan:Ningxia University,2018.
[16] 马先红,刘景圣,李艳红.发芽对粮食酚类化合物及抗氧化活性的影响[J].食品研究与开发,2015,36(24):197-200.
MA X H,LIU J S,LI Y H.Effects of germination on the phenolic compounds and antioxidant activity of grain[J].Food Research and Development,2015,36(24):197-200.
[17] ADOMA K K,LIU R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50(21):6 182-6 187.
[18] WU G,JOHNSON S K,BORNMAN J F,et al.Growth temperature and genotype both play important roles in sorghum grain phenolic composition[J].Scientific Reports,2016,6.DOI:10.1038/srep21835.
[19] SHANAKA K A S N,THARUKA M D,SELLATHTHURAI S,et al.Characterization and expression analysis of rockfish (Sebastes schlegelii) myeloid differentiation factor-88 (SsMyD88) and evaluation of its ability to induce inflammatory cytokines through NF-κB[J].Fish and Shellfish Immunology,2020,99:59-72.
[20] LU,LI,QUAN,et al.Identification of characteristic aroma volatiles of Ningxia goji berries (Lycium barbarum L.) and their developmental changes[J].International Journal of Food Properties,2017,20(1):214-217.
[21] 矫馨瑶,李恩惠,王月华,等.蓝莓多酚稳定性及热降解动力学研究[J].中国食品学报,2018,18(1):81-87.
JIAO X Y,LI E H,WANG Y H,et al.Study on stability and thermal degradation kinetics of blueberry polyphenols[J].Journal of Chinese Institute of Food Science and Technology,2018,18(1):81-87.
[22] ZHANG L J,CAO Y L,TONG J N,et al.An alkylpyrazine synthesis mechanism involving l-threonine-3-dehydrogenase describes the production of 2,5-dimethylpyrazine and 2,3,5-trimethylpyrazine by Bacillus subtilis[J].Applied and Environmental Microbiology,2019,85(24).DOI:10.1128/AEM.01 807-19.