L-异亮氨酸属于分支链氨基酸,是人体必需氨基酸之一,作为重要的食品添加剂,可调节食品中的氨基酸平衡[1],强化食品的营养价值,同时在肝脏中不能被降解,可直接进入血液,将直接影响肝脏中血糖的水平,被用于配制特殊的治疗型输液及药物,因而被广泛应用于食品和医药等行业,具有巨大的商业价值[2]。
L-异亮氨酸菌种改造及发酵优化的方法很多,菌体诱变有通过常温常压等离子体诱变[3]、采用紫外、亚硝基胍等复合诱变手段[4-5];菌种改造有过表达双组份转运系统BrnFE操纵子[6]、利用基因重组技术替换ilv LXGMEDA启动子并过表达解除L-异亮氨酸反馈抑制的ilv A和ilv IH等方法[7-8];发酵优化有对培养基成分葡萄糖、玉米浆、硫酸铵等的优化[9-10],也有对pH[11]、溶氧等在线条件优化[12-13],这些方法对L-异亮氨酸产量的提高都有很大帮助。
对于谷氨酸棒杆菌发酵产L-异亮氨酸的最大难题在于副产物积累过多,导致抑制菌体细胞生长,降低菌体活力、产酸下降。本实验通过全营养流加工艺[14],探究底物培养基与流加料最适浓度,使菌体始终处于最适发酵环境[16]。实验分为低浓度全营养流加,低初始营养偶联发酵全营养流加,丝肽粉等比例替换玉米浆全营养流加3个阶段,找出L-异亮氨酸产量最高、副产物缬氨酸(valine,Val),亮氨酸(leucine,Leu),丙氨酸(alanine,Ala)最低的流加条件;同时利用氮源替换实验,探究出玉米浆与丝肽粉对发酵的影响[17]。
1 材料与方法
1.1 菌种
谷氨酸棒杆菌(Corynebacterium glutamate)YILM1504 (LysL+MetL+AHVr+SGr+Ile-Hxr),由天津科技大学代谢工程实验室保存。
1.2 发酵培养基
发酵培养基(1):葡萄糖70 g/L,蛋白胨10 g/L,酵母粉2 g/L,(NH4)2SO4·7H2O 3 g/L,KH2PO4 2.2 g/L,VB1 0.2 mg/L,豆饼水解液20 mL/L,赖氨酸1 g/L,谷氨酸3 g/L,甲硫氨酸0.2 g/L,玉米浆干粉50 g/L。
发酵培养基(2):葡萄糖70 g/L,蛋白胨10 g/L,酵母粉2 g/L,(NH4)2SO4·7H2O 3 g/L,KH2PO4 2.2 g/L,VB1 0.2 mg/L,豆饼水解液20 mL/L,赖氨酸1 g/L,谷氨酸3 g/L,甲硫氨酸0.2 g/L,丝肽粉 50 g/L。
1.3 仪器与设备
LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;5 L 自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E 生物传感分析仪,山东省科学院生物研究所;Agilent1200高效液相色谱仪,Agilent Technologies;KQ-C 高压蒸汽发生器,上海奉贤协新机电厂;752 分光光度计,上海分析仪器厂;OLYMPUS 生物显微镜,日本 OLYMPUS 会社。
1.4 培养方法
斜面培养条件:一代试管斜面活化2根,恒温箱32 ℃培养24 h,二代茄形瓶斜面活化2支,恒温箱32 ℃培养18 h。
种子罐培养条件:接种量2支茄形瓶,发酵体积2 L,培养温度32 ℃,pH 6.8~7.0,溶氧30%以上,通风2.0 L/min,罐压0.05 MPa,初始转速200 r/min,转速上限930 r/min,转速与溶氧联动,种子培养12~15 h。
发酵罐培养条件:接种量600 mL,发酵体积3 L, 培养温度32 ℃,pH 6.8~7.0,溶氧30%以上,转速由200 r/min逐步提加到930 r/min;通风由2.0 L/min逐步提升到6.0 L/min,转速与溶氧联动,发酵时间36~40 h。
1.5 实验方法
1.5.1 高浓度底料、低浓度全营养流加方法
A(B、C、D)流加策略为发酵罐配制100%(1)号培养基2.7 L,从20 h流加300 mL 0%(5%、10%、15%)(1)号培养基浓缩液,浓缩液40 h流加完。
1.5.2 低初始营养偶联发酵全营养流加策略
E(F、G、H)流加策略为发酵罐配制10%(30%、50%、70%)(1)号培养基2.7 L,从0 h流加300 mL 90%(70%、50%、30%)(1)号培养基浓缩液,浓缩液全程流加,底料与流加料质量固定为3 L(1)号培养基。
1.5.3 丝肽粉等比例替换玉米浆全营养流加方法
将(1)号培养基中玉米浆等质量置换为丝肽粉成为(2)号培养基。
I、J、K流加策略以F流加策略为基准,分别将其中的(1)号培养基等比例置换成30%、70%、100%(2)号培养基。全营养流加策略如表1所示。
1.6 检测方法
1.6.1 pH值测定
发酵罐自带的梅特勒pH在线检测,用pH试剂进行放液验证检测。
1.6.2 菌体生物量测定
菌体生物量以每升发酵液中菌体干重(g DCW/L)表示。发酵液离心后用去离子水洗涤菌体2次,于80 ℃恒温箱中加热至恒重后,用分析天平称重。
表1 全营养流加策略
Table 1 Total nutrient flow plus strategy

流加策略全营养流加方法底料培养基流加培养基A100%(1)0%(1)B低浓度全营养流加策略100%(1)5%(1)C100%(1)10%(1)D100%(1)15%(1)E10%(1)90%(1)F低初始营养偶联发酵全营养流加策略30%(1)70%(1)G50%(1)50%(1)H70%(1)30%(1)I30%[70%(1)+30%(2)]70%[70%(1)+30%(2)]J丝肽粉等比例替换玉米浆全营养流加策略30%[30%(1)+70%(2)]70%[30%(1)+70%(2)]K30%(2)70%(2)
1.6.3 L-异亮氨酸及副产物测定
发酵液中L-异亮氨酸和副产物浓度用高效液相色谱法测定。采用AgilentC18(15 mm×4.6 mm,3.5 μm)色谱柱,衍生剂为2,4-二硝基氟苯,柱前衍生,流动相为50%的乙腈、4.1 g/L的醋酸钠溶液,柱温33 ℃,流速1 mL/min,检测波长360 nm。
1.7 计算方法
糖酸转化率(sugar acid,SA)计算如公式(1)所示:
(1)
式中:ρ,L-异亮氨酸质量浓度,g/L;V,发酵液总体积,L;m,总耗糖量,g。
所有实验数据取3次实验的平均值。单因素方差分析之后Dunnet t检验来确定数据差异的显著性(P<0.05)。
2 结果与分析
2.1 低浓度全营养流加对发酵的影响
在氨基酸生产过程中,常采用一次性投料发酵,但初始发酵时发酵液中高浓度营养会造成菌体的营养中毒,抑制菌体的生长,同时导致菌体代谢途径的异常,使得发酵罐内某些营养物质消耗过快,极容易发生菌体过早衰亡的现象。首先,本实验为延长生长周期,提升菌体活力,通过发酵初期低营养,发酵过程全营养流加工艺,探究发酵中后期全营养流加对发酵的影响,实验设置A、B、C、D 4种流加策略,以策略A为对照组,进行发酵对比实验。
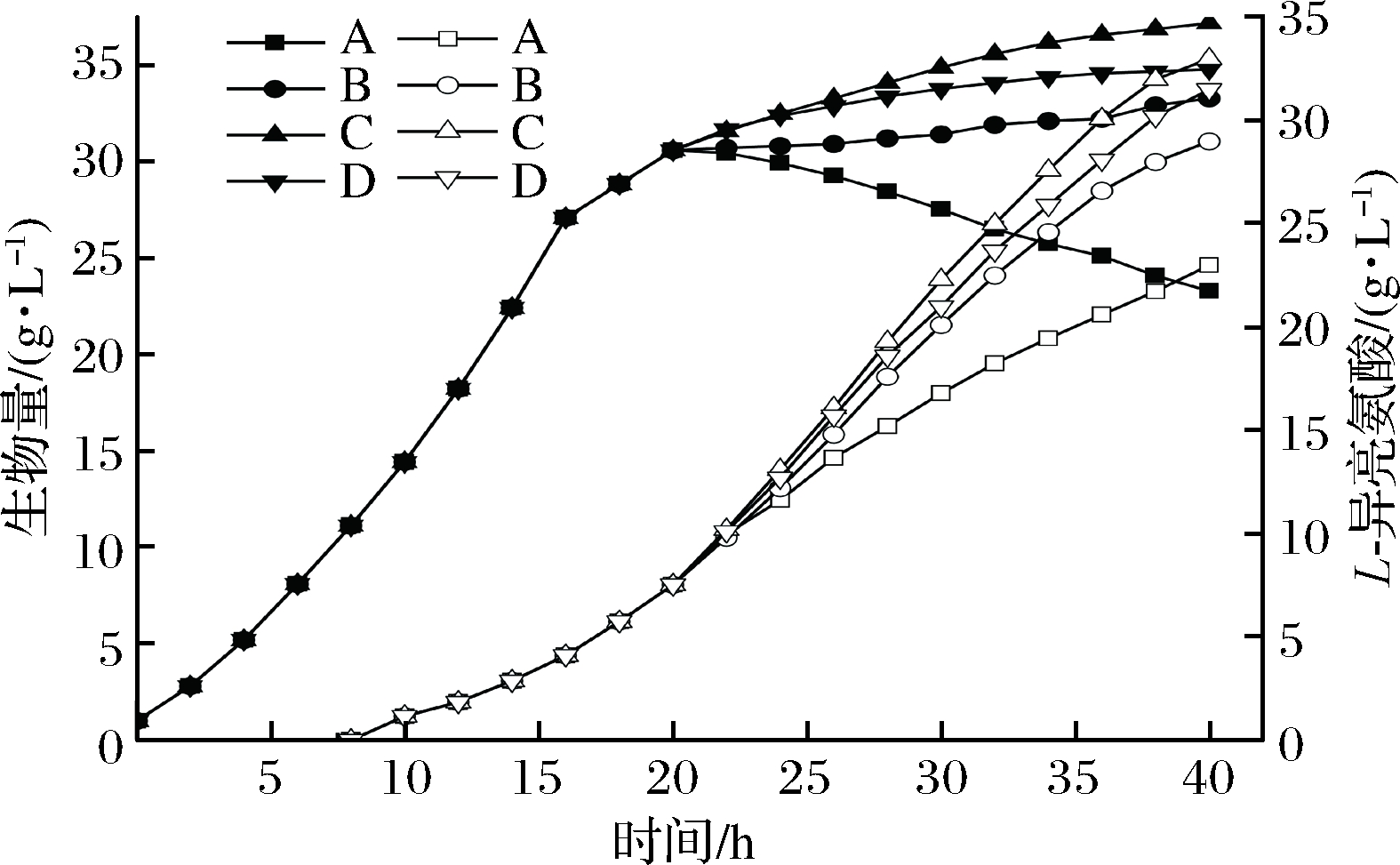
图1 低浓度全营养流加对生物量及L-异亮氨酸的影响
Fig.1 Effect of low concentration total nutrient flow on biomass and L-isoleucine
注:实心图标为菌体生物量、空心图标为L-异亮氨酸产量(图4、图7同)
由图1可知,流加策略A为全营养培养基底料,不流加培养基,发现发酵至15 h后,菌体活力降低,20 h菌体生物量开始下降,从最高菌体量30.6 g/L降低到23.3 g/L,同时此时产酸能力放缓,L-异亮氨酸产量为29.7 g/L。为解决发酵中后期菌体生物量下降问题,流加策略B、C、D分别在20 h流加5%、10%、15%的全营养培养基浓缩液,发现菌体量停止下降且小幅上升,最终菌体量分别达到了33.3、37.2、34.8 g/L,比对照组最终菌体量提高了42.9%、59.7%、49.4%,L-异亮氨酸分别达到了29.0、33.0、31.5 g/L,比对照组提高了26.1%、43.5%、40.0%。
由图2可知,随着流加糖浓度的上升,发酵葡萄糖消耗量逐渐上升但幅度较小,分别比对照组多消耗了3.3%、4.7%、5.6%;但葡萄糖对菌体转化率及L-异亮氨酸转化率显著上升(P<0.05),在26 h,对照组葡萄糖对菌体转化率<0.01 g/g,菌体活力极弱,菌体生长繁殖近乎停滞;随着对发酵罐流加全营养培养基浓缩液,20 h后葡萄糖对菌体转化率明显上升,26 h转化率达到了0.08、0.1、0.1,菌体仍有活力;同时26 h B、C、D流加策略的葡萄糖对L-异亮氨酸的转化率都为0.22 g/g,流加策略效果显著。

图2 低浓度全营养流加对葡萄糖消耗及转化率的影响
Fig.2 Effects of low concentration total nutrient flow on glucose consumption and glucose conversion
注:实心图标为葡萄糖消耗量、空心图标为葡萄糖对菌体转化率、半实心半空心为葡萄糖L-异亮氨酸转化率(图5同)
由图3可知,流加策略对合成L-异亮氨酸提升效果明显,同时对副产物的降低也有作用,流加策略B、C、D的Val分别达到了5.0、6.8、6.1 g/L,比对照组降低了37.5%、15.2%、23.8%,Leu分别为3.2、3.8、3.4 g/L,比对照组降低了46.7%、36.7%、43.3%,Ala分别为2.8、3.2、3.1 g/L,比对照组降低了37.8%、28.9%、31.1%。
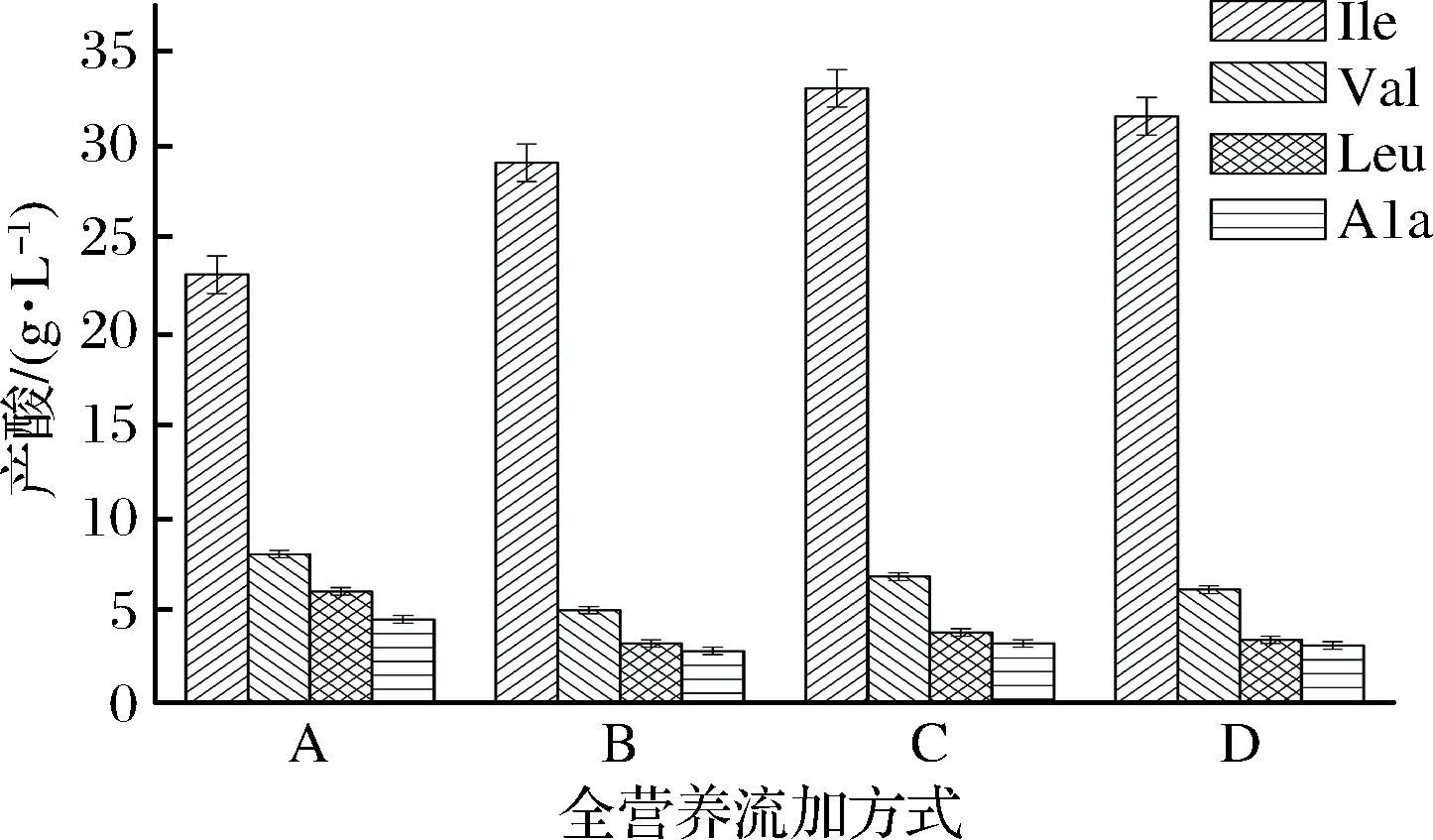
图3 低浓度全营养流加对产酸的影响
Fig.3 Effects of low concentration total nutrient flow on acid production
由上述结果可知,通过发酵中后期全营养流加策略,提高了葡萄糖的利用率及产酸能力,解决了20 h后菌体迅速衰亡、活力弱的缺点,这是因为流加培养基修正了发酵中后期某些必需元素缺失的问题,使菌体能够再次正常生长,延长了菌体发酵周期,但副产物Val、Leu、Ala相对于后续分离提取还是过多。3种副产物的积累过多使菌体代谢异常,再次影响了菌体的正常生长,同时出现糖酸转化率低、产品质量下降、提取困难等一系列问题。
2.2 低初始营养偶联发酵全营养流加策略
为了解决发酵初期底物营养过丰富而抑制菌体的问题,本实验通过降低初始发酵培养基的营养成分,采用低浓度初始发酵培养基发酵,在发酵过程流加全营养,以期降低发酵初期高营养抑制,并通过流加解决后期营养不足的问题。设计E、F、G、H流加策略,以A的培养基含量为基准,将培养基按比例分为底料与流加料,发酵全程流加,探究最适底料与流加料分配比例。
由图4可知,生物量与L-异亮氨酸随着底料与流加料质量比上升而上升,当底料与流加料为3∶7时,产酸与生物量达到最高。发酵40 h,流加策略E、F、G、H的菌体量分别为43.0、46.0、42.0、40.0 g/L,比对照组最大菌体量提高了40.5%、50.3%、37.3%、30.7%,L-异亮氨酸产量达到了34.8、36.8、34.0、33.6 g/L,比对照组分别提高了17.2%、23.9%、14.5%、13.1%。菌体量与L-异亮氨酸随着底料与流加料比例增加增长明显,因此高浓度底料是限制菌体增长的重要因素之一[18]。

图4 低初始营养偶联全营养流加策略对生物量及L-异亮氨酸的影响
Fig.4 Effects of total nutrient flow addition strategy on biomass and L-isoleucine in low initial nutrient
菌体对葡萄糖的利用率是评价菌株优良性状及发酵能力的重要指标之一,同时也是产品工业化生产的重要指标之一[19]。由图5可知,葡萄糖对菌体及L-异亮氨酸的转化率随着底料与流加料比例的增加而增长,其表现为流加策略E、F、G、H的葡萄糖对L-异亮氨酸的转化率后期下降平稳,26 h转化率分别为0.29、0.30、0.28、0.23 g/g,比对照组提高了93.3%、100%、86.7%、53.3%,且始终保持在0.1 g/g以上;E、F、G、H的葡萄糖对菌体的转化率分别为0.10、0.13、0.10、0.11 g/g,菌体活力旺盛。根据葡萄糖消耗曲线,E、F、G、H的葡萄糖消耗量分别为349.7、361.2、382.0、383.5 g/g,比对照组提升了3.0%、6.4%、12.5%、13.0%;可以看出葡萄糖消耗的增加量远小于葡萄糖对菌体及L-异亮氨酸的转化能力的提升,说明不同比例低浓度培养基底料添加与全营养流加有利于糖的正向利用率,减少了菌体细胞内其他非需求物质的产生,代谢主流导向理想载流途径[20]。
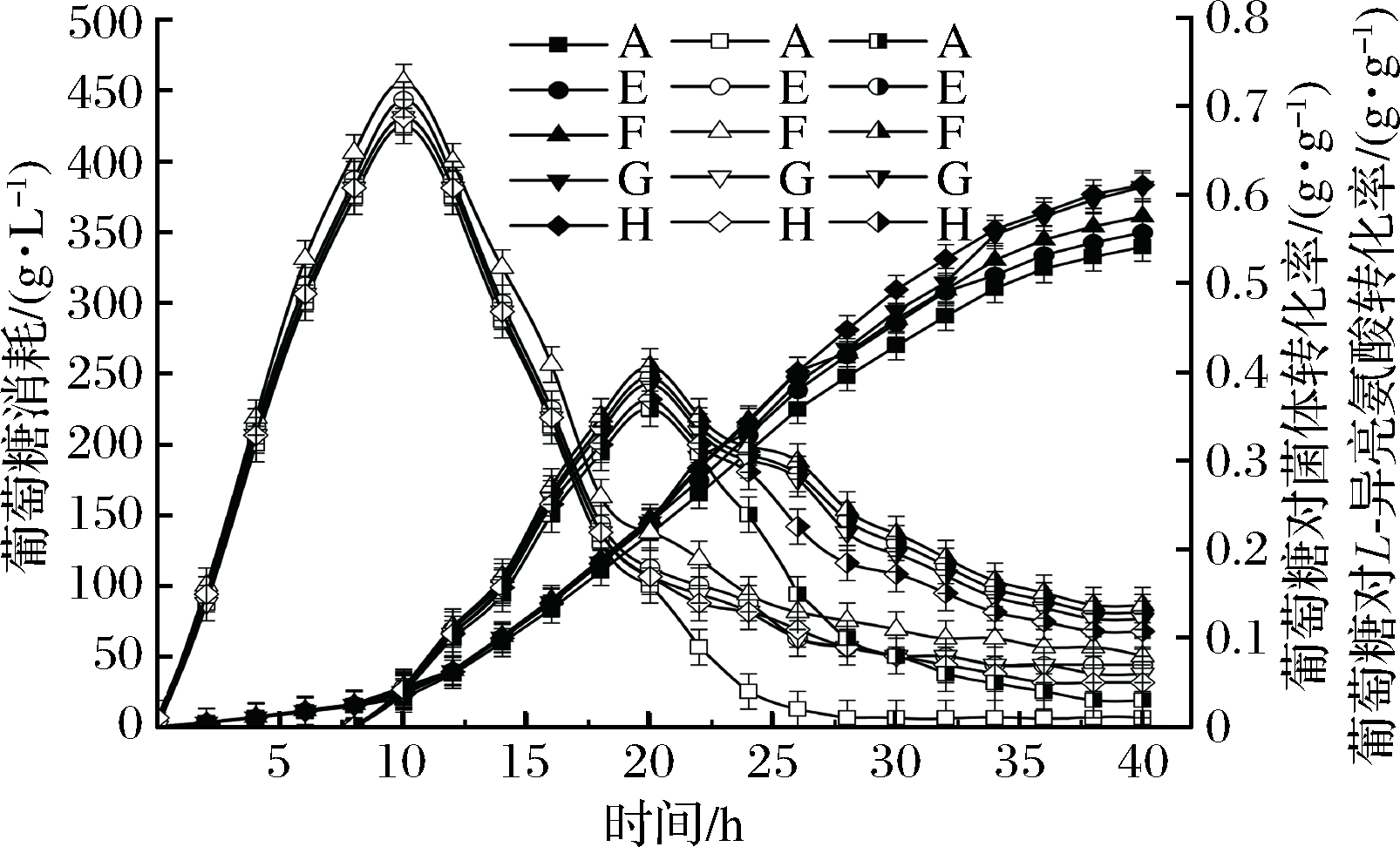
图5 低初始营养偶联发酵全营养流加策略对葡萄糖消耗量及转化率的影响
Fig.5 Effects of total nutrient flow plus strategy on glucose consumption and glucose conversion in low initial nutrient
图6-a中,E、F、G、H的Val分别为5.2、5.6、6.2、6.0 g/L,比对照组降低了35.0%、30.0%、22.5%、25.0%;图6-b中,E、F、G、H的Leu分别为2.2、2.3、2.7、3.0 g,比对照组降低了21.4%、17.9%、3.6%、7.1%;图6-c中,E、F、G、H的Ala分别为1.7、2.1、2.3、2.1 g/L,比对照组降低了39.3%、25%、17.9%、25%。从副产物曲线趋势可以看出,Val、Leu与Ile出现时间相近、产酸协同,且增长趋势都随着时间的推移逐渐降低;Ala的直接前体是丙酮酸,而Val、Leu的直接前体也是丙酮酸,随着发酵时间的持续,Val、Leu逐渐降低,而Ala却随着时间的推移越来越多。
从以上结果分析可知,底料、流加料双梯度全营养流加对生物量及L-异亮氨酸的生成效果显著,且降低了副产物的生成,解决了高浓度培养基对菌体生长及产酸的抑制作用[21];但生成的副产物对于产品纯化及产品工业化来说,同样相对较高,所以需要找到一种方法,在保持对L-异亮氨酸产量影响较小的情况下,将副产物降低到产业化标准的浓度之下。
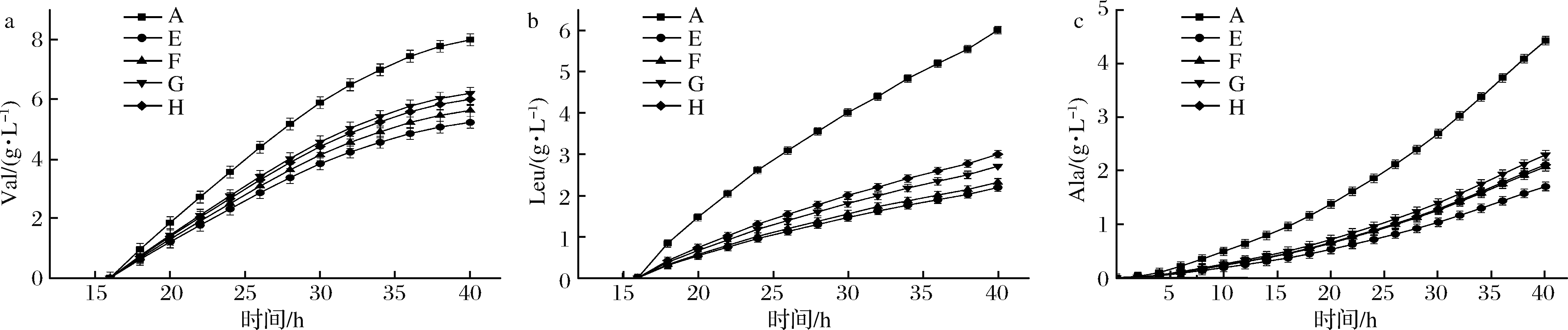
a-Val;b-Leu;c-Ala
图6 低初始营养偶联发酵全营养流加策略对副产物Val、Leu、Ala的影响
Fig.6 Effects of total nutrient flow addition strategy on by-products Val, Leu and Ala in low initial nutrient
2.3 丝肽粉等比例替换玉米浆全营养流加对L-异亮氨酸的影响
同时,在发酵过程中发现,由于玉米浆使用量过大,造成灭菌困难,容易染菌;玉米浆中蛋白质含量高,造成发酵过程泡沫过多,溶氧不足;玉米浆中灰分高,造成分离提取产物杂质高等问题。因此,有必要降低玉米浆的用量,利用清洁的有机氮源替换玉米浆。本实验利用丝肽粉代替一部分玉米浆。设计氮源替换实验,以流加策略F为基准,将发酵培养基(1)中玉米浆逐步替换为丝肽粉,探究玉米浆与丝肽粉在发酵中对副产物生成的影响。
由图7可知,随着丝肽粉替换玉米浆比例的上升,菌体生物量及产酸能力逐渐降低,发酵40 h,流加策略I、G、K的生物量为44.2、41.4、40.0 g/L,比对照组提升了89.7%、77.7%、71.7%,却比基准组F降低了3.9%、10.0%、13.0%;L-异亮氨酸产量为 36.1、34.2、33.1 g/L,比对照组提高了21.5%、15.2%、11.4%,比基准组降低了1.9%、7.1%、10.1%。玉米浆中含有大量的亚硫酸、肽、多糖、蛋白质和各种氨基酸,在氨基酸发酵中被用作有机氮源和生长因子的供应者,从结果可以看出在提高产酸能力、促进菌体生长的功能上玉米浆无法被丝肽粉替代。

图7 丝肽粉等比例替换玉米浆全营养流加对生物量及L-异亮氨酸的影响
Fig.7 Effects of total nutrient flow on biomass and L-isoleucine in corn pulp with equal proportion of silk peptide powder
丙酮酸是Val、Leu的直接前体,同时反应生产活性乙醛与乙酰辅酶A,活性乙醛参与合成Ile和Val,乙酰辅酶A参与Leu的合成,前体物对Val、Leu的生成有协同作用;乙酰羟基酸合成酶、二羟基脱水酶、支链氨基酸转氨酶等一系列酶共同参与三支链氨基酸的合成,反应酶对Ile和Val、Leu的生成有协同作用。由图8可知,在L-异亮氨酸产量降低的同时,副产物Ile和Val、Leu也大幅降低,这验证了Ile、Val、Leu生产协同的结论。流加策略I、G、K的Val分别为1.4、1.2、1.0 g/L,比对照组降低了82.5%、85%、87.5%;Leu分别为0.8、0.6、0.5 g/L,比对照组降低了75.0%、81.3%、84.4%;Ala分别为0.5、0.3、0.3 g/L,比对照组降低了78.6%、82.1%、82.1%。丝肽粉为优质清洁氮源,其生物素含量低、灰分≤6%,总氮(以N计)≥30%,同时从葡萄糖对L-异亮氨酸的转化率曲线可以看出,随着丝肽粉替换玉米浆比例的增加,转化率逐渐上升。
由上述结果可以得出,丝肽粉在抑制菌体的生成及L-异亮氨酸的产量上不及玉米浆,但会大幅度降低副产物Val、Leu、Ala的生成,达到工业生产及产品纯化的要求,所以为了既减少对菌体和L-异亮氨酸的抑制,又减少副产物的生成,可以选用流加方法I,即在F的流加基础上,将30%的玉米浆替换为丝肽粉,对产酸能力影响较小,L-异亮氨酸产量达到36.1 g/L,同时副产物Val、Leu、Ala分别为1.4、0.8、0.5 g/L,达到产业化标准。
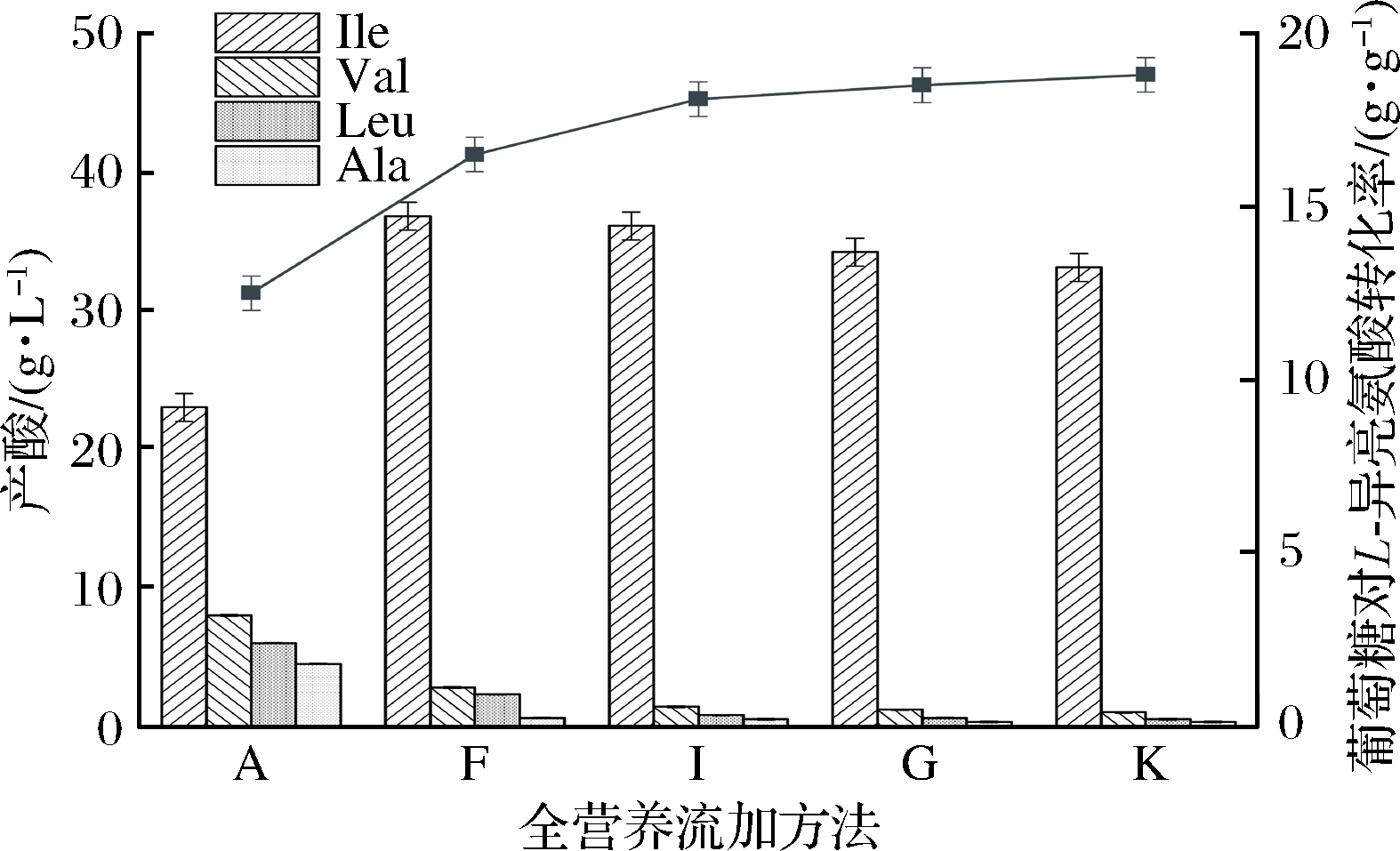
图8 丝肽粉等比例替换玉米浆全营养流加对产酸及转化率的影响
Fig.8 Effects of total nutrient flow on acid production and conversion of corn pulp with equal proportion of silk peptide powder to replace the corn syrup
3 结论
在谷氨酸棒杆菌发酵产L-异亮氨酸过程中,L-异亮氨酸产量及副产物含量是评价菌株优良性状及发酵能力的重要指标之一。实验通过高浓度底料、低浓度全营养流加策略,提升中后期菌体活力,加强产酸能力,其底料为3 L发酵培养基,在20 h后流加10%(1)号全营养培养基,最终生物量与L-异亮氨酸分别达到了37.2、33.0 g/L,比对照组提高了57.7%、43.5%。为解决前期高营养对菌体造成营养中毒,实验通过降低初始发酵培养基的营养成分,采用低浓度初始发酵培养基发酵,在发酵过程流加全营养,发现配制3 L发酵培养基,底料一次性添加30%,剩下70%作为浓缩液全程流加,使得生物量与L-异亮氨酸达到了46.0、36.8 g/L,比对照组提高了97.4%、60.0%。为减少由于玉米浆的高用量造成发酵染菌、起泡过多及后提取困难等问题,同时降低发酵副产物,提高产品纯度,实验设计氮源替换实验,用清洁丝肽粉等比例替换玉米浆全营养流加,最终发现流加策略I最优,即将发酵培养基中30%的玉米浆替换为丝肽粉,使得副产物Val、Leu、Ala分别为1.4、0.8、0.5 g/L,比对照组降低了82.5%、86.7%和88.9%,同时探究出玉米浆有利于菌体的生长及L-异亮氨酸产量的提高,而丝肽粉有利于发酵中副产物Val、Leu、Ala的降低。
[1] BECKER J, ROHLES C M, WITTMANN C.Metabolically engineered Corynebacterium glutamicum for bio-based production of chemicals, fuels, materials, and healthcare products[J].Metabolic Engineering,2018;50:122-141.
[2] WANG X Y.Strategy for improving L-isoleucine production efficiency in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology,2019;103:2 101-2 111.
[3] 孔帅,陈敏,郑美娟,等.常温常压等离子体诱变选育高产L-异亮氨酸谷氨酸棒杆菌[J].中国酿造,2019,38(7):76-79.
KONG S, CHEN M, ZHENG M J, et al.Mutation breeding of high-yield L-isoleucine Corynebacterium glutamicum by atmospheric and room temperature plasmas mutagenesis[J].China Brewing, 2019,38(7):76-79.
[4] SHI F, ZHANG S P, LI Y F, et al.Enhancement of substrate supply and ido expression to improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum ssp.lactofermentum[J].Applied Microbiology and Biotechnology,2019;103:4 113-4 124.
[5] 王壮壮,魏佳,于海波,等.L-异亮氨酸高产菌选育及其培养基优化[J].生物技术通报,2019,35(1):82-89.
WANG Z Z, WEI J, YU H B, et al.Breeding of strain producing L-isoleucine and medium optimization for it[J].Biotechnology Bulletin, 2019,35(1):82-89.
[6] 李忠财,董会娜,丛丽娜,等.双组份转运系统BrnFE的过表达和表面活性剂的添加对谷氨酸棒杆菌发酵生产L-异亮氨酸的影响[J].工业微生物,2016,46(4):1-7.
LI Z C, DONG H N, CONG L N, et al.Effects of overexpressing two-component export system BrnFE and adding surfactants on L-isoleucine production by Corynebacterium glutamicum[J].Industrial Microbiology, 2016,46(4):1-7.
[7] 还晓静,李坤,史锋,等.谷氨酸棒杆菌NAD激酶的过表达对L-异亮氨酸合成的促进作用[J].生物工程学报,2012,28(9):1 038-1 047.
HUAN X J, LI K, SHI F, et al.Overexpression of Corynebacterium glutamicum NAD kinase improves L-isoleucine biosynthesis[J].Chinese Journal of Biotechnology, 2012,28(9):1 038-1 047.
[8] 李燕军,张海宾,麻杰,等.代谢工程改造大肠杆菌合成L-异亮氨酸的研究[J].发酵科技通讯,2016,45(3):133-139.
LI Y J, ZHANG H B, MA J, et al.Study on metabolic engineering of Escherichia coli for L-isoleucine production[J].Bulletin of Fermentation Science and Technology,2016,45(3):133-139.
[9] 沈加彬,胡荣涛,罗磊,等.响应面法优化L-异亮氨酸产生菌的摇瓶发酵条件[J].福建师范大学学报(自然科学版),2018,34(2):48-56.
SHEN J B, HU R T, LUO L, et al.Optimization the flask-shaking fermentation conditions of an L-isoleucine producing strain Brevibacterium flavum by response surface method[J].Journal of Fujian Normal University (Natural Science Edition), 2018,34(2):48-56.
[10] 于丽男,刘慧燕,方海田,等.L-异亮氨酸高产菌种的选育与响应面法优化发酵培养条件的研究[J].食品科技,2015,40(10):9-16.
YU L N, LIU H Y, FANG H T, et al.Study on breeding of L-isoleucine producing strain and optimization of the fermentation medium by response surface methodology[J].Food Science and Technology, 2015,40(10):9-16.
[11] 孙家凯,吴晓娇,史建明,等.pH值对大肠杆菌发酵异亮氨酸的影响[J].食品与发酵工业,2012,38(3):12-16.
SUN J K, WU X J, SHI J M, et al.Effect of pH on the process of Escherichia coli L-isoleucine fermentation[J].Food and Fermentation Industries, 2012,38(3):12-16.
[12] 孙家凯,吴晓娇,王晶,等.磷酸盐对大肠杆菌发酵异亮氨酸的影响[J].食品与发酵工业,2012,38(1):20-24.
SUN J K, WU X J, WANG J, et al.Effect of phosphate on the process of Escherichia coli L-isoleucine fermentation[J].Food and Fermentation Industries, 2012,38(1):20-24.
[13] 马雷,程立坤,徐庆阳,等.柠檬酸钠对L-异亮氨酸发酵及代谢流量分布的影响[J].天津科技大学学报,2010,25(3):14-18.
MA L, CHENG L K, XU Q Y, et al.Effects of sodium citrate on metabolic flux distributions of L-isoleucine fermentation[J].Journal of Tianjin University of Science & Technology, 2010,25(3):14-18.
[14] 张成林,龙辉,温冰,等.双底物指数流加和双阶段溶氧控制对谷氨酸棒状杆菌生产L-异亮氨酸的影响[J].食品与发酵工业,2014,40(4):1-6.
ZHANG C L, LONG H, WEN B, Effect of dual exponential feeding and two-stage dissolved oxygen control strategy on L-isoleucine production by Corynebacterium glutamicum[J].Food and Fermentation Industries, 2014,40(4):1-6.
[15] LIU S, LIANG Y, LIU Q, et al.Development of a two-stage feeding strategy based on the kind and level of feeding nutrients for improving fed-batch production of L-threonine by Escherichia coli[J].Applied Microbiology & Biotechnology, 2013, 97(2):573-583.
[16] BRITTA J, TOBISCH S, MOGENS W, et al.Global expression profiling of Bacillus subtilis cells during industrial-close fed-batch fermentations with different nitrogen sources[J].Biotechnology & Bioengineering, 2010, 92(3):277-298.
[17] MA W, WANG J, LI Y, et al.Cysteine synthase A overexpression in Corynebacterium glutamicum enhances L-isoleucine production[J].Biotechnology and Applied Biochemistry,2019,66:74-81.
[18] 方振华. 补料分批发酵法生产谷氨酰胺的研究[J].食品与发酵科技, 2015, 51(3):16-18;22.
FANG Z H, Research on fed-batch fermentation technology of producing glutamine[J].Food and Fermentation Sciences & Technology, 2015, 51(3):16-18;22.
[19] 方声, 余斌, 章鹏鹏.卡那霉素连续补料发酵工艺的研究[J].发酵科技通讯, 2018, 47(1):48-51.
FANG S, YU B, ZHENG P P, Continuous feeding process for kanamycin fermentation[J].Bulletin of Fermentation Science and Technology, 2018, 47(1):48-51.
[20] 吴仁智, 陈东, 黄俊,等.木糖浓度及补料发酵对树干毕赤酵母乙醇发酵的影响[J].中国酿造, 2018, 37(12):112-115.
WU R Z, CHEN D, HUANG J, et al.Effect of xylose concentration and fed-batch fermentation on Pichia stipites fermentation for ethanol production from xylose[J].China Brewing, 2018, 37(12):112-115.
[21] CHASSAGNOLE C, DIANO A, FABIEN L, et al.Metabolic network analysis during fed-batch cultivation of Corynebacterium glutamicum for pantothenic acid production:First quantitative data and analysis of by-product formation[J].Journal of Biotechnology, 2003, 104(1-3):261-272.