由固体颗粒代替表面活性剂稳定的乳液统称Pickering乳液[1-2]。近年来,Pickering乳液由于低成本、环保、控制释放、抗聚集和脂质氧化等优势,已经被广泛应用于食品体系和包埋递送体系中,例如功能性饮料、蛋黄酱、沙拉酱、冰淇淋以及面包等[3-5],这对于产品风味的改善和品质的提升具有重要作用。在这些应用中,Pickering乳液往往会进行加热、冻融等不同处理以满足不同的消费需求,这就要求Pickering乳液具有较高的稳定性以抵抗外界环境[6]。Pickering乳液的稳定性主要与液滴的特性密切相关,液滴间的相互作用是决定乳液稳定性的最主要因素,刘洋[6]研究表明Pickering乳液的稳定性受pH、离子强度、热处理及冻融循环等多种因素影响。改变pH值,可以通过改变颗粒本身的电荷,进而影响乳液的稳定性。DESTRIBATS等[7]通过调节pH制备了不同的乳清蛋白颗粒以稳定Pickering乳液,结果表明,在pH为3.0和7.0时,Pickering乳液液滴具有较小的尺寸,且稳定性较高,在pH为4.7时(等电点左右),液滴尺寸明显增加且稳定性降低。盐离子可以通过静电屏蔽作用影响乳液的稳定。ZHU等[8]报道了由大豆蛋白颗粒稳定Pickering乳液的液滴尺寸随着NaCl的添加而增大,在100 mmol/L时液滴粒径达到最大,随着离子强度的进一步增加(200~500 mmol/L),液滴尺寸开始逐渐减少至相对稳定。Pickering乳液在经过加热或冻融处理时,可能会发生各种物理化学变化,包括结构破坏、水结晶、生物聚合物构象变化、冷冻浓缩和相分离现象等[9-10],进而影响乳液体系的质地、结构及稳定性。ZHU等[11]制备了以小麦醇溶蛋白颗粒稳定的Pickering乳液,结果表明,高盐(200和500 mM)和80 ℃预热处理有助于在冻融循环中维持凝胶网络结构,进而有利于改善乳液的冻融稳定性。GE等[12]制备了不同尺寸的淀粉颗粒以稳定Pickering乳液,结果表明Pickering乳液经过高温(60~90 ℃)处理后,液滴尺寸有明显的增加,乳液的稳定性有所降低。因此,研究Pickering乳液的稳定性对食品乳液体系具有十分重要的意义。
类胡萝卜素是最重要的天然色素之一,广泛存在于蔬菜和水果中(胡萝卜、西红柿、辣椒等),并提供人类饮食中约70%的维生素A。研究表明,类胡萝卜素具有优良的抗氧化和抗炎活性,在增强免疫力、抗癌、预防心血管疾病、保护视网膜和防止老年性黄斑变性等方面具有十分重要的作用[13]。因此,类胡萝卜素是一种极具发展前途的功能性天然色素,可作为抗氧化剂、着色剂、膳食补充剂等广泛应用于在食品、医药及化妆品等领域。β-胡萝卜素作为类胡萝卜素中最重要的一种,由于其较高的维生素A活性和优异的抗氧化性能而受到越来越多的关注[14-15]。研究表明,β-胡萝卜素降低了心血管疾病、皮肤病、癌症和眼病等的风险且提供一定的保护作用[16-17]。然而,由于β-胡萝卜素较低的水溶性、较高的熔点以及特殊的结构,使其对光、热、氧极为敏感,很容易发生光降解、氧化和异构化等反应,从而降低β-胡萝卜素的生物活性,严重限制了β-胡萝卜素在食品、医药及化妆品等领域的应用。目前,已经报道证明乳液系统装载β-胡萝卜素的可行性[18-20]。与传统乳液相比,Pickering乳液由于具有优异的抗脂质氧化和环保等性能可能更有利于β-胡萝卜素的装载。
在本课题组前期的研究中,我们以京尼平为交联剂,制备了食品级的明胶纳米颗粒(GNPs)[21],并且通过调控GNPs的浓度来制备不同性质的乳液[在0.5%(质量分数) GNPs浓度下可制备黏度较低、流动性和稳定性较好的Pickering乳液,在1.0%(质量分数) GNPs浓度下可制备黏度和稳定性较高的Pickering乳液,在1.5%(质量分数) GNPs浓度下可制备显著黏弹性和稳定性的Pickering乳液][22]。因此,本研究基于前期研究的基础,以1.0%(质量分数)GNPs稳定50%(体积分数)油相的Pickering乳液为研究对象,进一步研究了GNPs分散液中pH、离子强度以及加热处理对Pickering乳液乳析指数(creaming index,CI)、尺寸及微观结构的影响。此外,将前期研究所得的3种性质的乳液应用于β-胡萝卜素的装载中,主要研究了β-胡萝卜素在Pickering乳液中的保留率、游离脂肪酸(free fatty acids,FFA)释放以及生物可及性,以期为明胶基Pickering乳液对β-胡萝卜素的装载以及消化提供理论依据。
1 材料与方法
1.1 原料与试剂
B型明胶(来源于猪皮),美国Sigma-Aldrich公司。
京尼平(HPLC ≥ 98%),成都康邦生物科技有限公司;氢氧化钠、无水乙醇,成都市科隆化学品有限公司;九三牌大豆油(未经纯化),九三集团;β-胡萝卜素,上海Adamas试剂有限公司;脂肪酶,上海Macklin生化科技有限公司;胃蛋白酶(1∶10 000),北京索莱宝科技有限公司;牛黄胆酸钠,上海阿拉丁生化有限公司;氯化钠、盐酸、磷酸氢二钠、磷酸二氢钠、正己烷,成都市科隆化学品有限公司;氯化钙,重庆市钛新化工有限公司;所有的试剂均为分析纯。
1.2 仪器与设备
电子天平(JA3003B),上海精天电子仪器有限公司;漩涡混合器(QL 901 Vortex),海门市其林贝尔仪器制造有限公司;数显恒温搅拌水浴锅(HH-4),上海新诺仪器设备有限公司;实验室酸度计(PE 20),上海梅特勒-托利多仪器有限公司;台式高速冷冻离心机(Heraeus Multifuge X3R),美国赛默飞世尔科技公司;立式显微镜(BX53)日本OLYMPUS公司;电热恒温鼓风干燥箱(DGG-9140A),上海齐欣科学仪器有限公司;超声波清洗器(KQ-100B),昆山超声仪器有限公司;高速分散器(T18),美国IKA公司;水浴恒温振荡器(SHZ-B),上海龙跃仪器设备有限公司;紫外分光光度计(UV-2450),日本岛津公司。
1.3 明胶纳米颗粒的制备
参考COESTER[23]先前报道的两步去溶剂法并做适当的修改以制备GNPs。简而言之,将1.25 g B型明胶溶解与25 mL水,并在40 ℃下搅拌至完全溶解。然后将25 mL乙醇作为脱溶剂试剂添加到明胶溶液中,反应体系会出现分层现象,分离得到的下层澄清液为较高相对分子质量的明胶。然后再将其溶解到100 mL水中,并用1 mol/L的NaOH溶液调节pH为12,使明胶分子远离等电点。随后,在恒定搅拌速度下缓慢滴加乙醇将明胶再次去溶剂化,直至形成乳白色分散体。为了得到交联的GNPs,向该分散液中加入10%的京尼平溶液,然后在37 ℃下搅拌3 h进行交联。最后在10 000×g下离心20 min得到沉淀物,用乙醇清洗后再用20 000×g离心后收集沉淀物,重复清洗3次,后用氮气吹干,4 ℃保存备用。
1.4 Pickering乳液的制备
根据之前的研究确定油相体积(φ=50%)[21],以制备稳定的Pickering乳液。将3 mL 的GNPs分散液放入10 mL离心管中,并将3 mL大豆油缓慢地添加到分散液中。然后,使用均质机以15 000 r/min的速度将混合物均质1 min,以获得Pickering乳液。
1.5 显微镜和外观测定
使用移动相机获取乳液的照片,以评估宏观相行为,从而评估其稳定性。为了进一步观察乳状液的微观结构,将Pickering乳液(20 μL)放置在载玻片上,并用盖玻片覆盖。使用立式光学显微镜获取显微镜图像。实验在25 ℃下进行。
1.6 Pickering乳液的稳定性测定
1.6.1 pH稳定性
用0.1 mol/L HCl调节1.0% GNPs分散液的pH至 3、5、7、9,测定pH对Pickering乳液(6 mL, 50 %油相)稳定性的影响。然后用上述方法测定GNPs分散液的外观,以及Pickering乳液的外观和微观结构。实验在25 ℃下进行。
1.6.2 离子强度稳定性
向1.0% GNPs分散液加入NaCl,使得分散液的离子强度为0、50、100、300和500 mmol/L,测定离子强度对Pickering乳液(6 mL, 50%油相)稳定性的影响。然后用上述方法测量GNPs分散液的外观,以及Pickering乳液的外观、乳析指数(CI)和微观结构。实验在25 ℃下进行。CI按公式(1)计算:
(1)
式中:Hs是乳液析出水的高度,He是乳液的总高度。
1.6.3 热稳定性
将新鲜的Pickering乳液(6 mL, 1.0% GNPs,50%油相)置于离心管中,然后分别于70 ℃和100 ℃水浴中加热不同的时间(0、5、10、15和20 min),冷却至25 ℃。用上述方法测量Pickering乳液的外观,CI和微观结构。
1.6.4 冻融稳定性
冻融循环由冻融期和解冻期组成。在冷冻过程中,将新鲜制备的Pickering乳液(6 mL, 0.3%~2.0% GNPs,50%油相)置于平底玻璃瓶(直径=18 mm;高度=40 mm)中,在-20 ℃下恒温保存24 h,然后将冷冻的样品转移到30 ℃的烘箱中解冻2 h,完全解冻后对冻融样品的外观进行表征。
1.7 β-胡萝卜素在体外消化过程中的稳定性和生物可及性测定
1.7.1 β-胡萝卜素Pickering乳液的制备
参考LIU等[24]报道的方法制备装载β-胡萝卜素的Pickering 乳液。首先,将β-胡萝卜素溶于大豆油中(1 mg/mL), 超声处理5 min,以确保β-胡萝卜素完全溶解。然后参考方法1.4制备 Pickering乳液。
1.7.2 β-胡萝卜素标准曲线的制备
准确称量1 mg β-胡萝卜素,用正己烷溶液定容至10 mL,即为0.1 mg/mL的β-胡萝卜素标准溶液。分别吸取1,2,3,4,5 mL β-胡萝卜素标准溶液置于10 mL容量瓶中,用正己烷溶液定容至10 mL,于450 nm测定其吸光值。用吸光度对β-胡萝卜素浓度作标准曲线(y=4.625x-0.017 8, R2=0.996 5)。
1.7.3 β-胡萝卜的保留率
将装载β-胡萝卜素的Pickering乳液分别装在10 mL的平底瓶中,密封保存在4 ℃和25 ℃的开放环境中(未避光),间隔一定时间取出,测定Pickering乳液中β-胡萝卜素的含量。β-胡萝卜素含量的测定参照YUAN等[25]的方法:每个样品取出0.5 mL于10 mL离心管中,然后分别加入2 mL无水乙醇和3 mL正己烷,在漩涡混合器上充分振荡使乳液完全破乳,再静置10 min使得正己烷相和乙醇相分离,将上层的正己烷吸出并收集。然后再添加3 mL正己烷重复上述操作,合并正己烷。最后用紫外分光光度计在450 nm处测定吸光度。并结合标准曲线计算β-胡萝卜素的含量。β-胡萝卜素的保留率用Ct/C0表示,其中Ct表示在相应温度下储藏t天后β-胡萝卜素的浓度,C0表示原始Pickering乳液中β-胡萝卜素的浓度。
1.7.4 β-胡萝卜素的模拟体外消化模型
模拟胃液(simulated gastric fluid,SGF)的配制:2 mg/mL NaCl、7 mL/L HCl、3.2 mg/mL 胃蛋白酶,所有组分用超纯水配制。
模拟肠液(simulated intestinal fluid,SIF)的配制:盐溶液(36.7 mg/mL CaCl2、218.7 mg/mL NaCl)、24 mg/mL脂肪酶、54 mg/mL 胆盐、其中盐溶液用超纯水配制,脂肪酶和胆盐用5 mmol/L PBS (pH=7.0)配制。
模拟SGF消化:将SGF在37 ℃预热5 min,取7.5 mL乳液加入到7.5 mL的胃液中。用1 moL/L NaOH迅速将混合体系pH调整至2.5,于37 ℃恒温摇床(100 r/min)消化2 h。
模拟SIF消化:乳液在胃液中消化完成后,用0.5 mol/L NaOH迅速将混合体系pH调整至7.0。将SIF在37 ℃预热5 min,依次将1.5 mL的盐溶液、3.5 mL的胆盐溶液、2.5 mL的脂肪酶溶液加入到上述胃消化液中。最后于37 ℃恒温摇床(100 r/min)消化2 h。期间不断用0.5 mol/L NaOH调节混合体系中的pH维持在7.0。
1.7.5 脂质消化
参考TAN等[26]的方法进行脂质消化实验。从乳液中释放的游离脂肪酸含量(FFA)由所用的0.5 mol/L NaOH标准溶液的量计算得出。通过公式(2)计算消化过程中释放的FFA:
(2)
式中:CNaOH,NaOH溶液的摩尔浓度,mol/L;VNaOH,所用NaOH溶液的体积,L;M大豆油,该油的平均分子质量(880),g/mol;m大豆油,所用大豆油的总质量,g。
1.7.6 β-胡萝卜素生物可及性的测定
β-胡萝卜素生物可及性的测定参考LIU等[27]的方法,将消化后的混合物在4 ℃下用15 000×g离心30 min,理论上混合物将分为3层,上层为未消化的油脂,中间即为所需的胶束层,下层为难以消化或者未消化的固形物。β-胡萝卜素的生物可及性用公式(3)计算。
β-胡萝卜素的生物可及性/%
(3)
1.8 数据处理
所有实验至少独立进行3次,数据以平均值±标准偏差表示。利用SPSS Statistics 17.0和Origin 8.0软件进行显著性分析和作图。
2 结果与分析
2.1 Pickering乳液的pH稳定性分析
不同pH(9, 7, 5, 3)下GNPs稳定Pickering乳液的外观和微观结构(光学显微镜)如图1所示。相对于对照组(未调节pH,约为11),在pH为5或3时,GNPs分散液发生了肉眼可见的聚集,尤其是在pH为5时聚集最为严重,甚至出现絮状物。光镜图显示,在pH为5时,乳液发生了严重的相分离,仅有少量乳液被保留,随着GNPs分散液的pH偏离5,液滴尺寸明显减小。这可能是因为GNPs的等电点为5左右,GNPs尤其是连续相中的颗粒发生聚集,不利于颗粒在界面的吸附,导致乳液析水并发生絮凝现象,降低乳液的稳定性。偏离等电点时,由于较强的静电排斥作用而使分散液维持相对稳定的状态,进而有利于颗粒在油水界面的吸附,并且乳液未出现破乳现象,表明吸附在界面上的颗粒具有较高的稳定性[28]。因此,GNPs分散液在pH大于7的条件下制备的Pickering乳液更稳定。

A-外观;B-光学显微镜
图1 不同pH值对明胶稳定Pickering乳液的影响
Fig.1 Effect of different pH on the gelatin-stabilized Pickering emulsion
2.2 Pickering乳液的离子强度稳定性分析
不同离子强度(0, 50, 100, 300和500 mmol/L)下GNPs稳定 Pickering乳液的外观和微观结构如图2所示。由图2可得,当离子强度为50 mmol/L时,乳液的CI和液滴粒径均有所增加,随着离子强度的进一步增加(100~500 mmol/L),CI和液滴粒径略有改善并保持稳定。这可能是因为低离子强度下,离子通过静电作用屏蔽了颗粒的表面电荷,降低颗粒与颗粒之间的排斥作用,促进了颗粒的聚集,不利于颗粒在油滴表面的吸附及重排,从而导致液滴粒径增加以及水层的产生[29]。随着离子强度的增加(100~500 mmol/L),渗透压增加,乳液的保水性增加,因此CI逐渐减小并保持相对稳定。离子强度的增加(100~500 mmol/L),可能降低了GNPs的扩散速率,但由于表面电荷增加,促使更多的颗粒吸附到油水界面并参与了界面的稳定,赋予乳液较强的粘弹性膜和更高的界面压力,改善了液滴间的相互作用,使得液滴尺寸相对减小,乳液变得相对稳定[30-31]。这一现象与ZHU等[8]的研究类似,由大豆蛋白颗粒稳定Pickering乳液的液滴尺寸随着NaCl的添加而增大,在100 mmol/L时液滴粒径达到最大,随着离子强度的进一步增加(200~500 mmol/L),乳液液滴的粒径开始减少至稳定。
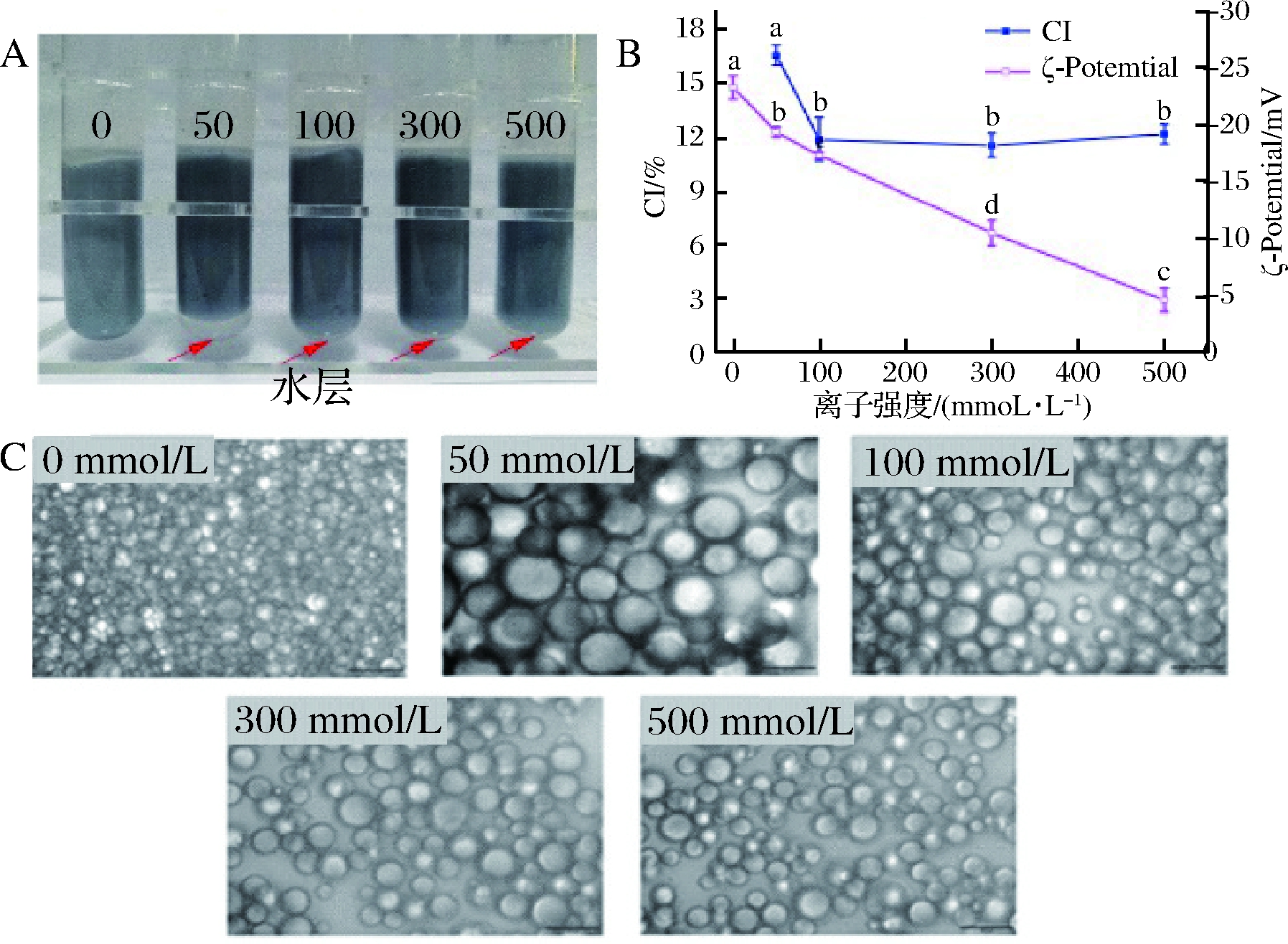
A-外观;B-电位和CI;C-光学显微镜
图2 不同离子强度对明胶稳定Pickering乳液的影响
Fig.2 Effect of different ionic strength on the gelatin-stabilized Pickering emulsion
注:图中不同的小写字母表示有显著性差异(P<0.05)
2.3 Pickering乳液的热稳定性分析
经过不同温度(70 ℃, 100 ℃)和时间(0、5、10、15、20 min)处理后的Pickering乳液的外观和微观如图3所示。乳液经过70 ℃或100 ℃处理后,出现明显的水层,且CI随着加热时间的延长而增加。光镜图结果显示,随着加热时间的延长,液滴间隙明显增大,且液滴尺寸也随之增加。明胶颗粒的非共价作用以氢键为主,加热处理可能导致氢键的破坏,从而使连续相中颗粒形成的紧密网络结构被破坏,液滴间隙变大,持水能力下降,从而导致水层的产生以及CI的增加。另一方面,加热处理还促进部分油滴发生聚集使得液滴尺寸增加[32]。总体来看,Pickering乳液经过加热杀菌处理后,虽然有一定的析水,但不会导致破乳,因此乳液可以耐受高温处理。

A-外观和CI;B-光学显微镜
图3 不同热处理温度对明胶稳定Pickering乳液的影响
Fig.3 Effect of different heat treatment temperature on the gelatin-stabilized Pickering emulsion
注:图中不同的小写字母表示有显著性差异(P<0.05)
2.4 Pickering乳液的冻融稳定性分析
不同GNPs浓度(0.3%~2.0%)稳定的Pickering乳液冻融稳定性如图4所示。由图所示,所制备的乳液经过一次冻融后即发生严重的破乳现象,且随着浓度的增加(0.3%~2.0%),破乳现象没有明显的改善,表明乳液的冻融稳定性较差。这可能是因为明胶颗粒之间形成的网络结构主要靠氢键维系,乳液在冷冻条件下,形成了冰晶,造成了明胶颗粒的脱水,从而影响了明胶颗粒之间氢键的平衡,而蛋白之间的共价交联可能并不足以单独维系明胶网络的稳定,因此颗粒之间形成的网络崩溃,界面膜被破坏,乳液破乳。因此,如何进一步提高明胶纳米颗粒稳定的Pickering乳液的冻融稳定性是未来需要进一步研究的方向之一。
2.5 Pickering乳液的pH稳定性分析负载β-胡萝卜素乳液的外观
负载β-胡萝卜的Pickering乳液素在不同储藏温度下(4 ℃, 25 ℃)的外观如图5所示。随着GNPs浓度(0.5%~1.5%)的增加,负载β-胡萝卜素的Pickering乳液的灰蓝色逐渐加深。4 ℃下储藏30 d后,流动性较好的乳液(0.5% GNPs)有轻微的β-胡萝卜素析出,黏度较高的乳液(1.0% GNPs)和高黏弹性的乳液(1.5% GNPs)仍然表现出优异的稳定性。然而,25 ℃下储藏20 d后,流动性较好的乳液(0.5% GNPs)发生明显的相分离现象,黏度较高的乳液(1.0% GNPs)也产生轻微的相分离,而高粘弹性的乳液(1.5% GNPs)仍具有较高的稳定性。
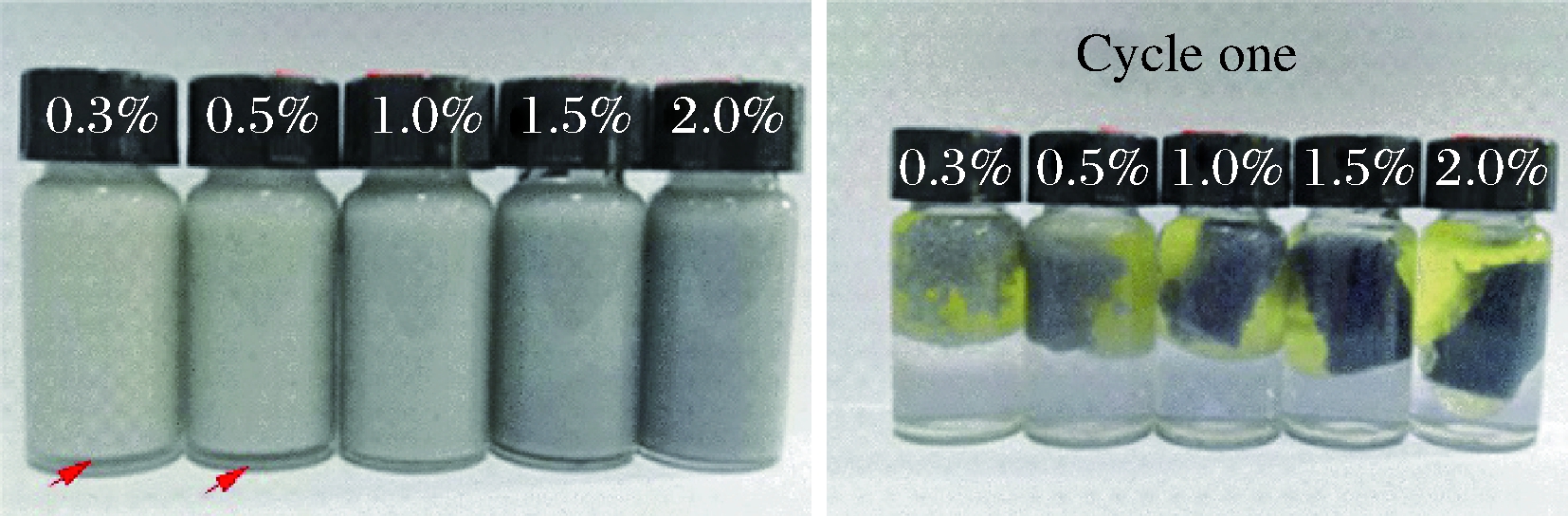
图4 冻融处理对明胶稳定Pickering乳液的影响
Fig.4 Effect of freezing-thawing treatment on the gelatin-stabilized Pickering emulsion

图5 不同储藏温度对负载β-胡萝卜素Pickering乳液的影响
Fig.5 Effect of different storage temperatures on the Pickering emulsion loaded with β-carotene
2.6 Pickering乳液装载β-胡萝卜素的保留率分析
Pickering乳液负载β-胡萝卜素在不同储藏温度下(4 ℃, 25 ℃)的保留率如图6所示。由图6可得,β-胡萝卜素在储存过程中都有一定程度的降解。在4 ℃ 条件下储藏30 d后,3种性质的乳液仍可保留70%以上的β-胡萝卜素。高黏弹性(1.5% GNPs)和黏度较高(1.0% GNPs)的乳液对β-胡萝卜素具有更好的保护作用,但两者之间没有明显的差异。而流动性较好的乳液(0.5% GNPs)对β-胡萝卜素的保护作用明显不如前两者,与外观图一致。然而,乳液在25 ℃下储藏20 d后即损失了约60%的β-胡萝卜素。高黏弹性乳液对β-胡萝卜素的保护作用明显高于其他2种乳液。可能的原因是高黏弹性乳液具有更加紧密的网络结构、较厚的界面吸附层以及高黏度,抑制了β-胡萝卜素的降解。另一方面,由GNPs稳定的Pickering乳液显示出灰蓝色,且随着GNPs浓度的增加,灰蓝色逐渐加深(图5),这可能对β-胡萝卜素的光降解也有一定的抑制作用。再者,β-胡萝卜素的降解随着储藏温度的增加而加快,可能的原因是温度升高增加了乳液的流动性,促进了β-胡萝卜素的降解,不利于乳液对β-胡萝卜素的保护[25]。总体而言,高黏弹性的Pickering乳液可能更适合于β-胡萝卜素的包埋递送。

图6 不同储藏温度对β-胡萝卜素保留率的影响(大豆油作为对照)
Fig.6 Effect of different storage temperature on the retention rate of β-carotene (soybean oil as control)
2.7 Pickering乳液装载β-胡萝卜素的体外消化特性
乳液经过胃部消化后到达肠液,此时释放的油滴与脂肪酶接触后分解成游离脂肪酸(FFA),油滴中负载的活性成分才可以被释放,从而被上皮细胞消化吸收。因此,研究乳液的FFA释放对于活性成分的吸收具有重要的指导意义。负载β-胡萝卜素的Pickering乳液的(FFA)释放曲线如图7所示。由图7可得,FFA释放发生在肠液消化的整个阶段,且随着消化时间的增加,FFA释放量逐渐增加。经过2 h模拟消化后,对照组的FFA释放量高达60%,流动性好的乳液的FFA释放量约为45%,明显低于对照组,并且随着GNPs浓度的增加,FFA释放速率和释放量逐渐减少,保持在30%左右,并且高黏弹性乳液的FFA明显低于其他组,可能的原因是高黏弹性的Pickering乳液具有更加致密的三维网络结构,较厚的界面吸附层以及相对较高的黏度,一定程度上阻碍了油滴与脂肪酶的接触,从而导致FFA的释放速率和释放量的减少[26]。
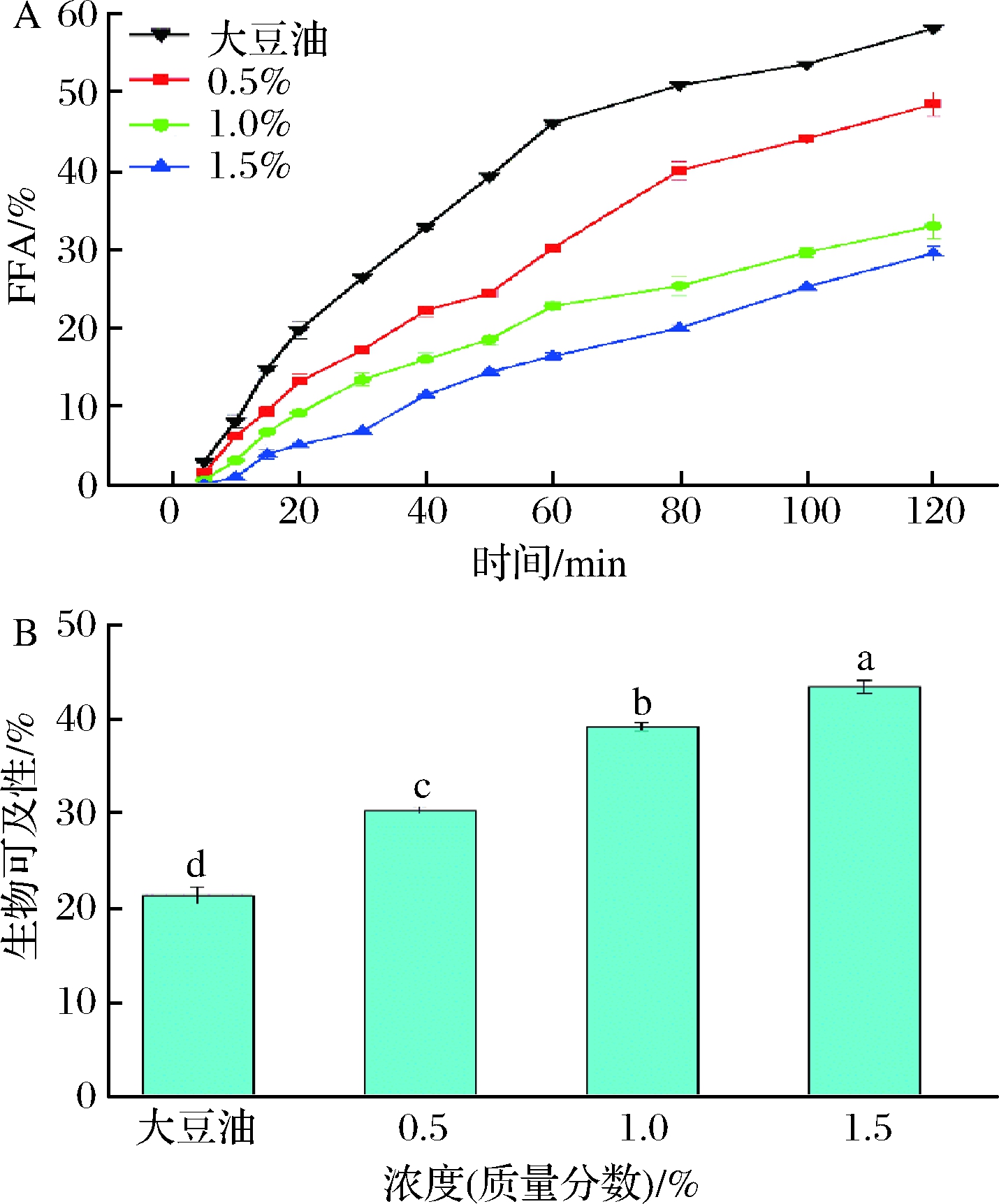
A-FFA;B-生物可及性
图7 Pickering乳液的FFA和生物可及性(大豆油作为对照)
Fig.7 The FFA and bio-accessibility of Pickering emulsion (soybean oil as control)
注:图中不同的小写字母表示有显著性差异(P<0.05)
活性物质的生物可及性是指摄入的营养物质经过消化后能提供给人体吸收部分的比例,也就是经过胃肠消化后可被小肠上皮细胞吸收的比例。在模拟小肠中的消化过程结束时,将经过肠液消化后的混合物离心,混合物分为3层,上层为未消化的油相,中间为胶束层,下层为固形物。收集胶束层以确定Pickering乳液中β-胡萝卜素的生物可及性。结果表明,β-胡萝卜素的生物可及性随着GNPs浓度的增加而增加,尤其是在1.5% GNPs浓度下制备的高黏弹性乳液,显示了最大的生物可及性(40%),可能的原因是高粘弹性乳液具有较紧密的网络结构、相对较高的黏度和良好的不易流动性,一定程度上减少了释放油滴在消化过程中的聚集,增加了β-胡萝卜素在胶束相的保留量。流动性较好的乳液网络结构相对疏松,释放的油滴可以聚集成大油滴,不利于β-胡萝卜素在胶束相中的保留。另一方面,高粘弹性乳液的网络结构也有利于抑制了β-胡萝卜素的降解[33]。因此,高粘弹性的Pickering乳液可显著增加β-胡萝卜素的生物可及性。
3 结论
(1)GNPs分散液的pH大于7时,由于较强的静电斥力,使得Pickering乳液具有较高的稳定性,但在酸性条件下稳定性较差;NaCl的添加导致静电屏蔽的产生,使得液滴尺寸和CI增加(0~50 mmol/L),随着NaCl的进一步增加(100~500 mmol/L),由于表面电荷增加,改善了液滴间的相互作用,使得液滴尺寸相对减小并保持稳定;乳液经过加热(70 ℃和100 ℃)处理后,导致液滴尺寸和CI增加,但乳液并未出现破乳现象;冻融过程中,冰晶的形成破坏了界面膜以及明胶颗粒通过氢键形成的网络结构,使得Pickering乳液不耐冻融。
(2)3种性质的Pickering乳液对装载的β-胡萝卜素的稳定性表现出优异的保护作用,甚至经过30 d的储藏,仍有70%以上的β-胡萝卜素被保留。
(3)体外消化研究表明,高黏弹性的乳液由于具有较高的黏度、较厚的界面吸附层以及致密的网络结构,抑制了脂肪酶接触油脂,从而降低了FFA的释放速度和释放量。此外,Pickering乳液的网络结构抑制了β-胡萝卜素的降解,减轻了油滴的聚集,从而增加β-胡萝卜素的生物可及性。
[1] 谭天仪, 李璟, 夏锐, 等.超细化豆渣作为皮克林乳液稳定剂的特性研究[J].食品与发酵工业, 2020,46(2):47-54.
TAN T Y, LI J, XIA R, et al.Preparation of ultrafine okara and its characteristics as a stabilizer for Pickering emulsion[J].Food and Fermentation Industries, 2020, 46(2):47-54.
[2] 刘兴丽, 赵双丽, 肖乃勇, 等.马铃薯蛋白微凝胶对皮克林乳液乳化特性的影响[J].轻工学报, 2019,34(5):1-9.
LIU X L, ZHAO S L, XIAO N Y, et al.Effect of potato protein microgel on emulsifying properties of Pickering emulsion[J].Journal of Light Industry, 2019, 34(5):1-9.
[3] SU J, GUO Q, CHEN Y, et al.Characterization and formation mechanism of lutein pickering emulsion gels stabilized by β-lactoglobulin-gum arabic composite colloidal nanoparticles[J].Food Hydrocolloids, 2020,98:105276.
[4] LIU G, WANG Q, HU Z, et al.Maillard-reacted whey protein isolates and epigallocatechin gallate complex enhance the thermal stability of the pickering emulsion delivery of curcumin[J].Journal of Agricultural and Food Chemistry, 2019,67(18):5 212-5 220.
[5] 朱雨晴, 刘伟, 陈兴, 等.食品级皮克林乳液的稳定机制及稳定性研究进展[J].食品工业科技, 2018,39(7):315-322.
ZHU Y Q, LIU W, CHEN X, et al.Advances in stabilization mechanism and stability control of food grade Pickering emulsion[J].Science and Technology of Food Industry, 2018, 39(7):315-322.
[6] 刘洋.大豆蛋白纳米颗粒稳定的乳液及其油凝胶性质[D].无锡:江南大学, 2016.
LIU Y.Properties of emulsions stabilized with soy protein nanoparticles and their oleogels[D].Wuxi:Jiangnan University, 2016
[7] DESTRIBATS M, ROUVET M, GEHIN-DELVAL C, et al.Emulsions stabilised by whey protein microgel particles:Towards food-grade Pickering emulsions[J].Soft Matter, 2014,10(36):6 941-6 954.
[8] ZHU X, ZHENG J, LIU F, et al.Freeze-thaw stability of Pickering emulsions stabilized by soy protein nanoparticles.Influence of ionic strength before or after emulsification[J].Food Hydrocolloids, 2018,74:37-45.
[9] DEGNER B M, CHUNG C, SCHLEGEL V, et al.Factors influencing the freeze-thaw stability of emulsion-based foods[J].Comprehensive Reviews in Food Science and Food Safety, 2014,13(2):98-113.
[10] WEI Z, HUANG Q.Developing organogel-based Pickering emulsions with improved freeze-thaw stability and hesperidin bioaccessibility[J].Food Hydrocolloids, 2019,93:68-77.
[11] ZHU Y, MCCLEMENTS D J, ZHOU W, et al.Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of Pickering emulsion gels[J].Food Chemistry, 2020,303:125 401.
[12] GE S, XIONG L, LI M, et al.Characterizations of Pickering emulsions stabilized by starch nanoparticles:Influence of starch variety and particle size[J].Food Chemistry, 2017,234:339-347.
[13] 米雪, 刘树兴, 曾桥, 等.响应面法优化超声辅助提取柿皮类胡萝卜素及其体外抗氧化性研究[J].中国调味品, 2019,44(11):26-31.
MI X, LIU S X, ZENG Q, et al.Optimization of ultrasound-assisted extraction of carotenoids from persimmon peel by response surface methodology and its antioxidant activity in vitro[J].China Condiment, 2019, 44(11):26-31.
[14] LU Y, MAO L, ZHENG H, et al.Characterization of β-carotene loaded emulsion gels containing denatured and native whey protein[J].Food Hydrocolloids, 2020,102:105 600.
[15] RODRIGUES R M, RAMOS P E, CERQUEIRA M F, et al.Electrosprayed whey protein-based nanocapsules for β-carotene encapsulation[J].Food Chemistry, 2020,314:126 157.
[16] LIN Q, LIANG R, ZHONG F, et al.Effect of degree of octenyl succinic anhydride (OSA) substitution on the digestion of emulsions and the bioaccessibility of β-carotene in OSA-modified-starch-stabilized-emulsions[J].Food Hydrocolloids, 2018,84:303-312.
[17] CHEN L, YOKOYAMA W, LIANG R, et al.Enzymatic degradation and bioaccessibility of protein encapsulated β-carotene nano-emulsions during in vitro gastro-intestinal digestion[J].Food Hydrocolloids, 2020,100:105 177.
[18] DAI L, SUN C, WEI Y, et al.Characterization of Pickering emulsion gels stabilized by zein/gum arabic complex colloidal nanoparticles[J].Food Hydrocolloids, 2018,74:239-248.
[19] MAO L, MIAO S, YUAN F, et al.Study on the textural and volatile characteristics of emulsion filled protein gels as influenced by different fat substitutes[J].Food Research International, 2018,103:1-7.
[20] ROOHINEJAD S, OEY I, WEN J, et al.Formulation of oil-in-water β-carotene microemulsions:Effect of oil type and fatty acid chain length[J].Food Chemistry, 2015,174:270-278.
[21] FENG X, DAI H, MA L, et al.Food-grade gelatin nanoparticles:preparation, characterization, and preliminary application for stabilizing pickering emulsions[J].Foods, 2019,8(10):479.
[22] FENG X, DAI H, MA L, et al.Properties of Pickering emulsion stabilized by food-grade gelatin nanoparticles:Influence of the nanoparticles concentration[J].Colloids and Surfaces B:Biointerfaces, 2020.196:111 294.
[23] COESTER C J,LANGER K,VON BRIESEN H,et al.Gelatin nanoparticles by two step desolvation a new preparation method, surface modifications and cell uptake[J].Journal of Microencapsulation, 2000,17(2):187-193.
[24] LIU F, TANG C.Soy glycinin as food-grade Pickering stabilizers:Fabrication of gel-like emulsions and their potential as sustained-release delivery systems for β-carotene[J].Food Hydrocolloids, 2016,56:434-444.
[25] YUAN Y, GAO Y, ZHAO J, et al.Characterization and stability evaluation of β-carotene nanoemulsions prepared by high pressure homogenization under various emulsifying conditions[J].Food Research International, 2008,41(1):61-68.
[26] TAN H, ZHAO L, TIAN S, et al.Gelatin particle-stabilized high-internal phase emulsions for use in oral delivery systems:protection effect and in vitro digestion study[J].Journal of Agricultural and Food Chemistry, 2017,65(4):900-907.
[27] LIU W, WANG J, MCCLEMENTS D J, et al.Encapsulation of β-carotene-loaded oil droplets in caseinate/alginate microparticles:Enhancement of carotenoid stability and bioaccessibility[J].Journal of Functional Foods, 2018,40:527-535.
[28] 王启明, 唐瑜婉, 杨雅轩, 等.pH对麦醇溶蛋白/槲皮素相互作用及其Pickering乳液特性的影响[J].食品科学, 2020,41(20):27-34.
WANG Q M, TANG Y W, YANG Y X, et al.Effects of pH on the interaction of wheat gliadin/quercetin and pickering emulsion properties[J].Food Science, 2020,41(20):27-34.
[29] 张亚珍, 熊文飞, 裴亚琼, 等.盐离子对花生粕分离蛋白纳米粒子及其稳定Pickering乳液特性的影响[J].食品科学, 2019,40(24):1-7.
ZHANG Y Z, XIONG W F,PEI Y Q, et al.Effects of salt ions on the properties of peanut protein isolate nanoparticles and pickering emulsion stabilized with the nanoparticles[J].Food Science, 2019,40(24):1-7.
[30] LIMA CARDIAL M R, PAULA H C B, DA SILVA R B C, et al.Pickering emulsions stabilized with cashew gum nanoparticles as indomethacin carrier[J].International Journal of Biological Macromolecules, 2019,132:534-540.
[31] DAI H, LI Y, MA L, et al.Fabrication of cross-linked β-lactoglobulin nanoparticles as effective stabilizers for Pickering high internal phase emulsions[J].Food Hydrocolloids, 2020,109:106 151.
[32] KASIRI N, FATHI M.Production of cellulose nanocrystals from pistachio shells and their application for stabilizing Pickering emulsions[J].International Journal of Biological Macromolecules, 2018,106:1 023-1 031.
[33] LIU W, GAO H, MCCLEMENTS D J, et al.Stability, rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J].Food Hydrocolloids, 2019,88:210-217.