传统食醋酿造法主要有固态发酵法和液态发酵法,固态发酵法以中国的山西老陈醋[1]、镇江香醋[2]和四川麸醋[3]为代表,液态发酵法以意大利香醋[4]、西班牙雪利醋[5]等为代表。不同酿造工艺酿制而成的食醋风味也有较大差异。液态深层发酵工艺酿制的食醋,由于使用纯种的醋酸菌进行发酵,食醋中的有机酸种类、风味物质等相对单一,产酸以乙酸为主,风味物质主要是乙酸乙酯,产品酸味刺鼻、风味寡淡[6]。固态发酵食醋多采用开放式的发酵工艺,主要酿造微生物除醋酸菌外,还有乳酸菌、芽孢杆菌、酵母菌和霉菌等,它们经代谢直接产生或其代谢物通过合成作用形成多种物质,如醇类、酯类、有机酸、醛类、烯萜类等,不同的香气物质组合在一起,共同赋予了食醋复杂而独特的风味[7-10]。
山西老陈醋醋酸发酵过程中的微生物大都具有特定的功能,通过微生物的代谢作用产生众多的食醋风味物质,为成品食醋特有风味的形成提供必要的基础,如醋酸菌可将乙醇转化为乙酸,是山西老陈醋醋酸发酵阶段的主要产酸微生物,其性能直接影响到食醋的产量和品质。酸味是山西老陈醋的主要呈味物质,成品食醋的主体成分除乙酸外还有乳酸、柠檬酸、琥珀酸等有机酸,而这些物质与乳酸菌有密不可分的关系。本研究以山西老陈醋的醋醅为样品,从中分离出产酸微生物,并对产酸性能优良、环境耐受性好的菌株进行筛选,为将来通过多种微生物菌剂优化食醋生产工艺、提高原料利用率、丰富食醋酿造的菌种资源奠定基础。
1 材料与方法
1.1 样品采集
采集地点:山西老陈醋集团有限公司醋化车间(山西,晋中)。
采样方法:在发酵缸的4个顶点以及中心位置,采集距离醋酸发酵缸表面20 cm处的醋醅100 g左右。跟踪采集同批次5个发酵缸的醋醅样本,并将其充分混匀,然后通过四分法舍去多余的醋醅,最终将300~500 g醋醅样品收集于已灭菌的自封袋中,冷藏带回实验室后进行产酸菌株的分离。
采样设计:如表1所示,跟踪取样同一批次正常发酵的醋醅,发酵周期9 d,隔天在翻醅后取样,分别标记为AAF1、AAF3、AAF5、AAF7、AAF9。
1.2 试剂与仪器
MRS琼脂培养基、无水葡萄糖、酵母膏、无水乙醇、琼脂、浓盐酸、CaCO3、NaOH、NaCl,所用试剂均为分析纯。
表1 山西老陈醋醋醅样品的采集时间及其编号
Table 1 Sampling time and number at acetic acid fermentation stages of Shanxi aged vinegar

醋化发酵取样时间/ d样品编号1AAF13AAF35AAF57AAF79AAF9
Ezup柱式细菌基因组DNA 抽提试剂盒,生工生物工程(上海)股份有限公司;DL-CJ-1ND型无菌超净工作台,北京东联哈尔滨仪器设备有限公司;LS-35LJ型立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;ZQPL-200型立式恒温振荡培养箱,天津莱玻特瑞设备有限公司;Nano Drop 2000c核酸浓度测定仪,美国Thermo Fisher Scientific公司;UVP凝胶成像系统, 英国Ultra-Violet Products有限公司;5424高速冷冻离心机,德国Eppendorf公司;7500实时荧光定量PCR仪,美国ABI公司;CX41生物显微镜,日本奥林巴斯公司。
1.3 试验方法
1.3.1 产酸菌的分离、纯化[11]
取10 g混匀样品放入装有玻璃珠和已灭菌的90 mL无菌生理盐水的三角瓶(250 mL)中,振荡20 min,即得到样品10-1稀释液,取5支已灭菌装有9 mL无菌生理盐水的试管,依次制成10-2~10-6稀释液,取10-3、10-4、10-5、10-6稀释度的稀释液0.1 mL,涂布于筛选培养基上(质量分数1%葡萄糖、1%酵母膏、2%CaCO3、2%琼脂,pH 4.5,121 ℃灭菌15 min后加入体积分数3%的无水乙醇)。将平板倒置于37 ℃恒温培养箱培养2~3 d,挑取长势良好、分布密度大且形态不同的单菌落进行纯化。将经过2~3次纯化后的菌株接种于斜面培养基中,37 ℃恒温培养18~24 h,置于4 ℃冰箱中保存。对于需要长期保藏的菌株,可采用安瓿管甘油-70 ℃保藏法。
1.3.2 产酸定量试验
1.3.2.1 醋酸菌
以恶臭醋酸杆菌(Acetobacter rancens)AS1.41为对照菌株,采用酸碱滴定法[12]对分离获得的醋酸菌进行产酸量(以醋酸计)测定,3次重复,取平均值,同时做空白滴定。酒精转化率计算[13]如公式(1)所示:
转化率![]()
(1)
式中:产酸量,g/L;酒精的体积分数转换成质量浓度计算,g/L。
1.3.2.2 乳酸菌
乳酸菌的产酸量测定方法同醋酸菌。
1.3.3 环境耐受性试验
将100 mL产酸培养基分装250 mL锥形瓶中,按2%接种量接种初筛得到的6株醋酸菌,设置不同的温度梯度(30、33、36、39、42 ℃)、乙醇体积分数(4、6、8、10、12%)和乙酸质量浓度(0、10、20、30、40、50、60 g/L),130 r/min培养6 d,测定菌株的生物量OD600和相应产酸量。每个梯度重复3次,取平均值。
1.3.4 遗传稳定性试验
醋酸菌在分离及保藏过程中容易发生突变,故需对其进行遗传稳定性试验。将初选菌株在平板上连续传代6次,观察菌落形态和个体特征。将各代菌株同时接种到乙醇体积分数为4%的基础培养基中,30 ℃、130 r/min摇瓶发酵培养6 d,测定发酵液的产酸量(以醋酸计),计算转酸率,重复3次。
产酸培养基:酵母膏1%,葡萄糖1%,pH 4.5,121 ℃灭菌15 min,冷却后加入体积分数6%的无水乙醇。
基础培养基:酵母膏1%,葡萄糖1%,pH 4.5,121 ℃灭菌15 min。
1.3.5 菌种形态鉴定
(1)观察菌落形态,记录各菌株的菌落形态特征。
(2)将菌种进行革兰氏染色,用显微镜观察菌种的菌体形态。
1.3.6 菌种分子生物学鉴定
对细菌的16S rDNA序列进行测序,从而鉴定优势菌株的种、属。将菌株的16S rDNA基因序列提交GenBank 数据库,使用NCBI的BLAST检测系统(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对序列同源性进行比较分析。
2 结果与分析
2.1 产酸微生物的分离、纯化
恒温培养48~72 h后,菌落的生长情况如图1所示。随着稀释倍数的增加,培养基上的菌落总数逐渐减少,当稀释倍数为10-5 时,产酸菌较为明显且多为单菌落。此时将平板上出现溶钙圈的单个菌落接入培养基,进行2~3纯化后,共获得54株产酸菌,其中醋酸菌22株、乳酸菌32株,保藏备用。

a-产酸菌株的分离筛选;b-产酸菌株的纯化
图1 产酸微生物的分离纯化
Fig.1 Isolation and purification of acid-producing microorganisms
2.2 醋酸菌的产酸性能测定
醋酸菌株产酸量及转酸率结果见表2,各菌株的产酸量及转酸率差别较大,菌株A14的酒精转化率最高,为57.49%,转酸率最低的是菌株A1,为37.08%。22株醋酸菌中有10株菌的产酸能力高于对照菌株。对产酸量在30.00 g/L以上的6株菌(A5、A10、A14、A16、A18、A20)进行环境耐受性分析。
表2 各醋酸菌株的产酸量及酒精转化率比较
Table 2 The comparison of acid producing and alcohol conversion rate between different AAB strains
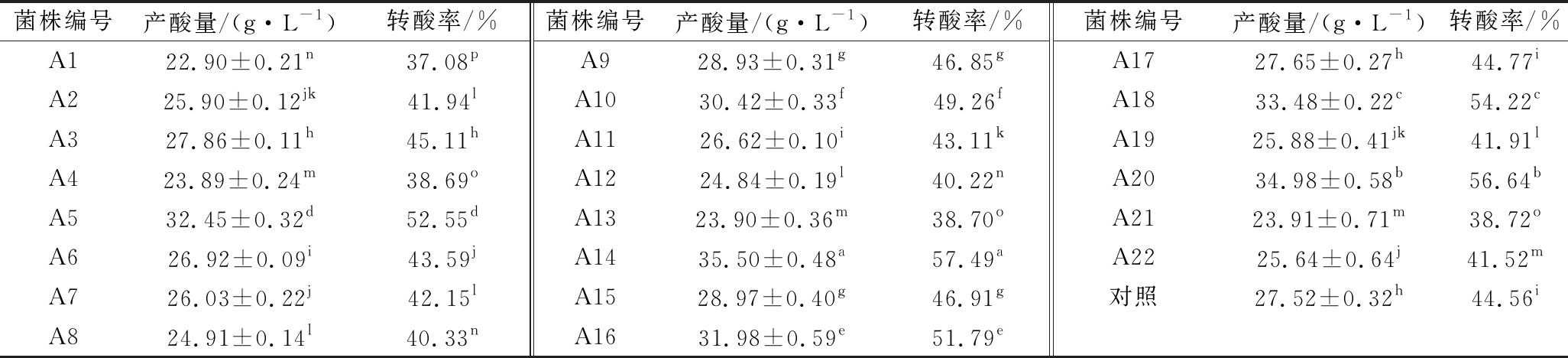
菌株编号产酸量/(g·L-1)转酸率/%菌株编号产酸量/(g·L-1)转酸率/%菌株编号产酸量/(g·L-1)转酸率/%A122.90±0.21n37.08pA928.93±0.31g46.85gA1727.65±0.27h44.77iA225.90±0.12jk41.94lA1030.42±0.33f49.26fA1833.48±0.22c54.22cA327.86±0.11h45.11hA1126.62±0.10i43.11kA1925.88±0.41jk41.91lA423.89±0.24m38.69oA1224.84±0.19l40.22nA2034.98±0.58b56.64bA532.45±0.32d52.55dA1323.90±0.36m38.70oA2123.91±0.71m38.72oA626.92±0.09i43.59jA1435.50±0.48a57.49aA2225.64±0.64j41.52mA726.03±0.22j42.15lA1528.97±0.40g46.91g对照27.52±0.32h44.56iA824.91±0.14l40.33nA1631.98±0.59e51.79e
注:数据表示形式为平均值±标准偏差(n=3),不同小写字母表示0.05水平下的差异显著性分析(下同)
2.3 醋酸菌的环境耐受性分析
在一定的范围内,培养温度的上升会有利于醋酸菌的生长和代谢,而温度过高则会使醋酸菌产酶能力降低甚至丧失,从而导致产酸下降[14]。图2-a显示,随着培养温度的上升,6株醋酸菌的吸光度值呈现出3种变化趋势,即A14、A20先保持平稳后快速下降,A5、A16先略微升高后快速下降,A10、A18先快速下降后保持平稳。由图2-b可知,菌株A14的产酸量最高且温度耐受性较好,在42 ℃的培养温度中,其产酸量仍能达到(26.54±0.05)g/L,其次为菌株A16和A20。A18的最适发酵温度为30 ℃,其他5株菌在培养温度为33 ℃时产酸量最大。
酒精度耐受试验发现,初筛醋酸菌的OD值随着酒精浓度的上升均呈较缓慢的降低趋势(图2-c)。各菌株的产酸量随着乙醇浓度增长,表现出不同的变化。菌株A5、A14和A18的产酸量先增加,分别在乙醇体积分数6%和8%时达到最大,之后产酸量下降(图2-d)。其他3株菌随着乙醇浓度的增加,产酸量呈下降趋势,说明A10、A16及A20的酒精耐受性较差。当发酵液中的乙醇体积分数达到12%时,6株菌可以存活,但其代谢受到明显的抑制,基本不生成酸。
过酸和碱性的环境都会导致相关酶活性下降,从而影响醋酸菌的生长和产酸能力[15]。随着培养液中乙酸浓度的上升,初筛菌株的OD600值均逐渐减小(图2-e)。酿醋生产过程中,发酵液中的总酸含量会随醋酸发酵进程而逐渐升高,从而对参与发酵的微生物产生一定抑制作用。图2-f显示,当发酵液中的乙酸含量超过3.0 g/100mL,6株醋酸菌仍然存活但产酸能力均明显减弱,与谢锦明等[16]陕西民间醋醅中筛选的醋酸菌耐酸性基本一致;当发酵液中的乙酸含量达到6.0 g/100mL,醋酸菌基本停止繁殖及代谢活动。
2.4 醋酸菌的遗传稳定性
由表3可以看出,经过传代培养后,各菌株每代的产酸量均发生变化。菌株A20各代发酵后的转酸率均有降低,且变化幅度较大;而菌株A14各代之间的产酸率没有明显的差异,遗传性能较稳定。综上,确定菌株A14为醋酸发酵优势菌种。
2.5 乳酸菌的产酸性能测定
由表4可知,32株乳酸菌的产酸量差异明显,其中菌株L14的产酸量最高,为(9.94±0.34)g/L;而菌株L8的产酸能力最差,仅(0.83±0.01)g/L。试验比较发现,乳酸菌代谢产物乳酸的生成量要远低于醋酸菌转化乙醇生成醋酸的量,说明AAF阶段,醋酸菌的数量虽然不及乳酸菌多,但其具有较高的转酸率,发酵液中乙酸的积累速度快于乳酸的积累速度。对产酸量高于9.00 g/L的菌株L4、L19、L11和L20进行环境耐受性分析。
2.6 乳酸菌的环境耐受性分析
图3-a的结果显示,初筛获得的4株乳酸菌对温度的反应大体相同,其吸光度值在渡过一个平稳期后均随着温度的上升呈逐渐下降趋势。当培养温度为30~40 ℃,OD600值基本保持不变;当温度超过40 ℃后,其繁殖及代谢开始受到抑制。通过温度耐受性测试,发现菌株L9和L11的温度耐受性较好,在50 ℃的环境中仍然保持相对较高的产酸能力(图6-b),初筛乳酸菌的最适产酸温度均为35 ℃。

a-不同温度梯度菌株的生物量;b-不同温度梯度菌株的产酸量;c-不同乙醇浓度菌株的生物量;d-不同乙醇浓度菌株的产酸量;e-不同乙酸含量菌株的生物量;f-不同乙酸含量菌株的产酸量
图2 六株醋酸菌菌株的环境耐受性
Fig.2 Environmental tolerance of six AAB strains
表3 传代菌种产酸量 单位:g/L
Table 3 The results of acid production of passaged strains
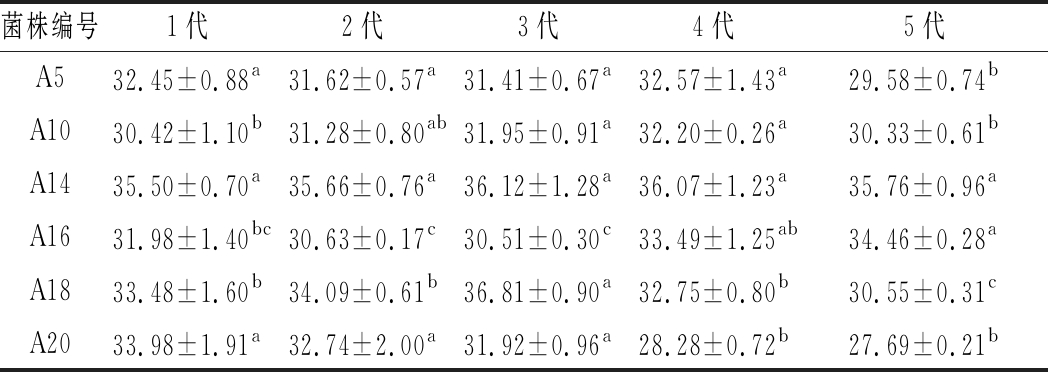
菌株编号1代2代3代4代5代A532.45±0.88a31.62±0.57a31.41±0.67a32.57±1.43a29.58±0.74bA1030.42±1.10b31.28±0.80ab31.95±0.91a32.20±0.26a30.33±0.61bA1435.50±0.70a35.66±0.76a36.12±1.28a36.07±1.23a35.76±0.96aA1631.98±1.40bc30.63±0.17c30.51±0.30c33.49±1.25ab34.46±0.28aA1833.48±1.60b34.09±0.61b36.81±0.90a32.75±0.80b30.55±0.31cA2033.98±1.91a32.74±2.00a31.92±0.96a28.28±0.72b27.69±0.21b
图3-c和图3-d是初筛乳酸菌对乙醇的耐受性测试结果,菌株L4及L20受乙醇的影响较大。与不含乙醇的发酵条件相比,当培养液中的乙醇体积分数为3%时,这2株菌的乳酸生成量分别降低了37.22%和43.36%。体积分数3%的乙醇对L9的产酸能力基本没有影响,当培养液中的乙醇体积分数达到12%时,菌株L9和L11的乳酸生成量分别降低了25.94%和30.13%,具有较好的乙醇耐受能力。
图3-e和图3-f显示的是乳酸菌对乙酸的耐受性结果,4株乳酸菌对乙酸的存在较为敏感、耐受能力均较差,当发酵液中乙酸的含量超过2.0 g/100 mL后,乳酸菌的繁殖和代谢基本停止。4株菌中,L9的乙酸耐受性最好,初始产酸量为(9.56±0.25)g/L,随着发酵液乙酸含量的升高,其产酸量迅速下降,当发酵液中的乙酸质量浓度为5.0 g/100mL,其产酸量仅为(1.54±0.01)g/L,代谢基本停止。综上,筛选出的优良产酸菌株为醋酸菌A14和乳酸菌L9。
表4 不同乳酸菌的产酸量比较 单位:g/L
Table 4 Comparison of acid production between different LAB strains
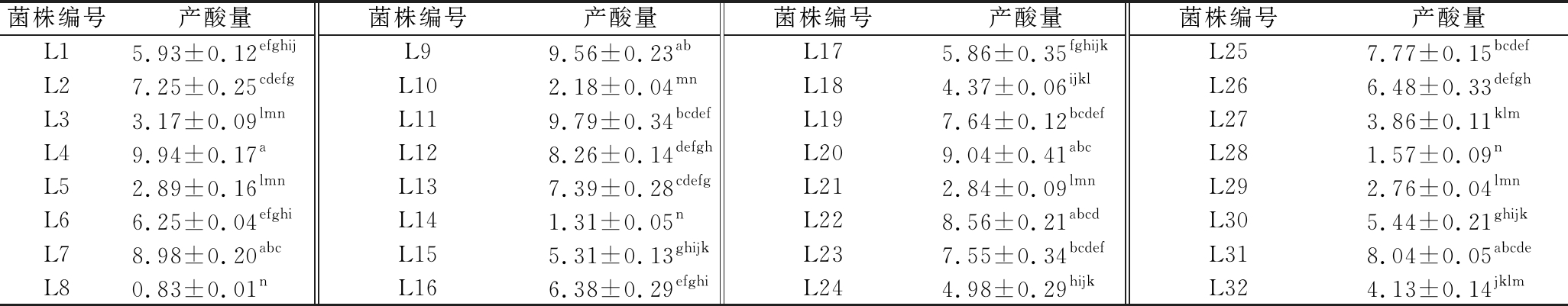
菌株编号产酸量菌株编号产酸量菌株编号产酸量菌株编号产酸量L15.93±0.12efghijL99.56±0.23abL175.86±0.35fghijkL257.77±0.15bcdefL27.25±0.25cdefgL102.18±0.04mnL184.37±0.06ijklL266.48±0.33defghL33.17±0.09lmnL119.79±0.34bcdefL197.64±0.12bcdefL273.86±0.11klmL49.94±0.17aL128.26±0.14defghL209.04±0.41abcL281.57±0.09nL52.89±0.16lmnL137.39±0.28cdefgL212.84±0.09lmnL292.76±0.04lmnL66.25±0.04efghiL141.31±0.05nL228.56±0.21abcdL305.44±0.21ghijkL78.98±0.20abcL155.31±0.13ghijkL237.55±0.34bcdefL318.04±0.05abcdeL80.83±0.01nL166.38±0.29efghiL244.98±0.29hijkL324.13±0.14jklm

a-不同温度梯度菌株的生物量;b-不同温度梯度菌株的产酸量;c-不同乙醇浓度菌株的生物量;d-不同乙醇浓度菌株的产酸量;e-不同乙酸含量菌株的生物量;f-不同乙酸含量菌株的产酸量
图3 四株乳酸菌菌株的环境耐受性
Fig.3 Environmental tolerance of four LAB strains
2.7 菌株A14和L9的鉴定
2.7.1 菌落形态
如图4所示,在平板培养基中,醋酸菌菌落呈白色,圆形,中间有凸起,菌落直径0.32~1.02 mm,周围有明显的透明圈;乳酸菌菌落呈白色,圆形,菌落直径0.58~3.07 mm,中间有凸起,表面有光泽。
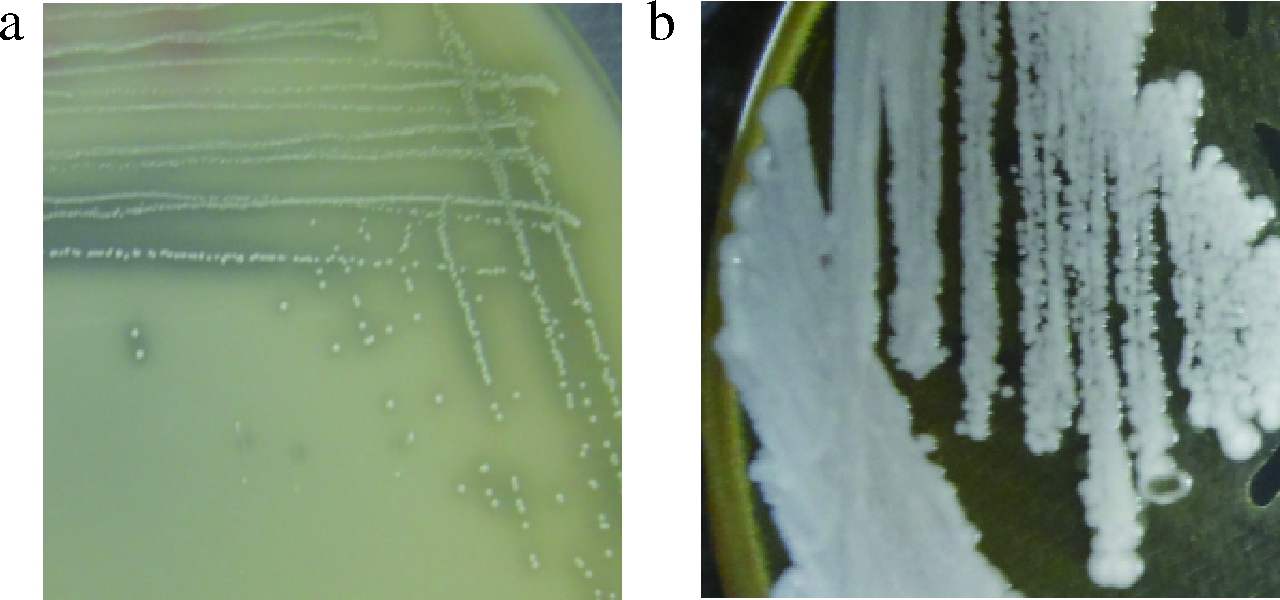
a-A14;b-L9
图4 菌株A14和L9的菌落形态
Fig.4 The colony morphology of A14 strain and L9 strain
2.7.2 菌体形态
对分离到的细菌进行革兰氏染色,然后在显微镜下进行观察,结果如图5所示。菌株A14经革兰氏染色后呈红色,阴性,微生物显微形态呈杆形,周边无芽孢,以单个或成对方式排列;而菌株L9革兰氏染色后呈紫色,阳性,微生物菌体形态呈球状,对生或成链状排列,周边无芽孢。
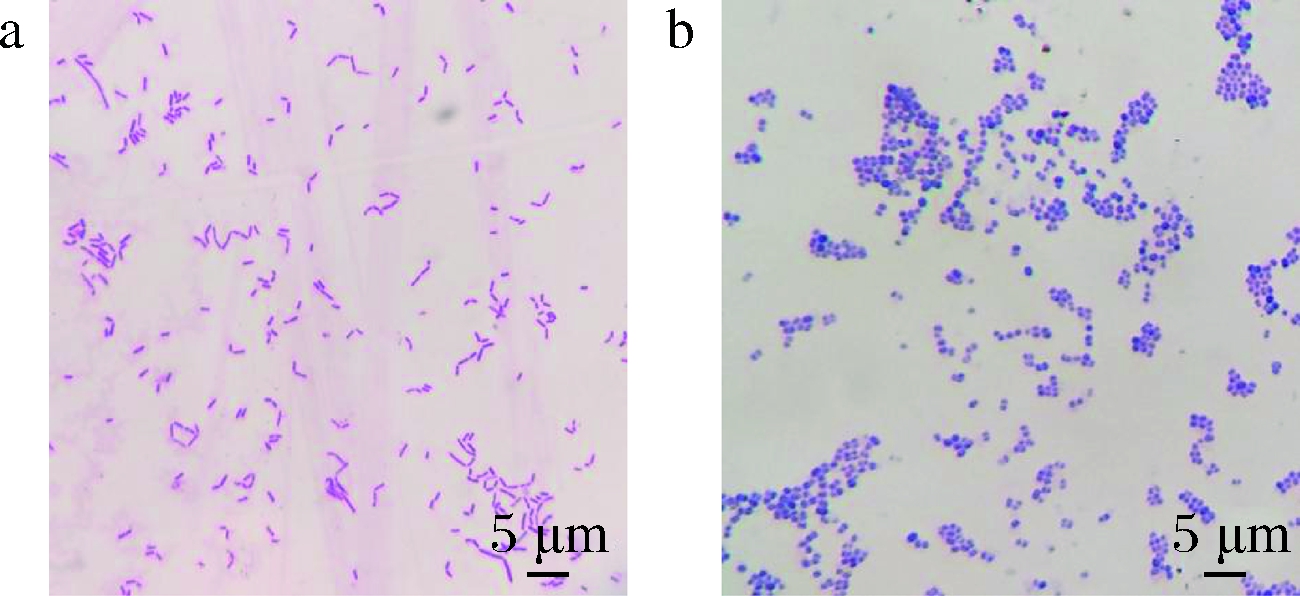
a-A14;b-L9
图5 菌株A14和L9的菌体形态观察
Fig.5 The microscopic observation of A14 strain and L9 strain
2.7.3 16S rDNA鉴定
对筛选出来的2株菌株进行16S rDNA基因序列分析鉴定,提取其基因组DNA,进行PCR扩增。将待测序菌株的PCR产物纯化后送至上海生工有限公司进行序列分析,待测序结果出来后,将其序列提交到NCBI基因库,通过BLAST程序进行碱基同源序列检索,对菌株进行同源性比较。表5的比对结果表明菌株A14与巴氏醋杆菌(Acetobacter pasteurianus CP021922.1)的同源性为99.85%,L9与戊糖片球菌(Pediococcus pentosaceus JN039348.1)同源性为100%。结合菌落形态、菌体形态和16S rDNA技术手段,鉴定菌株A14为A.pasteurianus,L9为P.pentosaceus。
表5 目标菌株比对情况
Table 5 Phylogenetic identification of target strains

菌株编号种属鉴定GenBank登录号相似度菌株来源A14Acetobacter pasteurianusCP021922.11377/1379(99.85%)CupeiL9Pediococcus pentosaceusJN039348.11436/1436(100%)Cupei
3 讨论
在对分离到的乳酸菌和醋酸菌进行产酸性能的测试过程中,发现醋酸菌的产酸能力明显高于乳酸菌,分离醋酸菌株的最低产酸量为(22.90±0.21)g/L,而乳酸菌中最高能产酸(9.94±0.34)g/L,产酸能力最差的仅(0.83±0.01)g/L。这说明在醋酸发酵阶段,虽然乳酸菌的丰度远高于醋酸菌,但醋醅中总酸的快速上升主要是由于乙酸的积累,而不是乳酸的原因。同时,乳酸菌对乙酸较敏感,耐酸能力不及醋酸菌,推测可能是醋酸菌利用乙醇生成的乙酸能轻易穿透乳酸菌的细胞膜引起细胞死亡[17]。此外,亓正良等[18]对A.pasteurianus在醋酸发酵过程中能量代谢的研究发现,添加琥珀酸和苹果酸可以提高醋杆菌耐酸能力和醋酸生产能力,强化细胞产能,从而使菌株在高酸环境中继续发酵产酸。山西老陈醋酿造过程中琥珀酸、苹果酸的生成,可能是醋酸菌耐酸能力强、产酸高的另外一种原因,具体机理还有待继续研究。
本课题组前期的微生物统计结果表明[19],成熟酒醪中依然存在大量的乳酸菌和醋酸菌,它们在酒精发酵阶段受高浓度乙醇(体积分数8%~9%)的胁迫,存活但基本不产酸或产酸很少,经过长期的适应,对乙醇的耐受能力逐渐提高,可以耐受体积分数12%的乙醇。分离到的乳酸菌和醋酸菌在高温(>42 ℃)条件下都能存活,可能与山西老陈醋高温醋酸发酵工艺有关,产酸菌经过长期的高温驯化,对温度的耐受能力也逐渐增强。有研究表明[20-21],从食醋醋醅中分离获得的A.pasteurianus普遍具有高耐受性,可以耐受体积分数12%的乙醇及43 ℃的高温,与本试验的研究结果一致。液态食醋和果醋发酵通常是将纯菌种接种至高乙醇含量的发酵液中,由于同种微生物快速繁殖、集中代谢,势必会导致发酵液中积累较高浓度的乙酸,同时释放大量的热,这就要求主体发酵微生物具有较好的环境耐受性。参与山西老陈醋发酵的微生物经过长期高温、高酸环境的驯化,具有较好的耐受性,且致病性较低,因此本研究筛选出来的醋酸菌和乳酸菌在液态食醋和果醋发酵方面具有很大的应用潜力,可制成菌剂进行初试试验。
4 结论
采用纯培养方式对山西老陈醋醋酸发酵过程中的产酸微生物进行了分离纯化,共获得54株产酸菌。对分离得到的22株醋酸菌和32株乳酸菌进行了产酸能力测试及环境耐受性分析,筛选出的醋酸菌经菌落形态、菌体形态和16S rDNA序列分析法鉴定为巴氏醋杆菌,产酸能力为(35.5±0.48)g/L,能耐受42 ℃高温、体积分数10%的乙醇和5.0 g/100mL的乙酸,且遗传性能较稳定;筛选出来的优势乳酸菌经鉴定后为戊糖片球菌,其产酸能力为(9.56±0.23)g/L,能耐受50 ℃高温和体积分数12% 的乙醇。
[1] 严蕊, 王晓云.山西老陈醋传统酿造工艺写实记录[J].食品工程, 2015(2):55-59.
YAN R, WANG X Y.Factory record of Shanxi aged vinegar′s traditional brewing vinegar process[J].Food Engineering, 2015(2):55-59.
[2] 朱瑶迪, 邹小波, 石吉勇, 等.镇江香醋固态发酵过程分析[J].中国食品学报, 2014, 14(8):256-261.
ZHU Y D, ZOU X B, SHI J Y, et al.Analysis of solid-fermentation process of Zhenjiang balsamic vinegar[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(8):256-261.
[3] 张奶英, 刘书亮, 杨勇,等.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技, 2014, 35(11):174-178.
ZHANG N Y, LIU S L, YANG Y, et al.Dynamic analysis of physiochemical indexes and microbes in fermentation process of Sichuan bran vinegar[J].Science and Technology of Food Industry, 2014, 35(11):174-178.
[4] GUERREIRO T M, DE OLIVEIRA D N, FERREIRA M S, et al.High-throughput analysis by SP-LDI-MS for fast identification of adulterations in commercial balsamic vinegars[J].Analytica Chimica Acta, 2014, 838:86-92.
[5] SOLIERI L, GIUDICI P.Vinegars of the World[M].Springer:Milan, 2009, 179-193.
[6] TESFAYE W, MORALES M L, GARCIA-PARRILLA M C, et al.Wine vinegar:technology, authenticity and quality evaluation[J].Trends in Food Science & Technology, 2002, 13(1):12-21.
[7] UYSAL R S, SOYKUT E A, BOYACI I H, et al.Monitoring multiple components in vinegar fermentation using raman spectroscopy[J].Food Chemistry, 2013, 141(4):4 333-4 343.
[8] QI W, WANG C, CAO X H,et al.Flavour analysis of Chinese cereal vinegar[J].IERI Procedia, 2013, 5:332-338.
[9] 孙宗保. 镇江香醋挥发性成分分析及醋龄的识别研究[D].镇江:江苏大学, 2014.
SUN Z B.Analysis of volatile components and study on age discrimination of Zhenjiang aromatic vinegar[D].Zhenjiang:Jiangsu University, 2014.
[10] 余宁华, 陆震鸣, 许伟,等.基于主成分分析的中国发酵食醋有机酸含量差异性分析[J].食品与发酵工业, 2010, 36(10):144-148.
YU N H, LU Z M, XU W, et al.Regional difference of organic acid contents in Chinese fermented vinegar based on principal component analysis[J].Food and Fermentation Industries, 2010, 36(10):144-148.
[11] 王子靖海, 李家欣, 朱运平, 等.传统发酵豆腐酸浆中高产酸乳酸菌的分离鉴定及特性分析[J].中国酿造, 2019, 38(12):14-19.
WANG Z J H, LI J X, ZHU Y P, et al.Isolation, identification and characterization of high yield acid-producing lactic acid bacteria from traditionally fermented soy-whey[J].China Brewing, 2019, 38(12):14-19.
[12] 朱克永. 食品检测技术[M].北京:科学出版社, 2004.
ZHU K Y.Food Testing Technology[M].Beijing:Science Press, 2004.
[13] 陈伟. 优质醋酸菌的选育苹果醋酸发酵规律及酶活影响的研究[D].泰安:山东农业大学, 2002.
CHEN W.Study on selection of higher quality acetic acid bacteria, fermentative pattern and enzyme activity in vinegar fermentation of apple juice[D].Tai′an:Shandong Agricultural University, 2001.
[14] DE ORY I, ROMERO L E, CANTERO D.Modelling the kinetics of growth of Acetobacter aceti in discontinuous culture:influence of the temperature of operation[J].Applied Microbiology & Biotechnology, 1998, 49(2):189-193.
[15] 姚洪礼, 李兴江, 郑志,等.基于16S rDNA的醋酸菌筛选及其发酵特性[J].食品科学, 2017, 38(4):6-12.
YAO H L, LI X J, ZHENG Z, et al.Screening and fermentation characteristics of an acetic acid bacterial strain based on 16S rDNA for vinegar production[J].Food Science, 2017, 38(4):6-12.
[16] 谢锦明, 赵秀芳, 袁江兰, 等.陕西民间醋醅中高产酸醋酸菌的筛选和发酵特性[J].食品与发酵工业, 2020, 46(10):173-178.
XIE J M,ZHAO X F,YUAN J L,et al. Screening of high yield acetic acid bacteria in Shaanxi Folk Vinegar Pei and its fermentation characteristics[J].Food and Fermentation Industries, 2020, 46(10):173-178.
[17] 邱婷. 产乙偶姻微生物群落的合成及其在传统食醋酿造过程的应用[D].无锡:江南大学, 2019.
QIU T.Synthesis of acetoin-producing microbial community and its application in traditional vinegar brewing process[D].Wuxi:Jiangnan University, 2019.
[18] 亓正良, 杨海麟, 夏小乐, 等.巴氏醋杆菌高酸度醋发酵过程的能量代谢分析[J].微生物学通报, 2013, 40(12):2 171-2 181.
QI Z L, YANG H L, XIA X L, et al.Analysis of energetic metabolism of Acetobacter pasteurianus during high acidic vinegar fermentation[J].Microbiology China, 2013, 40(12):2 171-2 181.
[19] 邢晓莹. 基于山西老陈醋优良菌株在山楂醋酿造中的应用[D].太原:山西农业大学, 2019.
XING X Y.Fermentation of hawthorn vinegar using excellent strains isolated from Shanxi aged vinegar[D].Taiyuan:Shanxi Agricultural University, 2019.
[20] 吴晓英. 耐乙醇巴氏醋杆菌选育及其耐受机制研究[D].天津:天津科技大学, 2015.
WU X Y.Screening ethanol tolerance Acetobacter pasteurianus and its mechanism of tolerance[D].Tianjin:Tianjin University of Science & Technology, 2015.
[21] 陈洋.耐乙醇醋酸菌特性研究及应用[D].湖北:湖北工业大学, 2016.
CHEN Y.The characteristics research and application of ethanol-tolerant acetic acid bacteria[D].Hubei:Hubei University of Technology, 2016.