浊米酒是一种以糯米、大米、红米或黑米等稻米为主要原料,配合酒曲和水酿造而成的传统低度发酵型酒精饮料[1]。浊米酒因在发酵结束后不采用过滤工艺而呈现浑浊的外观[2],具有独特的风味和较高的营养价值而深受大众喜爱[3]。浊米酒发酵过程中微生物代谢产生的高级醇与米酒风味及其安全性息息相关,高级醇通常是指碳原子数超过2的一元醇类物质[4],主要有异丁醇、异戊醇[5]、苯乙醇[6]、正丙醇[7-8]等,高级醇是酒体中重要的呈香呈味物质,但含量过高会使酒体呈现苦味等不良风味[9],且具有较强的致醉性[10],饮用后会出现“上头”和呕吐等不适症状[11-12],对人体健康有毒害威胁[13]。据报道称,以粮谷类原料酿制而成的酒,其高级醇质量浓度须控制在0.2 g/100mL以下(以异丁醇、异戊醇计)[9],而米酒中高级醇含量相对高于其他酒种[5,13],因此,米酒中高级醇含量的快速精准检测对控制米酒风味品质意义重大。
高级醇的测定方法主要为气相色谱法和分光光度法[14-15]:气相色谱法可准确分析米酒中单一高级醇的含量[12],并以各高级醇含量之和作为高级醇总量,但该方法需依赖昂贵的检测耗材,如色谱柱等,且后期维护费用较高;分光光度法通常采用2种或2种以上高级醇的混合标准溶液来代表被测样品中高级醇总含量,它不能准确检测样品中单个高级醇含量,检测相对耗时且所需样品量多(1 mL以上)。酶标仪比色法是基于朗伯-比尔定律实现对目标化合物的定量分析的一种检测方法[16],近年来广泛应用于食品安全检测研究中[17-18]。与以往研究对酶标仪比色法的评价一致[19],本研究在检测中发现酶标仪比色法的主要优点为样品少(200 μL)、通量高(可同时扫描检测96个样品)、检测速度快(1 s内可出扫描结果)、准确度高等。本研究采用酶标仪比色法建立6种高级醇(异丁醇、异戊醇、β-苯乙醇、正丙醇、正丁醇、己醇)定量分析的标准曲线,在单一标曲分析和浊米酒气相检测结果的基础上,建立6种高级醇不同配比的标准曲线,以期为浊米酒中高级醇含量的检测提供快速准确的检测方法。
1 材料与方法
1.1 材料与试剂
有机糯米,北京和雅堂食品有限公司;α-淀粉酶、糖化酶,北京索莱宝Solarbio公司;血球计数板,上海求精生化试剂仪器有限公司;异丁醇,天津瑞金特化学品有限公司;异戊醇,成都市科龙化工试剂厂;苯乙醇,上海麦克林生化有限公司;正丙醇,天津市致远化学试剂有限公司;正丁醇,天津市富宇精细化工有限公司;己醇,阿拉丁;无水乙醇,天津市科密欧化学试剂有限公司;硫酸,重庆万盛川东化工有限公司;对二甲氨基苯甲醛,天津市光复精细化工研究所。
1.2 仪器与设备
显微镜Ti-s,日本尼康;YXQ-30SⅡ型立式压力蒸汽灭菌锅、SW-CT-IFD型洁净工作台、SPX-250B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;DK-98-IIA型电热恒温水浴锅,天津市泰斯特仪器有限公司;IMS-20制冰机,常熟市雪科电器有限公司;7890A气相色谱仪,美国安捷伦;VARIOSKAN FLASH酶标仪,美国Thermo Fisher Scientific公司。
1.3 试剂配制
对二甲胺基苯甲醛-硫酸溶液(质量浓度5 g/L):取0.25 g对二甲胺基苯甲醛,用95%~98%的硫酸定容至50 mL。
1 mg/mL单一高级醇标准溶液(以异丁醇为例):称取0.1 g异丁醇,加入50 mL色谱级无水乙醇,用蒸馏水定容至100 mL。
0.1 mg/mL单一高级醇标准溶液(以异丁醇为例):吸取5 mL上述1 mg/mL异丁醇标准溶液,用蒸馏水定容至50 mL。
2种高级醇在不同体积配比下的组合溶液(质量浓度为0.1 mg/mL):组合1,V(正丙醇)∶V(异丁醇)=1∶1;组合2,V(正丙醇)∶V(异戊醇)=1∶1;组合3,V(异丁醇)∶V(异戊醇)=1∶1;组合4,V(异丁醇)∶V(异戊醇)=1∶4;组合5,V(异丁醇)∶V(异戊醇)=2∶1;组合6,V(异丁醇)∶V(异戊醇)=1∶2。
6种高级醇(配比顺序为异戊醇∶苯乙醇∶异丁醇∶正丙醇∶己醇∶丁醇)在不同体积配比下的混合标准溶液(质量浓度为0.1 mg/mL):配比1为1∶1∶1∶0.6∶0.02∶0.02,配比2为2∶1∶1∶0.6∶0.02∶0.02,配比3为2∶1∶1.5∶0.6∶0.02∶0.02;配比4为1∶1∶0.6∶0.6∶0.02∶0.02;配比5为2∶1∶0.6∶0.6∶0.02∶0.02;配比6为1.5∶1∶0.6∶0.6∶0.02∶0.02。
1.4 实验方法
1.4.1 米酒发酵实验
准确称取100 g糯米,加蒸馏水浸泡过夜,将浸泡米用4层纱布过滤,沥干后放入500 mL三角瓶中,121 ℃灭菌20 min。冷却后加入150 mL无菌水、1.89 g α-淀粉酶和0.56 g糖化酶,搅拌均匀,在 60 ℃水浴中酶解30 min制成糯米发酵培养基。将活化后的FBKL2.8022和FBKL2.8023酵母培养于10 mL的麦芽汁培养基中,在30 ℃条件下静置培养过夜,通过血球计数板计数,按照1×106个/mL接种至糯米发酵培养基中进行米酒发酵,每个发酵建立2个平行。发酵温度为30 ℃,每24 h记录发酵液重量损失,当失重<0.2 g/d即认为发酵结束。将发酵液经纱布过滤后取100 mL转移至500 mL蒸馏瓶中,加入100 mL蒸馏水和5颗玻璃珠进行蒸馏并收集馏出液,当馏出液达100 mL时停止蒸馏,将馏出液保藏于4 ℃冰箱中用于后续高级醇含量的检测[20]。
1.4.2 气相色谱法检测高级醇含量
气相色谱条件:色谱柱DB-FFAP (30 m×0.25 mm,0.25 μm),进样口温度260 ℃,程序升温到45 ℃保持3 min,以16 ℃/min速率升温到120 ℃并保持3 min,再以50 ℃/min的速率升温至220 ℃并保持5 min,FID检测器的检测温度为260 ℃。氢气流速30 mL/min,空气流速300 mL/min。进样方式为分流进样,进样量1 μL,分流比为40∶1[12]。标准曲线建立:配制8个梯度浓度的正丙醇、异丁醇、异戊醇、己醇、苯乙醇和正丁醇的混合标准溶液,以各组分标样梯度浓度为横坐标,测定峰面积为纵坐标,建立标准曲线,得到6种高级醇的定量线性关系[12]。样品检测:吸取2 mL蒸馏后的米酒样品,经0.22 μm滤膜过滤后进行气相色谱分析,每个样品检测3次,用变异系数(标准偏差/平均值)评估该方法的检测精密度。
1.4.3 酶标仪比色法检测高级醇含量
1.4.3.1 酶标仪比色法检测波长和时间研究
目前已有的研究报道采用比色法检测高级醇时所用波长不尽相同,有495[11,21-22]、500[23]、520[24]和425 nm[15]等。本研究按照GB/T 5009.48—2003《蒸馏酒与配制酒卫生标准分析方法》中4.4杂醇油检测步骤建立标准曲线[14]。利用酶标仪测定了408、450、500和520 nm下1 h内的吸光度值,分析所建立标准曲线R2受检测波长和检测时间的影响。
1.4.3.2 标准曲线的构建
单一标准曲线(0~0.05 mg)的建立:分别吸取0.1 mg/mL的高级醇标准溶液0、0.10、0.20、0.30、0.40、0.50 mL置于10 mL比色管中;各比色管中加蒸馏水至1 mL,摇匀并放入冷水中冷却,沿管壁缓慢加入2 mL对二甲胺基苯甲醛-硫酸溶液,摇匀放入沸水浴中加热15 min后取出,立即放入冰浴中冷却并加入2 mL蒸馏水混匀[14]。使用酶标仪于特定波长下检测吸光度值,建立高级醇质量与吸光度值之间的标准曲线。单一标准曲线(0~1 mg)的建立:分别吸取质量浓度为1 mg/mL的高级醇标准溶液0、0.02、0.05、0.2、0.5、0.75、1 mL置于10 mL比色管中,后续步骤与上述一致。混合标准曲线(0~0.05 mg)的建立操作步骤与同质量范围内单一标准曲线的操作步骤一致,区别在于吸取的高级醇标准溶液组成不同。根据2.2中气相色谱法对浊米酒中高级醇含量的检测结果,设置了6种配比关系(如1.2中所述),建立每一种配比条件下的标准曲线,为酶标仪比色法检测米酒中高级醇含量提供线性依据。在标准曲线构建的线性方程中,拟合度R2是反应变量之间相关系数密切程度的指标,通常认为拟合度>0.99时所构建的线性方程线性较好。
1.4.3.3 样品检测
吸取1.0 mL蒸馏后的米酒样品加蒸馏水定容至10 mL,混匀后吸取0.30 mL置于10 mL比色管中,后续操作与2.2中标准曲线构建时所用步骤一致。米酒样品中杂醇油的含量按公式(1)计算:
(1)
式中:X,试样中杂醇油质量浓度,g/100mL;m,测定试样稀释液中杂醇油的质量,mg;V2,试样体积,mL;V1,测定用试样稀释体积,mL;
2 结果与分析
2.1 气相色谱法检测浊米酒中高级醇含量
采用气相色谱外标法建立的标准曲线除苯乙醇的R2为0.99以上外,其他高级醇的R2均达到0.999以上,线性可靠(表1)。定量检测FBKL2.8022发酵的米酒样品中6种高级醇质量浓度为277.75 mg/L(表2),其中,异戊醇、苯乙醇、异丁醇和正丙醇为发酵米酒中主要的4种高级醇,异戊醇、苯乙醇、异丁醇、正丙醇、己醇、丁醇之间的比例接近配比2。定量检测FBKL2.8023发酵的米酒样品中6种高级醇质量浓度为169.66 mg/L(表2),异戊醇、苯乙醇、异丁醇和正丙醇为发酵米酒中主要的4种高级醇,异戊醇、苯乙醇、异丁醇、正丙醇、己醇、丁醇之间的比例接近配比4或配比6。除FBKL2.8023发酵米酒样品中的苯乙醇外,检测其他高级醇的变异系数均<10%,说明该方法精密度较高,重现性较好[24]。
表1 高级醇标准曲线(气相色谱法)
Table 1 Standard curves of higher alcohols established by gas chromatography method
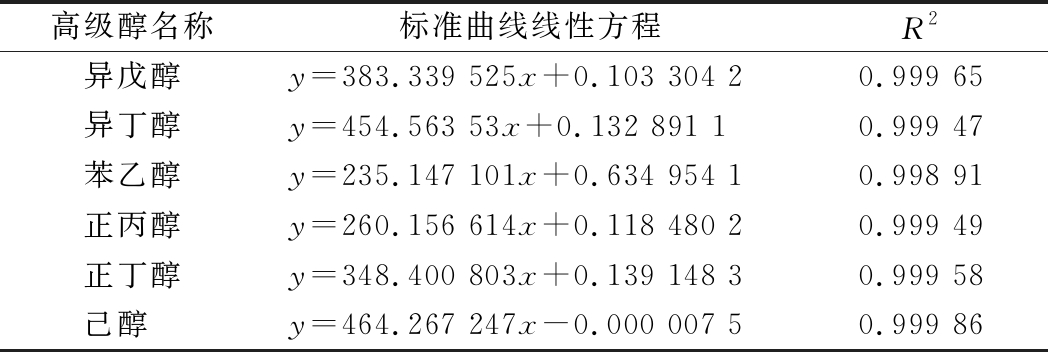
高级醇名称标准曲线线性方程R2异戊醇y=383.339 525x+0.103 304 20.999 65异丁醇y=454.563 53x+0.132 891 10.999 47苯乙醇y=235.147 101x+0.634 954 10.998 91正丙醇y=260.156 614x+0.118 480 20.999 49正丁醇y=348.400 803x+0.139 148 30.999 58己醇 y=464.267 247x-0.000 007 50.999 86
表2 浊米酒中高级醇含量(气相色谱法)
Table 2 Higher alcohols content in turbid rice wine detected by gas chromatography method

高级醇FBKL2.8 022-1/FBKL2.8 022-2FBKL2.8 023-1/FBKL2.8 023-2平均值/(mg·L-1)标准偏差/%变异系数/%平均值/(mg·L-1)标准偏差/%变异系数/%异戊醇121.73/119.410.18/0.271.50/2.2350.98/71.070.05/0.141.07/2.00苯乙醇53.41/54.120.15/0.072.87/1.3646.60/51.280.99/0.5421.21/10.56异丁醇68.81/64.380.15/0.142.16/2.1124.06/30.220.02/0.050.65/1.75丙醇33.53/36.450.04/0.101.07/2.8223.10/37.490.01/0.030.43/0.82己醇0.95/0.930.01/0.006.90/4.310.90/0.910.00/0.004.12/4.73丁醇0.80/0.970.00/0.013.46/7.271.17/1.550.00/0.011.27/8.046种高级醇总含量279.24/276.260.52/0.581.88/2.08146.81/192.520.93/0.776.31/4.02
2.2 酶标仪比色法检测浊米酒中高级醇含量
2.2.1 检测波长和时间确定
如图1-a所示,4种检测波长下1 h内所建立标准曲线的R2受检测时间的影响较小,受检测波长影响较大,其中520 nm时绘制的1 h内标准曲线的R2均>0.99,明显高于其他检测波长获得的R2,因此本研究选定520 nm为酶标仪比色法检测高级醇含量的检测波长。如图1-b所示,在520 nm处,吸光度受检测时间的影响较小,0~15 min内吸光度轻微下降,15 min之后趋于稳定,因此本研究选定15 min为酶标仪比色法检测高级醇含量的检测时间。
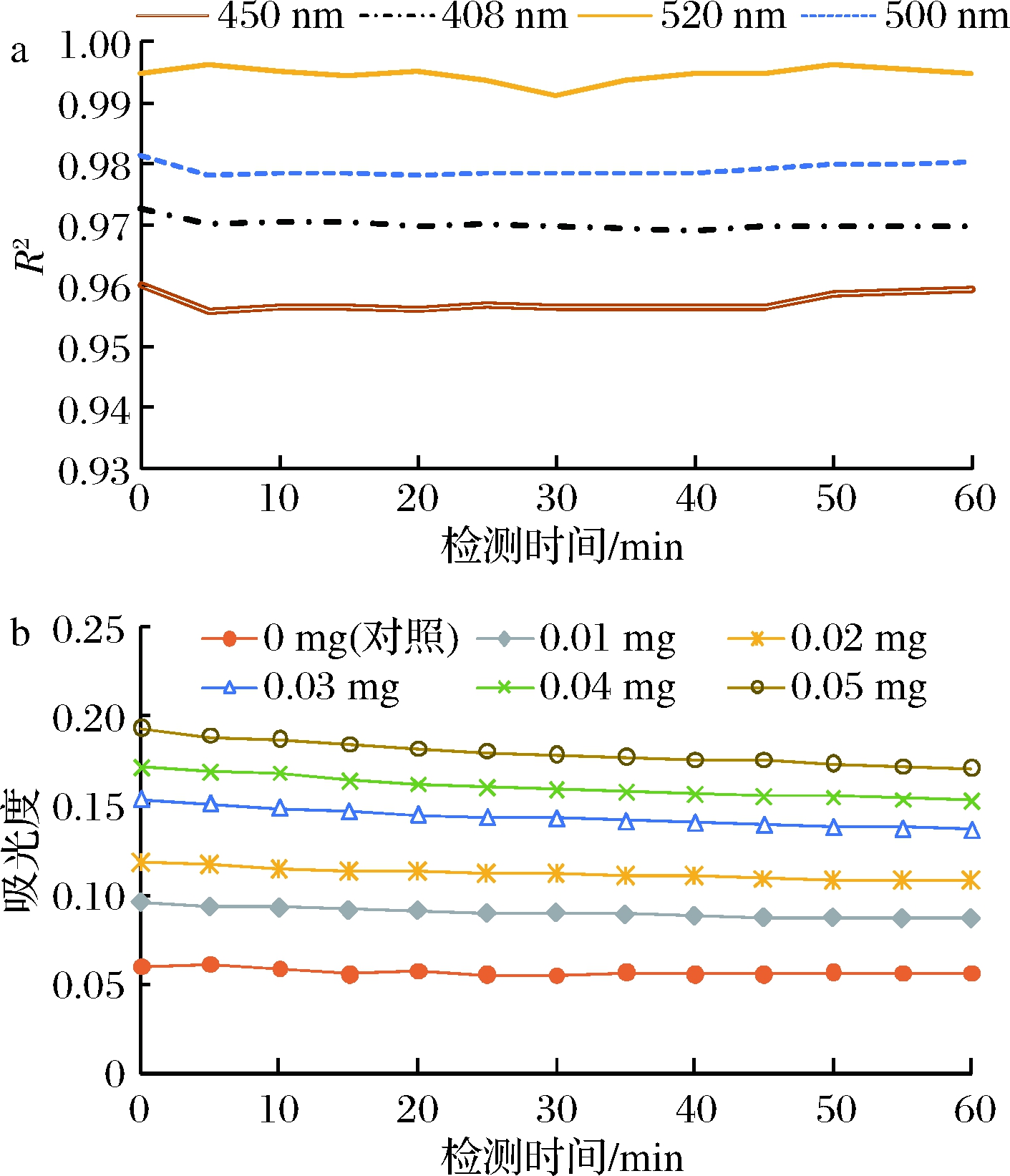
a-不同波长和时间获取的R2值变化曲线;b-520 nm检测
吸光度随检测时间变化曲线
图1 酶标仪比色法检测波长及时间的确定
Fig.1 The determination of measurement wavelength and time in the colorimetric method of microplate reader
2.2.2 高级醇标准曲线的建立
在0~0.05 mg的低质量范围内(表3,图2-a),异丁醇、异戊醇、己醇的线性较好,线性拟合度均>0.99;苯乙醇、正丁醇线性较差,但在此范围内其吸光度呈现上升趋势,即测定酒体中高级醇总含量时,苯乙醇和正丁醇的存在可能会影响其他高级醇含量的最终测定;正丙醇标准曲线几乎完全重合于X轴,与空白对照数据相差不大,即在此质量范围内正丙醇的存在可能不会影响到其他高级醇含量的测定。但在0~1 mg的高质量范围内(表3,图2-b),正丙醇和苯乙醇拟合度明显提高,异丁醇、异戊醇和苯乙醇的线性拟合度均达到0.99以上。通过对比发现(表3),单一高级醇在不同质量范围内呈现的标准曲线线性方程斜率差异较大,因此建立标曲前需根据具体样品中高级醇的浓度范围建立对应质量范围的标准曲线,样品中高级醇的浓度范围可通过气相色谱外标法或酶标仪比色法来确定。
为进一步分析正丙醇对浊米酒中主要高级醇含量检测的影响,本研究分别建立了正丙醇与异丁醇或异戊醇在1∶1的配比条件下0~0.05 mg的标准曲线(表3,图2-c)。结果表明正丙醇与异丁醇1∶1的混合标曲线性较好(R2=0.995 4),而正丙醇与异戊醇1∶1的混合标曲线性较差(R2=0.862 1),此外,2组混合标曲的线性方程的斜率均明显不同于异丁醇和异戊醇在相同质量范围内的单一标准曲线。因此,单一正丙醇在0~0.05 mg虽然没有呈现明显吸光度值,但与异丁醇或异戊醇1∶1混合后会影响对2种高级醇质量的检测。
采用分光光度法测定酒体中高级醇通常是以异丁醇和异戊醇体积之和表示,V(异丁醇)∶V(异戊醇)=1∶4[18]、V(异丁醇)∶V(异戊醇)=2∶5[23]等,因此,本研究建立了异丁醇与异戊醇在4种不同配比下的标准曲线(表3,图2-c)。结果发现异丁醇和异戊醇配比为1∶1和2∶1时所建标准曲线斜率接近于异丁醇在同质量范围内的单一标曲,而当异丁醇和异戊醇配比为1∶2和1∶4时所建标准曲线斜率接近于异戊醇在同质量范围内的单一标曲,并且线性拟合度随异丁醇占比的增加而提高,随异戊醇占比的增加而下降。因此,建立混合标曲前需根据具体样品中不同高级醇的浓度范围建立对应配比的标准曲线,样品中不同高级醇的质量浓度范围可通过气相色谱外标法或酶标仪比色法来确定。
根据气相色谱法对FBKL2.8022和FBKL2.8023发酵浊米酒中高级醇含量的检测结果,本研究共建立了6条不同高级醇配比的混合标准曲线(表3,图2-d),每一条标准曲线拟合度均达到0.99以上,其中配比2达到0.999以上,说明线性关系较好。平均值标准曲线(表3,图2-d)根据配比1到配比6的平均吸光度值建立,其斜率接近配比1和配比5。此外,FBKL2.8022发酵浊米酒中6种高级醇的比例接近于本研究设定的标曲2,而FBKL2.8023发酵浊米酒中6种高级醇的比例接近于本研究设定的标曲4和标曲6。6条不同高级醇配比的混合标准曲线斜率的差异进一步说明了所需检测样品中不同高级醇含量配比对酶标仪比色法检测结果的影响,因此,需要根据预实验检测样品中不同高级醇的质量浓度范围来选择准确的混合标曲进行样品检测分析。
2.2.3 浊米酒中高级醇含量检测
本研究采用酶标仪比色法根据3.2.1建立的检测条件分析FBKL2.8022和FBKL2.8023发酵浊米酒中高级醇的含量,检测到FBKL2.8022吸光度为0.042 233 667,FBKL2.8023吸光度为0.018 592 8,标准偏差均<0.001 5,变异系数均<3.1%,说明酶标仪比色法检测精密度高,重现性好。根据6条不同配比标准曲线和平均值标准曲线计算所得发酵浊米酒中高级醇总量如表4所示,本研究采用配比接近样品的混合标曲进行6种高级醇含量的计算,因此配比2标准曲线用于计算FBKL2.8022发酵浊米酒,各组分高级醇标准偏差在0.06%~3.94%,而配比4用于计算FBKL2.8023发酵浊米酒,各组分高级醇标准偏差在0.72%~1.58%。酶标仪比色法和气相色谱法检测同一米酒样品时,酶标仪比色法对各组分高级醇的检测结果略高于气相色谱法(图3),采用软件SPSS 21.0中单因素方差分析进行2种检测方法的差异显著性统计时发现,样品为FBKL2.8022发酵浊米酒时单一高级醇和高级醇总量的P值均<0.05,说明差异显著,而样品为FBKL2.8023发酵浊米酒时单一高级醇和高级醇总量的P值均>0.05,说明差异不显著,由表4可知导致FBKL2.8023发酵浊米酒检测方法差异不显著的主要原因可能是发酵平行样品的酶标仪比色法的标准偏差较大。

a-6种高级醇0~0.05 mg单一标准曲线;b-4种高级醇0~0.1 mg单一标准曲线;c-2种高级醇不同配比0~0.05 mg
混合标准曲线;d-6种高级醇不同配比0~0.05 mg混合标准曲线
图2 酶标仪比色法建立的单一和混合高级醇标准曲线图
Fig.2 Standard curves of single and mixed higher alcohols established by the colorimetric method of microplate reader
表3 高级醇标准曲线(酶标仪比色法)
Table 3 Standard curves of higher alcohols established by colorimetric method of microplate reader

高级醇线性方程R2异丁醇(0~0.05 mg)y=5.158 9x-0.004 80.997 7异戊醇(0~0.05 mg)y=4.532 4x+0.006 40.996 2正丙醇(0~0.05 mg)y=0.018 7x-9E-050.206 3苯乙醇(0~0.05 mg)y=0.295 1x+0.001 60.924 0正丁醇(0~0.05 mg)y=0.506 2x+0.005 10.866 4己醇(0~0.05 mg)y=2.337 4x-0.000 50.995 4异丁醇(0~1 mg)y=3.848 9x-0.028 20.998 3异戊醇(0~1 mg)y=2.257x-0.029 40.994 3正丙醇(0~1 mg)y=0.142 7x-0.009 20.915 5苯乙醇(0~1 mg)y=0.076 5x+0.002 60.997 2V(正丙醇)∶V(异丁醇)(1∶1,0~0.05 mg)y=2.337 4x-0.000 50.995 4V(正丙醇)∶V(异戊醇)(1∶1, 0~0.05 mg)y=1.296 9x+0.008 30.862 1V(异丁醇)∶V(异戊醇)(1∶1,0~0.05 mg)y=5.087 5x+0.0030.997 6V(异丁醇)∶V(异戊醇)(1∶4,0~0.05 mg)y=4.367 3x+0.0130.972 9V(异丁醇)∶V(异戊醇)(2∶1,0~0.05 mg)y=5.128 7x+0.002 10.999 0V(异丁醇)∶V(异戊醇)(1∶2,0~0.05 mg)y=4.710 4x+0.008 10.994 2配比1y=2.913 9x+0.002 20.991 4配比2y=3.483 3x-0.000 50.999 4配比3y=3.59x-0.0030.998 5配比4y=2.568 8x+0.000 80.991 2配比5y=2.885 9x+0.002 90.995 6配比6y=2.175 6x-0.000 50.997 06种高级醇混合配比平均值y=2.933x+0.000 40.998 3
表4 浊米酒中高级醇含量(酶标仪比色法)
Table 4 Higher alcohols content in turbid rice wine detected by the colorimetric method of microplate reader
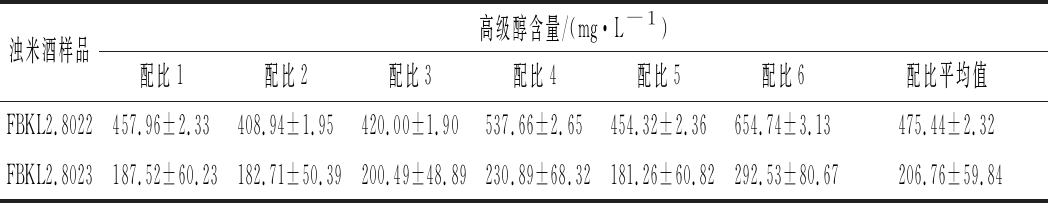
浊米酒样品高级醇含量/(mg·L-1)配比1配比2配比3配比4配比5配比6配比平均值FBKL2.8022457.96±2.33408.94±1.95420.00±1.90537.66±2.65454.32±2.36654.74±3.13475.44±2.32FBKL2.8023187.52±60.23182.71±50.39200.49±48.89230.89±68.32181.26±60.82292.53±80.67206.76±59.84
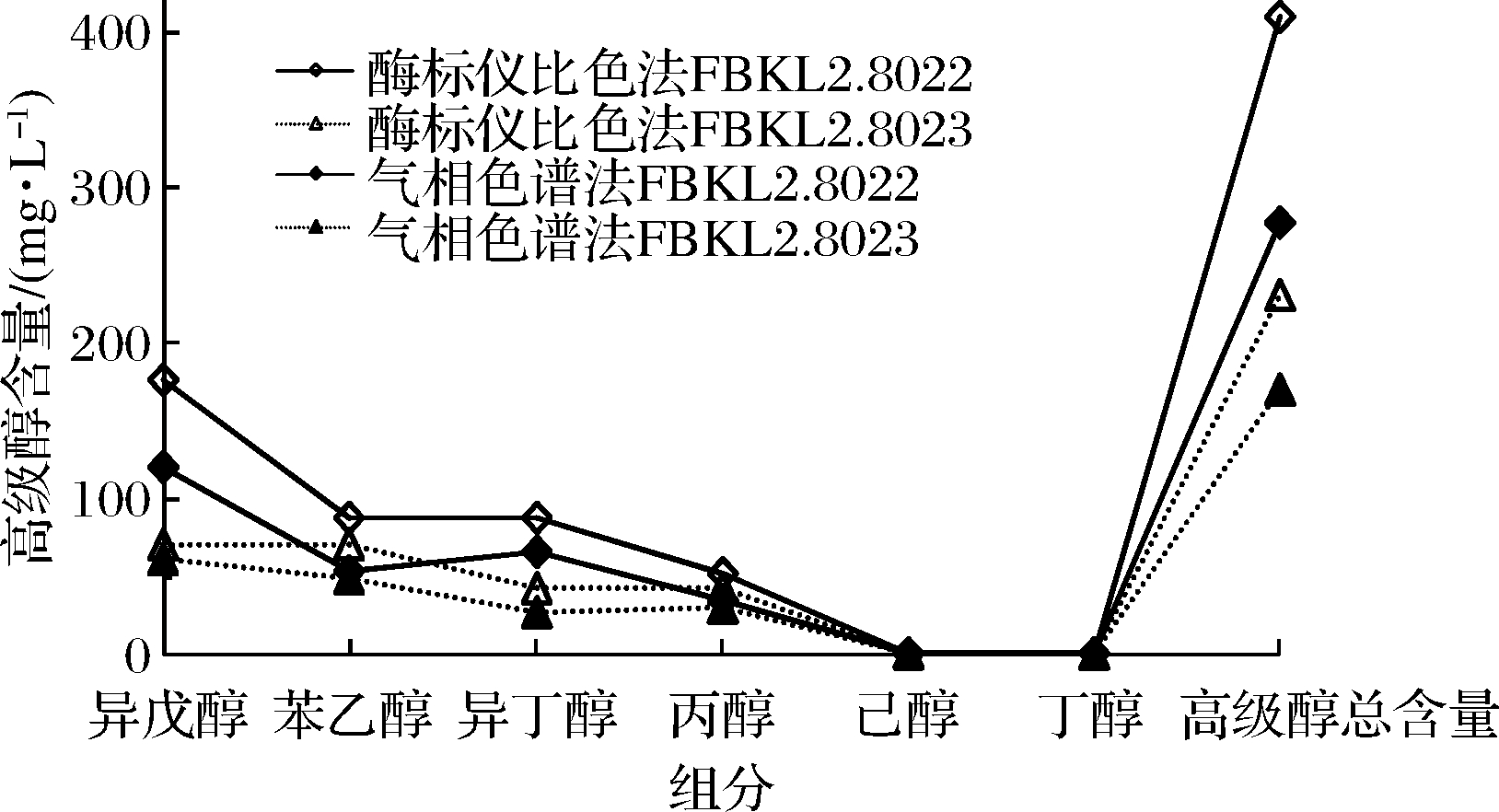
图3 酶标仪比色法和气相色谱法对浊米酒中高级醇
含量检测对比
Fig.3 Comparison of the higher alcohols content in turbid rice wine examined by the colorimetric method of microplate reader and gas chromatography
3 结论与展望
采用酶标仪比色法测定浊米酒中高级醇含量的最佳检测条件为520 nm、15 min,此条件下建立的混合标准曲线线性关系良好,而在单一标曲中正丙醇、苯乙醇、正丁醇标准曲线线性稍差,但拟合度会随质量范围增加而得到改善。通过配比2和配比4对应混合标曲所检测的浊米酒中高级醇质量浓度高于气相色谱法的检测结果,这可能与酒样中除异丁醇、异戊醇、苯乙醇、正丙醇、正丁醇、己醇外还存在其他高级醇而引起显色效果加深有关,这一推论还需进一步的检测来证实。
分光光度法测高级醇通常以V(异丁醇)∶V(异戊醇)=1∶4 来表示[14],但在实际情况中,由于酒体中不仅只含有异丁醇和异戊醇,其他高级醇的存在也会影响检测吸光度值,因此此法不能准确分析浊米酒中高级醇总含量。针对不同浊米酒样品,可以通过气相色谱法摸索样品中主要高级醇的比例,建立该比例下酶标仪比色法检测的混合标准曲线,以此检测高级醇含量。根据本研究结果,酶标仪比色法检测结果受不同高级醇含量的影响较大,且无法直接检测浊米酒中单一高级醇含量。进一步的研究需要解决酶标仪比色法对不同高级醇的定性分析,这对于采用酶标仪比色法快速检测浊米酒品质具有重要意义。
[1] WEI X L,LIU S P,YU J S,et al.Innovation Chinese rice wine brewing technology by bi-acidification to exclude rice soaking process[J].Journal of Bioscience & Bioengineering,2016,123(4):460-465.
[2] WANG Q J,SUN D W,JEONG S,et al.Screening of rice cultivars for brewing high quality turbid rice wine[J].LWT-Food Science and Technology,2014,56:145-152.
[3] LEE J,LEE Y,HA J,et al.Simultaneous determination of four bioactive compounds in Korean rice wine (makgeolli) by solvent extraction coupled with gas chromatography-mass spectrometry[J].International Journal of Food Properties,2018,21(1):139-146.
[4] 王春晓,唐佳代,吴鑫颖, 等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
WANG C X,TANG J D,WU X Y,et al.Progress in research of functional microbes in xiaoqu,a Chinese traditional fermentation starter for liquor and rice wine[J].Food Science,2019,40(17):309-316.
[5] 黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-87.
HUANG G D,XU S S, LIU H,et al.Selected inorganic nitrogen in reducing the contents of higher alcohols from Chinese rice wine[J].Food Science and Biotechnology,2018,37(1):82-87.
[6] 董洋,刘亚琼,刘姗姗.杂粮红曲酒高级醇及其挥发性风味物质研究[J].酿酒科技,2017(3):55-59.
DONG Y,LIU Y Q,LIU S S.Higher alcohols and volatile flavoring substances in monascus yellow rice wine produced by miscellaneous grains[J].Liquor-Making Science & Technology,2017(3):55-59.
[7] CHEN S,XU Y,QIAN M C.Aroma characterization of chinese rice wine by gas chromatography-olfactometry, chemical quantitative analysis, and aroma reconstitution[J].Journal of Agricultural and Food Chemistry, 2013,61(47):11 295-11 302.
[8] WANG P X,MAO J,MENG X Y,et al.Changes in flavour characteristics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J].Food Control,2014, 44:58-63.
[9] 苟静瑜,贾智勇,闫宗科, 等.降低白酒中高级醇含量的研究进展[J].酿酒,2016,3(4):25-29.
GOU J Y,JIA Z Y,YAN Z K,etal.Research progress in decreasing the contents of higher alcohols in baijiu(liguor)[J].Liquor Making,2016,3(4):25-29.
[10] 黄桂东, 吴子蓥, 唐素婷, 等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造, 2018,37(1):7-11.
HUANG G D,WU Z Y,TANG S T,et al.Research progress on control and detection of higher alcohols contents from Chinese rice wine[J].China Brewing,2018,37(1):7-11.
[11] 王珍,周洋,李春丽,等.浅谈白酒中杂醇油的分析方法[J].酿酒科技,2017(6):77-79.
WANG Z,ZHOU Y, LI C L,etal.Analytic methods of fusel oil in baijiu[J].Liquor-Making Science & Technology,2017(6):77-79.
[12] 唐开永,周鸿翔,刘彩婷,等.米酒中6种醇的气相色谱外标法测定研究[J].中国酿造, 2019,38(4):183-187.
TANG K Y,ZHOU H X,LlU C T,etal.Determination of 6 alcohols in rice wine by GC external standard method[J].China Brewing,2019,38(4):183-187.
[13] 汤二将.高级醇毒性效应及其定量构效关系研究[D].福建师范大学,2013.
TANG E J.Higher alcohols toxicity effect and quanti-tative structure activity relationship study[D].Fujian Normal University, 2013.
[14] 卫生部. GB/T 5009.48—2003 蒸馏酒与配制酒卫生标准的分析方法[S].北京:中国标准出版社,2003.
Ministry of health. GB/T 5009.48—2003 Analysis method of hygienic standard for distilled liquor and mixed liquor[S].Beijing:China Standard Press,2003
[15] 国家质量监督检验检疫总局. GB/T 394.2—2008 酒精通用分析方法[S].北京:中国标准出版社,2008.
General administration of quality supervision, inspection and quarantine of the people′s Republic of China. GB/T 394.2—2008 General analysis method of alcohol[S].北京:中国标准出版社,2003.
[16] 梁慧,薛正莲,周扬,等.酶标仪法测定γ-氨基丁酸[J].食品与发酵工业,2014,40(7):156-160.
LIANG H,XUE Z L, ZHOU Y,etal.Optimization of the determination of γ-aminobutyric acid by microplate reader[J].Food and fermentation industries,2014,40(7):156-160.
[17] 冉旭东,吴远根.百草枯核酸适配体的筛选及其比色检测研究[J].分析化学,2019,47(4):567-575.
RAN X D,WU Y G.Screening aptamers and development of colorimetric detection method of paraquat pesticide[J].Chinese Journal of Analytical Chemistry,2019,47(4):567-575.
[18] 石彬,李咏富,吴远根.氯化血红素比色法检测乳制品中土霉素[J].中国酿造,2018,37(7):168-172.
SHI B,LI Y F,WU Y G.Determination of oxytetracycline in dairy products by hemin colorimetry[J].China Brewing,2018,37(7):168-172.
[19] 石耀强,张晗依,刘双月.酶标仪检测技术应用的研究进展[J].科技展望,2016,26(24):73;107.
SHI Y Q,ZHANG H Y,LIU S Y.Research progress in the application of microplate reader testing technology[J].Science and Technology,2016,26(24):73;107.
[20] WANG C X,TANG J D,QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Frontiers in Microbiology,2020,11:2 103.
[21] 范衍琼.分光光度法测定蒸馏酒及配制酒中杂醇油[J].光谱实验室,2005(2):304-306.
FAN Y Q.Determination of fusel oil in distilled wines and mixed wines by spectrophotometry[J].Guangpu Shiyanshi,2005(2):304-306.
[22] 穆文斌,刘国英,郭增,等.杂醇油测定误差原因和改进措施[J].酿酒科技,2004(2):87-88.
MU W B,LlU G Y,GUO Z,et al.Causations for the errors in the determination of fusel oiland the relative improvement measures[J].Liquor-Making Science & Technology,2004(2):87-88.
[23] 汪勇,王海龙.比色法测定啤酒中高级醇含量[J].啤酒科技,2008(8):48-49.
WANG Y,WANG H L.Determination of higher alcohols in beer by colorimetry[J].Beer Technology,2008(8):48-49.
[24] 杜威,林玲,张兴亚,等.分光光度法测定黄酒中的高级醇[J].酿酒科技,2011(7):105-107.
DU W,LIN L,ZHANG X Y,etal.Determination of higher alcohols content in yellow rice wine by spectrophotometry[J].Liquor-Making Science & Technology,2011(7):105-107.