略阳乌鸡又叫黑河乌鸡,是陕西汉中地区略阳县的一个独立乌鸡品种。在全国四大乌鸡中,略阳乌鸡体形最大、鸡肉细嫩、味醇香、营养丰富,乌皮、乌腿、乌趾、乌喙、乌舌、乌冠的“六端乌”特征,是在当地独特的地理环境条件下经人们长期驯化和半野生放养形成的一种古老的优良地方肉用型鸡种[1-2]。
早期研究发现,生肉中前体物质综合呈现出既咸又腥的滋味,当给予加热、烘烤等一定的条件时,这些物质会产生复杂的化学反应,反应达到平衡时生成新的呈味物质,赋予肉香味,也就是风味[3-5]。近年来,国内外学者对于如何提高畜禽肉质风味做了大量的实验研究,在众多禽畜肉质风味的评价指标中,肌苷酸是研究者们公认的禽畜肉质鲜味最重要的表达及检测物质[6-10]。
纸电泳法、紫外吸收相结合法、薄层层析法是早期研究者们测定肌苷酸所使用的主要方法[11-13]。目前,具有高效、快速、准确的高效液相色谱法已广泛用于肌苷酸的检测分析[14-16]。本实验选用高效液相色谱法测定略阳乌鸡肌肉肌苷酸含量,选取4种样品前处理方法,探索肌肉中肌苷酸的提取效率。通过实验得到最佳的高效液相色谱条件,建立了略阳乌鸡肌肉肌苷酸准确度与灵敏性高的检测方法,为其方法学的研究奠定了基础。
1 材料与方法
1.1 材料与试剂
略阳乌鸡,陕西百味园网络科技有限公司;三乙胺(色谱纯),麦克林公司;甲醇(色谱纯),Merck公司;H3PO4(色谱纯)、KH2PO4、四丁基硫酸氢铵,天津市天力化学试剂有限公司;肌苷酸标品(纯度≥99.9%),北京中科仪友化工技术研究院。
1.2 仪器与设备
UltiMate3000高效液相色谱仪,戴安公司;AP-OIP真空泵,天津奥特赛恩斯仪器有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;SB-100DT超声波清洗机,宁波新芝生物科技股份有限公司;TDL-80-2B低速台式离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 样品前处理
取新鲜屠宰的略阳乌鸡腿部肌肉样100 g,用剪刀剪碎,每次取样均为5 g,平行3组。
鲜肉样品:取样后加入10 mL 0.05 mol/L磷酸三乙胺(0.05 mol/L磷酸三乙胺:精确量取7 mL H3PO4,加入200 mL超纯水和14.4 mL三乙胺,摇匀后加入超纯水定容至1 000 mL,用三乙胺调pH=6.5,0.45 μm水系膜过滤,超声脱气30 min),打磨至匀浆状,以3 500 r/min转速离心10 min,提取上清液,重复3次,用0.05 mol/L磷酸三乙胺定容至50 mL 容量瓶中,超声提取30 min,待测。
鲜肉去脂样:取样匀浆后,振荡摇匀,用55 ℃恒温水浴1 h,静置30 min,滤掉上清液,收集肉糜,重复3次;离心提取上清液,重复3次,定容至50 mL容量瓶中超声提取30 min,待测。
冷冻干燥样:取样置于干净的培养皿中,放于冷冻干燥机中48 h,取出后按制鲜肉方法制样。
冷冻干燥去脂样:取样冷冻干燥后加入等体积的石油醚去脂制样。
1.3.2 色谱条件
1.3.2.1 色谱柱的选择
甲醇-磷酸三乙胺(体积比4∶96);检测波长248 nm;柱温25 ℃;进样量20 μL;流速1 mL/min。进样244 μg/mL的标准品溶液,分别考察COSMOSIL Packed Column C18(4.6 mm×250 mm, 5 μm);AcclaimTM 120 C18(4.6 mm×250 mm, 5 μm)色谱柱对分离效果的影响。
1.3.2.2 检测波长的选择
选定色谱条件为:色谱柱COSMOSIL Packed Column C18(4.6 mm×250 mm,Φ5 μm);流动相:甲醇-磷酸三乙胺(体积比4∶96);柱温25 ℃;进样量20 μL;流速1 mL/min。进样244 μg/mL的标准品溶液,分别考察248、254、270 nm波长条件下的检测结果。
1.3.2.3 流动相的选择
选定色谱条件为:色谱柱COSMOSIL Packed Column C18(4.6 mm×250 mm, 5 μm);检测波长248 nm;柱温25 ℃;进样量20 μL;流速1 mL/min。进样244 μg/mL的标准品溶液,分别考察甲醇-磷酸三乙胺(体积比4∶96)、甲醇-磷酸三乙胺(体积比5∶95)、甲醇-磷酸三乙胺(体积比3∶97)和磷酸盐缓冲液(准确称取1.360 g磷酸二氢钾和0.475 3 g四丁基硫酸氢铵,加900 mL超纯水,调pH=3.33,定容至1 000 mL,0.45 μm水系膜过滤,超声脱气30 min)-甲醇(体积比4∶96)的流动相体系。
1.3.3 方法学考察
1.3.3.1 线性考察
准确称取肌苷酸标准品6.10 mg,用流动相定容到25 mL容量瓶中,浓度为244 μg/mL。
标准工作液:分别在母液中吸取0.5、1、2、3、4 mL 溶液,用流动相定容至10 mL,浓度分别为12.2、24.4、48.8、73.2、97.6 μg/mL,配成肌苷酸系列标准工作液。
将上述系列标准工作液在选定的色谱条件下进样测定,以峰面积为纵坐标,浓度为横坐标,在Excel中绘制标准曲线图。
1.3.3.2 精密度考察
以24.4、97.6、244 μg/mL的标准品溶液为低中高3个测定浓度,在选定的色谱条件下分别连续进样6针,测定肌苷酸标准品的精密度。
1.3.3.3 重现性考察
取同一样品6份,每份5 g,按1.3.1的方法制备样品溶液,在选定的色谱条件下进样测定,计算含量,确定重复性。
1.3.3.4 稳定性考察
取同一份样品溶液,室温下放置1、2、4、8、12、24、48 h,在选定的色谱条件下进样测定,计算含量,叠加信号值确定相对标准偏差(relative standard deviation,RSD)值,进而确定稳定性。
1.3.3.5 检出限和定量限
将质量浓度为244 μg/mL的标准品依次稀释,在选定的色谱条件下进样测定,以S/N的10倍和3倍确定其检出限和定量限。
1.3.3.6 加标回收率考察
称取5 g肌肉样品3份,分别加入质量浓度为12.2 μg/mL的肌苷酸标准品溶液1 mL,按1.3.1的方法制备样品溶液,稀释到标准曲线的浓度范围内,在选定的色谱条件下进样测定,根据加标前后样品中肌苷酸浓度和加标量,回收率计算如公式(1)所示:
(1)
式中:A,加标试样测定值;B,试样测定值;C,加标量。
1.3.4 四种前处理样品肌苷酸含量的测定
样品肌苷酸含量的计算如公式(2)所示:
(2)
式中:m,样品的肌苷酸含量,g/kg;X,与标曲相对应的样品肌苷酸的浓度,μg/mL;V,样品液的总体积,mL;Y,所称取样品的质量,g。
2 结果与分析
2.1 色谱条件的确定
2.1.1 色谱柱的选择
由图1可以看出,COSMOSIL Packed Column C18色谱柱的分离效果最佳。因此本次实验选取COSMOSIL Packed Column C18色谱柱进行测定分析。
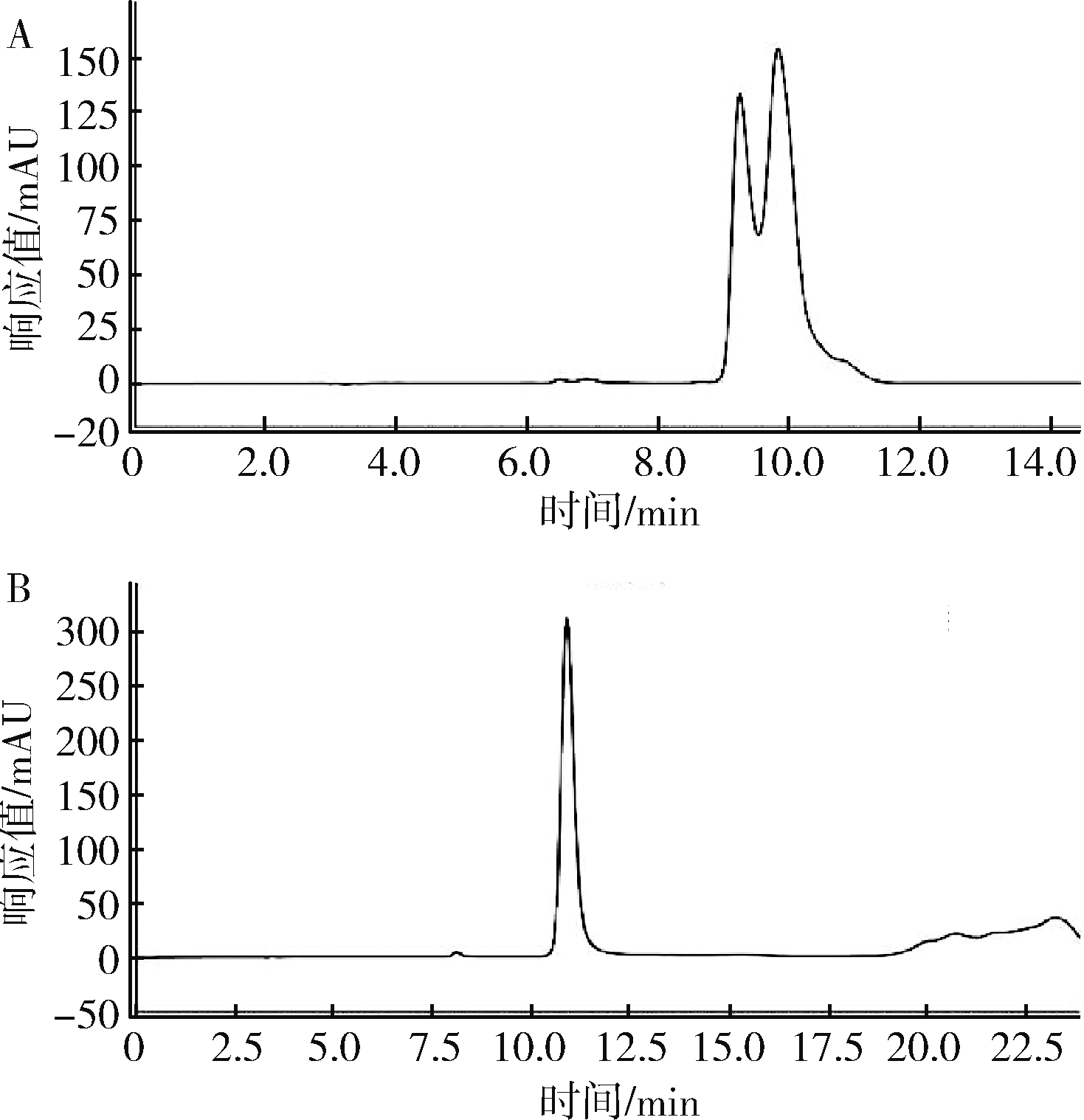
A-AcclaimTM120 C18柱子;B-COSMOSIL Packed Column C18柱子
图1 不同色谱柱下肌苷酸色谱图
Fig.1 Chromatograms of inosinic acid under different chromatographic columns
2.1.2 检测波长的选择
由表1可知,3个波长条件下保留时间相同,在248 nm下的峰面积大,响应值高,定量检测会越准确,因此本次实验选取248 nm进行测定。
表1 不同波长条件下的检测结果
Table 1 Detection results under different wavelength conditions

波长/nm峰面积/(mAU·min-1)响应值/mAU2481 273 9533082541 194 299284270545 516126
2.1.3 流动相的选择
甲醇-磷酸三乙胺和甲醇-磷酸盐缓冲液两种流动相,以相同的体积比(4∶96)和色谱条件进样后,得到的色谱图(图2)。由图2可知,A图峰形和检测效果较差,可见肌苷酸在磷酸盐缓冲液-甲醇体系中稳定性较差。
选择甲醇-磷酸三乙胺流动相之后,对其体积比进行考察。由表2可知,在甲醇-磷酸三乙胺体积比为4∶96条件下主要的定量指标峰面积最大,适合检测分析。因此最终选择甲醇-磷酸三乙胺(体积比4∶96)为流动相进行本次实验。

A-磷酸盐缓冲液-甲醇;B-甲醇-磷酸三乙胺
图2 不同流动相下肌苷酸色谱图
Fig.2 Chromatogram of inosinic acid in different mobile phases
表2 不同流动相条件下的检测结果
Table 2 Test results of different mobile phase conditions

V(甲醇)∶V(磷酸三乙胺)峰面积/(mAU·min-1)响应值/mAU5∶951 181 8523314∶961 273 9533083∶971 190 109238
2.1.4 色谱条件的确定
根据以上数据结果分析,本次实验最佳的色谱条件为:色谱柱COSMOSIL Packed Column C18(4.6 mm×250 mm,5 μm);甲醇-磷酸三乙胺(体积比4∶96);检测波长:248 nm;柱温25 ℃;进样量20 μL;流速1 mL/min。样品梯度洗脱如表3所示。
表3 样品梯度洗脱结果
Table 3 Gradient elution results of samples

时间/min甲醇体积分数/%磷酸三乙胺体积分数/%曲线049651549652050505254961
2.2 方法学考察结果
2.2.1 线性考察
在2.1.4的色谱条件下以峰面积为纵坐标,浓度为横坐标绘制的标准曲线图,肌苷酸标准曲线方程为y=7 152x-1 330,R2=0.999 9,线性范围12.2~97.6 μg/mL,肌苷酸在该范围线性良好。
2.2.2 精密度考察
如表4所示,是在肌苷酸浓度分别为24.4、97.6、244 μg/mL连续进样6针的结果,3个浓度下的RSD<5%,精密度良好,均满足试验方法的测定要求,且中浓度的RSD值最小,准确性最高。
表4 不同肌苷酸浓度精密度比较(n=6)
Table 4 Comparison of precision of different inosinic acid concentrations(n=6)
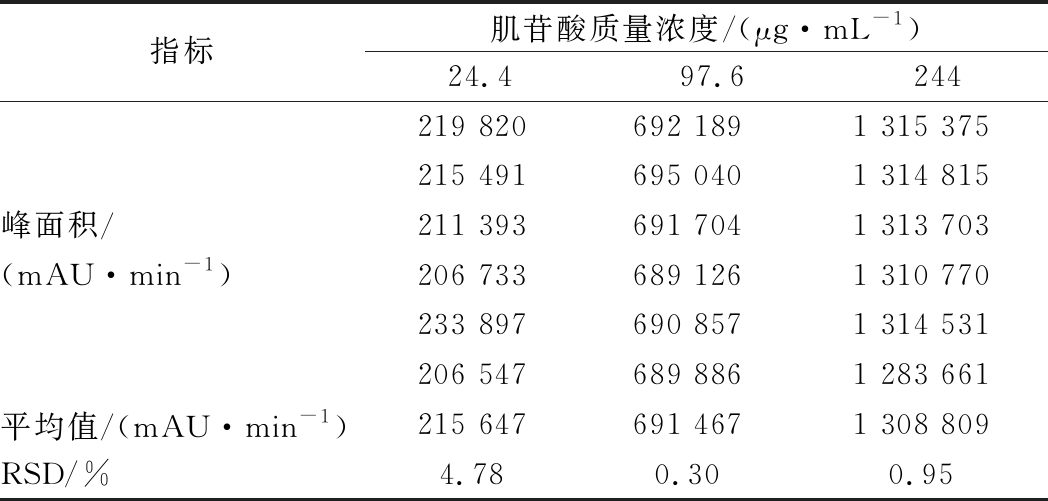
指标肌苷酸质量浓度/(μg·mL-1) 24.497.6244峰面积/(mAU·min-1)219 820692 1891 315 375215 491695 0401 314 815211 393691 7041 313 703206 733689 1261 310 770233 897690 8571 314 531206 547689 8861 283 661平均值/(mAU·min-1)215 647691 4671 308 809RSD/%4.780.300.95
2.2.3 重现性考察
如表5所示,通过叠加峰信号值得到峰面积RSD,依次通过1.3.6中公式计算样品中肌苷酸的含量,得出RSD为8.58%,说明该实验方法在鲜肉去脂样的测定中具有良好的重现性。
表5 重现性考察结果
Table 5 Results of reproducibility investigation
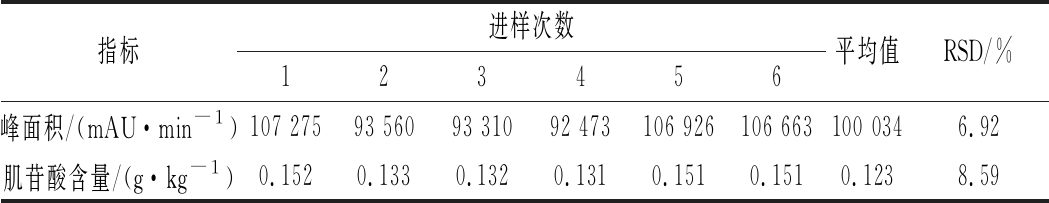
指标进样次数123456平均值RSD/%峰面积/(mAU·min-1)107 27593 56093 31092 473106 926106 663100 0346.92肌苷酸含量/(g·kg-1)0.1520.1330.1320.1310.1510.1510.1238.59
2.2.4 稳定性考察
同一份肌肉样品在常温下放置7个时间段,分别测定其肌苷酸含量,结果如表6所示,在12 h内的RSD为3.09%,因此所制得的样品应在12 h内完成测定,以保证试验的准确度。
表6 稳定性考察结果
Table 6 Results of stability investigation
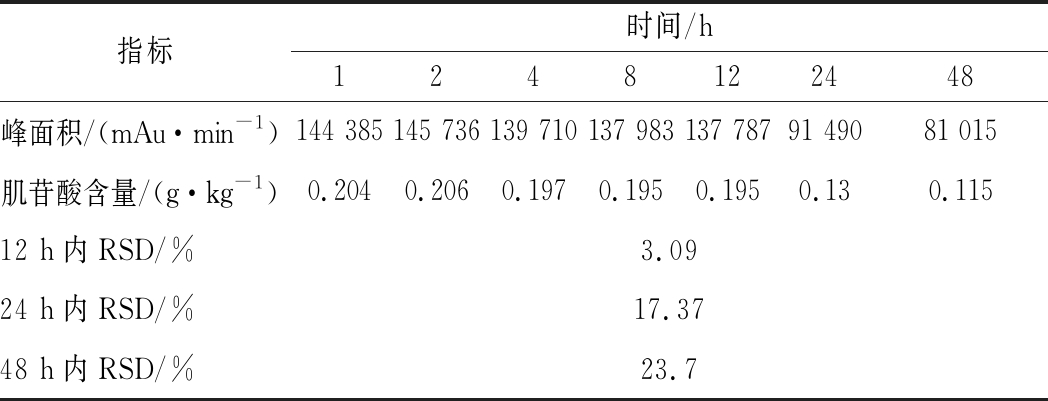
指标时间/h1248122448峰面积/(mAu·min-1)144 385145 736139 710137 983137 78791 49081 015肌苷酸含量/(g·kg-1)0.2040.2060.1970.1950.1950.130.11512 h内RSD/%3.0924 h内RSD/%17.3748 h内RSD/%23.7
2.2.5 检出限和定量限
在2.1.4所确定的最佳色谱条件下对依次稀释的母液标准品进样测定,最终测得S/N=10时标准品质量浓度约为0.08 μg/mL,S/N=3时标准品质量浓度为0.02 μg/mL,在这2个浓度条件下进样第2针未出峰,说明已达检测限。
2.2.6 加标回收率考察
表7为3份鲜肉去脂样品的加标回收率系列测定值,平均回收率99%,RSD值为2.71%,说明本次实验的方法准确性高。
表7 加标回收率考察结果
Table 7 Investigation results of spiked recovery rate
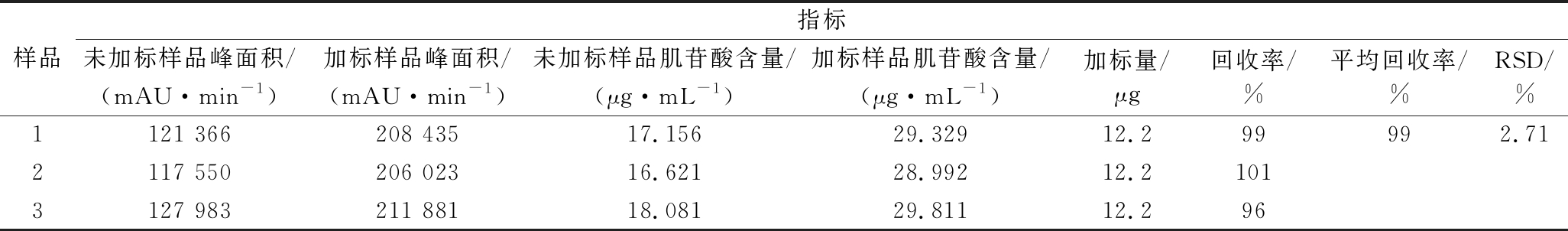
样品指标 未加标样品峰面积/(mAU·min-1)加标样品峰面积/(mAU·min-1)未加标样品肌苷酸含量/(μg·mL-1)加标样品肌苷酸含量/(μg·mL-1)加标量/μg回收率/%平均回收率/%RSD/%1121 366208 43517.15629.32912.299992.712117 550206 02316.62128.99212.21013127 983211 88118.08129.81112.296
2.3 四种方法处理后的肌肉样品肌苷酸的测定结果
按照1.3.4的含量计算公式和2.1.1的标准曲线方程计算鲜肉样品肌苷酸的含量。
样品色谱图如图3所示。图3-A为鲜肉样品得到色谱图,峰面积为8 788 mAu/min,算得样品的含量为0.014 g/kg;图3-B为冷冻干燥样样品得到色谱图,峰面积为15 438 mAu/min,计算得样品的含量为0.018 g/kg;图3-C为鲜肉去脂样样品得到色谱图,峰面积为11 592 mAu/min,计算得样品的含量为0.023 g/kg;图3-D为冷冻干燥去脂样品的色谱图,峰面积为19 647 mAu/min,计算得样品的含量为0.029 g/kg,所得结果在标准曲线范围内。
3 结论与讨论
3.1 色谱方法的优化和验证
本次实验改进了高效液相色谱法测定略阳乌鸡肌肉肌苷酸的主要测定条件。采用DIONEX UltiMate3000高效液相色谱仪,依次控制色谱柱、检测波长、流动相体系和流动相比例,进样标准品,通过对检测结果的分析最终确定了最佳的测定条件:COSMOSIL Packed Column C18(4.6 mm×250 mm,5 μm)色谱柱;甲醇-磷酸三乙胺(体积比4∶96)为流动相,柱温25 ℃, 检测波长248 nm,进样量20 μL。方法的检测限分别为0.02、0.08 μg/mL,方法精密度RSD值在0.30%~4.78%;平均回收率99%,RSD值为2.71%;肌苷酸方程线性范围为12.2~97.6 μg/mL,R2=0.999 9,线性关系均良好。

A-鲜肉样品;B-冷冻干燥样色谱图;C-鲜肉去脂样色谱图;D-冷冻干燥去脂样色谱图
图3 样品色谱图
Fig.3 Sample chromatogram
3.2 样品处理方法的分析
运用HPLC检测分析时,样品的提取率是最重要的影响因素之一。充分考虑溶剂性质、溶液选择、pH、温度、样本处理方式等内外因素来提升提取效率和检测的准确性。因为新鲜鸡肉中含有大量的脂肪,肌苷酸是属于水溶性化合物,根据相似相容原理,如果不脱除脂肪,其提取率就会降低。因此实验选择脱除肌肉脂肪来前处理样品,如图3所示,脱除脂肪的肌肉样品中肌苷酸的含量比较高,得到了理想的实验结果。
3.3 未知峰的分析
王美玲[17]报道了肌苷酸、鸟苷酸均为嘌呤合成的关键代谢物质。肌苷酸为合成鸟苷酸的中间物质,谷氨酰胺和PRPP经不同的酶催化转化为肌苷酸,再被相应的酶催化为鸟苷酸。在另一转化途径中, 肌苷酸在肌苷酸脱氢酶和鸟苷酸合成酶的作用下生成鸟苷酸[18]。5′-鸟苷酸和5′-肌苷酸是自然界中存在的2种单核苷酸,均具有强烈的呈味作用,在不同的pH、温度条件下含量表现出差异性[19]。在接近中性条件下,鸟苷酸的溶解性大于肌苷酸;中性pH下热稳定性二者的残留率均大于90%,稳定性较好[20-21]。本次实验所使用流动相的pH值为6.5,偏中性,实验结果与上述研究报道相契合。从结构上看,肌苷酸和鸟苷酸结构极为相似,二者结构相差一个—NH2,鸟苷酸比肌苷酸极性大,极性大的物质出峰时间早,与图3吻合,由此可推测未知峰的物质为鸟苷酸,有待后续实验的验证。
[1] TAO Z,LIU H,YANG L K,et al.The complete mitochondrial genome and molecular phylogeny of Lueyang black-bone chicken[J].British Poultry Science,2018,59(6):618-623.
[2] LIU S K,NIU S Y,MIN Y N,et al.Effects of dietary crude protein on the growth performance, carcass characteristics and serum biochemical indexes of Lueyang black-boned chickens from seven to twelve weeks of age[J].Brazilian Journal of Poultry Science, 2015, 17(1):103-108.
[3] 叶伟庆,杜炳旺,李东华,等.黄羽肉鸡不同生长时间肌苷酸含量及相关基因表达的对比[J].食品与发酵工业,2015,41(10):65-70.
YE W Q, DU B W, LI D H, et al.Comparison of IMP content and related gene expression at different time in yellow broilers [J].Food and Fermentation Industry, 2015,41(10):65-70.
[4] MANUELA R, ALBERTO B, EMANUELA Z, et al. Fatty acid profile, meat quality and flavour acceptability of beef from double-muscled Piemontese young bulls fed ground flaxseed[J]. Italian Journal of Animal Science.2019, 18(1):355-365.
[5] ROSSARIN, TANSAWAT, CURTIS, et al. Chemical characterisation of pasture-and grain-fed beef related to meat quality and flavour attributes[J]. International Journal of Food Science & Technology,2013, 48(3):484-495.
[6] WANG G X, SUN J F, YAO Y, et al. Detection of inosine monophosphate (IMP) in meat using double-enzyme sensor[J].Food Analytical Methods, 2020, 13(2):420-432.
[7] UTAMA D T,LEE S G,BAEK K H,et al. Effects of high-pressure processing on taste-related ATP breakdown compounds and aroma volatiles in grass-fed beef during vacuum aging[J]. Asian-Australasian Journal of Animal Sciences,2018,31(8):1 336-1 344.
[8] WANG X F,LIU G H,CAI H Y,et al. Attempts to increase inosinic acid in broiler meat by using feed additives[J].Poultry Science,2014,93(11):2 808.
[9] MACHIKO H,KEIKO N. Effect of contaminating bacteria on the inosinic acid content of chicken meat[J]. Journal of Home Economics of Japan,2003,54(6):441-448.
[10] 刘登勇,刘欢,张庆永,等.卤汤循环利用次数对扒鸡非盐呈味物质的影响[J].食品与发酵工业,2018,44(12):194-199.
LIU D Y, LIU H, ZHANG Q Y, et al.Effect of non-salt flavor compounds on braised chicken during brine recycles [J].Food and Fermentation Industry, 2018,44(12):194-199.
[11] 杜建中,曾秀文,黄少春,等.毛细管电泳法测定增味剂中的5′-肌苷酸二钠和5′-鸟苷酸二钠的含量[J].食品工业科技,2010,31(12):335-337.
DU J Z, ZENG X W, HUANG S C, et al.Study on the determination of disodium 5′-inosinate,disodium 5′-guanylate by capillary electrophoresis [J].Food Industry Science and Technology, 2010,31(12):335-337.
[12] PIESTANSKY J, GALBA J, KOVACECH B, et al. Capillary electrophoresis and ultra-high-performance liquid chromatography methods in clinical monitoring of creatinine in human urine: A comparative study[J]. Biomed Chromatogr. 2020,34(10):e4 907.
[13] 郑胜彪,唐婧.紫外分光光度法同时测定鸡精中谷氨酸钠和呈味核苷酸[J].中国调味品,2009,34(5):92-94.
ZHENG S B, TANG J.Simultaneous determination of sodium glutamate and I+G in chicken essence by the ultraviolet spectrophotometry method [J].Chinese Seasoning, 2009,34(5):92-94.
[14] 王欢欢,张乐,李庆海,等.高效液相色谱法同时测定乌骨鸡肌肉中的黑色素与肌苷酸[J].中国家禽,2014,36(21):12-16.
WANG H H, ZHANG L, LI Q H, et al.Simultaneous determination of melanin and inosinic acid in muscle of silky fowl by high performance liquid chromatography [J].Chinese Poultry, 2014,36(21):12-16.
[15] 丁玉庭,张静,周绪霞,等.常见食品及调味品中嘌呤类组分含量分析及分布规律[J].食品与发酵工业,2020,46(15):276-281.
DING Y T, ZHANG J, ZHOU X X, et al.Analysis and distribution of purine components in common foods and condiments [J].Food and Fermentation Industry, 2020, 46(15):276-281.
[16] 席斌,李大伟,郭天芬,等.不同品种鸡肌肉中氨基酸、脂肪酸及肌苷酸比较[J].甘肃农业大学学报,2020,55(2):46-53.
XI B, LI D W, GUO T F, et al.Comparison of amino acids, fatty acids and inosinic acid in muscle of different chicken breeds [J].Journal of Gansu Agricultural University, 2020,55(2):46-53.
[17] 王美玲.利用微生物技术生产肌苷酸和鸟苷酸的进展[J].山东食品发酵,2014(3):38-41.
WANG M L.Advances in the use of microbial technology to produce inosine mono-phosphate and guanosine mono-phosphate[J].Shandong Food Fermentation, 2014(3):38-41.
[18] 闫俊书,刘培峰,施振旦.家禽肌肉肌苷酸含量影响因素及其相关基因的研究进展[J].中国家禽,2017,39(10):41-46.
YAN J S, LIU P F, SHI Z D.Research progress on influencing factors of inosinic acid content in poultry muscle and related genes [J].Chinese Poultry, 2017,39(10):41-46.
[19] 文娜,汤兆星,李芳,等.反相高效液相色谱法同时测定羊肉中肌酸、肌酸酐、肌苷酸、鸟苷酸[J].化学工程与装备,2008(5):105-107.
WEN N, TANG Z X, LI F, et al.Simultaneous determination of creatine, creatinine, inosine 5,-monophospate and guanosine 5,-monophate by RP-HPLC [J].Chemical Engineering and Equipment, 2008(5):105-107.
[20] 铃木千秋.液体调味料增鲜的最佳选择—IMP[J].中国食品添加剂,1996(2):31-38.
SUZUKI QIANQIU.The best choice for freshening liquid seasoning-IMP [J].Chinese Food Additives, 1996(2):31-38.
[21] 杨炼,沈燕霆,李英雨,等.肌苷酸和鸟苷酸的热稳定性和酸稳定性[C].北京:北京食品学会(Beijing Food Institute),2011:185-187.
YANG L, SHEN Y T, LI Y Y, et al.Thermal stability and acid stability of inosinic acid and guanylic acid [C].Beijing:Beijing Food Institute,2011:185-187.