谷物、果蔬等农作物目前正遭受着曲霉属(Aspergillus)、青霉属(Penicillium)和镰刀菌属(Fusarium)等多种真菌的污染。真菌侵染农产品后,在适宜的温度、湿度和足够的营养条件下开始萌发繁殖,并不断分解农产品中的糖类、蛋白质等成分,造成营养物质损失,进而影响农产品的质量和产量,造成巨大的资源浪费和经济损失[1]。并且真菌对农产品的侵染往往伴随着其次级代谢产物——真菌毒素(mycotoxin)的产生,这严重威胁着人类的身体健康和生命安全。据粮农组织估计,全世界约有25%的作物受真菌污染并受真菌毒素影响,估计损失达数10亿美元[2]。真菌污染对全球粮食生产及储备造成了严重影响,引起了全球性关注。
目前常用的抑菌措施是喷洒化学杀菌剂,但是化学杀菌剂的滥用使得病原微生物的抗性逐渐增强,进而人们需要喷洒更多的化学杀菌剂,造成了恶性循环。而且很多化学杀菌剂不可生物降解,它们可以在土壤、植物和水中积累,并通过食物链影响人类。由于其较长的降解期和对人类健康的潜在影响(致癌性、致畸性、高残留毒性和激素失衡等),允许采后施用的化学杀菌剂的类型和浓度受到限制。近年来,公众对杀菌剂残留污染的关注度明显增加。考虑到这些因素,需要开发既有效又经济可行的安全易降解替代品[3]。
精油(essential oils, EOs)是天然抗菌剂,多种植物均可产生,以保护自身免受感染,在食品工业和农业中,在对抗病原微生物方面具有很大的潜力[4]。一些精油,如丁香油,百里香油,茶树油和肉桂油,具有广谱抗菌性。同时精油具有生物降解性、高挥发性和低残留等特点,不会像化学杀菌剂一样对生态环境造成负面影响,因此精油可作为绿色杀菌剂的重要来源之一。精油通常是含有大约20~80种不同化合物的复杂混合物,萜烯、萜类化合物和酚类是其抑制微生物的主要成分。精油成分的不同导致不同精油具有不同的抗微生物活性和抑菌机理,而特定精油的抗微生物活性主要取决于其浓度和化学组成[5]。
为了使植物精油在农业和食品工业上更好的应用,本文概述了植物精油对真菌微生物的抑制作用和降低真菌毒素产生的作用,并对抗菌和抑制毒素的作用机制进行了汇总,最后介绍了精油目前在农业方面的应用研究及精油乳液的研究前景。
1 真菌及真菌毒素污染
真菌毒素中毒(mycotoxicosis)[6]概念的提出是在60多年前,然而当时并没有人认为发霉的食物可以导致疾病,经过半个多世纪的深入研究,人们已经认识到真菌毒素是由多种真菌产生的具有不同毒性的次级代谢产物。常见的真菌毒素主要包括黄曲霉毒素(aflatoxin, AFs)、脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)、雪腐镰刀菌烯醇(nivalenol, NIV)、伏马菌素(fumonisins, FBs)、赭曲霉毒素A(ochratoxins A, OTA)、T-2毒素(T-2 toxin)和玉米赤霉烯酮(zearalenone, ZEA)等。如表1所示,真菌毒素不仅具有极强的急性毒性,致畸性、致癌性和致突变性的“三致”作用,还具有肝脏毒性、细胞毒性和免疫毒性等,给人类的身体健康造成极大的威胁[1]。
表1 几种常见的真菌毒素的产生菌种及毒性
Table 1 Several common mycotoxin production strains and toxicity

毒素种类产生菌种毒性参考文献黄曲霉毒素B1,B2,G1,G2黄曲霉、寄生曲霉肝脏毒性、致癌、免疫毒性[7-9]DON、B型单端孢霉烯族毒素镰刀菌属免疫毒性、引起动物厌食呕吐[10-11]NIV、B型单端孢霉烯族毒素镰刀菌属免疫毒性、血液毒性[10]FBs镰刀菌属致癌、肝脏毒性、肾毒性[12]OTA赭曲霉、炭黑曲霉、疣孢青霉肾脏毒性、遗传毒性、致癌[13-14]T-2,HT-2毒素 A型单端孢霉烯族毒素镰刀菌属血液毒性、免疫毒性、细胞毒性、动物拒食[10]ZEA镰刀菌属生殖毒性、致畸[15-16]
目前在农业上控制真菌毒素的方法主要有物理方法、化学方法和生物方法3种。但是这3种方法各有各的缺陷[17],通过机械分离密度小或粒径小的谷物、热水处理和放射处理的方法来去除被毒素污染的谷物难以工业化应用;添加甲醛、双氧水等化学试剂来处理粮食或者加入吡咯苯类、咪唑类等杀菌剂[1]则会造成环境污染问题;通过添加乳酸菌、白地霉等有益菌来抑制致病菌生长的方法也容易造成接种微生物的二次污染。因此,研究精油等绿色防霉剂来控制真菌和真菌毒素的污染在食品安全研究方面具有重要意义。
2 植物精油抗菌及降低毒素的研究
2.1 植物精油
精油是含有挥发性芳香化合物的浓缩油性液体,包括萜烯类,萜类化合物(氧化萜烯)和酚类等,挥发性芳香化合物大多衍生自植物材料,例如花,芽,叶和树皮[5]。通常情况下,植物中的油含量<1%,一般需要通过提取、蒸馏和溶剂萃取获得高度浓缩的精油,水蒸汽蒸馏是精油商业分离最常用的方法。植物精油目前由于其低残留、易挥发、易降解及绿色无污染等特性逐渐应用于抑菌防霉剂领域,关于精油主要成分及其对真菌抑制作用的研究也越来越广泛。
2.2 植物精油对真菌生长的抑制作用
具有抗微生物活性的常见精油及其主要成分见表2,精油的主要成分中抗微生物活性最高的是酚类物质,其次是萜类化合物。与酚类和萜类化合物相比,精油中的萜烯、酮类和酯类(如β-月桂烯,α-噻吩酮和乙酸香叶酯)的抑菌能力和生物活性较弱[18]。
表2 植物精油主要成分及其抗真菌活性和抑制毒素积累的情况
Table 2 Main components of plant essential oils and their antifungal activities and inhibition of toxin accumulation

精油主要成分测试微生物菌株抗真菌活性抑制真菌毒素作用参考文献丁香油β-石竹烯、丁香酚、乙酸丁香酚寄生曲霉、串珠镰刀菌、尖孢镰刀菌、禾谷镰刀菌2 μL/mL的丁香油可以使FB1的浓度降低78%[19]抑制尖孢镰刀菌生长的最小抑菌浓度为31.25 μg/mL[20]20 ℃,0.995 水分活度下丁香油完全抑制DON的产生[16]百里香油香芹酚、芳樟醇、百里酚禾谷镰刀菌、黄曲霉百里香酚抑制禾谷镰刀菌生长的最小抑菌浓度为0.02%,高于0.06%时会在10 s内灭活[21]在250 μg/mL时完全抑制黄曲霉生长150 μg/mL的百里香精油完全抑制黄曲霉毒素B1(AFB1)与AFB2的产生[9]薄荷油香叶醇、醋酸香叶酯、芳樟醇赭曲霉750 μg/mL的薄荷油在14 d内完全抑制赭曲霉生长750 μg/mL的薄荷在7 d内完全抑制OTA产生[14]肉桂油双环甘油酯、肉桂醛、β-石竹烯、丁香酚黄曲霉、青霉、镰刀菌20 d内完全抑制黄曲霉的生长肉桂油可显著抑制AFB1的积累,达98.94%[22]对镰刀菌和青霉具有100%的灭杀效果[23]柠檬草油香叶醛、橙花醛尖孢镰刀菌抑制尖孢镰刀菌生长的最小抑菌浓度为62.5 μg/mL[20]生姜油α-姜烯、香叶醛禾谷镰刀菌抑制禾谷镰刀菌的最小抑菌浓度为1 000 μg/mL,2 000 μg/mL的生姜油完全杀死禾谷镰刀菌500 μg/mL的生姜油抑制了47.3%的DON的产生,2 000 μg/mL时完全抑制[24]
续表2

精油主要成分测试微生物菌株抗真菌活性抑制真菌毒素作用参考文献罗勒油1,8-桉叶素、香叶醇,芳樟醇、甲基胡椒酚、肉桂酸甲酯、甲基丁香酚镰刀菌、青霉、黄曲霉在0.5%浓度的罗勒油中, 7 d内没有观察到镰刀菌和青霉菌的生长[25]圣罗勒能完全抑制黄曲霉、雪腐镰刀菌和交链孢菌的生长,对尖孢镰刀菌的抑制率达到95.4%在0.2 μg/mL下完全抑制AFB1的产生[26]山苍子油柠檬醛、芳樟醇黄曲霉、禾谷镰刀菌、根霉山苍子油抑制黄曲霉、禾谷镰刀菌及根霉的最小抑菌浓度皆为0.2%其主要成分柠檬醛,0.10%柠檬醛使AFs的产生减少了85%[27]牛至油香芹酚、对甲基异丙基苯、(E)-石竹烯、γ-萜品烯、百里香酚黑曲霉、赭曲霉、镰刀菌抑制黑曲霉生长的最小抑菌浓度为 0.125 μg/mL,最小杀菌浓度为0.25 μg/mL[28]750 μg/mL的牛至油在14 d内完全抑制赭曲霉生长750 μg/mL的牛至油在14 d内完全抑制OTA产生[14]
由表2可知,大部分精油都具有广谱抗菌活性。以丁香油为例,它对镰刀菌属、曲霉属等真菌都具有较好的抗菌活性。JUGLAL等[19]评估了9种植物精油对寄生曲霉和镰刀菌(F.moniliforme)生长的影响,发现丁香油的抑菌作用大于肉桂精油、牛至精油和肉豆蔻精油,并且丁香油可以显著降低AFs的形成(降低78%),并影响伏马菌素的产生。SHARMA等[20]发现丁香油抑制尖孢镰刀菌(F.oxysporum)生长的最小抑菌浓度为31.25 μg/mL,通过乳化的方法将丁香油包裹入纳米乳液并用于番茄幼苗阶段,有效控制了番茄中61.1%的由尖孢镰刀菌引起的枯萎病。
2.3 植物精油抑制真菌产真菌毒素的作用
植物精油不仅对真菌生长有较好的抑制效果,而且在减少各种真菌毒素(AFs、DON、OTA和ZEA等)积累方面效果显著。MARIN等[16]通过将精油直接添加到已知水分活度(water activity,Aw)的玉米粒中并接种禾谷镰刀菌的方式进行抑制产毒实验,发现丁香油在20 ℃,0.995 Aw下可以完全抑制禾谷镰刀菌产生DON,而且丁香油、香茅油和玫瑰草精油可以在30 ℃,0.950 Aw下完全抑制禾谷镰刀菌产生ZEA。
然而精油的水溶性相对较差,直接添加的方式往往存在着混合不均匀、利用率低等缺点,导致产毒实验的重复性差。研究人员提出了多种添加方法(如蒸气熏蒸、与吐温等乳化剂混匀等),改善了产毒实验的效果。(1)蒸汽熏蒸:袁媛[22]研究发现肉桂精油熏蒸玉米的处理,可以抑制黄曲霉的生长,显著降低AFB1的积累,降幅达98.94%,而且肉桂油可以降解玉米粉中的AFB1,降解率达43.96%,这也为添加植物精油直接降解真菌毒素的应用提供了参考。(2)液体直接添加:BASILICO等[14]通过在补充酵母提取物液体培养基(yeast extract with supplement medium,YES)中接种赭曲霉孢子并加入各种植物精油进行产毒实验,发现750 μg/mL的牛至油在14 d内完全抑制赭曲霉产生OTA,同浓度的薄荷油仅能在7 d 内完全抑制赭曲霉产生OTA,而1 000 μg/mL的牛至油和薄荷油在21 d内完全抑制赭曲霉产生OTA。(3)添加乳化剂:FERREIRA等[24]将生姜精油溶于0.001%的吐温-80并接入PDA液体培养基中,发现500 μg/mL的生姜油对禾谷镰刀菌产生DON的抑制率达到了47.3%,而在2 000 μg/mL时完全抑制了真菌生长和DON的产生。
2.4 植物精油抑制真菌的作用机制
从植物中提取的精油通常含有一些抗菌或抗氧化化合物,它们被认为是天然杀菌剂的良好选择,精油的抗菌活性已在许多不同抗菌模型中得到证实[5],其抗菌机制主要取决于精油中存在的化学成分的浓度和类型。不同的化学成分可以通过不同的机制起作用,也可以靶向不同种类的微生物,并且不同的作用机制也可以相互影响,从而达到抑菌的目的。
2.4.1 增强细胞通透性
精油的亲脂性和低分子质量组分容易穿过真菌细胞质膜,导致细胞膜渗透性和渗透平衡的破坏,从而导致细胞死亡,主要包括脂肪酸谱的改变和离子的泄漏。许多研究人员将精油的作用机制归因于它们穿透细胞膜进入细胞内部的能力,这使得细胞结构发生变化,周围的精油更容易渗透进入细胞[4, 29-30]。
(1)脂肪酸谱改变:萜类的抗菌机制发生在细胞膜水平,其抗微生物活性归因于它们具有抑制呼吸和其他能量依赖性过程的能力[31],然而,当作为单一成分时,萜类的总体抗微生物活性较低[29]。研究发现,萜类化合物的作用机制通常先是亲脂性成分改变细胞膜脂肪酸组成,导致了膜渗透性的改变和细胞内物质的渗漏[32],进而使萜类化合物跨膜进入细胞内发挥其影响代谢的作用。
(2)离子泄漏:ULTEE等[33]研究发现香芹酚由于其较好的脂溶性可在细胞质膜中积累(最高可达6×104 μg/g),引起细胞膜扩张,并导致膜不稳定及离子泄漏。另外,香芹酚通过将其羟基质子交换为另一种离子(K+等)而充当单价阳离子的跨膜载体,使质子释放到细胞质内而降低质子动力(图1),影响ATP的合成进而导致细胞死亡。
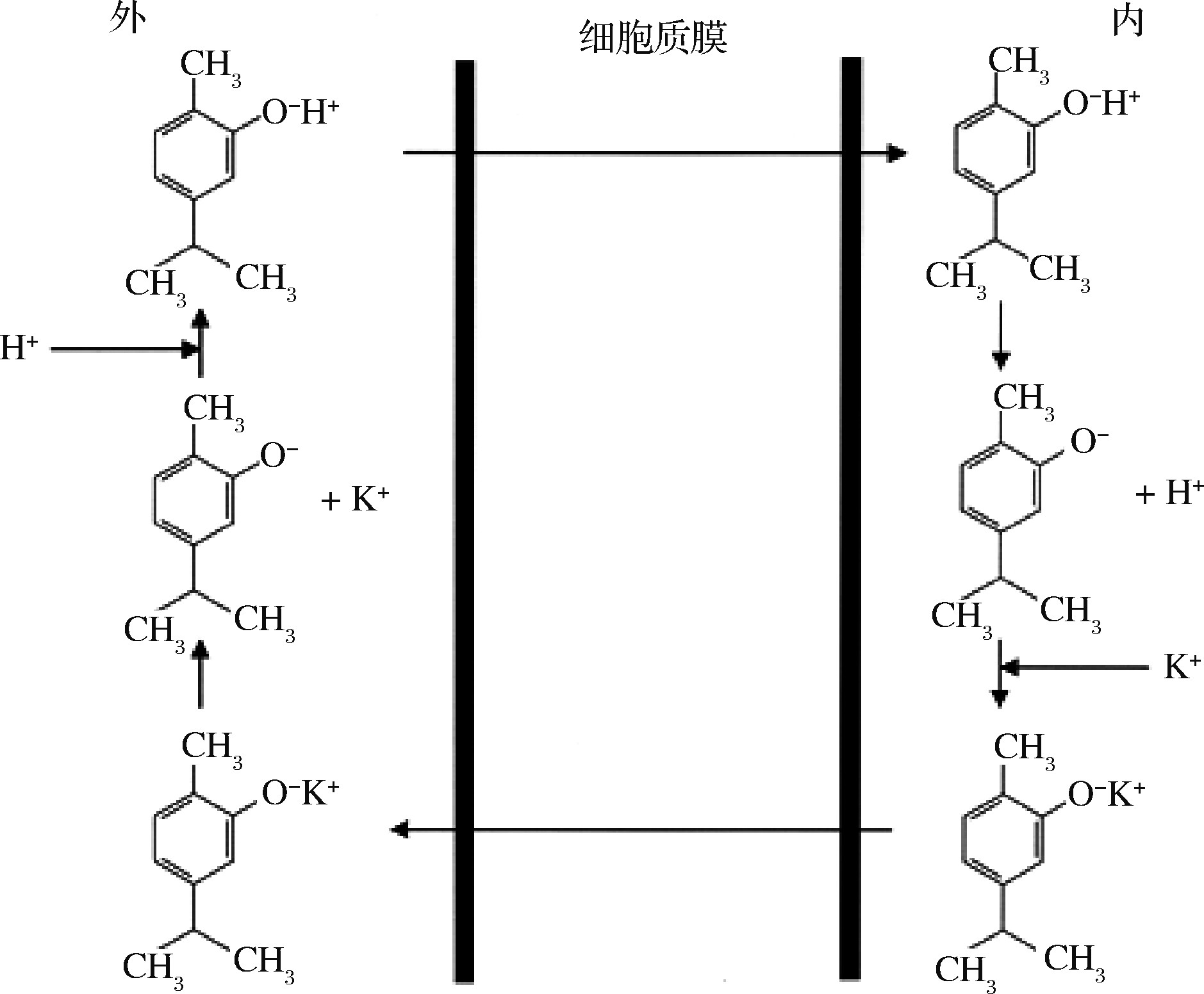
图1 香芹酚降低质子动力示意图[34]
Fig.1 Schematic diagram of carotenol reducing proton dynamics
2.4.2 影响细胞结构及功能
据文献报道,有些精油及其主要抑菌成分也会通过影响细胞结构及功能来达到抑菌的目的。罗曼[34]研究发现柠檬醛可以使菌丝体DNA、RNA、脂类和蛋白质等的生物合成受到抑制,进而影响相关基因的表达与调控,扰乱能量代谢与遗传稳定性,最终导致细胞死亡。研究发现柠檬醛损伤黄曲霉细胞核DNA,导致局部断裂,且其损伤程度与柠檬醛浓度呈正相关。柠檬醛通过损伤细胞壁和细胞膜上的功能脂质蛋白,导致膜对营养物质(如糖和蛋白质等)的吸收转运率分别下降为23.3%和30.61%。此外,柠檬醛可以使黄曲霉体内的琥珀酸脱氢酶、苹果酸脱氢酶活性分别呈不可逆趋势下降为31.82%和24.2%,并随着柠檬醛浓度的升高,2种酶的活性逐渐消失。
目前也有很多研究通过电子显微镜等手段直接观察精油对真菌结构的损伤。SUN等[35]通过扫描电子显微镜和透射电子显微镜观察肉桂醛对真菌菌丝体的损伤,发现肉桂醛可以破坏黄曲霉菌丝体并导致其内容物流失并破坏线粒体,如图2与图3所示。
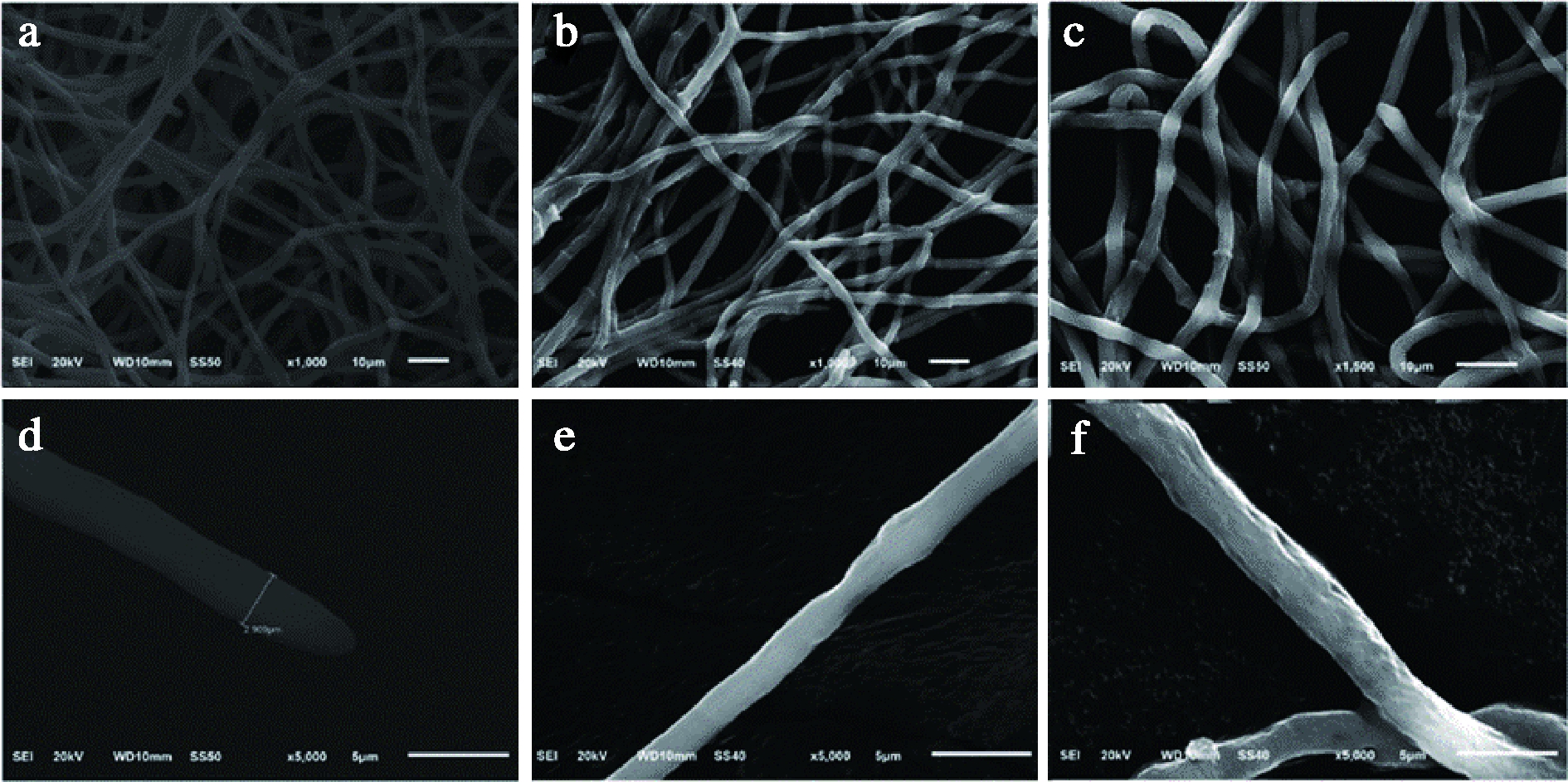
a,d-对照真菌菌丝体在所有部位均呈正常和规则的管状;
b,e-用低浓度肉桂醛(52 μg/mL)处理的菌丝(形态上略有塌陷);
c,f-用高浓度的肉桂醛(78 μg/mL)处理的菌丝(形态上明显干瘪有褶皱)
图2 肉桂醛对黄曲霉超微结构的影响(扫描电子显微镜)
Fig.2 Effect of cinnamaldehyde on the ultrastructure of A.flavus (scanning electron microscope)

a-显示均匀的细胞质和细胞内正常的细胞器结构(包括
线粒体,细胞核和囊泡);b-添加52 μg/mL肉桂醛的菌丝;
c-添加78 μg/mL肉桂醛的菌丝
图3 肉桂醛对黄曲霉超微结构的影响(透射电子显微镜)
Fig.3 Effect of cinnamaldehyde on the ultrastructure of A.flavus (transmission electron microscope)
2.4.3 紊乱能量代谢
精油紊乱真菌能量代谢的作用主要通过损伤线粒体及抑制菌丝体DNA、RNA、脂类和蛋白质等的生物合成来实现。精油会对线粒体产生一定的破坏作用[34, 36],受损的线粒体DNA抑制电子传递蛋白的表达,进而导致线粒体内活性氧(reactive oxygen species, ROS)的累积。李金寒等[37]通过电化学传感器实时监测和荧光分析观察柠檬醛作用下胞内外ROS的变化,结果表明柠檬醛能够刺激黄曲霉产生ROS,并在细胞内蓄积。ROS是氧代谢过程中产生的一系列中间产物,具有较强的氧化能力,能够与生物体内的活性大分子物质(脂质、蛋白质等)发生反应,对其产生不可逆的氧化损伤,从而导致生物体损伤[37]。同时ROS可影响很多酶的活性从而产生转录水平上的抑制。
罗曼[34]的研究发现柠檬醛通过损伤膜功能脂质蛋白,降低营养物质转运率,并可通过降低琥珀酸脱氢酶、苹果酸脱氢酶的活性紊乱能量代谢。添加柠檬醛后以琥珀酸、α-酮戊二酸和丙酮酸为底物时所测定线粒体呼吸速率分别下降了24.1%,14.3%和36.1%,能量代谢发生紊乱并促进细胞死亡。
2.4.4 精油组分间的协同作用
精油是20~80种化合物组成的复杂混合物,精油各组分之间的相互作用可能会产生协同或拮抗的抗菌作用。例如萜类化合物的作用机制通常是与亲脂性成分协同作用,亲脂性成分破坏细胞膜后使得萜类化合物进入细胞发挥作用。
JIANG等[38]利用GC-MS分析了迷迭香精油的主要成分,评估了1,8-桉叶素(26.54%)和α-蒎烯(20.14%)及迷迭香精油对金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、大肠杆菌、白色念珠菌及黑曲霉等的最小抑菌浓度,发现对所有测试微生物而言,迷迭香精油的最小抑菌浓度为0.03%~1.0%,α-蒎烯的最小抑菌浓度为0.3%~4.0%,而1,8-桉叶素的最小抑菌浓度为0.2%~4.0%,证实了植物精油的整体抗菌活性比其单一抗菌成分更强。
此外,BAYDAR等[39]发现香薄荷精油的抗菌活性要高于野生牛至油,然而其主要抗菌物质香芹酚和百里酚的含量却比牛至油的比例低,这是因为香薄荷含有更高浓度的ρ-伞花烃和γ-萜品烯。然而ρ-伞花烃和γ-萜品烯单独测试时,它们对任何微生物都没有抑制作用。这表明,精油中的微量成分通过协同作用对其抗菌活性产生重要作用。
不同精油协同作用的机理归根于不同精油不同化学组成的协同作用,相似作用机制的精油进行复配可能并没有好的协同作用,这也解释了精油复配作为抑菌剂添加会产生协同或者拮抗作用的原因。
2.5 植物精油抑制真菌产生毒素的作用机制
关于植物精油抑制真菌产生真菌毒素的机理非常复杂多样,通常认为在较高浓度下,植物精油主要通过抑制真菌生长而抑制真菌毒素的产生,而在较低浓度下,则通过下调毒素关键调控和合成结构基因的表达而抑制真菌毒素的生物合成。
FERREIRA等[24]以麦角甾醇的含量表征镰刀菌生物量来研究生姜精油(ginger essential oil, GEO)对禾谷镰刀菌生长及毒素产生的影响。结果表明,GEO在1 000 μg/mL的质量浓度下显著降低麦角甾醇的含量,并且在高于2 000 μg/mL时达到99.9%的抑制率。但是,在500 μg/mL时,随着麦角甾醇的含量增加,DON的含量反而下降47.3%。证实了在低浓度下,植物精油不通过抑制真菌生长而抑制毒素产生。LIANG等[40]的研究也发现肉桂醛(0.40 mmol/L)、丁香酚(0.80 mmol/L)和柠檬醛(0.56 mmol/L)在不抑制真菌生长的情况下显着降低AFB1产量,抑制率分别为68.9%、95.4%和41.8%。
SUN等[35]的研究表明肉桂醛可以通过降低过氧化氢和还原型谷胱甘肽水平来改变细胞内氧化还原状态进而抑制黄曲霉产生毒素。研究表明78 mg/L的肉桂醛使过氧化氢酶和谷胱甘肽过氧化物酶的活性分别上升了1.9倍和2.2倍,AFB1的含量降低了65.6%。
真菌毒素的产生受到相关基因的调控,SUN等[35]研究发现经肉桂醛短时作用(5 min)或长时作用(120 h)均能下调黄曲霉的黄曲霉毒素合成调控基因aflR的表达,并有明显的浓度梯度效应。LIANG等[40]发现肉桂醛、柠檬醛和丁香酚可以通过下调黄曲霉YC-15的黄曲霉毒素生物合成基因aflR,aflT,aflD,aflM和aflP来降低AFB1的产生,0.80 mmol/L的丁香酚在7 d内下调了5种基因的表达量,分别减少了15、4.8、5.2、138和2 061倍,降低了89.2%~97.9%的AFB1的生物合成,肉桂醛和柠檬醛也不同程度的下调了5种基因的表达并降低毒素的产生。
3 植物精油抑制真菌微生物的应用及研究现状
植物精油抑制真菌微生物的应用主要集中在粮食的贮存方面和果蔬保鲜方面,目前在玉米、小麦、大麦、花生、大豆、番茄、圣女果及草莓等方面均有深入的报道,并且已经有在农作物生长阶段添加精油制剂抑制病原微生物生长的报道[20],这也是下一步研究的方向。另外,与体外模型系统相比,实际应用中往往需要更高浓度的精油才能达到相同的抗微生物活性[5]。而高浓度的精油会因其高挥发性,低溶解度、不稳定性和独特的风味特征导致精油的利用率低而影响其抗菌活性。因此,近年来,人们对提高精油作为抗菌剂的抗菌活性的研究越来越多,包括制备微胶囊、纳米乳液及脂质体等[41]。
3.1 植物精油的应用研究
3.1.1 粮食贮存
植物精油目前最具有实用性的应用是作为熏蒸剂进行添加。已经报道了在封闭容器贮藏时,孜然油和薄荷油可以保护>63%的小麦和鹰嘴豆样品免受真菌侵害[42]。袁媛等[43]使用肉桂精油熏蒸玉米,20 d内完全抑制黄曲霉生长,且在玉米水分含量为13%时,对AFB1的抑制率达98.94%。同时,肉桂油可以降解玉米中的AFB1,降解率高达64.5%,这为植物精油的进一步应用提供了基础。精油熏蒸粮食是在贮存阶段防治真菌侵害比较好的方法,因为其价格低廉且低残留(粮食晒干后可以最大程度上去除精油蒸汽)而广受欢迎。
低剂量γ辐射在消毒和提高农产品的保质期方面已经得到世界卫生组织和联合国粮食与药物管理局的认可。将辐射与其他脱毒剂(如精油和化学杀菌剂)相结合是提高辐射杀菌效率有效创新的方法,组合方法减少了其所需的辐射剂量,并且可以在低辐射剂量下促进食品安全。KALAGATUR等[44-45]采用依兰精油和印度香水姜精油结合γ辐射处理玉米,在1.89 mg/g香水姜精油和4.12 kGy辐射处理下观察到禾谷镰刀菌的生长,DON和ZEA的产生则被完全抑制;在2.5 mg/g依兰精油和4 kGy γ辐射下完全抑制DON和ZEA的产生。
3.1.2 果蔬保鲜
植物精油在果蔬保鲜方面也有较出色的应用。徐仕翔[46]制备了平均粒径11.9 nm的月桂精油乳液,将1 000 μg/mL的微乳液作用于樱桃番茄,有效抑制了链格孢菌(Alternaria alternata)引起的灰霉病。与对照组相比,经月桂精油乳液处理后,抑菌率达33.4%。范小静等[47]研究发现15%的柠檬油微乳剂对圣女果有明显的保鲜作用,处理15 d后,坏果率仅为14.13%,比空白对照处理下降了62.89%。而且,柠檬油微乳剂可显著延缓圣女果可溶性固形物、有机酸和VC含量的下降,货架期可达到7 d。赵亚珠等[48]将百里香油制备成纳米乳液涂布于纸箱用于储藏草莓,4%的百里香精油抗菌纸箱可以明显降低灰霉(Botrytis allill)、青霉、交链孢霉和根霉(Rhizopus)引起的草莓腐烂,并降低菌落总数,使货架期延长1~2 d。
植物精油的引入可以较好地抑制真菌引起的果蔬腐烂,在延长果蔬货架期方面有较好地潜力。不仅如此,植物精油也可以较好地控制果蔬生长阶段的真菌病害。SHARMA等[20]制备了包括丁香油和柠檬草油的复合纳米乳液,有效控制了番茄幼苗阶段由尖孢镰刀菌引起的番茄枯萎病,抑制率达70.6%。
3.2 精油乳液抑制真菌微生物及真菌毒素的前沿进展
WU等[49]以肉桂油为油相,以卵磷脂为乳化剂,添加中链甘油三酯(medium chain triglycerides,MCT)抑制奥斯特瓦尔德熟化(ostwald ripening),添加壳聚糖进行包裹来提升其稳定性,制得平均粒径560 nm的纳米乳液。抑菌实验表明纳米乳液对禾谷镰刀菌孢子萌发的抑制率达100%,在产毒实验中对DON和3ADON产生的抑制率分别达91.3%和70.0%。冯文旭等[50]将丁香油、肉桂油、牛至油及山苍子油等分别制备成纳米乳液,4种乳液对禾谷镰刀菌菌丝生长及DON、15ADON的产生都具有较好的抑制作用,40 mg/g的牛至油乳液可完全抑制菌丝的生长,0.3 mg/g的肉桂油/MCT乳液对DON和15ADON的抑制效果可达98.8%和96.6%。
此外,精油制备成纳米乳液后由于其优良的稳定性使得其在应用时有较好的缓释作用。KALAGATUR等[51]利用壳聚糖包裹马提尼精油制备纳米乳液,纳米乳液中的马提尼精油在48 h内仅缓慢释放了43.37%。研究表明壳聚糖包埋的方法可以将精油的挥发性醇和酚基团转化为更稳定的络合物形式,通过逐渐释放抗真菌成分来增加其杀菌作用的有效作用时间。
3.3 精油应用的局限性
与体外模型相比,实际应用中往往需要更高浓度的精油才能达到相同的抑菌活性。比如,在半脱脂牛奶中约需要2倍的浓度,在猪肉香肠中约为10倍,在汤中则为50倍[4-5]。而高浓度精油的添加会因其高挥发性,低溶解度和不稳定性等导致其利用率降低甚至影响其抗菌活性。并且添加高浓度的精油可能会造成生物毒性或具有一定的刺激性,如丁香酚,薄荷醇和百里酚等会引起口腔组织刺激[5],因此精油在不同食品中允许使用的安全浓度需要进一步研究。
另外,精油常常有着令人不愉悦的刺激性气味,过量添加可能会对相应食品的感官造成一定的影响。精油的添加对于草药、香料及调味品等食品的气味方面影响较小,对于一些需要进一步烹饪的肉类、鱼类的影响也较小,在烹饪后即使有少量的残留也不会对风味及外观造成不良影响,且一些精油也会赋予这类食品一些较好的风味[5]。然而,精油应用于果蔬保鲜方面时,会与果蔬等本身的醇类、酯类等风味物质形成混合的芳香物质,影响了精油在食品行业的应用。植物精油与果蔬之间需要合理搭配来进行果蔬的品质(颜色、香气等)控制[52],也应该充分评估植物精油的残留导致的感官变化与精油的抑菌程度间的制约关系。
4 结论与展望
许多植物精油在体外模型中表现出了强烈的抗菌活性,并且部分精油的功效已经在实际应用中得到证实。天然植物精油是环境友好型的天然杀菌剂,是未来新型杀菌剂的重要来源之一,随着我国各类植物资源的不断开发研究,必将展现出更为广阔的发展前景。人们对各类植物精油抑菌机理的研究不断深入,目前主要体现在3个方面:(1)增强细胞通透性;(2)影响细胞结构及功能;(3)紊乱能量代谢,并且精油不同组分对真菌的抑制有协同作用。精油在抑制真菌产生真菌毒素方面也有着较好的效果,在较低浓度下就可以通过下调关键基因的表达降低毒素含量,展现出了较好的应用前景。
我国的植物资源非常丰富,大量的资源待开发,研究更为广泛的精油以挑选合适的抑菌防霉剂是科学研究及实际应用的需要。同时,为了合理的利用精油资源,提高抗微生物活性及利用率,需要在分子水平上深入研究精油的抑菌机理,如小分子化合物对转录翻译及代谢过程的影响,同时开发新的应用方式也是必不可少的。由于植物精油具有光、热、pH稳定性差、挥发性强等特点,导致植物精油在实际应用中的利用率低,人们提出了利用各类精油的输送系统来提升抗微生物活性。精油纳米乳液的制备为其提供了很好的思路,这也是下一步研究的方向。
[1] 李燕君,孔维军,李梦华,等.植物精油抑制真菌及真菌毒素的研究进展[J].中草药, 2016, 47(11):2 011-2 018.
LI Y J, KONG W J, LI M H, et al.Advance in study on plant essential oils for their inhibitory effects on fungal growth and mycotoxin synthesis[J].Chinese qraditional and eerbal arugs, 2016, 47(11):2 011-2 018.
[2] BHAT R, RAI R V, KARIM A A.Mycotoxins in food and feed:Present status and future concerns [J].Comprehensive Reviews in Food Science and Food Safety, 2010, 9(1):57-81.
[3] CABRAL L D, FERNANDEZ P V,PATRIARCA A.Application of plant derived compounds to control fungal spoilage and mycotoxin production in foods [J].International Journal of Food Microbiology.2013, 166(1):1-14.
[4] CALO J R,CRANDALL P G,O'BRYAN C A, et al.Essential oils as antimicrobials in food systems-A review[J].Food Control, 2015, 54:111-119.
[5] BURT S.Essential oils:Their antibacterial properties and potential applications in foods-A review [J].International Journal of Food Microbiology, 2004, 94(3):223-253.
[6] PITT J I, MILLER J D.A Concise history of mycotoxin research [J].Journal of Agricultural and Food Chemistry, 2017, 65(33):7 021-7 033.
[7] KENSLER T W, ROEBUCK B D, WOGAN G N, et al.Aflatoxin:A 50-year odyssey of mechanistic and translational toxicology [J].Toxicological Sciences, 2011, 120:28-48.
[8] TURNER P C.The molecular epidemiology of chronic aflatoxin driven impaired child growth [J].Scientifica, 2013.DOI:10.1155/2013/152879.
[9] KOHIYAMA C,RIBEIRO M,MOSSINI S, et al.Antifungal properties and inhibitory effects upon aflatoxin production of Thymus vulgaris L.by Aspergillus flavus Link [J].Food Chemistry, 2015, 173:1 006-1 010.
[10] 杨术鹏.镰刀菌毒素及其隐蔽型形式的代谢研究[D].北京:中国农业大学,2016.
YANG S P.Study on the metabolism of fusarium toxins and its masked form [D].Beijing:China Agricultural University, 2016.
[11] PAYROS D, ALASSANE K I, PIERRON A, et al.Toxicology of deoxynivalenol and its acetylated and modified forms [J].Archives of Toxicology, 2016, 90(12):2 931-2 957.
[12] World Health Organization.Evaluation of Certain Contaminants in Food[M].Geneva:World Health Organization, 2017:1-166.
[13] MALLY A, DEKANT W.Mycotoxins and the kidney:Modes of action for renal tumor formation by ochratoxin A in rodents [J].Molecular Nutrition & Food Research, 2009, 53(4):467-478.
[14] BASILICO M Z,BASILICO J C.Inhibitory effects of some spice essential oils on Aspergillus ochraceus NRRL 3174 growth and ochratoxin a production [J].Letters in Applied Microbiology, 1999, 29(4):238-241.
[15] MALLY A, SOLFRIZZO M, DEGEN G H.Biomonitoring of the mycotoxin Zearalenone:Current state-of-the art and application to human exposure assessment [J].Archives of Toxicology, 2016, 90(6):1 281-1 292.
[16] MARIN S, VELLUTI A, RAMOS A J, et al.Effect of essential oils on zearalenone and deoxynivalenol production by Fusarium graminearum in non-sterilized maize grain [J].Food Microbiology, 2004, 21(3):313-318.
[17] 金昭.啤酒酿造过程中脱氧雪腐镰刀菌烯醇的初步研究[D].无锡:江南大学,2009.
JIN Z.Preliminary study on deoxynivalenol during beer brewing[D].Wuxi:Jiangnan University, 2009.
[18] BASSOLE I H N, JULIANI H R.Essential oils in combination and their antimicrobial properties [J].Molecules,2012, 17(4):3 989-4 006.
[19] JUGLAL S, GOVINDEN R, ODHAV B.Spice oils for the control of co-occurring mycotoxin-producing fungi [J].Journal of Food Protection, 2002, 65(4):683-687.
[20] SHARMA A, SHARMA N K, SRIVASTAVA A, et al.Clove and lemongrass oil based non-ionic nanoemulsion for suppressing the growth of plant pathogenic Fusarium oxysponun f.sp lycopersici[J].Industrial Crops and Products, 2018, 123:353-362.
[21] GILL T A, LI J, SAENGER M, et al.Thymol-based submicron emulsions exhibit antifungal activity against Fusarium graminearum and inhibit Fusarium head blight in wheat [J].Journal of Applied Microbiology, 2016, 121(4):1 103-1 116.
[22] 袁媛. 植物精油熏蒸控制玉米中真菌毒素的研究[D].北京:中国农业科学院,2013.
YUAN Y.Study on the fumigation of essential oils to control fungal toxins in corn [D].Beijing:Chinese Academy of Agricultural Sciences, 2013.
[23] SINGH G, MAURYA S, DELAMPASONA M P, et al.A comparison of chemical, antioxidant and antimicrobial studies of cinnamon leaf and bark volatile oils, oleoresins and their constituents [J].Food and Chemical Toxicology, 2007, 45(9):1 650-1 661.
[24] FERREIRA F M D, HIROOKA E Y, FERREIRA F D, et al.Effect of Zingiber officinale Roscoe essential oil in fungus control and deoxynivalenol production of Fusarium graminearum Schwabe in vitro[J].Food Additives and Contaminants Part a-Chemistry Analysis Control Exposure & Risk Assessment, 2018, 35(11):2 168-2 174.
[25] HEMALATHA T, UMAMAHESWARI T, SENTHIL R, et al.Efficacy of chitosan films with basil essential oil:Perspectives in food packaging [J].Journal of Food Measurement and Characterization, 2017, 11(4):2 160-2 170.
[26] KUMAR A, SHUKLA R, SINGH P, et al.Chemical composition, antifungal and antiaflatoxigenic activities of Ocimum sanctum L.essential oil and its safety assessment as plant based antimicrobial [J].Food and Chemical Toxicology, 2010, 48(2):539-543.
[27] 余伯良,罗惠波,周健,等.山苍子油抗霉菌及抑制黄曲霉产毒的有效成分研究[J].四川轻化工学院学报,2002(1):32-36.
YU B L, LUO H B, ZHOU J, et al.Study on the active ingredient of antibiotic activities of litsea cubeba oil on moulds and the effect on aflatoxin production[J].Journal of sichuan institute of light industry and chemical technology, 2002(1):32-36.
[28] 王新伟,杜会云,宋玉函,等.牛至油、香芹酚、柠檬醛和肉桂醛抗真菌研究[J].食品科技,2011,36(2):193-196;202.
WANG X W, DU H Y, SONG Y H, et al.Antimicrobial activity of oregano oil, carvacrol, citral and cinnamaldehyde[J].Food science and technology, 2011, 36(2):193-196;202.
[29] HYLDGAARD M, MYGIND T, MEYER R L.Essential oils in food preservation:Mode of action, synergies, and interactions with food matrix components [J].Frontiers in Microbiology, 2012,3:12.
[30] SWAMY M K, AKHTAR M S, SINNIAH U R.Antimicrobial properties of plant essential oils against human pathogens and their mode of action:An updated review [J].Evidence-Based Complementary and Alternative Medicine, 2016, 2016:3 012 462.
[31] GRIFFIN S G, WYLLIE S G, MARKHAM J L, et al.The role of structure and molecular properties of terpenoids in determining their antimicrobial activity [J].Flavour and Fragrance Journal, 1999, 14(5):322-332.
[32] TROMBETTA D, CASTELLI F, SARPIETRO M G, et al.Mechanisms of antibacterial action of three monoterpenes [J].Antimicrobial Agents and Chemotherapy, 2005, 49(6):2 474-2 478.
[33] ULTEE A, BENNIK M H J, MOEZELAAR R.The phenolic hydroxyl group of carvacrol is essential for action against the food-borne pathogen Bacillus cereus[J].Applied and Environmental Microbiology, 2002, 68(4):1 561-1 568.
[34] 罗曼.天然抗菌香精油筛选及主要抗菌成分研究[D].武汉:武汉大学,2004.
LUO M.Study on the screening of natural antibacterial essential oil and its main antibacterial components [D].Wuhan:Wuhan University, 2004.
[35] SUN Q, SHANG B, WANG L, et al.Cinnamaldehyde inhibits fungal growth and aflatoxin B-1 biosynthesis by modulating the oxidative stress response of Aspergillus flavus [J].Applied Microbiology and Biotechnology, 2016, 100(3):1 355-1 364.
[36] BAKKALI F, AVERBECK S, AVERBECK D, et al.Biological effects of essential oils-A review [J].Food and Chemical Toxicology, 2008, 46(2):446-475.
[37] 李金寒,商博,梁丹丹,等.活性氧在柠檬醛抑制黄曲霉产毒过程中的作用[J].核农学报,2016,30(7):1 316-1 322.
LI J H, SHANG B, LIANG D D, et al.ROS-related mechanism for citral-induced inhibition of aflatoxin [J].Journal of Nuclear Agricultural Sciences, 2016, 30(7):1 316-1 322.
[38] JIANG Y, WU N, FU Y J,et al.Chemical composition and antimicrobial activity of the essential oil of Rosemary [J].Environmental Toxicology and Pharmacology, 2011, 32(1):63-68.
[39] BAYDAR H,SAGDIC O,OZKAN G,et al.Antibacterial activity and composition of essential oils from Origanum, Thymbra and Satureja species with commercial importance in Turkey[J].Food Control,2004,15(3):169-172.
[40] LIANG D D, XING F, SELVARAJ J N, et al.Inhibitory effect of cinnamaldehyde, citral, and cugenol on aflatoxin biosynthetic gene expression and aflatoxin B-1 biosynthesis in Aspergillus flavus [J].Journal of Food Science, 2015, 80(12):2 917-2 924.
[41] GHOSH V, MUKHERJEE A, CHANDRASEKARAN N.Eugenol-loaded antimicrobial nanoemulsion preserves fruit juice against, microbial spoilage [J].Colloids and Surfaces B-Biointerfaces, 2014, 114:392-397.
[42] DWIVEDY A K, KUMAR M, UPADHYAY N, et al.Plant essential oils against food borne fungi and mycotoxins [J].Current Opinion in Food Science, 2016, 11:16-21.
[43] 袁媛,邢福国,刘阳.植物精油抑制真菌生长及毒素积累的研究[J].核农学报,2013,27(8):1 168-1 172.
YUAN Y, XING F G, LIU Y.Role of essential oils in the inhibition of fungal growth and mycotoxin accumulation[J].Journal of Nuclear Agricultural Sciences, 2013, 27(8):1 168-1 172.
[44] KALAGATUR N K, MUDILI V, KAMASANI J R, et al.Discrete and combined effects of Ylang-Ylang (Cananga odorata) essential oil and gamma irradiation on growth and mycotoxins production by Fusarium graminearum in maize [J].Food Control, 2018, 94:276-283.
[45] KALAGATUR N K, KAMASANI J R, SIDDAIAH C, et al.Combinational inhibitory action of Hedychium spicatum L.essential oil and gamma-radiation on growth rate and mycotoxins content of Fusarium graminearum in maize:Response surface methodology [J].Frontiers in Microbiology, 2018,9:1 511.
[46] 徐仕翔.月桂精油及其复合保鲜方法对樱桃番茄采后病害抑制效果的研究[D]:杭州:浙江大学,2016.
XU S X.Effect of laurus nobilis essential oil and its composite preservation method on the postharvest disease of cherry tomato[D].Hangzhou:Zhejiang University, 2016.
[47] 范小静,闫合,李昂,等.柠檬油微乳剂研制及对圣女果的采后保鲜效果研究[J].河北农业大学学报,2018,41(4):56-61.
FAN X J, YAN H, LI A, et al.Study on the lemon essential oil micro emulsion and the preservation effects on postharvest cherry tomato fruits[J].Journal of Hebei Agricultural University, 2018, 41(4):56-61.
[48] 赵亚珠,郝晓秀,孟婕,等.百里香精油抗菌包装纸箱对草莓保鲜效果的影响[J].食品与发酵工业,2020,46(11):258-263.
ZHAO Y Z, HAO X Z MENG J, et al.Effect of antimicrobial packaging cartons coated with thyme essential oil on quality and shelf life of strawberries [J].Food and Fermentation Industries, 2020, 46(11):258-263.
[49] WU D H, LU J, ZHONG S, et al.Effect of chitosan coatings on physical stability, antifungal and mycotoxin inhibitory activities of lecithin stabilized cinnamon oil-in-water emulsions [J].LWT-Food Science and Technology, 2019, 106:98-104.
[50] 冯文旭,吴殿辉,蔡国林,等.精油纳米乳液对禾谷镰刀菌的抑制作用[J].食品与发酵工业,2020,46(9):94-100.
FENG W X, WU D H, CAI G Q, et al.The inhibitory effect of essential oil nanoemulsions on fusarium graminearum[J].Food and Fermentation Industries, 2020, 46(9):94-100.
[51] KALAGATUR N K, GHOSH O S N, SUNDARARAJ N, et al.Antifungal activity of chitosan nanoparticles encapsulated with Cymbopogon martinii essential oil on plant pathogenic fungi Fusarium graminearum [J].Frontiers in Pharmacology, 2018, 9:610.
[52] 冯可, 胡文忠, 徐永平, 等.植物精油的抑菌活性及在鲜切果蔬中的应用[J].食品工业科技,2015,36(15):382-385;389.
FENG K, HU W Z, XU Y P, et al.Antibacterial activity of plant essential oil and the application in fresh cut fruits and vegetables [J].Science and Technology of Food Industry, 2015, 36(15):382-385;389.