抑郁症(depression)是一类精神障碍疾病[1]。据不完全统计,焦虑和抑郁[2]已成为影响国人身心健康的主要公共卫生问题。近年来大量临床研究表明,抑郁患者在抑郁症发作时,会出现下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA轴)反馈机制失调[3-4]、免疫失调与慢性炎症[5]等病理特征。伴随着探索肠道的热潮,“微生物-肠-脑轴”的研究为抑郁症的防治打开了新的窗口。
抑郁症常与胃肠疾病有极高的共病性[6],其机制涉及“微生物-肠-脑轴”功能异常。作为肠道最重要的一类细菌代谢产物,短链脂肪酸与抑郁症关联密切。短链脂肪酸(short chain fatty acids,SCFAs)由宿主摄入体内的膳食纤维等耐消化物质经肠道微生物发酵产生[7],常见的SCFAs包括乙酸、丙酸、异丁酸、丁酸和异戊酸等。SCFAs既能作为G蛋白偶联受体的激动剂[8],介导肠上皮信号,又可作为组蛋白去乙酰化酶的抑制剂[9],稳定神经系统,因此成为生命科学的研究热点之一。随着对其作用机制的阐明,SCFAs被认为是调节精神类疾病的重要信号分子[10],广泛参与调控神经递质5-羟色胺(5-hydroxytrptamine,5-HT)生成[11]、维持神经元形态[3]、缓解神经炎症[12-13]等多项生理过程,表现出巨大的抗抑郁潜力。
由于SCFAs大多气味浓烈,直接灌胃SCFAs会影响小鼠情绪,进而影响研究结果;此外,SCFAs的钠盐会被小肠吸收,无法模拟肠道菌群代谢产生SCFAs的正常生理过程。因此无论是SCFAs还是SCFAs钠盐的干预方式都无法精确体现大肠中微生物代谢产生的SCFAs对神经系统的影响。而现有研究表明,取代度(degree of substitution,DS)在0.2~0.3的酰化淀粉具有小肠酶抗性[14],这种SCFAs的衍生产物在小肠难以被吸收分解,在大肠才会被肠道微生物发酵,释放出SCFAs及气体。FUKUDA等[15]研究证实,给小鼠喂食添加了乙酰化淀粉的食物,乙酰化淀粉在小鼠的大肠内分解释放出乙酸,显著提高粪便中醋酸盐含量;WANG等[16]通过对比不同组织中SCFAs的含量,也证实了酰化淀粉的抗小肠酶水解功能。
本研究采用SCFA-酰化淀粉,实现SCFAs在大肠的定点释放,探究其对慢性应激引起的抑郁症状的缓解及其机制。
1 材料与方法
1.1 仪器与试剂
分析天平、pH计,美国METTLER TOLEDO公司;热力磁力搅拌器,德国IKA公司;真空冷冻干燥机,上海泰事达机电设备有限公司;台式高速冷冻离心机,德国Eppendorf公司;EthoVision XT 11.5动物运动轨迹跟踪系统,原制造商荷兰Noldus公司;Waters e2695高效液相色谱仪、Waters 2475荧光检测器,上海沃特世科技有限公司;PCR基因扩增仪,美国Bio-Rad公司;高通量组织研磨器,宁波新芝公司;气相色谱-质谱联用仪(GC-MS),美国Thermo Fisher Scientific公司。
高直链玉米淀粉,国药集团化学试剂有限公司;乙酸酐、丙酸酐、异丁酸酐、丁酸酐,阿拉丁生化科技股份有限公司;异戊酸酐,日本TCI公司;小鼠皮质酮(corticosterone,CS)酶联免疫分析试剂盒、小鼠促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)酶联免疫分析试剂盒,南京森贝伽生物科技有限公司;qRT-PCR相关引物,上海桑尼生物科技有限公司。
1.2 饲料的制备
1.2.1 制备酰化淀粉
酰化淀粉的制备在洪雁等[17]的方法上加以改进。将高直链玉米淀粉配制成质量分数为40%的淀粉乳。控温40 ℃,滴加酸酐,用量相当于淀粉质量的50%,用0.50 mol/L NaOH溶液调节淀粉乳液pH,期间严格控制温度和pH稳定,反应2 h。结束后用0.50 mol/L盐酸将体系pH值调整至5.70。水洗至洗液中性,冷冻干燥,得酰化淀粉。
不加酸酐,严格同上操作制备空白对照组和抑郁模型组使用的普通淀粉。
1.2.2 测定取代度
(1)样品滴定:取2 g酰化淀粉样品加入50 mL蒸馏水,以1%酚酞作为指示剂,用0.1 mol/L NaOH溶液滴定至终点。加入25 mL 0.5 mol/L NaOH准溶液,皂化反应1.5 h。盐酸滴定体系中过量的NaOH溶液[18];平行滴定3次,取均值。
(2)空白实验:取2 g原料淀粉,检测步骤同上。
(3)取代度计算如公式(1)、公式(2)所示:
(1)
(2)
式中:A,酰基质量分数,%;V1,样品组耗用的盐酸标准溶液体积,mL;V2,空白组耗用的盐酸标准溶液体积,mL;c,盐酸标准溶液浓度,mol/L;m1,样品组样品质量,g;m2,空白组样品质量,g;M,取代基的摩尔质量,g/mol(乙酰基取43,丙酰基取57,丁酰基和异丁酰基取71,异戊酰基取85);DS,酰化淀粉取代度;162,淀粉相对分子质量,g/mol[高聚体淀粉分子通式为(C6H10O5)n]。
1.2.3 制备饲料
以DS=0.25为基准换算各类酰化淀粉需要添加量。以1 000 g混合饲料为例,需要150 g的取代度为0.25的酰化淀粉,如公式(3)所示:
0.25×150=DS×m
(3)
式中:m,1 000 g混合饲料中需加入的淀粉量。
将原饲料经粉碎机破碎成细小颗粒,加入酰化淀粉,混匀,少量多次加入水,经5 mL注射器挤压成型,分类存放于-20 ℃冰箱。使用时,将饲料经过紫外照射带入屏障环境。
1.2.4 验证酰化淀粉功能
SCFAs的测定在毛丙永[19]的方法上做适当改进。称取小鼠盲肠及内容物湿重约50 mg冻干,加入饱和NaCl溶液浸泡样品,破碎至无明显颗粒。硫酸酸化,振荡均匀。加入乙醚旋涡以提取SCFAs,4 ℃、14 000 r/min离心15 min,将乙醚转移至加入0.25 g无水硫酸钠的EP管中,再次离心。将上清液转移至气相进样小瓶中,用GC-MS测定,选取各分析物标准品的特征离子进行定量分析。外标法计算样品中SCFAs的含量(μmol/g)。
1.3 动物实验与方案设计
实验动物选择SPF级的C57BL/6J雄性小鼠,6周龄,购自苏州格瑞斯威生物科技有限公司。动物实验所有操作符合江南大学实验动物管理各项规定,许可证SYXK(苏)2016-0045。动物实验方案经江南大学实验动物福利与伦理审查批准,审批号JN.No20191115c0600109[321]。经适应性饲养后,除空白对照组外,其余6组经5周的慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)造模。动物实验方案设计如图1所示。
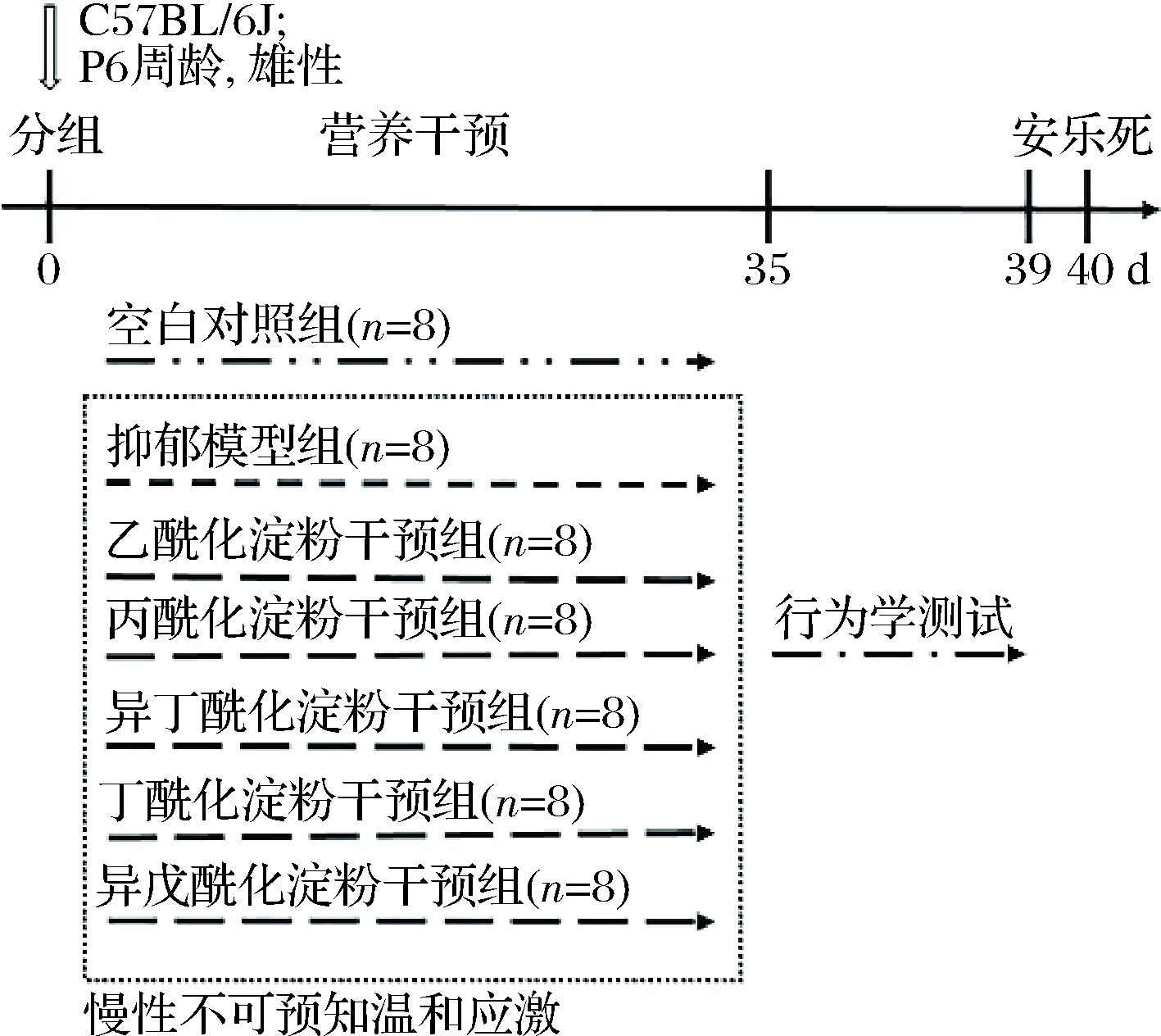
图1 动物实验方案设计
Fig.1 Animal experiment design
1.3.1 构造抑郁模型
采用CUMS结合C57BL/6J方式进行造模[20],每天随机采用1~2种刺激,并避免昼夜节律,刺激因素如表1所示。
表1 抑郁模型小鼠的造模方式
Table 1 Modeling method for depression mice

造模方式详细描述禁食禁水24 h将小鼠的饲料去除、水壶倒置潮湿垫料24 h在垫料中加入无菌水,混匀,将小鼠在潮湿垫料的条件下饲养24 h制动2 h将实验鼠置于在底部、顶部及管壁四周设有通气孔的束缚管中2 h夹尾3 min夹子距离小鼠尾尖1 cm,计时3 min持续光照24 h关闭照度灯,在照明灯的条件下饲养小鼠24 h空垫料24 h去除小鼠笼盒中的玉米芯垫料,实验鼠在笼盒中饲养24 h强迫游泳5 min将每只小鼠置于5 L烧杯中,水温(24±1) ℃,强行使其游泳5 min孤养24 h将每只小鼠单独饲养24 h
1.3.2 行为学测试
小鼠抑郁行为学的评价借助动物房的行为学实验室展开,通过EthoVision XT 11.5系统分析行为学相关指标。
1.3.2.1 旷场实验(open field test,OFT)
用镊子轻轻夹住小鼠尾部,将其放入旷场箱内底面中心,同时进行录像和计时,每只观察时间为10 min。分析小鼠在中心、边缘区域的活动情况[21]。
1.3.2.2 高架十字迷宫实验(elevated plus maze test,EPM)
实验开始时将小鼠面向开放臂放入迷宫中央格,同时进行录像和计时。记录5 min内小鼠在开放臂、闭合臂的活动情况[22]。
1.3.2.3 强迫游泳实验(forced swimming test,FST)
5 L实验桶内装有大约3 L的清水,水温在(24±1) ℃,每只小鼠进行6 min游泳测试。同时进行录像,分析3~6 min的小鼠静止、活跃和狂躁时间[23]。
1.3.3 生理指标检测
1.3.3.1 血清中HPA轴相关激素浓度的检测
采用双抗体夹心法ELISA试剂盒测定小鼠血清中ACTH和CS的含量。操作严格参考使用说明书。
1.3.3.2 结肠组织中神经递质及其前体浓度的检测
称取结肠组织50 mg,10倍稀释(预冷PBS)后进行组织匀浆,4 ℃、12 000 r/min离心15 min,取上清液,加入等体积的5%高氯酸沉淀蛋白,充分混匀,再次离心,上清液经0.22 μm水系膜过滤后,上机分析。外标法计算结肠样品中色氨酸(tryptophan,Trp)、5-羟色氨酸(5-Hydroxytryptophan,5-HTP)和5-HT的浓度[24]。
色谱条件:色谱柱为岛津Intertsil ODS-3(5 μm,4.6 mm×250 mm),流动相a为0.1 mol/L的NaAc(含0.1 mmol/L EDTA-2 Na),pH=5.10,甲醇为流动相b,流动相a∶b=85∶15,流速1.0 mL/min,激发波长为290 nm,发射波长为330 nm,进样量为10 μL。
1.3.3.3 结肠组织中色氨酸羟化酶1基因表达量的检测
取20 mg结肠组织,TRIZOL提取总RNA并立即进行反转录得cDNA模板。使用1 μL cDNA和SYBR Green Supermix在BioRad-CFX384系统上进行色氨酸羟化酶1(tryptophan hydroxylase 1,TPH1)的实时荧光定量PCR,每个样品重复3次,记录样品的循环阈值。基因表达量经由内参Gapdh归一化处理,使用2-△△Ct法进行分析小鼠结肠Tph1表达量[10]。
反应程序:95 ℃、2 min进行预变性,95 ℃、30 s,60 ℃、30 s,72 ℃、15 s条件下进行40个循环,默认程序采集融解曲线小鼠Tph1引物序列(5′-GTAGGAACCAACCAGATTCACCAT-3′;5′-CCAAGGAGAA-GATGAGAGTC-3′),小鼠Gapdh引物序列(5′-AGGTCGGTGTGAACGGATTTG-3′;5′-TGTAGACCATGTAGTTGAGGTCA-3′)。
1.4 数据分析
空白对照组和抑郁模型组的实验数据使用Turkey′s test进行比较,各酰化淀粉干预组和抑郁模型组的实验数据使用One-way ANOVA进行分析,P<0.05有统计学差异。实验结果用GraphPad Prism 8软件进行计算和绘图,使用SIMCA 14.1进行正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis, OPLS-DA)和主成分分析(principal component analysis, PCA)。
2 结果与分析
2.1 酰化淀粉的取代度
本实验采用碱法推进取代反应,得到的酰化淀粉皂化后滴定取代度。乙酰化淀粉、丙酰化淀粉、异丁酰化淀粉、丁酰化淀粉和异戊酰化淀粉的DS分别为0.22、0.25、0.22、0.26和0.28。
空白对照组和抑郁模型组小鼠所用的饲料加入不经酸酐取代、同等条件操作的淀粉,其余5组以DS=0.25为基准换算各类酰化淀粉需要添加的量。各实验组的原饲料与酰化淀粉用量情况如表2所示。
表2 干预饲料淀粉及原饲料用量
Table 2 Quantity of starch and raw feed
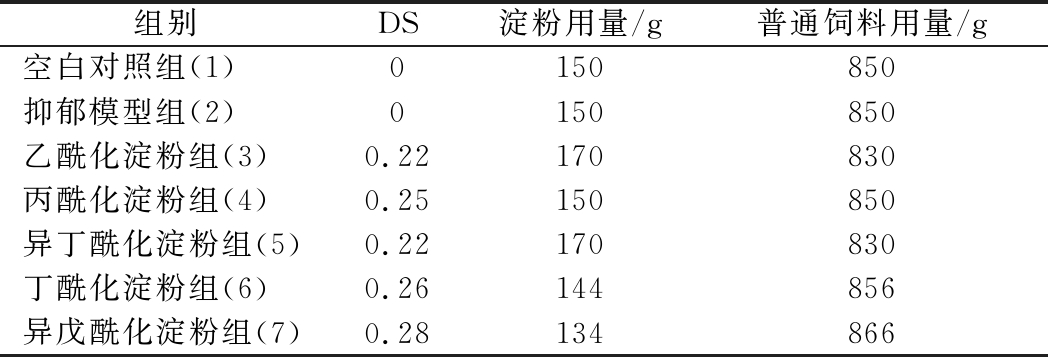
组别DS淀粉用量/g普通饲料用量/g空白对照组(1)0150850抑郁模型组(2)0150850乙酰化淀粉组(3)0.22170830丙酰化淀粉组(4)0.25150850异丁酰化淀粉组(5)0.22170830丁酰化淀粉组(6)0.26144856异戊酰化淀粉组(7)0.28134866
2.2 酰化淀粉实现大肠释放SCFAs
小鼠盲肠及内容物中SCFAs检测结果如图2所示。通过对比各组SCFAs浓度,发现补充特定的酰化淀粉能在盲肠段显著提高对应的短链脂肪酸的浓度,可以认为酰化淀粉实现了对应短链脂肪酸的大肠定点释放。此外,虽然空白对照组和抑郁模型组的饮食相同,但是抑郁模型组的小鼠大肠内乙酸和丁酸的浓度显著低于空白对照组的小鼠(P<0.05)。

a-小鼠盲肠及内容物中乙酸的浓度;b-小鼠盲肠及内容物中丙酸的浓度;c-小鼠盲肠及内容物中异丁酸的浓度;d-小鼠盲肠及内容物中丁酸的浓度;e-小鼠盲肠及内容物中异戊酸的浓度
图2 盲肠及内容物中主要SCFAs的浓度
Fig.2 Concentration of main SCFAs in cecum and contents
注:ns表示没有统计学差异;#表示P<0.05,##表示P<0.01;*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1(下同)
2.3 SCFAs改善行为表型
为评价酰化淀粉对抑郁和焦虑症状的缓解作用,采用旷场实验、高架十字迷宫实验和强迫游泳实验对小鼠的行为进行测试。分别就旷场实验中小鼠第一次潜伏期时间和小鼠在中心区域的移动距离占总移动距离比例(%)、高架十字迷宫实验中小鼠在开放臂活动时间占总时间比例(%)和强迫游泳实验中小鼠静止漂浮时间占总统计时间比例(%)进行评估,实验结果如图3所示。
空白对照组和抑郁模型组小鼠之间的焦虑及抑郁行为存在显著差异(P<0.01),而酰化淀粉的干预表现出了不同程度的抗焦虑、抗抑郁效果。在旷场实验中,异丁酰化淀粉干预组(P<0.05)、丁酰化淀粉干预组(P<0.01)和异戊酰化淀粉干预组(P<0.001)的小鼠的第一次潜伏期显著低于抑郁模型组的小鼠,并且异丁酰化淀粉干预组(P<0.05)的小鼠在中心区域移动的距离显著高于抑郁模型组,这提示异丁酸、丁酸和异戊酸可能对小鼠探索未知环境的焦虑有潜在的缓解作用;在高架十字迷宫实验中,各组小鼠在开放臂的停留时间无统计学差异,但是酰化淀粉干预的各组小鼠表现出在开放臂中停留时间增加的趋势;在抑郁相关的行为测试方面,强迫游泳实验中,空白组和模型组之间存在显著差异(P<0.05),而酰化淀粉干预的各组别无显著差异,部分组别出现静止漂浮时间延长的趋势,这和预期并不完全一致。先前有研究者提出,一定剂量的丁酸处理对于急性抑郁和焦虑模型的整体活动并没有影响,甚至使其在强迫游泳测试中表现出了更大的不活跃性[25]。这表明丁酸对情绪的调节作用仍需要进一步确认。

a-旷场实验:小鼠第一次潜伏期;b-旷场实验:小鼠在中心区域移动距离占总移动距离的比例;c-高架十字迷宫实验:
小鼠在开放臂停留时间占总时间比例;d-强迫游泳实验:小鼠静止漂浮时间占总时间比例
图3 行为学测试结果
Fig.3 Results of behavioral tests
2.4 SCFAs修复HPA轴功能
测定小鼠血清中ACTH和CS的浓度,ELISA结果如图4所示。抑郁模型组的血清ACTH和CS的浓度显著高于空白组(P<0.01),而乙酰化淀粉(P<0.01)、丙酰化淀粉(P<0.01)和异丁酰化淀粉(P<0.01)的干预使得小鼠体内ACTH的水平接近于空白对照组的小鼠,并且乙酰化淀粉(P<0.05)、异丁酰化淀粉(P<0.05)和丁酰化淀粉(P<0.01)的干预会降低小鼠体内CS的含量。这表明乙酸和丁酸能通过调节神经-内分泌系统,使应激激素恢复到正常水平,进而缓解小鼠HPA轴亢进。大量临床研究表明,抑郁患者常伴随着HPA轴亢进的症状。长期应激状态下,高浓度的糖皮质类激素使得海马体萎缩、调节HPA轴负反馈的能力下降,形成了恶性循环[26]。赵丹阳[27]提出,肠道微生物中,拟杆菌属和普雷沃氏菌科等菌群的丰度与ACTH的水平呈正相关,GAREAU等[4]发现服用乳酸菌能够降低母婴分离诱导的异常高的CS水平,并且束缚应激的大鼠服用乳酸菌后过度亢进的HPA轴活动能够恢复正常[28]。有研究明确指出,SCFAs作为主要的肠道菌群代谢产物,摄入后可以降低促皮质素释放激素水平[29],而人体循环中SCFAs的增加会随着皮质醇对社会心理压力反应的减弱而显著协变[30],并且可以缓解伴随炎症[5]。本文结果印证了先前的报道。尽管如此,GAGLIANO等[31]的研究表明,高剂量(1 200 mg/kg)的丁酸也具有应激作用,能够显著提高血浆中ACTH和CS的外周水平,诱导压力应激行为。因此,SCFAs和抑郁调节之间的量效关系仍需进一步探究。
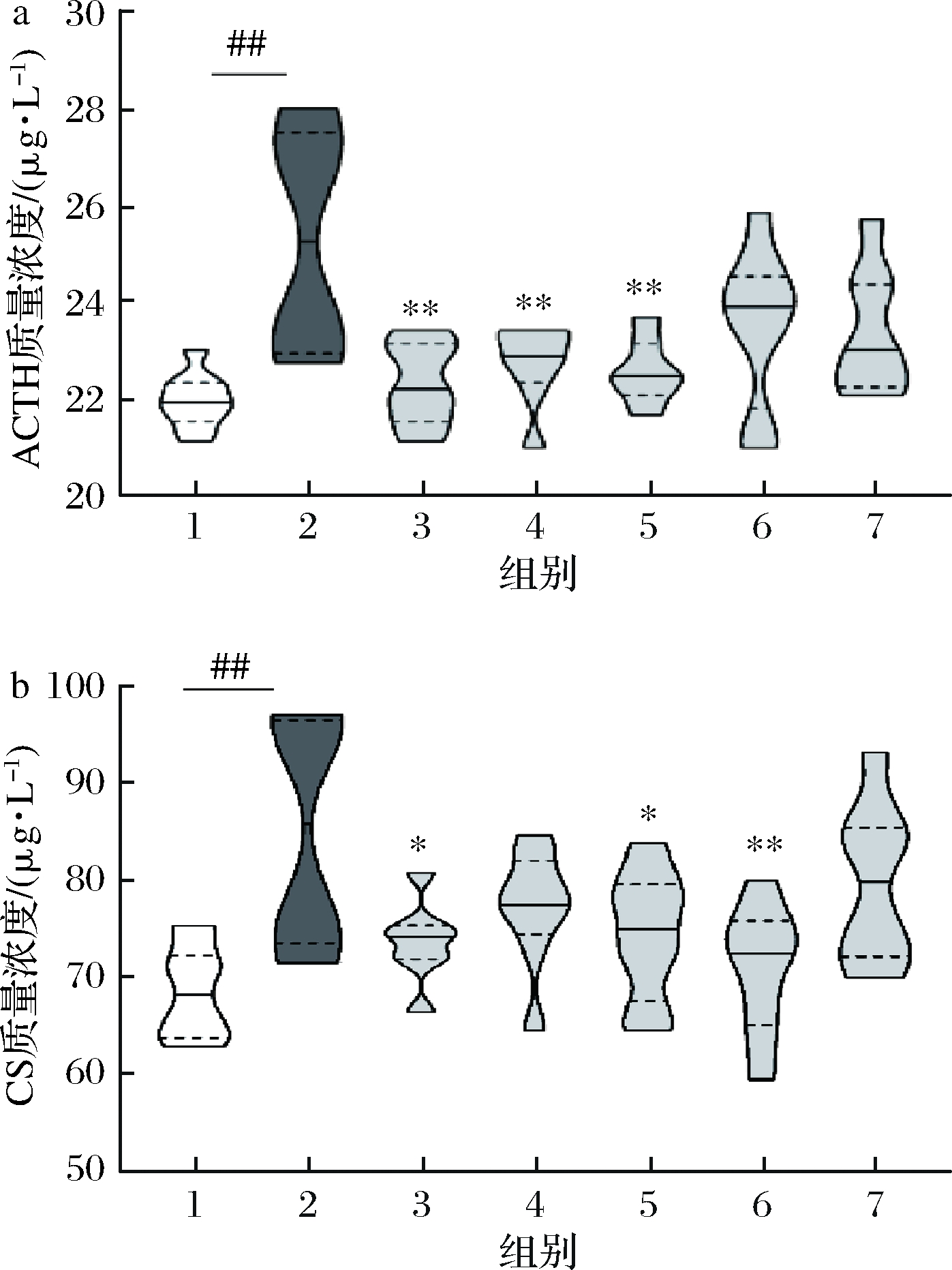
a-小鼠血清中ACTH的质量浓度;b-小鼠血清中CS的质量浓度
图4 HPA轴亢进相关的激素浓度
Fig.4 Concentration of hormone related to HPA axis hyperactivity
2.5 SCFAs影响神经递质合成
肠道中,L-Trp经TPH1转化可以得到5-HTP,5-HTP进而在脱羧酶的作用下转变成5-HT,是体内神经递质5-HT合成的主要来源[11]。Tph1的基因表达量参见图5,抑郁模型组小鼠Tph1表达量显著低于空白模型组(P<0.05),表明CUMS造成的抑郁小鼠其结肠内Trp向5-HTP及5-HT的转变受到了影响;而部分SCFAs,尤其是异丁酸(P<0.05)的摄入,能够恢复小鼠结肠内Trp向5-HTP及5-HT的转变过程,同时乙酸和丁酸也表现出了增强Tph1转录的特性,尽管没有显著性。我们的结果与先前的研究结论类似。REIGSTAD等[32]发现,恢复无菌小鼠的肠道菌群进而产生的SCFAs促进了肠嗜铬细胞模型——BON细胞中的Tph1转录,可以显著增强Trp向5-HTP的转变。并且肠道产孢子菌及其代谢产物(如丙酸盐和丁酸盐等)显著提高了小鼠肠道合成5-HT的功能[33]。SCFAs逆转了小鼠体内的低Tph1 mRNA水平,是影响5-HT合成的重要因素。
采用HPLC-荧光检测法对小鼠结肠组织的Trp、5-HTP和5-HT的浓度进行检测,实验结果如图6所示。可以看到,5类酰化淀粉的干预(相当于对应SCFAs的摄入)可以显著增加结肠内的Trp浓度,这表明SCFAs的摄入可能影响了肠道菌群的结构,从而使得由肠道微生物代谢蛋白质产生的Trp增多。但从结肠5-HTP、5-HT的水平变化来看,抑郁模型组小鼠结肠5-HT却显著(P<0.05)高于空白对照组,尽管其前体5-HTP的水平在空白对照组和抑郁模型组的小鼠之间没有显著性变化,并且与Tph1转录情况并不完全一致,这可能由于模型动物处于一种代偿性应激的状态,从而使得神经递质及其前体处于一个短暂升高的阶段。但可以肯定的是,SCFAs的摄入,尤其是乙酸和丁酸,均可以使CUMS造成的5-HT水平异常向正常恢复。
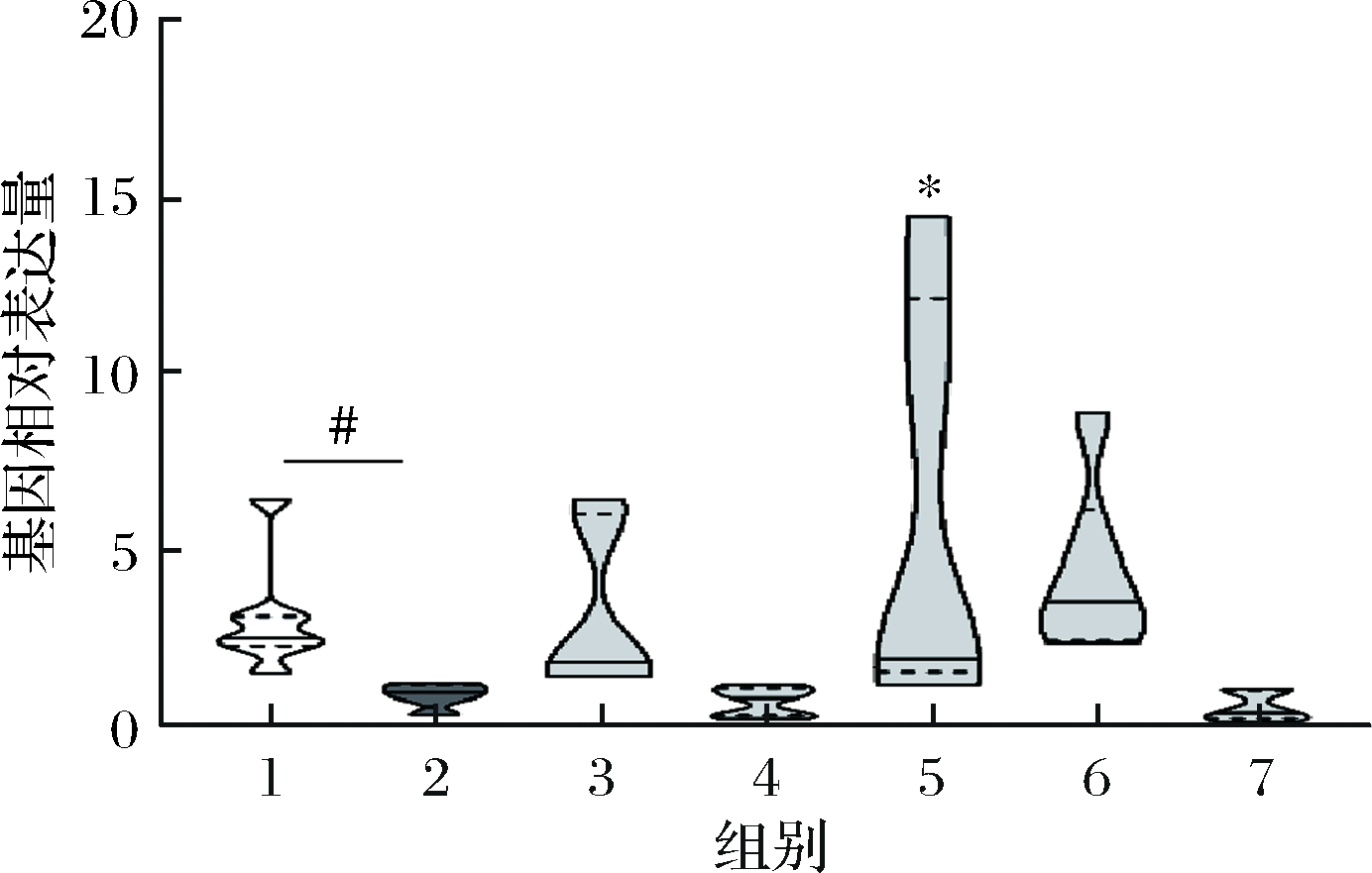
图5 小鼠结肠Tph1基因的相对表达量
Fig.5 Relative expression of Tph1 gene in mouse colon
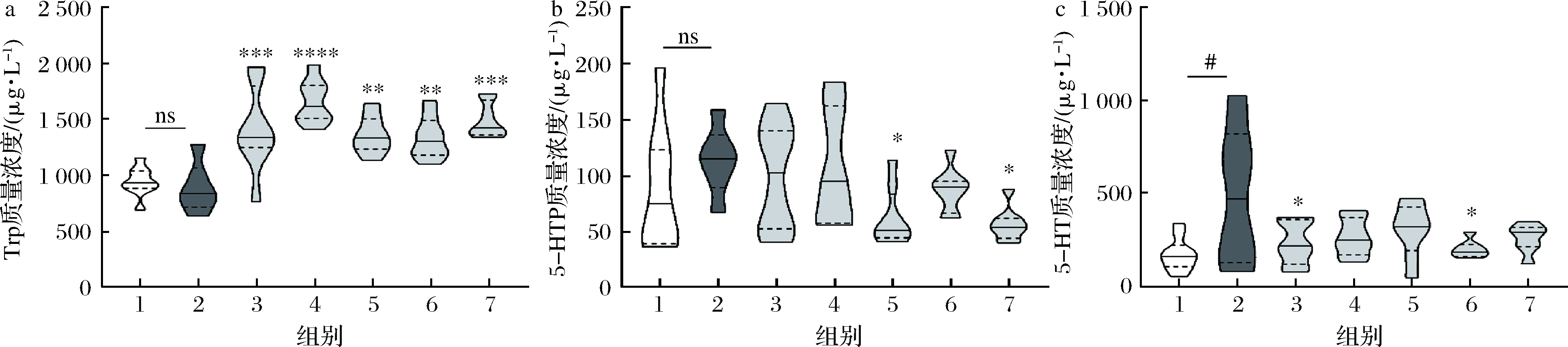
a-小鼠结肠中Trp的质量浓度;b-小鼠结肠中5-HTP的质量浓度;c-小鼠结肠中5-HT的质量浓度
图6 小鼠结肠中5-HT及其前体的浓度
Fig.6 Concentration of 5-HT and its precursors in mice colon
通过正交偏最小二乘法分析空白对照组和抑郁模型组小鼠的组间差异,得到OPLS-DA得分图,采用主成分分析对以上行为学及生理指标的实验结果进行降维处理,得到PCA载荷图(相关性图)。由图7-a可知,空白对照组和抑郁模型组在水平方向的差异证实了抑郁模型构建的有效性,在图7-b中,乙酰化淀粉干预组、异丁酰化淀粉干预组及丁酰化淀粉干预组的小鼠与空白对照组的各项指标的相关性较强,这提示乙酸、异丁酸和丁酸均能在一定程度上缓解抑郁症状,使得小鼠的行为表型与生理指标逐渐恢复到正常水平。此前,MARCEL等[29]发现,将乙酸钠、丙酸钠和丁酸钠的混合药物添加到饮水中进行干预,SCFAs组在行为学测试中表现出抗抑郁和抗焦虑特异性。我们的实验结果与先前报道一致。
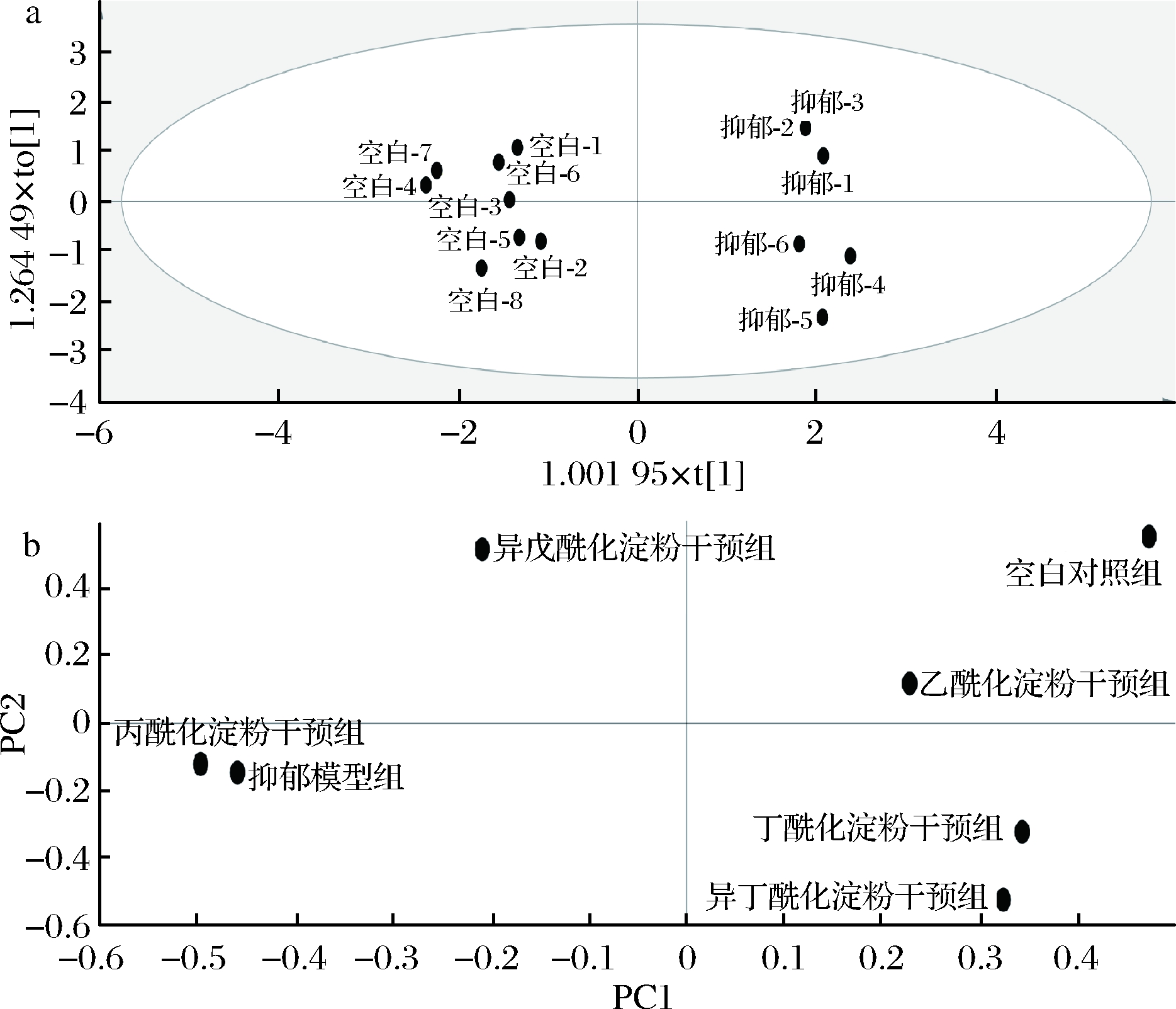
a-OPLS-DA得分图;b-PCA载荷图
图7 数据统计分析
Fig.7 Statistical analysis of data
3 结论与展望
在本文中,首次采用了SCFA-酰化淀粉的形式,实现了对应短链脂肪酸在肠道的定点释放,并证明了乙酸、异丁酸和丁酸均能在一定程度上缓解抑郁样行为;相较于对行为表型的影响,SCFAs调节生理指标的效果更加显著。在CUMS造模下,小鼠出现HPA轴亢进,分泌大量的应激激素并进入循环,体内5-HT及其前体水平出现紊乱,经过5周的酰化淀粉饮食干预,SCFAs使得小鼠体内ACTH和CS浓度逐渐恢复正常,对神经系统起到保护作用,稳定小鼠体内神经递质水平,缓解小鼠抑郁样症状。
由于人体肠道菌群是一个复杂的动态体系,SCFAs 通过“微生物-肠-脑轴”系统影响抑郁症的机制仍有很多未解的谜题,如SCFAs在肠道内的作用靶点、对宿主原生肠道微生物的影响、体内转运涉及的相关通路与受体等。此外,肠道微生物代谢产生的SCFAs生理浓度是否能有效到达大脑、进而直接参与体内神经调节,还需要更多证据来验证。对SCFAs作用机制更为详尽的探究,将为营养健康和疾病的精准干预提供更加坚实可靠的理论依据。
[1] HUANG Y, WANG Y, WANG H, et al.Prevalence of mental disorders in China:A cross-sectional epidemiological study [J].The Lancet Psychiatry, 2019, 6(3):211-224.
[2] CRASKE M G, STEIN M B.Anxiety [J].The Lancet, 2016, 388(10 063):3 048-3 059.
[3] ERNY D, ANGELS A L H D,JAITIN D, et al.Host microbiota constantly control maturation and function of microglia in the CNS [J].Nature Neuroscience, 2015, 18(7):965-977.
[4] GAREAU M G, JURY J, MACQUEEN G, et al.Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation [J].Gut, 2007, 56(11):1 522-1 528;1 587.
[5] LI B, GUO T, QU F, et al.Matrix-assisted laser desorption ionization:Time of flight mass spectrometryidentified models for detection of ESBL-producing bacterial strains [J].Med Sci Monit Basicres, 2014, 20:176 183.
[6] 陈卫,田培郡,张程程,等.肠道菌群与人体健康的研究热点与进展[J].中国食品学报,2017,17(2):1-9.
CHEN W, TIAN P J, ZHANG C C, et al. New progress of research on gut microbiota and human health[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(2): 1-9.
[7] KOH A, VADDER F D, KOVATCHEVA-DATCHARY P, et al.From dietary fiber to host physiology:Short-chain fatty acids as key bacterial metabolites[J].Cell, 2016, 165(6):1 332-1 345.
[8] COX H M, TOUGH I R, WOOLSTON A M, et al.Peptide YY is critical for acylethanolamine receptor Gpr119-induced activation of gastrointestinal mucosal responses [J].Cell metabolism, 2010, 11(6):532-542.
[9] REOLON G K, MAURMANN N, WERENICZ A, et al.Posttraining systemic administration of the histone deacetylase inhibitor sodium butyrate ameliorates aging-related memory decline in rats [J].Behavioural brain research, 2011, 221(1):329-332.
[10] TIAN P, WANG G, ZHAO J, et al.Bifidobacterium with the role of 5-hydroxytryptophan synthesis regulation alleviates the symptom of depression and related microbiota dysbiosis [J].J Nutr Biochem, 2019, 66:43-51.
[11] BELLONO N W, BAYRER J R, LEITCH D B, et al.Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways[J].Cell, 2017, 170(1):185-198;216.
[12] CAVAGLIERI C R, NISHIYAMA A, FERNANDES L C, et al.Differential effects of short-chain fatty acids on proliferation and production of pro- and anti-inflammatory cytokines by cultured lymphocytes [J].Life Sciences, 2003, 73(13):1 683-1 690.
[13] FROST G, SLEETH M L, SAHURI-ARISOYLU M, et al.The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism [J].Nature communications,2014, 5(1):1-11.
[14] 于瀛.乙酰化马铃薯淀粉微晶的制备、性能及应用研究[D].沈阳:沈阳工业大学,2014.
YU Y. Study on preparation, property and application of acetylated microcrystalline potato starch[D].Shenyang:Shenyang University of Technology, 2014.
[15] FUKUDA S, TOH H, HASE K, et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate [J].Nature, 2011, 469(7 331):543-547.
[16] WANG L, CEN S, WANG G, et al.Acetic acid and butyric acid released in large intestine play different roles in the alleviation of constipation [J].Journal of Functional Foods, 2020, 69:103 953.
[17] 洪雁,戴栋栋,顾正彪,等.一种制备丁酸酯淀粉的方法:江苏省,CN109400725A[P].2019-03-01.
HONG Y, DAI D D, GU Z B, et al. Method for preparing butyrate starch: Jiangsu Province, CN109400725A[P].2019-03-01.
[18] 高静, 罗志刚, 董华壮,等.低取代度木薯淀粉醋酸酯的制备及理化性质的研究[J].现代食品科技, 2008, 24(8):756-758;769.
GAO J, LUO Z G, DONG H Z, et al. Study on preparation and properties of cassava acetate starch with low degree of substitution[J]. Modern Food Science and Technology, 2008, 24(8): 756-758;769.
[19] 毛丙永.功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学,2015.
MAO B Y. Effects of functional oligosaccharides on the gut bacteria and the mechanism[D]. Wuxi:Jiangnan University, 2015.
[20] BUROKAS A, MARTIN-GARCIA E, GUTIERREZ-CUESTA J, et al.Relationships between serotonergic and cannabinoid system in depressive-like behavior:A PET study with [11C]-DASB [J].Journal of Neurochemistry, 2014, 130:126-135.
[21] 王维刚,刘震泽,吴文婷,等.小鼠动物实验方法系列专题(七)旷场实验在小鼠行为分析中的应用[J].中国细胞生物学学报,2011, 33(11):1 191-1 196.
WANG W G, LIU Z Z, WU W T, et al. The use of open field test in the behavior analysis of mice[J]. Chinese Journal of Cell Biology, 2011, 33(11): 1 191-1 196.
[22] WALF A A, FRYE C A.The use of the elevated plus maze as an assay of anxiety-related behavior in rodents [J].Nature Protocols, 2007, 2(2):322.
[23] TIAN P, O′RIORDAN K J, LEE Y K, et al.Towards a psychobiotic therapy for depression:Bifidobacterium breve CCFM1025 reverses chronic stress-induced depressive symptoms and gut microbial abnormalities in mice [J].2020, 12:100 216.
[24] TIAN P, ZOU R, SONG L, et al.Ingestion of Bifidobacterium longum subspecies infantis strain CCFM687 regulated emotional behavior and the central BDNF pathway in chronic stress-induced depressive mice through reshaping the gut microbiota[J].Food & Function, 2019, 10(11):7 588-7 598.
[25] GUNDERSEN B B, BLENDY J A.Effects of the histone deacetylase inhibitor sodium butyrate in models of depression and anxiety [J].Neuropharmacology, 2009, 57(1):67-74.
[26] 左玲俊,徐俊冕.HPA轴功能与抑郁症[J].中国心理卫生杂志, 2001(2):112-113;109.
ZUO L J, XU J M. HPA axis function and depression[J]. Chinese Mental Health Journal, 2001(2):112-113;109.
[27] 赵丹阳.基于肠道微生物对HPA轴的调控作用探讨通腑降浊方治疗IBS-C模型大鼠的机制研究[D].石家庄:河北医科大学, 2018.
ZHAO D Y. Researching the mechanism of Tongfujiangzhuo prescription for the treatment of IBS-C based on the regulation effect of intestinal microflorae on HPA axis[D]. Shijiazhuang:Hebei Medical University, 2018.
[28] AIT-BELGNAOUI A, DURAND H, CARTIER C, et al.Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats [J].Psychoneuroendocrinology, 2012, 37:1 885-1 895.
[29] MARCEL V D W, BOEHME M, LYTE J M, et al.Short-chain fatty acids:Microbial metabolites that alleviate stress-induced brain-gut axis alterations [J].J Physiol, 2018, 596(20):4 923-4 944.
[30] DALILE B, VERVLIET B, BERGONZELLI G, et al.Colon-delivered short-chain fatty acids attenuate the cortisol response to psychosocial stress in healthy men:A randomized, placebo-controlled trial [J].Neuropsychopharmacology, 2020,45(13):2 257-2 266.
[31] GAGLIANO H, DELGADO-MORALES R, SANZ-GARCIA A, et al.High doses of the histone deacetylase inhibitor sodium butyrate trigger a stress-like response [J].Neuropharmacology, 2014, 79:75-82.
[32] REIGSTAD C S, SALMONSON C E, RAINEY J F, et al.Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells [J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology,2015, 29(4):1 395-1 403.
[33] YANO J M, YU K, DONALDSON G P, et al.Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis [J].Cell, 2015, 161(2):264-276.