由水产食物引发的过敏性疾病作为重要的食品安全问题受到越来越多的关注,水产品的过敏反应由水产品本身或水产品接触的各种非水产成分(包括各种污染物,如寄生虫、细菌、化学添加剂等)引起[1]。近些年来,水产品生产量和贸易出口量不断增加,由其引发的过敏性疾病发病率持续上升,给食物过敏患者的身体健康造成了威胁[2]。据统计,亚洲儿童食物过敏人群中,甲壳类水产品引发的过敏反应占39%,鱼类占13.2%;而在成人中,甲壳类、软体类水产品的过敏反应引发率分别为33.8%、18.9%[3-4]。由此可见,水产品引发食物过敏是我们必须重视的食品安全问题。
食物过敏在医学领域被习惯性称作变态反应,指外来抗原首次接触机体,机体免疫细胞分泌相应的抗体来抵抗抗原的刺激,当同一种抗原再次刺激机体,细胞产生免疫反应,组织发生损伤或生理机能出现障碍[5]。目前还没有有效的措施来治疗食物过敏,只能通过人为避免接触过敏原或在食品生产过程中,选用合适的加工技术消减致敏蛋白的致敏性。常见的食品加工技术按其作用原理可分为物理加工法、化学修饰法和生物处理法三大类,但热处理[6]、辐照技术[7]、超声波[8]等物理方法需特定的设备且消减效果一般,还会对食品品质造成影响;糖基化修饰[9]、强酸[10]、强碱水解[11]等化学方法处理过程较复杂,条件较难掌控,需要一定成本,且会降解其他蛋白质并影响食物口感;而酶改性[12]、发酵[13]、基因改良[14]等生物加工技术成本低,操作简便,在不破坏营养品质的基础上可改善食品特性,因此被广泛应用于食品加工行业,成为过敏原消减领域新的研究热点。本文综述了酶改性、发酵、基因改良等生物加工技术及其优缺点,概括了利用生物加工技术消减水产品过敏蛋白致敏性的研究现状以及消减机制,以期为今后利用生物加工技术开发低致敏性水产加工食品提供理论指导。
1 水产品的主要过敏原
近年来,国内外学者对食用水产品引起的过敏反应的研究不断深入,常见的含有致敏蛋白的水产食物有硬骨鱼类、甲壳类、贝类及一些软体动物[15]。硬骨鱼类的主要致敏蛋白为小清蛋白(parvalbumin, PV),它富含于鱼类的肌肉组织中,在水中溶解度极高,在高温与酶的作用下不易被破坏,包括α和β两种类型,分子质量约12 kDa,且不同种类鱼肉中的PV同源性较高[16-17]。农小献等[18]通过 X-射线衍射谱技术发现鲤鱼PV的三级结构中有 6 个 α 螺旋,且它们两两结合成相同的蛋白体。甲壳类、贝类及软体动物的主要致敏蛋白为原肌球蛋白(tropomyosin, TM))、精氨酸激酶(arginine kinase, AK)和肌钙结合蛋白(sarcoplasmic calcium-binding protein,SCP)[19-20]。TM广泛存在于甲壳类水产品和蛤蜊、贻贝等软体动物的肌肉或非肌肉组织中,它的超螺旋结构中含有7个交互的肌动蛋白结合位点,相对分子质量在32~40 kDa,结构稳定且耐高温[21]。AK最早发现于贝类水产品中,主要以单体形式存在,极少情况以二聚体形式被发现。AK结构复杂,有研究表明,斑节对虾AK的N端结构域包含α-螺旋,而C端结构域由α-螺旋和β-折叠混合组成[22]。它的分子质量为40 kDa左右,与原肌球蛋白的不同之处在于,AK不耐热,在热的作用下,AK会形成多聚体[23]。SCP最早在斑节对虾和太平洋白虾中被发现,分子质量大约在20 kDa,它的结构和功能与脊椎动物体内PV的结构和功能相似性极高。有报道称,SCP 具有多态性(SCP-I, SCP-II和SCP-III),其中SCP-I和SCP-III与IgE的结合能力比SCP-II大[24]。
此外,肌球蛋白轻链(myosin light chain,MLC)[25]、肌钙蛋白(troponin C,TnC)[26]、血蓝蛋白(hemocyanin,HMC)[27]、磷酸丙糖异构酶(triosephosphate isomerase,TPI)[28]、鱼类胶原蛋白[29]、烯醇酶和肌酸激酶[30]等也相继被国内外研究人员确认为水产品的新型过敏原。表1列举了常见水产品的主要过敏蛋白及来源品种,具体如下:
表1 常见的水产品过敏蛋白
Table 1 Common allergic proteins in aquatic products

门主要过敏蛋白主要来源品种硬骨鱼 PV鲤、鳕、鲈、鳙、鲭、鲑等软体动物TM、AK鲍、蛤蜊、贻贝、牡蛎、章鱼等甲壳纲 TM、HMC、AK、MLC、SCP蟹、虾、龙虾等
2 生物加工技术对水产品过敏原致敏性的消减研究
以“enzyme,aquatic products, allergy”、“fermentation,aquatic products, allergy”、“genetic modification,aquatic products, allergy”分别为关键词,在web of science中共检索到2 995篇文献,其中利用生物加工技术消减硬骨鱼类过敏原致敏性的发表文章数为1 980篇,甲壳类和贝类为728篇,而利用生物加工技术消减软体动物类过敏原致敏性的发表文章数较少,仅287篇。近五年发表文章数占全部检索文献的25%,其中硬骨鱼类占15.1%,甲壳类和贝类占8.2%,软体动物类占1.7%,且总体来说,利用生物加工技术消减水产品过敏原致敏性的文章发表数呈现逐年递增趋势(图1)。这些数据表明,近些年来,生物加工技术对水产品过敏原致敏性的消减研究已经引发了科研人员极大的兴趣,成为了当前的一个研究热点。
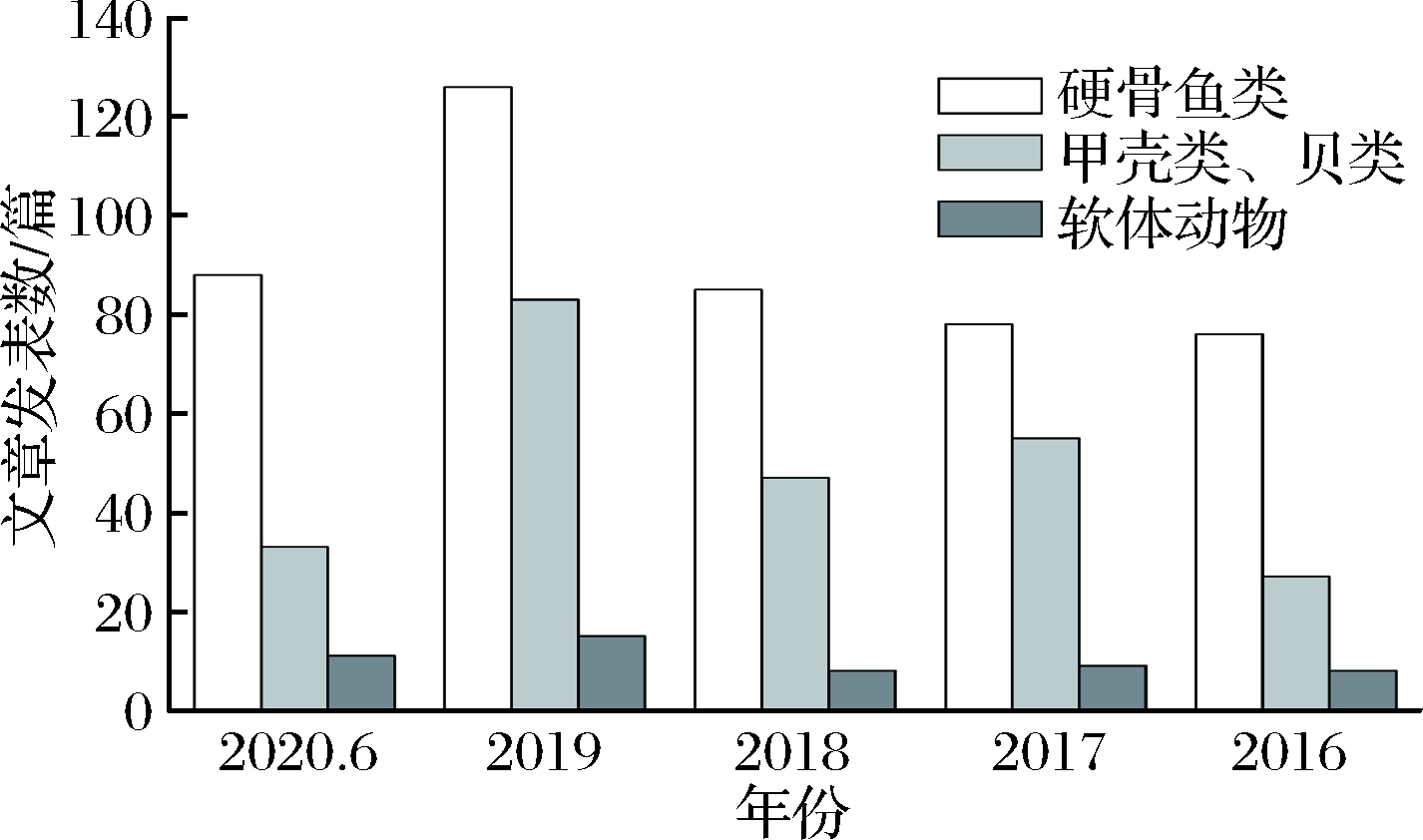
图1 年份-文章发表数
Fig.1 Year-article publications
2.1 酶改性技术
酶改性技术的原理是致敏蛋白被蛋白酶水解成多肽或氨基酸等小分子物质,或蛋白质在酶的作用下发生分子内或分子间的交联反应从而促使蛋白的交联聚合,致敏蛋白的空间结构遭到破坏,致敏性会随之发生改变[31]。MEJRHIT等[32]研究在消化液中虾原肌球蛋白的致敏性是否稳定存在,间接ELISA和斑点免疫印迹结果表明,原肌球蛋白在人工胃液中极其不稳定,在胃蛋白酶水解作用下显示出IgE结合能力的下降,这可能是因为原肌球蛋白的空间结构在蛋白酶的作用下发生了变化,造成其致敏性的改变。TIAN等[33]评价在不存在和存在咖啡酸的情况下,与酪氨酸酶(tyrosinase,Tyr)交联后,大菱鲆的PV与IgG结合能力的变化,SDS-PAGE结果显示,在交联的PV中出现了更高的分子质量谱带(24,36 kDa)且交联PV的二级结构变得松散无序。蛋白免疫印迹和间接ELISA观察到在Tyr处理后PV带的强度降低,交联PV的IgG结合能力降低了34.94%,荧光和紫外线吸收光谱分析也显示酶法交联后PV结构发生较大变化,结构的改变影响了PV的免疫活性。王学丽等[34]模拟TM的胃肠消化,采用质谱技术分析消化产物中氨基酸组成和序列是否发生变化,发现胃肠消化2 h 后,虽仍存在 3 个不被破坏的抗原表位(肽段 111~125、137~141、153~161)和 4 个抗消化能力很强的抗原表位(肽段 50~66、144~151、145~164、150~163),但胃蛋白酶会破坏TM 的大部分抗原表位,对其致敏性产生一定影响。由此可见,酶改性技术利用蛋白酶的水解作用或酶促交联反应,使得致敏蛋白的空间结构遭到破坏,氨基酸组成与序列发生改变,致敏表位遭到破坏,其致敏性由此发生变化。
2.2 发酵技术
利用乳酸菌发酵是当前应用较多的一种食品加工工艺,难溶解的大分子物质在乳酸菌分泌物的作用下分解为易溶的小分子物质[35],通过改变食品中各组分的占比,使致敏蛋白的结构和性质发生变化,致敏性随之改变。乳酸菌还可以调节相关炎症因子的释放,提升血清中IgA、IgM的水平[36],调节CD3+、CD4+和CD8+T细胞的占比分配,改善肠道菌群的失衡状态进而提高机体免疫能力,缓解食物过敏引起的不良反应[37]。高卿等[38]利用木糖葡萄球菌(Staphylococcus xylosus,Sx)发酵海鲈鱼,实验结果表明随着发酵过程的进行,海鲈鱼中的大量蛋白质发生降解,虽发酵初期降解效果不明显,但发酵60 h后PV的IgG、IgE结合能力分别下降了26.9%、22.3%,IgG、IgE结合能力的变化与PV空间结构的变化有密不可分的关系。傅玲琳等[39]通过体外实验研究5 种乳酸菌对小鼠致敏性的影响差异,发现其中芽孢乳酸菌 09.712对小鼠的抗过敏能力最强,利用体内检测法测定芽孢乳酸菌09.712治疗前后的致敏小鼠血清中特异性抗体、脾脏T淋巴细胞亚群等的含量变化,研究乳酸菌缓解食物过敏的免疫调节机理,结果表明,Th0细胞的分化受到芽孢乳酸菌的调控,它有利于Th1和Treg细胞的生成,而Th2细胞的生成受到抑制,IFN-γ等抗炎因子分泌量激增并被大量表达出来,这样有利于调节Th1/Treg/Th2的动态免疫平衡,从而减少过敏原对小鼠肠黏膜的刺激,这可能是其抑制过敏反应的机理之一。由此可见,乳酸菌不仅可以将大分子蛋白降解为小分子肽或氨基酸,还可以通过改善肠道菌群的失衡状态,调节炎症因子的释放,增强机体对外来致敏食物的免疫力,进而改善机体的过敏症状。
2.3 基因改良
基因改良技术是近年来迅速发展起来的一项新型生物技术,这项技术从生物遗传学的角度出发,聚焦于引发过敏反应的源头物质,通过改良或消除关键抗原表位的编码基因,使改良后的编码基因不能按照原先的方式参与蛋白表达过程,从而影响其致敏性。有研究表明, 反义技术可以达到改良或消除抗原表位的编码基因的目的,如首先在体外人工合成一条短链RNA,然后将其导入体内,它会对同源互补 mRNA起到降解作用,因此致敏基因会发生改变。另一种方法的原理为体内特异性基因的表达被人工导入的基因片段所抑制,这两种方法都可以改良致敏蛋白的编码基因,进而影响其致敏性[40]。
REESE等[41]通过诱发突变实验改变虾过敏原的表位组成,消减其致敏性,首先采用测试分析手段选定了5个可以识别IgE反应的关键致敏表位以及几个对IgE Ab结合能力具有较大影响的氨基酸位置,在此基础上,利用非过敏性脊椎动物的原肌球蛋白把虾过敏原的IgE识别肽替换掉,测试替换前后它们与IgE Ab的反应能力差异,然后将其关键IgE表位断开,再重新组合一个新的蛋白VR9-I,结果发现诱变后的过敏原蛋白的氨基酸序列出现变化,免疫反应性明显降低,致敏性降低了98%;WAI等[14]通过定点诱变和表位缺失两种技术方法改变TM的表位组成与结构,结果显示,当TM已知的8个表位被除去或者被鱼的相应氨基酸序列替换后,TM致敏性会发生明显变化。由此可见,基因改良技术可以将过敏原的关键致敏表位破坏或者改变,表位致敏性发生变化,且基因改良技术通过改变过敏原的线性表位和构象表位组成比例,产生新的氨基酸序列,影响了抗原表位的表达过程[42],从而达到改变致敏性的目的。
3 各生物加工技术对过敏原消减作用的比较
目前已知的用于消减过敏原致敏性的生物加工技术的优缺点见表2。酶改性技术反应条件温和, 不会损坏食品中的其他物质特别是营养元素, 还有可能产生一些具有特殊生理功能的活性肽,但酶改性效果受到酶种类、酶改性条件等因素的共同影响, 因此可能会产生一些降低食品风味体验的物质,如苦味肽;微生物发酵法降低食物致敏性并不是适合于所有的过敏食物,但发酵处理后的食品,营养成分不会被破坏,还有助于各类营养物质被人体最大程度化吸收;基因改良技术可以改变抗原表位组成,高效消减过敏原致敏性,但可能会引入新的抗原决定簇,诱导机体产生其他不良反应;联合技术虽消减过敏原致敏性的效率很高,但操作较复杂,且可能会影响风味。
表2 生物加工技术对致敏蛋白消减作用比较
Table 2 Comparison of the reduction effect of bioprocessing technology on allergenic proteins

生物加工技术作用机理优点缺点参考文献酶改性技术水解抗原,使分子量减小,结构变简单,掩盖或消除抗原决定簇高效且可控影响风味/产苦味肽[43-44]发酵抗原表位被掩盖或暴露后被破坏,可能改变二、三级结构高效简单无污染影响风味[45-46]基因改良抗原表位发生变化,一、二、三级结构改变非常高效成本高,不易控制[14,41]联合技术蛋白质活性变化,抗原表位暴露,结构更大程度改变非常高效复杂且可能影响风味[47-48]
4 展望
随着水产品市场的不断扩大,食物过敏反应日趋严重和复杂,因此水产品过敏原致敏性的消减受到越来越多学者的关注。但目前的研究主要集中在采用不同食品加工技术消减硬骨鱼类及甲壳类水产品中过敏原的致敏性,对其消减机理的研究较少,且涉及到机理研究的多为物理和化学消减方法,而生物加工技术对过敏原致敏性的消减机理研究甚少。因此,在今后的研究中,有必要深入研究生物加工技术对过敏原致敏性的消减作用机制,如生物加工技术影响过敏原致敏性的作用方式,生物加工技术消减过敏原致敏性的过程中,过敏原结构具体发生了哪些变化,哪些抗原表位遭到了破坏,关键致敏表位是否发生改变,表位变化与其氨基酸序列组成有何关系,结构变化及表位变化与致敏性变化的构效关系。此外,在之后的研究中,我们应该将目前成熟的生物消减技术更多的利用在软体动物致敏性的消减研究中,为今后利用生物加工技术开发低致敏性水产加工食品提供理论支撑。
[1] SCHEURER S, TODA M, VIETHS S.What makes an allergen?[J].Clinical and Experimental Allergy, 2015, 45(7):1 150-1 161.
[2] CARRARD A, RIZZUTI D, SOKOLLIK C.Update on food allergy[J].Allergy, 2015, 70(12):1 511-1 520.
[3] PERKIN J E.Update on food allergy research[J].Allergies and Adverse Reactions, 1994, 9(3):22-32.
[4] THONG B Y H, CHENG Y K, LEONG K P, et al.Immediate food hypersensitivity among adults attending a clinical immunology/allergy centre in Singapore[J].Singapore Medical Journal, 2007, 48(3):236-240.
[5] SCOTT H, SICHERER, HUGH A, et al.Food allergy:a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management[J].Journal of Allergy and Clinical Immunology, 2018, 141(1):41-58.
[6] BESLER M, STEINHART H, PASCHKE A.Stability of food allergens and allergenicity of processed foods[J].Journal of Chromatography B, 2001, 756(1-2):207-228.
[7] MOU H, GAO M X, ZHAO J, et al.Influence of gamma irradiation and heat treatment on the immunogenicity of five epitopes of pen a1[J].Food Science and Technology Research, 2014, 20(5):955-960.
[8] 刘光明, 余惠琳, 黄秀秀, 等.加工处理方式对蟹类原肌球蛋白的消化稳定性和过敏原性的影响[J].中国食品学报, 2011, 11(4):14-22.
LIU G M, YU H L, HUANG X X, et al.Effects of processing methods on digestibility and allergenicity of crab tropomyosin[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(4):14-22.
[9] PATRICK G, STEFAN V, ANDREA W, et al.Maillard reaction and enzymatic browning affect the allergenicity of pru av 1, the major allergen from cherry (prunus avium)[J].Agricultural and Food Chemistry, 2004(12):4 002-4 007.
[10] 徐静, 李一尘, 徐君怡, 等.食品加工对过敏原活性的影响[J].食品安全质量检测学报, 2012, 3(4):259-263.
XU J, LI Y C, XU J Y, et al.Effects of processing on food allergens[J].Journal of Food Safety and Quality, 2012, 3(4):259-263.
[11] BRENNA O, POMPEI C, ORTOLANI C, et al.Technological processes to decrease the allergenicity of peach juice and nectar[J].Journal of Agricultural and Food Chemistry, 2000, 48(2):493-497.
[12] 吴海明, 胡志和, 王丽娟.凡纳滨对虾主要过敏原鉴定及酶法消减技术的研究[J].食品科学, 2010, 31(17):272-276.
WU H M, HU Z H, WANG L J, et al.Identification and enzymatic elimination of major allergens in litopenaeus vannamei[J].Food Science, 2010, 31(17):272-276.
[13] FU L L, SONG J Y, WANG C, et al.Bifidobacterium infantis potentially alleviates shrimp tropomyosin-induced allergy by tolerogenic dendritic cell-dependent induction of regulatory t cells and alterations in gut microbiota[J].Frontiers in Immunology, 2017, 8:1 536.
[14] WAI C Y Y, LEUNG N Y H, HO M H K, et al.Immunization with hypoallergens of shrimp allergen tropomyosin inhibits shrimp tropomyosin specific IgE reactivity[J].PLOS One, 2014, 9(11):111 649.
[15] 李风铃, 李沂光, 孙天乐, 等.水产品中主要过敏原的研究与展望[J].中国渔业质量与标准, 2018, 8(1):16-23.
LI F L, LI Y G, SON T L, et al.Research advances and perspectives on allergens of aquatic products[J].Chinese Fishery Quality and Standards, 2018, 8(1):16-23.
[16] 张永霞, 杨阳, 蔡秋凤, 等.水产食物过敏原及其抗原表位的研究进展[J].中国渔业质量与标准, 2015, 5(5):1-8.
ZHANG Y X, YANG Y, CAI Q F, et al.The research of seafood allergens and its epitopes[J].Chinese Fishery Quality and Standards, 2015, 5(5):1-8.
[17] UNTERSMAYR E, SZALAI K, RIEMER A B, et al.Mimotopes identify conformational epitopes on parvalbumin, the major fish allergen[J].Molecular Immunology, 2006, 43(9):1 454-1 461.
[18] 农小献, 宾石玉, 蒙涛, 等.小清蛋白研究进展[J].生物技术通讯, 2011, 22(6):887-891.
NONG X X, BIN S Y, MENG T, et al.Research progress of parvalbumins[J].Letters in Biotechnology, 2011, 22(6):887-891.
[19] YANG Y, CAO M J, ALCOCER M, et al.Mapping and characterization of antigenic epitopes of arginine kinase of Scylla paramamosain[J].Molecular Immunology, 2015, 65(2):310-320.
[20] AYUSO R, S NCHEZ-GARCIA S, PASCAL M, et al.Is epitope recognition of shrimp allergens useful to predict clinical reactivity?[J].Clinical & Experimental Allergy, 2012, 42(2):293-304.
NCHEZ-GARCIA S, PASCAL M, et al.Is epitope recognition of shrimp allergens useful to predict clinical reactivity?[J].Clinical & Experimental Allergy, 2012, 42(2):293-304.
[21] ZHENG L N, LIN H, PAWAR R, et al.Mapping IgE binding epitopes of major shrimp (Penaeus monodon) allergen with immunoinformatics tools[J].Food and Chemical Toxicology, 2011, 49(11):2 954-2 960.
[22] 孙超, 王彦波, 傅玲琳.甲壳类水产品主要过敏原致敏反应及免疫调控机制[J].中国食品学报, 2014, 14(7):185-191.
SON C, WANG Y B, FU L L.Molecular mechanisms on sensitization and immune regulation of major allergens from crustaceans[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):185-191.
[23] 毛海燕. 拟穴青蟹精氨酸激酶的过敏性及其构效关系的初步研究[D].厦门:集美大学, 2013.
MAO H Y.Preliminary study on the allergenicity and structure-activity relationship of arginine kinase from Scylla paramamosain[D].Xiamen:Jimei University, 2013.
[24] CHEN H L, CAO M J, CAI Q F, et al.Purification and characterisation of sarcoplasmic calcium-binding protein, a novel allergen of red swamp crayfish (Procambarus clarkii)[J].Food Chemistry, 2013, 139(1-4):213-223.
[25] AYUSO R, GRISHINA G, BARDINA L, et al.Myosin light chain is a novel shrimp allergen, Lit v 3[J].Journal of Allergy and Clinical Immunology, 2008, 122(4):795-802.
[26] WNUK W, JAUREGUI-ADELL J.Polymorphism in high-affinity calcium-binding proteins from crustacean sarcoplasm[J].European Journal of Biochemistry, 1983, 131(1):177-182.
[27] 宋益银, 林蕾, 苏秀榕, 等.锯缘青蟹(Scylla serrata)特异性过敏原的研究[J].海洋与湖沼, 2009, 40(1):62-67.
SONG Y Y, LIN L, SU X R, et al.The specific allergens in crab Scylla serrata[J].Oceanologia Et Limnologia Sinica, 2009, 40(1):62-67.
[28] BAUERMEISTER K, WANGORSCH A, GAROFFO L P, et al.Generation of a comprehensive panel of crustacean allergens from the North Sea Shrimp Crangon crangon[J].Molecular Immunology, 2011, 48(15-16):1 983-1 992.
[29] HAMADA Y, NAGASHIMA Y, KAZUO S.Identification of collagen as a new fish allergen[J].Bioscience Biotechnology and Biochemistry, 2001, 65(2):285-291.
[30] LIU R, KRISHNAN H B, XUE W T, et al.Characterization of allergens isolated from the freshwater fish blunt snout bream (Megalobrama amblycephala)[J].Journal of Agricultural and Food Chemistry, 2011, 59(1):458-463.
[31] FEI D X, LIU Q M, CHEN F, et al.Assessment of the sensitizing capacity and allergenicity of enzymatic cross-linked arginine kinase, the crab allergen[J].Molecular Nutrition and Food Research, 2016, 60(7):1 707-1 718.
[32] MEJRHIT N, AZDAD O, CHDA A, et al.Evaluation of the sensitivity of Moroccans to shrimp tropomyosin and effect of heating and enzymatic treatments[J].Food and Agricultural Immunology, 2017(1):1-12.
[33] TIAN S, MA J, AHMED I, et al.Effect of tyrosinase-catalyzed crosslinking on the structure and allergenicity of turbot parvalbumin mediated by caffeic acid[J].Journal of the Science of Food and Agriculture, 2019,99(7):3 504-3 508.
[34] 王学丽, 李娅茹, 王梦梦,等.体外模拟胃液消化对虾中主要过敏原原肌球蛋白抗原表位的影响[J].中国免疫学杂志, 2019, 35(19):2 319-2 325.
WANG X L, LI Y R, WANG M M, et al.Effects of in vitro simulated gastric fluid digestion on epitopes of major allergen tropomyosin in shrimp[J].Chinese Journal of Immunology, 2019, 35(19):2 319-2 325.
[35] 谢秀玲, 李欣, 高金燕, 等.非热加工对食物过敏原影响的研究进展[J].食品科学, 2013, 34(17):344-349.
XIE X L, LI X, GAO J Y, et al.A review of studies on the effect of non-thermal processing on food allergens[J].Food Science, 2013, 34(17):344-349.
[36] 阿木尔吉日嘎拉. 乳酸菌的免疫调节作用研究[D].呼和浩特:内蒙古农业大学, 2006.
AR M E.The modulating effect of lactic acid bacteria on immune system[D].Hohhot:Inner Mongolia Agricultural University, 2006.
[37] NERMES M, SALMINEN S, ISOLAURI E.Is there a role for probiotics in the prevention or treatment of food allergy?[J].Current Allergy and Asthma Reports, 2013, 13(6):622-630.
[38] 高卿, 李振兴, 米娜莎, 等.海鲈鱼鱼肉发酵过程中小清蛋白IgE结合能力的变化[J].食品科学, 2017, 38(22):88-94.
GAO Q, LI Z X, MI N S, et al.Effect of fermentation on Ig E binding ability of sea bass (Lateolabrax japonicus) parvalbumin[J].Food Science, 2017, 38(22):88-94.
[39] 傅玲琳, 赵淑淑, 王彦波.具有缓解对虾原肌球蛋白致敏性乳酸菌的筛选及其免疫调节作用[J].中国食品学报, 2018, 18(2):15-21.
FU L L, ZHAO S S, WANG Y B.Screening and immunomodulatory effects of lactic acid bacterial strains with relieving sensitization of shrimp tropomyosin[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(2):15-21.
[40] 史晓磊. 基因工程在降低植物性食品致敏性中应用[J].粮食与油脂, 2009(9):4-6.
SHI X L.Application of genetic engineering in reduction of the allergenicity of plant food[J].Food And Oil, 2009(9):4-6.
[41] REESE G, VIEBRANZ J, LEONG-KEE S M, et al.Reduced allergenic potency of vr9-1, a mutant of the major shrimp allergen pen a 1 (tropomyosin)[J].Journal of Immunology, 2005, 175(12):8 354-8 364.
[42] 蔺海鑫. pH及糖基化处理对菲律宾蛤仔原肌球蛋白性质的影响[D].青岛:中国海洋大学, 2015.
LIN H X.Effect of pH shifts and glycation on lgE-binding capacity and conformational structure of tropomyosin from short-neck clam (Ruditapes philippinarum)[D].Qingdao:Ocean University of China, 2015.
[43] 刘光明, 沈苑, 曹敏杰, 等.虾类过敏原的识别、纯化和检测技术研究[J].中国食品学报, 2008, 8(6):142-148.
LIU G M, SHENG Y, CAO M J, et al.Study on the identification, purification and detection technique of shrimp allergen[J].Journal of Chinese Institute of Food Science and Technology, 2008, 8(6):142-148.
[44] 刘光明, 曹敏杰, 袁静静, 等.酶水解海蟹加工下脚料制备调味品原料[J].中国食品学报, 2009, 9(6):83-89.
LIU G M, CAO M J, YUAN J J, et al.Preparation of raw condiment with enzyme hydrolysate of the processing leftover from marine crab[J].Journal of Chinese Institute of Food Science and Technology, 2009, 9(6):83-89.
[45] 李振兴, 高卿, 米娜莎, 等.一种利用微生物降低鱼类过敏原活性的方法:中国, CN106722382A[P].2017-05-31.
LI Z X, GAO Q, MI N S, et al.A method that uses microorganisms to reduce fish allergen activity:China, CN106722382A[P].2017-05-31.
[46] FU L L, PENG J X, ZHAO S S, et al.Lactic acid bacteria-specific induction of CD4+Foxp3+T cells ameliorates shrimp tropomyosin-induced allergic response in mice via suppression of mTOR signaling[J].Scientific Reports, 2017, 7(1):1 987.
[47] 李振兴, 袁方舟, 米娜莎, 等.一种降低刀额新对虾过敏原原肌球蛋白的方法:中国, CN106072071B[P].2019-10-01.
LI Z X, YUAN F Z, MI N S, et al.A method to reduce the amount of myosin of the new shrimp allergen:China, CN106072071B[P].2019-10-01.
[48] 胡晓利, 布冠好.高压均质与酶法联合改性对大豆蛋白抗原性及结构的影响[J].河南工业大学学报(自然科学版), 2018, 39(6):29-35.
HU X L, BU G H.Effects of combination of high pressure homogenization and enzymatic and modification on the antigenicity and structure of soybean protein isolates[J].Journal of Henan University of Technology(Natural Science Edition), 2018, 39(6):29-35.