脂肪酶(triacylglycerol acylhydrolases,EC3.1.1.3)是一类可高效催化三酰甘油酯水解的酶,可催化油脂水解生成脂肪酸、甘油和甘油单酯或二酯,可进行催化酯化、酯交换反应、醇解反应和酸解等反应。脂肪酶广泛存在于动物、植物和微生物体内。微生物脂肪酶早在20世纪初已被发现,迄今已发现超过100种产生脂肪酶的微生物。通过微生物发酵法来制备脂肪酶,因受环境影响小、生产周期短、效率高、成本低等优势,已成为工业化生产脂肪酶的主要途径[1]。
脂肪酶用途广泛。在食品工业中,可以改善食品的风味,也可以合成高附加值的脂类产品。在造纸工业中,可以用于废纸脱墨。在洗涤剂工业中,可以提高去垢力,改善洗涤效果。在燃料工业中,可以将动植物油转化成可再生性柴油燃料。在生物催化剂中,用于制备稳定、可回收的纳米催化剂和磁性生物催化剂以及辛酸辛酯的合成。另外在生物医学科学以及日常清洁用品方面都有巨大的商业价值[2-3]。
工业生产对脂肪酶的热稳定性要求高,而天然脂肪酶的热稳定性难以满足生产要求。嗜热脂肪酶是一类在高温下仍具有催化活性的脂肪酶(一般最适作用温度大于40 ℃),可满足工业化运用要求。嗜热脂肪酶主要来源于极端条件下的嗜热微生物。而通过对嗜热脂肪酶进行分子结构改造,利用定向突变技术引入二硫键等方法可进一步提高酶的热稳定性。
1 酶产生菌及表征的研究进展
酶表达水平是衡量酶产生菌的酶生产能力指标。酶的最适pH值和最适温度是指在一定条件下,酶呈现最大活力时的pH值和温度。热稳定性一般以酶在特定温度条件下,维持一定时间后的剩余酶活力来表示。至今报道的嗜热脂肪酶产生菌及其表达水平、最适pH值和温度以及热稳定性见表1。
表1 耐酸/耐碱嗜热脂肪酶
Table 1 Acid / alkali resistant thermophilic lipase
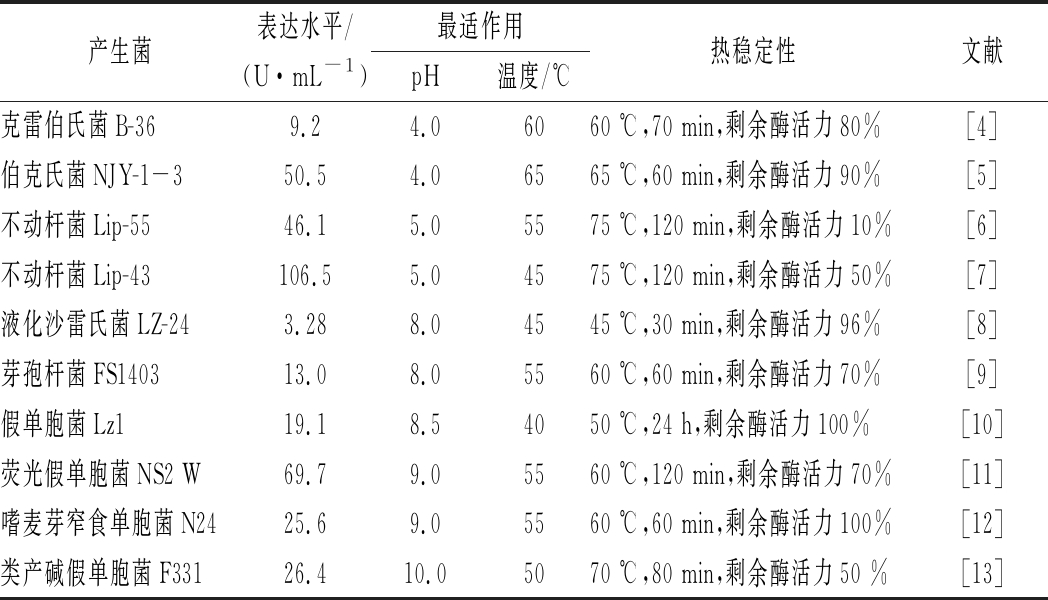
产生菌表达水平/(U·mL-1)最适作用pH温度/℃热稳定性文献克雷伯氏菌B-369.24.06060 ℃,70 min,剩余酶活力80%[4]伯克氏菌NJY-1-350.54.06565 ℃,60 min,剩余酶活力90%[5]不动杆菌Lip-5546.15.05575 ℃,120 min,剩余酶活力10%[6]不动杆菌Lip-43106.55.04575 ℃,120 min,剩余酶活力50%[7]液化沙雷氏菌LZ-243.288.04545 ℃,30 min,剩余酶活力96%[8]芽孢杆菌FS140313.08.05560 ℃,60 min,剩余酶活力70%[9]假单胞菌Lz119.18.54050 ℃,24 h,剩余酶活力100%[10]荧光假单胞菌NS2 W69.79.05560 ℃,120 min,剩余酶活力70%[11]嗜麦芽窄食单胞菌N2425.69.05560 ℃,60 min,剩余酶活力100%[12]类产碱假单胞菌F33126.410.05070 ℃,80 min,剩余酶活力50 %[13]
耐酸嗜热脂肪酶主要来源于细菌(克雷伯氏菌、伯克氏菌、不动杆菌等),酶表达水平为9.2~106.5 U/mL,最适pH值和温度分别为pH 4.0~7.0和45~80 ℃。这些产生菌中,不动杆菌Lip-43具有最高表达水平的酶表达量(106.5 U/mL)[7]。来源于伯克氏NJY-1-3和克雷伯氏菌B-36脂肪酶有最低的最适pH值为4.0,而来源于伯克氏菌NJY-1-3脂肪酶有最高的最适温度65 ℃[4-5,10]。另外,来源于不动杆菌Lip-43脂肪酶具有最高的热稳定性(75 ℃条件下维持120 min,仍保持55%的剩余酶活力),适合于高温环境下的生产[7]。
耐碱嗜热脂肪酶也主要来源于细菌,包括假单胞菌、液化沙雷氏菌和芽孢杆菌等,酶表达水平为3.8~120 U/mL,最适pH和温度分别为8.0~9.0和40~55 ℃。这些产生菌中,荧光假单胞菌NS2 W具有最高的酶表达量(69.7 U/mL)[11]。类产碱假单胞菌F331脂肪酶有最高的最适pH值为10[13],而来源于嗜麦芽窄食单胞菌N24、荧光假单胞菌NS2 W和芽孢杆菌FS1403脂肪酶的最适温度高达55 ℃[9,11-12]。来源于假单胞菌Lz1脂肪酶具有最好的热稳定性(50 ℃条件下维持24 h,仍保持100%的剩余酶活力)[10],适合要求温度较高的生产条件。
野生菌来源脂肪酶的酶表达水平普遍不高,表达量最高的不动杆菌Lip-43也远远达不到工业化生产的要求,其热稳定性也较低。由此可见,野生菌来源的脂肪酶须通过进一步的改造才能满足工业化生产。
2 酶异源表达的研究进展
通过构建重组工程菌异源高效表达嗜热脂肪酶,已经成为酶工业化生产的主要方法。基因重组菌的构建,所涉及酶基因来源和表达系统(包括宿主、质粒和启动子等)、表达水平以及酶表征等最近研究进展见表2。
表2 嗜热脂肪酶异源表达
Table 2 Heterologous expression of thermophilic lipase
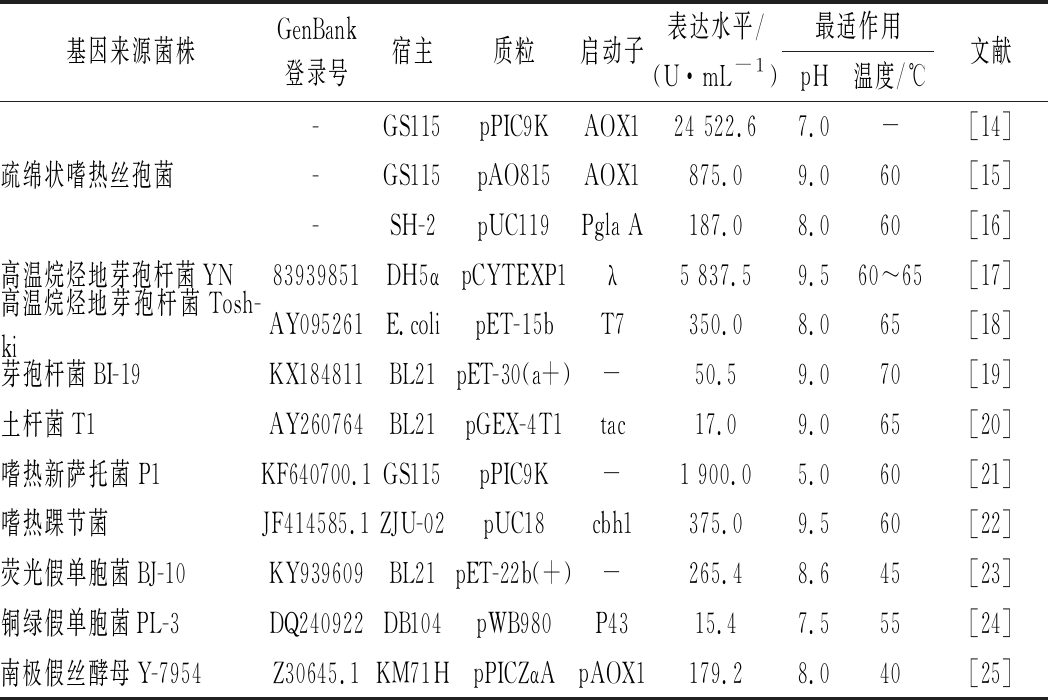
基因来源菌株GenBank登录号宿主质粒启动子表达水平/(U·mL-1)最适作用 pH温度/℃文献疏绵状嗜热丝孢菌-GS115pPIC9KAOX124 522.6 7.0-[14]-GS115pAO815AOX1875.09.060[15]-SH-2pUC119Pgla A187.08.060[16]高温烷烃地芽孢杆菌YN83939851DH5αpCYTEXP1λ5 837.59.560~65[17]高温烷烃地芽孢杆菌Tosh-kiAY095261E.colipET-15bT7350.08.065[18]芽孢杆菌BI-19KX184811BL21pET-30(a+)-50.59.070[19]土杆菌T1AY260764BL21pGEX-4T1tac17.09.065[20]嗜热新萨托菌 P1KF640700.1GS115pPIC9K-1 900.05.060[21]嗜热踝节菌JF414585.1ZJU-02pUC18cbh1375.09.560[22]荧光假单胞菌BJ-10KY939609BL21pET-22b(+)-265.48.645[23]铜绿假单胞菌PL-3DQ240922DB104pWB980P4315.47.555[24]南极假丝酵母Y-7954Z30645.1KM71HpPICZαApAOX1179.28.040[25]
嗜热脂肪酶异源表达所涉及的基因来源于细菌(包括芽孢杆菌、假单胞菌和酵母菌等)和真菌(嗜热新萨托菌、疏棉状嗜热丝胞菌和嗜热踝节菌等)。表达系统中常用宿主有BL21和GS115等,常用质粒有pET类和pPIC9K等,常用启动子有T7和AOX1等。在这些构建的工程菌中,基因来源于疏棉状丝胞菌、以GS115-pPIC9K-AOX1为表达系统构建工程菌GS115/pTL1,可获得最高酶表达量24 522.6 U/mL[14]。关于耐酸嗜热脂肪酶的异源表达,以来源于嗜热新萨托菌P1(基因编号KF640700.1)酶基因、GS115-pPIC9K为表达系统构建重组毕赤酵母工程菌GS115/pET22B(+)-Lip09,经过高密度发酵可获得1 900 U/mL的酶表达量[21]。另外,将来源于高温烷烃地芽孢杆菌YN的耐碱嗜热脂肪酶基因(基因编号83939851),以DH5α-pCYTEXP1-λ为表达系统,构建重组菌pCYTEX-LipA-6xhis,可获得5 837.5 U/mL的酶表达量[17]。
基因来源以及宿主、质粒与启动子等因素的选择对嗜热脂肪酶表达量有很大影响,可以通过对上述因素的进一步筛选(例如增加产量的强启动子)提高异源重组工程菌的酶表达量。
3 酶分子结构改造的研究进展
通过对酶分子的结构改造,可以显著提高酶的稳定性(即提高酶活力半衰期t1/2和酶分子熔解温度Tm),或降低酶分子的底物特异性Km,提高酶的催化效率。提高嗜热脂肪酶的热稳定性方式有很多,包括定向进化,定点突变等。AKBULUT等[26]通过定向进化使短小芽孢杆菌脂肪酶基因在50 ℃的t1/2提高了9倍,PENG[27]通过多点饱和突变的南极假丝酵母脂肪酶得到了更好的嗜热性,在60 ℃的t1/2提高了14倍。而利用定点突变技术在酶分子结构上引入二硫键,提高酶分子的热稳定性,是目前最主要的研究方向。二硫键可稳定蛋白质肽链空间结构,往往使蛋白质具有较好的热稳定性。研究表明二硫键不仅会使脂肪酶的结构更稳定,嗜热脂肪酶分子中的二硫键数目往往要多于不嗜热的脂肪酶[28]。另外,通过定点突变等技术改造酶分子与底物的结合部位,提高酶蛋白质与底物结合的稳定性,可以显著地提高酶分子对底物的亲和力,降低Km,提高催化效率。
嗜热脂肪酶催化活性中心是在蛋白质分子结构中由丝氨酸残基、组氨酸残基和天冬氨酸残基组成的“催化三联体”[34]。突变位点的选择可利用Disulfide by design软件进行预测和筛选拟二硫键。由表3可知,环孢青霉37通过定点突变获得单突变子T251C,t1/2有着12.8倍升高[29]。南极假丝酵母通过突变后获得双突变子A162C/K308C,Tm提高了8.5 ℃[33]。华根霉基因突变后的三突变子K64 N/K68T/T201C,其Km大幅下降了71%,显著地提高酶分子对底物的亲和性[32]。总之,通过定点突变技术,对酶分子关键位点进行突变改造,可以显著的提高嗜热脂肪酶分子的稳定性或改善酶分子与底物的亲和力,提高催化效率。因此,通过定向突变技术,结合其他分子改造技术,将是未来提高嗜热脂肪酶热稳定性的方法与手段。
表3 脂肪酶结构定点突变改造
Table 3 Site directed mutagenesis of lipase

基因来源宿主质粒突变子t1/2/Tm/Km文献米黑根霉GS115pPIC9KP96C/L106C60 ℃,t1/2提高5倍;最适温度提高了3 ℃[29]华根霉GS115pPIC9KF95C/F214CK64 N/K68T/T201CD190V60 ℃,t1/2提高11倍;Tm提高了7 ℃60 ℃,t1/2提高了1.5 倍;Km下降71%65 ℃,t1/2提高了1倍,最适温度提高了5 ℃,Km下降了23.3%[30] [31][32]环孢青霉37GS115pPIC9KT251C35 ℃,t1/2提高12.8倍,最适温度提高了5 ℃[28]南极假丝酵母BL21pET22A162C/K308C50 ℃,t1/2提高了4.5倍;60 ℃,Tm提高了8.5 ℃[33]
4 分离纯化与固定化研究的研究进展
经分离纯化后可获得高纯度的脂肪酶,为进一步研究酶分子结构提供前提基础。酶分子的分离纯化就是将酶分子溶解在溶剂中并把杂质去除的过程。由于游离态酶分子相对不稳定,容易受到环境pH、温度、金属离子、抑制剂、接触介质性质等因素影响而失活,因此纯化方法对酶活影响十分显著。酶分离纯化的目的就是为获得高比活力和酶活力回收率。分离纯化步骤多可除去更多杂质,获得高比活力,但是由于步骤繁琐、时间长等原因可导致酶活力损失大,造成酶活力回收率低。对嗜热脂肪酶的纯化总结如表4所示。
表4 嗜热脂肪酶的纯化
Table 4 Purification of thermophilic lipase
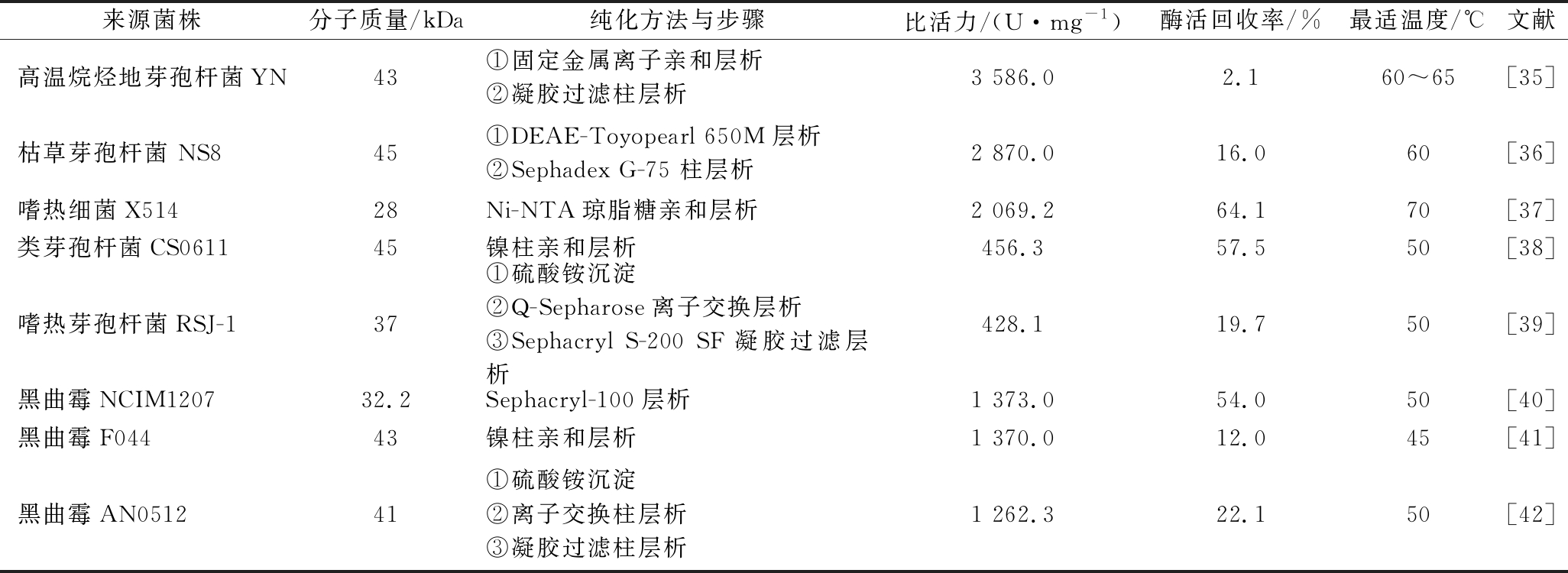
来源菌株分子质量/kDa纯化方法与步骤比活力/(U·mg-1)酶活回收率/%最适温度/℃文献高温烷烃地芽孢杆菌YN43①固定金属离子亲和层析②凝胶过滤柱层析3 586.02.160~65[35]枯草芽孢杆菌 NS845①DEAE-Toyopearl 650M层析②Sephadex G-75 柱层析2 870.016.060[36]嗜热细菌X51428Ni-NTA琼脂糖亲和层析2 069.264.170[37]类芽孢杆菌CS061145镍柱亲和层析456.357.550[38]嗜热芽孢杆菌RSJ-137①硫酸铵沉淀②Q-Sepharose离子交换层析③Sephacryl S-200 SF凝胶过滤层析428.119.750[39]黑曲霉NCIM120732.2Sephacryl-100层析1 373.054.050[40]黑曲霉F04443镍柱亲和层析1 370.012.045[41]黑曲霉AN051241①硫酸铵沉淀②离子交换柱层析③凝胶过滤柱层析1 262.322.150[42]
由表4可知,当前嗜热脂肪酶主要通过硫酸铵沉淀并结合层析柱等手段进行分离纯化。由于嗜热脂肪酶的分子质量为25~60 kDa,这限定了分离载体的孔径大小。对嗜热脂肪酶进行分离纯化后,酶比活力为31.0~3 586.0 U/mg,酶活力回收率2.1%~64.1%。高温烷烃地芽孢杆菌 YN经固定金属离子亲和层析和凝胶过滤后,可获得最高的酶比活力(3 586.0 U/mg),但其酶活力损失较大,酶活力回收率只有2.1%[35]。嗜热细菌X514通过Ni离子亲和层析纯化后,可得到最高的酶活力回收率(64.1%)[37],酶比活力(2 069.2 U/mg)也较高。黑曲霉NCIM 1207通过Sephacryl-100层析法纯化后,可得到着较高的酶比活力(1 373.0 U/mg)和较高的酶活力回收率(54%)[40]。
固定化酶技术是用物理或化学手段将游离的酶在一定范围内限制起来,酶分子易分离且可回收使用的一种技术。酶作为生物催化剂具有价格昂贵、寿命有限,而酶固定化技术可以使酶重复使用,增加酶的操作稳定性。固定化载体一般分为无机载体材料、高分子载体材料和复合载体材料。酶分子与载体的固定化过程可造成酶活力损失的原因有多种,包括载体与酶分子活力中心关键氨基酸的共价结合与空间位阻等因素,导致获得较低的酶活力回收率。而造成固定化酶使用过程中酶活力损失的原因有很多,例如酶本身失活、酶从载体上脱落、固定化载体破碎或溶解等都可能会造成酶活力损失。对嗜热脂肪酶的固定化总结见表5。
表5 嗜热脂肪酶的固定化
Table 5 Immobilization of thermophilic lipase
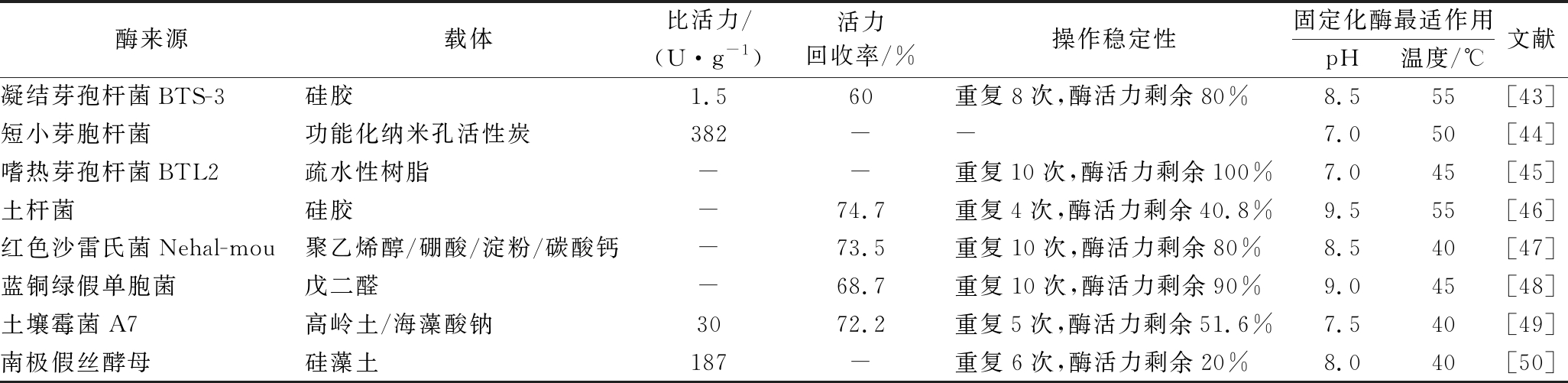
酶来源载体比活力/(U·g-1)活力回收率/%操作稳定性固定化酶最适作用pH温度/℃文献凝结芽孢杆菌BTS-3硅胶1.560重复8次,酶活力剩余80%8.555[43]短小芽胞杆菌功能化纳米孔活性炭382--7.050[44]嗜热芽孢杆菌BTL2疏水性树脂--重复10次,酶活力剩余100%7.045[45]土杆菌硅胶-74.7重复4次,酶活力剩余40.8%9.555[46]红色沙雷氏菌Nehal-mou聚乙烯醇/硼酸/淀粉/碳酸钙-73.5重复10次,酶活力剩余80%8.540[47]蓝铜绿假单胞菌戊二醛-68.7重复10次,酶活力剩余90%9.045[48]土壤霉菌A7高岭土/海藻酸钠3072.2重复5次,酶活力剩余51.6%7.540[49]南极假丝酵母硅藻土187-重复6次,酶活力剩余20%8.040[50]
由表5可知,嗜热脂肪酶固定化一般采用物理吸附方法,通过载体阴阳离子交换和吸附作用进行固定化。固定化载体主要包括硅胶、功能化纳米孔活性炭、疏水树脂、聚乙烯醇/硼酸/淀粉/碳酸钙、高岭土/海藻酸钠和硅藻土等。红色沙雷氏菌来源的嗜热脂肪酶通过与聚乙烯醇/硼酸/淀粉/碳酸钙固定化后固定化酶最佳温度从40 ℃上升到65 ℃,并经过10次催化反应重复后,酶活力依然保持80%,固定化技术显著提高了酶的嗜热性和稳定性[48]。土杆菌来源的酶用物理吸附的方式固定在硅胶上,获得最高的活力回收率(74.7%),但经催化反应4次重复后,酶活力仅剩余40.8%[47]。这是由于酶分子与载体的结合不够紧密,反应过程中酶分子容易从载体脱落而损失,造成操作稳定性低。蓝铜绿假单胞菌来源的酶与戊二醛交联固定化后,固定化酶呈现较好的酶活力回收率(68.7%)和操作稳定性,经过10个循环的催化反应后,酶活仍剩余90%[49]。嗜热芽孢杆菌BTL2通过疏水性树脂固定化并经过10次重复催化后,酶活力仍然保持100%[46]。因此,通过选择合适的固定化载体,运用合适的固定化技术,可以获得操作稳定性高以及比活力高的固定化酶。固定化嗜热脂肪酶提高了酶的操作稳定性,可在催化反应中重复使用性,这是实现酶工业化应用的主要途径。
5 展望
近年来嗜热脂肪酶在工业中的应用越来越广泛,野生菌来源的嗜热脂肪酶在表达量、热稳定性与催化效率等方面难于满足工业化需求。通过构建基因工程菌异源表达和酶分子结构改造等分子生物技术进行改良,可以提高酶表达水平和热稳定性。酶的改造技术已成为生物工程研究的热点,然而使用单一方法改造后往往达不到理想的效果。国内外越来越多的研究表明,异源表达系统、定点突变位点、纯化与固定化方式等方法对脂肪酶活力和热稳定性等都有影响。因此,谨慎地选择最优的组合方案尤为重要。为获得理想高产的嗜热脂肪酶,未来的方向应进行多方面综合考虑并结合多种方法进行研究,使嗜热脂肪酶在工业化应用中具有更好的发展前景。
[1] 徐锁玉.生物技术在脂肪酶生产中的应用[J].生物化工,2018,4(6):120-122.
XU S Y, Application of biotechnology in lipase production[J].Biological Chemical Engineering,2018,4(6):120-122.
[2] SOUZA C E, RIBEIRO B D, COELHO M A.Characterization and application of Yarrowia lipolytica lipase obtained by solid-state fermentation in the synthesis of different esters used in the food industry[J].Applied Biochemistry and Biotechnology,2019,189(3):933-959.
[3] RASHID A,MUSHTAQ M,SYED Q,et al.Application of lipase bearing dead mycelia as biocatalyst for octyl-octanoate synthesis[J].Food Science and Biotechnology,2018,27(6):1 707-1 718.
[4] 惠明,张开平,田青,等.Klebsiella sp.B-36的分离鉴定及产脂肪酶特性研究[J].中国粮油学报.2013,28(10):80-85.
HUI M,ZHANG K P,TIAN Q,et al.Study on isolation and identification of a Klebsiella sp.B-36 and properties of lipase[J].Journal of The Chinese Cereals and Oils Association,2013,28(10):80-85.
[5] 闫丽娟,谢振荣,赵春雷,等.耐高温酸性脂肪酶菌株NJY-1-3的选育及发酵条件的研究[J].食品科技, 2010,35(3):11-15.
YAN L J,XIE Z R,ZHAO C L,et al.A research on screening and fermentation conditions of thermostable lipase strain NJY-1-3[J].Food Science and Technology, 2010,35(3):11-15.
[6] 陈贵元,刘林波,桑鹏,等.高温酸性脂肪酶产生菌Acinetobacter sp.Lip-55的筛选、鉴定及其酶学性质研究[J].食品与发酵工业,2019,45(24):52-57.
CHEN G Y,LIU L B,SANG P,et al.Isolation and identification of a the rmostable lipase-producing strain and its enzymatic properties[J].Food and Fermentation Industries,2019,45(24):52-57.
[7] 桑鹏,刘林波,陈贵元,等.大理弥渡热泉耐热脂肪酶产生菌的筛选及其酶活性研究[J].中国饲料,2020(3):27-31.
SANG P,LIU L B,CHEN G Y,et al.Isolation and identification of a strain producing thermostable lipase and studying on its enzymatic properties[J].China Feed,2020(3):27-31.
[8] 韩生义,赵淑琴,刘晓丽,等.一株碱性脂肪酶产生菌的筛选、鉴定及酶学性质研究[J].甘肃农业大学学报,2017,52(1):119-125.
HAN S Y,ZHAO S Q,LIU X L,et al.Screening,identification and enzymatic properties of an alkaline lipase producing strain[J].Journal of Gansu Agricultural University,2017,52(1):119-125.
[9] 吴伟斌,施碧红,温建新,等.耐热脂肪酶产生菌FS1403的分离筛选和16S rDNA基因序列的分析[J].药物生物技术,2008,15(1):6-11.
WU W B,SHI B H,WEN J X,et al.Isolation and screening of thermostable lipase-producing bacterium FS1403 and analysis of its 16SrDNA gene sequence[J].Pharmaceutical Biotechnology,2008,15(1):6-11.
[10] 杨永梅,韩望,魏武,等.碱性脂肪酶产生菌的筛选与产酶条件及酶学性质研究[J].四川大学学报:自然科学版,2003(5):935-938.
YANG Y M,HAN W,WEI W,et al.Screening of alkaline lipase producing bacteria and study of its enzyme production conditions and enzymatic properties[J].Journal of Sichuan University:Natural Science Edition,2003(5):935-938.
[11] KULKARNI N,GADRE R V.Production and properties of an alkaline, thermophilic lipase from Pseudomonas fluorescens NS2 W[J].Journal of Industrial Microbiology & Biotechnology,2002,28(6):344-348.
[12] 伊芬芬,白方文,段静波,等.一株碱性脂肪酶产生菌的分离鉴定及其产酶条件[J].上海交通大学学报:农业科学版,2008,26(3):242-246.
YIN F F,BAI F W,DUAN J B,et al.Isolation and identification of an alkaline lipase producing strain and its enzyme producing conditions[J].Journal of Shanghai Jiaotong University:Agricultural Science Edition,2008,26(3):242-246.
[13] 吴松刚,谢新东,黄建忠,等.类产碱假单胞菌耐热碱性脂肪酶的研究[J].微生物学报,1997,37(1):32-39.
WU S G,XIE X D,HUANG J Z,et al.Cloning and expression in Escherichia coli of an alkaline and thermostable exolipase from Pseudomonas pseudoalcaligenes[J].Acta Microbiologica Sinica,1997,37(1):32-39.
[14] 蔡海莺,DUMBA T,张婷,等.毕赤酵母重组菌高密度发酵产疏绵状嗜热丝孢菌脂肪酶[J].中国食品学报,2018,18(7):99-107.
CAI H Y,DUMBA T,ZHANG T,et al.Producing of Thermomyces lanuginosus lipase using high density fermentation of recombinant Pichia pastoris[J].Journal of Chinese Institute of Food Science and Technology,2018,18(7):99-107.
[15] 尤逊.疏棉状嗜热丝孢菌脂肪酶的优化表达及生物柴油催化新工艺的初探[D].武汉:武汉轻工大学,2018.
YOU X.High-level expression of Thermomyces lanuginosus lipase in Pichia pastoris and its application in biodiesel preparation[D].Wuhan:Wuhan Polytechnic University,2018.
[16] 陈婧.疏棉状啫热丝孢菌耐热脂肪酶在无孢黑曲霉中表达的研究[D].广州:华南理工大学,2013.
CHEN J.Study on recombinant expression of Thermomyces lanuginosus thermostable lipase in non-spore Aspergillus niger[D].Guangzhou:South China University of Technology,2013.
[17] SOLIMAN N A,KNOLL M,ABDEL-FATTAH Y R,et al.Molecular cloning and characterization of thermostable esterase and lipase from Geobacillus thermoleovorans YN isolated from desert soil in Egypt[J].Process Biochemistry,2007,42(7):1 090-1 100.
[18] ABDEL-FATTAH Y R,GABALLA A A.Identification and over-expression of a thermostable lipase from Geobacillus thermoleovorans Toshki in Escherichia coli[J].Microbiological Research,2008,163(1):13-20.
[19] 刘秀萌.热泉菌Bacillus sp.BI-19产耐高温脂肪酶的基因克隆及其酶学性质研究[D].济南:山东大学,2016.
LIU X M.Cloning and characterization of thermostable lipase from hot springs bacterium Bacillus sp.BI-19[D].Jinan:Shandong University,2016.
[20] THEAN C L,RAJA N Z,MAHIRAN B,et al.High level expression of thermostable lipase from Geobacillus sp.strain T1[J].Bioscience, Biotechnology, and Biochemistry.2004,68(1):96-103.
[21] SUN Q Q,WANG H,ZHANG H T,et al.Heterologous production of an acidic thermostable lipase with broad-range pH activity from thermophilic fungus Neosartorya fischeri P1[J].Journal of Bioscience and Bioengineering,2016,122(5):539-544.
[22] 章旭.一种耐热碱性脂肪酶基因的克隆与表达[D].杭州:浙江大学,2016.
ZHANG X.Study on cloning and expression of a thermotolerant and alkaline lipase gene[D].Hangzhou:Zhejiang University,2016.
[23] 张维清.原料奶中荧光假单胞菌耐热性脂肪酶周质表达及酶学特性研究[D].北京:中国农业科学院,2018.
ZHANG W Q.Periplasmic expression and characterization of thermostable lipase of Pseudomonas Fluorescens from raw milk[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[24] 韩振林.耐热脂肪酶基因在枯草芽孢杆菌中的克隆与表达[D].天津:天津科技大学,2006.
HAN Z L.Cloning and expression of thermostable lipase gene in Bacillus subtilis[D].Tianjin:Tianjin University of Science and Technology,2006.
[25] 李迅,邓若冰,王飞.南极假丝酵母脂肪酶B在毕赤酵母中的分泌型表达及酶学性质初探[J].四川师范大学学报,2014,37(6):911-916.
LI X,DENG R B,WANG F.Expression of Candida antarctica Lipase B in Pichia Pastoris and studying of enzyme properties[J].Journal of Sichuan Normal University,2014,37(6):911-916.
[26] AKBULUT N,ZTRK M T,PIJNING T,et al.Improved activity and thermostability of Bacillus pumilus lipase by directed evolution[J].Journal of biotechnology,2013,164(1):123-129.
[27] PENG X Q.Improved thermostability of lipase B from Candida antarctica by directed evolution and display on yeast surface[J].Applied Biochemistry and Biotechnology,2013,169(2):351-358.
[28] 谭中标.圆弧青霉脂肪酶的异源表达、耐热性改造及底物专一性分析[D].无锡:江南大学,2014.
TAN Z B.Heterologous expression of lipase genes from Penicillium cyclopium,engineering thermostability and substrate specificity analysis of the enzymes[D].Wuxi:Jiangnan University,2014.
[29] HAN Z L,HAN S Y,ZHENG S P,et al.Enhancing thermostability of a Rhizomucor miehei lipase by engineering a disulfide bond and displaying on the yeast cell surface[J].Applied Microbiology & Biotechnology,2009,85(1):117-126.
[30] YU X W,TAN N J,XIAO R.Engineering a disulfide bond in the lid hinge region of Rhizopus chinensis lipase:Increased thermostability and altered acyl chain length specificity[J].PLOS ONE,2012,7(10):1-7.
[31] 姜占宝.提高脂肪酶热稳定性的理性设计研究[D].昆明:云南师范大学,2019.
JIANG Z B.Improving the thermostability of lipase based on rational design[D].Kunming:Yunnan Normal University,2019.
[32] 吴厚军.理性设计提高华根霉脂肪酶耐热性及其前肽功能研究[D].无锡:江南大学,2014.
WU H J.Improvement of thermostability of Rhizopus chinensis lipase by rational design and the function of its prosequence[D].Wuxi:Jiangnan University,2014.
[33] QUANG A T,JEONG C J,YOUNG J Y,et al.Development of thermostable Candida antarctica lipase B through novel in silico design of disulfide bridge[J].Biotechnology and Bioengineering,2012,109(4):867-876.
[34] 周换景,何腊平,张义明,等.脂肪酶高选择性催化研究进展[J].粮食与油脂,2013,26(5):1-4.
ZHOU H J,HE L P,ZHANG Y M,et al.Research advance on high selective catalysis by lipase[J].Cereals & Oils,2013,26(5):1-4.
[35] SOLIMAN N A,KNOLL M,ABDEL-FATTAH Y R,et al.Molecular cloning and characterization of thermostable esterase and lipase from Geobacillus thermoleovorans YN isolated from desert soil in Egypt[J].Process Biochemistry,2007,42(7):1 090-1 100.
[36] OLUSESAN A T, AZURA L K,FORGHANI B,et al.Purification, characterization and thermal inactivation kinetics of a non-regioselective thermostable lipase from a genotypically identified extremophilic Bacillus subtilis NS 8[J].New biotechnology,2011,28(6):738-745.
[37] 魏涛,杨昆鹏,郏未未,等.Thermoanaerobacter sp.X514嗜热脂肪酶LipTX的异源表达与酶学性质研究[J].现代食品科技,2016,32(11):91-97.
WEI T,YANG K P,JIA W L,et al.Heterologous Expression and enzymatic properties of lipase lip tx from thermophilic bacterium Thermoanaerobacter sp.strain X514[J].Modern Food Science and Technology,2016,32(11):91-97.
[38] 高嘉心.来源于类芽孢杆菌属脂肪酶的克隆表达、酶学性质及其催化合成棕榈酸乙酯的研究[D].广州:华南理工大学,2018.
GAO J X.Study on the cloning and expression,characterization of lipase from paenibacillus pasadenensis CS0611 and the synthesis of ethyl palmitate[D].Guangzhou:South China University of Technology,2018.
[39] SHARMA R,SONI S K,VOHRA R M,et al.Purification and characterization of a thermostable alkaline lipase from a new thermophilic Bacillus sp.RSJ-1[J].Process Biochemistry,2002,37(10):1 075-1 084.
[40] MHETRAS N C,BASTAWDE K B,GOKHALE D V.Purification and characterization of acidic lipase from Aspergillus niger NCIM 1207[J].Bioresource Technology,2009,100(3):1 486-1 490.
[41] 杨江科,张正平,刘立营,等.黑曲霉(Aspergillus niger)F044脂肪酶新型基因lipB的克隆、表达及酶学性质分析[J].微生物学报,2009,(8):1 095-1 101.
YANG J K,ZHANG Z P,LIU L Y,et al.Cloning, expression and characterization of a novel lipase gene lipB from Aspergillus niger F044[J].Acta Microbiologica Sinica,2009,(8):1 095-1 101.
[42] 刘光.黑曲霉脂肪酶的分离纯化及其性质研究[D].广州:华南理工大学,2013.
LIU G.Production,purification and characteristic of lipase from Aspergillus niger[D].Guangzhou:South China University of Technology,2013.
[43] KUMAR S,PAHUJANI S,OLA R P,et al.Enhanced thermostability of silica-immobilized lipase from Bacillus coagulans BTS-3 and synthesis of ethyl propionate[J].Acta microbiologica et immunologica Hungarica,2007,53(2):219-231.
[44] SARANYA P,SELVI P K,SEKARAN G.Integrated thermophilic enzyme-immobilized reactor and high-rate biological reactors for treatment of palm oil-containing wastewater without sludge production[J].Bioprocess and Biosystems Engineering,2019,42(6):1 053-1 064.
[45] PALOMO M,SEGURA R L,FERNNDEZ-LORENTE G,et al.Purification, immobilization, and stabilization of a lipase from Bacillus thermocatenulatus by interfacial adsorption on hydrophobic supports[J].Biotechnology progress,2004,20(2):630-635.
[46] BHARDWAJ K K,SAUN N K,GUPTA R.Immobilization of lipase from Geobacillus sp.and its application in synthesis of methyl salicylate[J].Journal of Oleo Science,2017,66(4):391-398.
[47] NEHAL F,SAHNOUN M,DAB A,et al.Production optimization, characterization, and covalent immobilization of a thermophilic Serratia rubidaea lipase isolated from an Algerian oil waste[J].Springer Netherlands,2019,46(3):3 167-3 181.
[48] PRITESH G,KAKOLI D,SWATI M,et al.Characterization of cross-linked immobilized lipase from thermophilic mould Thermomyces lanuginosa using glutaraldehyde[J].Bioresource Technology,2009,100(18):4 074-4 076.
[49] 黄家岭.细菌源脂肪酶的发酵生产及其纯化和固定化工艺研究[D].贵阳:贵州师范大学,2009.
HUANG J L.Study on lipase production by bacteria fermentation,its purification and immobilization processing[D].Guiyang:Guizhou Normal University,2009.
[50] 张玲敏,王斌,潘力.南极假丝酵母脂肪酶B在黑曲霉中的分泌表达及其硅藻土固定化应用[J].食品科学,2019,40(14):107-114.
ZHANG L M,WANG B,PAN L.Ecretory expression of Candida antarctica lipase B in Aspergillus niger and its application in diatomite immobilization[J].Food Science,2019,40(14):107-114.