猪肉及其产品在人类食物消费中占有举足轻重的地位,是人体所需蛋白质的主要来源之一,但在屠宰生猪时会产生大量猪皮。我国是全世界最大的猪肉生产和消费大国,每年约产猪皮6亿多张,猪皮资源相当丰富。猪皮中蛋白质含量占35%,主要是胶原蛋白,约占总蛋白含量的88%左右[1]。猪皮胶原蛋白含有18种氨基酸,营养价值较高,可增进皮肤弹性,起到改善人体微循环和细胞新陈代谢的作用。因此,如何高值利用猪皮中胶原蛋白已成为当前研究的热点[2]。目前对于猪皮的利用和研究主要还是水解获得功能性肽类,主要方法为酸水解法[2]、碱水解法[2]、酶水解法[3]、氧化水解法[4]以及混合水解法[5]。其中张康华等[6]研究pH渐变条件下采用碱性蛋白酶和菠萝蛋白酶分步酶解猪皮得到不同分子质量胶原蛋白肽,LAN等[4]用超声波处理辅助酶解,获得了更好的酶解效果。但该类方法获得的水解产物只是食品工业中一种中间产物,在实际生产中很有局限性,难以投入大规模生产,仍有80%的猪皮被废弃,造成大量环境污染[7]及蛋白资源的浪费。
固态发酵作为一种经济、高效的发酵技术,已经在食品工业中被广泛利用[8]。发酵过程中,微生物产生的一些酶系会促进营养、活性成分的生成,同时生长代谢也会分泌复杂的代谢产物,形成特殊的发酵风味。其中霉菌生长繁殖快,产酶效率高,发酵风味优良,是固态发酵中最常用的微生物之一[9]。如GULSUNOGLU等[10]利用曲霉处理苹果废渣来生产抗氧化酚类;SAMURAILATPAM等[11]利用枯草芽孢杆菌固态发酵大豆提高大豆的抗氧化性能。常见的发酵火腿[12]、发酵香肠[13]等食品的生产中也有霉菌的功劳。在中国绍兴的腐乳生产中有一种常见的优质霉菌——总状毛霉XH-22。该霉菌可分泌蛋白酶、脂肪酶等酶类,能提升产品营养并且赋予食品肉香和脂肪香味,是食品发酵工业中一种非常重要的微生物。
本文以总状毛霉XH-22为菌种对猪皮进行固态发酵,研究猪皮在发酵过程中表观结构,蛋白酶活力,游离氨基酸、多肽、可溶性蛋白等营养成分含量以及挥发性风味物质的动态变化,为发酵猪皮的标准化生产提供参考,对改进猪皮的加工方式,开发相关的功能性食品具有重要意义。
1 材料与方法
1.1 材料与设备
1.1.1 原料与试剂
灭菌脱脂猪皮,平阳县锦华宠物用品有限公司;总状毛霉XH-22,绍兴咸亨腐乳厂;KH2PO4、Na2HPO4·12H2O、乙醇、戊二醛、甘氨酸、NaOH、HCl、2,4,6-三甲基吡啶、三氯乙酸(trichloroacetic acid,TCA)、无水Na2CO3(均为分析纯),上海凌峰化学试剂有限公司;Gly-Gly-Tyr-Arg四肽标准物、硼酸,福林酚试剂、双缩脲试剂、葡萄糖琼脂液体培养基(potato dextrose broth,PDB)、酪氨酸、酪蛋白、牛血清蛋白,美国Sigma-Aldrich公司。
1.1.2 仪器与设备
S-433D型氨基酸自动分析仪,德国Sykam;Gemini 500高分辨扫描电子显微镜(scanning electron microscope, SEM),德国Zeiss;752N紫外可见分光光度计,上海精科仪器有限公司;TGL-16M高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;U410-86超低温冰箱,英国New Brunswick Scientific;SCIENTZ-12N冷冻干燥机,宁波新芝生物科技股份有限公司;TRACE1300-ISQQD型气相色谱-质谱联用仪,美国Thermo Fisher Scientific。
1.2 实验方法
1.2.1 毛霉孢子悬浮液的制备
称取37.5 g PDB培养基,加入1 L水,充分溶解,在121 ℃高压灭菌锅中灭菌30 min,冷却后接种毛霉孢子。25 ℃恒温箱中培养48 h后,加入含1%(质量分数)NaCl的无菌生理盐水,振荡均匀后过滤、计数,计数结果约为1×109~1×1011CFU/mL的毛霉孢子悬浮液,-4 ℃冷藏备用。
1.2.2 猪皮固态发酵
根据实验室已优化方法进行猪皮的预处理和固态发酵,流程如下:
猪皮灭菌→样品分割→浸泡→接种培养→取样观察
猪皮灭菌时,刮去多余脂肪和猪毛,然后用质量分数3%左右的食品级双氧水浸泡灭菌3 h,清水反复清洗。
随后切成3 cm×3 cm片状规格。于添加乳清蛋白2.1 g/100mL,葡萄糖1.7 g/100mL的浸泡液中浸泡30 min。然后接种毛霉孢子悬浮液于25 ℃恒温恒湿培养箱中培养。分别于发酵0、1、2、3、4、5、6、7 d取样,实验设置3个重复样本。
1.2.3 SEM微观结构观察
参考SAFORA等[14]和IVAN等[15]的样品预处理方法,并略微改进。取样品用2.5%(体积分数)戊二醛固定12 h,使用磷酸缓冲液冲洗3次,15 min/次。然后再用体积分数50%,70%,85%,90%的乙醇梯度脱水,15 min/次,再用无水乙醇脱水2次,15 min/次。脱水完成后冷冻干燥24 h,切成2~3 mm薄片备用,喷金,在扫描电镜下观察结构。
1.2.4 游离氨基酸分析
参考王馨雨等[16]和云金虎等[17]的方法,并略微改进。分别准确称取2.000 g猪皮,研磨后加入4%(体积分数)的磺基水杨酸萃取,用10 mL容量瓶定容,振荡混匀,静置1 h,12 000 r/min下离心10 min,吸取上清液,最后上清液用孔径为0.22 μm滤膜抽滤,滤液备用。使用氨基酸全自动分析仪测定游离氨基酸组成。
1.2.5 多肽含量的测定
参考鲁伟等[18]的方法,并略微改进。取样品2.000 g,加入10 mL TCA水溶液,混合均匀,静置10 min,然后在4 000 r/min下离心15 min,将上清液全部转移到50 mL容量瓶,并用5%(质量分数)的TCA定容至刻度;然后取6.0 mL上述溶液置于另一试管中,加入双缩脲试剂4.0 mL,混合均匀,静置10 min,2 000 r/min离心10 min,取上清液于540 nm下测定吸光度值,对照标准曲线求得样品中多肽含量。
1.2.6 可溶性蛋白含量测定
参考考马斯亮蓝法[19]测定样品中可溶性蛋白的含量。
1.2.7 蛋白酶活力的测定
参考GB/T 23527—2009《蛋白酶制剂》[20]和张云娟等[21]的方法测定样品中蛋白酶活力。
1.2.8 挥发性风味成分分析
参考李诚等[22]的方法并稍作修改。精确称取(3.00±0.01)g绞肉机绞碎样品后,加入500 μL 2,4,6-三甲基吡啶,装入15 mL顶空进样瓶中。将活化过的75 μm PDMS SPME萃取头置于顶空瓶中样品正上方。将顶空瓶放入60 ℃恒温水浴锅中萃取40 min,待萃取完毕后手动取出萃取头,并置入气相质谱联用仪进样口内热解析。
进样口参数:选择不分流模式,温度为250 ℃,载气为氦气,流速控制为1 mL/min。
GC条件:DB-5 MS弹性毛细管柱60 m×0.32 mm×1 μm,起始温度40 ℃保持10 min,以5 ℃/min升温至200 ℃,保持5 min,以20 ℃/min升温至250 ℃,保持5 min。
MS条件:EI模式,离子源温度250 ℃,传输线温度250 ℃,全质量扫描范围为35~500 amu,间隔时间0.2 s。
数据处理和挥发性风味物质的定性和定量:数据通过与标准谱库(NIST 2014和 Wiley 9)中的谱图进行自动匹配,并结合文献进行人工解析,对挥发性风味物质进行定性,利用内标物峰面积进行定量。
1.3 数据处理
数据采用SPSS 26软件进行整理分析,采用Origin 2019b软件作图。
2 结果与分析
2.1 猪皮发酵过程中表面结构的变化
如图1所示,在毛霉固态发酵过程中,猪皮的表面结构发生了很大变化,胶原纤维结构部分裂解,质地从紧致变疏松。发酵1 d时猪皮胶原纤维结构还呈现明显捆绑结构;发酵3 d时捆绑结构略微解体;5 d 时猪皮纤维分散,捆绑结构基本消失但质地紧密;7 d时捆绑结构消失且结构松散。分析原因,可能是由于毛霉的生长代谢改变其结构,分泌蛋白酶把胶原纤维蛋白分解成小分子物质,溶解于表面的水中,导致纤维结构解体,逐渐由密变稀。

a-发酵1 d;b-发酵3 d;c-发酵5 d;d-发酵7 d
图1 猪皮固态发酵过程中表面结构的SEM图
Fig.1 SEM images of the surface structure of pigskin during solid-state fermentation
2.2 猪皮发酵过程中蛋白酶活力的动态变化
本研究采用灭菌脱脂猪皮,总状毛霉在其表面固态发酵过程中主要分泌蛋白酶。如图2所示,在发酵过程中,毛霉分泌的蛋白酶活力呈现先上升后下降趋势,发酵2 d酶活力上升至21.391 0 U/g,发酵2~5 d显著上升,5 d后酶活力到达最高点54.733 4 U/g,之后逐渐下降至42.924 2 U/g。可能的原因是发酵2 d时毛霉生长至旺盛期,开始分泌蛋白酶,发酵2~5 d分泌蛋白酶速度大于酶失活速度,酶活力逐渐上升,5 d后毛霉老化开始产生孢子,产酶效率下降,产酶速度小于酶失活速度,导致毛霉发酵5 d后蛋白酶活力下降。
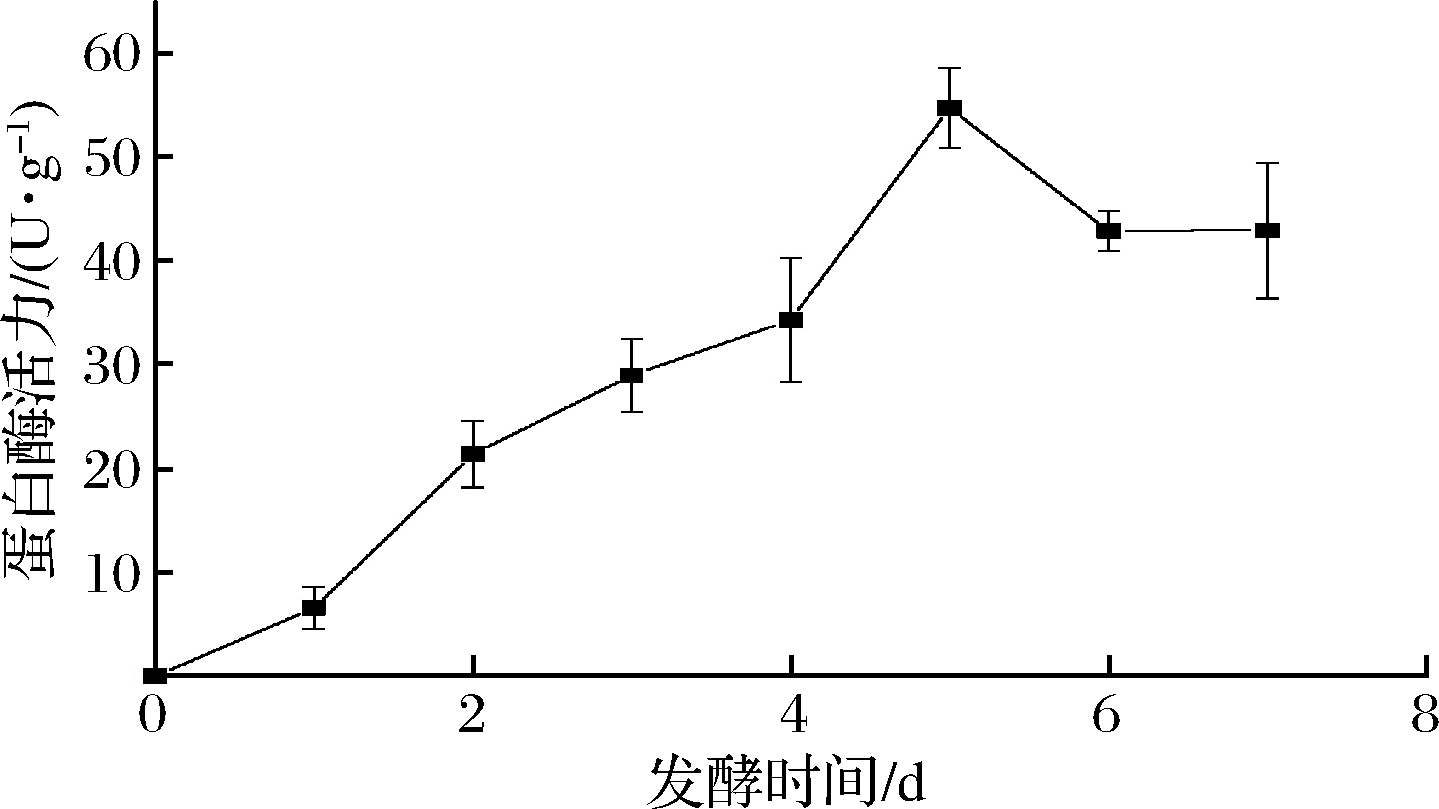
图2 猪皮固态发酵过程中蛋白酶活力的动态变化
Fig.2 Dynamic changes of protease activity during solid-state fermentation of pigskin
2.3 猪皮发酵过程中游离氨基酸含量的动态变化
由表1和图3可知,各种游离氨基酸的含量随着猪皮固态发酵时间的增加有着不同程度的变化。其中脯氨酸、丙氨酸、赖氨酸、苯丙氨酸发酵3~6 d上升较为明显(P<0.05),脯氨酸为胶原蛋白中含量最多的氨基酸,说明猪皮中胶原蛋白在发酵过程中得到了一定程度的水解。除苏氨酸外,其余氨基酸都随着发酵时间的延长,呈缓慢上涨趋势。必需氨基酸中,除了色氨酸没有检测到,其余7种都呈现缓慢上涨趋势。其原因可能是猪皮胶原蛋白中含有的氨基酸种类不齐全,色氨酸、苏氨酸含量较少,就算蛋白水解,苏氨酸含量也不会有较大的提升。在发酵过程中,发酵猪皮的游离氨基酸总量呈现上升趋势,发酵0~6 d,发酵猪皮中游离氨基酸总量由5.711 1 g/100g上升到7.000 1 g/100g,提高了22.6%,其中必需氨基酸总量从1.249 7 g/100g上升到1.484 1 g/100g,提高了18.8%。主要原因是毛霉生长所分泌的蛋白酶酶解了猪皮中的蛋白质,使得游离氨基酸含量逐渐升高。发酵6 d后氨基酸总量和必需氨基酸总量有较不明显的下降趋势(P>0.05),这可能是由于部分氨基酸降解,生产挥发性盐基氮或生成酮类物质,如壬酮、庚酮等。
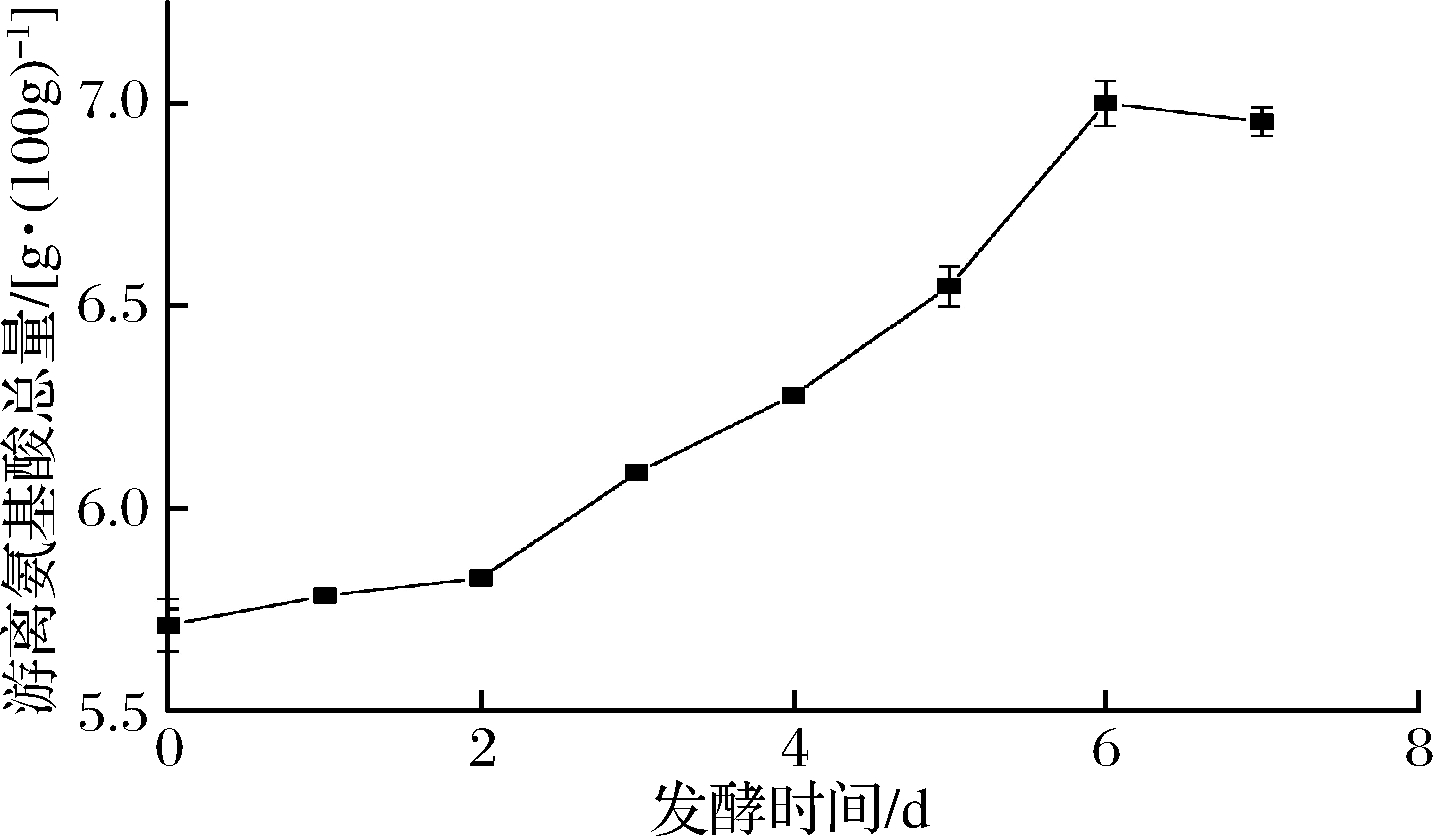
图3 猪皮固态发酵过程中游离氨基酸总量的动态变化
Fig.3 Dynamic changes of total free amino acids during solid-state fermentation of pigskin
2.4 猪皮发酵过程中多肽及可溶性蛋白含量的动态变化
由图4可知,发酵猪皮的可溶性蛋白含量呈现先上升后下降趋势,0~2 d无显著性变化(P>0.05),2~5 d显著上升(P<0.05),5 d后开始下降。主要原因是发酵2 d后毛霉生长所分泌的蛋白酶酶解了猪皮中的蛋白质,将难溶的胶原蛋白分解成分子质量更小的蛋白质,增加了蛋白质的溶解性,使得可溶性蛋白含量逐渐升高,而水中的蛋白质更容易与蛋白酶接触分解成肽类和氨基酸,导致5 d后可溶性蛋白含量下降。在固态发酵过程中(0~7 d),猪皮中多肽含量呈现上升趋势,由0.316 4 g/100g上升到了1.145 9 g/100g,增加了2.6倍,且发酵3~7 d过程中上升显著(P<0.05)。分析原因,主要是发酵3 d后是蛋白酶分泌的旺盛时期,酶活力提高,并且可溶性蛋白含量增加,更易与蛋白酶接触,使得多肽含量显著升高。
表1 猪皮发酵过程中游离氨基酸的含量变化(n=3) 单位:g/100g
Table 1 Changes of free amino acids content in pigskin fermentation process(n=3)

游离氨基酸0 d1 d2 d3 d4 d5 d6 d7 d天冬氨酸(Asp)0.538 4±0.008 6c0.542 2±0.001 3c0.540 6±0.001 1c0.541 5±0.007 1c0.546 8±0.006 4bc0.549 8±0.004 9abc0.561 5±0.002 4a0.558 8±0.001 4ab苏氨酸(Thr)0.162 7±0.004 1cd0.160 7±0.000 7d0.161 7±0.000 7d0.163 7±0.000 7bcd0.164 0±0.000 4bcd0.166 0±0.000 8abc0.168 8±0.001 4a0.167 2±0.000 4ab丝氨酸(Ser)0.787 1±0.003 5c0.790 5±0.001 0c0.790 7±0.000 7c0.792 2±0.000 1c0.793 4±0.000 3c0.818 4±0.019 7b0.866 5±0.014 1a0.870 1±0.006 4a谷氨酸(Glu)0.839 9±0.004 7d0.863 4±0.015 7cd0.863 9±0.000 9bcd0.859 8±0.014 1cd0.872 2±0.003 4bc0.889 3±0.013 5ab0.905 3±0.011 2a0.882 7±0.008 7abc脯氨酸(Pro)0.585 5±0.017 4e0.587 2±0.001 0e0.589 8±0.014 1e0.700 1±0.000 3d0.735 6±0.017 4c0.803 9±0.000 9b1.014 9±0.002 3a1.006 6±0.009 4a甘氨酸(Gly)0.353 1±0.009 3e0.353 4±0.001 6e0.359 6±0.007 1de0.374 9±0.007 0cd0.386 6±0.009 5bc0.398 2±0.001 1ab0.396 5±0.009 5ab0.406 1±0.010 1a丙氨酸(Ala)0.330 8±0.000 6e0.340 5±0.001 0e0.344 4±0.003 0e0.408 9±0.010 8d0.464 9±0.000 5c0.507 1±0.000 8b0.589 4±0.013 5a0.593 9±0.005 7a胱氨酸(Cys)0.157 1±0.003 5d0.158 2±0.002 3d0.162 2±0.001 4cd0.166 2±0.002 3bcd0.168 9±0.001 4abc0.178 2±0.002 3a0.172 7±0.010 0ab0.178 1±0.002 4a缬氨酸(Val)0.198 3±0.000 6d0.200 6±0.003 7d0.205 5±0.001 4cd0.211 5±0.002 4bc0.219 6±0.002 5ab0.218 4±0.002 6ab0.226 0±0.007 6a0.220 0±0.000 3a甲硫氨酸(Met)0.102 2±0.001 4f0.102 7±0.000 6f0.111 9±0.001 8e0.116 1±0.000 6d0.120 8±0.000 6c0.129 1±0.003 6b0.137 3±0.000 9a0.137 2±0.001 0a异亮氨酸(Ile)0.209 9±0.004 7e0.216 0±0.005 4de0.220 7±0.000 7d0.228 9±0.001 3c0.235 5±0.001 4bc0.240 5±0.001 0ab0.246 5±0.000 0a0.242 2±0.003 4ab亮氨酸(Leu)0.343 2±0.004 8ef0.340 5±0.001 0f0.342 2±0.001 4ef0.349 5±0.002 4de0.353 2±0.004 7d0.361 5±0.000 4c0.391 0±0.005 1a0.380 6±0.001 1b酪氨酸(Tyr)0.469 8±0.014 1cd0.463 4±0.003 1d0.458 9±0.003 3d0.468 6±0.001 1cd0.483 9±0.013 2bc0.500 6±0.003 7ab0.513 9±0.010 5a0.514 9±0.002 3a苯丙氨酸(Phe)0.131 2±0.002 1f0.135 5±0.001 4ef0.141 3±0.001 5e0.153 9±0.000 8d0.162 2±0.003 4c0.166 7±0.001 5bc0.174 8±0.007 1a0.172 2±0.003 4ab赖氨酸(Lys)0.102 2±0.001 4d0.113 4±0.004 4cd0.112 9±0.000 4cd0.121 7±0.002 1c0.136 5±0.014 2b0.161 1±0.004 4a0.162 9±0.002 3a0.164 7±0.000 4a组氨酸(His)0.092 1±0.003 3c0.095 0±0.000 5c0.095 5±0.001 4c0.096 5±0.000 0c0.097 7±0.005 1c0.110 5±0.001 0b0.114 9±0.002 3ab0.119 1±0.001 8a精氨酸(Arg)0.307 9±0.009 3f0.320 5±0.001 0ef0.325 6±0.001 3de0.333 6±0.001 3cde0.337 2±0.003 7bcd0.348 9±0.003 3ab0.357 4±0.010 7a0.340 5±0.001 0bc游离氨基酸总量5.711 1±0.065 4f5.783 6±0.015 3ef5.827 1±0.016 7e6.087 3±0.005 4d6.278 6±0.008 1c6.547 7±0.049 9b7.000 1±0.056 2a6.954 5±0.034 6a
注:同行数据肩标字母相同表示差异不显著(P>0.05)
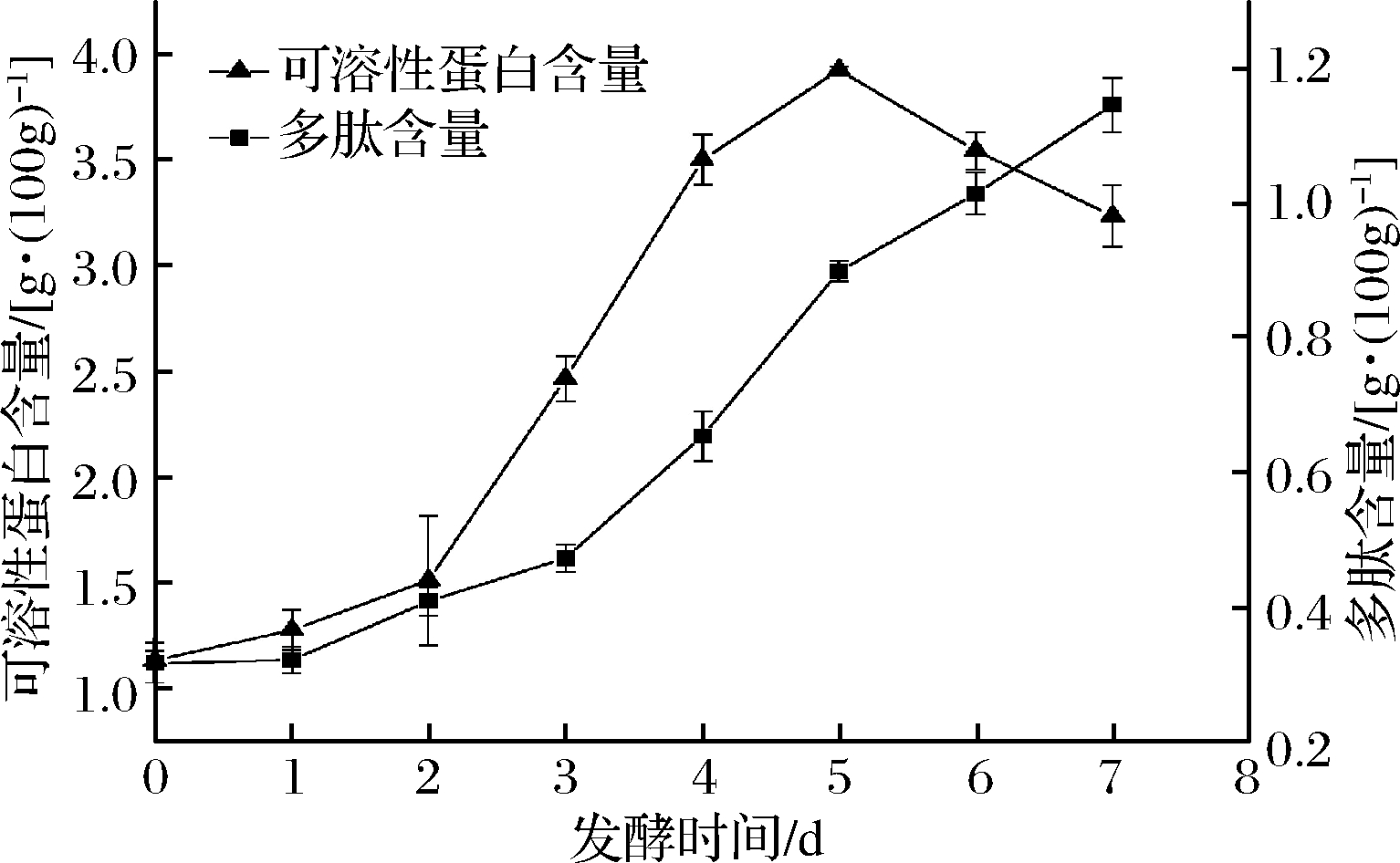
图4 猪皮固态发酵过程中多肽含量及可溶性蛋白含量的动态变化
Fig.4 Dynamic changes of polypeptide content and soluble protein content during solid-state fermentation of pigskin
2.5 猪皮发酵过程中挥发性成分的动态变化
猪皮毛霉固态发酵过程中共检测出主要挥发性风味成分的组分共35种,如表2所示。以醛类、醇类、酮类、酯类为主,还有其他类被检出。如表2和图5所示,在发酵0~7 d,挥发性风味成分的种类逐渐增加。发酵0 d的猪皮共检测出主要挥发性物质15种。到发酵3 d共检测出主要挥发性物质18种。发酵7 d共检测出主要挥发性物质29种。发酵7 d检出的主要挥发性成分有18种未在发酵0 d检出,尤其是醛类和醇类物质种类的增加,分别有3-甲基丁醛、正己醛、正辛醛、苯乙醛、反-2-辛烯醛、十二醛、十一醛、正己醇、1-烯-3-辛醇、2-壬醇、苯乙醇、1-壬醇。醛类物质阈值较低,对发酵风味的贡献较大。醇类主要由脂肪酸过氧化物降解产生,或者来自醛酮类羰基化合物的还原作用[23]。此外,酮类物质随着时间的推移,含量显著上升,尤其是2-壬酮、2-庚酮,可能是由氨基酸的降解生成[23]。酯类物质可赋予猪皮独特的酯香味,虽然含量不高,但是会对发酵猪皮的整体风味起到一定的增香作用[23]。
表2 猪皮发酵过程中主要挥发性风味物质及其含量变化(n=3) 单位:ng/g
Table 2 Changes of main volatile flavor compounds and their contents in pigskin fermentation process(n=3)
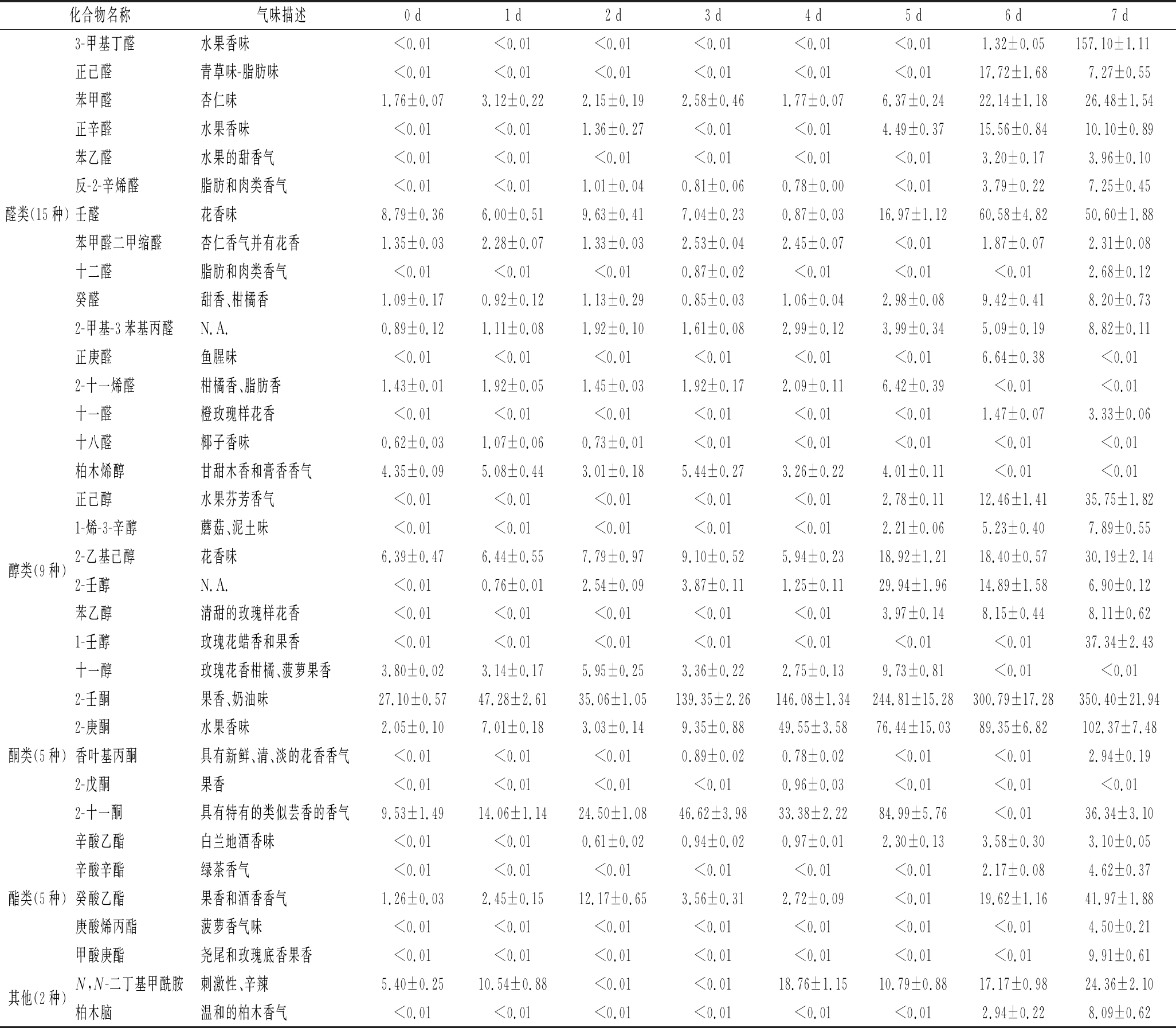
化合物名称气味描述0 d1 d2 d3 d4 d5 d6 d7 d3-甲基丁醛水果香味<0.01<0.01<0.01<0.01<0.01<0.011.32±0.05157.10±1.11 正己醛青草味-脂肪味<0.01<0.01<0.01<0.01<0.01<0.0117.72±1.687.27±0.55苯甲醛杏仁味1.76±0.073.12±0.222.15±0.192.58±0.461.77±0.076.37±0.2422.14±1.1826.48±1.54正辛醛水果香味<0.01<0.011.36±0.27<0.01<0.014.49±0.3715.56±0.8410.10±0.89苯乙醛水果的甜香气<0.01<0.01<0.01<0.01<0.01<0.013.20±0.173.96±0.10反-2-辛烯醛脂肪和肉类香气<0.01<0.011.01±0.040.81±0.060.78±0.00<0.013.79±0.227.25±0.45醛类(15种)壬醛花香味8.79±0.366.00±0.519.63±0.417.04±0.230.87±0.0316.97±1.1260.58±4.8250.60±1.88苯甲醛二甲缩醛杏仁香气并有花香1.35±0.032.28±0.071.33±0.032.53±0.042.45±0.07<0.011.87±0.072.31±0.08十二醛脂肪和肉类香气<0.01<0.01<0.010.87±0.02<0.01<0.01<0.012.68±0.12癸醛甜香、柑橘香1.09±0.170.92±0.121.13±0.290.85±0.031.06±0.042.98±0.089.42±0.418.20±0.732-甲基-3苯基丙醛N.A.0.89±0.121.11±0.081.92±0.101.61±0.082.99±0.123.99±0.345.09±0.198.82±0.11正庚醛鱼腥味<0.01<0.01<0.01<0.01<0.01<0.016.64±0.38<0.012-十一烯醛柑橘香、脂肪香1.43±0.011.92±0.051.45±0.031.92±0.172.09±0.116.42±0.39<0.01<0.01十一醛橙玫瑰样花香<0.01<0.01<0.01<0.01<0.01<0.011.47±0.073.33±0.06十八醛椰子香味0.62±0.031.07±0.060.73±0.01<0.01<0.01<0.01<0.01<0.01柏木烯醇甘甜木香和膏香香气4.35±0.095.08±0.443.01±0.185.44±0.273.26±0.224.01±0.11<0.01<0.01正己醇水果芬芳香气<0.01<0.01<0.01<0.01<0.012.78±0.1112.46±1.4135.75±1.821-烯-3-辛醇蘑菇、泥土味<0.01<0.01<0.01<0.01<0.012.21±0.065.23±0.407.89±0.55醇类(9种)2-乙基己醇花香味6.39±0.476.44±0.557.79±0.979.10±0.525.94±0.2318.92±1.2118.40±0.5730.19±2.142-壬醇N.A.<0.010.76±0.012.54±0.093.87±0.111.25±0.1129.94±1.9614.89±1.586.90±0.12苯乙醇清甜的玫瑰样花香<0.01<0.01<0.01<0.01<0.013.97±0.148.15±0.448.11±0.621-壬醇玫瑰花蜡香和果香<0.01<0.01<0.01<0.01<0.01<0.01<0.0137.34±2.43十一醇玫瑰花香柑橘、菠萝果香3.80±0.023.14±0.175.95±0.253.36±0.222.75±0.139.73±0.81<0.01<0.012-壬酮果香、奶油味27.10±0.5747.28±2.6135.06±1.05139.35±2.26146.08±1.34244.81±15.28300.79±17.28350.40±21.942-庚酮水果香味2.05±0.107.01±0.183.03±0.149.35±0.8849.55±3.5876.44±15.0389.35±6.82102.37±7.48酮类(5种)香叶基丙酮具有新鲜、清、淡的花香香气<0.01<0.01<0.010.89±0.020.78±0.02<0.01<0.012.94±0.192-戊酮果香<0.01<0.01<0.01<0.010.96±0.03<0.01<0.01<0.012-十一酮具有特有的类似芸香的香气9.53±1.4914.06±1.1424.50±1.0846.62±3.9833.38±2.2284.99±5.76<0.0136.34±3.10辛酸乙酯白兰地酒香味<0.01<0.010.61±0.020.94±0.020.97±0.012.30±0.133.58±0.303.10±0.05辛酸辛酯绿茶香气<0.01<0.01<0.01<0.01<0.01<0.012.17±0.084.62±0.37酯类(5种)癸酸乙酯果香和酒香香气1.26±0.032.45±0.1512.17±0.653.56±0.312.72±0.09<0.0119.62±1.1641.97±1.88庚酸烯丙酯菠萝香气味<0.01<0.01<0.01<0.01<0.01<0.01<0.014.50±0.21甲酸庚酯尧尾和玫瑰底香果香<0.01<0.01<0.01<0.01<0.01<0.01<0.019.91±0.61其他(2种)N,N-二丁基甲酰胺刺激性、辛辣5.40±0.2510.54±0.88<0.01<0.0118.76±1.1510.79±0.8817.17±0.9824.36±2.10柏木脑温和的柏木香气<0.01<0.01<0.01<0.01<0.01<0.012.94±0.228.09±0.62

图5 猪皮固态发酵0~7 d主要挥发性物质总量的动态变化
Fig.5 Dynamic changes of the total amount of main volatile substances in pigskin solid-state fermentation for 0-7 days
3 结论
本文研究了猪皮毛霉固态发酵过程中猪皮表观结构,主要营养成分,相关酶活力变化以及挥发性风味物质变化。结果表明,与未发酵的猪皮相比,经毛霉固态发酵后猪皮的游离氨基酸、多肽含量呈现随时间延长而增加的趋势,可溶性蛋白含量、蛋白酶活力呈先上升后下降趋势,于5 d达到最大值,挥发性风味物质增加12种,醇、醛、酯类物质显著增多,酮类含量显著增加。本研究结果表明毛霉固态发酵猪皮后能提高猪皮营养价值,改善猪皮风味,本研究为利用猪皮开发功能性配料或食品提供理论依据。
[1] 张慧芸,陈俊亮,康怀彬,等.猪皮胶原蛋白水解物体外抗氧化作用模式初探[J].食品与发酵工业,2012,38(9):54-58.
ZHANG H Y, CHEN J L, KANG H B,et al.Antioxidant activity and the possible mechanism pig skin collagen hydrolysates[J].Food and Fermentation Industries,2012,38(9):54-58.
[2] 杨芳宁,张慧芸,康怀彬.猪皮胶原蛋白制备及其抗氧化肽水解条件优化[J].食品研究与开发,2013,34(4):65-69.
YANG F N, ZHANG H Y, KANG H B.Preparation of pig skin collagen and optimization of antioxidant peptide hydrolysis conditions[J].Food Research and Development,2013,34(4):65-69.
[3] 李诚,余霞,付刚,等.猪皮胶原蛋白酶解及其酶解产物的抗氧化活性[J].食品科学,2011,32(23):147-151.
LI C, YU X, FU G, et al.Enzymatic preparation and antioxidant activity of porcine skin collagen hydrolysates[J].Food Science,2011,32(23):147-151.
[4] LAN M M,LI W F,CHANG C,et al.Enhancement on enzymolysis of pigskin with ultrasonic assistance[J].Bioengineered,2020,11(1):397-407.
[5] NATHALIA A G, LEIDY J G, JOSÉ E,et al.Kinetic models to produce an antioxidant by enzymatic hydrolysis of bovine plasma protein using a high substrate concentration[J].Current Enzyme Inhibition,2019,15(2):144-153.
[6] 张康华,姜珊,高鹏,等.pH渐变条件下双酶分步酶解的猪皮胶原肽的体内外抗氧化活性研究[J].食品研究与开发,2019,40(20):9-13.
ZHANG K H, JIANG S, GAO P, et al.Study on the anti-oxidation activity of pigskin collagen peptide by double-enzyme step-by-step enzymatic hydrolysis under the condition of pH gradient [J].Food Research and Development,2019,40(20):9-13.
[7] 万红芳,赵勇,王正全,等.生产菌种及环境微生物与腐乳品质关系研究进展[J].食品与发酵工业,2019,45(6):255-261.
WAN H F, ZHAO Y, WANG Z Q, et al.Research progress on the relationship between sufu quality and microorganisms from starters and environment[J].Food and Fermentation Industries,2019,45(6):255-261.
[8] GAO S S,SHANG Z,LI X M, et al.Secondary metabolites produced by solid fermentation of the marine-derived fungus Penicillium commune QSD-17[J].Japan Society for Bioscience, Biotechnology, and Agrochemistry,2014,76(2):358-360.
[9] KUMAR S, KUMAR P, SATYANARAYANA T.Production of raw starch-saccharifying thermostable and neutral glucoamylase by the thermophilic mold Thermomucor indicae-seudaticae in submerged fermentation.[J].Applied biochemistry and biotechnology,2007,142(3):221-230.
[10] GULSUNOGLU Z, PURVES R, KARBANCIOGLU-GULER F, et al.Enhancement of phenolic antioxidants in industrial apple waste by fermentation with Aspergillus spp.[J].Biocatalysis and Agricultural Biotechnology,2020.DOI:10.1016/j.bcab.2020.101562.
[11] SAMURAILATPAM S, AMIT K R, ALI M, et al.Enhancement of antioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J].Journal of Functional Foods,2015,14:650-658.
[12] GE Q F,PEI H J,LIU R, et al.Effects of Lactobacillus plantarum NJAU-01 from Jinhua ham on the quality of dry-cured fermented sausage[J].LWT,2019,101:513-518.
[13] PALAVECINO P N Z, GARRO O A, ROMERO M, et al.Evaluation of an autochthonous starter culture on the production of a traditional dry fermented sausage from Chaco (Argentina) at a small-scale facility[J].Meat Science,2016,115:41-44.
[14] SAFORA N,EBRAHIM A,ALI A N.Effects of different preparation techniques on the microstructural features of biological materials for scanning electron microscopy[J].Journal of Agriculture and Food Research,2020,2:100 036.
[15] IVAN N, ANASTASIA S, ANDREY T, et al.A rapid method of whole cell sample preparation for scanning electron microscopy using neodymium chloride[J].Micron, 2019,124:102 687.
[16] 王馨雨,王蓉蓉,王婷,等.不同品种百合内外鳞片游离氨基酸组成的主成分分析及聚类分析[J].食品科学,2020,41(12):211-220.
WANG X Y, WANG R R, WANG T, et al.Principal component analysis and cluster analysis of free amino acids composition of different species and inner and outer lily bulbs[J].Food Science,202,41(12):211-220.
[17] 云金虎,江皓,韩文学,等.不同品种海棠叶茶游离氨基酸组成分析与评价[J].食品与发酵工业,2020,46(7):1-10.
YUN J H, JIANG H, HAN W X, et al.Analysis and evaluation of free amino acid composition of different cultivars of crabapple leaf tea[J].Food and Fermentation Industries,2020,46(7):1-10.
[18] 鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
LU W, REN G P, SONG J M.Determination of content of peptides in protein hydrolysates[J].Food Science,2005,26(7):169-171.
[19] 中华人民共和国镇江出入境检验检疫局. SN/T 3926—2014 出口乳、蛋、豆类食品中蛋白质含量的测定 考马斯亮蓝法[S].北京:中国标准出版社,2014.
Zhenjiang Entry-Exit Inspection and Quarantine Bureau of the People′s Republic of China. SN/T 3926—2014 Determination of protein content in dairy foods, egg foods and soy foods for export - Coomassie brilliant blue method[S].Beijing:China Standards Press,2014.
[20] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23527—2009 蛋白酶制剂[S].北京:中国标准出版社,2009.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China,Standardization Administration of China.GB/T 23527—2009 Protease preparations [S].Beijing:China Standard Press,2009.
[21] 张云娟,田洋,周学,等.辣木叶毛霉固态发酵过程中主要营养成分及其抗氧化活性的动态变化研究[J].西南农业学报,2019,32(8):1 773-1 778.
ZHANG Y J, TIAN Y, ZHOU X, et al.Dynamic changes of main nutrients and antioxidant activities of mucor Moringa oleifera leaves during solid-state fermentation of Mucor[J].Southwest China Journal of Agricultural Sciences,2019,32(8):1 773-1 778.
[22] 李诚,张静,付刚.跷碛火腿发酵过程中挥发性风味成分的变化[J].食品科学,2010,31(24):405-409.
LI C, ZHANG J, FU G.Change in volatile flavor components in Qiaoqi Ham during fermentation[J].Food science,2010,31(24):405-409.
[23] 王悦齐,李春生,李来好,等.基于GC-MS联用技术分析传统鱼露发酵过程中挥发性风味成分和脂肪酸组分变化[J].水产学报,2018,42(6):984-995.
WANG Y Q, LI C S, LI L H, et al.Analysis of volatile flavor components and fatty acids in fish sauces during fermentation by GC-MS[J].Journal of Fisheries of China, 2008,42(6):984-995.