乳清分离蛋白(whey protein isolate,WPI)是蛋白含量在90%以上的一种乳清蛋白产品。乳清蛋白是干酪生产的副产物乳清中的主要固形物成分,具有较高的营养价值,被广泛应用到加工食品中。乳清蛋白包含β-乳球蛋白(β-lactoglobulin,β-LG)、α-乳白蛋白(α-lactalbumin,α-LA)、牛血清白蛋白等以及其他活性成分。其中β-LG和α-LA在WPI中含量较高,也是牛乳过敏的主要过敏原[1]。已有众多学者研究了乳清蛋白改性技术,来消减乳清蛋白的致敏性。如热处理、酶水解、辐照以及超高压等技术[2-4]。不同加工技术对乳清蛋白结构的影响不同,通过对乳清蛋白结构的修饰,进而影响其致敏性。其中,乳清蛋白致敏性变化程度取决于加工方法、程度、处理时间等。
超高压(ultra-high pressure, UHP)作为近年来较为新型的食品加工技术,有着较为广泛的应用前景。高压过程可以产生强烈的机械应力以及摩擦热,产生局部高热[5],不仅能够使微生物有效破坏,还可以导致蛋白质结构的变化[6],并且在食品工业中易于扩大生产[7]。超高压处理可以通过改变分子间或者分子疏水相互作用以及静电作用而导致蛋白质三级、四级结构的可逆或者不可逆的改变[8],从而使其功能特性发生变化。庞佳坤等[9]利用傅里叶红外光谱探究高压对WPI结构的影响,发现压力可以使其二级结构发生改变。但是,也有研究表明超高压处理后乳清蛋白的三级和四级结构改变,而二级结构并未发生明显的改变[10-11]。蛋白质的致敏性与其结构息息相关[1],超高压对蛋白结构的影响又较为复杂,与压力大小、保压时间、温度以及溶液pH等相关[12]。已有的研究大多聚焦在超高压对蛋白结构以及其他理化性质的影响上面,如溶解性、抗氧化活性等[9,13]。但是少有研究具体探究超高压技术对WPI中致敏蛋白的影响方式和程度。对于超高压对WPI致敏性影响的程度,十分有必要了解其在微观和宏观层面以及后续的胃肠道消化时,如何通过结构的改变影响致敏性。
因此,本研究的目的是探究超高压对于WPI结构以及致敏蛋白含量的影响,降低WPI的致敏性。采用不同的超高压力处理WPI,通过圆二色性光谱、内源荧光光谱、巯基含量等的测定来评估超高压对WPI二级、三级结构的影响,并通过水解度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-page)以及β-LG和α-LA含量的检测来考察超高压对WPI中致敏蛋白含量降解的影响,进而为超高压技术应用在低致敏性乳粉生产中提供一定的理论依据。
1 材料与方法
1.1 材料与设备
乳清分离蛋白(WPI,蛋白质质量分数93.9%),恒天然商贸(上海)有限公司;Ellmans′s试剂、tris-gly、乙二胺四乙酸,美国Sigma公司;β-乳球蛋白以及α-乳白蛋白检测试剂盒,上海酶联生物技术有限公司。其余试剂均为分析纯。FPG7100 型高压设备,德国 IKA 公司;SepectraMax M5酶标仪,美国 Molecular Devices 公司;SPECORD-205 紫外分光光度计,德国Analytikjena公司;J815圆二色光谱仪,日本JASOC公司;PROTEAN3 电泳仪、Geldoc-XR+凝胶成像仪,美国 Bio-Rad 公司。
1.2 实验方法
1.2.1 超高压处理
配制质量浓度为10 mg/mL的WPI溶液,取适量溶液分装于特制包装袋中进行真空包装,后置于超高压压力腔中,进行实验。压力条件为100、200、400和600 MPa,保压时间20 min。以未经压力处理的WPI溶液作为对照。
1.2.2 圆二色性光谱分析
WPI样品稀释至200 μg/mL,加入到石英比色皿(光径0.1 cm)中,置于圆二色光谱仪上进行检测。扫描范围190~250 nm,步长0.5 nm,扫描速度200 nm/min,并用CD Pro软件拟合乳清蛋白中二级结构的组成与含量[14-15]。
1.2.3 总巯基和表面巯基含量的测定
参考MAFORIMBO等[16]的方法,进行测定。表面巯基含量的测定:取200 μL的WPI样品和1 mL的Tris-甘氨酸缓冲液(pH 8.0,含4 mmol/L的EDTA)混合,随后加入20 μL的Ellman′s试剂(4 mg/mL),室温(25±2) ℃避光振荡30 min后测定412 nm处的吸光度值,以仅加Ellman′s试剂为空白对照。总巯基含量的测定和表面巯基含量的测定方法一致,所使用的的缓冲溶液为含有4 mmol/L的EDTA、8 mol/L的尿素,pH 8的tris-gly缓冲溶液。
巯基(SH)含量的计算如公式(1)所示:
SH含量![]()
(1)
式中:A412,样品在412 nm处的吸光值;D,样品的稀释倍数;C,WPI的蛋白质质量浓度,mg/mL。
1.2.4 内源荧光光谱检测
参考GINA等[17]的方法。把样品稀释到1 mg/mL,用酶标仪进行色氨酸内源性荧光分析。激发波长为280 nm,扫描300~400 nm的发射光谱。
1.2.5 超高压对WPI降解情况分析
1.2.5.1 水解度的测定
根据SPELLMAN等[18]描述的方法,采用邻苯二甲醛(o-phthalaldehyde,OPA)法测定样品的水解度,以L-丝氨酸溶液(0.1 g/L)作为标准品。按照文献中描述的方法配置OPA溶液,取400 μL待测样品加入到盛有3 mL OPA溶液的试管中,振荡混匀5 s,避光反应2 min,以去离子水作为空白对照。用紫外分光光度计测量样品在340 nm处的吸光值。按照公式(2)计算水解度:
(2)
式中:ODsa,测得样品的吸光度;ODb,测得空白对照的吸光度;ODst,测得标准品的吸光度;X,样品重量,g;P,样品中蛋白质的含量;0.1,样品体积转换成L。
1.2.5.2 SDS-page凝胶电泳
参考CARULLO等[6]的方法,不同压力条件的WPI样品(1 mg/mL)分别取样进行SDS-page凝胶电泳。采用5%浓缩胶,15%分离胶,上样量为8 μL。电泳初始电压为100 V,待样品进入分离胶时,调整电压至150 V。样品涌动至距凝胶底部0.5 cm时停止电泳。
1.2.5.3 β-LG以及α-LA含量的测定
根据酶联免疫吸附法原理[19]测定样品中β-LG以及α-LA的含量。将样品稀释至1 mg/mL,利用β-LG以及α-LA试剂盒检测样品中2种蛋白的含量。
1.2.6 数据处理及统计分析
所有的实验数据均由平行测定3次得到,结果以平均值±标准差的形式表示。采用Excel 2010以及SPSS Statistics 22.0软件进行统计学分析,显著水平设置为P<0.05,采用Origin Pro 2017对实验数据进行绘图。
2 结果与分析
2.1 UHP对WPI二级结构含量的影响
经过圆二色性光谱拟合软件对圆二色性光谱图进行分析计算,得到WPI表面蛋白结构随不同的超高压变化的情况,如表1所示。和对照组(0.1 MPa)相比,100 MPa组的二级结构变化不明显。可能是产生了结构的回复,有研究显示,在一定的压力保压一段时间后,在很短的时间内,会回复到之前的状态[20]。但到了200 MPa及以上,随着压力的增加,二级结构含量的变化在P<0.05的水平下,较为显著。具体表现为α-螺旋和β-转角的显著减少以及β-折叠和无规则卷曲的显著增加,主要的原因可能是超高压使维持蛋白质α-螺旋结构的氢键以及静电作用减弱,导致部分α-螺旋结构转化为β-折叠结构,以及转角结构的部分解体,蛋白结构变得松散,结果和MUNIZAGA等[21]和LI等[22]的结论一致,超高压处理可以改变WPI的 α-螺旋、β-折叠和无规则卷曲的含量,改变蛋白的二级结构。

图1 不同UHP处理的WPI圆二色性光谱图
Fig.1 The circular dichroism spectrum of WPI in different UHP treatments
表1 不同UHP处理的WPI二级结构含量
Table 1 Secondary structure contents of WPI in different UHP treatments
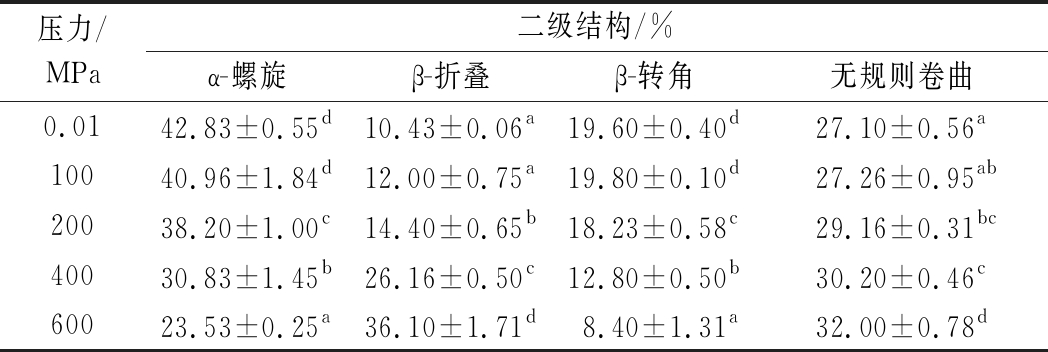
压力/MPa二级结构/%α-螺旋β-折叠β-转角无规则卷曲0.0142.83±0.55d10.43±0.06a19.60±0.40d27.10±0.56a10040.96±1.84d12.00±0.75a19.80±0.10d27.26±0.95ab20038.20±1.00c14.40±0.65b18.23±0.58c29.16±0.31bc40030.83±1.45b26.16±0.50c12.80±0.50b30.20±0.46c60023.53±0.25a36.10±1.71d8.40±1.31a32.00±0.78d
注:同一列不同的上标小写字母表示差异性显著(P<0.05)(下同)
2.2 UHP对WPI巯基含量的影响
巯基是蛋白质中重要的功能基团之一,具有较高的生物活性,可与二硫键在巯基/二硫键氧化还原酶的催化下相互转化,对蛋白质三维构象的稳定性起着重要的作用。游离巯基含量的变化可以在一定程度上反映蛋白质在外界作用下发生的去折叠或变性的情况[23-24]。而且,相关的研究显示,蛋白质的致敏能力与其结构相关[1,25]。不同的UHP水平对WPI的表面巯基和总巯基的含量影响如图2所示。与未经过压力处理的样品相比,100 MPa就能使WPI的巯基含量显著增加(P<0.05),这是由于超高压可以使蛋白质的三维构象发生变化,使折叠的巯基暴露或破坏部分二硫键转化为游离巯基。随着压力的逐渐增加,巯基含量也呈增加的趋势,这和前人的研究一致[26],从图2也可以看出,超高压对于表面巯基比总巯基的影响更大。400 MPa处理组,总巯基含量提高了25.92%,表面巯基提高了104.82%。而600 MPa组和400 MPa组对比不显著,巯基含量的增量出现了减小的趋势,可能的原因是在过高的压力下,WPI可能发生了不可逆的变性,BELLOQUE等[27]的研究也表明了同样的结果。

图2 不同UHP处理的WPI总巯基和表面巯基含量
Fig.2 Total and surface sulfhydryl contents of different UHP treatments on WPI
2.3 UHP对WPI内源性荧光光谱的影响
蛋白质分子中的色氨酸、酪氨酸以及苯丙氨酸能够发射荧光,因此这3种氨基酸可以作为内源性荧光探针来预测蛋白质三级结构的变化情况[28-29]。从图3 可以看出,超高压处理导致WPI荧光强度以及最大吸收波长位置的变化。对照组和实验组的最大荧光波长出现在331 nm附近。100、200以及400 MPa处理组荧光强度较对照组弱,随着压力的增大,荧光强度逐渐增强。600 MPa使得WPI的荧光强度显著增强,这说明较高的压力使得WPI内部的疏水基团暴露,造成色氨酸残基在WPI溶液中的暴露量发生改变。所有的实验组均发生了较为明显的红移,这反映了WPI结构中氨基酸侧链的变化。YIN等[30]的研究也显示超高压处理增加色氨酸残基在溶剂中的暴露,进而增加红芸豆分离蛋白的荧光强度。
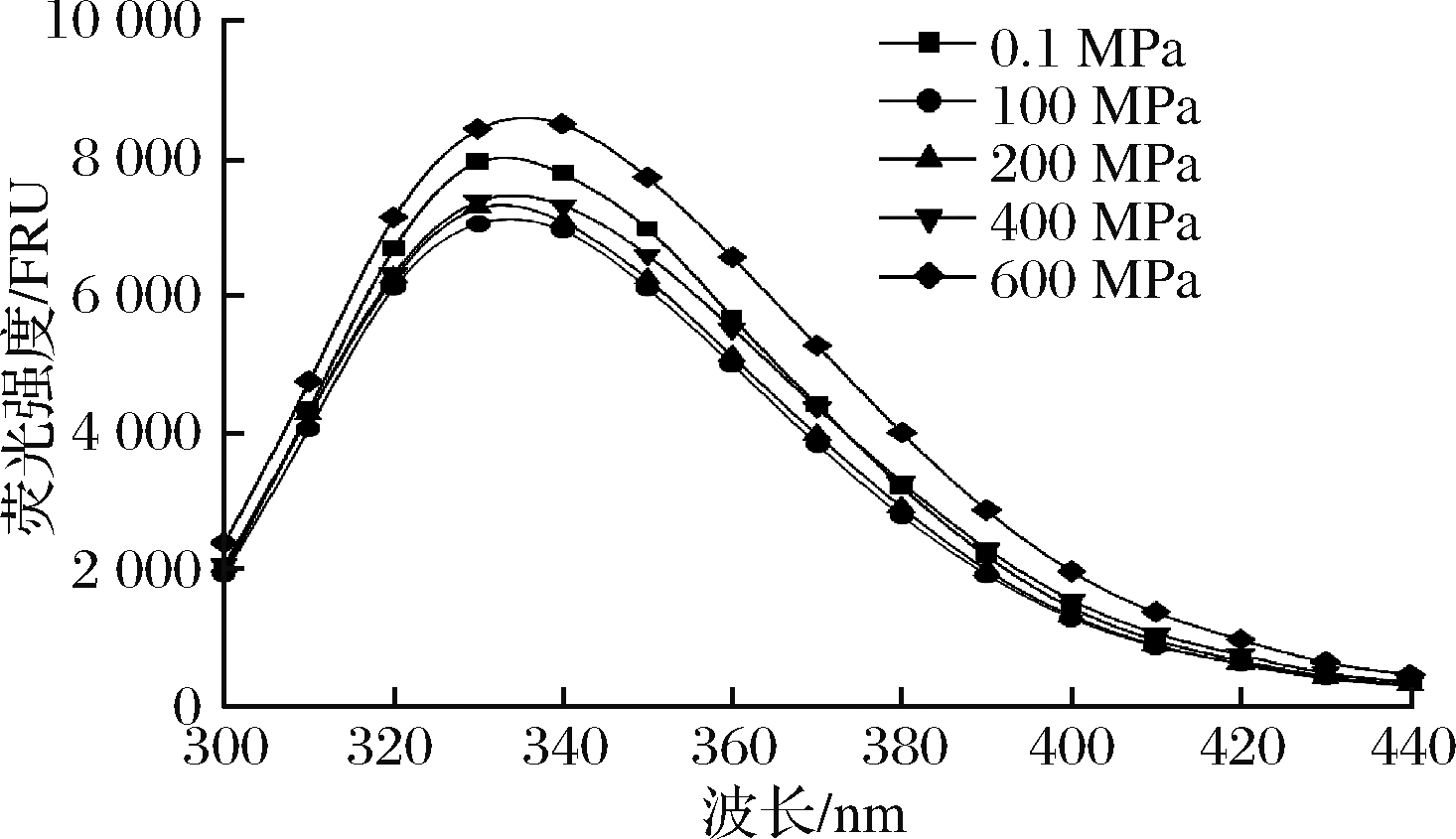
图3 不同UHP处理的WPI内源荧光光谱
Fig.3 Endogenous fluorescence spectra of WPI in different UHP treatments
2.4 UHP对WPI降解的影响
2.4.1 UHP对WPI水解度的影响
水解度可以作为评估蛋白质分子质量降解的一个指标,蛋白分子质量降解得越多,水解度越高[31]。故可以用水解度来评估WPI中致敏蛋白降解的程度。从表2可以看出,不同的压力水平对WPI水解度的影响不显著(P<0.05)。这表明超高压对致敏蛋白的含量降解影响较小。这与CARULLO等[6]的结论一致,他的研究说明,超高压处理对蛋白质的一级结构影响较小。CHEN等[4]的研究也显示了同样的结果。
表2 不同UHP处理水平WPI的水解度
Table 2 Enzymatic hydrolysis of WPI in different UHP treatments

压力/MPa水解度/%0.016.93±0.13a1007.00±0.08a2007.01±0.02a4006.56±0.14a6006.88±0.43a
注:以去离子水作为参比,显著性水平P<0.05
2.4.2 UHP对WPI电泳特性的影响
经过不同的UHP处理的WPI电泳图谱如图4所示,所有样品分子质量大都分布在14.4和18.4 kDa处,这是由于WPI的主要成分β-LG(约占WPI的50%)的分子质量为18.3 kDa,α-La(约占WPI的25%)的分子质量为14.2 kDa。此外还可见含量较少的牛血清白蛋白分布在66.2 kDa附近。从电泳图中可以看出,处理组和对照组的条带并无明显差异,600 MPa以内的超高压水平对WPI的分子质量的影响较小,未引起WPI的降解。
2.4.3 WPI中β-LG以及α-LA含量降解情况
β-LG和α-LA约占乳清蛋白的75%,是牛乳中主要的致敏成分,特别是β-LG,研究显示大约有80%的牛乳过敏和β-LG相关[32]。故而利用ELISA原理,来具体检测WPI中2种标志性过敏蛋白β-LG以及α-LA的含量,其含量如表3所示。不同的超高压水平对β-LG影响不同,400 MPa处理的时候还呈现了显著增加。其原因可能是β-LG的结构较为紧密,呈现球状的结构,400 MPa的压力可以使WPI结构打开,藏在结构内部的β-LG蛋白出现了一定程度的暴露,故而呈现增加的现象。压力对α-LA含量的影响更大。其含量随着压力的增大呈现下降的趋势,这可能原因是α-LA在WPI中大多分布在外部,超高压能够显著破坏α-LA中的二硫键等非共价键,从而造成α-LA含量的减少。
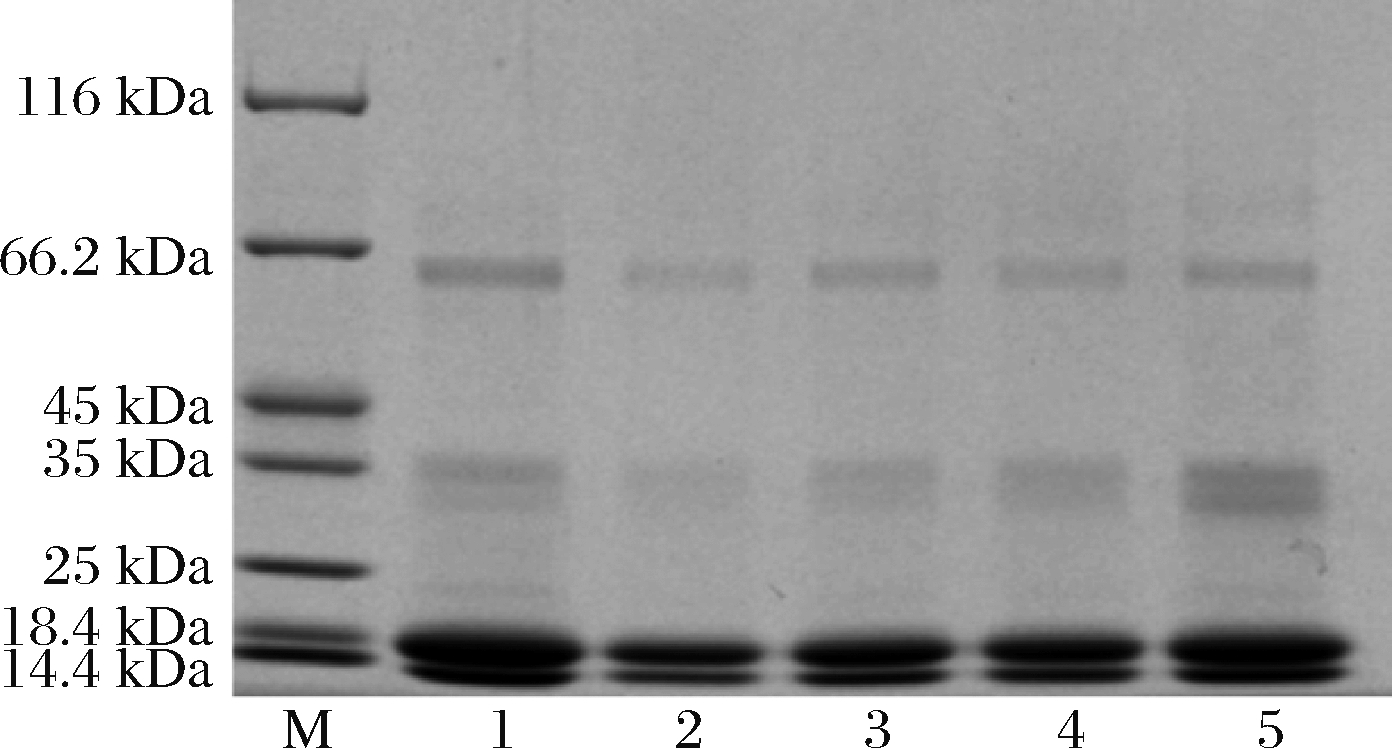
M-蛋白质分子质量标准;1-WPI;2-100 MPa,20 min;3-200 MPa,20 min;
4-400 MPa,20 min;2-600 MPa,20 min
图4 不同UHP处理的WPI的SDS-page电泳图谱
Fig.4 SDS-page electrophoresis of different UHP treatments on WPI
表3 不同UHP处理水平WPI的β-LG和α-LA含量
Table 3 Content of β-LG and α-LA in WPI under different UHP treatments

压力/MPaβ-LG/[g·(100g)-1]α-LA/[g·(100g)-1]0.0135.74±0.45b8.8±0.16e10032.7±0.55a8.5±0.07d20035.51±0.84b7.3±0.05c40038.53±0.99c6.59±0.04b60035.7±0.67b4.2±0.10a
3 结论与讨论
通过不同的超高压力处理WPI,考察超高压对WPI的结构和标志性致敏蛋白含量的影响。相比于对照组,100 MPa及以上的压力可以使WPI的表面巯基和总巯基含量显著上升(P<0.05),而到400 MPa后和更高的压力相比差异不显著(P>0.05),这表明,一定的压力可以使WPI的三级结构发生变化,从而增加了巯基的暴露量。内源性荧光检测的结果也表示了同样的结论,超高压处理组的荧光强度发生显著变化,这表明,超高压处理造成了WPI中色氨酸残基的变化。而对于WPI的二级结构,本研究发现,超高压处理对WPI的二级结构影响较为显著,α-螺旋和β-转角转化为β-折叠和无规则卷曲,蛋白的结构变松散。超高压处理对WPI的水解度以及电泳图谱的影响较小,说明超高压并不能显著改变WPI的一级结构及含量。但是对于β-LG以及α-LA的含量进行分析却发现,超高压可以显著影响到这2种致敏蛋白的含量,具体来说是在400 MPa时,β-LG出现最大程度的暴露,而α-LA的含量却是随着压力的增大呈现显著减少的趋势,其原因可能是超高压对于WPI结构一定程度的破坏造成的。故由上述可得出的结论为,超高压对WPI的一级结构影响较为轻微,但可以显著改变二级和三级结构,进而对β-LG和α-LA的致敏性造成影响。但是,对其中致敏蛋白的总量影响较小,而且在致敏蛋白的致敏性影响方面,还造成了β-LG含量增大的现象。因此若想通过单纯的超高压技术处理WPI不能降低WPI的致敏性。但通过此技术作为前处理,使蛋白质结构打开,继而采用酶解技术处理WPI,则能提高酶解的作用效果,从而有利于生产低致敏性的乳制品。
[1] VILLA C, COSTA J, OLIVEIRA M B P P, et al.Bovine milk allergens:A comprehensive review[J].Compr Rev Food Sci F, 2018, 17(1):137-164.
[2] BLOOM K A, HUANG F R, BENCHARITIWONG R, et al.Effect of heat treatment on milk and egg proteins allergenicity [J].Pediatr Allergy Immunol, 2014, 25(8):740-746.
[3] BU G H, LUO Y K, CHEN F S, et al.Milk processing as a tool to reduce cow′s milk allergenicity:A mini-review [J].Dairy Sci Technol, 2013, 93(3):211-223.
[4] CHEN H, HONG Q, ZHONG J, et al.The enhancement of gastrointestinal digestibility of β-LG by dynamic high-pressure microfluidization to reduce its antigenicity [J].International Journal of Food Science & Technology, 2019, 54(5):1 677-1 683.
[5] CARULLO D, ABERA B D, CASAZZA A A, et al.Effect of pulsed electric fields and high pressure homogenization on the aqueous extraction of intracellular compounds from the microalgae Chlorella vulgaris [J].Algal Research, 2018, 31:60-69.
[6] CARULLO D, ![]() F, FERRARI G.Influence of high-pressure homogenization on structural properties and enzymatic hydrolysis of milk proteins [J].LWT-Food Science and Technology, 2020, 130:109 657.
F, FERRARI G.Influence of high-pressure homogenization on structural properties and enzymatic hydrolysis of milk proteins [J].LWT-Food Science and Technology, 2020, 130:109 657.
[7] ALI A, LE P I, HUANG N, et al.Effect of high pressure homogenization on the structure and the interfacial and emulsifying properties of β-lactoglobulin [J].International Journal of Pharmaceutics, 2018, 537(1):111-121.
[8] SØRENSEN H, MORTENSEN K, SØRLAND G H, et al.Dynamic ultra-high pressure homogenisation of milk casein concentrates:Influence of casein content [J].Innov Food Sci Emerg, 2014, 26:143-152.
[9] 庞佳坤, 郑远荣, 刘振民,等.超高压对乳清分离蛋白结构和抗氧化活性的影响 [J].食品与发酵工业, 2020, 46(4):72-77.
PANG J K, ZHENG Y R, LIU Z M, et al.Effects of ultra-high pressure on structure and antioxidant activity of whey protein isolates[J].Food and Fermentation Industries, 2020, 46(4):72-77.
[10] PITTIA P, WILDE P J, HUSBAND F A, et al.Functional and structural properties of β-lactoglobulin as affected by high pressure treatment[J].J Food Sci, 1996, 61(6):1 123-1 128.
[11] HUPPERTZ T, FOX P F, KRUIF K G D, et al.High pressure-induced changes in bovine milk proteins:A review [J].Biochimica Et Biophysica Acta, 2006, 1 764(3):593-598.
[12] AMBROSI V, POLENTA G, GONZALEZ C, et al.High hydrostatic pressure assisted enzymatic hydrolysis of whey proteins [J].Innov Food Sci Emerg, 2016,38:294-301.
[13] YU C, WU F, CHA Y, et al. Effects of high-pressure homogenization at different pressures on structure and functional properties of oyster protein isolates[J]. International Journal of Food Engineering, 2018, 14(4): 9.
[14] WHITMORE L, WALLACE B A.DICHROWEB, an online server for protein secondary structure analyses from circular dichroism spectroscopic data [J].Nucleic Acids Research, 2004, 32(2):668-673.
[15] LOBLEY A, WHITMORE L, WALLACE B A.DICHROWEB:An interactive website for the analysis of protein secondary structure from circular dichroism spectra [J].Bioinformatics, 2002, 18(1):211-212.
[16] MAFORIMBO E, SKURRAY G R, NGUYEN M.Evaluation of l-ascorbic acid oxidation on SH concentration in soy-wheat composite dough during resting period [J].LWT - Food Science and Technology, 2007, 40(2):338-343.
[17] GINA C U M, VÉRONIQUE P, LO C H, et al.Impact of a high hydrostatic pressure pretreatment on the separation of bioactive peptides from flaxseed protein hydrolysates by electrodialysis with ultrafiltration membranes [J].Separation & Purification Technology, 2019, 211:242-251.
C H, et al.Impact of a high hydrostatic pressure pretreatment on the separation of bioactive peptides from flaxseed protein hydrolysates by electrodialysis with ultrafiltration membranes [J].Separation & Purification Technology, 2019, 211:242-251.
[18] SPELLMAN D, MCEVOY E, O′CUINN G, et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis [J].Int Dairy J, 2003, 13(6):447-453.
[19] ORCAJO J, LAVILLA M, ![]() I.Specific and sensitive ELISA for measurement of IgE-binding variations of milk allergen beta-lactoglobulin in processed foods [J].Anal Chim Acta, 2019, 1 052:163-169.
I.Specific and sensitive ELISA for measurement of IgE-binding variations of milk allergen beta-lactoglobulin in processed foods [J].Anal Chim Acta, 2019, 1 052:163-169.
[20] ZHANG T, JIANG B, MIAO M, et al.Combined effects of high-pressure and enzymatic treatments on the hydrolysis of chickpea protein isolates and antioxidant activity of the hydrolysates [J].Food Chemistry, 2012, 135(3):904-912.
[21] TABILO-MUNIZAGA G, GORDON T A, VILLALOBOS-CARVAJAL R, et al.Effects of high hydrostatic pressure (HHP) on the protein structure and thermal stability of Sauvignon blanc wine [J].Food Chem, 2014, 155(15):214-220.
[22] LI H, ZHU K, ZHOU H, et al.Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soybean protein isolate for infant formula [J].Food Chem, 2012, 132(2):808-814.
[23] LIU H H, KUO M I.Ultra high pressure homogenization effect on the proteins in soy flour [J].Food Hydrocolloid, 2016, 52:741-748.
[24] SIDDIQUE M A B, MARESCA P, PATARO G, et al.Effect of pulsed light treatment on structural and functional properties of whey protein isolate [J].Food Res Int, 2016, 87:189-196.
[25] GOLKAR A, MILANI J M, VASILJEVIC T.Altering allergenicity of cow′s milk by food processing for applications in infant formula [J].Crit Rev Food Sci Nutr, 2019, 59(1):159-172.
[26] HINRICHS J, RADEMACHER B J J D R.High pressure thermal denaturation kinetics of whey proteins [J].J Dairy Res,2004, 71(4):480-488.
[27] BELLOQUE J, CHIC N R, L
N R, L PEZ-FANDI
PEZ-FANDI O R.Unfolding and refolding of beta-lactoglobulin subjected to high hydrostatic pressure at different pH values and temperatures and its influence on proteolysis [J].J Agric Food Chem, 2007, 55(13):5 282-5 288.
O R.Unfolding and refolding of beta-lactoglobulin subjected to high hydrostatic pressure at different pH values and temperatures and its influence on proteolysis [J].J Agric Food Chem, 2007, 55(13):5 282-5 288.
[28] LI M, MA Y, NGADI M O.Binding of curcumin to β-lactoglobulin and its effect on antioxidant characteristics of curcumin [J].Food Chem, 2013, 141(2):1 504-1 511.
[29] CHIC N R, L
N R, L PEZ-FANDI
PEZ-FANDI O R, ALONSO E, et al.Proteolytic pattern, antigenicity, and serum immunoglobulin E binding of β-lactoglobulin hydrolysates obtained by pepsin and high-pressure treatments[J].J Dairy Sci, 2008, 91(3):928-938.
O R, ALONSO E, et al.Proteolytic pattern, antigenicity, and serum immunoglobulin E binding of β-lactoglobulin hydrolysates obtained by pepsin and high-pressure treatments[J].J Dairy Sci, 2008, 91(3):928-938.
[30] YIN S W, TANG C H, WEN Q B, et al.Functional properties and in vitro trypsin digestibility of red kidney bean (Phaseolus vulgaris L.) protein isolate:Effect of high-pressure treatment [J].Food Chem, 2008, 110(4):938-945.
[31] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].J Food Sci, 2001, 66(5):642-646.
[32] ![]() J, KOWALSKI I M, ZWIERZCHOWSKI G, et al.Characteristics of cow′s milk proteins including allergenic properties and methods for its reduction [J].Polish Annals of Medicine, 2013, 20(1):69-76.
J, KOWALSKI I M, ZWIERZCHOWSKI G, et al.Characteristics of cow′s milk proteins including allergenic properties and methods for its reduction [J].Polish Annals of Medicine, 2013, 20(1):69-76.