尿酸由嘌呤代谢而生成,在人体肝脏部位形成,在肾脏的作用下以尿液形式排出体外,如无特殊影响,人体的血尿酸不会出现大幅波动,而是以一种动态平衡状态存在,成年男性含量为149~416 μmol/L、成年女性含量为89~357 μmol/L。人体血尿酸2/3是内源产生的,1/3的尿酸来自于肉类、海鲜等食品,长期摄入过量的高嘌呤食物或身体疾病等原因会造成嘌呤代谢紊乱,从而导致尿酸含量过高[1]。新时期下,人们生活水平提升的同时,对饮食也提出了较高的要求,而高尿酸血症患者数量也呈现出逐年递增的趋势。医学上来讲,血尿酸的增高会引发诸如痛风、高血压、糖尿病等一系列并发症[2-3]。现阶段,临床上用以抗高尿酸血症的药物包括:黄嘌呤氧化酶抑制剂、尿酸盐阴离子转运蛋白1抑制剂、尿酸氧化酶类似物,这些药物虽具有较好的疗效,但毒副作用大,常出现腹痛、恶心、呕吐、发热等症状[4]。因此,寻找安全、高效的天然降尿酸食源性成分已成为众多研究者的研究方向。
生物活性肽不仅在人体内易于吸收、安全可靠,且制造成本较为低廉,其生物活性丰富多样,具有极大的利用价值。以海洋鱼类为原料制备具有多功能的活性肽受到学者们的广泛关注[5]。MUROTA等[6]发现,自鲨鱼软骨水解物提取的2种活性肽,有较好的治疗痛风的药效,分别为Tyr-Leu-Asp-Asn-Tyr和 Ser-Pro-Pro-Tyr-Trp-Pro-Tyr,最终认定,该分离物中黄嘌呤氧化酶抑制活性极高,高出别嘌呤醇的13~23倍。赵谋明等[7]报道,采用中性蛋白酶和胰酶共同水解秋刀鱼,在水解物中得到含有黄嘌呤氧化酶抑制肽。柯虹乔等[8-11]报道,金枪鱼低聚肽生物活性丰富,不仅有利于抗氧化、降血压、抗疲劳,同时也具有调节代谢疾病的功效。HE等[12]从金枪鱼酶解产物中分离出的Phe-His二肽具有很强的黄嘌呤氧化酶抑制活性(IC50=25.7 mmol/L),有显著降尿酸作用。
鲣鱼别名炸弹鱼,具体分类有圆舵鲣、扁舵鲣、狐鲣等亚种,学界一般将其归为低值金枪鱼[13],是我国金枪鱼捕捞量最大的品种,在我国东海、南海分布广泛[14]。鲣鱼的蛋白质含量高、脂肪含量低、具有营养价值高的特点,但是,鲣鱼的产品较为单一,主要加工为罐头食品,产品附加值低[15]。鲣鱼具有丰富的肌肽和鹅肌肽,李宇娟[16]报道鲣鱼背部肉中鹅肌肽含量高达1.26 mg/g,具有显著降低血清尿酸水平的功效。鲣鱼通过酶法水解也可以制备出具有降尿酸功效的活性肽,李宇娟[16]从鲣鱼酶解产物中分离纯化出4条具有抑制黄嘌呤氧化酶(xan-thine oxidase,XOD)活性的多肽:Pro-Gly-Ala-Cys-Ser-Asn,Trp-Met-Leu,Ala-Met-Pro-Phe和Phe-Gly-Val-Gly;邹琳等[17]从鲣鱼鱼肉中分离纯化出Ala-Cys-Glu-Cys-Asp,其XOD抑制活性IC50值为7.23 mg/mL,具有较好的降尿酸效果。
本研究目的是采用高尿酸大鼠动物模型对扁舵鲣鱼酶法水解制备的低聚肽降尿酸功效进行评价,促进对降尿酸食品开发与生产制备工程的探究,为高尿酸血症治疗和调养的长期研究提供一些理论参考。
1 材料与方法
1.1 实验材料
扁舵鲣鱼(Auxis thazard),体长50~60 cm,购于广东省茂名市博贺港,置于-20 ℃超低温冰箱备用。
实验大鼠,选取SPF级SD雄性大鼠共计60只,单只重量在140~160 g,置于21~25 ℃的饲养环境下,相对湿度控制在55%~65%。直接由广东省医学实验动物中心展开该扁坨鲣鱼降尿酸作用研究试验(批准文号:GDMLAC/F-IAC01)。
1.2 实验试剂
动物蛋白水解酶(200万U/g),广西南宁庞博生物工程有限公司;别嘌醇片,世贸天阶制药(江苏)有限责任公司;腺嘌呤,Sigma公司;羧甲基纤维素钠,天津市福晨化学试剂厂;甲醛,西陇科学股份有限公司;磷酸缓冲盐粉末,鼎国昌盛。尿酸、尿素氮、肌酐、黄嘌呤氧化酶试剂盒,上海科华生物工程股份有限公司。
1.3 主要仪器
YP1002 N电子分析天平,德国Sartorius;TM-CM-01陶瓷膜分离设备、WTM-1812G膜分离设备,杭州沃腾膜工程有限公司;日立7020全自动生化分析仪,日本株式会社日立高新技术;KDC-2046低速冷冻离心机,科大创新股份有限公司中佳分公司;5418台式高速离心机,德国Eppendorf。
1.4 实验方法
1.4.1 扁舵鲣鱼低聚肽(Auxis thazard oligopeptide,ATO)的制备
扁舵鲣鱼去头、去骨与内脏,清洗、匀浆,然后在50 ℃条件下,添加0.5%(质量分数)的动物蛋白水解酶和0.1%(质量分数)的风味酶,调节pH至7.5,酶解3 h,在90~100 ℃条件下加热10 min灭酶,在4 000 r/min 条件下离心15 min,启动管式离心机将上清液进行(15 000 r/min)脱油,在产物酶解液之中掺入适量的珍珠岩完成脱色脱苦操作,珍珠岩添加量为3 g/100L,静置0.5~1.0 h,澄清液通过陶瓷膜(孔径 200 nm)过滤,然后使用截留分子质量为5 000 u的超滤膜进行分离,过滤液经旋转蒸发仪浓缩后,进行喷雾干燥,喷雾干燥进口温度为175 ℃,出口温度为210 ℃,获取产物—低聚肽粉,将其放置于温度为4 ℃的干燥器内储存,以便后期使用[18]。
1.4.2 建立高尿酸大鼠模型
实验动物根据血尿酸值随机分为正常对照组、模型对照组、阳性对照组和ATO低、中、高剂量组。除正常对照组外,各组动物均给予腺嘌呤溶液,每日剂量为250 mg/kg体重,正常对照组给予纯水,连续30 d建立高尿酸血症大鼠模型。
1.4.3 降尿酸动物试验
实验动物基于腺嘌呤3 h后,ATO低、中和高剂量组分别给予0.8、1.6和2.4 g/kg体重剂量的ATO溶液,而阳性对照组每天给予300 mg的别嘌呤醇片剂,连续30 d每天1次,每次10 mL/kg体重。在给药的第2天、第7天和第14天测定肌酐、尿素氮和XOD的活性,并在实验结束时采集血样。在测试结束时,收集16个小时的尿液,并测量尿量和尿酸含量,称重肝脏和右肾,肾脏用氦和尿酸盐晶体染色进行组织病理学观察。
1.4.4 尿液采集
施用29 d后,收集动物16 h的尿液,测量尿量,并检测尿酸含量。
1.4.5 血生化指标检测
在2 d、7 d和14 d,通过腹膜注射1.5 mL/kg体重的3%戊巴比妥钠溶液,麻醉大鼠,然后眼眶静脉窦采血,结束试验时腹主动脉采血,以3 000 r/min离心10 min后,分离血清并检测血清肌酐、血清尿素氮、血尿酸和黄嘌呤氧化酶活性。
1.4.6 苏木精-伊红染色法(HE)染色观察
选择右边的肾脏,采用4%(质量分数)中性甲醛进行固定,常规石蜡包埋切片,最后进行HE染色,并观察。取左肾,无水乙醇固定,进行尿酸特殊染色,观察尿酸盐结晶。
1.4.7 数据分析
实验重复测定9次,数据采用![]() 表示,应用SPSS 21.0软件进行统计分析;如果测量数据的方差是齐次的,或者转换后数据的方差是齐次的,则采用组间成对比较的单向方差分析;如果转换后数据的方差仍然不均匀,则使用秩和检验进行统计分析,使用Origin 8.5进行绘图。
表示,应用SPSS 21.0软件进行统计分析;如果测量数据的方差是齐次的,或者转换后数据的方差是齐次的,则采用组间成对比较的单向方差分析;如果转换后数据的方差仍然不均匀,则使用秩和检验进行统计分析,使用Origin 8.5进行绘图。
2 结果与分析
试验期间造模大鼠体型偏瘦,各大鼠大小便情况正常。与正常组相比,模型组大鼠体重在各称重时间点均显著下降,差异有统计学意义(P<0.05)。与模型组相比,阳性对照组第31天的体重增加有显著性差异(P<0.05)。
2.1 ATO对高尿酸大鼠模型脏器系数的影响
脏器系数能非常简便地判断出器官是否病变。在试验期间,将所有试验大鼠的肝脏和肾脏进行了脏器系数分析,结果如表1所示。与正常对照组相比,模型对照组肝脏系数及右肾系数明显升高,有统计学差异(P<0.05),说明用腺嘌呤溶液对大鼠进行造模对肝肾是有一定损伤的。与模型对照组相比,低剂量组肝脏系数升高,阳性对照组右肾系数明显下降,有统计学差异(P<0.05),其余各组脏器系数无统计学差异(P>0.05),说明高尿酸血症大鼠在降酸药和中、高剂量的ATO作用下,能让肝脏和肾脏有一定程度的恢复。
表1 ATO对高尿酸大鼠模型的降尿酸作用研究期间各组大鼠脏器系数
Table 1 The coefficient of ATO on lowering uric acid in rat model was studied during the study period

组别肝脏系数(g/100g体重)右肾系数(g/100g体重)正常对照组3.22±0.280.32±0.02模型对照组3.62±0.30▲2.19±0.40▲▲阳性对照组3.48±0.451.78±0.23*ATO低剂量组4.01±0.55*2.19±0.42ATO中剂量组3.82±0.422.22±1.00ATO高剂量组3.91±0.311.92±0.34
注:肝脏系数采用方差分析方法,右肾系数采用log转换后方差分析方法进行统计分析。与正常对照组比较,“▲”P<0.05,“▲▲”P<0.01;与模型对照组比较,“*”P<0.05
2.2 ATO对高尿酸大鼠XOD活性的影响
XOD主要位于肝脏,是催化次黄嘌呤产生尿酸的关键酶。这种酶主要存在于哺乳动物的肝脏中,但在正常人的血清中检测不到或含量甚微。当肝脏内尿酸含量明显增高时,XOD 释放入血清[19]。因此,本文通过检测血清XOD活性,可以评价ATO对尿酸生成的影响。从图1可以看出,大鼠模型组和空白对照组相比,血尿酸浓度显著升高(P<0.01),XOD 活性显著增加(P<0.01),说明大鼠高尿酸血症模型造模成功;相比于模型组,第7天时,ATO组和阳性药物组的大鼠血尿酸浓度都有不同程度的降低,说明ATO能降低尿酸的生成量。第14天时,XOD含量有一个反弹上升,到第32天时,XOD含量回落,ATO 0.8 g/kg和1.6 g/kg剂量组与模型对照组有显著性差异(P<0.05),这说明短期试验中,ATO的降尿酸功能比较明显,但长期使用,ATO降尿酸功能不是很突出。
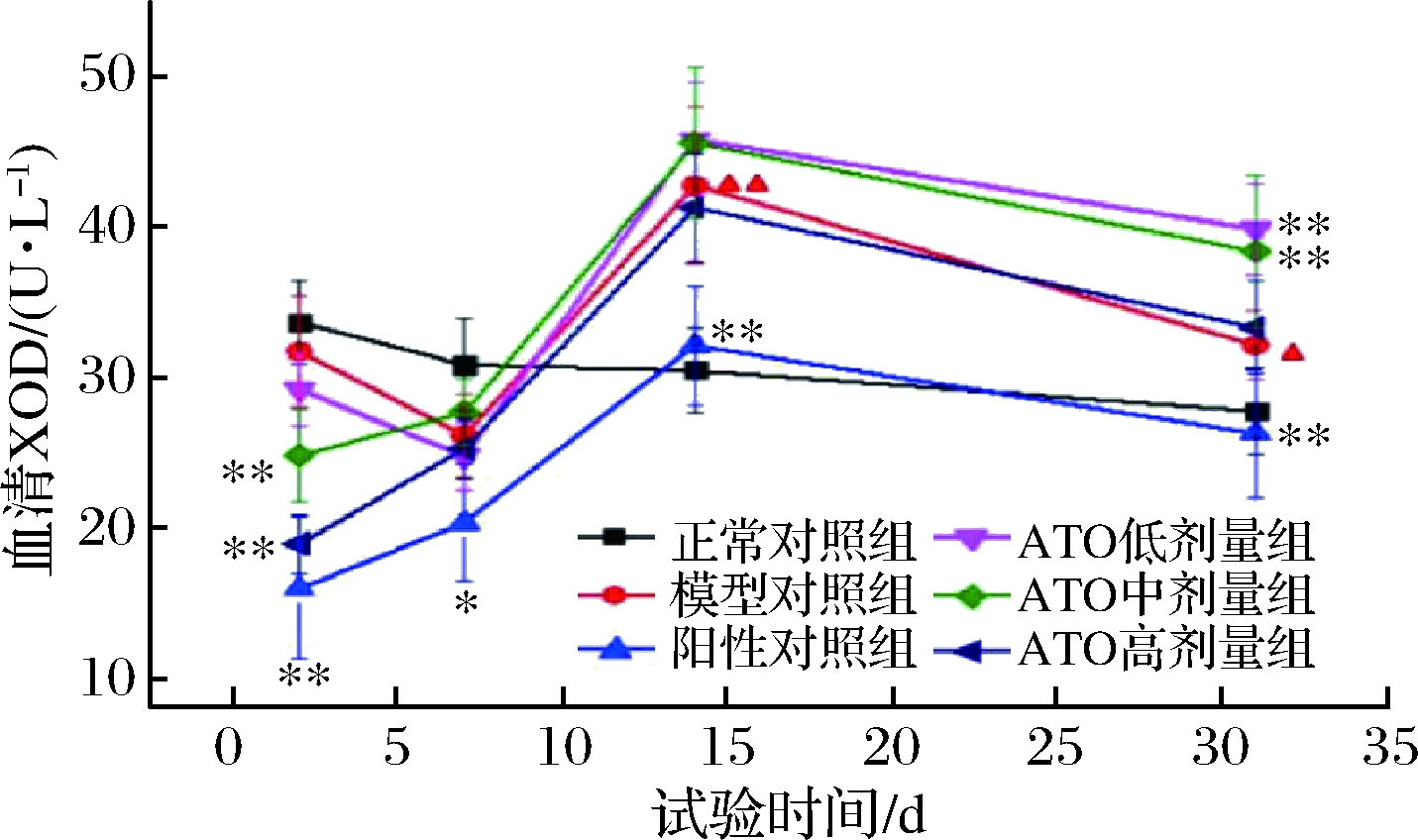
图1 ATO对高尿酸大鼠模型的降尿酸作用研究期间各组大鼠血清XOD活性结果
Fig.1 The results of serum XOD activity in rats of each group during the study of ATO′s effect on lowering uric acid in rat model with high uric acid
注:采用重复测量方差分析的分析方法进行统计分析。
与正常对照组比较,“▲”P<0.05,“▲▲”P<0.01;与模型对照组比较,“*”P<0.05,“**”P<0.01
2.3 ATO对高尿酸大鼠血液指标的影响
为了进一步研究ATO对高尿酸大鼠的降尿酸作用,在实验过程中测定了每只大鼠血清肌酐(serum creatinine, SCR)、血清尿素氮(serum urea nitrogen, BUN)和血尿酸(blood uric acid, BUA)含量,测定结果如图2所示。SCR 与 BUN 是临床评估肾脏损伤的常用指标。肾脏受损会伴随两者水平升高[20]。从图2-a可以看出,正常组的血清肌酐水平无明显变化。与正常对照组相比,模型对照组血清肌酐含量在实验期间显著升高(P<0.05)。与模型对照组相比,第2天ATO 2.4 g/kg高剂量组,第7天ATO1.6 g/kg和2.4 g/kg剂量组,第14天阳性对照组和ATO 3个实验剂量组的血清肌酐含量均显著降低(P<0.05),说明短期内降尿酸效果显著。第31天ATO 1.6 g/kg和0.8 g/kg剂量组SCR含量有所下降,但无统计学差异(P>0.05);由此可以看出ATO的低、中剂量在长时间的摄入后对降尿酸效果一般。由图2-b可以得出,正常对照组在试验中,BUN水平基本没有变化。与正常对照组相比,模型对照组在实验周期内,血清尿素氮含量明显上升。与模型对照组相比,第2天高剂量组,第14天阳性对照组、ATO低、中、高剂量组血清尿素氮含量明显降低(P<0.05),说明降尿酸效果明显。第31天 ATO低、中剂量组血清尿素氮含量有所下降,但无统计学差异(P>0.05),说明ATO的低、中剂量在长时间的摄入后对降尿酸的效果一般,这与SCR指标的测定结果相一致。吴婷等[21-22]采用小鼠试验证实大麦叶粉具有防治高尿酸血症的作用,其中试验组的SCR和BUN也呈现出此规律,说明持续的高尿酸可一定程度上引起肾脏损伤,阳性对照组(投喂别嘌呤醇)也并未使SCR和BUN降低,提示别嘌呤醇的长期使用可能对肾脏产生损伤。体内次黄嘌呤和黄嘌呤在XOD的作用下生成BUA,从图2-c中可以看出,造模成功的大鼠体内BUA的含量是较高的,如摄入阳性药物或者具有降尿酸功效的物质,可通过抑制XOD的活性而减少BUA的水平[21],在图2-c,正常对照组的BUA是偏低的,阳性对照组和ATO的高、中、低剂量组整体呈下降的趋势。与正常对照组相比,模型组在试验时期中,BUA显著提升(P<0.05)。与模型组相比较,ATO的高剂量组在测定的4个时间节点中,血尿酸含量显著降低(P<0.05),说明高剂量的ATO对大鼠的降尿酸疗效较为显著。
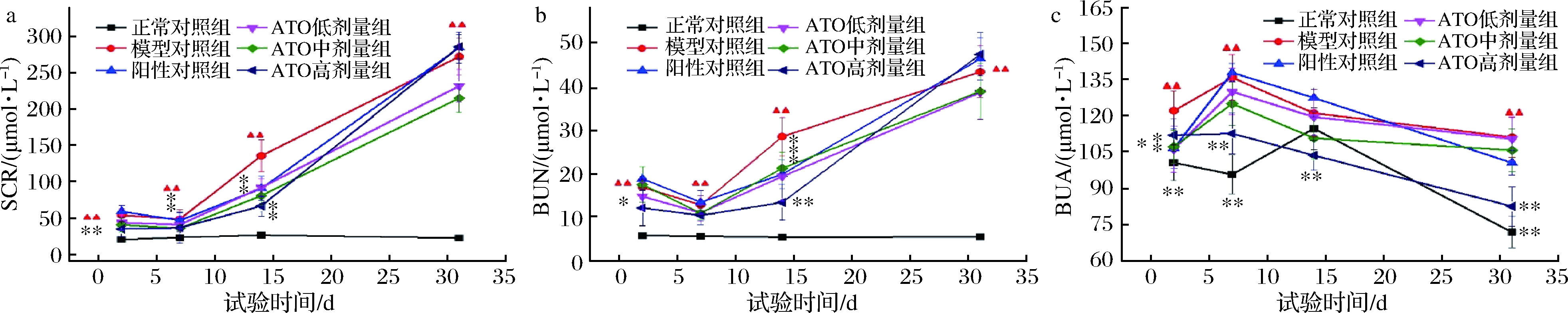
a-SCR;b-BUN;c-BUA
图2 ATO对高尿酸大鼠模型的降尿酸作用研究期间各组大鼠血液指标结果
Fig.2 Results of blood indexes in each group during the study of ATO′s effect on lowering uric acid in rat model with high uric acid
注:采用重复测量方差分析的分析方法进行统计分析。与正常对照组比较“▲”P<0.05,“▲▲”P<0.01;与模型对照组比较,“*”P<0.05,“**”P<0.01
2.4 尿液指标
高尿酸血症主要是由于尿酸的产生(如摄入富含嘌呤的食物)与排泄(如肾功能降低)之间的不平衡造成的[22]。无论产生多少尿酸,如果排泄量少,体内的尿酸水平会不断积累和上升,从而导致高尿酸血症及其并发症。试验期间,检测实验各组的尿液量和尿酸浓度,计算尿酸排泄量,结果如表2所示。与正常对照组相比,模型对照组的尿酸浓度、尿量和尿酸排泄量均显著降低(P<0.01),表明尿酸在实验期间在高尿酸血症大鼠体内积累。与模型对照组相比,阳性对照组与ATO实验组在这3项指标上无显著性差异。结果表明,在实验过程中,大鼠体内尿酸排泄量减少。
2.5 ATO对高尿酸血症大鼠肾脏组织病理学的影响
通过观察大鼠肾脏病理切片,从细胞层面比较各组肾脏损伤情况,进而判断ATO对肾脏受损的高尿酸血症大鼠的影响[23]。如图3所示,正常组肾小球和肾小管结构正常,无病理改变;模型组肾小管细胞轻度脂肪变性,肾小管上皮细胞内出现大量脂肪空泡,表明模型药物对肾小管上皮细胞有严重损伤。与模型组相比,阳性对照组肾小管上皮细胞的脂肪泡变小,细胞核向细胞一侧挤压,管腔变窄,说明别嘌呤醇在治疗高尿酸血症时对肾脏造成了一定的损害;这与席圆圆等[24]研究的铁观音水提物对高尿酸小鼠的肾脏组织病理结果相一致。ATO的高、中、低剂量组肾小管上皮细胞正常,只见少量脂肪变性,与模型组比较,脂肪空泡较小、较少,病变轻微,大部分肾小管结构恢复正常;但ATO的各实验组之间并没有明显的差异,表明高尿酸血症大鼠肾脏修复中ATO的量效关系不明显。
表2 试验期间各组大鼠尿液指标结果
Table 2 Urine index results of rats in each group during the experiment
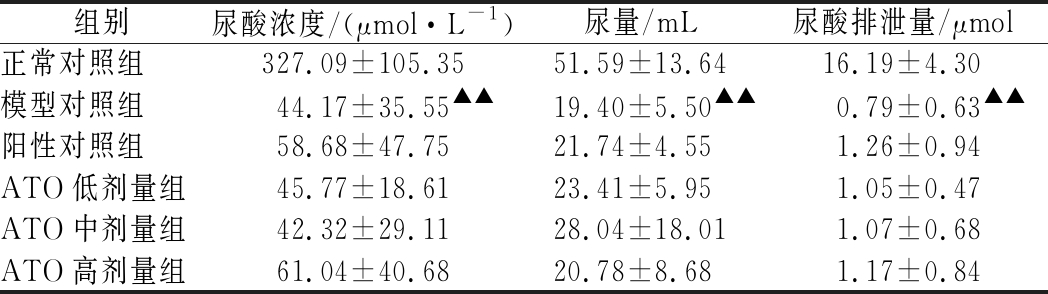
组别尿酸浓度/(μmol·L-1)尿量/mL尿酸排泄量/μmol正常对照组327.09±105.3551.59±13.6416.19±4.30模型对照组44.17±35.55▲▲19.40±5.50▲▲0.79±0.63▲▲阳性对照组58.68±47.7521.74±4.551.26±0.94ATO低剂量组45.77±18.6123.41±5.951.05±0.47ATO中剂量组42.32±29.1128.04±18.011.07±0.68ATO高剂量组61.04±40.6820.78±8.681.17±0.84
注:采用秩和检验的统计方法进行统计分析;与正常对照组比较,“▲▲”P<0.01
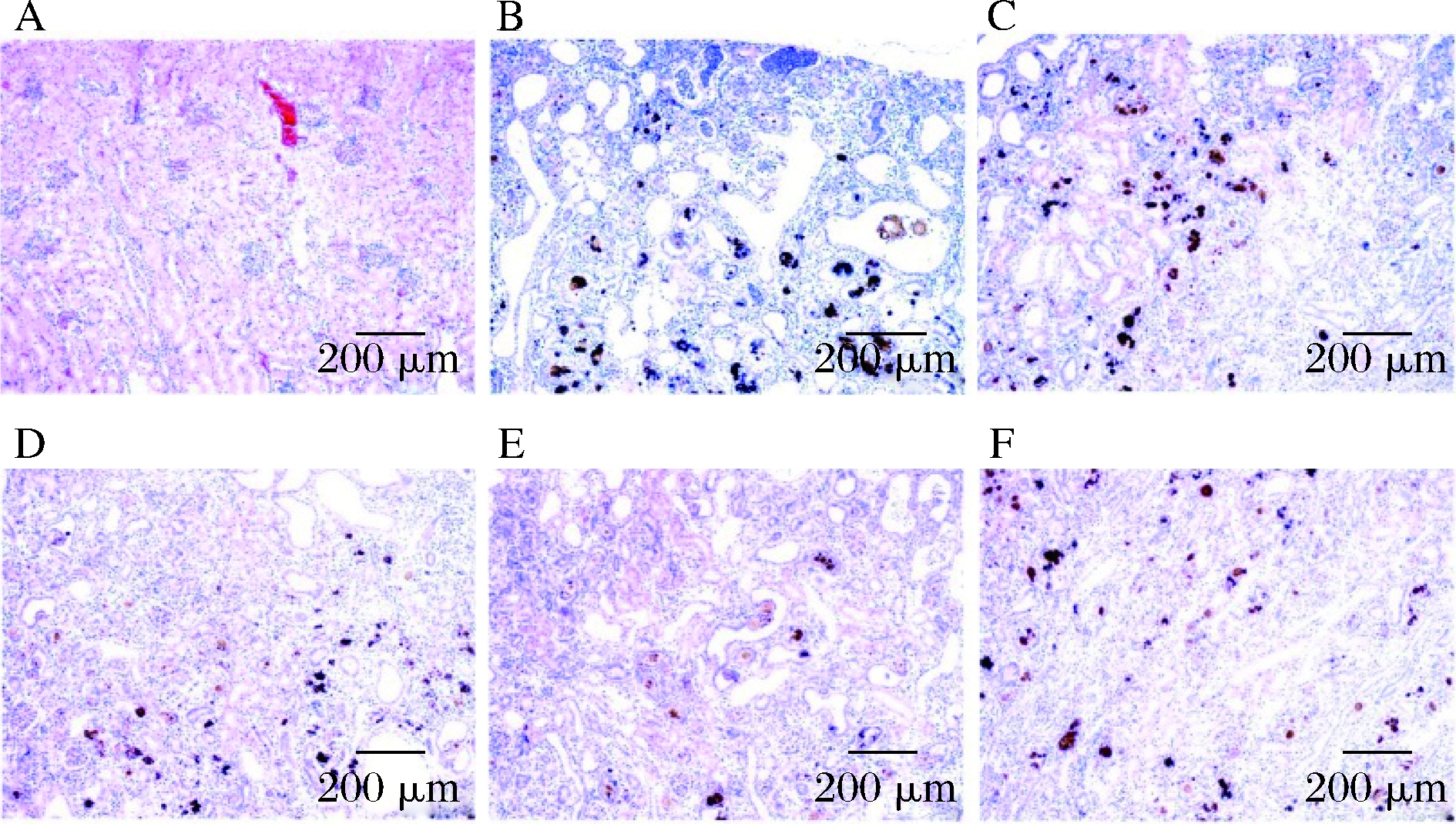
a-正常对照组;b-模型对照组;c-阳性对照组;d-ATO低剂量组;e-ATO中剂量组;f-ATO高剂量组
图3 各实验组肾脏组织病理学检查
Fig.3 Histopathological examination of kidney in each experimental group
尿酸在血液中的溶解度极低,当血清尿酸水平超过其物理溶解度(约7 mg/dL),通过与 IgM、IgA、IgG等抗体结合,或形成尿酸盐结晶(monosodium uratecrystals,MSU)。MSU沉聚在人体血管中最内层的表皮,不仅可以增加白细胞对最内层表皮细胞的黏着程度,还可以提升人体体内的炎症细胞因子成分的存活性,同时我们血管内部的细胞膜炎性破损。当尿液中的尿酸上升到一定的指标时,尿酸盐就会结成晶体分解出来,沉聚在血管细胞的内壁,从而造成部分炎性症状的出现,所以会在一定程度上破坏细胞血管内层表皮,使其结构发生变化和损伤,也会导致内层的细胞表皮生成较多的带炎症的成分,造成严重的不良重复。尿液中的尿酸盐成分会引起内皮细胞起反应的标准浓度是1 184 μmol/L,伴着尿酸盐含量的不断提升,内层表皮细胞分子所产生的带有炎性症状因子的成分也不断提高,尿酸盐的含量达到一定的程度时,炎症因子的生成会到达一个瓶颈,提示高浓度的尿酸盐的细胞毒性较大,可引起细胞凋亡,造成细胞死亡[25-26]。从图4可以看出,相比正常对照组,其他各实验组都有大量尿酸盐沉积的现象,其中模型对照组较为显著,阳性对照组和ATO各试验组差异性不明显,说明别嘌呤醇和ATO在一定程度降低了尿酸的生成,减少了MSU的沉积。

a-正常对照组;b-模型对照组;c-阳性对照组;d-ATO低剂量组;e-ATO中剂量组;f-ATO高剂量组
图4 各实验组尿酸盐染色检查
Fig.4 Examination urate staining in each experimental group
3 结论
采用高尿酸血症大鼠模型评价ATO降尿酸功效,通过血液XOD、血液指标、尿液指标测定结果和肾组织切片病理变化观察表明,ATO能抑制XOD酶的活性,减少尿酸的生成和尿酸盐晶体的沉积,因此具有降低血尿酸的作用。研究结果为扁舵鲣鱼低聚肽降尿酸产品开发提供了科学依据,也为扁舵铿鱼的高值化利用提供了技术基础。
[1] CHEN S, GUO X F, DONG S Y, et al.Association between the hypertriglyceridemic waist phenotype and hyperuricemia:A cross-sectional study[J].Clinical Rheumatology, 2017, 36(5):1 111-1 119.
[2] XU K Y, ZHAO X, FU X Q, et al.Gender effect of hyperuricemia on the development of nonalcoholic fatty liver disease (NAFLD):A clinical analysis and mechanistic study[J].Biomedicine & Pharmacotherapy, 2019, 117:109 158.
[3] ZHANG Y, JIN LJ, LIU J C, et al.Effect and mechanism of dioscin from Dioscorea spongiosa on uric acid excretion in animal model of hyperuricemia[J].Journal of Ethnopharmacology, 2018, 214(25):29-36.
[4] GLIOZZI M, MALARA N, MUSCOLI S, et al.The treatment of hyperuricemia[J].International Journal of Cardiology, 2016, 213:23-27.
[5] 胡晓, 周雅, 杨贤庆, 等.食物蛋白源降尿酸活性肽的研究进展[J].食品与发酵工业, 2020, 46(4):287-293.
HU X, ZHOU Y, YANG X Q, et al.Research progress on anti-hyperuricemic peptides obtained from food proteins[J].Food and Fermentation Industries, 2020, 46(4):287-293.
[6] MUROTA I, TAGUCHI S, SATO N, et al.Identification of antihyperuricemic peptides in the proteolytic digest of shark cartilage water extract using in vivo activity-guided fractionation[J].Journal of Agricultural & Food Chemistry, 2014, 62(11):2 392.
[7] 赵谋明, 徐巨才, 刘洋, 等.秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺优化[J].农业工程学报, 2015, 31(14):299-305.
ZHAO M M, XU J C, LIU Y, et al.Technology optimization on preparation of XOD inhibition peptide from Saury[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(14):299-305.
[8] 柯虹乔. 酶解金枪鱼头蛋白制备抗氧化活性肽的研究[D].湛江:广东海洋大学, 2011.
KE H Q.Preparation of antioxidant peptides from Tuna head by enzymatic hydrolysis[D].Zhanjiang:Guangdong Ocean University, 2011.
[9] RAJU A, CHUN B.Subcritical water hydrolysis for the production of bioactive peptides from tuna skin collagen[J].Journal of Supercritical Fluids.2018, 141:88-96.
[10] 陈悦, 李路, 李云坤,等.小分子金枪鱼多肽对小鼠记忆力、皮肤弹性及睡眠的影响[J].基因组学与应用生物学, 2019,38(12):5 412-5 420.
CHEN Y, LI L, LI Y K, et al.Effects of small molecule polypeptide of tuna on memory, skin elasticity and sleep in mice[J].Genomics and Applied Biology, 2019,38(12):5 412-5 420.
[11] 李淑凡, 李鑫, 韩姣姣, 等.金枪鱼红肉酶解液对小鼠抗疲劳和调节肠道菌群效果的研究[J].食品工业科技, 2019, 40(17):314-320;326.
LI S F, LI X, HAN J J, et al.Effect of bluefin red meat enzymatic hydrolysate on anti-fatigue and regulation of intestinal flora in mice[J].Science and Technology of Food Industry, 2019, 40(17):314-320, 326.
[12] HE W W, SU G W, SUN-WATERHOUSE D X, et al.In vivo anti-hyperuricemic and xanthine oxidase inhibitory properties of tuna protein hydrolysates and its isolated fractions[J].Food Chemistry, 2019, 272(30):453-461.
[13] CHEN M, JI H W, ZHANG Z W, et al.A novel calcium-chelating peptide purified from Auxis thazard protien hydrolysate and its binding properties with calcium[J].Journal of Functional Foods, 2019, 60:103447.
[14] 陈洋洋, 陈新军.中西太平洋鲣鱼渔业研究进展[J].广东海洋大学学报, 2017, 37(5):34-43.
CHEN Y Y, CHEN X J.Reviews on skipjack (Katsuwonus pelamis) fishery in the west-central pacific ocean[J].Journal of Guangdong Ocean University, 2017, 37(5):34-43.
[15] SHIMOSE T, KANAIWA M, TANABE T.Influence of the fat content on the auction price of Pacific bluefin tuna Thunnus orientalis at Japanese fish markets[J].Fisheries Research, 2018, 204:224-230.
[16] 李宇娟. 鲣鱼降尿酸肽的制备分离、结构表征及功效机制研究[D].广州:华南理工大学, 2019.
LI Y J.Preparation, isolation, structural characterization, and the effect mechanism of uric acid-lowering peptides derived from bonito[D].Guangzhou:South China University of Technology, 2019.
[17] 邹琳, 冯凤琴.食品中降尿酸活性物质及其作用机理研究进展[J].食品工业科技, 2019, 40(13):352-357;364.
ZOU L, FENG F Q.The research progress of uric acid-lowering active substances in food and their mechanism[J].Technology of Food Industry, 2019, 40(13):352-357;364.
[18] 吉薇, 刘扬, 龙慧静.扁舵鲣鱼低聚肽化学组成及其对人体肝癌细胞的抑制作用[J].广东农业科学, 2019, 46(10):123-131.
JI W, LIU Y, LONG H J.Chemical composition of oligopeptide derived from Auxis thazard protein and its inhibiting activity on human liver cancer cells[J].Guangdong Agricultural Science, 2019, 46(10):123-131.
[19] HILLE R, HALL J, BASU P.The mononuclear molybdenum enzymes[J].Chemical Reviews, 2014, 114(7):3 963-4 038.
[20] ISABEL G, MARIAN G, BORJA Q, et al.Hyperuricemia is associated with progression of chronic kidney disease in patients with reduced functioning kidney mass[J].Nefrologia, 2018, 38(1):73-78.
[21] 吴婷, 赵泽安, 陈演瑜, 等.大麦叶粉防治高尿酸血症及肾脏保护作用研究[J].食品工业科技, 2020,41(22):284-298;304.
WU T, ZHAO Z, CHEN Y Y, et al.Anti-hyperuricemic and nephroprotective effects of barley leaf powder in hyperuricemic mice[J].Science and Technology of Food Industry, 2020,41(22):284-298;304.
[22] LIANG D, YONG T, CHEN S, et al.Hypouricemic effect of 2,5-dihydroxyacetophenone, a computational screened bioactive compound from ganoderma applanatum, on hyperuricemic mice[J].International Journal of Molecular Sciences, 2018,19(5):1 394-1 408.
[23] PAN L, HAN P, MA S R, et al.Abnormal metabolism of gut microbiota reveals the possible molecular mechanism of nephropathy induced by hyperuricemia[J].Acta Pharmaceutica Sinica B, 2020, 10(2):249-261.
[24] 席圆圆, 徐宏彦, 刘霞, 等.铁观音茶水提取物对小鼠高尿酸血症的缓解作用[J].生物技术进展, 2020, 10(3):256-264.
XI Y Y, XU H Y, LIU X, et al.Alleviating effect of tieguanyin tea aqueous extract on hyperuricemia in mice[J].Current Biotechnology, 2020, 10(3):256-264.
[25] ANDREA D M, EMILIO F, EDOARDO C, et al.The popliteal groove region:A new target for the detection of monosodium urate crystal deposits in patients with gout.An ultrasound study[J].Joint Bone Spine Revue Du Rhumatisme, 2019, 86(1):89-94.
[26] ELLMANN H, BAYAT S, ARAUJO E, et al.Effects of conventional uric acid-lowering therapy on monosodium urate crystal deposits[J].Arthritis & Rheumatology, 2019, 72(1):150-156.