浓香型白酒的生产以泥窖窖池为基础,不同窖龄的窖池有着不同的微生物群落结构[1-2]。窖泥中栖息着种类多样、数量丰富的微生物,这些微生物随着窖池的使用不断得到驯化,进而构成了独特的微生态区系,这些微生物的群落结构和演替影响着白酒的质量[3-4]。酒醅为窖泥中的微生物提供其生长所需的碳源、氮源、生长因子等各类营养物质,窖泥中的微生物则生长代谢产生己酸、乳酸、丁酸、乙酸等酸类,进一步在窖泥或酒醅中酯化酶的作用下生成各种酯类[5-6]。浓香型白酒主体香味成分己酸乙酯的生成与窖泥微生物有最直接的关系,研究窖泥微生物意义重大。据相关资料[7]表明,窖泥微生物的研究主要包含酵母菌、霉菌、细菌、放线菌,相对而言,放线菌的相关研究较少,其中有关浓香型白酒酿造环境中放线菌的研究还远远不够[8]。王涛等[9]对浓香型白酒酿造相关放线菌发酵液中的主要醇溶性和水溶性挥发性产物进行GC-MS分析发现代谢产物有醇类、酯类、醛类、酸类。周敬波等[10]对放线菌的产酶能力进行研究,发现实验菌株具有很强产淀粉酶、产蛋白酶能力。郭威等[11]发现放线菌的产酶能力与其促己酸菌产己酸能力是有一定关联的。这些研究都表明了放线菌在白酒生产中具有较高的可研究前景和可开发价值。
对于窖泥放线菌研究来说,多采用直接从窖池取回窖泥进行筛菌工作,可以直观地获得该时期该窖泥中的微生物,但是会大概率无法分离得到放线菌,可能是由于所取样品无放线菌或者放线菌在该时期的生存能力较弱导致的难以筛选,针对于这一不足,利用细菌不能产生菌丝,就无法透过滤膜进入原位培养基中,丝状真菌菌丝体较粗,同样会被滤膜阻隔,酵母菌不产生菌丝,菌体也较大,因而也不能透过滤膜,只有放线菌可穿过滤膜这一原理,自制原位培养装置,埋放于窖泥中富集放线菌。原位培养(in situ cultivation)可以模拟自然环境,富集菌体,有利于提高微生物,特别是某些未培养微生物(uncultivated microorganisms)的获取率[12-13]。
本试验通过高通量测序技术对窖泥细菌群落结构进行分析,进一步对放线菌多样性进行分析,筛选分离出放线菌,以系统发育特征及生理生化特征对菌株进行鉴定,并对其相关耐受性和代谢特性进行研究,为探究放线菌在窖泥中的功能提供理论基础。
1 材料与方法
1.1 样品
窖泥取自川南某浓香型白酒生产企业一口50年窖龄且发酵正常的窖池。
1.2 主要试剂
KNO3、NaCl、KH2PO4、葡萄糖、重铬酸钾(均为分析纯),成都市科龙化工试剂厂;酵母膏、麦芽浸粉、蛋白胨(均为生物试剂),北京奥博星生物技术有限责任公司;结冷胶(食品级),郑州市中成化工。
1.3 仪器与设备
DM500生物显微镜,德国Leica公司;C1000 Touch PCR仪、ChemiDocXPS+凝胶成像系统,美国BIO-RAD公司;5430离心机,Eppendorf公司;固相微萃取头(50 μm/30 μm DVAB/CAR/PDMS),美国Supelco 公司;5975B-7890A气相色谱质谱联用仪,安捷伦科技中国有限公司。
1.4 培养基
原位培养基:黄水1 L,琼脂粉1.5%(质量分数),结冷胶0.5%(质量分数),自然pH值。
纯化培养基:高氏Ⅰ号培养基[14]。
YEME培养基:葡萄糖10 g,蔗糖100 g,蛋白胨5 g,麦芽浸粉3 g,酵母膏3 g,蒸馏1 L,灭菌后加MgCl2(2.5 mol/L) 2 mL,灭菌条件为121 ℃,15 min。
以上培养基所用无机盐均为水合盐,下同,均添加1%琼脂和0.5%的结冷胶做凝固剂[15-16],添加75 μg/mL的重铬酸钾[17],5 mL/L的黄水,调节pH 7.0~7.4,均在121 ℃下灭菌15 min。
燕麦汁培养基:生燕麦片20 g,可溶性淀粉10 g,微量盐溶液1 mL(FeSO4 0.1%,MgCl2 0.1%,ZnSO4 0.1%)(质量分数),自然pH值,灭菌条件为121 ℃,15 min。
固态发酵培养基:燕麦粉50 g,微量盐溶液1 mL(KNO3 1%、KH2PO4 0.5%、MgSO4 0.5%,FeSO4 0.1%,NaOH 0.8%)(质量分数),pH自然,灭菌条件为121 ℃,15 min。
1.5 窖泥中微生物群落结构分析
取中、下、底3个空间位置的窖泥,3点取样,混合均匀,取回冷冻。送往上海美吉生物医药科技有限公司,采用通用引物968FMID-1401R,参照邓杰等[18]的方法完成高通量测序工作,对测序数据利用Mother软件进行分析,结果采用平均值±标准误差的形式表示。
1.6 放线菌的分离纯化与鉴定
1.6.1 放线菌的分离纯化
参照姜明国等[19]分离红树林根际土壤放线菌所用原位培养装置(图1-a)与闫志英等[20]发明的一种原位分离产纤维素酶放线菌的装置,自制原位培养装置(图1-b)。将其分别埋放在窖底和窖壁下层泥下1 cm左右,约70 d后取回捣碎,称取10 g加入90 mL 0.85%(质量分数)无菌生理盐水,振荡均匀,静置2 h后梯度稀释至10-1、10-2、10-3,涂布至高氏I号培养基,28 ℃恒温培养5 d,每个稀释度3组平行。挑取具有放线菌典型菌落形态特征的单菌落[21],纯化培养2~3次,最后以试管斜面-4 ℃保藏备用。
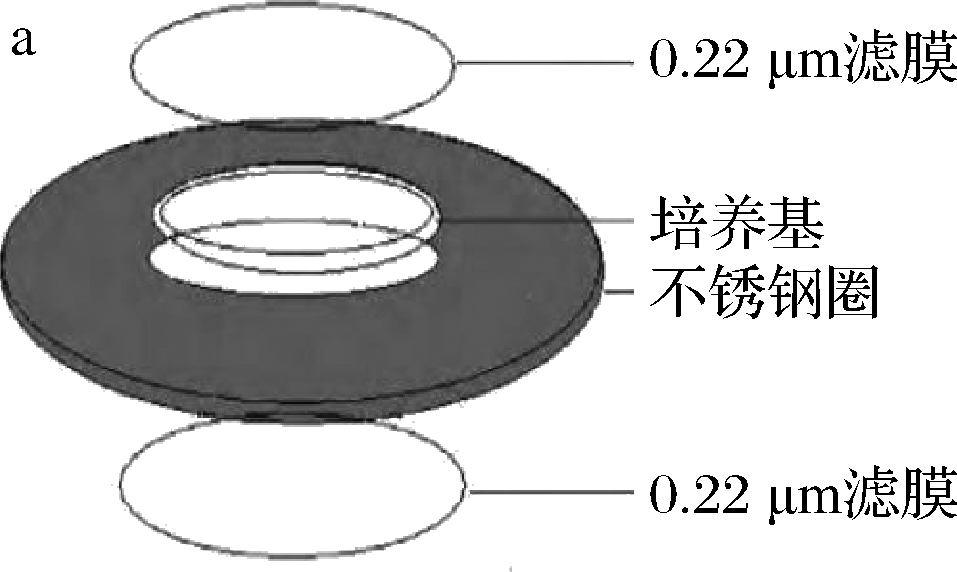

a-放线菌原位俘获装置;b-自制原位培养装置
图1 原位培养装置
Fig.1 The chamber of in situ cultivation
1.6.2 放线菌的初步鉴定
参照《放线菌系统分类技术》[21]用插片法并滴加美蓝染液观察菌体形态,并进行明胶液化、牛奶凝固与胨化、淀粉水解、纤维素分解、硝酸盐还原、H2S的产生这6组生理生化试验。
1.6.3 放线菌DNA提取、扩增及测序
利用土壤基因组DNA提取试剂盒(康为世纪)提取放线菌DNA,采用细菌16S rRNA基因扩增通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGCTACCTTGTTACGACTT-3′),参照张洪伟等[22]的反应体系,进行PCR扩增。将PCR反应产物送上海杰李生物技术有限公司进行纯化和测序。在NCBI官方网站(http://www.ncbi.nlm.nih.gov/)上进行序列同源性比对,采用 MEGA 7.0构建系统发育树,获得目的菌的分类地位及其近缘系统发育地位。
1.7 放线菌的耐受特性研究
1.7.1 放线菌的耐酸性研究
菌株发酵采用YEME液体培养基。每组发酵罐分装1 200 mL培养基,用浓盐酸和1 mol/L NaOH溶液分别调节pH值至3.0、4.3、5.6和7.0。脱脂棉堵住发酵罐各开口,121 ℃灭菌30 min后使用。控制发酵温度为28 ℃,搅拌转速100 r/min,通气流量(经空气过滤器)25 L/h。每隔12 h取1次样,每次取样25~30 mL。
试验以菌体干重法分析菌株生长情况[23]。准确吸取25 mL发酵液样品5 000 r/min离心10 min,弃去上清液,带管于80 ℃烘干至恒重(2次称量差<0.002 g)。
1.7.2 放线菌的乙醇耐受性研究
用无菌的无水乙醇调节发酵液酒精度至2%vol、4%vol、6%vol和8%vol,其余操作同1.7.1。
1.8 挥发性产物分析
1.8.1 放线菌液态培养
分别按2%接种量进行接种,于28 ℃条件下培养5 d(液态培养需将转速调至120 r/min)。每组3个平行,密封瓶口,继续培养2 d。
1.8.2 放线菌固态培养
每瓶50 g固态发酵培养基,灭菌后,在无菌条件下分别吸取10 mL菌种液,振荡混匀,28 ℃恒温培养,每隔24 h振荡摇匀1次。菌株A1、A2培养5 d后密封瓶口,继续培养2 d。同时做不添加放线菌菌液的空白试验组,按相同的条件培养并分析。
1.8.3 发酵液挥发性产物分析
采用顶空固相微萃取法提取发酵液挥发性产物。吸取5 mL发酵液加入顶空瓶中,加入1.5 g NaCl,在60 ℃下平衡10 min后,萃取30 min,进样口250 ℃解析2 min,进行GC-MS分析[24]。
气相色谱条件[25]:毛细管色谱柱为J&W 122-7062(60.0 m×250 μm,0.25 μm);手动分流进样,分流比为12∶1;进样口温度250 ℃;起始温度60 ℃,维持2 min,然后以5 ℃/min升温至200 ℃,维持 1 min,再以20 ℃/min升温至250 ℃,维持2 min;以He为载气,流速为1 mL/min。
质谱条件[25]:电离方式EI,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,恒压10 Pa,质量扫描范围20~550 amu。
1.8.4 燕麦固态发酵醅挥发性产物分析
采用顶空固相微萃取法提取燕麦固态发酵醅的挥发性成分。称取燕麦醅5.0 g/瓶,并加入5 μL 2 004.5 mg/100mL的乙酸丁酯标品进行半定量分析。于60 ℃恒温条件下平衡10 min,后续萃取、分析方法及步骤均同1.8.3。
2 结果与分析
2.1 窖泥细菌多样性分析
对测序数据利用Mother软件按97%归类,划分OTU,得到稀释曲线,见图2,可看出,样品稀释曲线随测序数目的增大而趋于平稳,说明取样合理,数据有效。将细菌OUT分类按门和目进行统计,结果如图3所示。发现该窖泥样品含有丰富的放线菌,含(87±30)个OTUs,占(10.7±3.4)%,仅次于厚壁菌门(Firmicutes)的(42.5±3.0)%和未分类(Unclassified)的(28.6±0.6)%。进一步分析数据,发现放线菌主要分布于未分类(24±7)个OTUs、链霉菌亚目(Streptomycineae)(21±7)个OTUs、科里氏杆菌亚目(Coriobacterineae)(19±6)个OTUs、双歧杆菌目(Bifidobacteriales)8±3个OTUs、小单孢菌亚目(Micromonosporineae)(7±3)个OTUs、丙酸杆菌亚目(Propionibactrineae)(6±2)个OTUs、另有微球菌亚目(Micrococcineae)(4±2)个OTUs。由窖泥样品中放线菌群落结构的分析结果可以看出,该窖泥中放线菌物种丰富,链霉菌亚目(Streptomycineae)是其中的绝对优势菌群,与王涛等[26]的研究结果一致。对比刘茂轲等[27]、谭崇尧等[28]、刘延波等[29]的研究结果,发现本试验所得到的放线菌种属类更为丰富。首次从浓香型白酒窖泥中分析出Coriobacterineae、Micrococcineae、Bifidobacteriales、Propionibactrineae、Micromonosporineae。
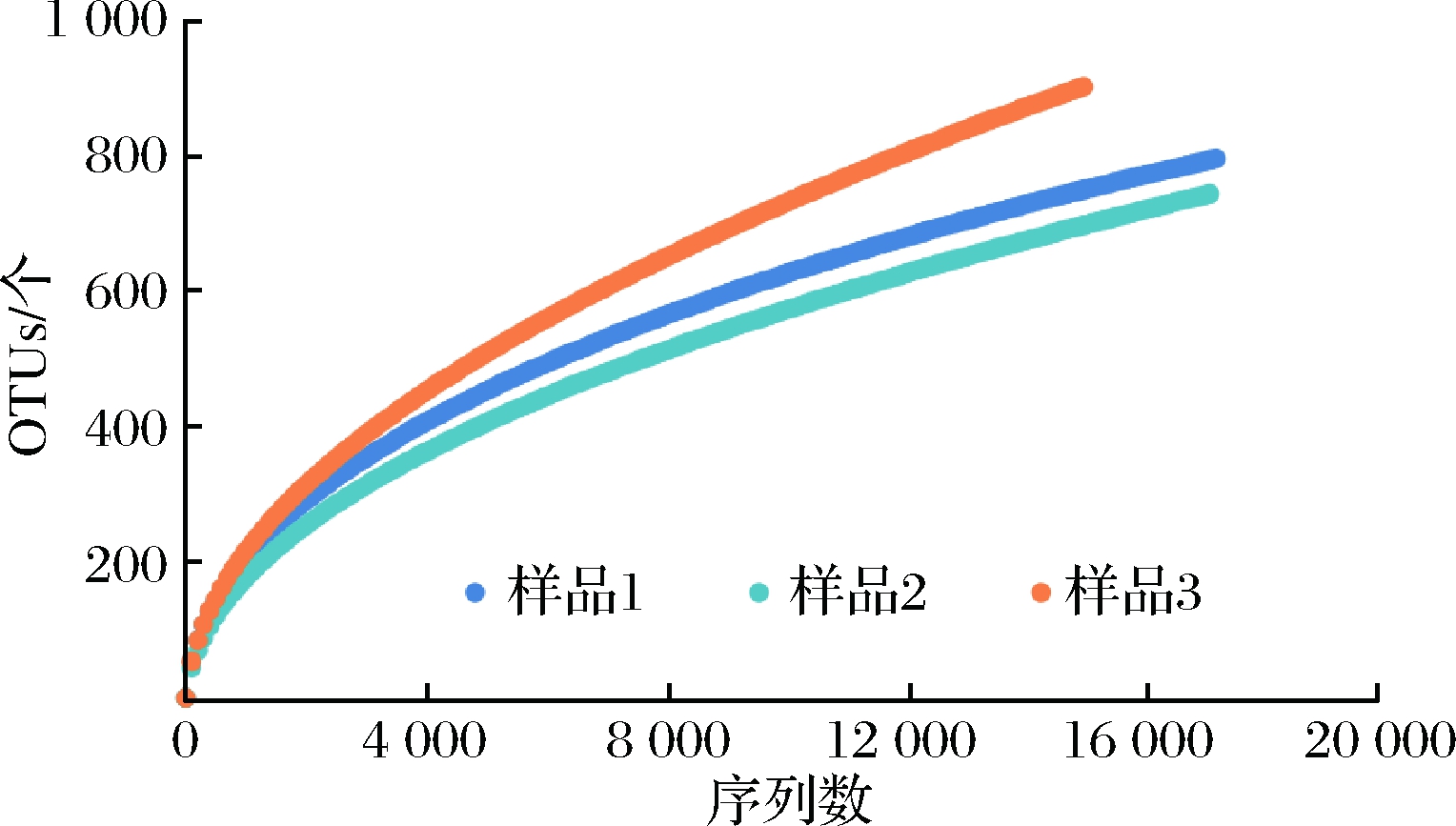
图2 窖泥样品稀释曲线
Fig.2 Rarefaction curve in pit mud
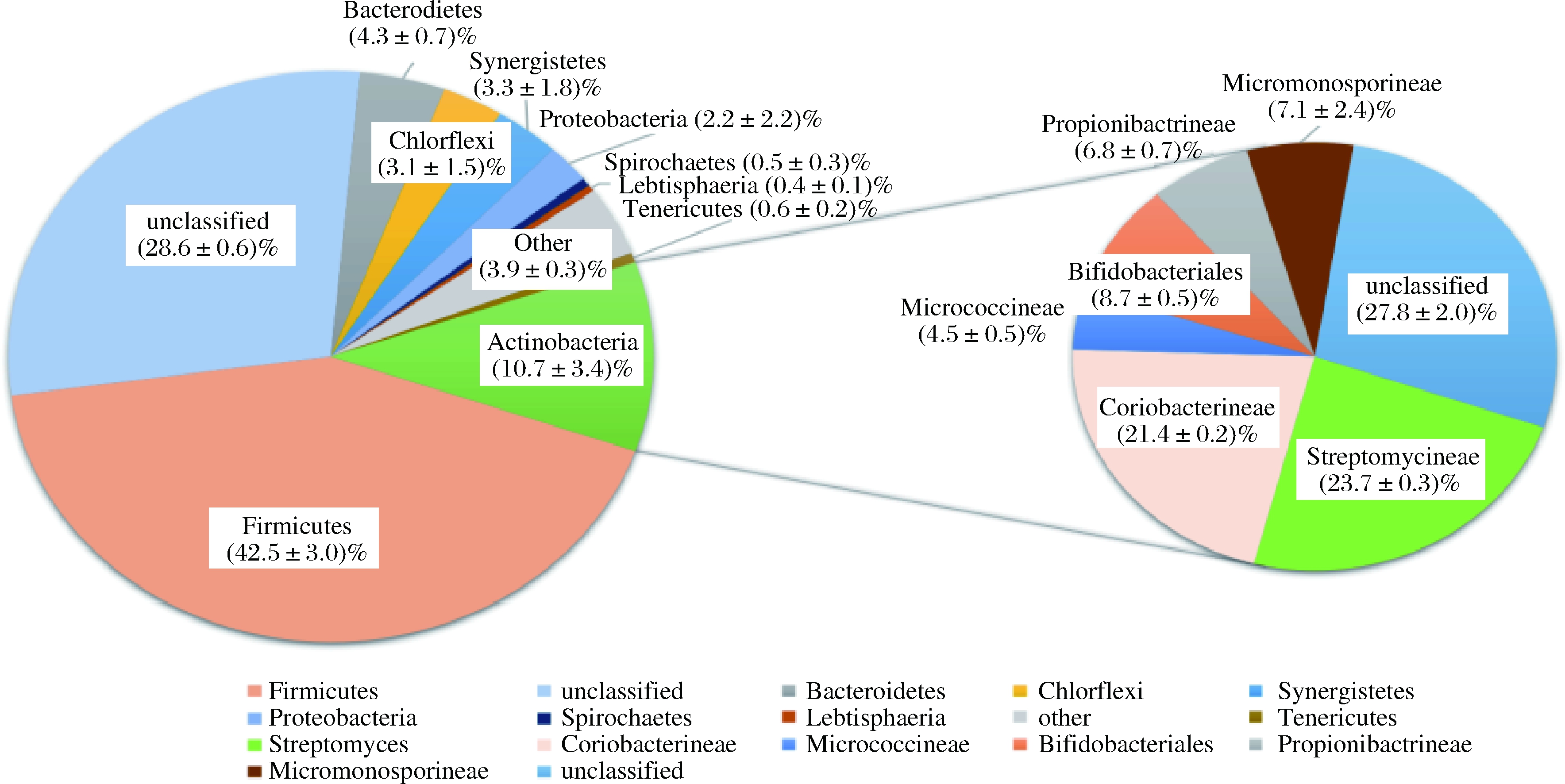
图3 放线菌多样性分布图
Fig.3 Distribution map of actinomycetes diversity
2.2 放线菌的分离与鉴定
2.2.1 形态鉴定
由原位培养基从窖泥中筛选得到的菌株,经纯化培养后,对具有典型放线菌菌落特征的菌株观察菌落大小、对比生长速度、嗅闻香味,最终筛选出2株具有特殊香气的菌株,分别编号为A1、A2,对菌落形态观察见图4,镜检观察结果见图5。
由图4可知,A1菌落表面干燥,不透明,表面有丝绒感;菌落与培养基结合紧密,培养时间较长后可刮取到粉状菌体,反面呈黑褐色,产可溶性色素。菌株A2较A1生长缓慢,菌落细小,颜色较浅。正反颜色基本一致,不产可溶性色素。
由图5可知均有发育良好的分枝状气生菌丝,基内菌丝发达。孢子在镜检结果中呈透明状,A1可见成堆或排列成串的孢子,A2气生菌丝分枝较多,可见少量散落的或成串的孢子。由镜检结果和菌落形态初步鉴定A1、A2均为放线菌。
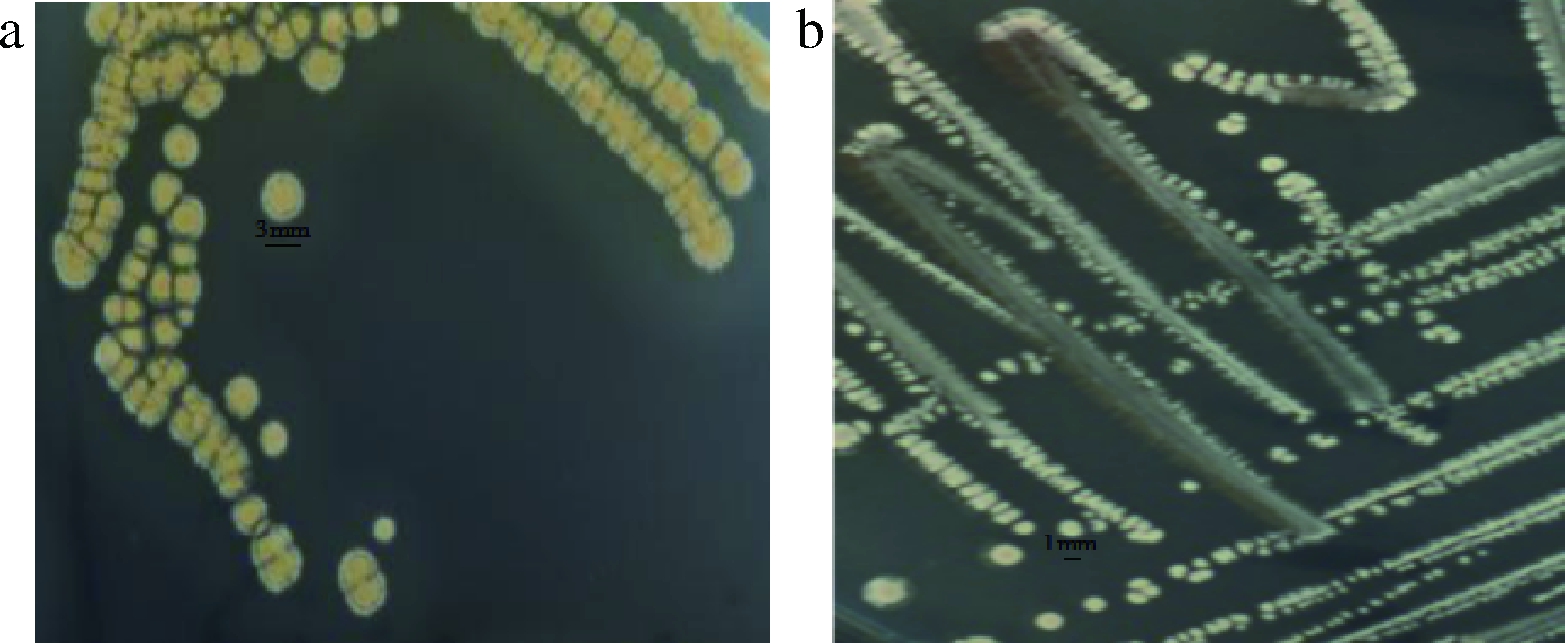
a-A1菌落图;b-A2菌落图
图4 两株菌的菌落形态
Fig.4 Colony morphology of 2 strains
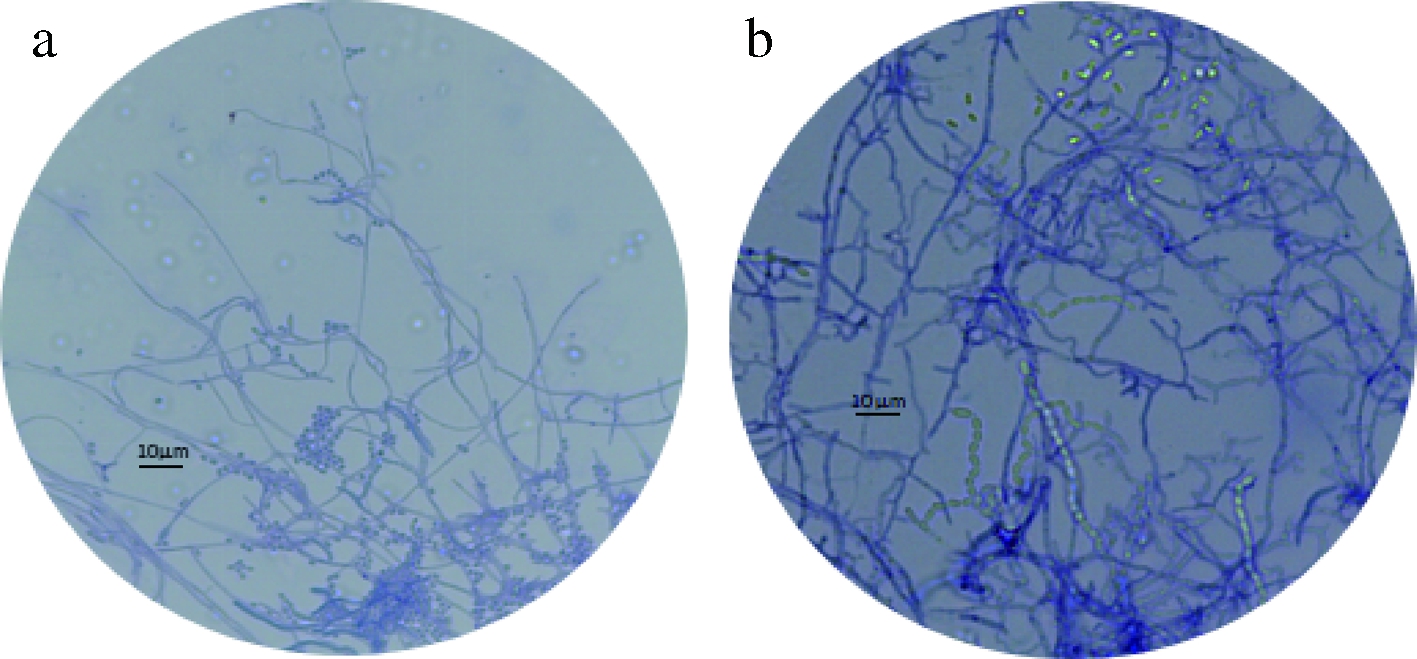
a-A1气生菌丝;b-A2气生菌丝
图5 两株菌气生菌丝镜检图(100×)
Fig.5 Microscopic examination of aerial mycelium of the 2 strains
2.2.2 生理生化试验
本试验工作仅选取若干组与白酒酿造有一定相关性的理化特征进行试验,结果见表1。试验发现,菌株A1仅H2S的产生呈现阴性,其余试验均呈阳性,因此推测A1可能有产蛋白酶、淀粉酶和纤维素酶能力。A2仅淀粉水解呈现阳性,其余试验均呈阴性,由此推测菌株A2可能有产淀粉酶能力。这些酶可使原料中的大分子物质分解以供窖池中微生物进一步发酵利用。根据《伯杰氏细菌鉴定手册》(第八版)[30]和《链霉菌鉴定手册》[31],菌株A1、A2符合链霉菌科链霉菌属生理生化特征。
表1 生理生化试验结果
Table 1 Results of physiological and biochemical experiments

菌株明胶液化牛奶凝固与胨化淀粉水解纤维素分解硝酸盐还原H2S的产生A1+++++-A2--+---
注:“+”表示阳性;“-”表示阴性
2.2.3 16S rRNA基因测序及发育分析
将PCR反应原液送上海杰李生物技术有限公司进行纯化和测序,测序序列经NCBI数据库比对获取最高相似菌株序列,使用MEGA 7.0构建系统发育树。菌株A1、A2系统发育树结果如图6所示。菌株A1与streptomyces sampsonii NRRL B12325、streptomyces sampsonii 具有最大的序列相似性,达100%,发育树上处于同一个分支,将菌株A1鉴定为桑氏链霉菌(Streptomyces sampsonii),暂时命名为Streptomyces sampsonii A1。菌株A2与Streptomyces rutgersensis strain NBRC 3727、Streptomyces rutgersensis strain NBRC 3419具有最大的序列相似性,达99%,且发育树上处于同一个分支,我们将菌株A2鉴定为鲁地链霉菌(Streptomyces rutgersensis),暂时命名为Streptomyces rutgersensis A2。

图6 邻接法构建的菌株A1、A2 16S rRNA序列系统发育树
Fig.6 Phylogenetic tree of strain A1 and A2 16S rRNA constructed by adjacency method
2.3 放线菌的耐受性研究
2.3.1 放线菌耐酸性研究
菌株A1、A2的耐酸性结果见图7。显然,2株菌均在pH<4.3时生长受到抑制,在pH>4.3时生长良好。窖泥底层和下层的pH值在4.0~5.5,上层在5.5~6.5[29],因此菌株A1、A2在窖内都具有一定的生存能力,但相比之下,A2对酸性环境更具有耐受性。本试验以无机酸调节pH,而窖泥自然环境中则主要为有机酸类,菌株在窖内可能具有更佳的耐酸性,但考虑到窖内的厌氧和高乙醇浓度,实际影响可能更为复杂。
2.3.2 放线菌乙醇耐受性研究
图8为A1和A2在不同浓度乙醇下的生长曲线。菌株A1在2%vol、4%vol、6%vol和8%vol的酒精度下均能生长,但有不同长度的延滞期(8%vol>6%vol>4%vol>2%vol)。而菌株A2不耐受8%vol的酒精度,在6%vol下可以缓慢生长,在4%vol和2%vol生长情况相近。总之,菌株A1、A2都可以耐受6%vol及以下的酒精度,酒醅中的酒精度一般在3%vol~6%vol[33],所以2株菌在窖内的酒精环境下具有一定生存能力。

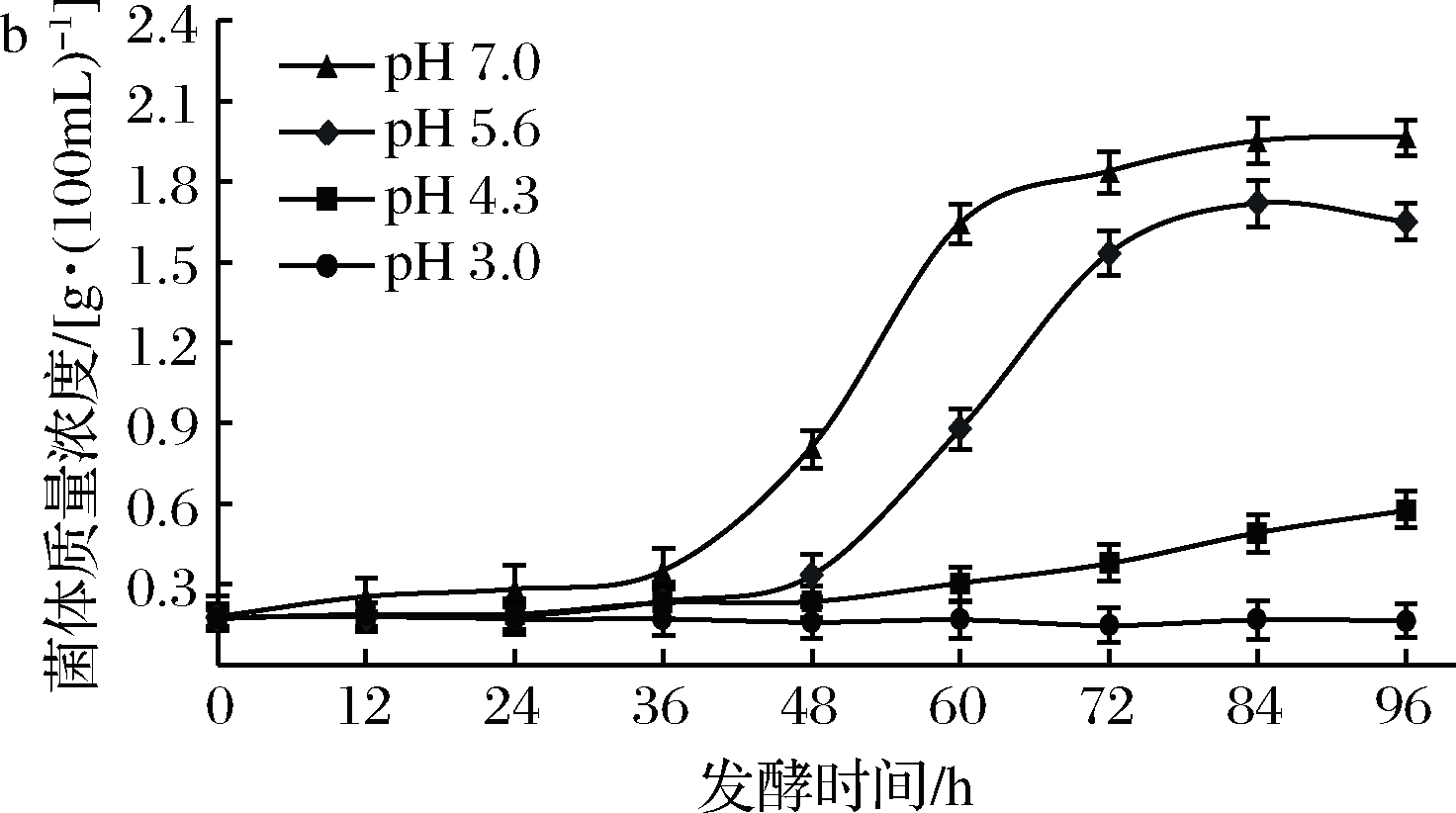
A-A1;B-A2
图7 A1、A2的耐酸性生长曲线
Fig.7 Growth curves of the strain of A1,A2 in the environment of different pH
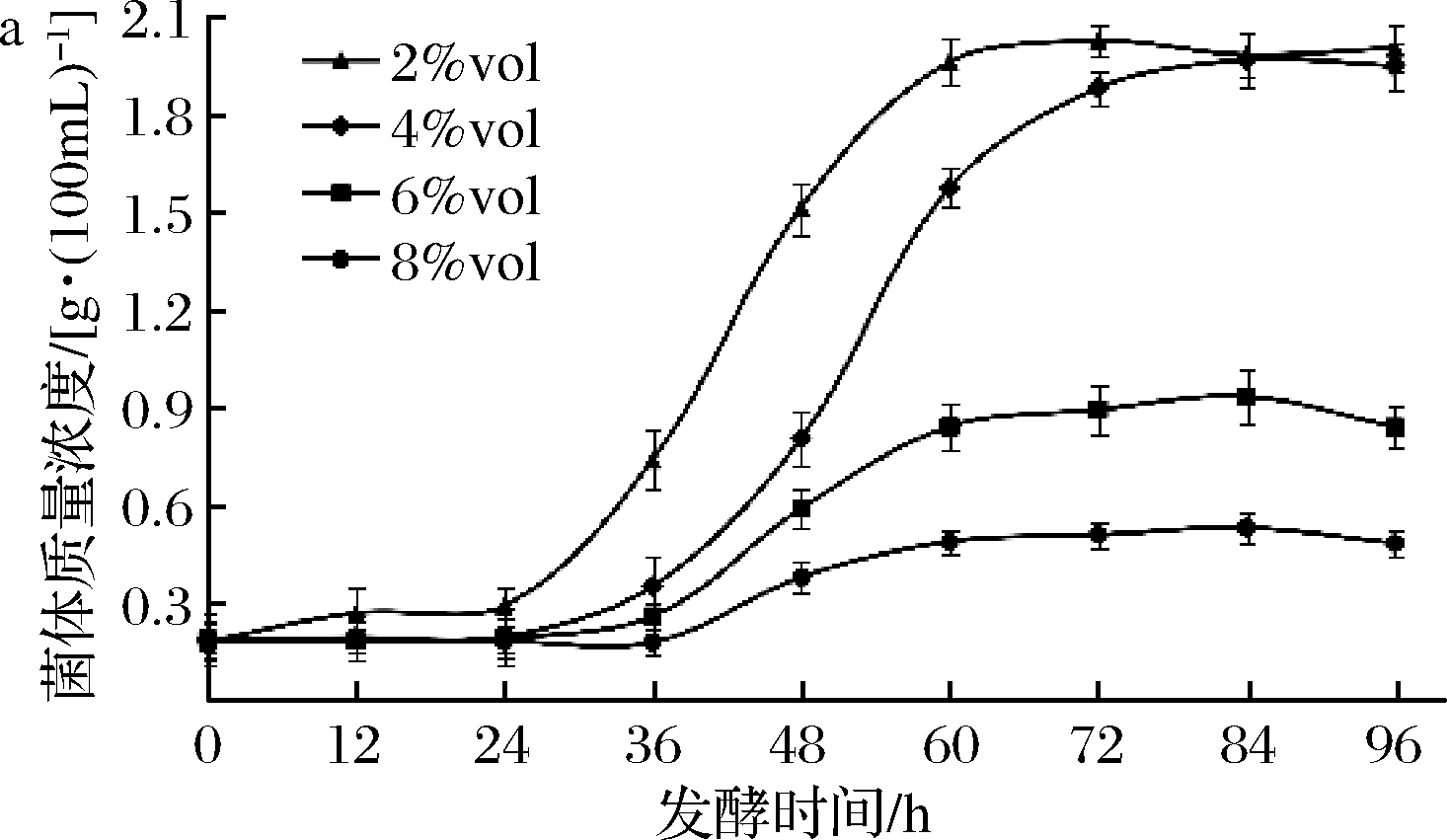

a-A1;b-A2
图8 A1、A2的乙醇耐受性生长曲线
Fig.8 Growth curves of the strain of A1、A2 in the environment of different ethanol concentration
2.4 挥发性产物研究
2.4.1 菌株在液态培养条件下挥发性产物分析
经谱库NIST检索和资料分析,A1和A2在液态培养条件的产物分别见表2和表3。菌株A1在液态培养条件可产约35.030%的萜烯类物质,33.855%的土臭素(gesomin,GSM)以及5.721%的多菌灵类似物N-苯并咪唑-2-基氨基甲酸甲酯。此前,杜海从酿造环境中筛选出了5株产GMS菌株,鉴定均为链霉菌属[34]。菌株A2能够产生多种酯类,其中己酸乙酯具有较高的相对含量(5.384%)。同样地,A2在液态条件下能产萜烯类物质(3.327%)和多菌灵类似物(1.788%),以及少量具有苦杏仁、樱桃及坚果香的苯甲醛。
表2 A1发酵液主要挥发性成分
Table 2 The main volatile components of the fermentation broth of A1 strain
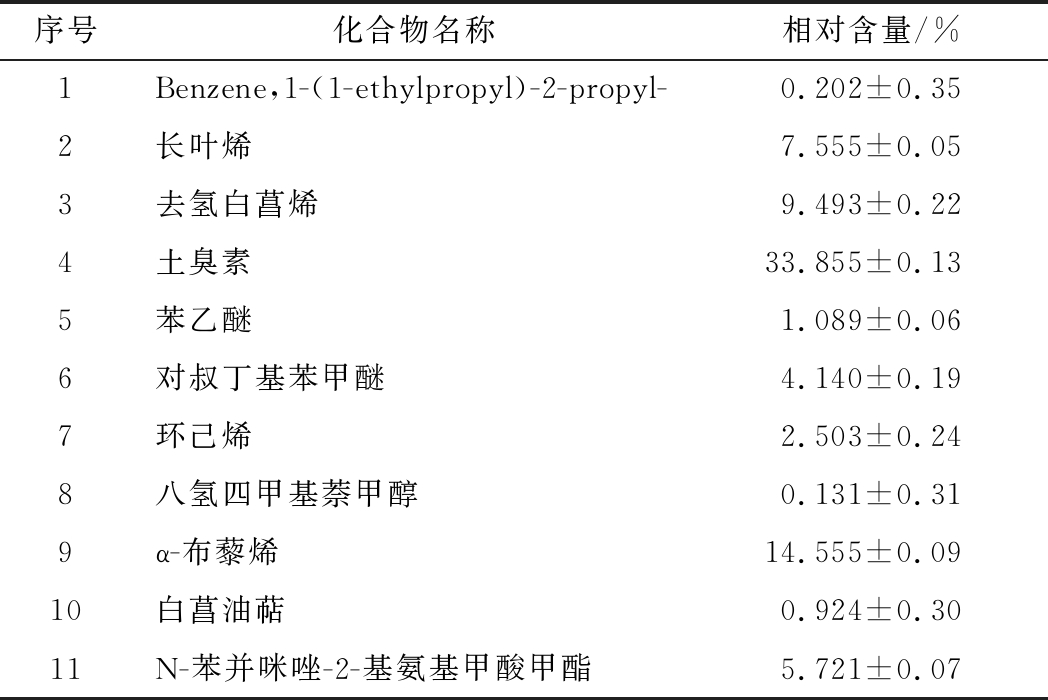
序号化合物名称相对含量/%1Benzene,1-(1-ethylpropyl)-2-propyl-0.202±0.352长叶烯7.555±0.053去氢白菖烯9.493±0.224土臭素33.855±0.135苯乙醚1.089±0.066对叔丁基苯甲醚4.140±0.197环己烯2.503±0.248八氢四甲基萘甲醇0.131±0.319α-布藜烯14.555±0.0910白菖油萜0.924±0.3011N-苯并咪唑-2-基氨基甲酸甲酯5.721±0.07
注:去除空白试样峰和溶剂杂峰,仅列出相似度>80或相对含量>1%的成分(下同)
表3 A2发酵液主要挥发性成分
Table 3 The main volatile components of the fermentation broth of A2 strain
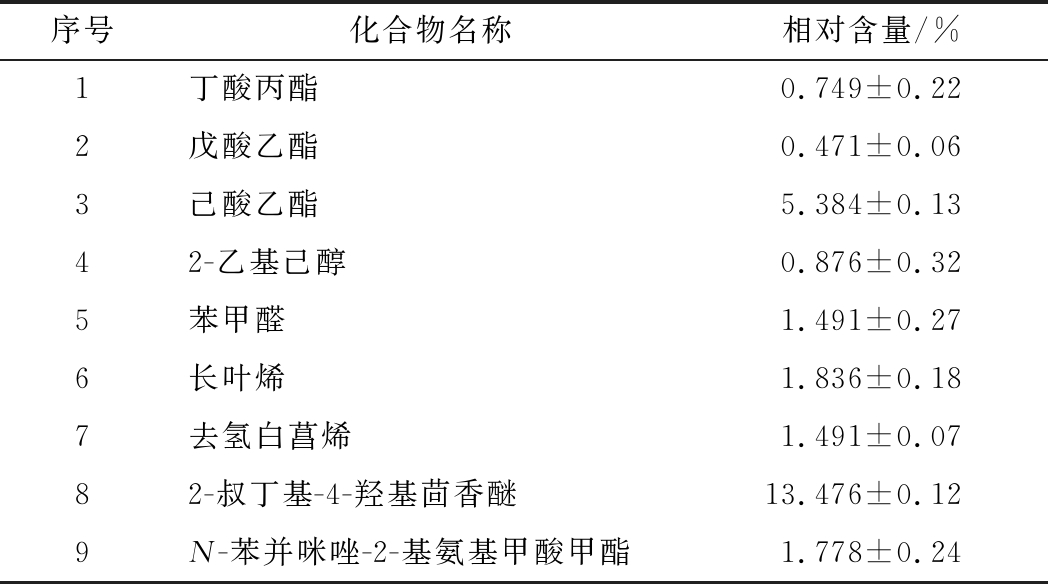
序号化合物名称相对含量/%1丁酸丙酯0.749±0.222戊酸乙酯0.471±0.063己酸乙酯5.384±0.1342-乙基己醇0.876±0.325苯甲醛1.491±0.276长叶烯1.836±0.187去氢白菖烯1.491±0.0782-叔丁基-4-羟基茴香醚13.476±0.129N-苯并咪唑-2-基氨基甲酸甲酯1.778±0.24
2.4.2 菌株在固态培养条件下挥发性产物分析
经谱库NIST检索和资料分析,放线菌菌株A1、A2在固态培养条件下其主要挥发性产物分别见表4和表5。
表4 菌株A1燕麦醅主要挥发性成分
Table 4 The main volatile components of the fermented Oatmeal of A1 strain
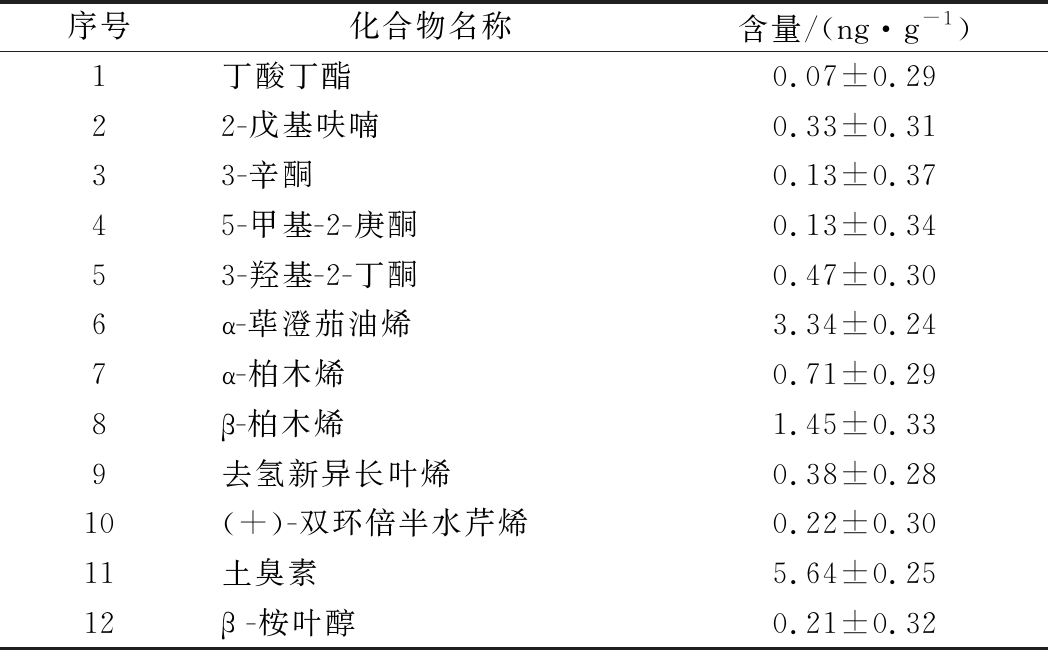
序号化合物名称含量/(ng·g-1)1丁酸丁酯0.07±0.2922-戊基呋喃0.33±0.3133-辛酮0.13±0.3745-甲基-2-庚酮0.13±0.3453-羟基-2-丁酮0.47±0.306α-荜澄茄油烯3.34±0.247α-柏木烯0.71±0.298β-柏木烯1.45±0.339去氢新异长叶烯0.38±0.2810(+)-双环倍半水芹烯0.22±0.3011土臭素5.64±0.2512β -桉叶醇0.21±0.32
表5 菌株A2燕麦醅主要挥发性成分
Tab.5 The main volatile components of the fermented Oatmeal of A2 strain

序号化合物名称含量/(ng·g-1)12-戊基呋喃1.20±0.2722-辛酮0.12±0.3433-羟基-2-丁酮44.48±0.4042,5-二甲基吡嗪0.30±0.3152,3,5-三甲基吡嗪1.92±0.236乙酸0.44±0.2972,3,5,6-四甲基吡嗪5.26±0.188苯甲醛0.24±0.3192,3-丁二醇25.10±0.1110异丁酸2.16±0.1711(2R,3R)-(-)-2,3-丁二醇25.74±0.2512苯乙醇0.24±0.33
由表4可知,与液态培养条件下相比,菌株A1在固态培养条件下能产生更多种萜烯类物质,同样地能产较高含量的GSM,达5.64 ng/g。由表5可知,菌株A2在固态培养条件下,能够检测出大量醇类物质(51.08 ng/g)、酮类物质(44.60 ng/g)和吡嗪类物质(7.84 ng/g),其中醇类物质以2,3-丁二醇为主,达(25.10±0.11) ng/g;酮类物质以3-羟基-2-丁酮为主,达(44.48±0.40)ng/g;吡嗪类以2,3,5,6-四甲基吡嗪为主,达(5.26±0.18)ng/g。2,3-丁二醇可转化为3-羟基-2-丁酮,因此A2产高含量的2,3-丁二醇,也一定程度上表明了会有高含量的3-羟基-2-丁酮[35]。此前,杜海[34]研究发现链霉菌会生成碱性的吡嗪类物质调节周围生产环境。总的来说,菌株A1在固、液态条件下都以产GMS和萜烯类物质为主,菌株A2在液态条件下具有较强产酯能力,在固态条件下主产酮类、醇类以及吡嗪类物质。与现有报道相比,挥发性产物含量不突出,但尚未见报道从浓香型窖泥中分离出主要产萜烯类、2,3-丁二醇、3-羟基-2-丁酮、四甲基吡嗪的放线菌。
3 讨论
本研究对窖泥样品的微生物群落结构进行分析,作为分离放线菌的参考和指导,分析结果扩大了窖泥放线菌的种属范围。采用原位培养法对放线菌进行分离,分离所得2株菌均为链霉菌亚目(Streptomycineae),可能是由于试验仅挑取了有典型放线菌菌落特征的菌株,忽略了非典型的放线菌,也可能是由于原位培养装置只富集了仍有生长代谢活动的菌株,导致分离得到的菌株较少。
2株菌在固、液态培养条件下产物有较大差异,因为这些物质多为次级代谢产物,微生物具有多种次级代谢途径的潜能,不同培养基或者不同培养方式影响着菌株的次级代谢产物种类及含量[36],如PUDER等[37]分别采用燕麦培养基和豆粉培养基获得试验放线菌的同种类型的不同化合物。从白酒中的美拉德反应[38]角度,菌株A1、A2在液态条件下生成的萜烯类物质,可与乙醇在醋酸的促进下生成原羰基化合物(醛、酮、羧酸及羧酸衍生物),因此固态实验中,A1可生成多种酮类物质以及A2可生成多种酮类、醇类、吡嗪类物质可能是萜烯类物质转化而来。菌株A1产生的GSM与二甲基异茨醇(2-methyl isoborneol,MIB)是饮水中最常出现的土霉异味的2个主要来源[39]。GMS可引起白酒产生糠味,是影响清香型白酒风味主要原因[40],因此在投入生产中应注意改善工艺,避免影响白酒风味。对于其产生的萜烯类物质,常见于植物的挥发油中,具有一定的药理功效[41]。菌株A2产生的3-羟基-2丁酮,又名乙偶姻,是一种重要的食用香料,具有强烈的奶油、脂肪样香气,高度稀释后有令人愉快的奶香气,是白酒的重要的香味成分[42]。其中2,3-丁二醇是一种重要的医药成分,在白酒中可单独用做香料,改善白酒风味,也可以转化为3-羟基-2-丁酮[35]。四甲基吡嗪是白酒中重要的香气化合物,且具有药理功能,被认为是中国白酒中的健康功能因子。有动物试验表明,四甲基吡嗪可以修复酒精引起的肝细胞损伤和脑神经损伤[43-44]。由此可见,菌株A2可深入研究,提高其物质产量后加以运用。
对于放线菌在浓香型白酒窖泥中的功能,研究还不够深入,但其应用前景很大,比如可用于生产人工窖泥等方面。在开发放线菌多种功能性产品的同时,需对菌种本身了解充分再加以利用,这还需要不断深入探究。
[1] GUO M Y, HOU C J, BIAN M H, et al.Characterization of microbial community profiles associated with quality of Chinese strong-aromatic liquor through metagenomics[J].Journal of applied microbiology, 2019, 127(3):750-762.
[2] LI H, HUANG J, LIU X P, et al.Characterization of interphase microbial community in luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].Journal of Microbiology & Biotechnology, 2016, 27(1):130-140.
[3] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].International Journal of Food Microbiology, 2019, 311:108 350.
[4] GAO Z Z, WU Z Y, ZHANG W X.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of chinese strong-flavor liquor[J].Foods, 2020, 9(3):372.
[5] ZHENG Q, LIN B R, WANG Y B, et al.Proteomic and high-throughput analysis of protein expression and microbial diversity of microbes from 30-and 300-year pit muds of Chinese Luzhou-flavor liquor[J].Food Research International, 2015, 75:305-314.
[6] 王世伟, 王卿惠, 芦利军, 等.白酒酿造微生物多样性、酶系与风味物质形成的研究进展[J].农业生物技术学报, 2017,25(12):140-153.
WANG S W, WANG Q H, LU L J, et al.Research progress of the microbial diversity, enzyme system and formation of flavor compounds in chinese flavor liquor[J].Chinese Journal of Agricultural Biotechnology, 2017,25(12):140-153.
[7] 唐贤华, 黄睿, 王思思, 等.浓香型白酒窖泥微生物研究综述[J].酿酒, 2019, 46(2):12-14.
TANG X H, HUANG R, WANG S S, et al.Advances in rescarch on microorganisms in pit mud of Luzhou-flavor Baijiu[J].Liquor Making, 2019, 46(2):12-14.
[8] 张超, 赵东, 王涛, 等.多粮浓香型白酒生产中放线菌的多样性[J].食品科学, 2011, 32(23):192-196.
ZHANG C, ZHAO D, WANG T, et al.Diversity of actinomycetes in the brewing process of Luzhou-flavor multiple-grains liquor[J].Food Science, 2011, 32(23):192-196.
[9] 王涛,游玲,赵冬,等.浓香型白酒酿造相关放线菌挥发性产物分析[J].食品科学, 2012, 33(14):184-187.
WANG T, YOU L,ZHAO D, et al.Preliminary analysis of volatiles in fermentation broths of actinomycetes isolated from Luzhou-flavor liquor brewing environments[J].Food Science, 2012, 33(14):192-196.
[10] 周敬波,许雨欣,郭威,等.白酒酿造中放线菌的产酶能力研究[J].酿酒, 2015, 42(6):66-69.
ZHOU J B, XU Y X, GUO W, et al.Research of actinomycetes enzyme production capacity in the liquor brewing[J].Liquor Making, 2015, 42(6):66-69.
[11] 郭威, 管健, 陈茂彬, 等.放线菌的产酶能力与其促己酸菌产己酸的关系探究[J].酿酒, 2016, 43(5):62-65.
GUO W, GUAN J, CHEN M B, et al.Research on the relationship between actinomycetes′ enzyme-producing abilities and its ability to promoting caproic acid bacteria producing caproic acid[J].Liquor Making, 2016, 43(5):62-65.
[12] 李俊霞, 刘晨光.提高微生物可培养性的方法的研究概况和进展[J].微生物前沿, 2016, 5(1):1-8.
LI J X, LIU C G.Progress on methods for increasing microbial culturability[J].Advances in Microbiology, 2016, 5(1):1-8.
[13] SLAVA S.EPSTEIN.Uncultivated Microorganisms[M].Springer, Berlin, Heidelberg:2009.
[14] 沈萍, 陈向东.微生物学实验[M].第五版.北京:高等教育出版社, 2018.
SHEN P, CHEN X D.Microbiology Experiment[M].5th ed.Beijing:Higher Education Press, 2018.
[15] 杜娟,战伟伟.结冷胶的研究进展及应用[J].山东轻工业学院学报(自然科学版), 2012, 26(4):66-69.
DU J, ZHAN W W.The research progress and application of gella gum[J].Journal of Shandong Polytechnic University, 2012, 26(4):66-69.
[16] 吴许文, 吴清平, 张淑红, 等.几种微生物培养基凝固剂的研究和应用现状[J].中国卫生检验杂志, 2010, 20(3):694-696.
WU X W, WU Q P, ZHANG S H, et al.Research and application of several coagulants for microbial culture medium[J].Chinese Journal of Health Laboratory Technology, 2010,20(3):694-696.
[17] 司美茹, 薛泉宏, 来航线.放线菌分离培养基筛选及杂菌抑制方法研究[J].微生物学通报, 2004, 31(2):61-65.
SI M R, XUE Q H, LAI H X.Studies miscellaneous microorganism on selection of the isolation medium for actinomycetes and inhabition methods to miscellaneous microorganism[J].Microbiology China, 2004, 31(2):61-65.
[18] 邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技, 2015, 31(7):57-62.
DENG J, HUANG Z G, WEI C H, et al.High-throughput sequencing reveals bacterial structure in the mud pits of heavy-fragrance baijiu[J].Modern Food Science & Technology, 2015, 31(7):57-62.
[19] 姜明国,甘光华,杨立芳,等.广西红树林根际土壤放线菌的原位培养分离及其活性筛选[J].海洋学报, 2015, 37(2):55-64.
JIANG M G, GAN G H, YANG L F, et al.In situ isolation of actinomycetes and screening bioactive potential from mangrove rhizosphere soils in Guangxi[J].Haiyang Xuebao, 2015, 37(2):55-64.
[20] 闫志英,刘晓风,袁月祥,等.一种原位分离产纤维素酶放线菌的装置:中国,CN201737942U[P/OL].2011-02-09.
YAN Z Y, LIU X F, YUAN Y X.A device for in situ isolation of cellulase producing actinomycetes:China, CN201737942U[P/OL].2011-02-09.
[21] 关统伟,张小平.放线菌系统分类技术[M].北京:化学工业出版社,2016.
GUAN T W, ZHANG X P.Classification Technology of Actinomycetes[M].Beijing:Chemical Industry Press, 2016.
[22] 张洪伟, 张利平, 张秀敏.放线菌快速检测方法的反应体系及反应条件的优化[J].安徽农业科学, 2010, 38(11):5 539-5 541.
ZHANG H W, ZHANG L P, ZHANG X M.Optimization of method and system on rapid detection of actinomycetes[J].Journal of Anhui Agricultural Sciences, 2010, 38(11):5 539-5 541.
[23] 张红丹,杜茜,张正坤,等.放线菌769抑菌谱及液体培养生长曲线的测定[J].中国植保导刊, 2010, 85(7):5-9.
ZHANG H D, DU Q, ZHANG Z K, et al.Determination of actinomycin 769 inhibitory spectrum and liquid culture growth curve[J].China Plant Protection, 2010, 85(7):5-9.
[24] ZUO Y,LI L,ZHANG T, et al.Contribution of streptomyces in sediment to earthy odor inthe overlying water in xionghe reservoir,China[J].Water Research,2010,44:6 085-6 094.
[25] 祝云飞,黄治国,邓杰,等.浓香型大曲中一株酵母菌的分离鉴定及其挥发性产物分析[J].四川理工学院学报(自然科学版), 2016, 39(1):7-11.
ZHU Y F, HUANG Z G, DENG J, et al.Isolation and identification of one yeast strain from nong-flavor daqu and analysis of its volatile products[J].Journal of Sichuan University of Science & Engineering (Natural Science Edition), 2016, 39(1):7-11.
[26] 王涛, 杜江, 陈泽军, 等.窖泥放线菌的分离方法研究[J].酿酒科技, 2009(3):26-27.
WANG T, DU J, CHEN Z J, et al.Study on the isolation methods of actinomycetes from pit mud[J].Liquor-Making Science & Technology, 2009(3):26-27.
[27] 刘茂柯,唐玉明,赵珂,等.浓香型白酒窖泥放线菌的群落结构及其多样性[J].生态学报, 2015, 35(3):858-864.
LIU M K, TANG Y M, ZHAO K, et al.Analysis of actinobacteria community and diversity in the pit mud of chinese Luzhou flavour liquor[J].Acta Ecologica Sinica, 2015, 35(3):858-864.
[28] 谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技, 2018(9):118-122.
TAN C Y, XU J.Analysis of microbial structure of nongxiang daqu from different regions by high-throughput sequencing[J].Liquor-Making Science & Technology, 2018(9):118-122.
[29] 刘延波,赵志军,陈黄曌, 等.高通量测序技术分析浓香型白酒中温曲和高温曲的细菌群落结构[J].现代食品科技, 2018, 34(5):229-235.
LIU Y B, ZHAO Z J, CHEN H Z, et al.Analysis of bacterial community structure in medium temperature daqu and high temperature daqu of Luzhou-flavor liqu by high-throughput sequencing[J].Modern Food Science and Technology, 2018, 34(5):229-235.
[30] R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984.
R.E.BUCHANAN, N.E.GIBBONS.Bergey′s Manual of Systematic Bacteriology[M].8th ed.Beijing:Science Press, 1984.
[31] 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M].北京:科学出版社,1975.
Actinomycetes taxonomic group, Institute of Microbiology, Chinese Academy of Sciences.Manual for Identification of Streptomyces[M].Beijing:Science Press, 1975.
[32] 泸州老窖集团有限责任公司. 泸型酒技艺大全[M].北京:中国轻工业出版社,2011.
Lu Zhou Lao Jiao Company.The Brewing Technique Pandect of Lu-Type Liquor[M].Beijing:China Light Industry Press, 2011.
[33] 张杰,李学思,李绍亮, 等.浓香型白酒固态发酵周期中初级产物指标的变化研究[J].周口师范学院学报, 2018, 35(5):76-78.
ZHANG J, LI X S, LI S L, et al.Study on the changes of primary product indexes in the solid state fermentation cycle of Luzhou flavor liquor[J].Journal of Zhoukou Normal University, 2018, 35(5):76-78.
[34] 杜海. 产土味素菌群对白酒酿造的影响机制及监测控制[D].无锡:江南大学,2013.
DU H.The influence mechanism of geosmin-producing microflora on chinese liquor brewing and its monitoring & Controlling[D].Wuxi:Jiangnan University, 2013.
[35] 黄守锋,裴芳艺,王长丽,等.利用酿酒酵母工程菌株生产2,3-丁二醇的研究进展[J].食品安全质量检测学报, 2015, 6(10):3 928-3 934.
HUANG S F, PEI F Y, WANG C L, et al.Research progress in production of 2,3-butanediol by saccharomyces cerevisiae engineering strains[J].Journal of Food Safety & Quality, 2015, 6(10):3 928-3 934.
[36] BODE H B, BETHE B, HFS R, et al.Big effects from small changes:Possible ways to explore nature′s chemical diversity[J].Chem Bio Chem, 2002, 3(7):619-627.
[37] PUDER C, LOYA S, HIZI A, ET al.New co-metabolites of the streptazolin pathway[J].Journal of Natural Products, 2001, 64(1):42.
[38] 周国红,李彩,董士海.美拉德反应对白酒香味的影响[J].安徽农业科学, 2012, 40(3):1 461-1 462.
ZHOU G H, LI C, DONG S H.Effects of maillard reaction on flavors of Chinese liquors[J].Journal of Anhui Agricultural Sciences, 2012,40(3):1 461-1 462.
[39] SRINIVASAN R,SORIAL G A.Treatment of taste and odor causing compounds 2-methyl isoborneol and geosmin in drinking water[J].Journal of Environmental Sciences,2011,23(1):1-13.
[40] 李玮. 白酒中GSM的检测与形成规律研究[D].天津:天津科技大学,2014.
LI W.A Study of detection and formation of GSM in Chinese liquor[D].Tianjin:Tianjin University of Science&Technology, 2014.
[41] 张建红,刘琬菁,罗红梅.药用植物萜类化合物活性研究进展[J].世界科学技术-中医药现代化, 2018, 20(3):419-430.
ZHANG J H, LIU W J, LUO H M.Advances in activities of terpenoids in medicinal plants[J].World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2018, 20(3):419-430.
[42] 韩丽,赵祥颖,刘建军.乙偶姻的性质、生产及应用[J].山东轻工业学院学报(自然科学版), 2007, 21(4):80-83.
HAN L, ZHAO X Y, LIU J J.The property, production and application of acetoin[J].Journal of Shandong Institute of Light Industry (Natural Science Edition), 2007, 21(4):80-83.
[43] LU C,JIANG Y,ZHANG F,et al.Tetramethylpyrazine prevents ethanol-induced hepatocyte injury via activation of nuclear factor erythroid 2-related factor 2[J].Life Sciences,2015,141(15):119-127.
[44] LI H,YANG X,SHI W,et al.Protective effects of tetramethylpyrazine on cerebrovascular regulations in rats with chronic alcoholic encephalopathy[J].Biomedical and Environmental Sciences,2015,28(9):691-695;702.