葡萄酒是以葡萄为原料,经过发酵后产生乙醇的一种天然酒精类饮品[1]。葡萄酒对饮用者健康功能的影响一直备受关注,科研人员不断深入研究其原理与功效。葡萄酒中酚类物质大多来自葡萄原料,根据化学结构可分为类黄酮与非类黄酮类。酚类物质的组成、含量,密切影响着葡萄酒色泽、收敛性、苦味等酒体结构因素[2]。目前,葡萄酒抗氧化和预防疾病等功效,均是建立在酚类物质的高生理活性上得以实现的[3]。
葡萄酒在国际市场中流行度仅次于啤酒,而葡萄酒进入中国市场时间较短,具有很大的市场潜力。据统计,我国葡萄酒消费量为每人0.40 L,而世界人均消费量大于6 L,可见我国葡萄酒消费总体水平偏低[4]。2020年1~6月全国进口葡萄酒达0.9亿万L,全国葡萄酒产量达12.71万L。中国现已成为全球第六大葡萄酒生产国,第八大进口国[5-6],我国市场的潜力之大,备受国际关注。
随着生活水平的提高及葡萄酒产业的快速成长,我国葡萄酒消费群体已逐渐形成,绿色健康的概念备受关注。大多消费者尚未全面了解葡萄酒,他们的购买欲望来自于健康价值与功效,但只依据商家品牌宣传及价格差异,并不可靠。我国葡萄酒产业历史相对较短,标准与体制仍需完善。运用试验方法对葡萄酒样品的功能性成分及抗氧化值进行测定,为消费者提供数据支持[7-8]。
葡萄酒的有益物质主要是生物活性成分(多酚类化合物)。本研究将采自于西北部产区(焉耆盆地、吐哈盆地、天山北麓、伊犁河谷)及中部产区(河北产区)葡萄酒为样本,测定其多酚组成及抗氧化能力,分析样品间差异性及相关性,探究影响抗氧化功效的单体酚物质,为葡萄种植及酿造提出参考建议。
1 材料与方法
1.1 材料与试剂
红、白葡萄酒,产于西北部产区(焉耆盆地、吐哈盆地、伊犁河谷、天山北麓)及中部产区(河北产区),详情见表1。
槲皮素、柚皮素、香豆素、橙皮苷、杨梅素、芦丁、山奈酚、没食子酸、丁香酸、水杨酸、香草酸、原儿茶酸、咖啡酸、对香豆酸、芥子酸、绿原酸、阿魏酸、儿茶素、表儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、反式白藜芦醇,Sigma公司。
福林酚、DPPH、水溶性VE(trolox)、7-二甲氨基香豆素-4-乙酸(7-dimethylaminocoumarin-4-aceticacid,DMACA)、ABTS+,美国Spectrum公司。
表1 葡萄酒样品
Table 1 Wine sample

样品分类编号样品名称酿造原料年份1焉耆干红100%赤霞珠20182吐哈干红100%赤霞珠2018红葡萄酒3天山干红100%赤霞珠20184伊犁干红100%赤霞珠20185河北干红100%赤霞珠20186焉耆干白100%霞多丽20187吐哈干白100%霞多丽2018白葡萄酒8天山干白100%霞多丽20189伊犁干白100%霞多丽201810河北干白100%霞多丽2018
1.2 仪器与设备
Essentia LC-15C高效液相色谱(含LC-10Atvp多元泵、SPD-10Avp检测器、CTO-10Avp柱温箱、SCL-10Avp系统控制)、岛津UV—2450分光光度计,岛津制作所;RN-36旋转蒸发器,上海安亭生化仪器厂;万分之一天平,北京赛多利斯科学仪器有限公司;SHD-Ⅲ循环水式多用真空泵,巩义予华仪器设备有限公司。
1.3 实验方法
1.3.1 常规理化指标测定
测定葡萄酒中总糖(以葡萄糖计)、总酸(以酒石酸计)、pH的方法主要参照GB/T 15038—2006[9],所有酒样均重复测定3次。
1.3.2 多酚类物质理化指标测定
总酚、总花色苷、总黄酮和总黄烷-3-醇分别采用Folin-Ciocalteu法[10]测定(以干没食子酸当量表示)、pH示差法测定(以矢车菊素-3-葡萄糖苷当量表示)[11]、三氯化铝法测定(以儿茶素当量表示)[7]及DMACA法[7]测定(以儿茶素当量表示)。
1.3.3 单体酚测定
1.3.3.1 样品前处理
取50 mL酒样,在萃取瓶中加入50 mL无水乙醚进行萃取,将酯相取出,再加入同体积无水乙醚重复萃取2次,合并3次酯相。温度条件为35 ℃,减压浓缩至干,加入10 mL甲醇溶解,过0.45 μm滤膜,-30 ℃保存待测。
1.3.3.2 色谱条件
色谱柱:C18(4.6×250 mm,3.5 m);流动相:A相(5%甲醇+0.1%甲酸+水),B相(5%乙腈+0.1%甲酸+甲醇);流速1.0 mL/min;进样量10 uL;柱温35.0 ℃;检测器采集280 nm波长下的信号。梯度洗脱程序见表2。
表2 梯度洗脱程序
Table 2 Gradient elution program

时间/min泵流量/(mL·min-1)15.00B2630.01B4050.00B6560.01B8066.00B0
1.3.3.3 标准溶液配制
称取20.0 mg芦丁、香豆素等21种标准品,各标准品分别在10 mL棕色容量瓶中用甲醇定容,-30 ℃保存备用。准备实验时,将标准储备液用甲醇溶液稀释储备液配制标准和混合标准液。
1.3.4 反式白藜芦醇测定
测定参考薛洁的方法[12]。
1.3.5 体外抗氧化能力评价
1.3.5.1 DPPH自由基清除能力测定
将0.1 mL样品加到3.9 mL DPPH甲醇溶液中,避光反应20 min,在517 nm处测吸光值,结果用Trolox当量值(μmol/L)表示,均重复处理测定3次。
1.3.5.2 ABTS+自由基清除能力测定
取0.1 mL葡萄酒样品加到3.9 mL ABTS+溶液(吸光值在734 nm处为0.70±0.02)中,避光反应时长为8 min,在734 nm处测定吸光值,结果用Trolox当量值(μmol/L)表示。
1.3.5.3 羟自由基清除能力测定
在试管中加入1 mL样品、1 mL 9 mmol/L FeSO4、1 mL 9 mmol/L水杨酸/乙醇溶液,并做空白对照组。不同组均先加入1 mL H2O2反应,37 ℃条件下水浴30 min,样品液本底用1 mL蒸馏水代替,在510 nm处测定吸光度(用蒸馏水做参比),计算如公式(1)所示。
羟自由基清除率![]()
式中:A0、Ax、Ax0分别为空白组、样品组和样品溶液本底组的吸光度值。
2 结果与分析
2.1 样品理化指标对比
由表3可知,不同样品葡萄酒的总糖、总酸、pH值、酒精度指标均符合GB/T 15037—2006。
表3 不同葡萄酒的常规理化指标
Table 3 Routine physical and chemical indexes of different red wine
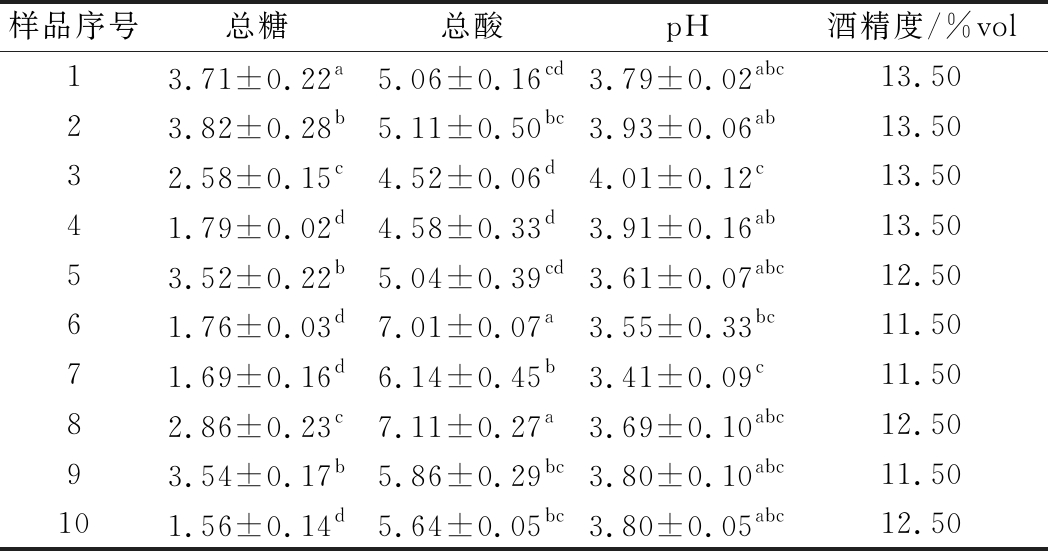
样品序号总糖总酸pH酒精度/%vol13.71±0.22a5.06±0.16cd3.79±0.02abc13.5023.82±0.28b5.11±0.50bc3.93±0.06ab13.5032.58±0.15c4.52±0.06d4.01±0.12c13.5041.79±0.02d4.58±0.33d3.91±0.16ab13.5053.52±0.22b5.04±0.39cd3.61±0.07abc12.5061.76±0.03d7.01±0.07a3.55±0.33bc11.5071.69±0.16d6.14±0.45b3.41±0.09c11.5082.86±0.23c7.11±0.27a3.69±0.10abc12.5093.54±0.17b5.86±0.29bc3.80±0.10abc11.50101.56±0.14d5.64±0.05bc3.80±0.05abc12.50
注:同一指标不同样品间字母不同则代表差异显著(P<0.05),样本量为3(下同)
其中,不同酒样中,红葡萄酒总糖值为1.79~3.82 g/L,白葡萄酒总糖值为1.56~3.54 g/L;红葡萄酒总酸值为4.52~5.11 g/L,白葡萄酒总酸值为5.64~7.11 g/L;红葡萄酒pH值为3.61~4.01,白葡萄酒pH值为3.41~3.80。各样品基本理化指标存在一定差异,这可能与原料品种及成熟情况有较大关系。红葡萄酒样品的酒精度高于白葡萄酒样品,这是因为氮元素在葡萄酒浸渍的过程种被很大程度促进释放,其可影响酵母活性,使糖更大程度地转化成酒精[13]。
2.2 总酚、总黄烷-3-醇、总黄酮、总花色苷
多酚类物质是葡萄酒中主要生物活性成分,主要存在于高等植物的器官内[14-16]。近些年来,由于多酚物质对人体具有明显的抗氧化、抗逆、清除自由基及改善微循环等功效[4],人们对葡萄酒中酚类物质的研究越加深入。根据碳环结构的不同,多酚分为类黄酮和非类黄酮类物质。其中类黄酮类物质包括花色苷及其衍生物(单体花色苷、vitisins、pinotins及portisins等)、黄烷醇类(黄烷-3-醇单体和原花色素)和黄酮醇类(杨梅酮、槲皮素和山柰酚等),这是因为在苯环上的羟基和甲氧基的数量和位置存在差异。非类黄酮类物质是指不具有C6-C3-C6结构的物质,可分为酚酸(羟基苯甲酸类、羟基肉桂酸类)和芪类。其中酚酸这类小分子质量物质包括羟基苯甲酸(水杨酸、香草酸、没食子酸及原儿茶素等)、水解单宁(没食子单宁和鞣花单宁)和羟基肉桂酸(咖啡酸、香豆酸、阿魏酸及芥子酸等);芪类中反式和顺式白藜芦醇占绝大多数。
酚类物质在葡萄酒中地位举足轻重,它对葡萄酒的感官品质(颜色、苦味、涩味以及结构等)与保健作用具有重要影响[17-18]。为此,本研究检测了西北部及中部不同产区的红、白葡萄酒的多酚类物质组成,结果如表4所示。
表4 样品多酚物质理化指标结果 单位:mg/L
Table 4 Results of physicochemical indexes of polyphenols in samples
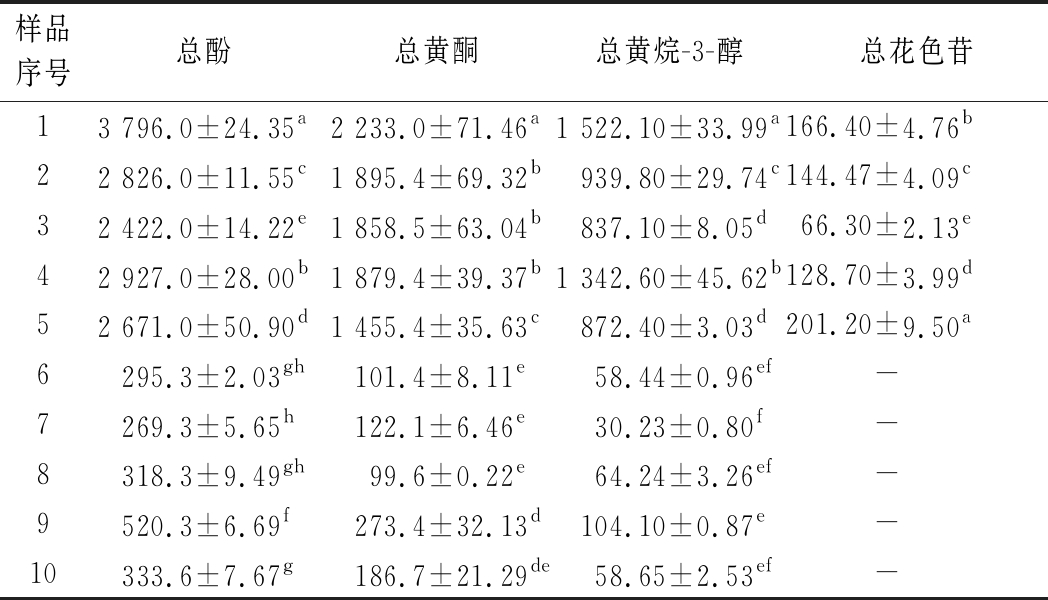
样品序号总酚总黄酮总黄烷-3-醇总花色苷13 796.0±24.35a2 233.0±71.46a1 522.10±33.99a166.40±4.76b22 826.0±11.55c1 895.4±69.32b939.80±29.74c144.47±4.09c32 422.0±14.22e1 858.5±63.04b837.10±8.05d66.30±2.13e42 927.0±28.00b1 879.4±39.37b1 342.60±45.62b128.70±3.99d52 671.0±50.90d1 455.4±35.63c872.40±3.03d201.20±9.50a6295.3±2.03gh101.4±8.11e58.44±0.96ef-7269.3±5.65h122.1±6.46e30.23±0.80f-8318.3±9.49gh99.6±0.22e64.24±3.26ef-9520.3±6.69f273.4±32.13d104.10±0.87e-10333.6±7.67g186.7±21.29de58.65±2.53ef-
注:-表示未检测到(下同)
根据结果得知,红、白葡萄酒总酚含量分别为2 422~3 796 mg/L和269~520 mg/L;红葡萄酒的总黄酮含量为1 455~2 233 mg/L,白葡萄酒的总黄酮含量为99~273 mg/L;红、白葡萄酒中总黄烷-3-醇的含量分别为837~1 522 mg/L和30~104 mg/L;红葡萄酒中总花色苷含量为66~201 mg/L,白葡萄酒中的总花色苷未检出。结果表明,各多酚组分仅相当于红葡萄酒的1/10,这可能与红、白葡萄酒在酿造过程中的浸泡时间和温度有关,与酿制工艺有关,对其多酚组成造成了以上影响。
从地域因素来分析,吐哈产区、天山产区等地处我国西北部,样品多酚含量比其他产区高,黄酮和黄烷-3-醇含量尤为显著,这与产区的气候相关联,例如日照时长、昼夜温差及土地贫瘠度等。贫瘠土地可促进黄酮物质的合成,因为其能提供更多无机离子[19]。从品种因素来分析,红葡萄酒的总酚、总类黄酮含量较高,白葡萄酒含量较低,这与前人报道相符[17]。据文献得知,巴西产区的红葡萄酒总酚含量为1 260~1 893 mg/L[15],希腊产区的红葡萄酒总酚含量为2 481 mg/L[16],智利产区的红葡萄酒总酚含量为2 133 mg/L[17]。通过试验结果得知,我国西北部和中部产区红葡萄酒总酚含量为2 422~3 796 mg/L,相比之下,我国西北部及中部产区葡萄酒多酚类物质含量较高。
2.3 单体酚
葡萄酒中多酚的组成较为复杂,为探索不同葡萄酒样品间单体酚类别和含量差异,对样品中单体酚物质定量分析。如图1所示,测定的21种单体酚分别是在酒体中呈苦味和收敛性的感官特征、支撑酒体“骨架感”的黄烷醇类物质,分别为儿茶素、表儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯;7种黄酮类物质(槲皮素、芦丁、山奈酚、橙皮苷、杨梅素、柚皮素、香豆素),主要来源于果皮,目的是减少组织被紫外线过度照射受损[20],为葡萄酒提供黄色色调;10种来自果实和陈酿过程的酚酸类物质,包括原儿茶酸、丁香酸、水杨酸、没食子酸、香草酸(对羟基苯甲酸类物质)、芥子酸、阿魏酸、对香豆酸、绿原酸、咖啡酸(羟基肉桂酸类物质);1种芪类(反式白藜芦醇),主要存在于葡萄的叶片和果皮,产生于果实收到胁迫时[21],反式白藜芦醇较为常见。

a-21种单体酚标准品;b-1号样品
图1 21种单体酚标准品及1号样品色谱图
Fig.1 Chromatogram of 21 monomer phenolic standard substances and sample No.1
2.3.1 黄烷-3-醇
黄烷醇类物质在葡萄酒体中作用主要为呈苦味和收敛性[22],影响着葡萄酒品质。试验数据显示,红葡萄酒中黄烷-3-醇含量约为白葡萄酒的10倍,含量远高于白葡萄酒,这与理化方法测定结果相同。黄烷-3-醇单体和原花色素为葡萄酒中黄烷醇类物质[22],如表5所示,儿茶素和表儿茶素含量比表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯含量高,且部分酒样未检出表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯。不同产区红、白葡萄酒间含量差异较大。黄烷醇物质主要存在于葡萄浆果的种子、果皮和果梗部分[21],葡萄酒中含量差异应该源自于原料的情况和酿造工艺的不同,它们的组分差异和含量高低直接影响葡萄酒的陈酿潜力。
表5 葡萄酒黄烷-3-醇含量 单位:mg/L
Table 5 Flavan-3-ols content of wines
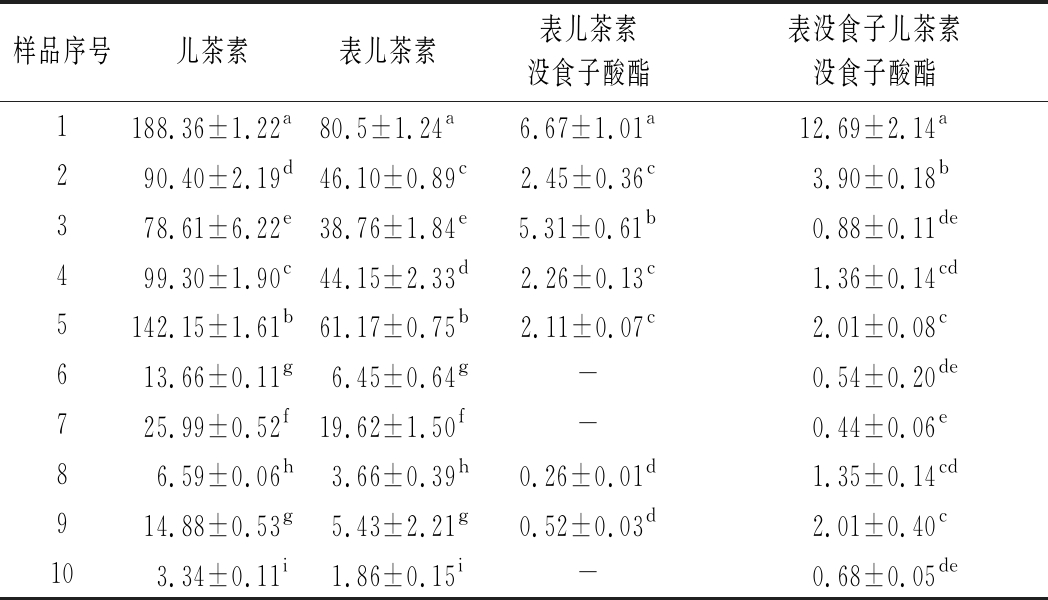
样品序号儿茶素表儿茶素表儿茶素没食子酸酯表没食子儿茶素没食子酸酯1188.36±1.22a80.5±1.24a6.67±1.01a12.69±2.14a290.40±2.19d46.10±0.89c2.45±0.36c3.90±0.18b378.61±6.22e38.76±1.84e5.31±0.61b0.88±0.11de499.30±1.90c44.15±2.33d2.26±0.13c1.36±0.14cd5142.15±1.61b61.17±0.75b2.11±0.07c2.01±0.08c613.66±0.11g6.45±0.64g-0.54±0.20de725.99±0.52f19.62±1.50f-0.44±0.06e86.59±0.06h3.66±0.39h0.26±0.01d1.35±0.14cd914.88±0.53g5.43±2.21g0.52±0.03d2.01±0.40c103.34±0.11i1.86±0.15i-0.68±0.05de
2.3.2 黄酮醇
黄酮醇主要来自葡萄果皮,是酚类化合物中重要的一类,在发酵过程中渗入酒体,影响苦味和酒体颜色[23-24],目前被广为研究的是黄酮醇物质的辅色作用。黄酮醇类物质相较于其他多酚类物质含量较少,在红葡萄酒中质量浓度<100 mg/L[24],酒体中含量较高的苷元主要是杨梅素、槲皮素和山奈酚[25]。如表6所示,槲皮素在不同产区含量差异较为明显,源于氧化、酿造过程中沉淀或酿造工艺等因素。总体来说,葡萄酒中黄酮含量与黄烷-3-醇相比,含量较少。
表6 葡萄酒黄酮醇含量 单位:mg/L
Table 6 Flavonols content of wines
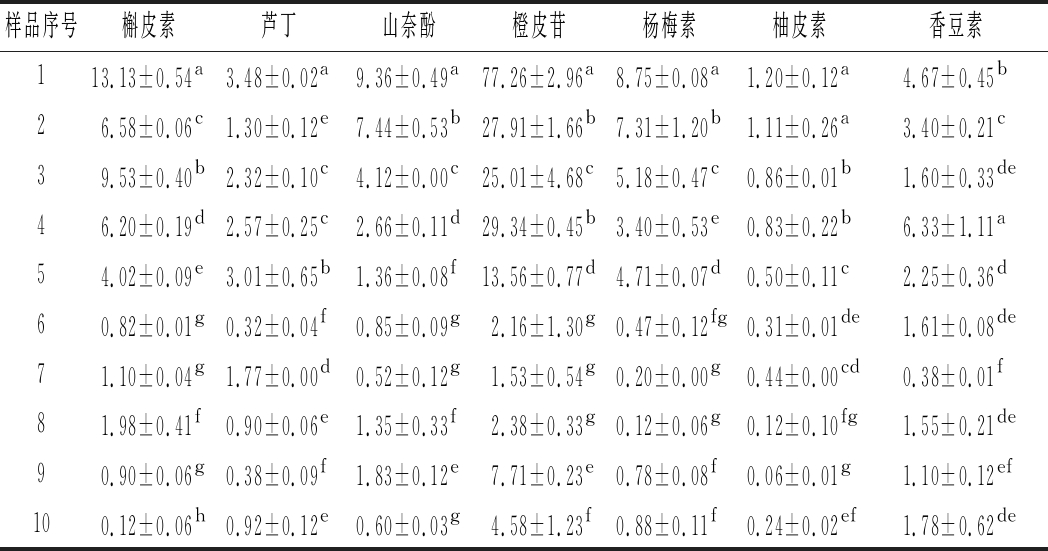
样品序号槲皮素芦丁山奈酚橙皮苷杨梅素柚皮素香豆素113.13±0.54a3.48±0.02a9.36±0.49a77.26±2.96a8.75±0.08a1.20±0.12a4.67±0.45b26.58±0.06c1.30±0.12e7.44±0.53b27.91±1.66b7.31±1.20b1.11±0.26a3.40±0.21c39.53±0.40b2.32±0.10c4.12±0.00c25.01±4.68c5.18±0.47c0.86±0.01b1.60±0.33de46.20±0.19d2.57±0.25c2.66±0.11d29.34±0.45b3.40±0.53e0.83±0.22b6.33±1.11a54.02±0.09e3.01±0.65b1.36±0.08f13.56±0.77d4.71±0.07d0.50±0.11c2.25±0.36d60.82±0.01g0.32±0.04f0.85±0.09g2.16±1.30g0.47±0.12fg0.31±0.01de1.61±0.08de71.10±0.04g1.77±0.00d0.52±0.12g1.53±0.54g0.20±0.00g0.44±0.00cd0.38±0.01f81.98±0.41f0.90±0.06e1.35±0.33f2.38±0.33g0.12±0.06g0.12±0.10fg1.55±0.21de90.90±0.06g0.38±0.09f1.83±0.12e7.71±0.23e0.78±0.08f0.06±0.01g1.10±0.12ef100.12±0.06h0.92±0.12e0.60±0.03g4.58±1.23f0.88±0.11f0.24±0.02ef1.78±0.62de
2.3.3 对羟基苯甲酸
无C6-C3-C6结构的物质被称为非类黄酮类物质,按照结构不同分为酚酸和芪类。酚酸类物质主要参与氧化还原与褐变反应,主要影响感官评价与营养功效[25]。如表7所示,不同酒种及同酒种间对羟基甲酸含量差异显著,这与不同产区的特性有关。红葡萄酒和白葡萄酒中水杨酸含量均是最高的,这点与文献中报道存在差异,可能成为西北部葡萄酒的一个特点。
表7 样品中对羟基苯甲酸含量 单位:mg/L
Table 7 Content of p-hydroxybenzoic acid in the sample
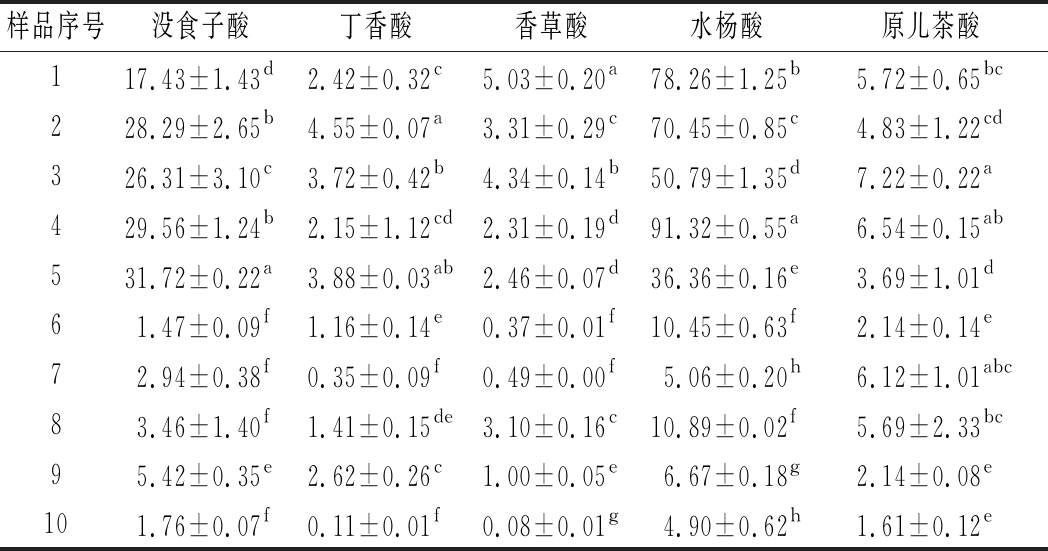
样品序号没食子酸丁香酸香草酸水杨酸原儿茶酸117.43±1.43d2.42±0.32c5.03±0.20a78.26±1.25b5.72±0.65bc228.29±2.65b4.55±0.07a3.31±0.29c70.45±0.85c4.83±1.22cd326.31±3.10c3.72±0.42b4.34±0.14b50.79±1.35d7.22±0.22a429.56±1.24b2.15±1.12cd2.31±0.19d91.32±0.55a6.54±0.15ab531.72±0.22a3.88±0.03ab2.46±0.07d36.36±0.16e3.69±1.01d61.47±0.09f1.16±0.14e0.37±0.01f10.45±0.63f2.14±0.14e72.94±0.38f0.35±0.09f0.49±0.00f5.06±0.20h6.12±1.01abc83.46±1.40f1.41±0.15de3.10±0.16c10.89±0.02f5.69±2.33bc95.42±0.35e2.62±0.26c1.00±0.05e6.67±0.18g2.14±0.08e101.76±0.07f0.11±0.01f0.08±0.01g4.90±0.62h1.61±0.12e
2.3.4 对羟基肉桂酸
如表8所示,不同产区葡萄酒样品中咖啡酸和芥子酸含量较高,阿魏酸含量较低,但白葡萄酒样品在有未检出现象葡萄酒中对羟基甲酸含量高于对羟基肉桂酸含量。阿魏酸和芥子酸与葡萄酒酒体色泽有密切的关联,为辅色特性的化合物;其含量分别为总酚酸的1.01%、0.08%,对花色苷的维稳有重要作用。分析结果得知咖啡酸和对香豆酸的高含量来自肉桂酸酒石酸脂类分解,其辅色物质的特性影响着红葡萄酒酒体颜色。
表8 样品中对羟基肉桂酸含量 单位:mg/L
Table 8 Content of p-hydroxycinnamic acid in the sample
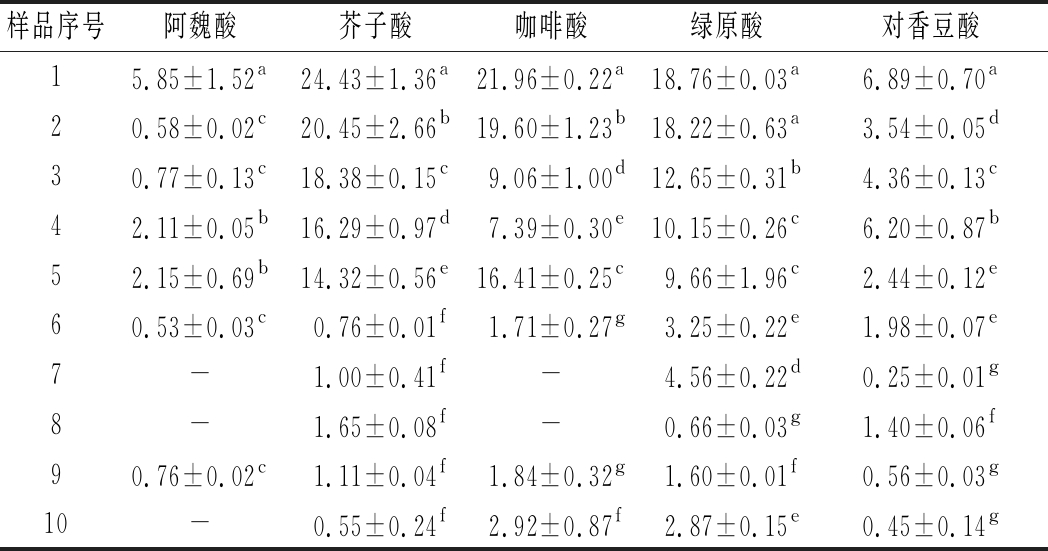
样品序号阿魏酸芥子酸咖啡酸绿原酸对香豆酸15.85±1.52a24.43±1.36a21.96±0.22a18.76±0.03a6.89±0.70a20.58±0.02c20.45±2.66b19.60±1.23b18.22±0.63a3.54±0.05d30.77±0.13c18.38±0.15c9.06±1.00d12.65±0.31b4.36±0.13c42.11±0.05b16.29±0.97d7.39±0.30e10.15±0.26c6.20±0.87b52.15±0.69b14.32±0.56e16.41±0.25c9.66±1.96c2.44±0.12e60.53±0.03c0.76±0.01f1.71±0.27g3.25±0.22e1.98±0.07e7-1.00±0.41f-4.56±0.22d0.25±0.01g8-1.65±0.08f-0.66±0.03g1.40±0.06f90.76±0.02c1.11±0.04f1.84±0.32g1.60±0.01f0.56±0.03g10-0.55±0.24f2.92±0.87f2.87±0.15e0.45±0.14g
2.3.5 芪类
白藜芦醇因其生物学活性一直备受消费者关注[26],而反式白藜芦醇是最重要的芪类。反式白藜芦醇在葡萄酒中含量为1~30.0 mg/L[18],它是葡萄受到外界胁迫(真菌感染、紫外照射)后的产物[26],受葡萄种植条件、气候状况和灾害程度等因素影响。如表9所示,红、白葡萄酒间反式白藜芦醇含量差距大,其中白葡萄酒中反式白藜芦醇质量浓度<0.4 mg/L,红葡萄酒中反式白藜芦醇质量浓度为0.9~3.4 mg/L。
表9 样品中芪类含量 单位:mg/L
Table 9 Contents of stilbenes in the sample

样品序号反式白藜芦醇13.48±0.03a21.97±0.09c32.56±0.10b41.33±0.05d50.98±0.14e60.18±0.01fg70.32±0.03f80.10±0.01g90.27±0.14f100.16±0.08fg
2.4 抗氧化能力分析
葡萄酒的抗氧化功能深受消费者喜爱,通过葡萄酒对DPPH、ABTS+和羟自由基的清除能力来评估样品的抗氧化能力。
图2为西北部产区及中部产区样品抗氧化能力值测定结果,样品间抗氧化能力相差较显著,这与原料的栽培管理、酿造工艺及陈酿工艺有很大的关系。由数据得知,红、白2种葡萄酒间抗氧化能力差异十分明显。红葡萄酒样品中抗氧化能力值为19 669~25 334 μmol/L Trolox当量,而白葡萄酒抗氧化能力值为1 352~2 457 μmol/L Trolox当量,仅为红葡萄酒的1/10。各产区之间比较,和伊犁产区抗氧化能力较强,可能具有较高的保健功能。
2.5 葡萄酒多酚含量与抗氧化能力相关性分析
运用 SPSS 软件对葡萄酒样品主要的指标建立相关性分析表。如表10、表11所示。按照反应机理不同抗氧化反应分为电子转移反应和氢原子转移反应2种,原理为抗氧化剂通过转移电子而使某些物质(金属、羰基、自由基)被还原和抗氧化剂通过提供氢原子而清除某些自由基[27]。DPPH、ABTS+与羟自由基方法之间具有显著相关性,与原理相符;葡萄酒样品多酚成分含量(总多酚、总黄酮、总黄烷-3-醇、总花色苷)与抗氧化指标(DPPH、ABTS+、羟自由基)间,总多酚、总黄酮、与总黄烷-3-醇间呈极显著正相关,且与抗氧化指标均具有极显著正相关性;其他指标相关性不显著。
对单体酚与各抗氧化指标结果进行分析,从单体酚层面,除原儿茶素、表没食子儿茶素没食子酸酯与各抗氧化指标相关性不显著,其他单体酚与各抗氧化指标均呈显著相关;对抗氧化能力贡献较大的依次为芥子酸、水杨酸、杨梅素、儿茶素、表儿茶素;从多酚类别分析得知,对抗氧化能力贡献较大的依次为对羟基肉桂酸、芪类、对羟基苯甲酸、黄烷-3-醇、黄酮醇。
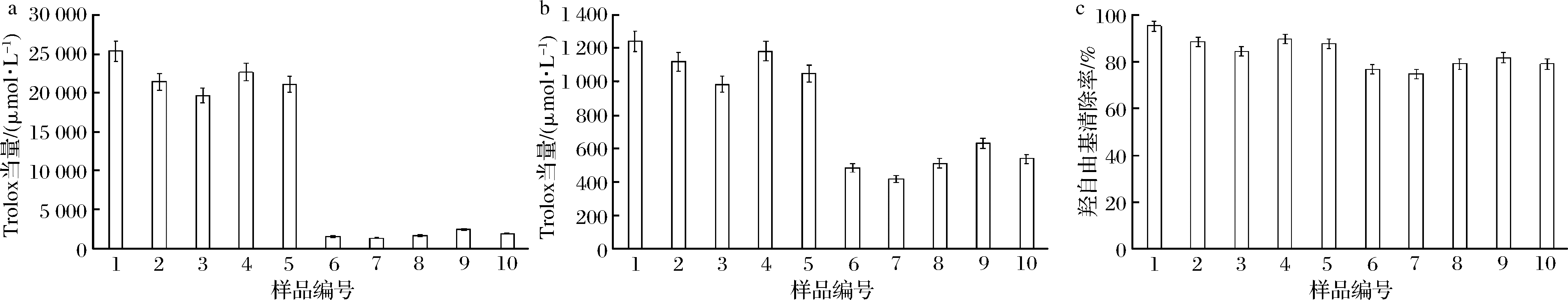
a-DPPH自由基;b-ABTS+自由基;c-羟自由基
图2 葡萄酒抗氧化能力图
Fig.2 Antioxidant capacity of wines
表10 葡萄酒中多酚成分与抗氧化活性相关性分析
Table 10 Correlation analysis between polyphenols and antioxidant activity in wine
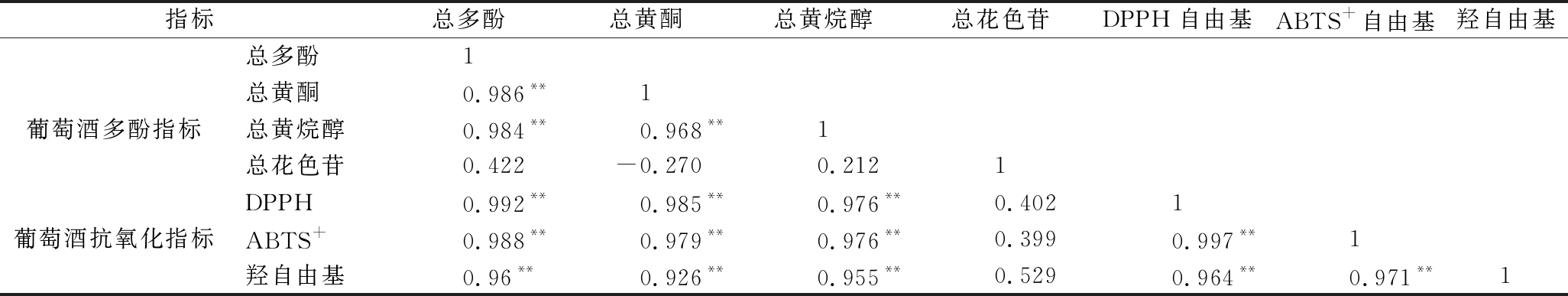
指标总多酚总黄酮总黄烷醇总花色苷DPPH自由基ABTS+自由基羟自由基总多酚1总黄酮0.986**1葡萄酒多酚指标总黄烷醇0.984**0.968**1总花色苷0.422-0.270 0.2121DPPH0.992**0.985**0.976**0.4021葡萄酒抗氧化指标ABTS+0.988**0.979**0.976**0.3990.997**1羟自由基0.96**0.926**0.955**0.5290.964**0.971**1
注:**表示在 0.01 水平(双侧)上显著相关,*表示在0.05水平(双侧)上显著相关(下同)
表11 葡萄酒中单体酚成分与抗氧化活性相关性分析
Table 11 Correlation analysis of individual phenol and antioxidant activity in wine

指标DPPH自由基ABTS+自由基羟自由基儿茶素表儿茶素ECGEGCG槲皮素芦丁山奈酚橙皮苷杨梅素柚皮素香豆素香草酸没食子酸水杨酸原儿茶素丁香酸咖啡酸阿魏酸绿原酸芥子酸对香豆酸反式白藜芦醇DPPH自由基1葡萄酒抗氧化指标ABTS+自由基0.997**1羟自由基0.964**0.971**1儿茶素0.9140.8990.911表儿茶素0.9140.8980.8880.9331ECG0.8340.8090.8090.8290.8311EGCG0.5870.5880.7620.7390.7130.7251槲皮素0.8650.850 0.8440.8460.8560.9810.7451芦丁0.7950.7650.740 0.9020.9080.7660.5550.771山奈酚0.7490.7570.7990.7240.740 0.8240.8480.8740.500 1橙皮苷0.8060.8020.870 0.8510.8380.8940.9160.9330.7210.900 1葡萄酒单体酚指标杨梅素0.9160.9080.9010.8930.9080.880 0.7430.9050.7120.910 0.8671柚皮素0.8540.850 0.7920.8040.8480.8270.6330.8940.7010.8660.8320.917 1香豆素0.7690.7990.8040.6570.6350.510 0.4930.6140.5620.5580.6960.5980.6721香草酸0.7620.7530.7560.730 0.7370.8820.6460.9070.6530.7960.7680.810 0.7270.4671没食子酸0.9020.8970.7850.7590.7810.6210.2160.6540.6960.4880.4840.7530.7120.610 0.6231水杨酸0.9280.9410.8920.7970.810 0.7480.5370.8360.6960.7940.7910.8250.8930.8980.7090.8161原儿茶素0.4560.4430.3410.4150.4780.5540.190 0.6280.6010.3860.4130.3950.5810.3440.6690.4770.5721丁香酸0.7370.7370.6710.5920.6090.5360.2520.5650.370 0.5640.3870.7210.5540.290 0.6490.8240.5820.2631咖啡酸0.8820.8770.8860.9050.9110.7650.730 0.790.6920.8370.7950.9680.8340.5670.7120.7440.7520.2420.721阿魏酸0.7720.7130.8610.8740.830 0.7690.8940.7730.7620.6930.9130.7220.6280.6480.6150.4040.6490.2450.2730.7171绿原酸0.890 0.8850.8430.8510.8870.8420.6740.8890.6970.8970.8340.9750.9760.6150.7560.7550.8590.4790.6740.9250.651芥子酸0.9680.9620.9190.900 0.9190.8950.640 0.9340.780 0.8470.8440.9660.9370.6960.8450.8530.9190.5550.7320.9050.6970.9611对香豆酸0.8770.880 0.8630.810 0.8020.8420.6350.9020.7270.7460.8690.7920.8490.8610.7630.6850.9410.5710.4610.6940.7750.7990.8831反式白藜芦醇0.8540.8360.8270.8320.850 0.9780.750 0.9860.7340.9020.9170.9330.9150.5580.8630.640 0.8060.5570.5840.8230.7450.9240.9340.8541
注:ECG、EGCG 分别表示表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯
3 结论
本研究以西北部产区(焉耆盆地、吐哈盆地、天山北麓、伊犁河谷)及中部产区(河北产区)葡萄酒为样本,测定其多酚组成及抗氧化能力,分析样品间差异性及相关性,探究影响抗氧化功效的单体酚物质,为葡萄种植及酿造提出参考建议。通过对酚类物质含量、DPPH、ABTS+及羟自由基清除率的测定,发现西北部产区样品酚类物质含量高,且种类丰度较高;焉耆与伊犁产区葡萄酒抗氧化能力较高。相关性分析表明,DPPH、ABTS+和羟自由基的清除率3种方法具有极显著正相关性;对抗氧化能力贡献较大的多酚类物质依次为对羟基肉桂酸、芪类、对羟基苯甲酸、黄烷-3-醇、黄酮醇,对抗氧化能力贡献较大的单体酚依次为芥子酸、水杨酸、杨梅素、儿茶素、表儿茶素。
对结果进行分析可知,西北部产区及中部产区葡萄酒整体水平较高,说明近年来我国葡萄酒市场正在逐步走向完善,品质也在不断提升,提升了消费者对国产葡萄酒的自信心。目前葡萄酒的品质主要依靠专业品酒师的品评,受专业水平和主观因素影响,本研究主要依据多酚物质丰度、含量及抗氧化能力对葡萄酒进行评价,是一种新型的评价方法,可为葡萄酒市场提供新的参考。
[1] ALBERTO A E B.Wine,research and cardiovascular disease:Instructions for use[J].Atherosclerosis,2007,195(2):242-247.
[2] 马磊.基于不挥发风味物质对葡萄酒产地、品种特征性及收敛性的研究[D].无锡:江南大学,2013.
MA L.Study on geographic origin, grape variety characteristics and astringency base on non-volatile flavor compounds[D].Wuxi:Jiangnan University,2013.
[3] SOKOLOWSKY M, FISCHER U.Evaluation of bitterness in white wine applying descriptive analysis, time-intensity analysis, and temporal dominance of sensations analysis[J].Anal Chim Acta,2012,732:46-52.
[4] 孙翔宇,杜国荣,马婷婷,等.陕西市售国产葡萄酒中多酚类物质的特征与抗氧化能力分析[J].现代食品科技,2014,30(8):242-250;218.
SUN X Y,DU G R,MA T T,et al.Polyphenol composition and antioxidant activity of domestic wines from shaanxi province[J].Modern Food Science & Technology,2014,30(8):242-250;218.
[5] GARRIDO-BANUELOS G, PANZERI V , BRAND J, et al. Evaluation of sensory effects of thiols in red wines by projective mapping using multifactorial analysis and correspondence analysis[J]. Journal of Sensory Studies,2020,35(4): 1-11.
[6] 李华,李甲贵,杨和财.改革开放30年中国葡萄与葡萄酒产业发展回顾[J].现代食品科技,2009,25(4):341-347.
LI H,LI J G,YANG H C.Review of grape and wine industry development in recent 30 years of china′s reforming and opening-up[J].Modern Food Science & Technology,2009,25(4):341-347.
[7] LI H, WANG X Y, LI Y, et al.Polyphenolic compounds and antioxidant properties of selected china wines[J].Food Chem,2008,112(2):454-460.
[8] EBERHARDT M V,LEE C Y,LIU R H.Antioxidant activity of fresh apples.[J].Nature,2000,405(6 789):903-904.
[9] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China.Standardization Administration.Analytical methods of wine and fruit wine GB/T 15038—2006[S].Beijing:Standards Press of China,2006.
[10] SINGLETON V,ROSSI J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].American Journal of Enology & Viticulture,1964,16(3):144-158.
[11] MENG J F,NING P F,XU T F,et al.Effect of rain-shelter cultivation of Vitis vinifera cv.Cabernet Gernischet on the phenolic profile of berry skins and the incidence of grape diseases[J].Molecules,2012,18(1):381-397.
[12] 薛洁.山葡萄酒中白藜芦醇含量的测定[J].酿酒科技,2004(5):103-104.
XUE J.Measurement of resveratrol content in wild grape wine[J].Liquor-Making Science & Technology,2004(5):103-104.
[13] OLEJAR K J,FEDRIZZI B,KILMARTIN P A.Antioxidant activity and phenolic profiles of sauvignon blanc wines made by various maceration techniques[J].Australian Journal of Grape and Wine Research,2015,21(1):57-68.
[14] CHERVIN C,TRIANTAPHYLIDES C,LIBERT M F,et al.Reduction of wound-induced respiration and ethylene production in carrot root tissues by gamma irradiation[J].Postharvest Biology and Technology,1992,2(1):7-17.
[15] FARKAS,SARAY,MOHACSIFARKAS,et al.Effects of low-dose gamma radiation on shelf-life and microbiological safety of pre-cut/prepared vegetables[J].Advances in Food ences,1997,19:111-119.
[16] FAN X, SOKORAI K J B.Retention of quality and nutritional value of 13 fresh-cut vegetables treated with low-dose radiation[J].Journal of Food ence,2010,73(7):367-372.
[17] PIETRO SANTAMARIA.Nitrate in vegetables:Toxicity, content, intake and EC regulation[J].J Sci Food Agric,2006,86(1):10-17.
[18] GOULARTE L,MARTINS C ![]() C I,et al.Combination of minimal processing and irradiation to improve the microbiological safety of lettuce (Lactuca sativa L.)[J].Radiation Physics and Chemistry, 2004,71(1):157-161.
C I,et al.Combination of minimal processing and irradiation to improve the microbiological safety of lettuce (Lactuca sativa L.)[J].Radiation Physics and Chemistry, 2004,71(1):157-161.
[19] PRAKASH A, MANLEY J, DE COSTA S,et al.The effects of gamma irradiation on the microbiological, physical and sensory qualities of diced tomatoes[J].Radiation Physics and Chemistry,2002,63(3):387-390.
[20] FLINT S D,JORDAN P W,CALDWELL M M.Plant protective response to enhanced uv-b radiation under field conditions:leaf optical properties and photosynthesis[J].Photochemistry & Photobiology,2010, 41(1):95-99.
[21] MONAGAS M,BARTOLOMÉ BEGO A,GOMEZ-CORDOVES C.Updated knowledge about the presence of phenolic compounds in wine[J].Crit Rev Food,Nutr,2005,45(2):85-118.
[22] 张欣珂,赵旭,成池芳,等.葡萄酒中的酚类物质Ⅰ:种类,结构及其检测方法研究进展[J].食品科学,2019,40(15):255-268.
ZHANG X K,ZHAO X,CHENG C F,et al.Phenolics in Wines I:A Review of Categories, Structures and Detection Methods[J].Food Science,2019,40(15):255-268.
[23] HE F, HE J J,PAN Q H,et al.Mass-spectrometry evidence confirming the presence of pelargonidin-3-O-glucoside in the berry skins of Cabernet Sauvignon and Pinot Noir (Vitis vinifera L.)[J].Australian Journal of Grape&Wine Research,2010,16(3):464-468.
[24] CLARK A M,BAILLY C.Apoptosis induced by the alkaloid sampangine in HL-60 leukemia cells-KLUZA-2006-Annals of the New York academy of sciences-Wiley Online Library[J].Journal of the American College of Cardiology,2005,45(12):2 004-2 007.
[25] 王凯丽,张波,韩舜愈,等.干红葡萄酒中多酚提取响应面优化及非花色苷类物质的测定研究[J].食品与发酵科技,2018,2(4):102-110.
WANG K L,ZHANG B,HAN S Y,et al.Response surface optimization of polyphenols and determination of non-anthocyanins in dry red wine[J].Sichuan Food and Fermentation,2018,2(4):102-110.
[26] SALAS E,FULCRAND H,MEUDEC E,et al.Reactions of anthocyanins and tannins in model solutions[J].Journal of Agricultural and Food Chemistry,2003,51(27):7 951-7 961.
[27] 王璐.山荆子多酚分离鉴定及对γ辐射诱导氧化损伤的防护作用[D].哈尔滨:哈尔滨工业大学,2013.
WANG L.Study on geographic origin, grape variety characteristics and astringency base on non-volatile flavor compounds[D].Harbin:Harbin Institute of Technology,2013.