随着食品科学领域的发展,食品安全逐渐成为食品工业中不可忽视的全球性问题,由微生物引起的食品腐败与疾病给世界各国造成了损失,目前广泛应用的化学防腐剂价格低廉,虽然可以抑制细菌生长,但对人体有一定的致畸、致癌和致突变作用。蜡样芽孢杆菌(Bacillus cereus)是一种内生芽孢的革兰氏阳性杆状菌,寄生于土壤中,污染多种食品,如大米、蔬菜、鸡蛋、肉制品、乳制品等[1],蜡样芽孢杆菌是与食物中毒相关的食源性致病菌之一,能产生多种毒素[2]导致腹泻和呕吐等症状,因此寻找高效安全的天然保鲜剂来应对食品腐败菌具有重大意义。
狭果茶藨子(Ribes stenocarpum Maxim)属虎耳草科植物,全世界约有160种,青海省有11种,1个变种[3]。茶藨子为落叶灌木,生于山坡灌丛、云杉林和杂木林下或山沟中[4]。研究发现,茶藨子的化学成分主要为不饱和脂肪酸、有机酸、多糖、黄酮类化合物等[5]。前期研究发现,青藏高原狭果茶藨子提取物对金黄色葡萄球菌、大肠杆菌等具有一定的抑制作用[6],具有成为新型多功能食品添加剂的潜力,为了拓宽狭果茶藨子在食品防腐保鲜中的应用,本研究以蜡样芽孢杆菌为试验菌,探究青藏高原狭果茶藨子提取物对其抑菌作用及作用机理,以期为狭果茶藨子天然食品保鲜剂的研发提供依据。
1 材料和方法
1.1 材料与试剂
狭果茶藨子产自青海大通东峡乡;蜡样芽孢杆菌(CMCC(B) 63303),上海鲁微科技有限公司;超微量ATP酶、苹果酸脱氢酶、琥珀酸脱氢酶、碱性磷酸酶试剂盒,南京建成生物科技有限公司;碘硝基氯化四氮唑蓝(iodonitrotetrazolium chloride,INT),上海源叶生物科技有限公司。
1.2 仪器与设备
RF-6000荧光分光光度计,日本岛津公司;Micro-GCM微生物生长曲线仪,德国BMG公司;JSM-6610LV扫描电镜,日本电子公司;MF1显微细胞分析/菌落计数/抑菌圈测量联用仪,杭州迅数科技有限公司。
1.3 试验方法
1.3.1 狭果茶藨子粗提物的制备
狭果茶藨子低温烘干,粉碎,过60目筛,取1 000 g样品加入95%乙醇回流提取2 h,提取2次,过滤后合并滤液并浓缩,得到总粗提物80 g,分别用乙酸乙酯、正丁醇萃取,制备乙酸乙酯提取物、正丁醇提取物、水提取物。
采用AB-8大孔树脂进一步分离纯化乙酸乙酯提取物(40 g),分别用蒸馏水、20%、40%、60%、80%、100%(体积分数)乙醇梯度洗脱,收集不同极性洗脱液,浓缩,低温冷冻干燥,得组分DW1、DW2、DW3、DW4、DW5、DW6,其中DW1为19 g,4 ℃密封储存备用。
1.3.2 抑菌活性测定
将蜡样芽孢杆菌活化后,用无菌生理盐水稀释,比浊至0.5麦氏单位,配制不同浓度狭果茶藨子提取物,并放入药敏纸片浸泡12 h,采用纸片扩散法进行抑菌实验,菌落计数器测量抑菌圈直径[7]。
1.3.3 最低抑菌浓度和最低杀死浓度测定
参照KANG等[8]的方法测定最低抑菌浓度和最低杀死浓度。
1.3.4 生长曲线测定
将细菌接至含有提取物的96孔板,使终浓度分别为1/16最低抑菌浓度(minimum inhibitory concentration,MIC)、1/8 MIC、1/4 MIC、1/2 MIC、MIC、最低杀菌浓度(minimum bactericidal concentration,MBC),置于微生物生长曲线检测系统中培养35 h(37 ℃ 200 r/min),每30 min测定1次,绘制生长曲线[9]。
1.3.5 细胞膜膜蛋白测定
参照WANG等[10]的方法测定蜡样芽孢杆菌细胞膜膜蛋白的荧光光谱。
1.3.6 碱性磷酸酶测定
参照SONG等[11]的方法测定碱性磷酸酶活性。
1.3.7 核酸及蛋白质泄漏试验
参照LIU等[12]的方法测定核酸蛋白质泄露。
1.3.8 ATP酶测定
参照WANG等[13]的方法测定蜡样芽孢杆菌中Na+K+-ATP酶、Ca2+Mg2+-ATP酶、T-ATP酶的活性。
1.3.9 呼吸链脱氢酶测定
取培养4 h的蜡样芽孢杆菌与1 mL提取物混合,37 ℃ 120 r/min条件下振荡培养1 h,菌悬液离心并用生理盐水清洗,加入2.7 mL PBS 和0.3 mL INT混合后于室温下避光暗处理1 h,490 nm[14]下测定吸光度值。
1.3.10 扫描电镜观察
参照LI等[15]的方法观察细胞微观变化。
1.4 数据分析
采用Excel 2010进行数据整理及作图,实验统计数据以平均值±标准差![]() 表示。使用SPSS 21.0 进行数据处理。
表示。使用SPSS 21.0 进行数据处理。
2 结果与分析
2.1 抑菌活性筛选
狭果茶藨子提取物对蜡样芽孢杆菌抑菌效果如表1所示,抑菌圈直径大小关系为乙酸乙酯提取物>正丁醇提取物>水提取物,抑菌活性与提取物浓度成正比,当乙酸乙酯提取物质量浓度为400 mg/mL时,抑菌圈直径(19.21±0.11) mm,表现为高敏,效果明显优于正丁醇提取物和水提取物,说明乙酸乙酯提取物为抑制蜡样芽孢杆菌的有效活性部位。
表1 不同提取物浓度对蜡样芽孢杆菌抑菌圈直径的影响 单位:mm
Table 1 Effect of different concentration of extracts on the diameter of B.cereus inhibition zone
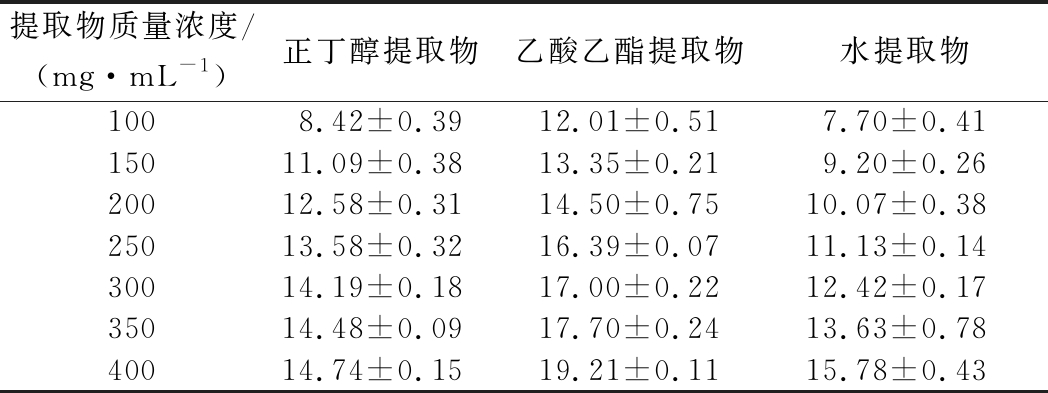
提取物质量浓度/(mg·mL-1)正丁醇提取物乙酸乙酯提取物水提取物1008.42±0.3912.01±0.517.70±0.4115011.09±0.3813.35±0.219.20±0.2620012.58±0.3114.50±0.7510.07±0.3825013.58±0.3216.39±0.0711.13±0.1430014.19±0.1817.00±0.2212.42±0.1735014.48±0.0917.70±0.2413.63±0.7840014.74±0.1519.21±0.1115.78±0.43
乙酸乙酯提取物经AB-8大孔吸附树脂分离纯化后,得到6个组分,其抑菌效果如表2所示,其中DW1组分抑菌活性最强,其次为DW2组分,其他组分则无抑菌作用;当DW1质量浓度为300 mg/mL时,抑菌圈直径(18.54±0.52) mm,表现为高敏,与食品中常用的防腐保鲜剂丙酸钠、山梨酸钾、苯甲酸钠和脱氢乙酸钠比较,丙酸钠与山梨酸钾对蜡样芽孢杆菌无抑制作用,苯甲酸钠、脱氢乙酸钠、青霉素和氨苄西林抑菌圈直径均小于DW1,因此后期抑菌机制试验选用DW1组分进行,抑菌效果DW1>脱氢乙酸钠>苯甲酸钠>山梨酸钾=丙酸钠,DW1抑菌效果优于阳性对照药氨苄西林(10/10 μg)和青霉素(10 U)。
表2 不同组分对蜡样芽孢杆菌抑菌圈直径的影响 单位:mm
Table 2 Effect of different concentration of fractions on the diameter of B.cereus inhibition zone

组分100 mg/mL200 mg/mL300 mg/mLDW114.51±0.7016.80±0.2518.54±0.52DW210.09±0.2812.35±0.2114.87±0.26DW3000DW4000DW5000DW6000丙酸钠000山梨酸钾000苯甲酸钠07.63±0.207.83±0.33脱氢乙酸钠10.30±0.6212.72±0.7215.70±0.12青霉素(10 U)8.29±0.65氨苄西林(10/10 μg)12.66±0.21
注:抑菌圈直径>20 mm为极敏;15~20 mm为高敏;10~15 mm为中敏;7~9 mm为低敏
2.2 最低抑菌浓度和最低杀菌浓度
狭果茶藨子提取物对蜡样芽孢杆菌具有较强抑制作用,实验结果表明,MIC为3.13 mg/mL,MBC为6.25 mg/mL,为MIC的2倍,空白对照无抑菌作用。
2.3 蜡样芽孢杆菌生长曲线测定结果
狭果茶藨子提取物对蜡样芽孢杆菌生长影响如图1所示,对照组迟缓期为1 h,随后进入对数期,5 h后进入稳定期,35 h内未进入衰亡期,MBC和MIC组吸光值变化较小,即细菌生长较少,1/2 MIC组第16 h进入生长期,持续至26 h,1/4 MIC组2 h时进入生长期,12 h进入稳定期,1/8 MIC组与1/16 MIC与对照相差较小,抑制作用不明显,结果表明,当浓度为MIC和MBC时,提取物抑制蜡样芽孢杆菌生长繁殖,当浓度为1/2 MIC和1/4 MIC时,表现为迟缓期和对数生长期延长。
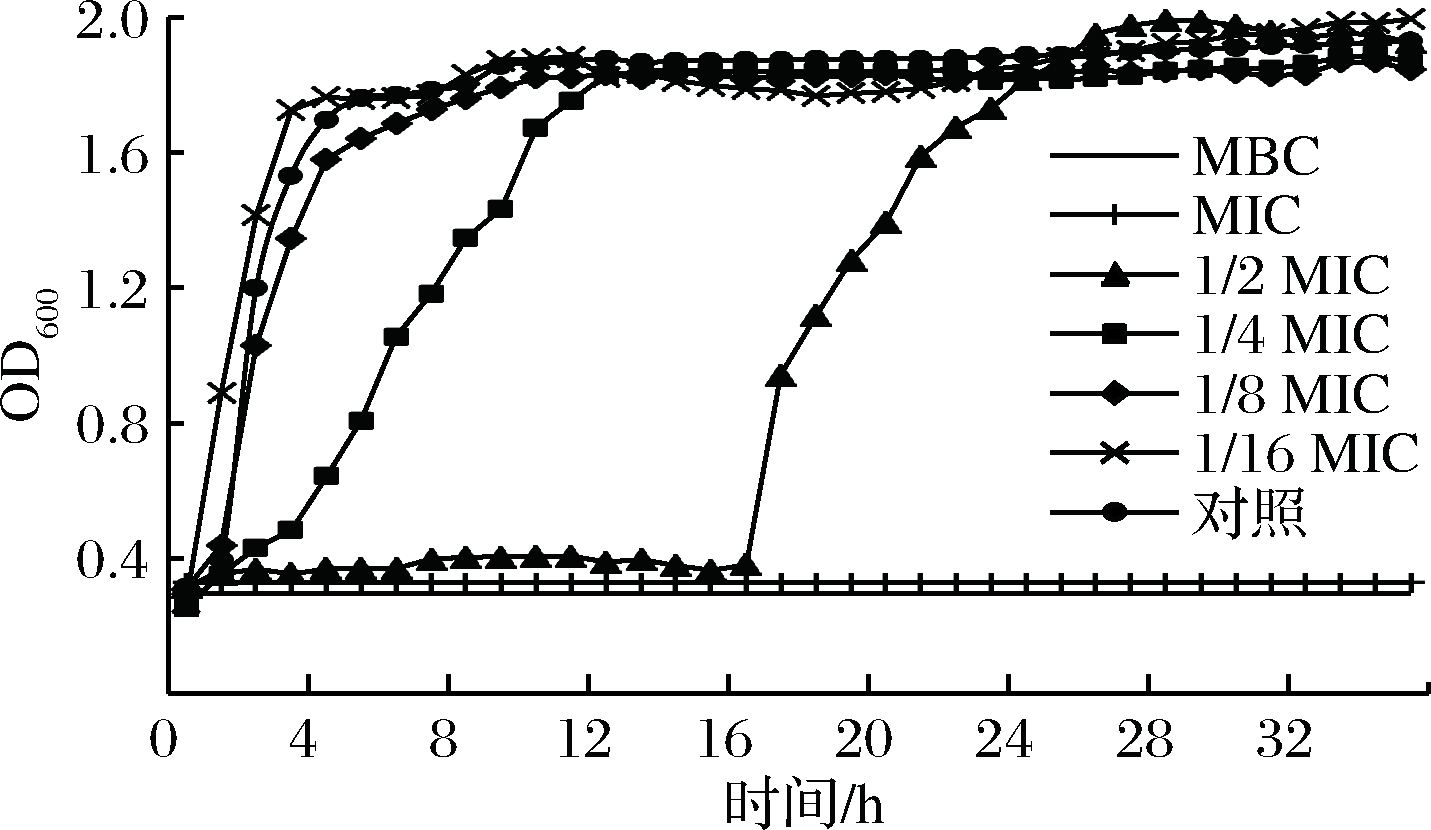
图1 不同浓度狭果茶藨子提取物下蜡样芽孢杆菌生长曲线
Fig.1 Growth curves of B.cereus under different concentrations of R.stenocarpum extract
2.4 提取物浓度对蜡样芽孢杆菌膜蛋白的影响
膜蛋白是细胞的重要组成部分,在物质运输、细胞识别、信号传导等方面具有重要功能。膜蛋白中含有苯丙氨酸(phenylalanine,Phe)、酪氨酸(tyrosine,Tyr)和色氨酸(tryptophan, Trp)等氨基酸,可以在膜蛋白中发出荧光。KI是一种荧光淬灭剂,可以定性确定Phe、Trp、Tyr残基在蛋白质中的位置。图2显示了不同浓度KI处理蜡样芽孢杆菌膜蛋白氨基酸残基的荧光光谱,KI浓度从上到下依次为0.005、0.01、0.015、0.02、0.025、0.03 mol/L。结果表明,随着KI浓度增加苯丙氨酸荧光淬灭效果明显,色氨酸和酪氨酸荧光淬灭效果不明显,表明色氨酸和酪氨酸残基主要位于细胞膜内部。图3显示了不同浓度狭果茶藨子提取物对蜡样芽孢杆菌膜蛋白荧光光谱的影响,提取物浓度从上到下依次为1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC、1/2 MIC、MIC、MBC,结果表明,随着提取物浓度增加,各氨基酸荧光强度均逐渐下降、当浓度为MIC和MBC时,伴随明显红移,这表明狭果茶藨子提取物可能与膜蛋白结合,改变了蜡样芽孢杆菌细胞膜膜蛋白的结构和构象,使Phe、Trp 和Tyr 残基变得更加亲水[16],导致细胞膜功能障碍和细胞损伤。
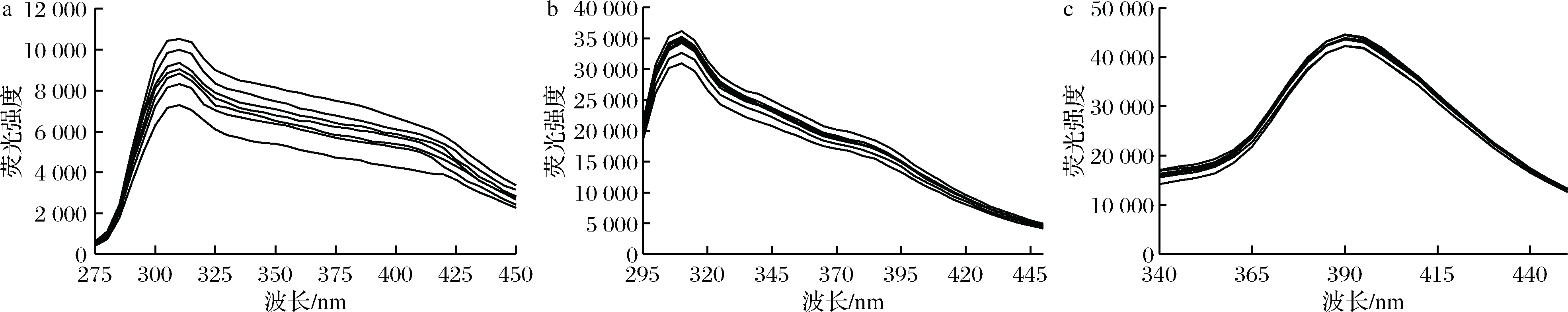
a-苯丙氨酸;b-色氨酸;c-酪氨酸
图2 不同浓度KI 下蜡样芽孢杆菌膜蛋白氨基酸残基荧光光谱
Fig.2 Fluorescence spectra of amino acid residues of B.cereus membrane proteins under different concentrations of KI

a-苯丙氨酸;b-色氨酸;c-酪氨酸
图3 不同浓度狭果茶藨子提取物下蜡样芽孢杆菌膜蛋白氨基酸残基荧光光谱
Fig.3 Fluorescence spectra of amino acid residues of B.cereus membrane proteins under different concentrations of R.stenocarpum extract
2.5 碱性磷酸酶活力测定结果
碱性磷酸酶(alkaline phosphatase,AKP)存在于细胞壁和细胞膜之间,当细胞壁被破坏,碱性磷酸酶会流出[17]。不同浓度狭果茶藨子提取物对蜡样芽孢杆菌碱性磷酸酶活性影响如图4所示,对照组AKP活性为1.11金氏单位/mg prot,MBC组AKP活性为3.60金氏单位/mg prot,是对照组的3.24倍,随着提取物浓度的增大,AKP活性增加,说明蜡样芽孢杆菌细胞壁受损越严重,碱性磷酸酶流出越多。
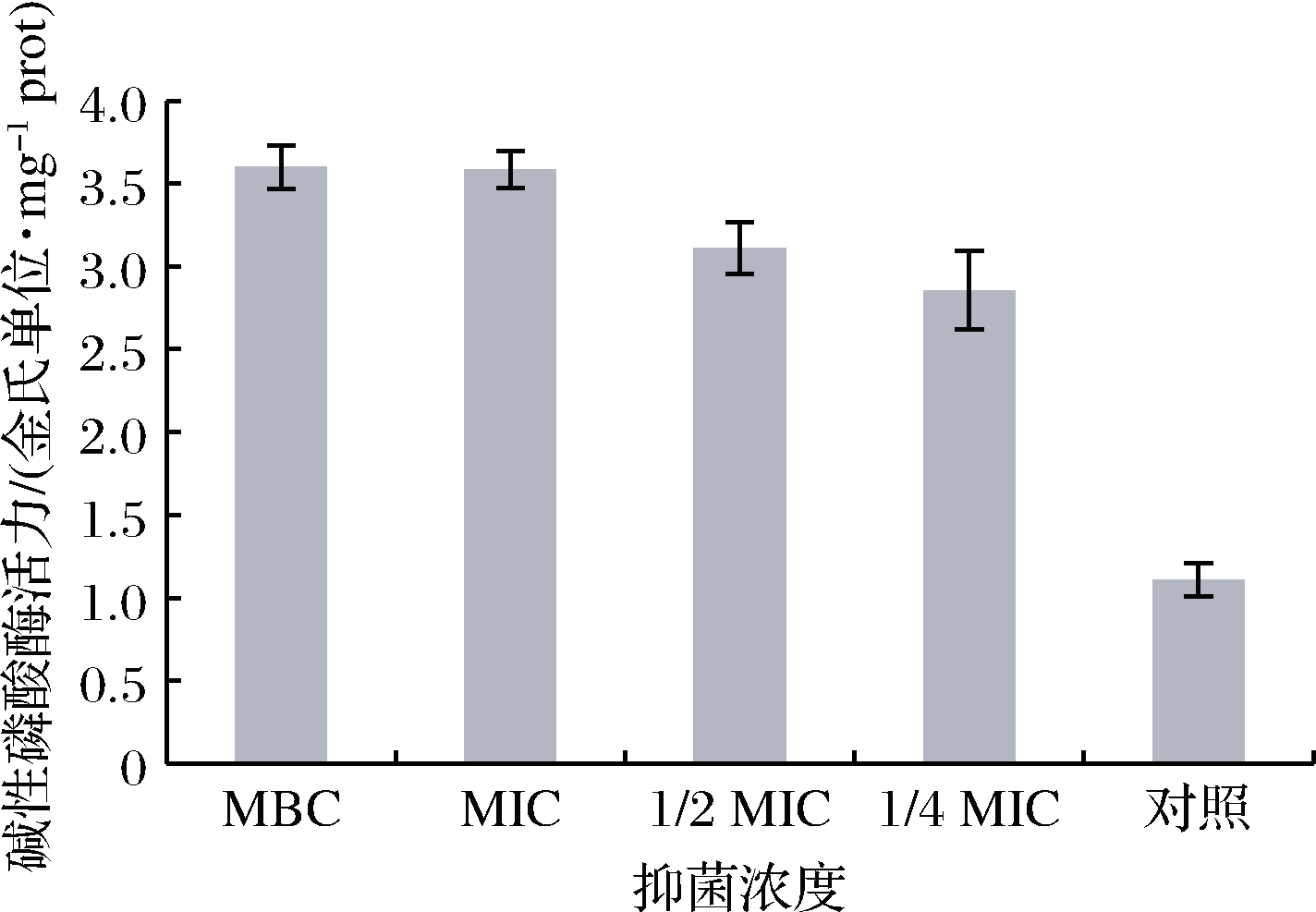
图4 不同浓度狭果茶藨子提取物下蜡样芽孢杆菌AKP活力影响
Fig.4 AKP activity of B.cereus at the different concentrations of R.stenocarpum extract
2.6 核酸及蛋白质泄露结果
核酸和蛋白质对于细胞生长、新陈代谢、维持细胞功能有重要作用,细胞膜损伤,胞内物质就会泄露,细胞膜的完整性对细菌发育至关重要[18]。狭果茶藨子提取物对蜡样芽孢杆菌核酸及蛋白质泄露影响结果如图5所示,对照组核酸及蛋白质几乎不发生泄露,12 h内OD280值、OD260值变化不大,经狭果茶藨子提取物处理后,蜡样芽孢杆菌核酸蛋白质泄露与样品浓度呈正相关,其中MBC组OD280值从0.01增加至0.16,OD260值从0.01增加至0.15,说明随着时间和浓度增加,蜡样芽孢杆菌核酸及蛋白质泄露程度加剧,即细胞膜破损越严重,进而影响细胞生长和新陈代谢,最终导致蜡样芽孢杆菌死亡。
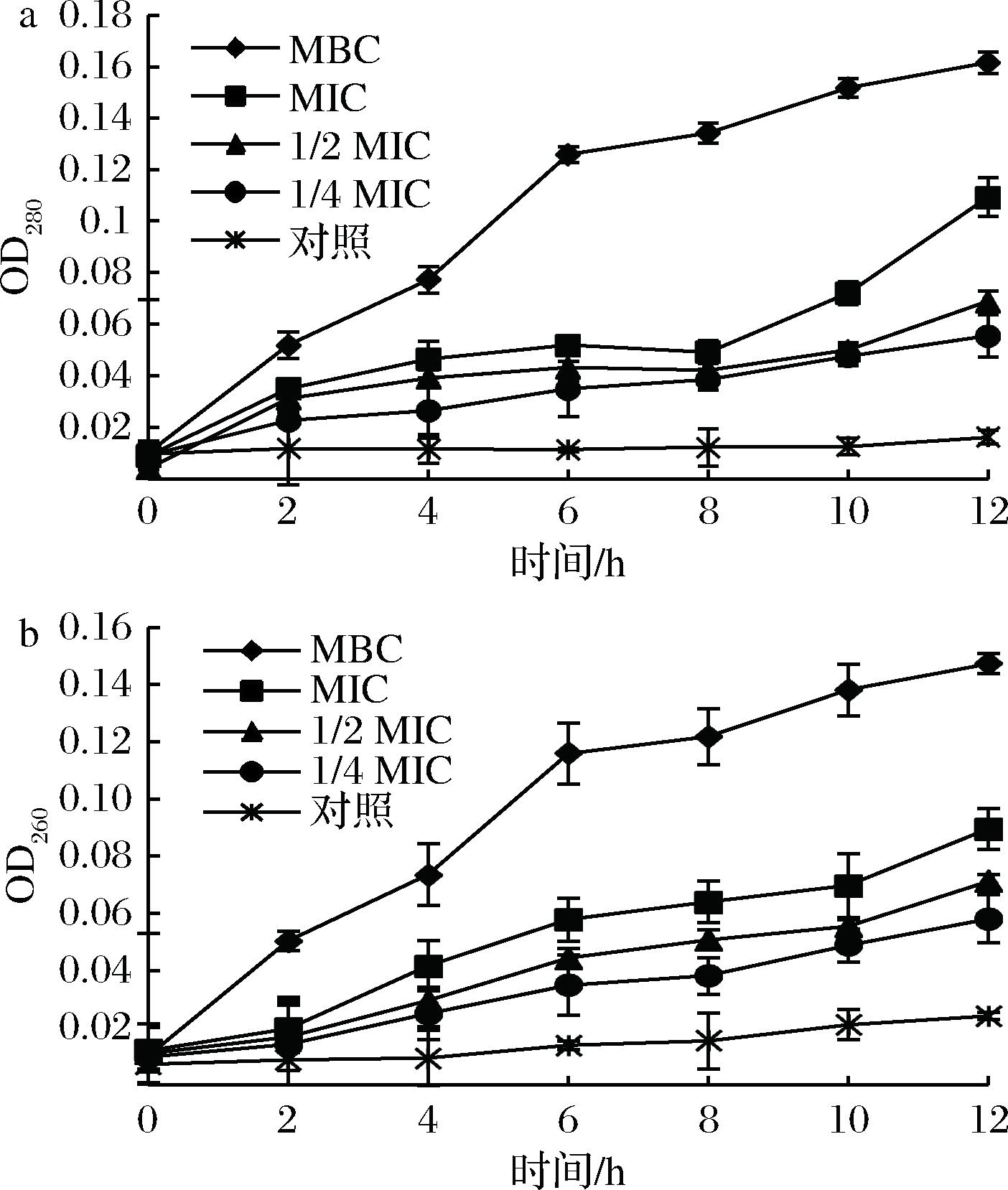
a-蛋白质泄露;b-核酸泄露
图5 不同浓度狭果茶藨子提取物下蜡样芽孢杆菌核酸及蛋白质泄露
Fig.5 Nucleic acid and protein leakage of B.cereus at different concentrations of R.stenocarpum extract
2.7 ATP酶活性测定结果
Na+K+-ATP酶即钠钾泵,能促进ATP的水解,能够调节细胞内钠/钾离子浓度,为Na+、K+的跨膜运输提供能量,从而保持细胞的静息电位;Ca2+Mg2+-ATP酶主要功能是建立跨膜的离子梯度、维持细胞内外离子平衡及渗透压平衡[19]。狭果茶藨子提取物对蜡样芽孢杆菌ATP酶的影响结果如图6所示,随着提取物浓度升高,3种酶活性均升高,对照组Na+K+-ATP酶活性为11.99 U/mg prot,Ca2+Mg2+-ATP酶活性为3.79 U/mg prot,T-ATP酶活性为15.65 U/mg prot,MBC组Na+K+-ATP酶活性27.69 U/mg prot,为对照组的2.3倍,Ca2+Mg2+-ATP酶活性 8.34 U/mg prot,为对照组的2.2倍,T-ATP酶活性 59.47 U/mg prot,为对照组的3.8倍,以上数据表明,狭果茶藨子提取物能有效提高Na+K+-ATP酶、Ca2+Mg2+-ATP酶及T-ATP酶的活性,激活蜡样芽孢杆菌膜结合离子通道,显著破坏细胞膜,增加细胞膜的通透性;细菌通过改变细胞膜内外离子浓度以抵抗不利环境的影响,保持细胞内外电化学梯度的平衡[20],这与LI等[21]的研究一致。
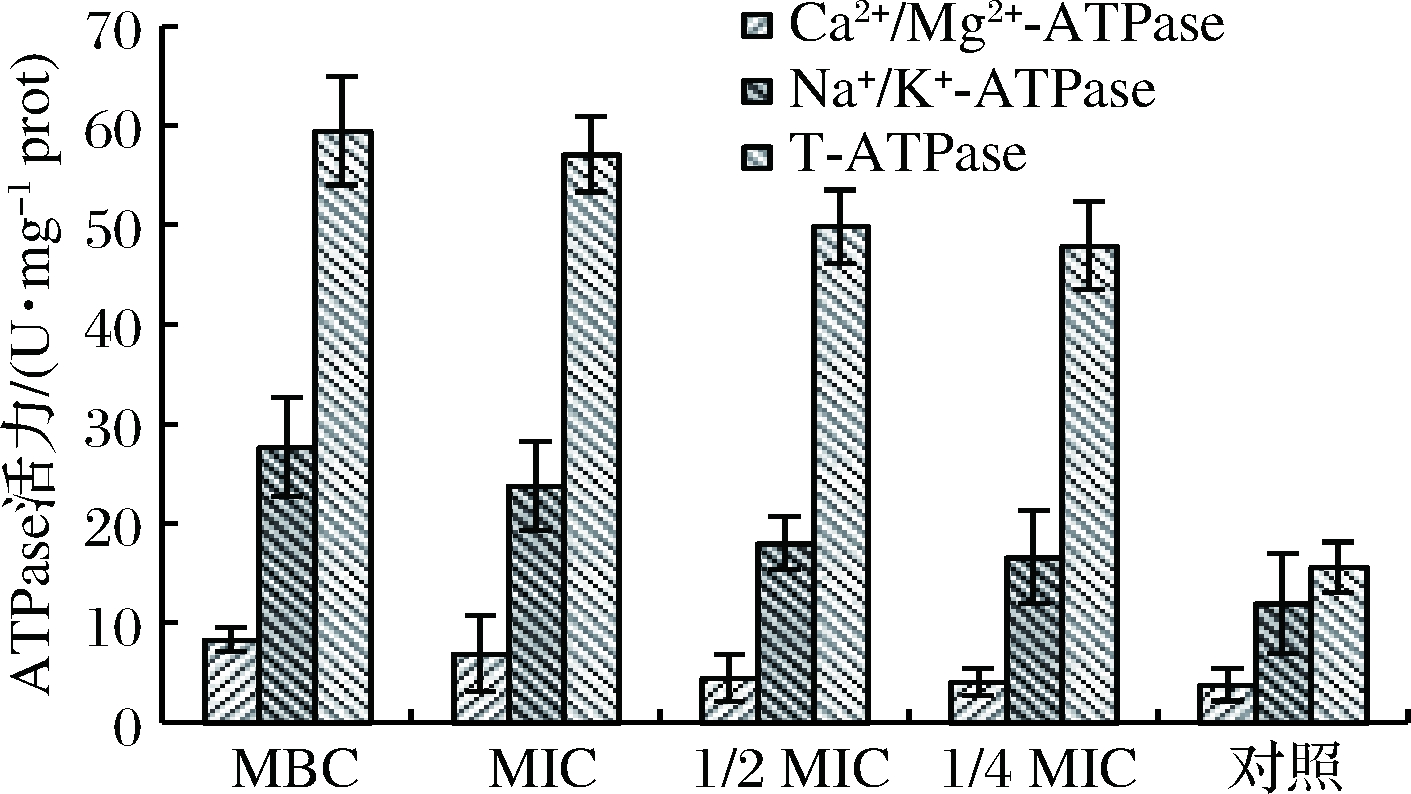
图6 不同浓度狭果茶藨子提取物对蜡样芽孢杆菌ATP活性的影响
Fig.6 Effects of ATPase activity of B.cereus at different concentrations of R.stenocarpum extract
2.8 呼吸链脱氢酶活力测定结果
呼吸链脱氢酶是TCA循环中的关键酶,反映了细胞呼吸作用的强度和生成ATP的能力[22]。狭果茶藨子提取物对蜡样芽孢杆菌呼吸链脱氢酶活性影响如图7所示,图中对照组OD值为3.12,MBC组OD值为1.08(仅为对照组的1/3),呼吸链脱氢酶酶活性随提取物浓度的升高而降低,说明经狭果茶藨子提取物处理后蜡样芽孢杆菌中呼吸链脱氢酶活性显著下降,提取物可能通过抑制蜡样芽孢杆菌呼吸链脱氢酶活性,进而抑制呼吸作用和能量供应,最终导致菌体细胞死亡。
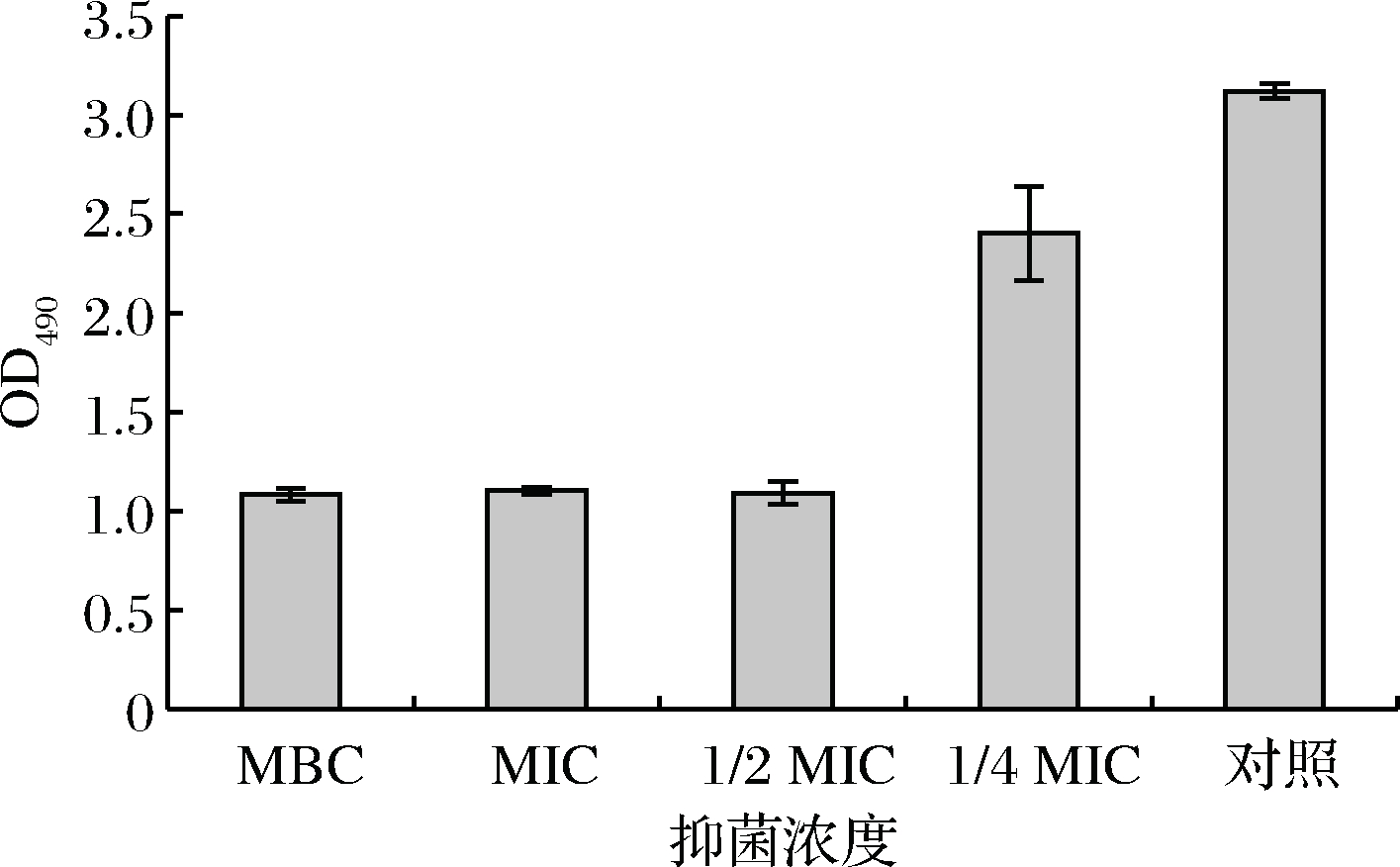
图7 不同浓度狭果茶藨子提取物对蜡样芽孢杆菌呼吸链脱氢酶活力影响
Fig.7 Effects of respiratory chain dehydrogenase activity of B.cereus at different concentrations of R.stenocarpum extract
2.9 扫描电镜观察结果
不同浓度提取物对蜡样芽孢杆菌微观形态影响如图8所示,对照组蜡样芽孢杆菌呈杆状,无异常凸起或凹陷,细胞形态完整,表面光滑,MBC组细胞褶皱,表面有严重凸起和凹陷,细胞严重变形,MIC组细胞呈杆状,表面有褶皱,表面不光滑,1/2MIC组部分细胞有褶皱、但形态完整,变形程度MBC组>MIC组>1/2MIC组>对照组,即变形程度与提取物浓度呈正相关,提取物浓度越高,细胞变形越明显。
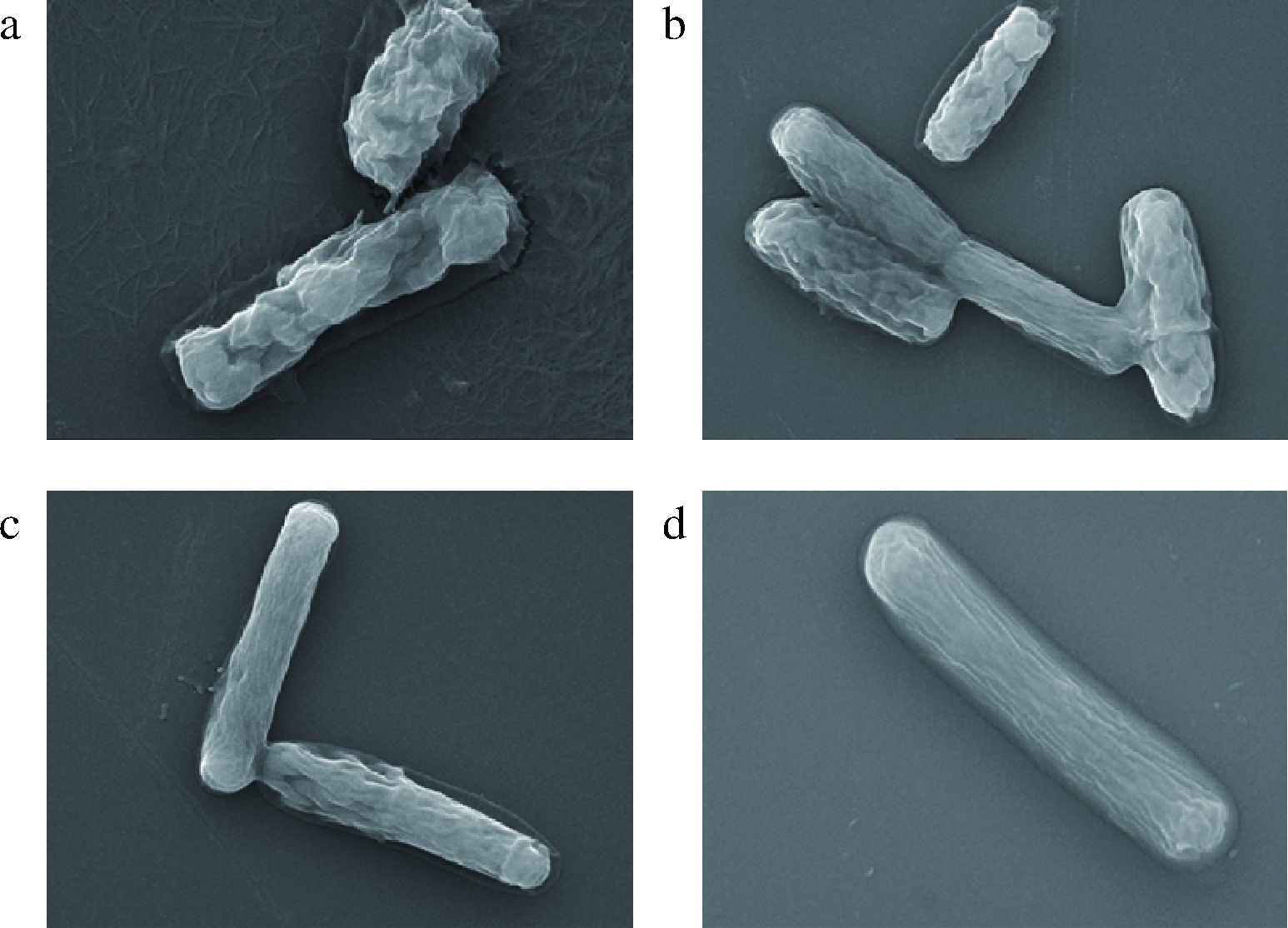
a-MBC;b-MIC;c-1/2 MIC;d-对照
图8 不同浓度狭果茶藨子提取物对蜡样芽孢杆菌微观形态影响
Fig.8 SEM photomicrographs of B.cereus treated with different concentrations of R.stenocarpum extract
3 结论
本研究以青藏高原狭果茶藨子为原料,探讨其对蜡样芽孢杆菌的抑菌活性及作用机制,研究表明,狭果茶藨子提取物对蜡样芽孢杆菌有明显抑制作用,乙酸乙酯萃取物为抑制蜡样芽孢杆菌的有效极性部位,且有效活性物质主要存在于DW1组分中,当其质量浓度为300 mg/mL时,抑菌圈直径达(18.54±0.52) mm,表现为极敏;狭果茶藨子提取物对蜡样芽孢杆菌的最低抑菌浓度和最低杀菌浓度分别为3.13和6.25 mg/mL。初步抑菌机制试验表明,狭果茶藨子提取物可以改变蜡样芽孢杆菌细胞膜膜蛋白的构象,造成核酸和蛋白质泄露,破坏细胞壁,导致碱性磷酸酶流出,通过抑制琥珀酸脱氢酶、苹果酸脱氢酶、呼吸链脱氢酶的活力抑制呼吸作用和能量代谢,同时提高Na+K+-ATP酶、Ca2+Mg2+-ATP酶活力,激活膜结合离子通道,细胞膜内外离子浓度被改变以抵抗不利环境的影响;扫描电镜结果表明狭果茶藨子提取物可导致蜡样芽孢杆菌细胞严重变形,表面有异常凸起和凹陷,最终导致菌体细胞死亡。
[1] LAURENCE D, NADINE B, MIRJANA A, et al.An emetic Bacillus cereus outbreak in a kindergarten:Detection and quantification of critical levels of cereulide toxin[J].Foodborne Pathog Dis, 2015, 12(1):84-87.
[2] TALAHMEH N, ABU-RUMEILEH S, AL-RAZEM F.Development of a selective and differential media for the isolation and enumeration of Bacillus cereus from food samples[J].J Appl Microbiol, 2020, 128(5):1 440-1 447.
[3] 陆玲娣. 中国茶藨子属的研究[J].植物分类学报, 1995,33(1):58-75.
LU L T. A study on the genus Ribes L.in China[J].Acta Phytotaxonomica Sinica, 1995, 33(1):58-75.
[4] 王占林, 樊光辉, 贺永远.青海高原茶藨子属树种资源与育苗技术[J].北方园艺, 2012(19):43-45.
WANG Z L, FAN G H, HE Y Y.Ribes species resources and afforestation technique in Qinghai Plateau[J].Northern Horticulture, 2012(19):43-45.
[5] 金志民, 柴军红, 何婷婷,等.正交设计优化东北茶藨子的活性成分提取工艺[J].中国林副特产, 2018(6):14-16.
JIN Z M, CHAI J H, HE T T, et al.Optimization of extraction process for active ingredient from Ribes mandshuricum[J].Forest By-Product and Speciality in China, 2018(6):14-16.
[6] 叶英, 李宗仁, 曹效海,等.青藏高原狭果茶藨子果实提取物成分、抑菌活性及其抗疲劳活性[J].食品工业科技, 2019,40(13):7-13.
YE Y, LI Z R, CAO X H, et al.Components and antibacterial activities of extracts from the fruits of Ribes stenocarpum Maxim in Qinghai-Tibet Plateau and their anti-fatigue activity[J].Science and Technology of Food Industry, 2019,40(13):7-13.
[7] 冯亚净, 张媛媛, 王瑞鑫,等.五味子木脂素对大肠杆菌的抑菌机理及效果[J].食品与发酵工业, 2016,42(2):72-76.
FENG Y J, ZHANG Y Y, WANG R X, et al.Antibacterial effect of Lignanoid from Fructus Schisandrae chinensis on the Escherichia coli and its mechanism[J].Food and Fermentation Industries, 2016,42(2):72-76.
[8] KANG S M, KONG F H, SHI X Y, et al.Antibacterial activity and mechanism of lactobionic acid against Pseudomonas fluorescens and Methicillin-resistant Staphylococcus aureus and its application on whole milk[J].Food Control, 2020,108:106 876.
[9] CAI X T, WANG X, CHEN Y C, et al.A natural biopreservative:Antibacterial action and mechanisms of Chinese Litsea mollis hemsl.extract against Escherichia coli dh5α and Salmonella spp.[J].Journal of Dairy Science, 2019, 102(11):9 663-9 673.
[10] WANG L H, WANG M S, ZENG X, et al.Membrane and genomic DNA dual-targeting of citrus flavonoid naringenin against Staphylococcus aureus[J].Integrative Biology (Camb), 2017, 9(10):820-829.
[11] SONG M Z, WANG X R, MAO C Q, et al.The discovery of a potential antimicrobial agent:The novel compound natural medicinal plant fermentation extracts against Candida albicans[J].IOP Conference Series:Materials Science and Engineering, 2018, 301(1):012 026.
[12] LIU X, CAI J X, CHEN H M, et al.Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J].Microb Pathog, 2020, 141:103 980.
[13] WANG B Y, GAO X L, LIU B G, et al.Protective effects of curcumin against chronic alcohol-induced liver injury in mice through modulating mitochondrial dysfunction and inhibiting endoplasmic reticulum stress[J].Food & Nutrition Research, 2019,63:3 597.
[14] 郑志永, 姚善泾.比色法测定大肠杆菌呼吸链脱氢酶活性[J].浙江大学学报(工学版), 2005(3):119-122.
ZHENG Z Y, YAO S J.Colorimetric assay for respiratory chain dehydrogenase activity in Escherichia coli[J].Journal of Zhejiang University(Engineering Science), 2005(3):119-122.
[15] LI Y Q, HAN Q, FENG J L, et al.Antibacterial characteristics and mechanisms of ε-poly-lysine against Escherichia coli and Staphylococcus aureus[J].Food Control, 2014, 43:22-27.
[16] 周云冬, 章漪玲, 宗红, 等.牡丹花蕾提取物对铜绿假单胞菌的抑菌活性及其机理[J].食品与发酵工业, 2019,45(13):92-97.
ZHOU Y D, ZHANG Y L, ZONG H, et al.Antibacterial activities and mechanisms of Paeonia suffruticosa Andr.buds extract against Pseudomonas aeruginosa[J].Food and Fermentation Industries, 2019,45(13):92-97.
[17] CAO J R, FU H J, GAO L H, et al.Antibacterial activity and mechanism of lactobionic acid against Staphylococcus aureus[J].Folia Microbiol (Praha), 2019, 64(6):899-906.
[18] XIANG Q S, KANG C D, NIU L Y, et al.Antibacterial activity and a membrane damage mechanism of plasma-activated water against Pseudomonas Deceptionensis CM2[J].LWT, 2018, 96:395-401.
[19] 翟艺宗, 黄昌林, 常祺, 等.中频脉冲电流经皮刺激肝区对运动性疲劳大鼠肝细胞线粒体Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶活性的影响[J].解放军医学杂志, 2015,40(4):327-330.
ZHAI Y Z, HUANG C L, CHANG Q, et al.Effects of percutaneous midband pulse current stimulation in hepatic region on the activity of hepatic mitochondrial Na+-K+-ATPase and Ca2+-Mg2+-ATPase in exercise-induced fatigued rats[J].Medical Journal of Chinese People′s Liberation Army, 2015,40(4):327-330.
[20] LIN Y L, TANG X, XU L Z, et al.Antibacterial properties and possible action mechanism of chelating peptides-zinc nanocomposite against Escherichia coli[J].Food Control, 2019, 106:106 675.
[21] LI X C, HE C F, SONG L Y, et al.Antimicrobial activity and mechanism of Larch bark procyanidins against Staphylococcus aureus[J].Acta Biochim Biophys Sin (Shanghai), 2017, 49(12):1 058-1 066.
[22] 李志刚, 陈宝峰, 张中华, 等.辅助能量物质强化环磷酸腺苷发酵合成机制[J].中国生物工程杂志, 2020,40(Z1):102-108.
LI Z G, CHEN B F, ZHANG Z H, et al.The physiological mechanism for enhanced cyclic adenosine monophosphate biosynthesis by auxiliary energy substance[J].China Biotechnology, 2020,40(Z1):102-108.