酱香型是众多香型白酒中重要的香型之一,高温制曲、高温堆积、高温发酵等独特的生产工艺使其富含多种生物活性成分[1-2]。研究发现,酱香型白酒含有有机酸、酚类化合物、醛类化合物、杂环类化合物及川芎嗪等多种生物活性成分[3-4]。其中的酚类化合物具有清除自由基、抗氧化、抗衰老的功能[5];杂环类化合物——川芎嗪,具有扩张血管、抗血栓、抗血小板凝集的生理活性,在缺血性心脑血管疾病的临床治疗中受到广泛关注[6]。此外,酱香型白酒中还富含对人体有益的微量元素[3]。
幽门螺旋杆菌(Helicobacter pylori)是一种可引起慢性胃炎的革兰氏阴性细菌。调查发现,发展中国家有70%以上的人口曾感染过H.pylori,H.pylori感染会诱发消化性溃疡、胃癌等[7]。目前,最常见的H.pylori治疗方案多是采用质子泵抑制剂(proton pump inhibitors,PPI)和抗生素(阿莫西林、克拉霉素)治疗[8],虽有一定的疗效,但成功率不尽人意,尚未见的H.pylori根治药物报道。
多种醇类化合物具有一定的抗H.pylori活性,有助于抑制H.pylori感染[9]。酱香型白酒中除乙醇外还含有仲丁醇、异丁醇、正丁醇、异戊醇等多种其他醇类化合物,而关于这些醇类化合物(active alcohols,AAs)的抗H.pylori活性报道却十分缺乏。本文评价了酱香型白酒中醇类化合物的抗H.pylori活性,并对其潜在的机制进行研究。
1 材料与方法
1.1 材料与试剂
酱香型白酒 (Moutai-flavor Baijiu (liquor),MTL),贵州茅台集团;酱香型白酒中生物活性成分 (bio-active compounds in Moutai-flavor Baijiu, BAC),参考文献[5]的方法提取获得;胎牛血清(fetal bovine serum,FBS)、青-链霉素 、RPMI 1640,HyClone公司;PBS,广州瑞舒生物科技有限公司;哥伦比亚琼脂、布氏肉汤,Oxoid公司;ROS、TNF-α、IL-1β、IL-6等试剂盒,碧云天生物科技有限公司;CCK-8试剂,同仁公司;cagA和vacA抗体,Santa Cruz Biotechnology公司;RNA prep pure Cell/Bacteria Kit,TianGen公司;人胃正常黏膜上皮细胞GES-1细胞株,ATCC(美国);H.pylori标准菌株为Sydney Strain 1 (SS1) H.pylori 标准菌株,深圳大学医学院病原微生物系惠赠;其他化合物、标准品均购于阿拉丁试剂有限公司。
低温高速离心机 (2K15型),Sigma公司;TECAN infinite M200多功能酶标仪,德国;三菱C-31厌氧培养盒,日本三菱公司;CytoFLEX流式细胞仪,美国贝克曼公司;INCO2108型CO2培养箱,德国Memmert;T100 Bio-Rad PCR仪,美国。
1.2 实验方法
1.2.1 体外抑菌试验
按文献方法复苏H.pylori并接种于哥伦比亚琼脂固体培养基,于37 ℃微需氧环境培养72 h。然后转移H.pylori至布氏肉汤液体培养基,于37 ℃微需氧振荡(100 r/min)扩大培养。挑起一部分培养72 h的H.pylori菌株,用无菌生理盐水清洗后,配成布氏肉汤菌悬液;用标准比浊管比浊,校正菌液浓度相当于1×108CFU/mL[10]。
用PBS作为溶剂溶解BAC、MTL、乙醇及AAs,将培养的H.pylori菌液用PBS重悬至1×107 CFU/mL,取0.1 mL H.pylori的PBS混悬液加入配制好的BAC、MTL、Ethanol及AAs溶液中培养72 h,观察生长情况,H.pylori生长抑制率为50%所对应的浓度即为MIC50。
1.2.2 脲酶法检测苯乙醇对H.pylori脲酶活性的影响
在布鲁氏肉汤培养基中加入BAC、MTL、乙醇及苯乙醇(AA-29),终质量浓度为100 μg/mL,不加药的肉汤培养基作为H.pylori空白对照。分别取50 mL培养基并加入1 mL浓度为1×108 CFU/mL的H.pylori,37 ℃、微氧环境的培养箱中培养24 h后,4 ℃离心弃上清液,加入3 mL混合蛋白酶抑制剂的PBS,随后冰浴超声破碎至澄清,4 ℃下离心,取出上清液置于透析袋中,PBS透析除盐,得到的脲酶溶液加入等体积的甘油后混合,再加入等体积的50 mmol/L的尿素溶液,室温孵育20 min后加入根据参考文献[11]中的方法配制的Berthelot显色液,室温显色10 min,酶标仪测635 nm的OD值,按照公式(1)计算脲酶残余活性:
脲酶残余活性![]()
(1)
1.2.3 H.pylori感染对GES-1细胞增殖及细胞凋亡的影响
将GES-1细胞 (5×103 cells/mL,100 μL/well)接种于96或(5×104 cells/mL,100 μL/well)接种于6孔板中培养过夜。将H.pylori (1×108 CFU/mL)与100 μg/mL的BAC、MTL、乙醇及AA-29在布鲁氏肉汤中37 ℃、微氧孵育12 h;随后分离H.pylori加入到含有GES-1细胞的96或6孔板中,使H.pylori与GES-1细胞比例为100∶1,培养箱中孵育12 h后使用CCK-8法检测细胞增殖活性;收集包括上清液漂浮在内的全部细胞,1 000 r/min离心5 min,用预冷的PBS洗2次,按Annexin V-FITC/PI试剂盒使用说明流式细胞术检测细胞凋亡情况;酶联免疫吸附试验 (ELISA)检测ROS、TNF-α、IL-1β及IL-6含量。
1.2.4 RT-PCR检测H.pylori脲酶相关基因、H.pylori毒力基因转录
将H.pylori (1×108 CFU/mL)与100 μg/mL的BAC、MTL、乙醇及AA-29在布鲁氏肉汤中37 ℃振荡微氧孵育24 h,离心弃上清液,用PBS冲洗3次后,使用RNA prep pure Cell/Bacteria Kit分离总RNA[12]。cDNA的合成按试剂盒(SYBR@PrimeScript TM RT-PCR Kit)操作说明进行,引物如表1所示。
表1 H.pylori脲酶相关基因
Table 1 H.pylori urease related genes
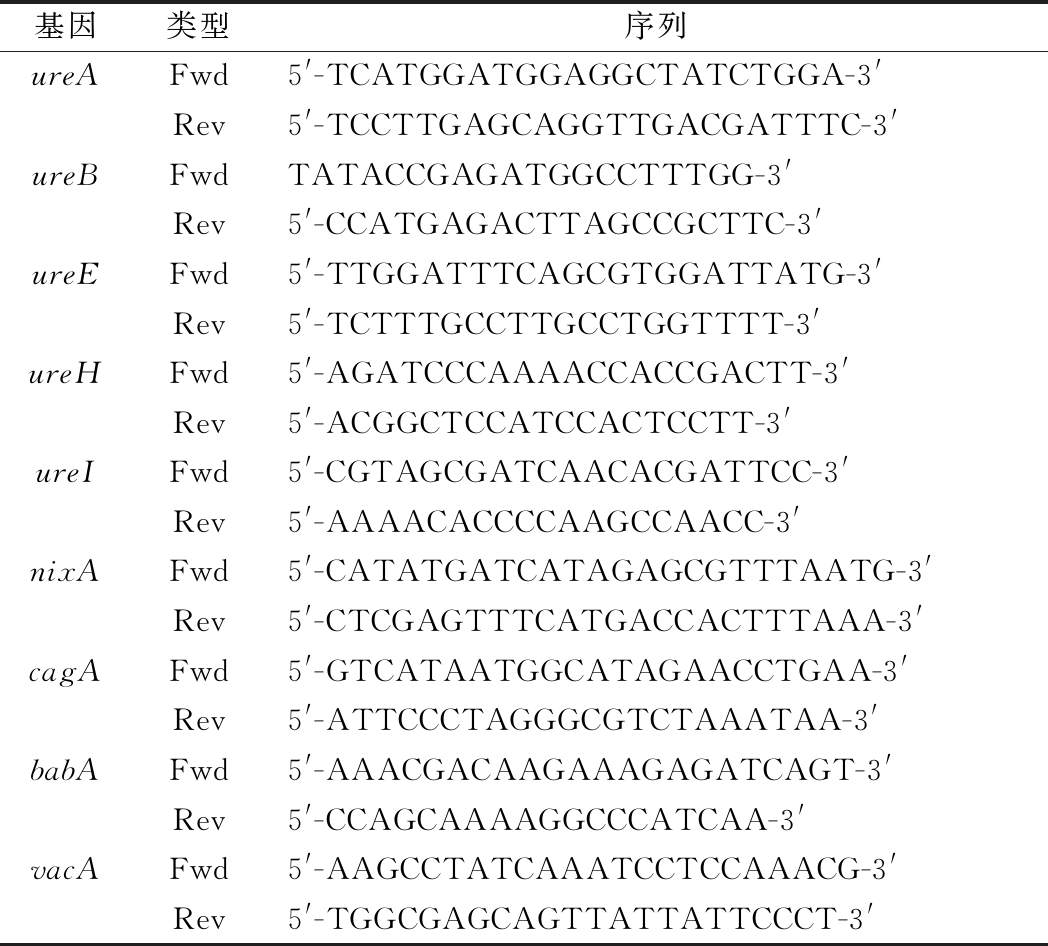
基因类型序列ureAFwd5'-TCATGGATGGAGGCTATCTGGA-3'Rev5'-TCCTTGAGCAGGTTGACGATTTC-3'ureBFwdTATACCGAGATGGCCTTTGG-3'Rev5'-CCATGAGACTTAGCCGCTTC-3'ureEFwd5'-TTGGATTTCAGCGTGGATTATG-3'Rev5'-TCTTTGCCTTGCCTGGTTTT-3'ureHFwd5'-AGATCCCAAAACCACCGACTT-3'Rev5'-ACGGCTCCATCCACTCCTT-3'ureIFwd5'-CGTAGCGATCAACACGATTCC-3'Rev5'-AAAACACCCCAAGCCAACC-3'nixAFwd5'-CATATGATCATAGAGCGTTTAATG-3'Rev5'-CTCGAGTTTCATGACCACTTTAAA-3'cagAFwd5'-GTCATAATGGCATAGAACCTGAA-3'Rev5'-ATTCCCTAGGGCGTCTAAATAA-3'babAFwd5'-AAACGACAAGAAAGAGATCAGT-3'Rev5'-CCAGCAAAAGGCCCATCAA-3'vacAFwd5'-AAGCCTATCAAATCCTCCAAACG-3'Rev5'-TGGCGAGCAGTTATTATTCCCT-3'
1.2.5 Western blotting检测
将H.pylori (1×108 CFU/mL)与100 μg/mL的BAC、MTL、乙醇及AA-29在布鲁氏肉汤中37 ℃振荡微氧孵育24 h,离心弃上清液,用PBS冲洗3次后,按细菌蛋白提取试剂盒说明提取细菌总蛋白,Western Blotting检测细胞毒素基因cagA 和空泡毒素基因vacA 的蛋白表达情况[13]。
1.3 数据处理
采用GraphPad Prism 8软件对实验数据进行统计;P <0.05具有显著性差异,结果以Mean±SEM表示;对样本先进行方差齐性检验;方差齐时,用One-Way ANOVA 检验,并进行组间的多重比较;方差不齐时,用非参数秩和检验,先用 Kruskal-WallisHtest 比较总的差异,再用Mann-Whitney U 进行两组之间比较。
2 结果与分析
2.1 酱香型白酒中醇类化合物对H.pylori菌落形成的影响
天然产物中含有的多种醇类化合物具有抗菌活性,如从天然产物中分离出的广藿香醇在体内和体外均具有抗H.pylori的作用[9]。实验结果表明,酱香型白酒中部分醇类化合物具有一定的抑制H.pylori增殖活性。其中二醇及芳香醇类化合物的抗H.pylori增殖活性更佳。AA-29能够显著抑制H.pylori增殖,其MIC50低于其他醇类化合物,且优于BAC、MTL及乙醇组(表2)。
表2 酱香型白酒中醇类化合物抗H.pylori增殖活性
Table 2 Anti H.pylori proliferation activities of alcohols in Maotai-flavor Baijiu

分组化合物MIC50/(μg·mL-1)分组化合物MIC50/(μg·mL-1)AA-1乙醇343.2AA-26(Z)-3-壬烯-1-醇143.1AA-2正丙醇332.9AA-271-壬-4-醇223.5AA-32-丁醇313.2AA-28苯甲醇141.4AA-42-甲基-1-丙醇305.8AA-29苯乙醇105.2AA-5正丁醇308.9AA-30二甲基乙醇258.1AA-63-戊醇279.4AA-31苯丙醇149.8AA-72-戊醇274.6AA-32乙基苯乙醇154.3AA-83-甲基-1-丁醇237.3AA-332-呋喃甲醇133.7AA-91-戊醇231.1AA-342,3-丁二醇161.3AA-102-甲基-3-戊醇209.1AA-351,3-丁二醇169.2AA-112-己醇220.4AA-361,4-丁二醇154.5AA-122,3-二甲基-1-丁醇192.3AA-372-丁烯-1-醇152.3AA-132-甲基-1-戊醇216.5AA-383-甲基3-丁烯-1-醇136.5AA-142-乙基-1-丁醇203.2AA-39(Z)-2-戊烯-1-醇133.5AA-154-甲基-1-戊醇208.9AA-403-甲基-2-丁烯-1-醇142.8AA-163-甲基-1-戊醇201.3AA-41(Z)-3-己烯-1-醇161.3AA-171-己醇185.8AA-424-甲基-3-戊烯-1-醇145.6AA-182-庚醇178.5AA-43环己醇138.4AA-192,2-二甲基-1-戊醇169.3AA-442-乙基-1-己醇229.2AA-203-甲基-1-己醇164.1AA-45正辛醇164.1AA-214-甲基-1-己醇207.5AA-462-壬醇167.7AA-224-庚烷醇201.4AA-472-甲基4-辛醇181.1AA-231-庚醇229.3AA-48壬醇159.6AA-243-乙基-2-戊醇230.8AA-49丙二醇270.6AA-253-辛醇242.4AA-50(S)-2-辛醇182.4Erythromycin1)-3.03MTL2)-309.4BAC-353.1
注:1)为阳性对照化合物;2)为MTL的整体质量浓度
2.2 AA-29抑制H.pylori损伤GSE-1细胞
研究发现,H.pylori毒力因子会破坏宿主细胞线粒体和溶酶体,进而导致宿主细胞氧化损伤,H.pylori感染诱发慢性炎症是导致消化性溃疡疾病和胃癌的重要因素[14]。为了检验AA-29能否降低H.pylori对GES-1细胞的损伤能力,通过CCK8方法检测了GES-1细胞的增殖情况结果如图1所示。与空白对照组相比,H.pylori使GES-1细胞数目降低22.6%,说明H.pylori感染使细胞数目显著降低,对其造成了极大的损伤。而AA-29组细胞数目比H.pylori高15.6%(P<0.01),说明AA-29处理抑制了H.pylori损伤GES-1细胞能力。类似的,BAC、MTL及Ethanol预处理均抑制了H.pylori损伤GES-1细胞的能力。
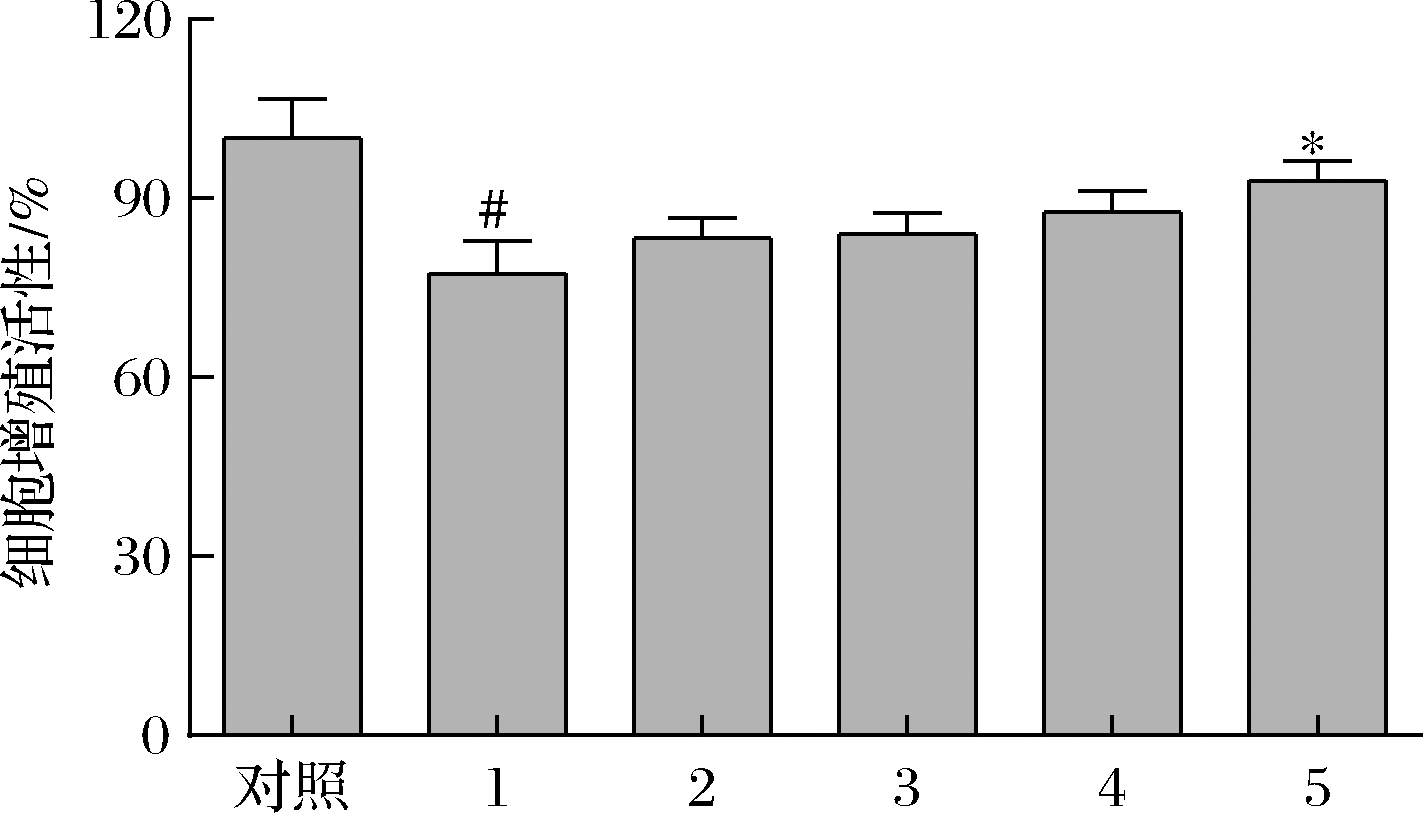
1-H.pylori;2-乙醇;3-MTL;4-BAC;5-AA-29
图1 AA-29抑制H.pylori对GES-1细胞的损伤能力
Fig.1 AA-29 inhibits the damage ability of H.pylori to GES-1 cells
研究报道,H.pylori感染会损伤胃黏膜细胞,进而诱发细胞凋亡[15]。AA-29处理能够抑制H.pylori损伤GES-1细胞能力,我们进一步检测AA-29预处理能够抑制H.pylori诱导GES-1细胞凋亡,结果如图2所示。与空白对照组相比,H.pylori组中GES-1细胞总凋亡率增加21.4%(P<0.01),说明H.pylori感
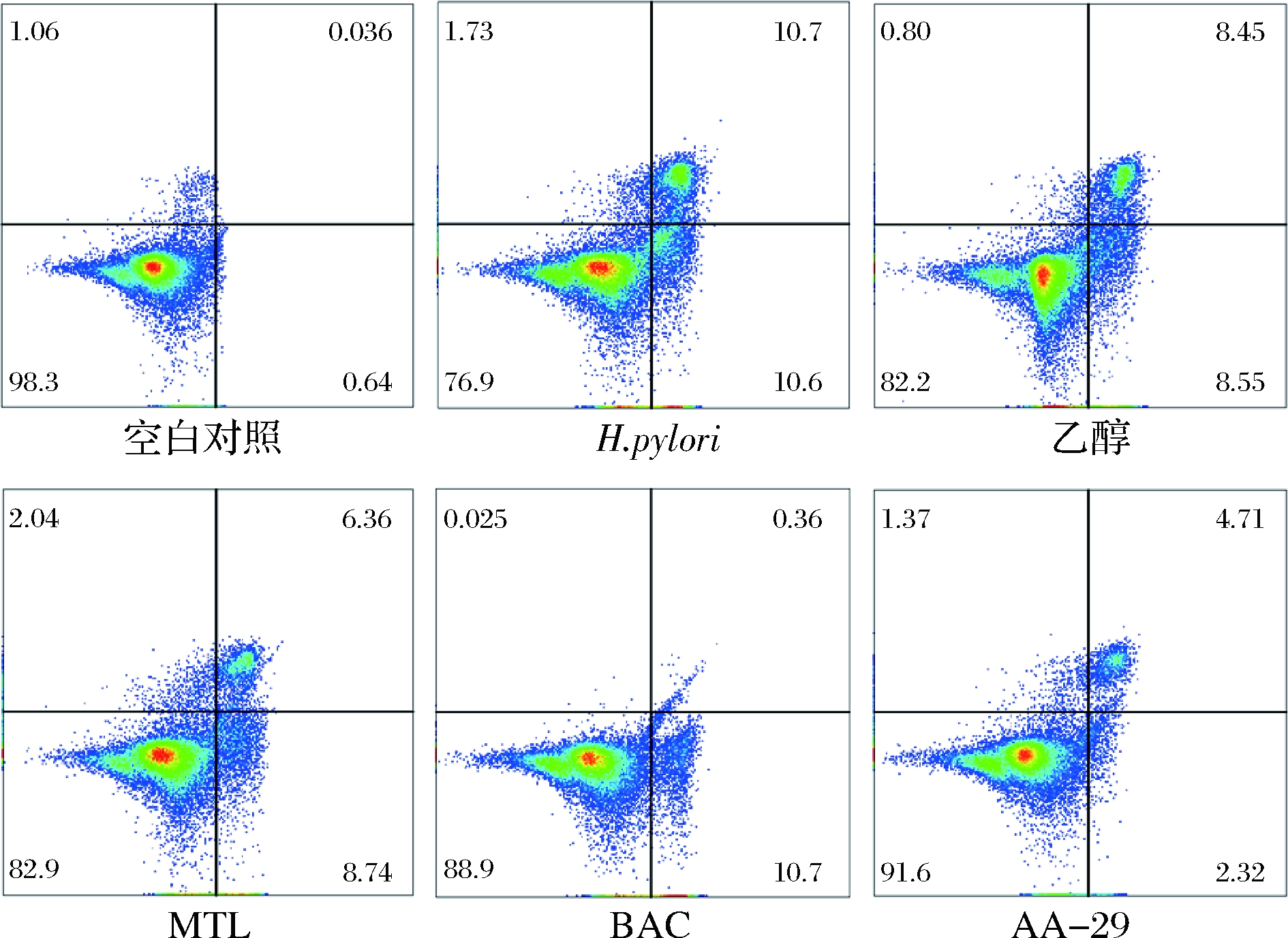
图2 AA-29抑制H.pylori诱导GES-1细胞凋亡活性
Fig.2 AA-29 inhibits H.pylori-induced apoptosis in GES-1 cells
染损伤GES-1细胞进而诱导其凋亡。而AA-29组细胞凋亡率比H.pylori低14.7%(P<0.01),说明AA-29能够显著降低H.pylori对GES-1细胞的损伤。类似的,BAC、MTL预处理也降低了H.pylori诱导GES-1细胞凋亡活性。
H.pylori感染宿主细胞会诱发氧化损伤及炎症反应[15]。因此,检测了H.pylori感染对GES-1细胞ROS及TNF-α、IL-1β、IL-6等炎性细胞因子分泌的影响。为便于比较,将空白对照组中ROS、TNF-α、IL-1β及IL-6的含量设为1,其他组含量为相对值。如图3所示,H.pylori感染使GES-1细胞ROS含量增加389%(P<0.01),推测GES-1细胞数目下降及细胞凋亡增加可能是由于H.pylori感染诱发GES-1细胞氧化应激,进而造成氧化损伤导致的。而AA-29显著降低了H.pylori对GES-1细胞的氧化损伤能力。相比于H.pylori组,AA-29组ROS含量减少49.5%(P<0.05);类似的,BAC也显著降低了H.pylori对GES-1细胞的氧化损伤能力;而MTL及乙醇组ROS含量与H.pylori组相比则无显著变化,我们推测,MTL及乙醇未能显著降低H.pylori对GES-1细胞的氧化损伤能力。
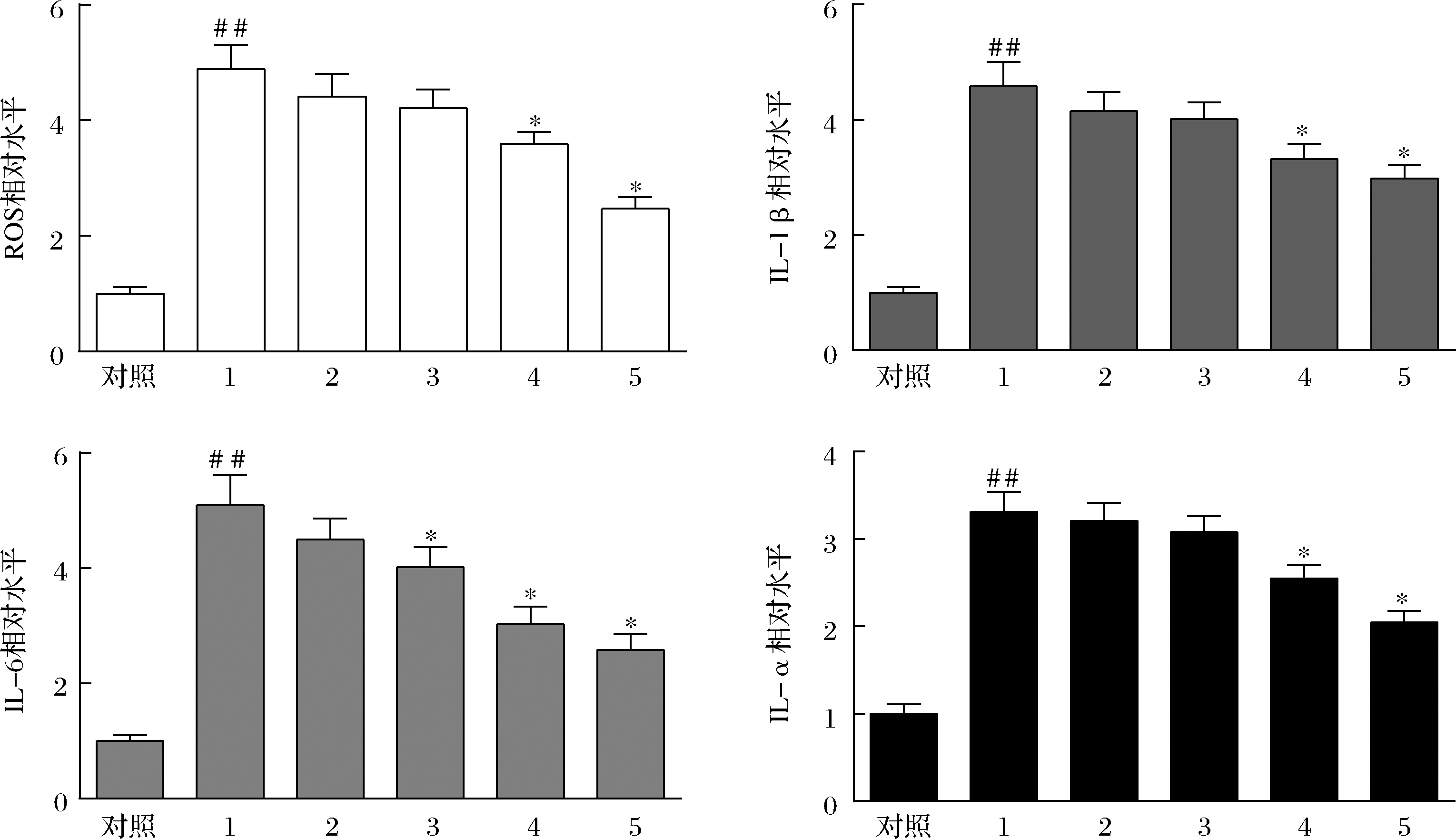
1-H.pylori;2-乙醇;3-MTL;4-BAC;5-AA-29
图3 AA-29抑制H.pylori对GES-1细胞的氧化损伤及炎性损伤能力
Fig.3 AA-29 inhibits oxidative and inflammatory damage of GES-1 cells induced by H.pylori
进一步检测了AA-29能否抑制H.pylori诱发GES-1细胞炎症的活性。如图3所示,H.pylori感染使GES-1细胞TNF-α、IL-1β、IL-6分泌增加231%(P<0.01)、359%(P<0.01)、410%(P<0.01);而AA-29显著抑制H.pylori诱发GES-1细胞炎症的能力。相比于H.pylori组,AA-29组中TNF-α、IL-1β及IL-6分泌降低38.1%(P<0.05)、35.1%(P<0.05)及49.4%(P<0.05);类似的,BAC也能够显著抑制H.pylori损伤GES-1细胞、诱发细胞炎性损伤的能力。而MTL及乙醇组中TNF-α、IL-1β及IL-6含量变化不明显,推测MTL及乙醇未能显著抑制H.pylori诱发GES-1细胞炎性损伤的能力。
2.3 AA-29抑制H.pylori脲酶活性
H.pylori定植宿主细胞是H.pylori感染的关键步骤,脲酶是H.pylori定植过程的关键蛋白。脲酶还会诱发宿主细胞炎症反应,甚至诱导肿瘤[16]。如图4所示,相比于空白对照组,AA-29组H.pylori脲酶活性降低20.4% (P<0.05);BAC预处理也显著降低了H.pylori脲酶活性,相比于H.pylori组,其活性下降14.7% (P<0.05);而MTL及乙醇预处理未显著影响H.pylori脲酶活性。
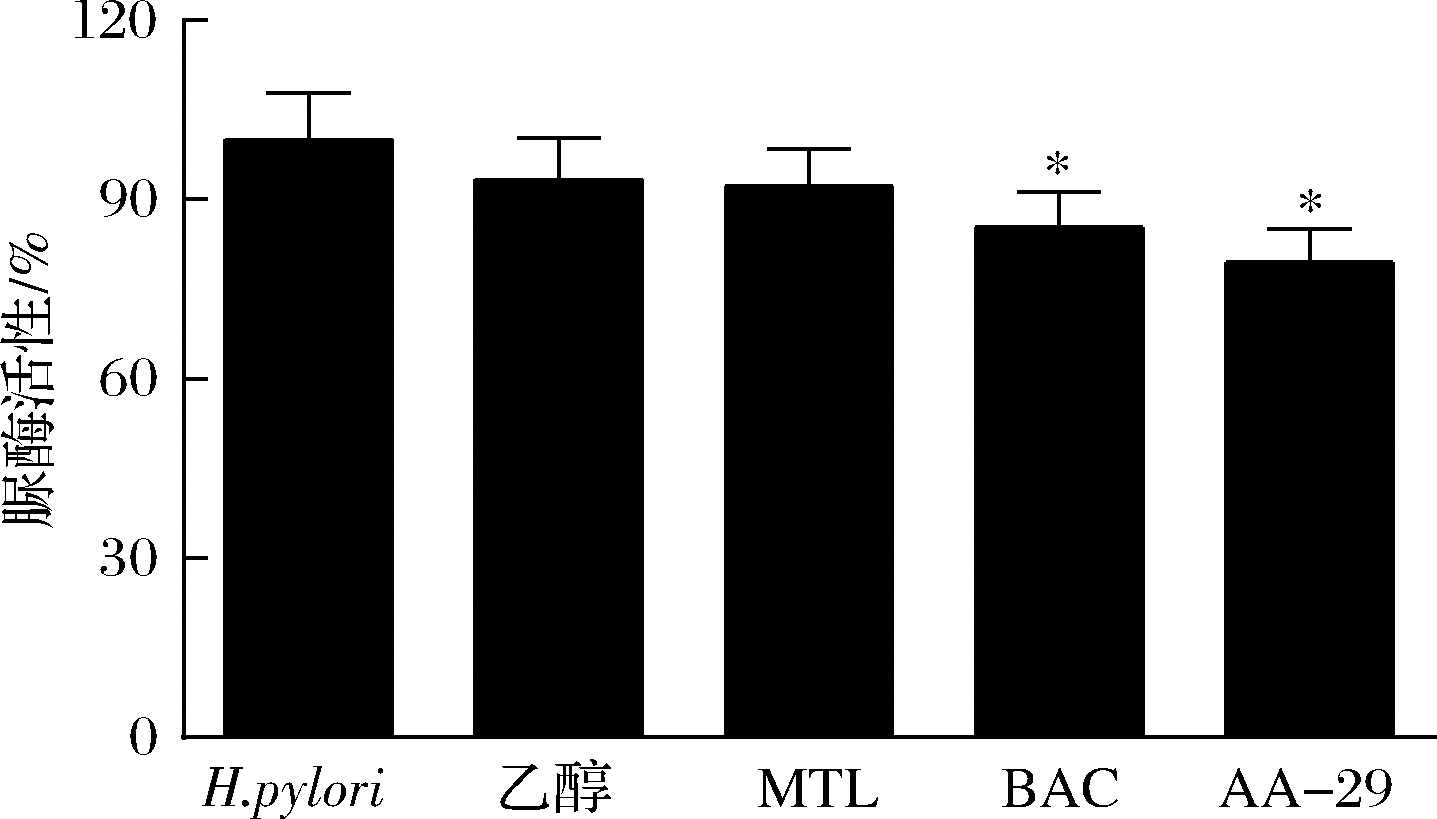
图4 AA-29抑制H.pylori脲酶活性
Fig.4 AA-29 inhibits H.pylori urease activity
注:H.pylori空白对照组的脲酶活性设为100%,其他组脲酶活性为
相对值,与H.pylori空白对照组比较,*P<0.05,**P<0.01
2.4 AA-29抑制H.pylori毒力基因及脲酶相关基因的表达
babA是可特异性结合宿主细胞受体的H.pylori外膜蛋白,能够赋予H.pylori持久定植能力;空泡细胞毒素A (vacA)因其在真核细胞中诱导空泡形成,能够破坏细胞内吞作用、释放有机阴离子![]() 抑制免疫细胞导致免疫耐受和慢性感染等[17]。据报道,高毒力的H.pylori菌株多具有细胞毒素相关基因(cagA),参与cagA转运和宿主的炎症反应[18]。
抑制免疫细胞导致免疫耐受和慢性感染等[17]。据报道,高毒力的H.pylori菌株多具有细胞毒素相关基因(cagA),参与cagA转运和宿主的炎症反应[18]。
RT-PCR检测H.pylori babA、cagA及vacA基因转录变化结果如图5-a所示。AA-29能够抑制H.pylori babA、cagA的转录,但未显著抑制vacA转录。此外,BAC对babA、cagA及vacA转录也有较强的抑制能力,且抑制活性高于MTL及乙醇组。babA、cagA及vacA编码的蛋白能够诱发炎症导致细胞损伤等,因此,我们推测,AA-29可通过抑制H.pylori相关毒力基因的表达,减少H.pylori对GSE-1细胞的损伤能力。

1-H.pylori;2-乙醇;3-MTL;4-BAC;5-AA-29
图5 AA-29抑制H.pylori毒力基因及脲酶相关基因的表达
Fig.5 AA-29 inhibits the expression of H.pylori virulence genes and urease related genes
H.pylori脲酶蛋白主要由结构蛋白和辅助蛋白组成,其中结构蛋白由ureA和ureB基因编码,构成H.pylori的脲酶原;ureE、ureF、ureG、ureH和ureI则编码了H.pylori的辅助蛋白,能够将镍离子转运到无活性的脲酶原上并激活脲酶蛋白;nixA蛋白则能独立的将镍离子转运至胞内[19]。
为进一步验证AA-29抑制脲酶活性的功能是通过抑制H.pylori基因簇的转录实现的,我们采用RT-PCR方法检测H.pylori脲酶的ureA、ureB、ureE、ureH、ureI和nixA 基因转录情况。结果如图5-b、5-c所示。AA-29可显著抑制ureA、ureH和nixA基因转录,但对ureB、ureE和ureI基因的转录无显著影响;乙醇组仅抑制了ureA和ureH基因转录;BAC和MTL均抑制了ureA、ureH和nixA的基因表达。
2.5 AA-29抑制H.pylori毒力蛋白表达
Western Blotting分析H.pylori cagA、vacA的表达,结果如图6所示。AA-29能够显著降低H.pylori中cagA的表达,与RT-PCR结果类似(图6)。推测AA-29可通过抑制H.pylori中相关毒力基因的转录及毒力蛋白表达,从而抑制H.pylori对GES-1细胞的损伤。
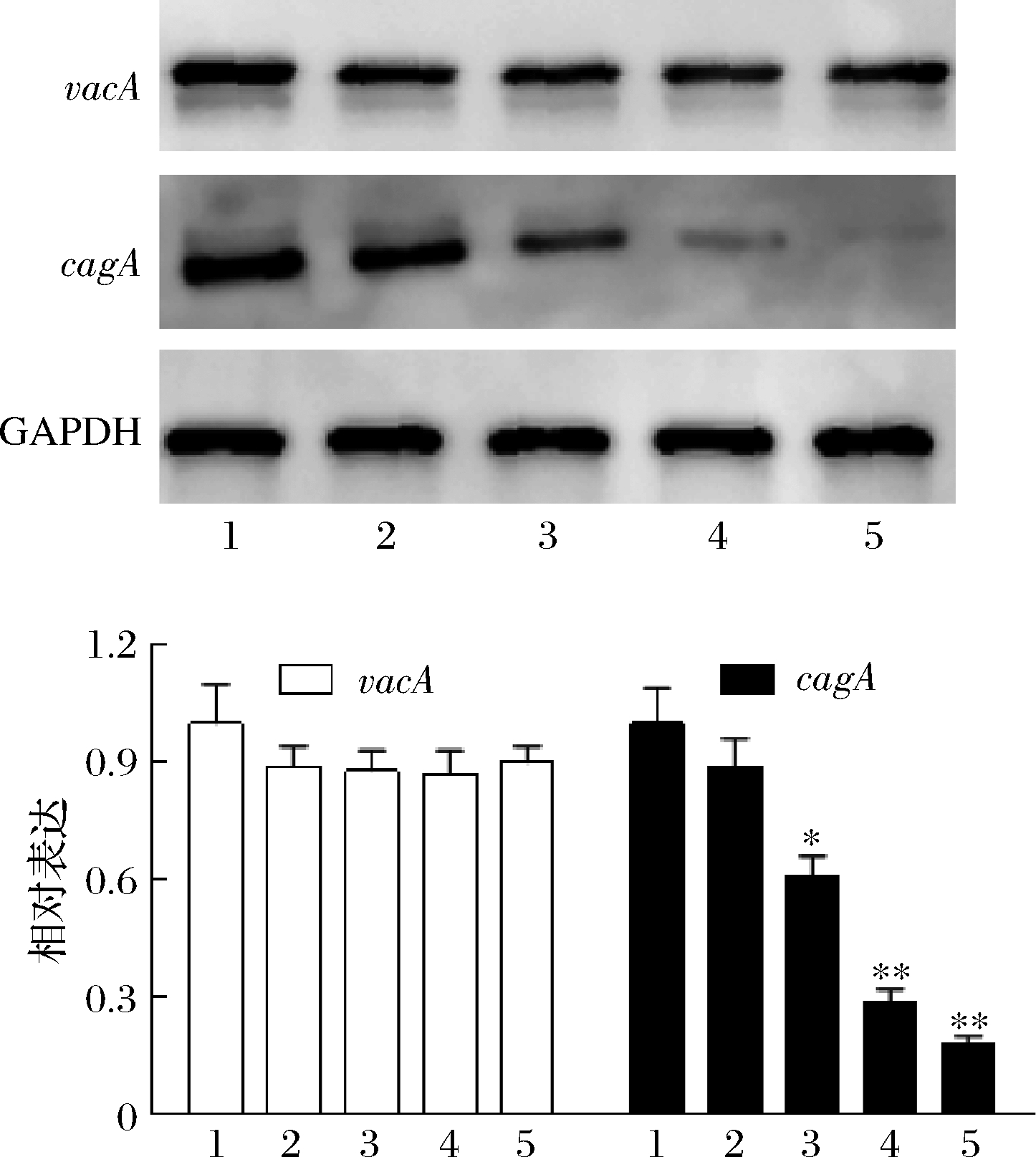
1-H.pylori;2-乙醇;3-MTL;4-BAC;5-AA-29
图6 AA-29抑制H.pylori毒力蛋白cagA和vacA的表达
Fig.6 AA-29 inhibits the expression of H.pylori virulence proteins cagA and vacA
3 讨论
胃上皮细胞是胃肠道黏膜机械屏障的重要组成部分,其分泌的细胞因子和趋化因子对胃肠道黏膜通透性有着重要的影响。H.pylori感染首先是通过表达babA等外膜蛋白黏附在胃肠道黏膜细胞上,再通过表达vacA和cagA等蛋白诱发炎症和细胞损伤,进而增加胃肠道黏膜通透性,利于其迁移。定植是H.pylori感染的第一步,H.pylori定植宿主细胞后会释放cagA和vacA等毒力因子诱发胃上皮细胞炎症和氧化损伤等,脲酶则在H.pylori的定植中起到关键性的作用。ureA、ureB、ureE、ureH、ureI和nixA等基因编码的蛋白在脲酶的形成和活化中至关重要。
本研究表明,酱香型白酒中的醇类化合物可抑制H.pylori生长;其中,AA-29 (苯乙醇)可通过抑制脲酶结构基因、辅助基因(ureA、ureH、nixA)的转录实现抑制H.pylori脲酶活性;此外,AA-29还通过抑制H.pylori相关毒力基因babA及vacA的转录,及vacA的表达发挥其抑制H.pylori对GES-1细胞的损伤能力。进一步的研究发现,AA-29可抑制H.pylori对GES-1的感染及诱导细胞氧化损伤及炎性损伤的能力。
本研究说明酱香型白酒中的部分醇类化合物具有抗H.pylori增殖,减轻H.pylori对胃黏膜细胞损伤的活性,但大量研究显示酗酒会损伤胃肠道黏膜,酱香型白酒中的生物活性物质虽具有抑制H.pylori对胃黏膜细胞损伤的活性,但仍不建议酗酒。
[1] 崔利.酱香型白酒中吡嗪类化合物的生成途径及环节[J].酿酒,2007(5):39-40.
CUI L.Biosynthetic pathways and steps of pyrazine compounds in Moutai-flavour Baijiu[J].Liquor Making, 2007(5):39-40.
[2] 郑岩,汤庆莉,吴天祥,等.GC-MS法建立贵州茅台酒指纹图谱的研究[J].中国酿造,2008(9):78-80.
ZHENG Y,TANG Q l,WU T X,et al.Study on fingerprint construction of Kweichow Moutai liquor by GC-MS[J].China Brewing,2008(9):78-80.
[3] 庄名扬.酱香型白酒中微量成分的生理活性[J].酿酒,2006(6):109-110.
ZHUANG M Y.Physiological activity of trace components in Maotai flavor Baijiu[J].Liquor Making,2006(6):109-110.
[4] SUN Q,XIANG P,SHEN B,et al.Identification of Kweichow Moutai liquor by gas chromatography-mass spectrometry fingerprint.[J].Chinese Journal of Chromatography,2010,28(9):833.
[5] 罗强,刘杰,刘志刚.酱香型白酒中活性成分的抗氧化活性[J].食品与发酵工业,2019,45(23):84-89.
LUO Q,LIU J,LIU Z G.Antioxidant activity of active components in Maotai-flavor liquor[J].Food and Fermentation Industries,2019,45(23):84-89.
[6] 申莉.川芎嗪注射液临床应用研究进展[J].中国乡村医药,2008(4):48-49.
SHEN L.Progress in clinical application of ligustrazine injection[J].Chinese Journal of Rural Medicine,2008(4):48-49.
[7] MLADENOVA I,DURAZZO M.Transmission of Helicobacter pylori[J].Minerva Gastroenterologicae Dietologica,2018,64(3):251-254.
[8] PARK D,PARK J H,KIM H,et al.M1117 The effect of probiotics and mucoprotective agents on PPI-based Triple therapy for eradication of Helicobacter pylori[J].Gastroenterology,2010,138(5):S-335.
[9] 连大卫,许艺飞,扶丽君,等.广藿香醇对幽门螺杆菌酸抵抗能力的影响及其机制探讨[J].山东医药,2017,57(34):16-19.
LIAN D W,XU Y F,FU L J,et al.Effect of patchouli alcohol on acid resistance of Helicobacter pylori[J].Shandong Medical Journal,2017,57(34):16-19.
[10] 王琼,杨杰,潘科,等.幽门螺杆菌不同运送条件及培养基分离效果的比较[J].世界华人消化杂志,2016,24(8):1 241-1 246.
WANG Q,YANG J,PAN K,et al.Effect of different transport conditions and media on Helicobacter pylori isolation[J].World Chinese Journal of Digestology,2016,24(8):1 241-1 246.
[11] 顾性初.用于筛选天然产物中脲酶抑制剂的脲酶活性测试方法的建立[J].中国医药工业杂志,1995(11):487-489.
GU X C.Establishment of a urease assay for screening urease inhibitors in natural product[J].Chinese Journal of Pharmaceuticals,1995(11):487-489.
[12] 宋鑫,陈惠新,陈洁,等.幽门螺杆菌细胞毒素相关基因A对人胃腺癌AGS细胞生物学行为的影响[J].中华肿瘤杂志,2008(5):339-342.
SONG X,CHEN H X,CHEN J,et al.Effect of Helicobacter pylori-encoded CagA on biological behavior of gastric adenocarcinoma cells in vitro[J].Chinese Journal of Oncology,2008(5):339-342.
[13] 张雁,张姝,罗昭逊,等.中药头花蓼对幽门螺杆菌CagA及VacA表达的影响[J].贵阳医学院学报,2015,40(5):455-458.
ZHANG Y,ZHANG S,LUO Z X,et al.Effect of Chinese medicine polygonum capitatum on expression of Helicobacter pylori CagA and VacA[J].Journal of Guizhou Medical University,2015,40(5):455-458.
[14] 高俊,陈慧,詹轶群,等.病原微生物毒力因子与宿主细胞信号通路相互作用研究进展[J].生物技术通讯,2016,27(5):705-710.
GAO J,CHEN H,ZAN Y Q,et al.Progress in the interaction of pathogenic microbes virulence factors with host cell signalling[J].Letters in Biotechnology,2016,27(5):705-710.
[15] 易健,舒徐,吕静,等.ROS在幽门螺杆菌对胃上皮细胞DNA损伤中的作用[J].世界华人消化杂志,2014,22(35):5 393-5 399.
YI J,SHU X,LYU J,et al.Role of ROS in DNA damage caused by Helicobacter pylori in gastric epithelial cells[J]World Chinese Journal of Digestology,2014,22(35):5 393-5 399
[16] 王静,王蔚虹.幽门螺杆菌定植相关致病因子研究进展[J].中国病原生物学杂志,2010,5(2):130-133.
WAMG J,WANG W H.Pathogenic factors related to Helicobacter pylori colonization[J].Journal of Pathogen Biology,2010,5(2):130-133.
[17] 耿春雨,马智军,胡继科,等.幽门螺杆菌毒力因子及其致病机制研究进展[J].山东医药,2018,58(7):108-110.
GENG C Y,MA Z J,HU J K,et al.Research progress on virulence factors and pathogenic mechanism of Helicobacter pylori[J].Shandong Medical Journal,2018,58 (7):108-110.
[18] 汪强武,王启之,于东红,等.幽门螺杆菌及其细胞毒素相关蛋白A与胃癌形成的关系及可能机制[J].中国组织化学与细胞化学杂志,2013,22(3):260-265.
WANG Q W,WAMG Q Z,YU D H,et al.Relationship and possible mechanism between Helicobacter pylori and cytotoxin-associated protein A with aastric carcinoma[J].Chinese Journal of Histochemistry and Cytochemistry,2013,22(3):260-265.
[19] 李晓姣,赵圣国,郑楠,等.细菌脲酶蛋白复合物及其活化机制[J].生物工程学报,2019,35(2):204-215.
LI X J,ZHAO S G,ZHENG N,et al.Progress in bacterial urease complexes and their activation mechanisms[J].Chinese Journal of Biotechnology,2019,35(2):204-215.