炎症性肠病(inflammation bowel disease,IBD)是以肠道炎症性细胞浸润、肠黏膜受损为主要表现的肠道慢性炎症病变,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩氏病(crohn′s disease,CD)[1]。目前认为IBD是由遗传、免疫及环境等多个因素相互作用所致[2]。IBD的发病较多缓渐,隐匿病史常为数月或数年,亦有持续活动而不缓解者[3-4],缓解期与活动期又容易反复交替,需长期维持治疗。近年来IBD在我国的发病率逐年上升,带来重大医疗负担[5],而有关治疗IBD的新药多从调节免疫及炎症反应方面入手[6]。多糖作为保健食品和药物的良好来源之一,受到人们的普遍关注。魏江洲等[7]发现海螵蛸多糖缓解炎症的路径是加速溃疡组织的愈合,同时降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达。日本研究人员在动物实验中发现,海带中的昆布多糖能防止溃疡性结肠炎等炎性肠病[8]。
厚壳贻贝(Mytilus coruscus)是一种近海暖温性底栖双壳软体动物[9],富含蛋白质、活性多糖和氨基酸等多种营养成分,被誉为“海中鸡蛋”[10]。其中多糖是由10个以上的单糖以糖苷键连接而成的一类天然高分子多聚物[11],在贻贝中的含量丰富。研究表明贻贝多糖具有调节免疫[12]、抗肿瘤[13]、抗衰老[14]、抗氧化[15]、预防非酒精性脂肪肝[16]和降血脂血糖[17]等功能活性。姚滢[18]通过实验发现厚壳贻贝多糖(Mytilus coruscus polysaccharide,MP)不仅能增加小鼠脾淋巴细胞活性,而且能增强机体免疫和抗氧化作用。栾洁等[19]研究发现MP可增强小鼠迟发型变态反应及吞噬作用,调节小鼠的免疫功能,因此把MP作为预防和治疗炎性疾病的活性成分研究具有重要的意义。
MP具有抗氧化及免疫调节的作用,而结肠炎很大程度上是与氧化过激或免疫失调等相关,但贻贝多糖对结肠炎的改善作用尚未见报道[20-22]。因此,通过建立由葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎小鼠模型,研究MP对模型小鼠体重、结肠组织病变以及血清和结肠组织中谷胱甘肽还原酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、TNF-α和白细胞介素-6(interleukin-6,IL-6)水平的影响,探讨厚壳贻贝多糖对结肠炎能否起到改善作用,以便为贻贝多糖预防和改善结肠炎提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 材料
厚壳贻贝购买自浙江舟山东河市场。去除外壳后,将贝肉洗净剪碎后加入适量纯水匀浆,在匀浆液中分别加入20 g木瓜蛋白酶和胰蛋白酶,在50 ℃,pH 7的条件下酶解6 h,酶解完成后于95 ℃水浴中进行酶灭活,在10 000 r/min条件下离心10 min后取上清液,上清液经乙醇梯度醇沉[23],取沉淀,真空冷冻干燥后得到贻贝粗多糖。
1.1.2 实验动物
SPF级ICR小鼠,雄性,4周龄,体重(20±1) g,购自上海斯莱克实验动物有限责任公司。小鼠给予标准粮,自由采食饮水,温度(24±1)℃,湿度(65±5)%,光暗周期12/12 h,适应性饲养1周。本研究遵循的程序符合负责本单位动物试验委员会所制订的伦理学标准,批准文号为2019003。
1.2 实验试剂
DSS(分子质量36 k~50 kDa),美国加州MP Biomedicals 公司;小鼠标准粮,苏州双狮实验动物饲料科技有限公司。Mouse TNF alpha ELISA Kit、Mouse IL-6 ELISA Kit,博士德生物工程有限公司;GSH-PX、SOD试剂盒,南京建成生物工程研究所;乙醇等试验试剂(分析纯),国药集团化学试剂有限公司。
1.3 实验仪器
902型超低温冰箱,青岛海尔股份有限公司;IKA T10匀浆机,新芝生物科技有限公司;Micro21R高速冷冻离心机,赛默飞世尔科技有限公司;Synergy H1全功能微孔板检测仪,美国BioTek;BP211D电子天平,美国Sartorius。
1.4 实验方法
1.4.1 小鼠模型的制备
口服DSS诱导的结肠模型与人类发病机制极为相似,许多研究均采用这一模型[24-25],本次实验也采用这一模型来探讨厚壳贻贝多糖改善由DSS诱导的结肠炎的机制。
将适应1周的小鼠,按平均体重无显著性差异分为3组,每组6只。空白组和模型组(DSS组)每日灌胃生理盐水,贻贝多糖组灌胃MP[300 mg MP/(kg BW·d)],每日1次,2周后DSS组和MP组日常饮用水中加入质量分数3.5%的DSS,连续7 d,每隔2 d更换一次新配的DSS溶液[26]。
1.4.2 测量指标和方法
1.4.2.1 疾病活动指数(disease activity index, DAI)
从DSS诱发结肠炎模型第1天起,每天记录小鼠体重,观察粪便性状及肉眼血便情况[27],根据小鼠的情况记录打分。DAI按公式(1)计算[28]:
(1)
表1 DAI评分标准
Table 1 Disease activity index scoring system

体重下降/%大便性状*大便隐血/肉眼血便计分0正常正常01~5糊状隐血阳性16~10211~15腹泻肉眼血便3>164
注:*正常大便:成形大便;糊状大便:不黏附于肛门的糊状、半成形大便;腹泻:可黏附于肛门的稀水样便
1.4.2.2 ELISA 法检测结肠和血浆内炎症因子的含量及抗氧化指标
在实验的第21天,采集小鼠眼球处血液,4 ℃冰箱保存一夜,低温4 000 r/min离心15 min后取上清液,根据不同试剂盒的说明书检测血清中的GSH-Px、SOD、TNF-α和IL-6。解剖后,取出肠道,剔除肠系膜,拍照并记录结肠长度,分别取不同处理组的结肠100 mg,加入1 mL无菌生理盐水,使用电动匀浆机将肠道磨至黏液状,低温4 000 r/min离心10 min,取上清液分装,保存在-80 ℃的冰箱中。用BCA试剂盒测定蛋白浓度,根据不同试剂盒的说明书检测肠道的GSH-Px、SOD、TNF-α、和IL-6。
1.5 统计与分析
数据应用Graph Pad Prism10.01软件进行统计学分析,P<0.05表示有显著性差异,具有统计学意义。
2 结果与分析
2.1 MP对结肠炎小鼠体态特征的影响
在给予除空白组以外的小鼠DSS造模的7 d内,与空白组相比,DSS组小鼠毛发微微发黄、杂乱,行动迟缓,个别小鼠拉稀,肛门处可以明显观察到血便的痕迹。MP组的小鼠少见血便,拉稀症状有所减轻。结肠长度缩短在一定程度上可以作为一项指标来衡量炎症的严重程度[29]。解剖后发现,小鼠的结肠明显皱缩,结肠内容物发黑,以上现象可以表明,结肠炎模型造模成功。
通过图1-a可以看出,在日常饮用水中加入DSS后,DSS组小鼠随着时间变化呈现下降水平,而MP组小鼠虽然也呈现下降趋势,但体重下降比DSS组平缓很多,情况相对良好。图1-b反映了小鼠体重变化、粪便松散程度以及粪便出血情况,可以看到MP组的DAI低于DSS组,证明经过给药处理后,小鼠的生理状况得到了一定的改善。从图1-c和图1-d中发现饮用DSS后小鼠结肠长度都有一定程度变短,但MP+DSS组结肠缩短的情况好于DSS单独造模组,MP+DSS组结肠长度与肉眼观察情况也均显著好于DSS组(P<0.05)。表明MP可以改善由DSS诱导的结肠炎小鼠引起的结肠缩短。
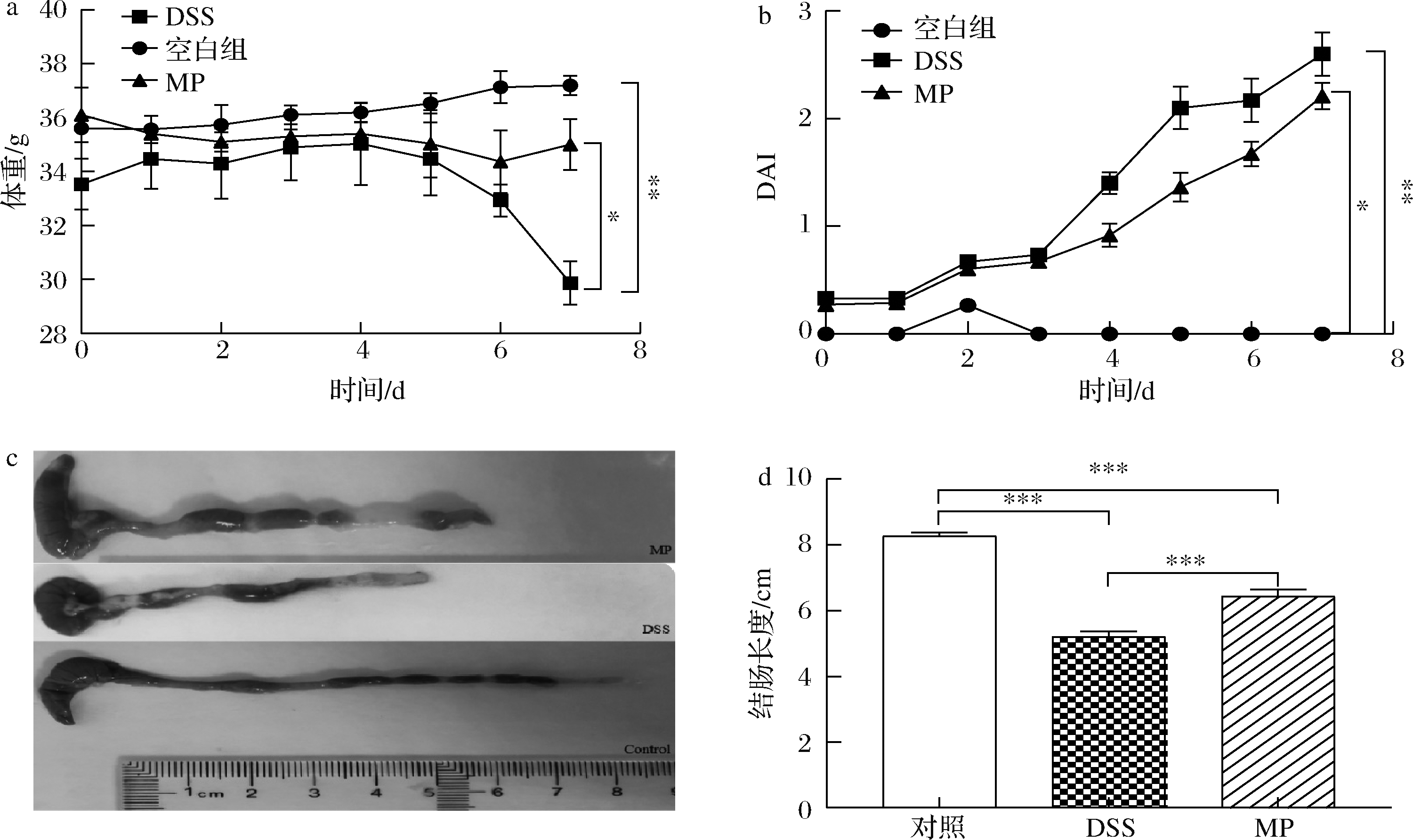
a-体重变化;b-DAI;c-结肠形态;d-结肠长度
图1 MP对结肠炎小鼠体重变化、DAI、结肠形态、结肠长度的影响
Fig.1 Effect of MP on body weight change, disease activity index, macroscopic appearances of colons and colon length of colitis in mice
注:*表示具有显著性差异(* P<0.05,** P<0.01,*** P<0.001)(下同)
2.2 对结肠炎小鼠肠道组织形态的影响
通过苏木精-伊红(hematoxyin-eosin,HE)染色对肠道组织进行评价,结果如图2所示。空白组小鼠的结肠组织表面上皮完整,隐窝无破坏,且无明显的炎性细胞,腺体排列紧密规则,结构清晰(2-a);模型组出现明显的肠壁增厚,固有层内存在大面积中性粒细胞浸润,绒毛上皮细胞大面积坏死,肠腔可见坏死上皮细胞以及坏死组织和炎性细胞浸润,黏膜上皮出现较大溃疡,炎症程度明显高于正常组(图2-b)。
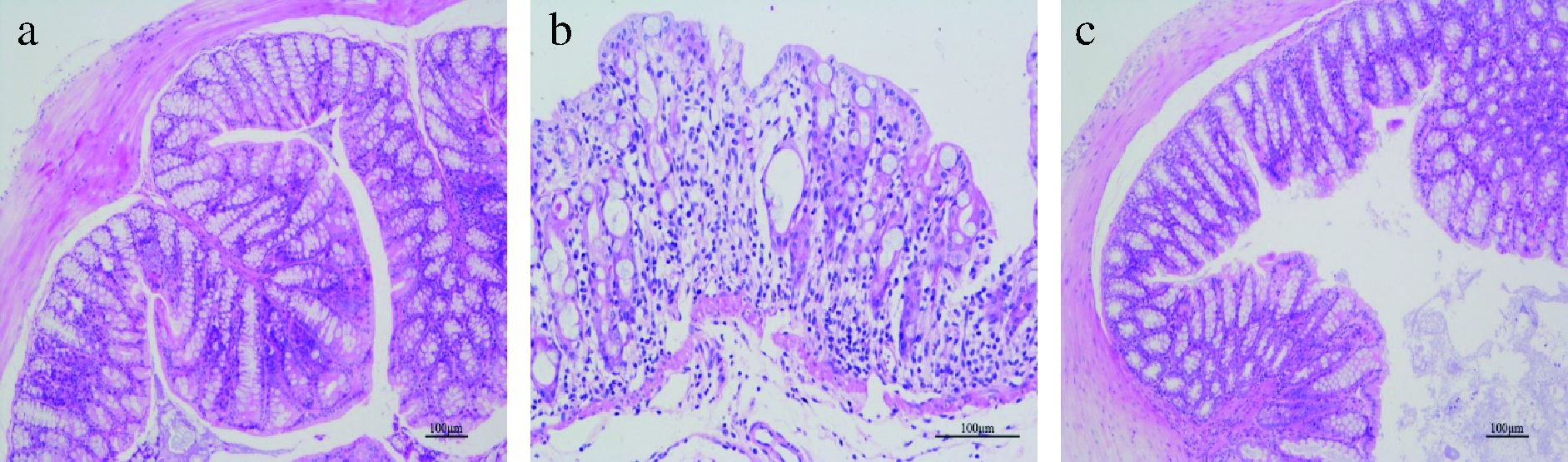
a-空白组;b-模型组;c-MP:DSS+300 mg/kg MP(下同)
图2 肠道组织切片HE染色
Fig.2 HE staining of intestinal tissue sections
而在MP组中,出现可见的隐窝结构,肠壁水肿转为轻度,肠绒毛上皮完整,中性粒细胞浸润明显缓解,炎性程度减轻(图2-c),说明MP对肠道发挥保护作用。
2.3 MP对结肠炎小鼠肠道指标的影响
2.3.1 MP对结肠炎小鼠肠道抗氧化水平的影响
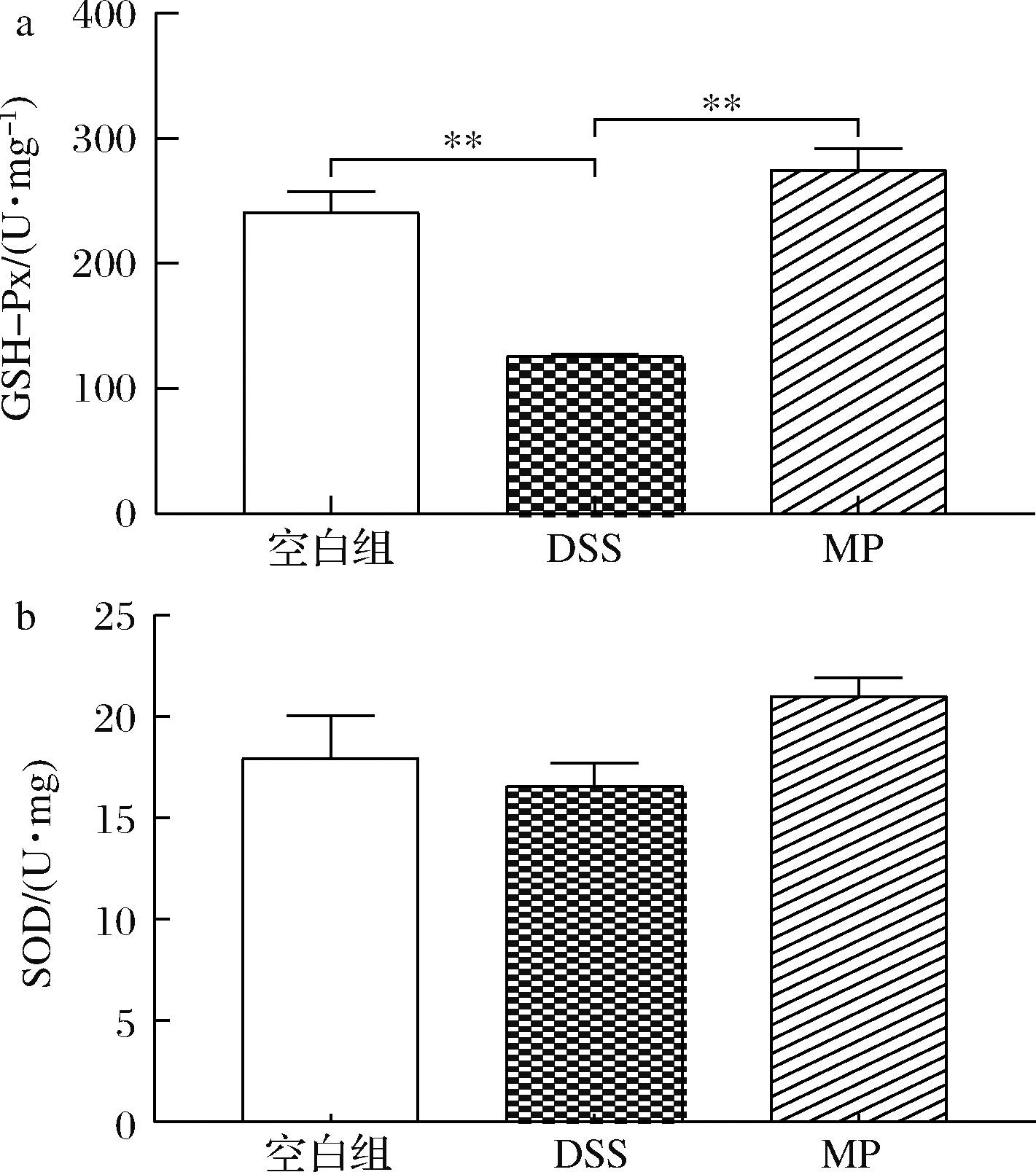
SOD与GSH均是机体抗氧化系统中的重要成员,可有效分解过氧化物、脂质过氧化物,中止脂质过氧化反应,SOD、GSH水平可反映机体清除氧自由基的能力[30]。GSH-Px 可特异催化GSH对H2O2的还原反应使之变成水,有效维持细胞稳定性,保护细胞结构[31]。从图3中可以看出与空白组相比,DSS组的GSH-Px和SOD的水平显著下降(P<0.05),与DSS组相比,MP组的GSH-Px和SOD水平显著升高(P<0.05)。结果表明MP在一定程度上改善了DSS诱导的肠道应激。
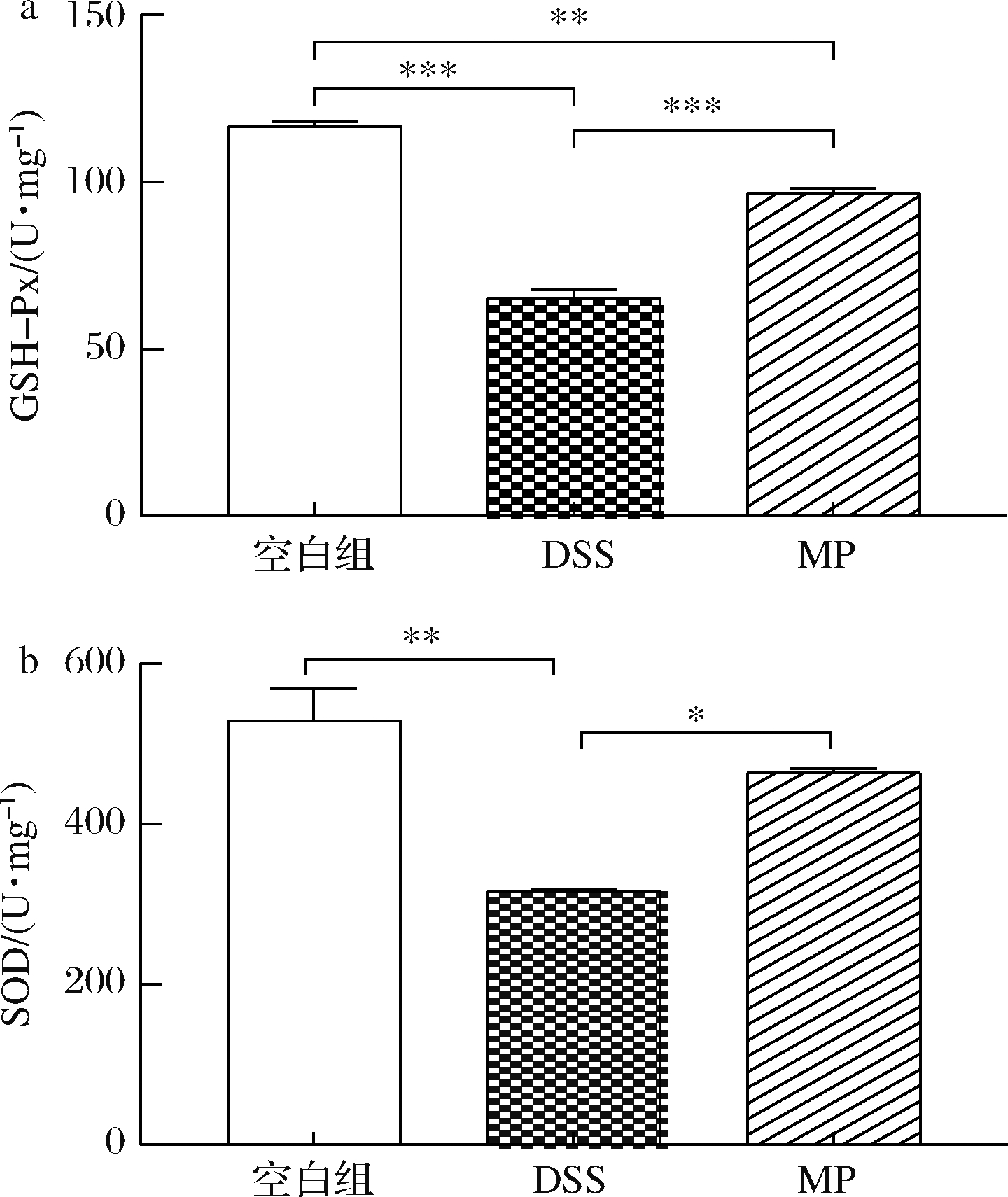
a-GSH-Px;b-SOD
图3 MP对小鼠结肠抗氧化水平GSH-Px和SOD的影响
Fig.3 Effect of MP on antioxidant levels of GSH-Px and SOD in colonic tissue
2.3.2 MP对结肠炎小鼠肠道炎性因子水平的影响
细胞因子在IBD中起重要作用,包括致炎和抗炎作用。TNF-α和IL-6的含量在很大程度上可以反映炎症的轻重程度[32]。由图4可知,与空白组相比,DSS组小鼠结肠的促炎细胞因子TNF-α水平显著上升(P<0.05),而IL-6无显著性变化,可能是因为DSS组的取样小鼠的炎症不是特别严重;与DSS组相比,MP组小鼠的结肠TNF-α和IL-6呈下降趋势;与空白组相比,MP组的TNF-α和IL-6水平无显著性差异(P>0.05)。总体上来说,MP有利于改善小鼠的炎症反应。
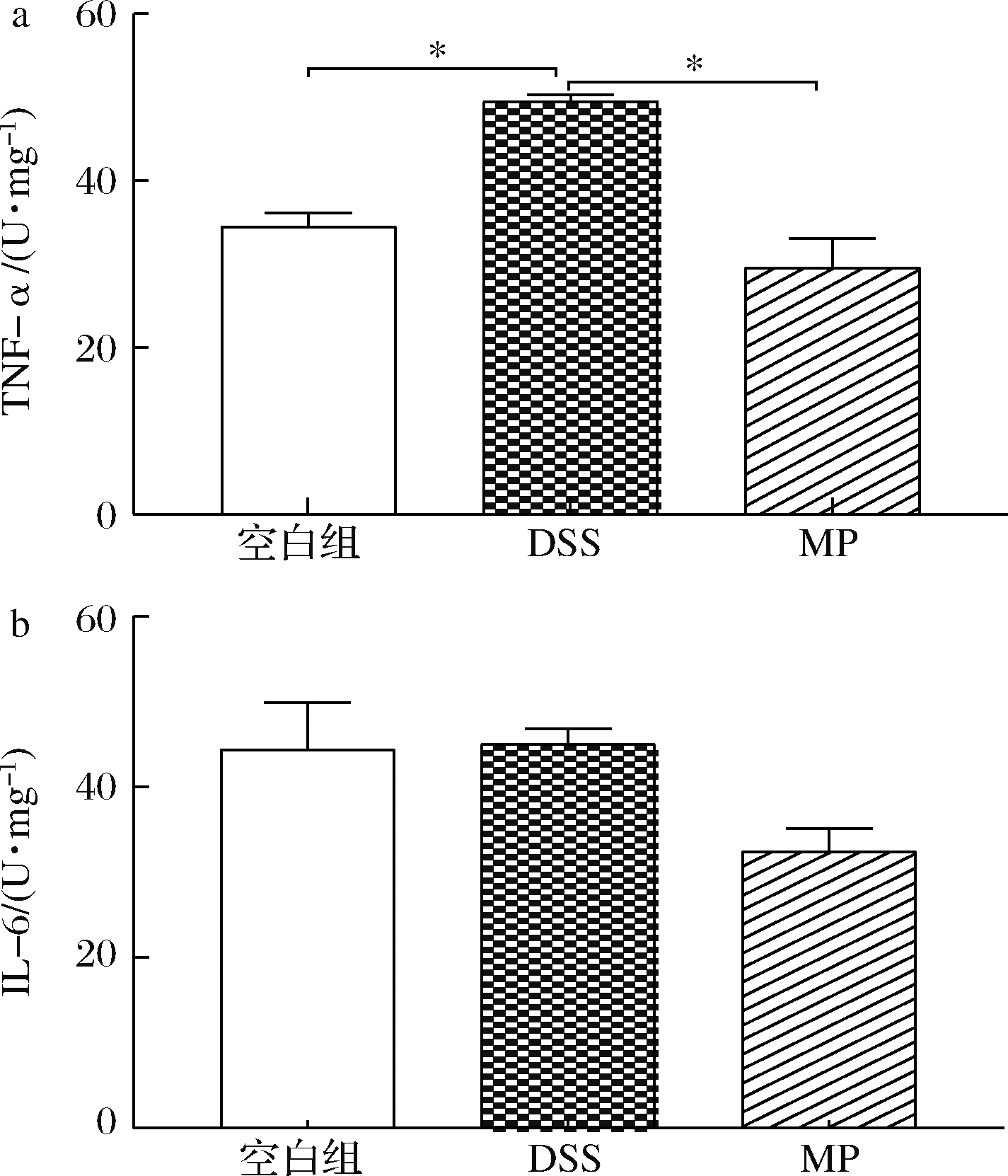
图4 MP对小鼠结肠炎症细胞因子水平TNF-α和IL-6的影响
Fig.4 Effects on the levels of TNF-α and IL-6 in the serum of mice
2.4 MP对结肠炎小鼠血清指标的影响
2.4.1 MP对结肠炎小鼠血清抗氧化水平的影响
由图5可知,与空白组相比,DSS组GSH-Px水平显著降低(P<0.01),SOD水平虽然下降但未呈现出显著性差异,而MP组与DSS组相比,血清中的GSH-Px显著升高(P<0.01),SOD则未呈现显著性差异(P>0.05)。与空白组相比,MP组的GSH-Px和SOD水平没有呈现出显著性差异(P>0.05)。从血清水平可以证明,MP在一定程度上能提高小鼠的抗氧化能力。
a-GSH-Px;b-SOD
图5 MP对小鼠血清中抗氧化水平GSH-Px和SOD的影响
Fig.5 Effect of MP on antioxidant levels of GSH-Px and SOD in mice
2.4.2 MP对结肠炎小鼠血清炎性因子水平的影响
由图6可知,与空白组相比,DSS组小鼠结肠中TNF-α水平显著升高(P<0.05),MP组小鼠TNF-α显著性下降(P<0.01),但3组的IL-6水平无显著性差异,可能是因为空白组的小鼠体重较高,而MP组的小鼠给药后预后不良。从血清水平可以证明,MP在一定程度改善了小鼠的炎症反应。

a-TNF-α;b-IL-6
图6 MP对小鼠血清中细胞因子水平TNF-α和IL-6的影响
Fig.6 Effects on the levels of TNF-α and IL-6 in the serum of mice
3 结论与讨论
从本次实验来看,MP对大鼠的日常活动、饮水进食、排便等各方面都有改善作用,与其余各组相比,模型组DAI评分明显增高(P<0.05)。分析给予DSS后一周内体重变化结果,与空白组相比,模型组体重显著性下降(P<0.05);药物组体重下降,但下降趋势未超过模型组,2组存在显著性差异(P<0.05)。通过各组实验大鼠的结肠组织HE病理切片结果,空白组结肠部分肠壁清晰,无炎性浸润,情况正常;模型组结肠部分出现十分明显的炎性浸润,肠黏膜破坏严重,炎症活动程度最重;MP组与DSS组相比,肠壁明显更完整,炎性浸润程度减轻,排列也更加清晰,说明MP可以减轻小鼠的炎症反应。
在炎性肠病中通常炎性因子TNF-α[33]、IL-6等表达会一起升高[34],表明调控这些炎症因子非常重要。通过在血清水平和结肠组织匀浆液水平测定TNF-ɑ和IL-6的表达水平,可以明显看到MP能够显著降低TNF-α和IL-6表达,这表明MP可以通过调节多种信号通路抑制促炎症细胞因子表达,对实验性结肠炎产生免疫治疗作用,保护受损结肠组织。通过在血清水平和结肠组织匀浆液测定GSH-Px和SOD的表达水平,可以看到MP能一定程度的提高GSH-Px和SOD表达,这能证明MP能增强机体抵抗氧化过激引起的损伤,提升总抗氧化能力,减轻IBD中结肠的损伤程度[35],有效改善机体的炎症受损状况,从而提高免疫力,减缓机体的结肠炎症状,对治疗炎症性疾病起到一定的治疗效果。
目前,炎症性疾病临床治疗药物主要包括糖皮质激素类和免疫抑制剂[36],两类治疗药物虽能在短时间内改善症状,但使用频率过高或周期长将会导致副作用产生,长期服用后药效不佳[21]。因此积极防治溃疡性结肠炎显得十分重要与迫切,寻求有效且无副作用或副作用低的治疗药物是一项艰巨的任务。MP具有抗炎作用,这将为防治结肠炎提供新的思路。本研究发现MP能抑制小鼠结肠炎的炎症因子表达和降低炎症因子在血清的浓度,显著减少炎症细胞的浸润和结肠组织结构的损伤,对小鼠结肠炎症能起到一定的改善作用。本研究可为预防肠炎的功能性食品或保健品开发提供理论和实验基础。
[1] 杨小冰,金明玉,吴小禾,等.膳食营养素与炎症性肠病关系研究进展[J].食品科学,2019,40(9):317-323.
YANG X B,JIN M Y,WU X H,et al.Research progress on the relationship between dietary nutrients and inflammatory bowel disease[J].Food Science,2019,40(9):317-323.
[2] 郭小芹. IL-17/IL-17R通路在炎症性肠病中的免疫调节机制研究[D].北京:中国人民解放军军事医学科学院,2013.
GUO X Q.The immunoregulatory mechanism of IL-17/IL-17R pathway in inflammatory bowel disease[D].Beijing:Chinese Academy of Military Medical Sciences,2013.
[3] 李亮成. 炎症性肠病的临床表现[J].山西医药杂志,1993(2):93-94.
LI L C.Clinical manifestations of inflammatory bowel disease[J].Shanxi Medical Journal,1993(2):93-94.
[4] 邓长生, 陈志芬.炎症性肠病的临床表现、诊断及鉴别诊断[J].实用医学杂志,2003(5):9-10.
DENG C S,CHEN Z F.Clinical manifestations,diagnosis and differential diagnosis of inflammatory bowel disease[J].The Journal of Practical Medicine,2003(5):9-10.
[5] ZSUZSANNA V,ZSUZSANNA K,PETER L L.Epidemiology of inflammatory bowel diseases from west to east[J].Journal of Digestive Diseases,2017,18(2):92-98.
[6] 兰艳. 脂多糖对葡聚糖硫酸钠所致炎症性肠病的影响及机制研究[D].武汉:华中科技大学,2012.
LAN Y.Effect of lipopolysaccharide on inflammatory bowel disease caused by dextran sodium sulfate and its mechanism[D].Wuhan:Huazhong University of Science and Technology,2012.
[7] 魏江洲, 张建鹏,刘军华,等.海螵蛸多糖CPS-1对小鼠实验性溃疡性结肠炎作用的初步观察[J].第二军医大学学报,2006,27(1):28-30.
WEI J Z,ZHANG J P,LIU J H,et al.Preliminary observation on the effect of cuttlefish polysaccharide CPS-1 on experimental ulcerative colitis in mice[J].Journal of Second Military Medical University,2006,27(1):28-30.
[8] 王百亿. 海带所含昆布多糖能防肠炎[J].世界最新医学信息文摘,2018,18(32):10.
WANG B Y.Laminaria polysaccharide contained in kelp can prevent enteritis[J].Digest of World Latest Medical Information,2018,18(32):10.
[9] 周文丽. 东海厚壳贻贝多糖的抗衰老生物学活性研究[D].上海:第二军医大学,2009.
Zhou W L.Study on the anti-aging biological activity of polysaccharides from the East China Sea mussels[D].Shanghai:Second Military Medical University,2009.
[10] 侯重文, 朱梓昂,张金华,等.高效凝胶色谱法测定贻贝多糖含量及分子量[J].中国生化药物杂志,2016,36(11):9-12.
HOU C W,ZHU Z A,ZHANG J H,et al.Determination of mussel polysaccharide content and molecular weight by high performance gel chromatography[J].Chinese Journal of Biochemical Pharmaceutics,2016,36(11):9-12.
[11] 徐红丽. 东海厚壳贻贝水溶性多糖MP-Ⅰ的结构鉴定及生物学活性研究[D].上海:第二军医大学,2007.
XU H L.Study on the structure identification and biological activity of the water-soluble polysaccharide MP-Ⅰ from the east China sea mussel mussels[D].Shanghai:Second Military Medical University,2007.
[12] 李江滨, 侯敢.翡翠贻贝多糖免疫调节作用研究[J].食品研究与开发,2009(5):10-12.
LI J B,HOU G.Study on the immunomodulatory effect of polysaccharides from emerald mussel[J].Food Research and Development,2009(5):10-12.
[13] YANG R H.Investigation on extraction of mussel juice polysaccharides and their biological activities[J].Journal of Chinese Institute of Food Science & Technology,2009 (1):13-14.
[14] 周越. 贻贝肽与贻贝多糖对衰老的干预作用及其机制[D].镇江:江苏大学,2013.
ZHOU Y.Interventional effects of mussel peptides and mussel polysaccharides on aging and its mechanism[D].Zhenjiang:Jiangsu University,2013.
[15] ZHANG H Y,LUO G H,HAO J Y,et al.Optimization of ultrasonic-assisted enzymatic extraction of polysaccharides from Cynomorium songaricum and their antitumor activity[J].Food Science,2016:895-902.
[16] WU J X,SHAO H R,ZHANG J H,et al.Mussel polysaccharide α-D-glucan (MP-A) protects against non-alcoholic fatty liver disease via maintaining the homeostasis of gut microbiota and regulating related gut-liver axis signaling pathways[J].International Journal of Biological Macromolecules,2019,130:68-78.
[17] 李孟婕, 范秀萍,吴红棉,等.翡翠贻贝粗多糖降血脂作用的研究[J].食品科学,2012,33(1):264-268.
LI M J,FAN X P,WU H M,et al.Study on the hypolipidemic effect of the crude polysaccharide of Emerald mussel[J].Food Science,2012,33(1):264-268.
[18] 姚滢.东海厚壳贻贝多糖的分离提纯和免疫学活性研究[D].上海:第二军医大学,2005.
YAO Y.Isolation,purification and immunological activity of polysaccharides from the east China sea mussels[D].Shanghai:Second Military Medical University,2005.
[19] 栾洁, 辛甜,储智勇,等.贻贝多糖对小鼠免疫功能的调节作用[J].中国海洋药物,2010(4):43-45.
LUAN J,XIN T,CHU Z Y,et al.The regulatory effect of mussel polysaccharide on the immune function of mice[J].China Marine Medicine,2010(4):43-45.
[20] ZURONG T,KAIDA X,SHUOBO L,et al.Effects of low concentrations copper on antioxidant responses,DNA damage and genotoxicity in thick shell mussel Mytilus coruscus[J].Fish & Shellfish Immunology,2018,82:77-83.
[21] 付元庆. 厚壳贻贝脂质提取物对肠道损伤、溃疡性结肠炎以及类风湿性关节炎的影响和其机理研究[D].杭州:浙江大学,2015.
FU Y Q.Study on the effect and mechanism of the lipid extract of mussel thick shell on intestinal injury,ulcerative colitis and rheumatoid arthritis[J].Hangzhou:Zhejiang University,2015.
[22] WENWEI CHEN,ZHENBAO JIA,JIAJIE ZHU,et al.Optimization of ultrasonic-assisted enzymatic extraction of polysaccharides from thick-shell mussel (Mytilus coruscus) and their antioxidant activities[J].International Journal of Biological Macromolecules,2019,140:1 116-1 125.
[23] 刘淑集, 罗钦钦,潘裕添,等.翡翠贻贝不同醇沉物体外抗氧化活性研究[J].食品与发酵工业,2017,43(6):187-192.
LIU S J,LUO Q Q,PAN Y T,et al.Study on antioxidant activity in different alcohol precipitation of emerald mussel[J].Food and Fermentation Industries,2017,43(6):187-192.
[24] ROBIN G L,VANCE J M,CHARLES O E.Animal models of intestinal inflammation:Ineffective communication between coalition members[J].Springer Seminars in Immunopathology,2005,27(2):233-247.
[25] PODOLSKY D K,XAVIER R J.Unravelling the pathogenesis of infIammatory bowel disease[J].Nature Protocols,2007,448(7 152):427-434.
[26] YAN H,ZHAO J M,XIN G,et al.Effect of warming moxibustion on P2RX_7 regulation in tianshu acupoint skin of rats with ulcerative colitis[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2016(6),245.
[27] STEFAN W,VANESSA P,MARKUS K,et al.Chemically induced mouse models of acute and chronic intestinal inflammation[J].Nature Protocols,2017,12(7):1 295-1 309.
[28] 徐丽红, 肖芳,兰小琴,等.葡聚糖硫酸钠诱导C57BL/6 J小鼠急性结肠炎模型的建立与评价[J].医学研究生学报,2014,27(9):918-922.
XU L H,XIAO F,LAN X Q,et al.Establishment and evaluation of acute colitis model in C57BL/6 J mice induced by dextran sodium sulfate[J].Journal of Medical Postgraduates,2014,27(9):918-922.
[29] TOIYAMA Y,MIKI C,INOUE Y,et al.Evaluation of an inflammation-based prognostic score for the identification of patients requiring postoperative adjuvant chemotherapy for stage II colorectal cancer[J].Experimental & Therapeutic Medicine,2011,2(1):95-101.
[30] 曾江宁, 彭玲,黄伟,等.厚壳贻贝抗氧化酶活性和脂质过氧化物含量对Cd和Aroclor1254胁迫的响应[J].生态学杂志,2015,34(3):718-726.
ZENG J N,PENG L,HUANG W,et al.Antioxidant enzyme activity and lipid peroxidation content of mussel thick shell in response to Cd and aroclor 1254 stress[J].Chinese Journal of Ecology,2015,34(3):718-726.
[31] LI Q,XIONG C,CHEN C,et al.Neuroprotective effect of crude polysaccharide isolated from the fruiting bodies of Morchella importuna against H2O2-induced PC12 cell cytotoxicity by reducing oxidative stress[J].Biomedicine & Pharmacotherapy,2016,83:569-576.
[32] 浦江, 王少鑫,刘超群,等.炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义[J].胃肠病学和肝病学杂志,2015,3:104-106.
PU J,WANG S X,LIU C Q,et al.Expression and clinical significance of inflammatory factors TNF-α,IL-6 and IL-4 in ulcerative colitis[J].Stomach Journal of Enterology and Hepatology,2015,3:104-106.
[33] WU X X,GUO W J,WU L M,et al.Selective sequestration of STAT1 in the cytop lasm via phosphorylated SHP-2 amel iorates murine exper imental colitis[J].Journal of Immunology,2019,189(7):3 497-3 507.
[34] KRETZMANN N A,FILLMANNH H,JOSÉ L M,et al.Effects of glutamine on proinflannatory gene expression and activation of nuclear factor kappa B and signal transducers and activators of transcription in TNBS-induced colitis[J].Inflammatory Bowel Diseases,2010,14(11):1 504-1 513.
[35] LIU Y,DU Y Q,WANG J H,et al.Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J].International Journal of Biological Macromolecules,2014(64):63-68.
[36] 蔡洁珠,陈宁.炎症性肠病治疗的实验室监测[J].中华检验医学杂志,2018,41(10):781-783.
CAI J Z,CHEN N.Laboratory monitoring for the treatment of inflammatory bowel disease[J].Chinese Journal of Laboratory Medicine,2018,41(10):781-783.