油橄榄(Olea europaea L.),属于木犀科(Oleaceae)木犀榄属品种之一,富含各种营养物质,为亚热带常绿乔木,主要分布在地中海沿岸地区。油橄榄距今已有4 000多年的栽培历史,20世纪中期,我国开始进行油橄榄的引种栽培,主要种植于湖北、云南、甘肃、四川等地区。据统计我国已种植油橄榄5.3万 hm2[1],油橄榄总资源超过170余份[2]。在地中海国家,橄榄叶的“煎服”常作为民间用药[3],研究证明油橄榄叶提取物可增加动脉血液流速[4],具有降血糖、抗氧化、降血压、抗微生物等作用[5],且油橄榄叶中的抗氧化活性物质含量比油橄榄果、茎和树皮都高[6]。橄榄叶主要含有橄榄苦苷、多酚和黄酮等活性物质[7]。王洁等[8]对橄榄叶中常见功效成分的作用机制进行了总结,橄榄叶中的活性物质可抑制胆固醇的生物合成、肠道吸收,并促进胆汁酸粪便排泄,从而降低胆固醇的水平,对高血脂的治疗具有重要意义。
高血脂是由于血液中高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)含量偏低,总胆固醇(total cholesterol, TCHO)和甘油三酯(triglyceride, TG)含量偏高引起的血脂异常疾病。研究表明,高血脂会加速动脉粥样硬化,从而引起糖尿病、高血压等诸多疾病,其中动脉粥样硬化是心脑血管疾病发病的主要原因[9-10]。高血脂症患者同时患冠心病、心肌梗死和猝死的几率均比正常人高[11]。据统计,全世界范围内每年死于高血脂症及相关疾病的总人数约为1 800万。相关研究表明,将有更多的人死于这类心血管疾病,且心血管疾病已经成为导致死亡的首要疾病[12]。临床医学表明,高血脂、高血压等疾病通过药物治疗效果不甚理想,且对人体有一定的副作用,而通过天然膳食调节的效果更佳。橄榄叶提取物能天然降压,清理血管,降低胆固醇,且没有严重的毒副作用,是天然的降脂植物。因此,橄榄叶提取物降血脂的研究对高血压、高血脂以及糖尿病并发症的防治具有一定意义,在保健功能产品开发领域具有较好的市场价值和发展前景。
1 材料与方法
1.1 实验动物、材料、试剂
4~6周龄的无特定病原体(specific pathogen free, SPF)雄性昆明小鼠60只,由重庆腾鑫生物技术有限公司提供,饲养于SPF级动物房。实验小鼠同室分笼,分装为5笼,每笼6只,室温控制在(23±2)℃,湿度适中。经学院伦理委员会审查,所选择的动物品种、等级、数量、规格合适。实验中善待动物,给予麻醉和镇痛处理,实验后给予安乐死,死后动物无害化处理,没有对环境带来危害,实验符合动物实验研究伦理标准。
皮瓜尔橄榄叶、鄂植8号橄榄叶,重庆江源油橄榄开发有限公司基地。普通饲料:主要含鸡肉、鱼粉、豆粕、麸皮、玉米、面粉等;高脂饲料:含18%(质量分数,下同)脂肪、25%蛋白质、1%胆固醇、0.2%牛胆盐,南京盛民科研动物养殖场。
TG试剂盒、TCHO试剂盒、HDL-C试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)试剂盒,南京建成生物工程研究所;其余试剂为国产分析纯级。
1.2 仪器和设备
LUX多功能性酶标仪,美国Thermo Fisher Scientific公司;R1002VN旋转蒸发仪,郑州长城科工贸有限公司;ICEN-24R高速冷冻离心机,杭州奥盛仪器有限公司;BX43生物显微镜,日本奥林巴斯公司;多孔恒温水浴锅,郑州长城科工有限公司;过滤装置(漏斗与滤瓶);粉碎机,天津泰斯特仪器有限公司。
1.3 实验方法
1.3.1 灌胃物质
取橄榄叶100 g,置于粉碎机中粉碎成粉末状。分别在称取15、30、45 g橄榄叶粉末于烧杯中,加入200 mL蒸馏水(粉末均匀分散于水中,不呈现块状或糊状),置于85 ℃的水浴锅中充分水浴50 min。取出过滤(若残渣过多,考虑抽滤)。将滤液放于烧杯中后转移至500 mL圆底烧瓶中进行旋转蒸发,蒸发至100 mL(烧瓶中无沉淀物析出)。最终分别制得质量浓度为150、300、450 g/L的皮瓜尔油橄榄叶(Picual olive leaves, POL)和鄂植8号油橄榄叶(E planting No.8 olive leaves, EP8OL)提取物为灌胃物质。
1.3.2 诱导高脂小鼠模型
小鼠随机分为普通组和高脂饲料组,饲喂普通饲料一周以适应环境。普通组以普通饲料为食,高脂饲料组参考文献[13-14]对小鼠高血脂体诱导的研究为模型,借鉴文献[15-16]对的高脂饲料成分进行配比,喂食28 d得到实验所需的高脂体小鼠模型。
1.3.3 实验分组与灌胃
以健康小鼠为空白组(普通饲料+自来水),模型小鼠分为对照组(高脂饲料+蒸馏水)、橄榄叶提取物低剂量组(高脂饲料+150 g/L提取物)、橄榄叶提取物中剂量组(高脂饲料+300 g/L提取物)、橄榄叶提取物高剂量组(高脂饲料+450 g/L提取物);每日灌胃量为0.2 mL,灌胃周期为4周,灌胃期间均用普通饲料投食,每周对小鼠进行1次称重并记录。
1.3.4 实验小鼠取材
灌胃结束后,将小鼠绝食(不断水)24 h,并进行解剖前称重,对小鼠经摘眼球取血后,将小鼠处死解剖,将全部解剖完的小鼠尸体进行集中无害化处理[17]。血液用2 mL离心管收集,在1 000 r/min条件下离心10 min,分离血清,并立即放于4 ℃冰箱冷冻保存,用于后续测定血清中TCHO、TG、HDL-C、LDL-C含量;取出小鼠肝脏,剪下一小部分装入含有体积分数10%福尔马林溶液的2 mL离心管中,于4 ℃冰箱冷藏保存,用于后续制作苏木精—伊红(hematoxylin-eosin,HE)染色切片。
1.3.5 血清生化指标测定
将小鼠已离心好的血清全部解冻,TCHO、TG、HDL-C、LDL-C按照试剂盒说明书进行测定。
96孔板注射方法:取一个洁净的96孔板,将其标注为空白孔、标准孔、样本孔,用10 μL移液枪吸取蒸馏水注入96孔板的前3个孔作为空白孔,每个孔2.5 μL;在空白孔后3个孔每孔注入2.5 μL校准品作为标准孔;其余为样本孔,样本孔为实验组的5组样品。滴加顺序依次为空白组、低浓度组(150 g/L%)、中浓度组(300 g/L)、高浓度组(450 g/L)和对照组,每组5个样品,每个样品滴加3个孔,做平行试验,每个孔注入样品2.5 μL。
1.3.6 肝组织病理学观察
取出肝脏组织,按照固定→脱水→浸蜡→包埋→切片→脱蜡→复水→染色→烘干→封片→观察的步骤进行制片,于40×10倍的电子显微镜下,观察小鼠肝脏切片的组织细胞(主要观察主动脉周围),对小鼠肝脏病理学形态进行分析。剩余的组织存于自封袋,于-80 ℃保存。
1.4 数据统计
实验数据全部来自于3次以上独立实验结果的平均值,数据结果以平均值±标准差表示,使用Origin 软件作图。采用SPSS进行单因素方差分析, P<0.05认为存在显著性差异。
2 结果与分析
2.1 橄榄叶提取物对小鼠体质量的影响
体质量是一项可以衡量人和动物肥胖的指标,而肥胖是影响心血管疾病的重要危险因素[18],是诱发心血管疾病的主要原因[19],肥胖与甘油三酯水平增加、HDL-C水平减少密切相关[20]。因此,在控制体质量的同时也能控制血清中胆固醇的水平,降低血脂水平,减少心血管疾病的发生。研究表明,油橄榄叶直接喂食反刍动物,可使瘤胃细菌合成蛋白质量增加[21]。
由图1可知,经灌胃处理后,与高脂对照组相比,2组小鼠的体质量增长速度明显降低,随着提取物浓度的增加效果越明显。经EP8OL灌胃的小鼠在1~3周的体质量无明显差异,第3周体质量呈现显著下降趋势;经POL灌胃的小鼠在灌胃期内体质量显著低于对照组,从第2周开始实验组的体质量增长趋于平缓。

图1 鄂植8号橄榄叶(a)、皮瓜尔橄榄叶(b)提取物对
小鼠体质量变化的影响
Fig.1 Effect of EP8OL (a) and POL (b) on body mass of mice
实验表明,EP8OL和POL提取物均对高脂小鼠的体质量增长具有抑制作用,各剂量组的抑制效果一致,其中EP8OL对降低小鼠体质量的作用效果明显。
2.2 橄榄叶提取物对小鼠血脂指标的影响
小鼠经饲喂高脂饲料后,血清中总胆固醇含量上升显著,甘油三酯、LDL-C含量上升,HDL-C含量下降。说明饲喂高脂饲料后,小鼠脂类代谢失调,血清中的胆固醇水平升高,产生高脂血症。经橄榄叶提取物灌胃后,小鼠血脂显著降低,肝脏脂肪样变减少,组织损伤减低。POUDYAL等[22]发现橄榄叶提取物降糖、降血脂作用与其较强的抗氧化能力有关,其机制可能与其改善肝脏氧化应激水平有关[23]。
2.2.1 血清中总胆固醇含量
人体胆固醇约2/3由肝脏进行内源性合成。在肝细胞中,通过HMG-CoA还原酶途径,在细胞内形成胆固醇。正常情况下,细胞内过多的胆固醇会外流[24]。若外流机制受损,胆固醇就会在细胞内蓄积,导致人体内的脂类代谢失调,血清中的胆固醇水平就会升高,从而产生高脂血症。
根据图2可知,空白组小鼠中总胆固醇含量最低。与对照组相比,低剂量组降低胆固醇含量效果最佳,效果与浓度呈负相关,说明提取物的浓度过高并不利于降低胆固醇。2种灌胃物质在抑制小鼠体内的总胆固醇水平的作用效果相似。
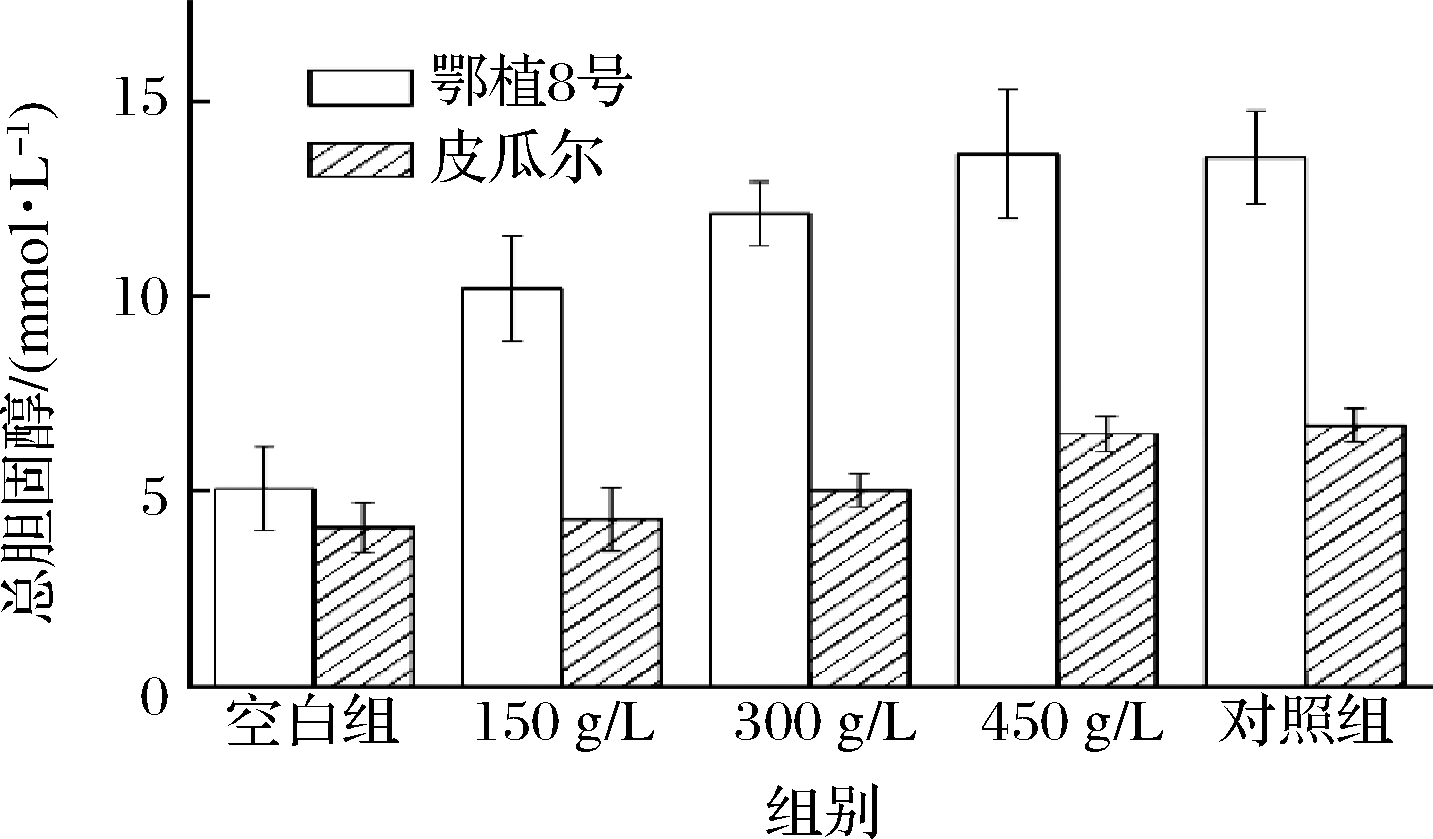
图2 橄榄叶提取物灌胃后小鼠总胆固醇水平
Fig.2 Total cholesterol level in mice after gavage of olive leaf extract
实验表明,小鼠体内总胆固醇含量:低浓度组<中浓度组<高浓度组<对照组,说明降低高脂小鼠胆固醇含量效果最佳的是150 g/L橄榄叶提取物,其中POL降低小鼠体内胆固醇水平更稳定,EP8OL提取物灌胃后小鼠血清胆固醇含量是POL提取物的数倍,说明体内胆固醇的蓄积还可能与小鼠自身体质、消化吸收有关。
2.2.2 血清中甘油三酯含量
“甘油三酯”又称脂肪,是由食物脂肪与肝脏合成的,由长链脂肪酸和甘油形成,是血脂检查中比较重要的一项指标。轻度甘油三酯增高,可能是糖类食物摄入过多、吸烟、肥胖等因素引起,重度的高甘油三酯,多与糖尿病、肝病、慢性肾炎等有关。研究表明,高甘油三酯可引起细胞内质网应激反应[25],增加胞内Ca+浓度,导致高甘油三酯血症性胰腺炎[26]。
由图3可知,各浓度组的甘油三酯含量均低于对照组,说明油橄榄叶提取物能有效降低小鼠的甘油三酯含量,中浓度组的降低效果最佳,但各浓度组降低效果无显著差异,小鼠体内甘油三酯含量:中浓度组<低浓度组<高浓度组。与正常小鼠(空白组)相比,EP8OL高剂量和中剂量组小鼠甘油三酯含量更低,而POL剂量组小鼠的甘油三酯含量均高于空白组,说明同一剂量浓度下,EP8OL降低小鼠体内甘油三酯含量效果更好。

图3 橄榄叶提取物灌胃后小鼠甘油三酯含量
Fig.3 Average contents of triglyceride in mice after gavage of olive leaf extract
2种提取物均能降低高脂小鼠甘油三酯含量,随灌胃物质浓度的升高,甘油三酯含量呈现先降低后升高的趋势,但POL提取物灌胃组的小鼠体内甘油三酯含量波动更大,而EP8OL组小鼠体内的甘油三酯含量较平稳。
2.2.3 血清中HDL-C含量
高密度脂蛋白胆固醇可通俗地理解为“好”胆固醇,血浆脂蛋白中,HDL具有抗炎性反应作用[27],可减少主动脉壁VCAM-1、ICAM-1的表达[28],减少代谢性内毒素血症[29]。可抗动脉粥样硬化,调节血脂水平,减少患冠状动脉心脏病的危险。
根据图4可知,HDL-C含量空白组高于对照组和实验组,说明高脂饮食能影响小鼠体内的高密度蛋白胆固醇水平。2组小鼠中空白组与对照组的HDL-C含量差值为0.1~0.11 mmol/L;3个浓度组与对照组间对比可得,一定浓度的橄榄叶提取物有利于提升HDL-C的含量,但提升并不显著,且在同一浓度下2种灌胃物质对小鼠体内HDL-C含量的影响波动范围均在0.2 mmol/L。

图4 橄榄叶提取物灌胃后小鼠HDL-C含量
Fig.4 HDL-C content in mice after gavage of olive leaf extract
2类物质在稳定HDL-C含量的最佳浓度不同,且HDL-C水平各组间比较平稳。因此,EP8OL和POL对于小鼠体内HDL-C的血脂水平作用效果一致。
2.2.4 血清中LDL-C含量
人或动物体内的LDL-C主要负责把胆固醇从肝脏运送到各个组织,再由高密度脂蛋白将各处的胆固醇送回肝脏代谢[30]。但当低密度脂蛋白过量时,由它携带的胆固醇便积存在动脉壁上,容易引起动脉硬化,影响血脂水平,引发心血管疾病[31]。
根据图5,鄂植8号组的正常小鼠LDL-C含量明显高于实验组、略低于对照组,实验组明显低于对照组,说明EP8OL提取物能显著降低小鼠体内的LDL-C含量,其中油橄榄提取物浓度对小鼠体内LDL-C水平影响不大,中浓度组小鼠LDL-C含量最低;POL实验组明显低于对照组,说明POL能有效降低高脂小鼠的LDL-C含量,其中高浓度组小鼠LDL-C含量最低。实验表明,橄榄叶提取物能有效降低小鼠体内LDL-C水平,EP8OL作用效果更佳,能将小鼠体内LDL-C水平降低至正常小鼠以下。因此,降脂效果与小鼠个体体质、橄榄叶品种、提取物浓度有关。

图5 橄榄叶提取物灌胃后小鼠LDL-C含量
Fig.5 LDL-C content in mice after gavage of olive leaf extract
2.2.5 橄榄叶提取物对小鼠肝组织病理学变化的影响
肝脏是脂肪摄取、氧化、脂肪酸代谢、胆固醇、磷脂和脂蛋白的合成和分泌的重要器官,正常状态下,脂类代谢在肝脏中保持着动态平衡。当摄入脂质过多时,会引起脂代谢紊乱,大量脂肪从脂库中出来,大部分进入肝细胞。肝内脂肪的增加超过了肝细胞将其氧化利用和合成脂蛋白运输出去的能力,则使肝细胞脂肪沉积及肝细胞变性,形成脂肪肝[32-33]。DAY[34]提出的“二次打击”学说以脂质代谢异常、脂质过氧化等被广泛接受。研究表明,油橄榄叶除具有抗氧化、抗菌、降脂作用外,对铅中毒的小鼠各项脏器指标具有改善作用[35]。因此,橄榄叶提取物对小鼠肝组织的病变也具有一定的改善、调节作用。
由图6可知,两大组的空白组小鼠肝脏细胞排列整齐、紧密,形态正常,细胞以中心经脉为中心呈散发状分布。对照组肝细胞排列杂乱无序、松散,中心经脉周围细胞排列杂乱,细胞界限不明显,细胞间隙较大,肝损伤严重。进行橄榄叶提取物营养干预后,低浓度组肝细胞排列较为紊乱,比较松弛,细胞核大小不一,细胞界限较为明显,低浓度组肝细胞形态总体优于对照组。300 g/L中浓度组肝细胞排列有序,比较紧密,细胞间隙比较明显,中心静脉周围的细胞呈较有规律地排列,细胞呈有规律的散发状分布,肝细胞总体形态有所缓解。高浓度组肝细胞形态与空白组小鼠肝细胞形态更相近,排列相对规整。实验表明EP8OL可以有效缓解小鼠肝细胞损伤。2组空白组小鼠的肝脏均未受到损伤,经灌胃后,2组小鼠的肝病变程度均随着提取物浓度的增强而变小,说明了较高浓度的橄榄叶提取物对小鼠肝损伤病变有良好的治疗作用,也对高血脂小鼠的肝脏病变有明显的抑制和调节作用[36-37]。

1-空白组;2-对照组;3-低浓度组;4-中浓度组;5-高浓度组
图6 鄂植8号橄榄叶(a)、皮瓜尔橄榄叶(b)提取物对小鼠
肝组织病理学变化的影响
Fig.6 Effect of EP8OL (a) and POL (b) extracts on liver histopathology in mice
3 结论
本实验中2种橄榄叶提取物对模型小鼠体质量控制具有较好的效果,EP8OL提取物降低小鼠体质量的效果明显,POL提取物也能有效地抑制小鼠体质量的增长速率。
2种橄榄叶提取物均能降低模型小鼠总胆固醇、甘油三酯、LDL-C的水平,并能提高小鼠HLD-C的含量,使实验小鼠血清指标趋于正常水平,起到调节血脂的作用,其降脂效果相似,总体效果趋于一致。但2种橄榄叶提取物降低总胆固醇、甘油三酯、LDL-C水平,升高HDL-C水平的最佳浓度不同。2种橄榄叶提取物能降低高脂饮食对实验小鼠肝脏组织的损伤,随提取物浓度的增加,作用效果越显著。因此,橄榄叶能抑制高脂模型小鼠的肝脏病变,起到调节肝损伤的作用。
[1] 程子彰,贺靖舒,占明明,等.油橄榄果生长与成熟过程中油脂的合成[J].林业科学,2014,50(5):123-131.
CHEN Z Z,HE J S,ZHAN M M,et al.Synthesis of olive oil during olive development and ripening[J].Scientia Silvae Sinicae,2014,50(5):123-131.
[2] 韩华柏,何方.我国油橄榄引种研究进展[J].中国南方果树,2007,36(3):37-42.
HAN H B,HE F.Research progress of olive introduction in China[J].South China Fruits,2007,36(3):37-42.
[3] GONZALEZ M,ZARZUELO A,GAMEZ M J,et al.Hypoglycemic activity of olive leaf[J].Planta Med,1992,58(6):513-551.
[4] ZARZUELO A.Vasodilator effect of olive leaf[J].Planta Medica,1991,57:417-419.
[5] SAVOURNIN C,BAGHDIKIAN B,ELIAS R,et al.Rapid HPLC analysis for the quantitative determination of oleuropein in Olea europaea leaves[J].Journal of Agricultural and Food Chemistry,2001,49(2):618-621.
[6] CAMPOS M S,LOPEZ-ALIAGA I,ARRIONUEVO M B,et al.Nutritive utilization of calcium in rats:Effects of dietary fat components and vitamin D3 on intestinal resected rats[J].Journal of Nutritional Science and Vitaminolog,1989,35:511-521.
[7] 高彩霞.油橄榄叶抗氧化物有效成分及其含量变化规律研究[D].北京:中国林业科学研究院,2007.
GAO C X.Study of effective component of antioxidant in olive leaves and the content changes[D].Beijing:Chinese Academy of Forestry,2007.
[8] 王洁,王志江,陈继承,等.天然食物中降血脂营养药物研究进展[J].食品科技,2014,39(8):75-82.
WANG J,WANG Z J,CHEN J C.et al.Research progress on hypolipidemic nutraceuticals from natural foods[J].Food Science and Technology,2014,39(8):75-82.
[9] 夏峰.浅析高血脂可诱发多种疾病对人体的危害[J].医学信息,2011,24(9):4 341-4 342.
XIA F.A brief analysis on harm of human body with high blood fat[J].Medical Information,2011,24(9):4 341-4 342.
[10] United Nations,Department of Economic and Social Affairs,Population Division (2013).World population ageing[Z].2013.ST/ESA/SER.A/348.
[11] 崔兰玲.浅谈高血脂症的危害及中医预防[J].西部中医药,2012,25(12):101-102.
CUI L L.The damage of hyperlipidemia and its prevention with TCM[J].Western Journal of Traditional Chinese Medicine,2012,25(12):101-102.
[12] MATHERS D,LONCAR D.Updated projections of global mortality and burden of disease,2 002-2030:Data sources,methods and results[R].Geneva:World Health Organization,2005.
[13] 梁红峰,陈方.高脂血症模型小鼠生化指标的变化[J].广东微量元素科学,2004,11(4):42-44.
LIANG H F,CHEN F.Changes of biochemical indexes in hyperlipidemia model mice[J].Guangdong Trace Elements Science,2004,11(4):42-44.
[14] 张少芬,陈方,吴铁,等.长期脂肪乳剂灌胃致小鼠高脂血症模型的研究[J].广东医学院学报,2004,22(4):328-330.
ZHANG S F,CHEN F,WU T,et al.Establishment of hyperlipemic mouse model by long-term gastric perfusion of intralipid[J].Journal of Guangdong Medical College,2004,22(4):328-330.
[15] 高莹,李可基,唐世英,等.几种高脂血症动物模型的比较[J].中西医结合,2004,2(2):97-99.
GAO Y,LI K J,TANG S Y,et al.Comparison of animal models of hyperlipidemia[J].Journal of China Integr Med,2004,2(2):97-99.
[16] 肖荣,张喜忠,李秀花,等.食物中可溶性纤维对大鼠脂质水平的影响[J].中国公共卫生学报,1995,14(1):23-26.
XIAO R,ZHANG X Z,LI X H,et al.Effect of soluble-fiber on lipoprotein and lipid levels in rats fed high cholesterol containing diets[J].Chinese Journal of Public Health,1995,14(1):23-26.
[17] 周艺.刺梨茶对实验小鼠降血糖、血脂及抗氧化作用研究[D]贵阳:贵州大学,2017.
ZHOU Y.The study on the hypoglycemic and hypolipidemic and antioxidant activity effect from the tea of Rosa roxbugrhii Tratt[D].Guiyang:Guizhou University,2017.
[18] National Heart,Lung,and Blood Institute.Clinical guidelines on the identification,evaluation and treatment of overweight and obesity in adults:The evidence report[J].Obes Res,1998,6(suppl):51S-209S
[19] National Task Force on the Prevention and Treatment of Obesity.Overweight,obesity,and health risk[J].Arch Intern Med,2000,160:898-904
[20] 王黎一.个体化的生活习惯干预对超重、高血压、高血脂和高血糖治疗的有效性[D]石家庄:河北医科大学,2014.
WANG L Y.Efficacy of individualized lifestyle intervention in the treatment of overweight,hypertension,hyperlipidemia and hyperglycemia[D].Shijiazhuang:Hebei Medical University,2014.
[21] MOLINA-ALCAIDE E,YANEZ RUIZ D R.Potential use of olive by-products in ruminant feeding:A review[J].Animal Feed Science and Technology,2008,147:247-264.
[22] POUDYAL H,CAMPBELL F,BROWN L.Olive leaf extract attenuates cardiac,hepatic,and metabolic changes in high carbohydrate-,high fat-fed rats[J].J Nutr,2010,140(5):946-953.
[23] JEMAI H,EL F A,SAYADI S.Antidiabetic and antioxidant effects of hydroxytyrosol and oleuropein from olive leaves in alloxan-diabetic rats[J].Journal of Agricculture and Food Chemistry,2009,57(19):8 798-8 804.
[24] LI A C,GLASS C K.The macrophage foam cell as a target for therapeutic intervention[J].Nat Med,2002,8(11):1 235-1 242.
[25] 常仁杰.MLCK在实验性高甘油三血症性胰腺炎胰腺导管上皮细胞中作用的初步研究[D]南宁:广西医科大学,2018.
CHANG R J.Preliminary study on the role of MLCK in pancreatic ductal epithelial cells in experimental hypertriglyceridemia pancreatitis[D].Nanning:Guangxi Medical University,2018.
[26] PEDRAGOSA A,MERINO J,ARANDAJ L,et al.Clinical profile of patients with very high hypertriglyceridemia from the registry of hypertriglyceridemia of the Spanish Atherosclerosis Society[J].Clin Investig Arterioscler,2013,25(1):8-15.
[27] 崔莹雪.艾灸及艾烟对ApoE-/-小鼠动脉粥样硬化胆固醇代谢和炎性反应的影响[D].北京:北京中医药大学,2014.
CUI Y X.Effects of moxibustion and moxa on cholesterol metabolism and inflammatory response of ApoE-/-mice atherosclerosis[D].Beijing:Beijing University of Chinese Medicine,2014.
[28] PATEL S,DI BARTOLO B A,NAKHLA S,et al.Anti-inflammatory effects of apolipoprotein A-I in the rabbit[J].Atherosclerosis,2010,212(2):392-397.
[29] CAI L,WANG Z,MEYER J M,et al.Macrophage SR-BI regulates LPS induced pro-inflammatory signaling in mice and isolated macrophages[J].J Lipid Res,2012,53(8):1 472-1 481.
[30] 谷双清.高密度脂蛋白与低密度脂蛋白与2型糖尿病的相关性研究[J].中外医疗,2012,31(5):58-59.
GU S Q.Study on the correlation between high-density lipoprotein and low-density lipoprotein and type 2 diabetes mellitus[J].China & Foreign Medical Treatment,2012,31(5):58-59.
[31] RUNDALL TG,SHORTELL SM,WANG MC,et al.As good as it gets chronic care management in nine leading US physician organizations[J].BMJ,2002,325:958-961.
[32] 常全娥,赵立,苟萍.大蒜活性物质对高血脂小鼠肝细胞的影响[J].新疆大学学报(自然科学版),2013,30(2):224-228.
CHANG Q E,ZHAO L,GOU P.The effects of garlic active substances on hepatocytes of hyperlipemia mouse[J].Journal of Xinjiang University(Natural Science Edition),2013,30(2):224-228.
[33] HORTON J D,GOLDSTEIN J L,BROEN MS.Activators of the complete program of cholesterol and fatty acid synthesis in the liver[J].Journal of Clinical Investigation,2002,109(9):1 125-1 131.
[34] DAY C P.Non-alcoholic fatty liver disease:A massive problem[J].Clin Mcd,2011,11:176-178.
[35] JAPON-LUJAN R,LUQUE-RODRIGUAZ J,LUQUE M.Dynamic ultrasound-assisted extraction of oleuropein and related biophenols from olive leaves[J].Journal of Chromatography A,2006,1 108(1):76-82.
[36] 冯春红.四种油脂组合对小鼠肝脏抗氧化能力和肾功能的影响[D].长沙:湖南农业大学,2015.
FENG C H.The effects of four grease composition on the liver antioxidant capacity and renal function in mice[D].Changsha:Hunan Agricultural University,2015.
[37] 杨雪晗,杨波,车金营,等.复方五味子保健茶对大鼠高脂血症的降脂作用[J].吉林医药学院学报,2019,40(2):89-92.
YANG X H,YANG B,CHE J Y,et al.Hypolipidemic effect of Co Schisandra health tea on rats with hyperlipidemia[J].Journal of Jilin Medical University,2019,40(2):89-92.