作为三大产能物质的蛋白质、脂肪和碳水化合物在人体代谢过程中是相互联系、彼此影响的,当减少其中一种能量物质的摄入时,机体必须通过摄入其他两种能量物质获得热量补充[1]。无论哪种产能物质,当摄入量超过机体的正常消耗量时,多余的能量就会转化成脂肪储存在体内,可能导致肥胖,同时引起心脑血管疾病、Ⅱ型糖尿病以及消化系统疾病等多种慢性疾病[2]。目前,通过高蛋白饮食代替高脂肪或高碳水化合物饮食逐渐成为膳食减重策略之一,然而,长期的高蛋白饮食会导致肝脏和血清中甘油三酯含量增加[3-4]。因此,有必要通过抑制多余蛋白质的消化吸收来降低过度摄入高蛋白造成的不良影响。
胃蛋白酶和胰蛋白酶在蛋白质的消化吸收过程中占主导地位,因此常作为目标酶去探究小分子化合物对蛋白质消化吸收的影响。LIU等[5]以消化蛋白酶为目标酶研究了儿茶素对乳蛋白生物活性和生物利用度的影响;WANG等[6]研究发现,苦丁茶叶中的苯丙素苷粗提物通过改变胃蛋白酶、胰蛋白酶和α-糜蛋白酶的极性和结构抑制酶的活性。实验室前期研究发现,金花茶花提取物对胰腺脂肪酶、胆固醇酶、α-淀粉酶和α-葡萄糖苷酶都具有潜在的活性抑制,且能有效的降低餐后血糖和脂肪的摄入[7-8],但金花茶花浸提物对蛋白质消化酶(胃蛋白酶和胰蛋白酶)活性的影响研究尚未见报道。本文探究了金花茶花浸提物对消化蛋白酶活性的影响及其机制,以期为金花茶花的科学开发和应用提供理论基础。
1 材料与方法
1.1 材料与试剂
金花茶花,广西防城港市嫦龙金花茶种植园圃。
胃蛋白酶(猪胃黏膜)、茶多酚(tea polyphenol, TP)、Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐(Na-benzoyl-DL-arginine-4-nitroanilidehydrochloride, BAPNA)、1 mol/L福林酚,上海源叶生物科技有限公司;胰蛋白酶(猪胰脏)、三氯乙酸,上海阿拉丁生化科技股份有限公司;三(羟甲基)氨基甲烷(Tris),上海麦克林生化科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
N-1100V-W全自动旋转蒸发仪,东京理化器械株式会社;FDU-1100 冷冻干燥机,东京理化器械株式会社;Cary 100紫外可见分光光度计,美国安捷伦公司;Varioskan Flash 多功能酶标仪,美国赛默飞世尔科技公司;RF-5301PC 荧光光谱仪,德国BRUKER光谱仪器公司;Chirascan 圆二色光谱仪,英国应用光物理公司等。
1.3 实验方法
1.3.1 金花茶花浸提物的制备
金花茶花浸提物分为乙醇提物(Camellia nitidissima Chi flower ethanol extract,CNEE)和水提物(Camellia nitidissima Chi flower aqueous extract,CNAE),参考ZHANG等[8]的方法,并稍作修改。乙醇提物提取条件:称取100 g粉碎后的金花茶花并按照料液比1∶25(g∶mL)加入2.5 L 体积分数为50%的乙醇,在55 ℃下浸提5 h,8 000 r/min离心30 min后收集浸提液,重复浸提2次,混合,在37 ℃下旋转蒸发浓缩并冷冻干燥得到醇粗提物。水提物提取条件:称取100 g金花茶花粉末,按料液比1∶30(g∶mL)加入3 L蒸馏水,在90 ℃下浸提2 h,后续操作与醇粗提物相同,得到水粗提物。用XAD1600大孔树脂纯化粗提物,分别收集醇提物和水提物洗脱液,然后经旋转浓缩和冷冻干燥后获得了CNEE和CNAE用于后续实验。
1.3.2 抑制率实验
胃蛋白酶的抑制实验参考ZENG等[9]的方法并稍作修改。不同浓度的金花茶花提取物与胃蛋白酶在37 ℃反应30 min,加入牛血红蛋白继续反应10 min,再加入适量三氯乙酸,以12 000 r/min离心10 min,收集沉淀用碱性铜溶液溶解,并加入福林酚溶液进行显色反应,测A650 nm值。
胰蛋白酶的抑制实验参考FENG等[10]方法并做修改。不同浓度的金花茶花提取物与胰蛋白酶在37 ℃下反应30 min,再加入BAPNA溶液,反应10 min后,加入适量的三氯乙酸终止反应,测定A410nm值。胃蛋白酶和胰蛋白酶的抑制率计算如公式(1)所示:
胃蛋白酶和胰蛋白酶抑制率/%=
(1)
1.3.3 抑制动力学研究
参考WANG等[6]的方法对胃蛋白酶和胰蛋白酶抑制动力学进行探究。
1.3.3.1 提取物对胃蛋白酶和胰蛋白酶抑制动力学
不同浓度的金花茶花浸提物与胃蛋白酶等体积混合在37 ℃下反应30 min,然后加入不同质量浓度(6、7、8、9、10 g/L)的牛血红蛋白溶液,在650 nm处测定其吸光度值。
不同浓度的金花茶花浸提物与胰蛋白酶等体积混合在37 ℃下反应30 min,然后加入不同质量浓度(2、4、6、8、10 g/L)的BAPNA溶液,在410 nm处测定吸光度值。
抑制类型采用Lineweaver-Burk[11]方程解析,以1/v和1/[S]作图,根据公式(2)计算:
(2)
式中:v和vmax分别为初始反应速度和最大初始反应速度;Km、Ki、K′i分别为米氏常数、竞争抑制常数和非竞争抑制常数;[I],抑制剂的浓度, g/L;S为底物的质量浓度,g/L。
1.3.4 荧光特性分析
0.1 mL不同质量浓度的CNEE或CNAE溶液和3.9 mL 0.2 g/L的胃蛋白酶或胰蛋白酶溶液迅速混合反应30 min,在激发波长为280 nm,发射波长为290~500 nm,狭缝宽度为5 nm的条件下测定其荧光强度。荧光猝灭由Stern-Volmer[12]方程确定,如公式(3)所示:
![]() =1+Kqτ0[Q]=1+KSV[Q]
=1+Kqτ0[Q]=1+KSV[Q]
(3)
式中:F0,未加入CNEE或CNAE的荧光强度;F,已加入CNEE或CNAE的荧光强度;Kq和KSV为生物分子猝灭常数和猝灭常数;τ0为荧光团的生命周期(无猝灭剂);[Q]为CNEE或CNAE的质量浓度,g/L。
1.3.5 紫外可见吸收光谱测定
设置3个实验组,第1组为消化蛋白酶组,分别加入质量浓度为5 g/L不同体积(0.2、0.4、0.6、0.8、1.0 mL)的胃蛋白酶或胰蛋白酶,加入酸溶液或Tris-HCl溶液补充至4 mL。第2组为金花茶花浸提物组,分别加入质量浓度为1 g/L的不同体积(0.1、0.3、0.5、0.7、0.9 mL)的CNEE或CNAE,再加入酸溶液补充至4 mL。第3组为金花茶花浸提物+消化蛋白酶组,将0.45 mL 5 g/L的胃蛋白酶和0.7 mL 1 g/L的CNEE或0.8 mL 1 g/L的CNAE混合;1 mL 5 g/L胰蛋白酶和0.1 mL 1 g/L的CNEE或0.15 mL 1 g/L的CNAE混合。在扫描波长范围为190~500 nm,扫描精度为1.0 nm,测试温度为298 K的条件下测定溶液的紫外光谱。根据实验结果进行分析,做出(金花茶花浸提物+消化蛋白酶)-金花茶花浸提物的紫外图谱,并分析曲线差异。
1.3.6 二级结构的测定
采用圆二色谱法分析金花茶花浸提物与消化蛋白酶反应前后二级结构的变化。金花茶花浸提物与胃蛋白酶和胰蛋白酶[1∶1(V/V)]以1∶1(g∶L)的比例混合,添加于5 mL离心管中,振荡反应,在190~260 nm处扫描。
1.3.7 统计学分析
所有的实验数据均用SPSS 25.0软件处理,每次实验重复3次,结果用平均值±标准差表示,不同组间的比较采用LSD进行方差分析,当P<0.05时表示有显著性差异。
2 结果与分析
2.1 金花茶花浸提物对胃蛋白酶和胰蛋白酶活性的影响
由图1-a1和b1可知,CNEE和CNAE对胃蛋白酶和胰蛋白酶都有一定的抑制作用,且抑制作用强弱顺序依次为:CNEE>CNAE>TP。CNEE和CNAE对胃蛋白酶的IC50分别为3.194和3.330 g/L,其与周培羽等[13]研究的低聚合度(2.45)葡萄籽原花青素对胃蛋白酶的IC50值为3.160 g/L的结果接近。然而,CNEE和CNAE对胰蛋白酶的IC50分别为29.131和56.534 g/L,这说明CNEE和CNAE对胃蛋白酶活性的抑制能力强于胰蛋白酶。综上可知,CNEE和CNAE对胃蛋白酶和胰蛋白酶有一定的抑制作用,且CNEE对胃蛋白酶和胰蛋白酶抑制强度大于CNAE,这可能是由于CNEE中黄酮和多酚含量高于CNAE,更易与消化蛋白酶的结合。
由图1-a2和b2可知,CNEE和CNAE抑制胃蛋白酶活性的3条曲线都交于第二象限,Vmax随着CNEE和CNAE浓度的增加而减小,而Km值随着CNEE和CNAE浓度的增加逐渐增大,属于混合型抑制,且CNEE和CNAE对胃蛋白酶的竞争抑制常数分别为4.518和7.641 g/L。图1-a3和b3所示,CNEE和CNAE抑制胰蛋白酶活性的3条曲线都交于第三象限,Vmax和Km值随着CNEE和CNAE质量浓度的增加而减小,属于混合型抑制,且CNEE和CNAE对胰蛋白酶的竞争抑制常数分别为74.571和175.832 g/L。上述结果表明,CNEE和CNAE与胃蛋白酶和胰蛋白酶相互作用过程中,CNEE和CNAE可能与底物结合位点和其他活性位点竞争性相互作用。XIAO等[14]研究单宁酸与胰蛋白酶相互作用中发现其抑制类型为混合型抑制,与本研究结果一致。
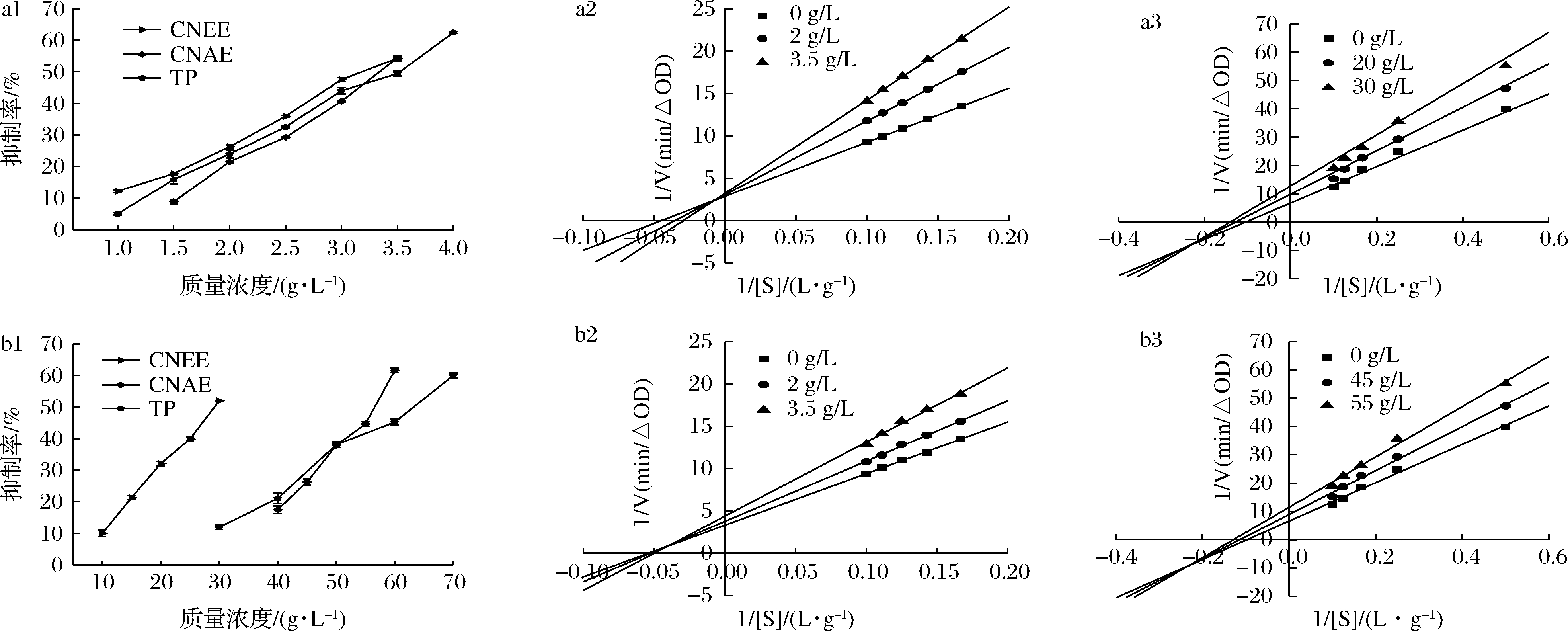
a1-金花茶花浸提物和茶多酚对胃蛋白酶的抑制率;a2-CNEE对胃蛋白酶的抑制动力学图;a3-CNEE对胰蛋白酶的抑制动力学图; b1-金花茶花浸提物和茶多酚对胰蛋白酶的抑制率;b2-CNAE对胃蛋白酶的抑制动力学图;b3-CNAE对胰蛋白酶的抑制动力学图
图1 CNEE和CNAE对胃蛋白酶和胰蛋白酶的抑制率和双倒数曲线
Fig.1 The inhibition rate and double countdown curve of CNEE and CNAE on gastric pepsin and trypsin
2.2 CNEE和CNAE对胃蛋白酶和胰蛋白酶的荧光猝灭效应
荧光猝灭可分为静态猝灭和动态猝灭2种类型[15]。如图2-a1和b1所示,胃蛋白酶在340 nm处有最大发射波长,随着CNEE和CNAE浓度的增加,胃蛋白酶在340 nm处的荧光强度逐渐下降,说明CNEE和CNAE与胃蛋白酶相互作用使酶结构发生了改变同时产生了猝灭现象。但是CNEE和CNAE都未改变胃蛋白酶的最大发射波长,这表明CNEE和CNAE对胃蛋白酶中色氨酸残基的微环境没有影响。通过公式(3)判定猝灭的类型,由图2-a2和b2以及表1可知,CNEE和CNAE对胃蛋白酶的荧光猝灭常数KSV随着温度的升高而下降,即为静态猝灭。ZENG等[16]和REN等[17]研究也发现,水飞蓟宾和芦荟大黄素能与胃蛋白酶形成复合物,从而降低胃蛋白酶的荧光强度,猝灭酶的内源荧光,影响酶的构象。由图3-c1和d1可知,胰蛋白酶在337 nm处有最大发射波长,随CNEE和CNAE浓度的增大胰蛋白酶的荧光强度下降,说明CNEE和CNAE与胰蛋白酶的相互作用使酶的结构发生了改变并产生猝灭现象。由图3-c2和d2以及表2可知,CNEE和CNAE对胰蛋白酶的荧光猝灭常数随着温度升高而降低,这可能是在静态猝灭过程中,由于温度升高,扩散速度降低,导致CNEE和CNAE与胰蛋白酶碰撞猝灭量降低,进而使荧光猝灭常数下降[18]。

图2 CNEE和CNAE对胃蛋白酶的荧光猝灭
Fig.2 Fluorescence quenching of pepsin by CNEE and CNAE.
注:a1和a2为CNEE对胃蛋白酶荧光图;b1和b2为CNAE对胃蛋白酶荧光图; a1和b1中曲线(1→6)对应于CNEE和CNAE浓度为0.0、0.1、0.2、0.3、0.4和0.5 g/L
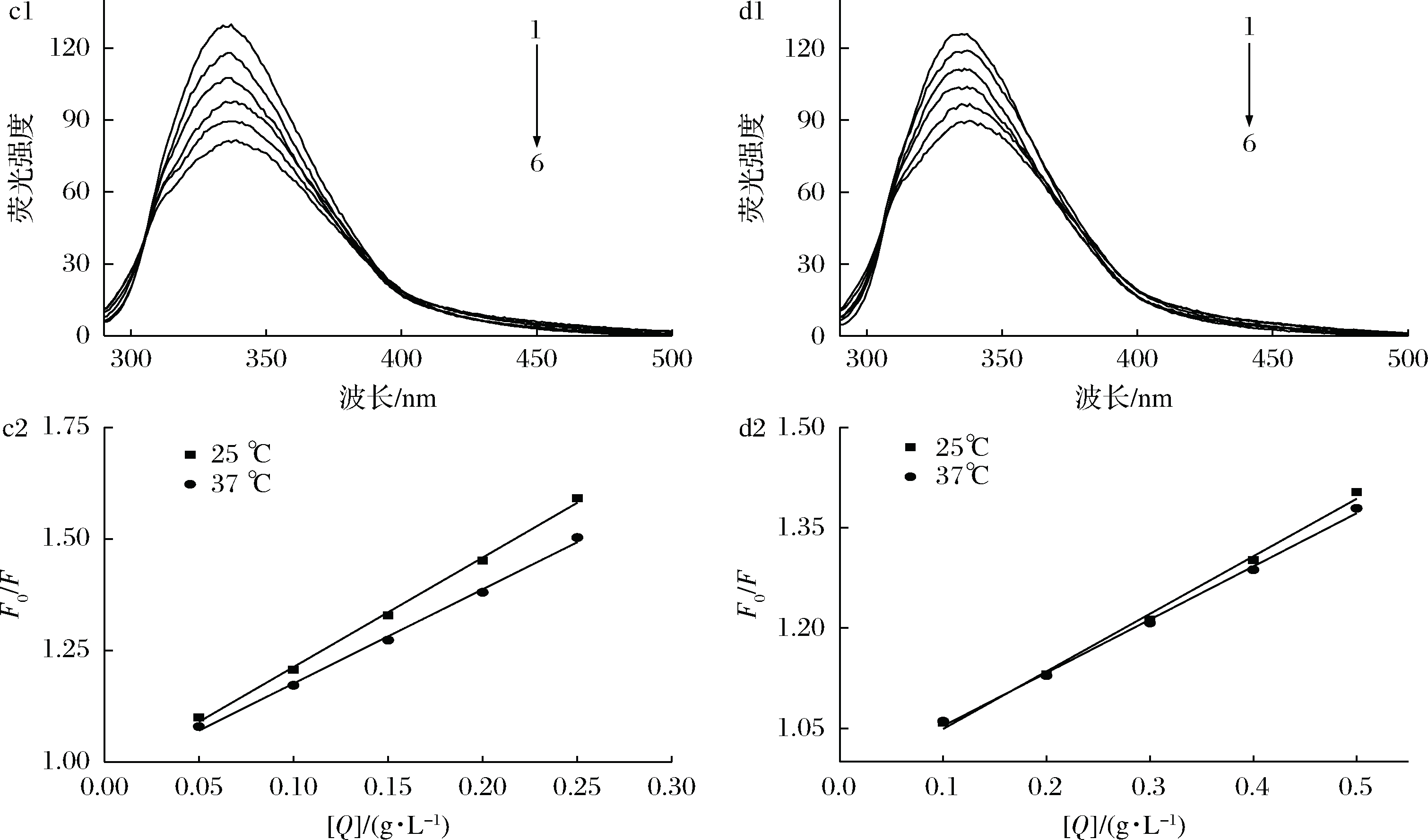
图3 CNEE和CNAE对胰蛋白酶的荧光猝灭
Fig.3 Fluorescence quenching of trypsin by CNEE and CNAE.
注:c1和c2为CNEE对胰蛋白酶荧光图;d1和d2为CNAE对胰蛋白酶荧光图; c1和d1中曲线(1→6)对应于CNEE和CNAE浓度为0.00、0.05、0.10、0.15、0.20和0.25 g/L
表1 CNEE和CNAE对胃蛋白酶的荧光猝灭常数
Table 1 Stern-Volmer quenching constants of CNEE and CNAE on pepsin

浸提物T/KKSV/(L·g-1)RCNEE2981.522±0.340 90.993 53101.276±0.224 20.991 5CNAE2981.205±0.295 00.992 83100.646 7±0.091 1 0.990 9
表2 CNEE和CNAE对胰蛋白酶的荧光猝灭常数
Table 2 Stern-volmer quenching constants of CNEE and CNAE on trypsin

浸提物T/KKSV/(L·g-1)RCNEE2982.175±0.148 20.992 13101.808±0.164 10.993 7CNAE2981.392±0.172 00.995 13101.363±0.120 20.993 7
注:R是KSV值的相关系数
综上可知,CNEE和CNAE通过静态猝灭机制猝灭胃蛋白酶和胰蛋白酶的内源荧光。这与倪孟婷等[19]和赵红辉[20]的研究结果一致,随着温度升高,猝灭常数不断下降,槲皮素、山奈酚、芹菜素和芦丁等均不能改变胰蛋白酶中色氨酸等微环境。
2.3 CNEE和CNAE与胃蛋白酶和胰蛋白酶相互作用的紫外可见吸收光谱图
由图4-a1和a2可知,胃蛋白酶在210 nm有较强吸收峰,其体现了蛋白质的骨架和肽键结构;在280 nm处有弱吸收峰,其主要由色氨酸、酪氨酸和苯丙氨酸引起。当CNEE和CNAE与胃蛋白酶和胰蛋白酶不发生相互作用时,曲线A(E)与曲线D(H)应大致相同[21];然而,当CNEE或CNAE与胃蛋白酶发生相互作用后,210 nm处的峰值下降且发生小幅度红移,说明CNEE和CNAE与胃蛋白酶发生了相互作用且猝灭类型为静态猝灭;且280 nm处的峰值增加,这可能是由CNEE或CNAE破坏了酶的结构,增加了芳香族氨基酸亲水区域的暴露。由图4-b1和b2可知,与胃蛋白酶相比,CNEE和CNAE与胰蛋白酶相互作用后,280 nm处的峰值增加幅度较小,在210 nm处无明显位移,这说明了CNEE和CNAE对胰蛋白酶的猝灭类型为静态猝灭且CNEE和CNAE对胰蛋白酶构象影响较小。

图4 CNEE和CNAE对胃蛋白酶和胰蛋白酶紫外光谱的影响
Fig.4 Effects of CNEE and CNAE on the UV spectra of pepsin and trypsin
综上可知,不同浸提物都改变了胃蛋白酶和胰蛋白酶的结构,猝灭类型为静态猝灭,这与荧光光谱结果一致。REN等[17,22]在研究大黄素与胃蛋白酶和胰蛋白酶的结合特性中也发现大黄素改变了消化酶的构象,其对酶的猝灭类型为静态猝灭。
2.4 CNEE和CNAE与胃蛋白酶和胰蛋白酶相互作用的圆二色谱图
由图5中a1、a2和表3可知,胃蛋白酶在200 nm处有一个负峰,说明胃蛋白酶含有大量的β-折叠和无规则卷曲。这与拟合结果胃蛋白酶含有35.1%无规则卷曲和35.4% β-折叠的结果一致。当CNEE与胃蛋白酶以0.25∶0.2混合后,胃蛋白酶的α-螺旋和无规则卷曲分别下降了0.4%和4.7%,且β-折叠和β-转角分别提升了10.4%和0.7%。当CNAE与胃蛋白酶浓度比以0.25∶0.2混合后,胃蛋白酶中的α-螺旋和无规则卷曲相对于空白分别下降了0.2%和4.5%,β-折叠与β-转角含量分别提升了8.3%和0.3%,这说明了CNEE和CNAE通过促进α-螺旋和无规则卷曲向β-折叠与β-转角转变而改变蛋白酶的二级结构,且CNEE对胃蛋白酶二级结构的影响大于CNAE。由图5-b1、b2和表3可知,胰蛋白酶在195、205和222 nm处有负峰,且通过拟合可知,胰蛋白酶含有6.1%的α-螺旋,16.9%的β-转角,29.6%的无规则卷曲和51.1%的β-折叠。当CNEE与胰蛋白酶以0.25∶1混合后,胰蛋白酶的α-螺旋和无规则卷曲分别下降了0.1%和0.7%,而β-折叠和β-转角分别增加了1.4%和0.3%。在相同浓度下,CNEE对胰蛋白酶二级结构的影响比CNAE更显著。当CNAE与胰蛋白酶以0.25∶1混合后,胰蛋白酶的α-螺旋和无规则卷曲分别下降了0.1%和0.4%,β-折叠和β-转角分别增加了0.7%和0.3%。因此,CNEE对胃蛋白酶和胰蛋白酶二级结构的影响大于CNAE,更容易与酶的活性位点相结合,促使胃蛋白酶和胰
蛋白酶分子结构发生改变。刘婵[23]研究发现没食子儿茶素与胰蛋白酶相互作用后也增加了胰蛋白酶中β-折叠含量。
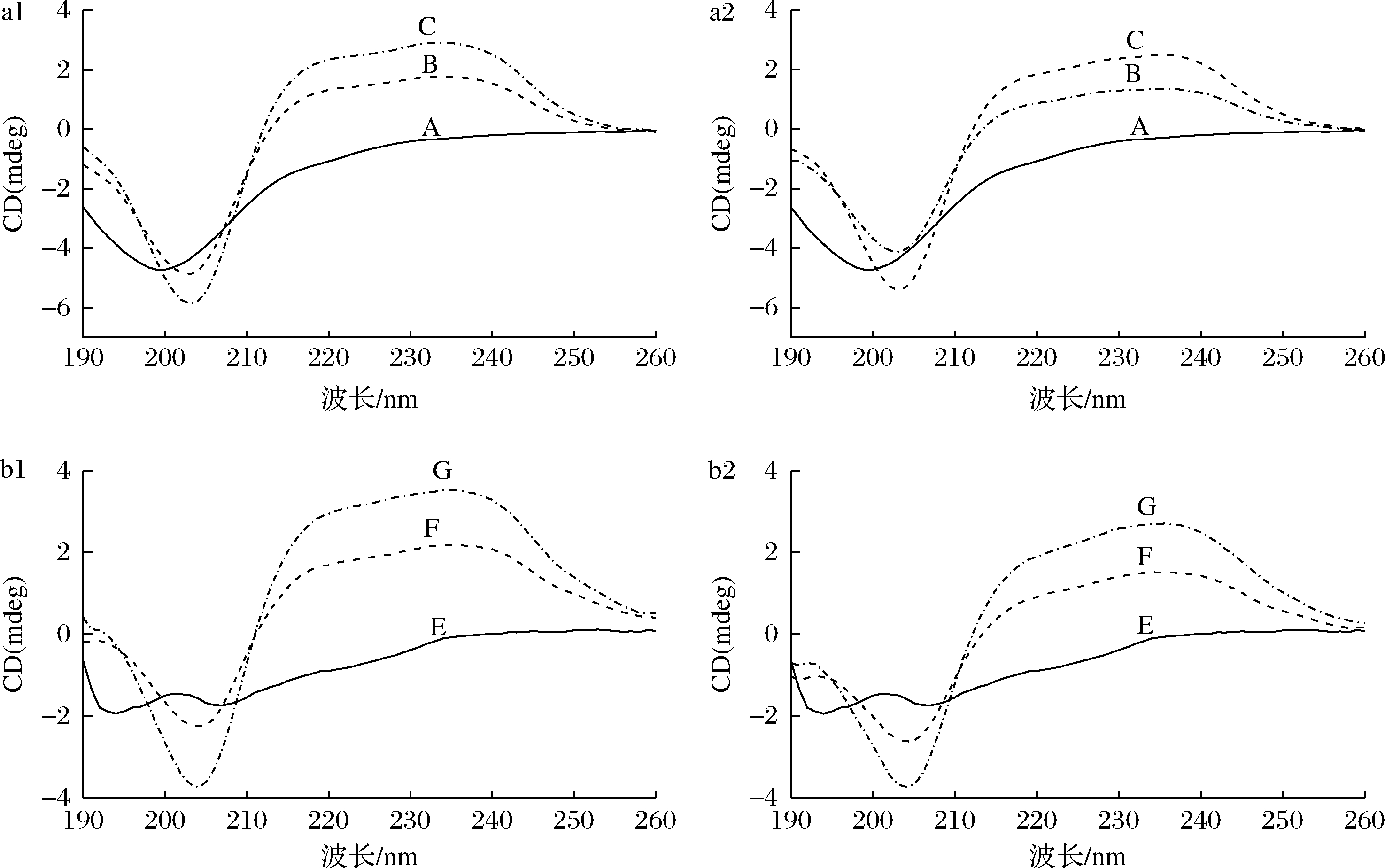
图5 CNEE和CNAE对胃蛋白酶和胰蛋白酶圆二色谱的影响
Fig.5 Effects of CNEE and CNAE on the circular dichroism spectra of pepsin and trypsin
注:a1-CNEE对胃蛋白酶的圆二色谱的影响;a2-CNAE对胃蛋白酶的圆二色谱的影响;b1-CNEE对胰蛋白酶的圆二色谱; b2-CNAE对胰蛋白酶的圆二色谱。其中A、B、C分别表示CNEE或CNAE与胃蛋白酶的比值为0∶0.2、
0.15∶0.2和0.25∶0.2;E、F、G分别表示CNEE或CNAE与胰蛋白酶的比值为0∶1、0.15∶1和0.25∶1
表3 CNEE和CNAE对胃蛋白酶和胰蛋白酶二级结构的影响
Table 3 Effects of CNEE and CNAE on the secondary structure of pepsins and trypsin.
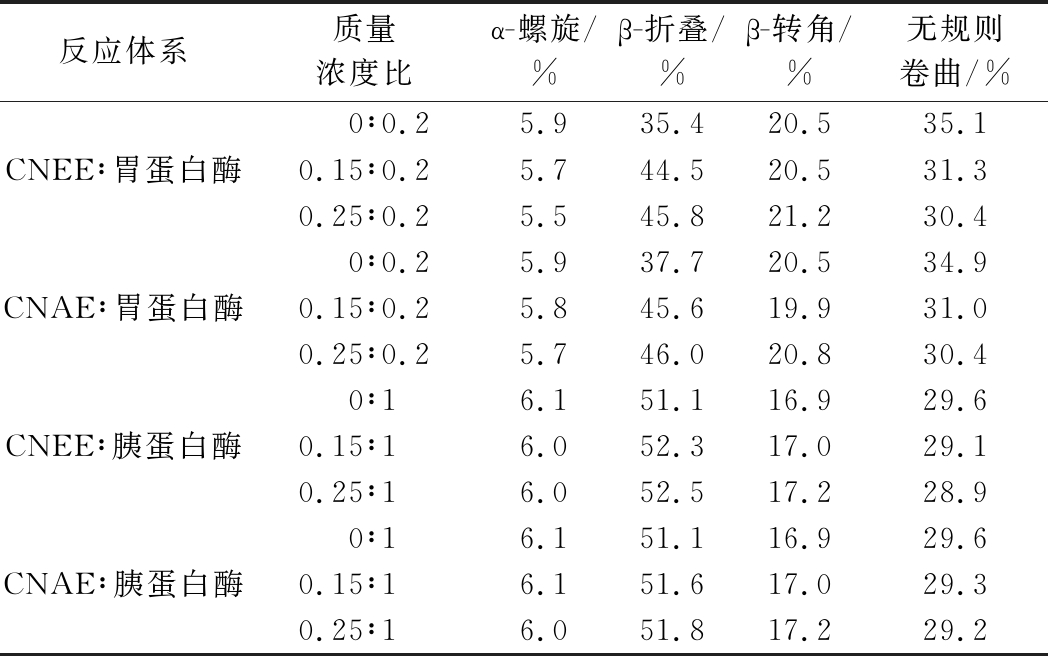
反应体系质量浓度比α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%0∶0.25.935.420.535.1CNEE∶胃蛋白酶0.15∶0.25.744.520.531.30.25∶0.25.545.821.230.40∶0.25.937.720.534.9CNAE∶胃蛋白酶0.15∶0.25.845.619.931.00.25∶0.25.746.020.830.40∶16.151.116.929.6CNEE∶胰蛋白酶0.15∶16.052.317.029.10.25∶16.052.517.228.90∶16.151.116.929.6CNAE∶胰蛋白酶0.15∶16.151.617.029.30.25∶16.051.817.229.2
3 结论
CNEE和CNAE通过改变消化蛋白酶(酶蛋白酶和胰蛋白酶)的结构进而抑制酶的活性且为可逆的混合型抑制,其中CNEE和CNAE对胃蛋白酶的抑制作用更明显。静态猝灭是导致消化蛋白酶内源荧光猝灭的主要原因。CNEE和CNAE与消化蛋白酶相互作用的研究为金花茶花在保健品行业的应用提供了理论基础。
[1] MOHAN V,UNNIKRISHNAN R,SHOBANA S,et al.Are excess carbohydrates the main link to diabetes & its complications in Asians?[J] Indian Journal of Medical Research,2018,148(5):531-538.
[2] 姜勇.我国成人超重肥胖流行现状、变化趋势及健康危害研究[D].北京:中国疾病预防控制中心,2013.
JIANG Y.Study on prevalence,secular trends and health risk of overweight and obesity among Chinese adults[D].Beijing:Chinese Center For Disease Control And Prevention,2013.
[3] D AZ-R
AZ-R A R,KEIJER J,PALOU A,et al.Long-term intake of a high-protein diet increases liver triacylglycerol deposition pathways and hepatic signs of injury in rats[J].The Journal of Nutritional Biochemistry,2017,46:39-48.
A R,KEIJER J,PALOU A,et al.Long-term intake of a high-protein diet increases liver triacylglycerol deposition pathways and hepatic signs of injury in rats[J].The Journal of Nutritional Biochemistry,2017,46:39-48.
[4] NAMIKOSHI T,TOMITA N,SATOH M,et al.High dietary protein intake induces endothelial dysfunction in uninephrectomized rats[J].Molecular Medicine Reports,2009,2(3):429-434.
[5] LIU C,HE W,CHEN S,et al.Interactions of digestive enzymes and milk proteins with tea catechins at gastric and intestinal pH[J].International Journal of Food Science & Technology,2017,52(1):247-257.
[6] WU X,WANG W,ZHU T,et al.Phenylpropanoid glycoside inhibition of pepsin,trypsin and α-chymotrypsin enzyme activity in Kudingcha leaves from Ligustrum purpurascens[J].Food Research International,2013,54(2):1 376-1 382.
[7] ZHANG H L,WU Q X,QIN X M.Camellia nitidissima Chi flower extracts inhibit α-amylase and α-glucosidase:In vitro by analysis of optimization of addition methods,inhibitory kinetics and mechanisms[J].Process Biochemistry,2019,86:177-185.
[8] ZHANG H L,WU Q X,WEI X,et al.Pancreatic lipase and cholesterol esterase inhibitory effect of Camellia nitidissima Chi flower extracts in vitro and in vivo[J].Food Bioscience,2020,37:100 682.
[9] ZENG H J,YANG R,LIANG H,et al.Molecular interactions of flavonoids to pepsin:Insights from spectroscopic and molecular docking studies[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2015,151:576-590.
[10] FENG Y,LV M,LU Y,et al.Characterization of binding interactions between selected phenylpropanoid glycosides and trypsin[J].Food Chemistry,2018,243:118-124.
[11] SON H U,YOON E K,YOO C Y,et al.Effects of synergistic inhibition on alpha-glucosidase by phytoalexins in soybeans[J].Biomolecules,2019,9(12):828.
[12] FANG Y,XU H,SHEN L,et al.Study on the mechanism of the interaction between acteoside and pepsin using spectroscopic techniques[J].Luminescence,2015,30(6):859-866.
[13] 周培羽,张灵敏,李灵犀,等.不同聚合度葡萄籽原花青素对三种消化酶抑制作用机制[J].沈阳药科大学学报,2019,36(5):436-445.
ZHOU P Y,ZHANG L M,LI L X,et al.Study on the interaction between grape seed procyanidins with different degrees of polymerization and digestive enzymes[J].Journal of Shenyang Pharmaceutical University,2019,36(5):436-445.
[14] XIAO H Z,LIU B G,MO H Z,et al.Comparative evaluation of tannic acid inhibiting α-glucosidase and trypsin[J].Food Research International,2015,76(Pt 3):605-610.
[15] LAKOWICZ J R.Principles of fluorescence spectroscopy,third edition [M].Springer Science Business Media,2006.
[16] ZENG H J,YOU J,LIANG H L,et al.Investigation on the binding interaction between silybin and pepsin by spectral and molecular docking[J].International Journal of Biological Macromolecules,2014,67:105-111.
[17] REN G,SUN H,LI G,et al.Molecular docking and muiltple spectroscopy investigation on the binding characteristics of aloe-emodin to pepsin[J].Journal of Molecular Structure,2019,1 195:369-377.
[18] MIAO M,JIANG B,JIANG H,et al.Interaction mechanism between green tea extract and human α-amylase for reducing starch digestion[J].Food Chemistry,2015,186:20-25.
[19] 倪孟婷,樊美慧,胡兴,等.槲皮素与胰蛋白酶的作用机制及其抗氧化活性[J].南昌大学学报(理科版),2017,41(3):244-248;254.
NI M T,FAN M H,HU X,et al.Interaction mechanism of quercetin with trypsin and the antioxidant activity of quercetin[J].Journal of Nanchang University (Natural Science),2017,41(3):244-248;254.
[20] 赵红辉. 类黄酮与胰蛋白酶相互作用特性的研究[D].广州:华南理工大学,2012.
ZHAO H H.Research on the interaction between flavonoids and trypsin[D].Guangzhou:South China University of Technology,2012.
[21] WANG R,KANG X,WANG R,et al.Comparative study of the binding of trypsin to caffeine and theophylline by spectrofluorimetry[J].Journal of Luminescence,2013,138:258-266.
[22] REN G Y,SUN H,GUO J Y,et al.Molecular mechanism of the interaction between resveratrol and trypsin via spectroscopy and molecular docking[J].Food & Function,2019,10(6):3 291-3 302.
[23] 刘婵. 体外消化环境下多酚与蛋白、酶间的竞争相互作用及其对多酚和蛋白功能特性的影响研究[D].无锡:江南大学,2017.
LIU C.Competitive interaction between polyphenols and proteins,enzymes in vitro digestion and its effect on functional properties of polyphenols and proteins[D].Wuxi:Jiangnan University,2017.