梁平柚主产于重庆市梁平区,有两百多年的栽培史。作为当地的特色优势农业产业,其年产量高达九万t,但由于缺少有效的途径,柚子皮的利用率极其低下[1-2]。据报道,柚皮中含有多种有利于人体健康的多糖、黄酮和柠檬苦素等活性成分[3];梁平柚柚皮水提液具有较好的·OH清除率![]() 清除率,以及抑制小鼠脑、心、肝组织中的脂质过氧化作用[4-5],此为梁平柚柚皮的综合利用提供了一条新的途径。
清除率,以及抑制小鼠脑、心、肝组织中的脂质过氧化作用[4-5],此为梁平柚柚皮的综合利用提供了一条新的途径。
多糖在柚皮中易与其他物质以化学键的方式相结合,因此,提取多糖的前提需要破坏该化学键,使多糖游离[6]。目前常用的多糖提取方法有热水浸提法、酶法、微波法、超声波提取法等[7]。酶法提取作为多糖提取的主要方法之一,因其具有反应条件温和、提取效率高、产物活性强、成本低、节能环保等优点,而被广泛用于植物多糖的提取[8]。
本实验以梁平柚柚皮为原料,采用复合酶法提取柚皮多糖。以提取率为指标,考察液料比、pH、酶解温度、酶解时间对多糖提取率的影响。并采用响应面实验确定其最佳工艺参数。此外,采用液相色谱-质谱联用、红外光谱、紫外光谱以及扫描电镜对其构成和结构进行表征。同时,并采用体外抗氧化实验考查梁平柚柚皮多糖的抗氧化活性,为梁平柚柚皮多糖的提取及梁平柚综合利用提供理论依据。
梁平柚,购于重庆市梁平区;果胶酶、纤维素酶,山东圣斯德食品添加剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),阜阳曼林生物技术有限公司;邻苯三酚,国药集团化学试剂有限公司;三氟乙酸、单糖标品,美国Sigma公司。其余均为国产分析纯试剂。
UV-2450紫外可见光分光光度计,日本岛津公司;FTIR-650傅里叶变换红外光谱仪,天津港东科技股份有限公司;ALPH1-2/LD-Plus冷冻干燥机,德国CHRIST公司;I-class UPLC,Xevo TQ-S micro三重四级杆液相色谱-质谱联用仪,美国Waters公司;HITACHI S-3400扫描电镜,日本日立公司。
1.3.1 酶法辅助梁平柚柚皮多糖的提取工艺优化
1.3.1.1 多糖提取
选取新鲜的梁平柚柚皮于55 ℃条件下烘干,待其干燥至恒重后粉碎并过80目筛。按一定液料比称取去离子水与柚皮粉末,溶解后加入15 g/L的复合酶[m(果胶酶)∶m(纤维素酶)=1∶1][9],调节pH后,在一定温度下酶解一定时间,酶解完成后采用Savag法除去蛋白,再加入3倍体积的无水乙醇进行多糖提取,静置24 h后离心收集沉淀,并经冷冻干燥后即得梁平柚柚皮多糖。
1.3.1.2 单因素实验
以液料比25∶1 (mL∶g),pH 4,酶解时间120 min,酶解温度50 ℃为基础实验条件。考察液料比(10∶1、15∶1、20∶1、25∶1、30∶1、35∶1 (mL∶g)、pH(4.0、4.5、5.0、5.5、6.0、6.5)、酶解时间(30、60、90、120、150、180 min)和酶解温度(40、45、50、55、60、65 ℃)对柚皮多糖提取率的影响。
1.3.1.3 响应面优化
采用4因素3水平的响应面分析方法, 以A(液料比)、B(pH)、C(酶解时间)、D(酶解温度)为自变量,梁平柚柚皮多糖提取率为响应值,优化提取的最佳工艺。因素及水平编码见表1。
表1 响应面试验设计因素水平表
Table 1 Factors and levels of response surface test design
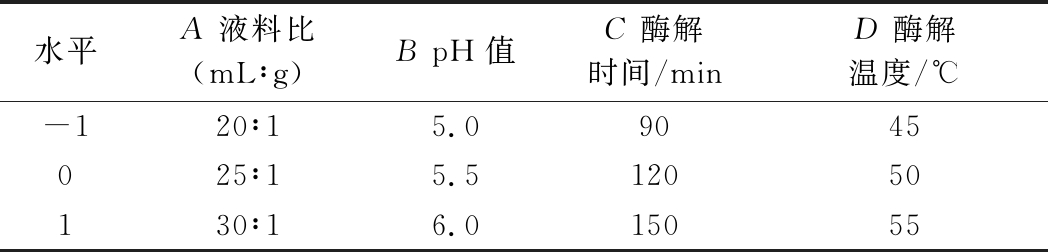
水平A 液料比(mL∶g)B pH值C 酶解时间/minD 酶解温度/℃-120∶15.09045025∶15.512050130∶16.015055
1.3.1.4 多糖提取率的测定
提取得到的粗多糖样品放入250 mL容量瓶中,用去离子水定容,并采用苯酚—硫酸法测定其多糖含量[10]。以葡萄糖为对照制作标准曲线,其回归方程:y=0.883 5x+0.025 6,R2=0.991 6。柚皮多糖提取率按公式(1)计算:
多糖提取率![]()
(1)
式中:c,多糖溶液的质量浓度,mg/mL;m,梁平柚柚皮质量,g。
1.3.2 梁平柚柚皮多糖结构表征
1.3.2.1 单糖组成
根据文献所描述的方法,采用PMP柱前衍生结合液相色谱-质谱联用(ultra-performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)对梁平柚柚皮多糖的单糖组成进行分析[11-12]。称取10 mg样品于20 mL安瓿瓶中,加入5 mL三氟乙酸(2 mol/L)溶液,N2封管后在100 ℃条件下水解2 h。水解完成后,取1 mL水解液并加入1 mL甲醇,于70 ℃条件下用N2吹干,重复2次后加入1 mL NaOH(0.3 mol/L)溶液溶解残渣。分别取400 μL的样品水解液与单糖标准溶液于5 mL试管中,加入400 μL的PMP甲醇溶液,混匀,70 ℃反应2 h,反应完成后放置至室温,再加入400 μL的HCl(0.3 mol/L)溶液调节pH至6~7,加水1 200 μL,再加入等体积的氯仿萃取,涡旋混匀,静置后收集水相,重复2次。将水相用0.45 μm水系滤膜过滤后供UPLC-MS/MS分析。
HPLC条件:Agilent EC-C18色谱柱(2.7 μm, 2.1 mm×50 mm);流量0.4 mL/min;流动相A 20 mmol/L乙酸铵缓冲液(pH 7);流动相B 乙腈;梯度洗脱模式:时间梯度为0、1、7、11、13、14.5、14.6、17 min,流动相B的体积分数梯度为14%、14%、18.5%、20%、60%、60%、14%、14%。
质谱条件:ESI+模式;喷雾电压2.0 kV;锥孔电压30 V;离子源温度150 ℃;脱溶剂温度500 ℃;脱溶剂气体N2流速为1 000 L/h;质谱扫描范围m/z 170~800。
1.3.2.2 紫外光谱分析
称取一定量的梁平柚柚皮多糖溶于蒸馏水中,并以蒸馏水为对照在200~600 nm波长范围内进行紫外光谱扫描。
1.3.2.3 红外光谱分析
称取1~2 mg梁平柚柚皮多糖粉末,置于玛瑙研钵中,加入150~200 mg干燥后的KBr晶体,研磨均匀后压片,在4 000~400 cm-1范围内记录其红外光谱。
1.3.2.4 扫描电镜分析
用导电胶把梁平柚柚皮多糖固定在样品台上,送进真空喷镀仪内进行喷金处理,随后在12.5 kV下用扫描电镜进行扫描,拍摄不同倍数下的外貌形态。
1.3.3 梁平柚柚皮多糖体外抗氧化活性测定
1.3.3.1 DPPH自由基清除能力的测定
根据文献[13]报道的方法测定梁平柚柚皮多糖的DPPH自由基的清除能力。称取0.020 1 g的DPPH,用体积分数95%乙醇溶解并定容至250 mL,DPPH溶液和不同浓度的多糖溶液各取2 mL分别混合,静置30 min,在517 nm波长下测定其吸光度值。DPPH自由基清除率按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:A1,多糖样品溶液反应后的吸光度值;A2,无水乙醇代替多糖溶液反应后的吸光度值;A3,无水乙醇代替DPPH溶液反应后的吸光度值。
1.3.3.2 ·OH清除能力的测定
采用Fenton反应体系模型[14],在2 mL多糖溶液中,按顺序加入2 mL 9 mmo1/L的FeSO4溶液、2 mL 9 mmo1/L的水杨酸-乙醇溶液、2 mL 8.8 mmo1/L的H2O2溶液,混匀后37 ℃水浴30 min,在波长510 nm处测定吸光度值, ·OH清除率按公式(3)计算:
·OH清除率![]()
(3)
式中:A1,多糖样品溶液的吸光度值;A2,蒸馏水代替样品溶液后的吸光度值;A3,蒸馏水代替H2O2后的吸光度值。
1.3.3.3 ![]() 清除能力测定
清除能力测定
根据文献[15]所描述的方法测定多糖的![]() 清除能力。取0.05 mo1/L,pH 8.2的Tris-HCl缓冲液4.6 mL置于试管中, 25 ℃恒温水浴20 min,加入10 mmo1/L的邻苯三酚0.4 mL,再加入供试液1.0 mL混匀,25 ℃保温4 min,再加8 mmo1/L的盐酸溶液 0.1 mL终止反应。在325 nm波长下测定溶液的吸光度值,
清除能力。取0.05 mo1/L,pH 8.2的Tris-HCl缓冲液4.6 mL置于试管中, 25 ℃恒温水浴20 min,加入10 mmo1/L的邻苯三酚0.4 mL,再加入供试液1.0 mL混匀,25 ℃保温4 min,再加8 mmo1/L的盐酸溶液 0.1 mL终止反应。在325 nm波长下测定溶液的吸光度值,![]() 清除能力按公式(4)计算:
清除能力按公式(4)计算:
![]() 清除率
清除率![]()
(4)
式中:A1,多糖样品溶液的吸光度值;A2,蒸馏水代替样品溶液后的吸光度值;A3,蒸馏水代替邻苯三酚溶液后的吸光度值。
每组实验重复3次,结果采用![]() 表示。采用单因素方差分析进行显著性检验。方差齐性时,组间对比采用最小显著性差异法。方差不齐性时,采用Tamhane’s T2检验。响应面实验设计及方差分析采用Design-expert.8.0.6软件。绘图采用Origin 2018软件,IC50计算根据Probit回归模型,并采用SPSS 23.0软件进行。
表示。采用单因素方差分析进行显著性检验。方差齐性时,组间对比采用最小显著性差异法。方差不齐性时,采用Tamhane’s T2检验。响应面实验设计及方差分析采用Design-expert.8.0.6软件。绘图采用Origin 2018软件,IC50计算根据Probit回归模型,并采用SPSS 23.0软件进行。
如图1-a所示,液料比在达到25∶1 (mL∶g)时,多糖的提取率最高;液料比<25∶1 (mL∶g)时,提取率随着液料比的增加而显著提高(P<0.05);液料比>25 (mL∶g)时,提取率随着液料比的增加而显著降低(P<0.05)。其原因在于,当液料比较低时,溶剂量较少,溶液中的多糖溶解度容易达到饱和,导致多糖不能完全渗出,从而提取率较低;随着液料比的增大,多糖的溶出量提高;液料比>25∶1 (mL∶g)时,复合酶被过度稀释,对细胞壁的破坏作用不完全,导致多糖的溶出量降低。因此选择液料比为25∶1 (mL∶g)更合适。

a-液料比;b-pH;c-酶解时间;d-酶解温度
图1 单因素实验结果
Fig.1 Results of single-factor experimental
注:不同字母表示存在显著性差异(P<0.05)
由于果胶酶和纤维素酶作用的pH范围分别在3.0~7.0和4.2~5.2,因此选择pH 4.0~6.5的提取体系进行单因素实验[16],结果如图1-b所示。pH 4.0~5.0时,多糖提取率随着pH的升高而显著提高(P<0.05);pH 5.0~5.5时,虽然多糖提取率随着pH的升高有提高的趋势,但不具有统计学意义(P>0.05);pH>5.5时,多糖提取率随着pH的升高而显著下降(P<0.05)。综上,pH 5.5左右可以获得更高的多糖提取率。
酶解时间对多糖提取率的影响如图1-c所示。酶解时间<120 min时,多糖提取率随着酶解时间的延长而显著提高(P<0.05)。其原因在于随着酶解时间的延长,果胶酶和纤维素酶对柚皮细胞壁的破坏作用更加完全,使得柚皮多糖可以充分溶出。酶解时间在120 ~150 min时,多糖提取率随着酶解时间的延长而显著降低(P<0.05)。其原因可能是长时间的酶解造成柚皮细胞中大量细胞质溶出,影响多糖的溶出。酶解时间>150 min时,酶解时间对多糖提取率的影响趋于平缓(P>0.05)。综上,选择酶解时间120 min更合适。
酶解温度对多糖提取率的影响如图1-d所示。酶解温度<50 ℃,多糖提取率随着酶解升高而显著提高(P<0.05)。其原因在于随着酶解温度的升高,柚皮粉软化,果胶酶和纤维素酶的活性增强,对柚皮细胞结构的破坏程度逐渐加强,溶剂分子运动速度加快,多方面作用下,溶剂与多糖的接触几率增加[17]。酶解温度>50 ℃时,随着酶解温度的升高,多糖提取率显著降低(P<0.05)。其原因在于过高的温度使得酶的活性降低,导致多糖提取率降低[18]。
2.2.1 响应面实验结果及方差分析
响应面实验结果如表2所示。采用Design-expert.8.0.6软件进行回归分析,得到回归方程:Y=4.78+0.44A+0.11B-0.072C+0.79D+0.002 5AB-0.43AC+0.45AD-0.097BC-0.22BD+0.015CD-0.85A2-1.15B2-0.99C2-0.50D2。其中A、B、C、D分别代表液料比、pH值、酶解时间以及酶解温度,Y代表多糖提取率。
响应面回归模型的方差分析如表3所示,模型P=0.000 6<0.05,失拟项P=0.168 36>0.05,表明该模型显著,可以很好地描述测试结果。由各因素的F值可知,各因素对梁平柚柚皮多糖提取率的影响程度由高到低依次为:D(酶解温度)>A(液料比)>B(pH)>C(时间)。
表2 响应面分析的试验结果
Table 2 Program and experimental results of RSA

试验序号A液料比(mL∶g)B pH值C 酶解时间/minD 酶解温度/℃提取率/%125∶16.0150502.67225∶15.0120451.65325∶15.0120554.15425∶16.0150553.79525∶16.0120504.56625∶16.0120452.66720∶15.5 90503.07830∶15.0120503.59925∶16.090502.821025∶15.090502.431125∶15.5150453.011225∶15.5120504.711330∶15.5 90503.721430∶16.0120503.511530∶15.5120452.601620∶15.5150503.111725∶15.5 90452.701825∶15.5120504.971930∶15.5120555.462025∶15.5 90553.422130∶15.5150502.052225∶15.5120504.812330∶15.5120553.372425∶16.0120554.272520∶15.5120452.312225∶15.5120504.862725∶15.0150502.672820∶15.0120501.962920∶16.0120501.87验证25∶16.0 90505.11
表3 二次响应面回归模型方差分析
Table 3 ANOVA for response surface quadratic model analysis of variance table

方差来源平方和自由度均方F值P值显著性模型 26.28141.886.610.000 6**A2.2912.298.060.013 1*B0.1510.150.530.476 6C0.0610.060.220.648 4D7.5717.5726.660.001 4**AB2.50×10-512.50×10-58.81×10-50.992 6AC0.7310.732.570.130 9AD0.8110.812.850.113 3BC0.0410.040.130.719 9BD0.2010.200.700.417 7CD9.00×10-419.00×10-43.17×10-30.955 9A24.6814.6816.480.001 2**B28.5118.5129.98<0.000 1**C26.4116.4122.590.000 3**D21.6411.645.780.030 6*残差3.97140.28失拟项3.88100.3916.050.168 3误差 0.09740.024总合 30.2528
注:*差异显著P<0.05;**差异极显著P<0.01
2.2.2 各因素交互作用的响应面分析及最佳工艺的确定
根据响应面回归方程,利用Origin 2018软件绘制各因素响应面分析图和等高线图(图2)。当等高线呈圆形时表明两因素交互作用不显著,而呈椭圆形或马鞍形时则表示交互作用显著;其次,交互作用的曲面坡度越大,其影响程度越高[19]。如图2所示,液料比所对应的曲面坡度强于pH,证明液料比对多糖提取率的影响强于pH。由图2分析可知,各因素对多糖提取率的影响强弱依次为:酶解温度>液料比>pH>酶解时间,其结果符合方差分析。

图2 各因素交互作用对柚皮多糖提取率影响的响应面图和等高线图
Fig.2 Response and contour diagram of the interactions between factors on the extraction rate of pomelo peel polysaccharide
根据实际情况并采用Design-expert.8.0.6软件确定酶法辅助提取梁平柚柚皮多糖的最优工艺参数为:液料比25∶1 (mL∶g),pH 6.0,提取时间90 min,提取温度50 ℃。程序预测此条件下柚皮多糖提取率达到5.11%。实际在此条件下获得的提取率为5.46%,与程序预测值相比相对误差<5%,优化参数准确可靠,具有实际应用价值。
2.3.1 单糖组成分析
利用PMP柱前衍生液相色谱质谱联用法测定梁平柚柚皮多糖的单糖组成,其结果如表4所示。梁平柚柚皮多糖主要由核糖(1.18%)、葡萄糖醛酸(1.32%)、甘露糖(4.26%)、鼠李糖(4.72%)、葡萄糖(11.46%)、半乳糖(21.48%)、半乳糖醛酸(23.67%)和阿拉伯糖(31.90%)组成。
表4 单糖组成结果
Table 4 Results of monosaccharide composition

化合物名称质量/g检测离子(m/z)含量/%L-古洛糖醛酸194.140 525-D-甘露糖醛酸194.140 525-D-葡萄糖醛酸194.140 5251.32 D-半乳糖醛酸194.140 52523.67 D-甘露糖180.155 5114.26 D-葡萄糖180.160 51111.46D-半乳糖180.160 51121.48 D-氨基葡萄糖215.500 510-D-氨基半乳糖215.500 510-L-鼠李糖164.160 4954.72 L-岩藻糖164.160 495-D-核糖150.130 4811.18 D-木糖150.130 481-L-阿拉伯糖150.130 48131.90
2.3.2 紫外光谱及红外光谱分析
梁平柚柚皮多糖的紫外吸收光谱如图3-a所示,在260 和280 nm处无明显吸收峰,表明梁平柚柚皮多糖中不存在蛋白质和核酸[20]。柚皮多糖的红外光谱如图3-b所示,在波数为3 436和2 933 cm-1处的信号分别代表O—H和C—H的伸缩振动,此为糖类物质的特征吸收峰[21-22];1 744 cm-1处的吸收峰可能为乙酰基或羧酸酯中的C![]() O的特征峰,表明样品中可能含有糖醛酸[23-24];1 630 cm-1处的信号可能为结合水的特征吸收峰[25-26];1 417 cm-1处的信号可能为羧基中C—O的伸缩振动吸收峰[27];1 241 cm-1处的吸收峰被认为是C—O—C的特征吸收峰[28];1 000~1 200 cm-1的几个吸收表明样品含有吡喃糖环[29];此外,921 cm-1 处的吸收峰表明样品主要由β-糖苷键组成[30]。综上所述,梁平柚柚皮多糖是一种由β-糖苷键连接,具有吡喃糖环的酸性多糖。
O的特征峰,表明样品中可能含有糖醛酸[23-24];1 630 cm-1处的信号可能为结合水的特征吸收峰[25-26];1 417 cm-1处的信号可能为羧基中C—O的伸缩振动吸收峰[27];1 241 cm-1处的吸收峰被认为是C—O—C的特征吸收峰[28];1 000~1 200 cm-1的几个吸收表明样品含有吡喃糖环[29];此外,921 cm-1 处的吸收峰表明样品主要由β-糖苷键组成[30]。综上所述,梁平柚柚皮多糖是一种由β-糖苷键连接,具有吡喃糖环的酸性多糖。

图3 梁平柚柚皮多糖的紫外光谱图(a)和红外光谱图(b)
Fig.3 UV(a) and IR(b) spectra of polysaccharide from Liangping pomelo peel
2.3.3 扫描电镜分析
梁平柚柚皮多糖的扫描电镜图如图4所示,当柚皮多糖放大130倍时,多糖为颗粒状且表面粗糙多孔;当放大500倍时,可看到有光滑的片状和粗糙的块状,许多小颗粒附着在上表面,有纤维状的结构;当放大1 000倍时可看到梁平柚柚皮多糖呈片状结构,有纤维状的结构。

a-×130;b-×500;c-×1 000
图4 梁平柚柚皮多糖扫描电镜图
Fig.4 Scanning electron microscopy of polysaccharide from Liangping pomelo peel
由图5-a可知,梁平柚柚皮多糖质量浓度在0.2~1.2 mg/mL时,对DPPH自由基的清除率随着多糖浓度的升高而增强,存在明显的剂量效应关系。其IC50为1.71 mg/mL。·OH是一种强活性自由基,可破坏细胞中的核酸、蛋白质和脂质,使细胞功能丧失,因此对·OH的清除作用是抗氧化能力的关键指标[31]。如图5-b所示,多糖质量浓度在0.2~1.0 mg/mL时,·OH清除率随质量浓度的增大而增大,存在明显的剂量效应关系。其IC50为1.43 ![]() 是机体代谢产生的重要自由基,是抗氧化过程中需要清除的主要自由基之一。由图5-c可知,梁平柚柚皮多糖对
是机体代谢产生的重要自由基,是抗氧化过程中需要清除的主要自由基之一。由图5-c可知,梁平柚柚皮多糖对![]() 有一定的清除能力,但此能力与Vc相比还具有较大的差距,其预测得到的IC50为5.37 mg/mL。
有一定的清除能力,但此能力与Vc相比还具有较大的差距,其预测得到的IC50为5.37 mg/mL。
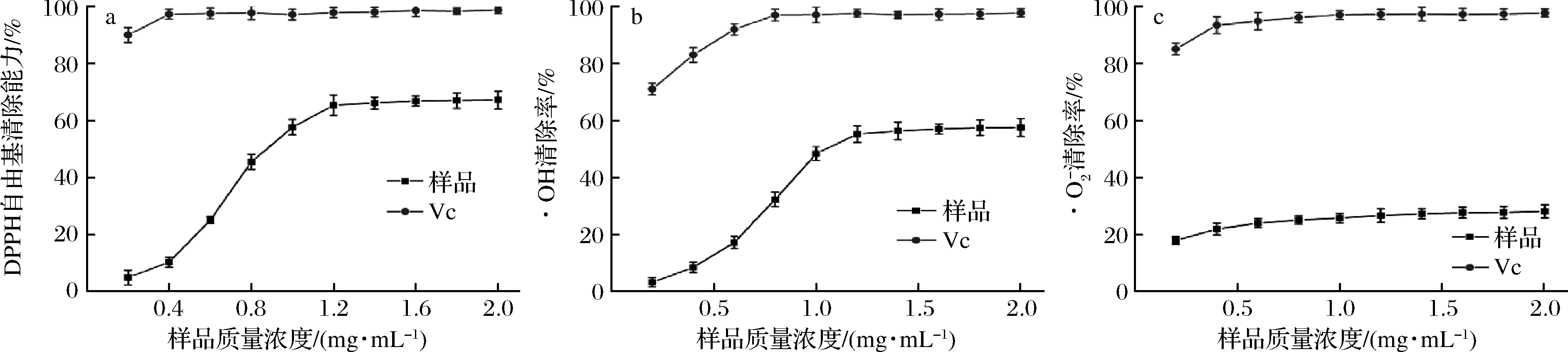
a-DPPH自由基;![]()
图5 梁平柚柚皮多糖抗氧化活性
Fig.5 Antioxidative activity of polysaccharide from Liangping pomelo peel
复合酶法常被用于短肽、黄酮、花色苷及多糖等天然活性物质的提取[8,32]。在多糖提取研究中,复合酶法主要被用于植物多糖的提取,通过果胶酶与纤维素酶可水解破坏细胞壁结构,从而产生细胞局部的坍塌、溶解和疏松,可减少提取时来自细胞壁和细胞间质的阻力,从而提高植物多糖提取率[33]。但由于酶活性受到温度、pH等因素的影响,同时考虑到多糖提取率易受到液料比、提取时间等因素的影响,本实验选择以液料比、pH、酶解时间和酶解温度为自变量,考察其对梁平柚柚皮多糖的影响。实验结果表明,复合酶法提取梁平柚柚皮多糖的最佳工艺参数为:液料比25∶1 (mL∶g)、pH 6.0、酶解时间90 min、酶解温度50 ℃。此条件下,多糖提取率为5.46%。郭文等[9]对柚皮多糖的提取分级及分子质量分布研究中发现,复合酶法提取蜜柚柚皮多糖的最佳工艺参数为:酶用量1.5%、料液比1∶25、酶解时间120 min、酶解温度50 ℃,提取率为10.39 g/100 g。对比分析后发现,等比例混合的果胶酶与纤维素酶在柚皮多糖的提取中,其最适液料比和最适酶解温度可能为1∶25和50 ℃。由于提取方法及提取率计算方法相同,推测两者提取率间的差异可能是受原料差异的影响。另外,由于多糖提取率计算方法的不同,所以无法与其他研究进行对比。
近年来,对于柚皮中的多糖成分已有了部分研究。与江飞凤等[12]的研究相比,梁平柚柚皮多糖中阿拉伯糖与半乳糖醛酸含量较高,葡萄糖含量较低;在红外光谱中,梁平柚柚皮多糖在1 744 cm-1处存在的吸收峰,可能是由于梁平柚柚皮多糖中半乳糖醛酸中的C![]() O所引起的。另外,与CUI等[34]对西柚柚皮果胶的研究相比,梁平柚柚皮多糖中阿拉伯糖含量较高,半乳糖醛酸含量较低;其红外光谱与酸法提取的柚皮果胶更为接近;与林诺怡等[35]对金柚幼果粗多糖的研究相比,梁平柚柚皮多糖中阿拉伯糖含量较高,但半乳糖含量较低。相比较而言,梁平柚柚皮多糖在结构方面与已报道的柚皮多糖存在一定差异。
O所引起的。另外,与CUI等[34]对西柚柚皮果胶的研究相比,梁平柚柚皮多糖中阿拉伯糖含量较高,半乳糖醛酸含量较低;其红外光谱与酸法提取的柚皮果胶更为接近;与林诺怡等[35]对金柚幼果粗多糖的研究相比,梁平柚柚皮多糖中阿拉伯糖含量较高,但半乳糖含量较低。相比较而言,梁平柚柚皮多糖在结构方面与已报道的柚皮多糖存在一定差异。
自由基是指含有未配对电子的基团,它是人体内正常代谢的产物。一般情况下,人体内的自由基处于动态平衡中,但平衡一旦被打破后,自由基会攻击邻近分子(碳水化合物、蛋白质、脂质等)以夺取电子。所以,过多的自由基会导致细胞结构破坏、功能丧失,造成细胞损伤或死亡[36]。本实验通过测定DPPH自由基清除率,·OH清除率以及![]() 清除率来考察梁平柚柚皮多糖的抗氧化活性。结果表明,在一定浓度范围内,柚皮多糖的抗氧化性具有明显的剂量效应关系。与江飞凤等[12]的研究相比,酶法提取的梁平柚柚皮多糖在DPPH自由基清除能力与·OH清除能力方面略高。与陈文娟等[5]的研究相比,梁平柚柚皮多糖的
清除率来考察梁平柚柚皮多糖的抗氧化活性。结果表明,在一定浓度范围内,柚皮多糖的抗氧化性具有明显的剂量效应关系。与江飞凤等[12]的研究相比,酶法提取的梁平柚柚皮多糖在DPPH自由基清除能力与·OH清除能力方面略高。与陈文娟等[5]的研究相比,梁平柚柚皮多糖的![]() 清除能力较弱,但DPPH自由基清除能力较强。造成这方面差异的原因可能是原料及提取方法的不同。综上所述,梁平柚柚皮多糖具有较好的抗氧化活性,可为梁平柚柚皮的综合利用提供一条新的思路。
清除能力较弱,但DPPH自由基清除能力较强。造成这方面差异的原因可能是原料及提取方法的不同。综上所述,梁平柚柚皮多糖具有较好的抗氧化活性,可为梁平柚柚皮的综合利用提供一条新的思路。
本实验以梁平柚柚皮多糖提取率为指标,采用单因素实验与响应面实验对复合酶法提取梁平柚柚皮多糖的工艺条件进行优化。结果表明,在液料比25∶1 (mL∶g),pH值6.0,提取时间90 min,提取温度50 ℃条件下,其多糖提取率最高,为5.46%;此外,方差分析结果表明,各因素对多糖提取率的影响程度为:D(温度)>A(液料比)>B(pH)>C(时间)。通过考察梁平柚柚皮多糖的DPPH自由基清除率、·OH清除率![]() 清除率来衡量其抗氧化性。结果表明,在一定浓度范围内,其抗氧化性具有明显的剂量效应关系,其DPPH自由基清除率、·OH清除率和
清除率来衡量其抗氧化性。结果表明,在一定浓度范围内,其抗氧化性具有明显的剂量效应关系,其DPPH自由基清除率、·OH清除率和![]() 清除率的IC50值分别为1.71、1.43和5.37 mg/mL。表明梁平柚柚皮多糖具有良好的抗氧化能力,可作为天然的抗氧化剂来源,为梁平柚的综合利用提供一定参考。
清除率的IC50值分别为1.71、1.43和5.37 mg/mL。表明梁平柚柚皮多糖具有良好的抗氧化能力,可作为天然的抗氧化剂来源,为梁平柚的综合利用提供一定参考。
[1] 张军.梁平柚鼠李糖基转移酶基因Cm1, 2RhaT的克隆及表达分析[D].重庆:西南大学, 2012.
ZHANG J.Cloning and expression analysis of a rhamnosyl transferase gene Cm1,2RhaT from Citrus maxima cv.Liangping[D].Chong-qing:Southwest University,2012.
[2] 吴兴文. 用现代管理技术助推梁平柚产业发展[J].中国果业信息,2018,35:14-15;18.
WU X W.Promoting the development of Liangping pomelo industry with modern management technology[J].China Fruit News,2018,35:14-15;18.
[3] METHACANON P,KRONGSIN J,GAMONPILAS C.Pomelo (Citrus maxima) pectin:Effects of extraction parameters and its properties[J].Food Hydrocolloids,2014,35(3):383-391.
[4] 彭述辉, 黄泳梅,刘胜龙,等.梁平柚皮抗氧化作用的研究[J].安徽农业科学,2006,34(1):3-8.
PENG S H,HUANG Y M,LIU S L,et al.Study on antioxidation of Liangping pomelo peel[J].Journal of Anhui Agricultural Sciences,2006,34(1):3-8.
[5] 陈文娟, 陈建福.超声辅助提取血柚皮多糖工艺优化及其对自由基的清除作用[J].南京师大学报(自然科学版),2014,37(1):141-146.
CHEN W J,CHEN J F.Optimization of ultrasonic-assisted extracting and free radicals scavenging of polysaccharides from blood pummelo peel[J].Journal of Nanjing Normal University (Natural Science Edition),2014,37(1):141-146.
[6] 赵玲华. 沙田柚柚子皮多糖提取分级及保润性研究[D].广州:仲恺农业工程学院,2015.
ZHAO L H.Study on extraction and separation of polysaccharide from pomelo peel and moisture character[D].Guangzhou:Zhongkai University of Agriculture and Engineering,2015.
[7] CHEN Y,YAO F K,MING K,et al.Polysaccharides from traditional Chinese medicines:extraction,purification,modification,and biological activity[J].Molecules,2016,21(12):1 705-1 709.
[8] 董宇, 林翰清,缪松,等.酶法提取多糖的研究进展[J].食品工业科技,2021,42(3):351-358.
DONG Y,LIN H Q,MIAO S,et al.Advances in enzymatic extraction of polysaccharides[J].Science and Technology of Food Industry,2021,42(3):351-358.
[9] 郭文,陶红,于立梅,等.柚皮多糖提取分级及分子质量的分布[J].食品与发酵工业,2015,41(3):233-237.
GUO W,TAO H,YU L M,et al.The extraction of polysaccharide from pomelo peel and its molecules weight distribution[J].Food and Fermentation Industries,2015,41(3):233-237.
[10] 杨勤, 谷文超,周浓,等.苯酚-硫酸法与蒽酮-硫酸法测定地参多糖的比较研究[J].食品科技,2020,45(1):343-350.
YANG Q,GU W C,ZHOU N,et al.Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in Lycopus lucidus Tilrcz. var. Hirtus Regel[J].Food Science and Technology,2020,45(1):343-350.
[11] LIAO J Z,LI C Y,HUANG J.et al.Structure characterization of honey-processed Astragalus polysaccharides and its anti-inflammatory activity in vitro[J].Molecules,2018,23(1):168.
[12] 江飞凤, 谭晓辉,胡鹏刚,等.超声-微波协同提取柚子皮多糖工艺优化及单糖组成、结构和抗氧化活性分析[J].食品与发酵工业,2021,47(2):196-204.
JIANG F F,TAN X H,HU P G,et al.Optimization of ultrasonic-microwave extraction process of pomelo peel polysaccharide and analysis of monosaccharide composition,structure and antioxidant activity[J].Food and Fermentation Industries,2021,47(2):196-204.
[13] LI J X,DONG J Q,OUYANG J,et al.Synthesis,characterization,solubilization,cytotoxicity and antioxidant activity of aminomethylated dihydroquercetin[J].Med Chem Comm,2017,8(2):353-363.
[14] CAO M,WANG S L,GAO Y M,et al.Study on physicochemical properties and antioxidant activity of polysaccharides from Desmodesmus armatus[J].Journal of Food Biochemistry,2020,44(7):e13243.
[15] DU X,WANG X,CHEN Y,et al.Antioxidant activity and oxidative injury rehabilitation of chemically modified polysaccharide (TAPA1) from Tremella aurantialba[J].Macromolecular Research,2018,26(6):479-483.
[16] 魏述众. 生物化学[M].北京:中国轻工业出版社,1996.
WEI S Z.Biochemistry[M].Beijing:China Light Industry Press,1996.
[17] ZHANG Z S,WANG F,WANG X M,et al.Extraction of the polysaccharides from five algae and their potential antioxidant activity in vitro[J].Carbohydrate Polymers,2010,82(1):118-121.
[18] 王华,王莹,胡仁和,等.复合酶法辅助提取番茄红素[J].食品工业,2013,34(12):60-63.
WANG H,WANG Y,HU R H,et al.Optimization of lycopene extraction from tomato pulp by compound enzymes method[J].The Food Industry,2013,34(12):60-63.
[19] BUCKOW R,KASTELL A,TEREFE N S,et al.Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J].Journal of Agricultural and Food Chemistry,2010,58(18):10 076-10 084.
[20] TANG H L,CHEN C,WANG S K,et al.Biochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L.[J].International Journal of Biological Macromolecules,2015,77:235-242.
[21] HE Y,LI W,ZHANG X,et al.Physicochemical,functional,and microstructural properties of modified insoluble dietary fiber extracted from rose pomace[J].Journal of Food Science and Technology,2020,57(4):1 421-1 429.
[22] 宋莎莎, 高菲,任迪峰,等.乌鸡肽铁(Ⅱ)螯合物的制备及红外光谱鉴定[J].食品与发酵工业,2013,39(6):13-17.
SONG S S,GAO F,REN D F,et al.Preparation and infrared spectrum identification of black-bone silky fowl oligopeptide-iron (Ⅱ) chelates[J].Food and Fermentation Industries,2013,39(6):13-17.
[23] ZHANG H,CHEN Y,WANG S,et al.Extraction and comparison of cellulose nanocrystals from lemon (Citrus limon) seeds using sulfuric acid hydrolysis and oxidation methods[J].Carbohydrate Polymers,2020,238:116 180.
[24] HAMMI K M,HAMMAMI M,RIHOUEY C,et al.Optimization extraction of polysaccharide from Tunisian Zizyphus lotus fruit by response surface methodology:Composition and antioxidant activity[J].Food Chemistry,2016,212:476-484.
[25] 张欢, 戴宏杰,陈媛,等.离子液体-球磨法制备柠檬籽纤维素纳米纤丝及其结构表征[J/OL].食品科学:1-12[2020-09-14].http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1506.164.html.
ZHANG H,DAI H J,CHEN Y,et al.Preparation and structure characterization of lemon seed cellulose nanofibrils based on ionic liquid-ball milling method[J/OL].Food Science:1-12[2020-09-14].http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1506.164.html.
[26] LUO Q L,TANG Z H,ZHANG X F,et al.Chemical properties and antioxidant activity of a water-soluble polysaccharide from Dendrobium officinale[J].International Journal of Biological Macromolecules,2016,89(89):219-227.
[27] XU Y,CLAI F,YU Z,et al.Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity[J].Food Chemistry,2016,194:650-658.
[28] ZHA S H,ZHAO Q S,CHEN J J,et al.Extraction,purification and antioxidant activities of the polysaccharides from maca (Lepidium meyenii)[J].Carbohydrate Polymers,2014,111:584-587.
[29] 任玮. 嗜热链球菌胞外多糖的制备、结构特征及流变特性研究[D].上海:上海理工大学,2016.
REN W.Study on preparation,structure and rheological properties of exopolysaccharide from a Streptococcus thermophilus AR333[D].Shanghai:University of Shanghai for Science and Technology,2016.
[30] 刘昕, 刘京熙,张健,等.仿刺参卵多糖的分离纯化及体外抗肿瘤活性[J].食品科学,2016,37(23):105-110.
LIU X,LIU J X,ZHANG J,et al.Purification and antitumor activity in vitro of polysaccharides from Apostichopus japonicus spawn[J].Food Science,2016,37(23):105-110.
[31] CHEUNG Y,SIU K,LIU Y,et al.Molecular properties and antioxidant activities of polysaccharide-protein complexes from selected mushrooms by ultrasound-assisted extraction[J].Process Biochemistry,2012,47(5):892-895.
[32] 曹渊, 徐彦芹,夏之宁.酶法及其联用技术在中草药提取中的应用[J].中药材,2008,31(12):1 924-1 928.
CAO Y,XU Y J,XIA Z N.Application of enzyme method and its combination technology in extraction of Chinese herbal medicine[J].Journal of Chinese Medicinal Materials,2008,31(12):1 924-1 928.
[33] CHAMANI E,TAHAMI S K,ZARE N,et al.Effect of different cellulase and pectinase enzyme treatments on protoplast isolation and viability in Lilium ledebeourii bioss[J].Notulae Botanicae Horti Agrobotanici Cluj-napoca,2012,40(2):123-128.
[34] CUI J F,REN W B,ZHAO C Y,et al.The structure-property relationships of acid-and alkali-extracted grapefruit peel pectins[J].Carbohydrate Polymers,2020,229:115 524.
[35] 林诺怡,刘袆帆,王琴,等.金柚幼果粗多糖的结构鉴定与免疫调节作用[J].现代食品科技,2020,36(9):1-8.
LIN N Y,LIU H F,WANG Q,et al.Structural characterization and immunomodulatory activity of polysaccharide extracted from pomelo fruitlets[J].Modern Food Science and Technology,2020,36(9):1-8.
[36] 艾于杰.抗氧化活性茶多糖构效关系研究[D].武汉:华中农业大学,2019.
AI Y J.Study on the structure-activity relationship of antioxidant tea polysaccharides[D].Wuhan:Huazhong Agricultural University,2019.