谷氨酸是有机体内氮代谢的基础氨基酸之一,在生命体内物质代谢方面扮演着重要的角色[1-3]。由于其独特的生理功能,被广泛应用于食品、医药、化工、化妆品和饲料行业,成为了世界上产量最大的氨基酸产品[4-5]。目前,生物素亚适量型菌株是谷氨酸发酵较为普遍使用的菌株,具有发酵周期短、产酸稳定、提取收率高和不易染菌等优点[6]。但从整个发酵周期来看,不难发现采用生物素亚适量工艺发酵时,在发酵后期菌体活力和产酸速率会有大幅度的下降,同时伴随着泡沫的大量产生。这是由于菌体的生产能力不仅取决于菌体本身的性能,还必须给予菌体合适的环境,在发酵后期,培养基中养分不足以维持菌体正常生理代谢和合成产物的需要时,菌体活力下降,过早自溶[7],而谷氨酸菌体的衰老自溶使得菌体蛋白和胶体物质析出,加剧泡沫的产生,降低氧的传递效率[8-9]。随着发酵液中溶氧的降低,谷氨酸脱氢酶的活力下降,乳酸脱氢酶活力上升,胞内氧化还原电势升高,在其共同作用下,谷氨酸发酵的代谢流流向三羧酸(tricarboxylic acid,TCA)循环的还原臂途径和乳酸合成途径,从而导致谷氨酸产量下降和杂酸产量的上升[10]。
全营养流加主要是选择适当的全营养培养,在合适的时间内进行营养的补加,通过补加的营养来弥补菌体因生长代谢而消耗的营养物质,使其一直处于适宜的生活环境中,从而提高菌体活力、防止菌体衰老,进而使得代谢流充分地流向谷氨酸,避免杂酸的产生;采取全营养流加时,可以相应地降低初始发酵培养基浓度,解除初期培养基营养过丰富导致的营养中毒、抑制菌体生长的问题,同时防止过高的渗透压对菌体的抑制。
本研究以生物素亚适量型菌株黄色短杆菌GDK-9为供试菌株,采用全营养流加的方式,通过对全营养流加的时间、浓度及持续流加时间进行了探究,为解决生物素亚适量型菌株发酵生产谷氨酸时由于菌体活力下降所带来的一系列问题提出建设性意见,从而提高菌体的产酸能力,进一步提高谷氨酸产量。
1 材料与方法
1.1 菌种
L-谷氨酸生产菌:生物素亚适量型菌株黄色短杆菌GDK-9,天津科技大学代谢工程研究室保藏。
1.2 培养基
1.2.1 活化斜面培养基
葡萄糖2 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母粉5 g/L,KH2PO4·3H2O 1 g/L,MgSO4·7H2O 0.2 g/L,琼脂粉25 g/L。
1.2.2 种子培养基
葡萄糖35 g/L,玉米浆干粉15 g/L,豆浓22 mL/L,K2HPO4·3H2O 3 g/L,MgSO4·7H2O 1 g/L,蛋氨酸0.5 g/L,苏氨酸 1 g/L,丁二酸1 g/L,FeSO4·7H2O 5 mg/L,MnSO4·H2O 5 mg/L,微量元素[Na2 Mo4·2H2 O 2.5 g/L,Al(SO4 )3·18H2 O,2.25 g/L,NiCl2·6H2 O,1.6 g/L,CaCl2·2H2 O,10g/L,CuSO4·5H2 O,0.4 g/L]2 mL/L,VB1 0.5 mg/L,VB3 0.5 mg/L,VB5 0.5 mg/L,VB12 0.5 mg/L,氯化胆碱0.1 g/L,甜菜碱0.1 g/L。
1.2.3 发酵培养基
MnSO4·H2O 10 mg/L,MgSO4·7H2O 1.8 g/L,FeSO4·7H2O 5 mg/L,Na2HPO4·12H2O 3.5 g/L,KCl 1.8 g/L,VB1 0.5 mg/L,VB3 0.5 mg/L,VB5 0.5 mg/L,VB12 0.5 mg/L,糖蜜1.2 g/L,玉米浆干粉2.5 g/L,豆浓15 mL/L,微量元素溶液2 mL/L,氯化胆碱0.1 g/L,甜菜碱0.1 g/L。
1.2.4 流加培养基
MnSO4·H2O 10 mg/L,MgSO4·7H2O 1.8 g/L,FeSO4·7H2O 5 mg/L,Na2HPO4·12H2O 3.5 g/L,KCl 1.8 g/L,VB1 0.5 mg/L,VB3 0.5 mg/L,VB5 0.5 mg/L,VB12 0.5 mg/L,豆浓15 mL/L,微量元素溶液2 mL/L,氯化胆碱0.1 g/L,甜菜碱0.1 g/L。
1.3 主要仪器
LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;Agilent 1200高效液相色谱仪,Agilent Technologies;KQ-C高压蒸汽发生器,上海奉贤协新机电厂;752分光光度计,上海分析仪器厂;OLYMPUS生物显微镜,日本OLYMPUS会社。
1.4 培养方法
1.4.1 菌种活化
使用接种环每次从保藏在-80 ℃的甘油管中蘸取2~3环菌液,然后均匀接种于3支一代斜面培养基上,于32 ℃培养箱中培养12 h,之后再从培养好的一代斜面培养基中取一环菌体接种于二代斜面培养基上,于32 ℃培养箱中培养12 h。
1.4.2 一级种子培养
将3支活化好的菌种斜面分别接种到3个1 L圆底烧瓶中,每个烧瓶中含有100 mL的种子培养基,然后将其放置于32 ℃,220 r/min的摇床上,培养6~8 h。
1.4.3 二级种子培养
将培养好的一级种子,通过发酵罐进样口接种到含有种子培养基的5 L发酵罐中,通过流加氨水,pH控制在7.0附近,温度34 ℃,溶氧维持在30%~50%。
1.4.4 发酵培养
当OD600达到15左右时,按体积分数为20%的接种量接入含有发酵培养基的5 L发酵罐中。发酵过程中通过流加氨水,将pH控制在7.0附近,通过控制转速和通风量将溶氧稳定在30%~50%。初始发酵温度为34 ℃,每4 h提高0.5 ℃,提至36 ℃(16 h)后至发酵结束不变,发酵时间为30~32 h。
1.5 检测方法
1.5.1 pH的测定
采用发酵罐自带的梅特勒pH电极进行测定,pH 6.4~8.0时采用精密pH试纸辅助测定。
1.5.2 残糖含量检测
每隔2 h取样,离心取上清液,将其稀释100倍,用生物传感分析仪检测残糖含量。
1.5.3 菌体量检测
每隔2 h取样,分别稀释10、20、50、100倍,用紫外可见分光光度计测量OD600,其吸光值范围在0.2~0.8,如超过量程后需换下一个稀释倍数。按公式(1)计算菌体生物量:
菌体生物量=OD600×稀释倍数
(1)
1.5.4 有机酸和氨基酸的测定
使用高效液相色谱分析仪进行有机酸测定,首先,取1 mL的发酵液置于1.5 mL的离心管中,12 000 r/min离心5 min,取其上清液并进行适当倍数稀释,然后过0.22 μm微孔滤膜,最后采用液相色谱分析仪进行含量检测;色谱柱条件:Bio-Rad Aminex HPX-87H色谱柱(300 mm×7.8 mm,8 μm),0.04 mol/L硫酸缓冲液洗脱,柱温32 ℃,流速0.4 mL/min,检测波长为210 nm。
发酵液中氨基酸(副产物)含量采用氨基酸分析仪进行检测,发酵液的预处理方式同上述有机酸测定,稀释适当倍数后,然后过0.22 μm微孔滤膜,最后使用氨基酸分析仪进行定量检测;色谱条件:LCAK06/Na色谱柱(4.6 mm×152 mm),体积分数50%的乙腈溶液和4.1 g/L的乙酸钠溶液为流动相,进行同时洗脱,柱温58 ℃,流速0.50 mL/min,检测波长为570和440 nm。
1.5.5 蛋白质含量的测定
采用总蛋白定量测试盒进行测定[11-12]。
1.5.6 糖酸转化率计算
按照公式(2)计算糖酸转化率:
糖酸转化率![]()
(2)
式中:ρ,L-谷氨酸质量浓度,g/L;V,发酵液总体积,L;m,总耗糖量,g。
1.6 数据处理
所有实验数据取3次实验的平均值。单因素方差分析之后 Dunnet t 检验来确定数据差异的显著性(P<0.05)。
2 结果与讨论
2.1 开始流加时间对L-谷氨酸生产的影响
分别从发酵开始后的0 h(延滞期)、2 h(对数生长期)、8 h(稳定期)和20 h(衰亡期)开始流加体积分数为30%的流加培养基,通过对其菌体量和L-谷氨酸产量的测定,明确不同的起始流加时间对菌体生长和L-谷氨酸产量的影响,结果如图1、图2所示。

图1 开始流加时间对于GDK-9生长的影响
Fig.1 Influence of the start time of feeding on the growth of GDK-9

图2 开始流加时间对L-谷氨酸产量的影响
Fig.2 Effect of the start time of feeding on the production of L-glutamic acid
由图1可知,策略E为不流加发酵,最大菌体量为51,菌体量在20 h开始出现明显下降。采用全营养流加策略后,策略A、B、C和D的最大菌体量分别达到了60、62.2、52.9和51.3,与策略E相比分别提高了17.6%、22.0%、3.7%和1.2%;菌体量出现明显下降时间分别为24、24、22和20 h,分别向后推迟了4、4、2和0 h。从图2中可以看出,策略J(不流加发酵)的L-谷氨酸产量为135 g/L,转型时间为4 h。采用全营养流加后,策略F、G、H和I的谷氨酸产量分别为153、160、142和137 g/L,提升了13.3%、18.5%、5.2%和1.5%;转型时间分别为2、2、4和4 h,分别提前了2、2、0和0 h。
经过分析可知,0和2 h开始流加,此时为菌体的对数生长期,及时补充菌体消耗的必须营养物质使得菌体一直处于最适生长状态,菌体生长速度加快,菌体量大,菌体间竞争生物素,使得菌体细胞膜通透性更好,进而转型时间提前,产酸速率提高;8和20 h开始流加,一方面因为在对数生长期没有流加,营养物质大量消耗,菌体生长缓慢,另一方面又因为发酵培养基中生物素亚适量,两方面的共同作用导致了单位菌体利用的生物素高于策略A和B,细胞膜通透性较差,剩余的生物素不足以支持菌体继续增长,加上全营养培养基中不含有生物素,因此菌体量不再增长,最大菌体量相对较低、转型慢、产酸速率低。发酵后期,流加的全营养培养基补充了菌体代谢所需的必须营养物质,进而使得菌体活力得到增强,产酸时间延长,菌体下降速率减缓。选择合适的时间开始流加才能对菌体的增长和L-谷氨酸产量起到积极作用,因此,选择在2 h开始流加全营养培养基。
2.2 不同体积分数流加对L-谷氨酸生产的影响。
为了探究全营养培养基的流加体积分数对菌体发酵性能的影响,分别按全营养培养基体积分数为20%、40%、60%、80%和100%配制流加液,通过发酵罐自带的蠕动泵以0.1 r/min的流加速度进行流加,保证流加的稳定性,从而确定最佳的流加体积分数,结果如图3和图4所示。
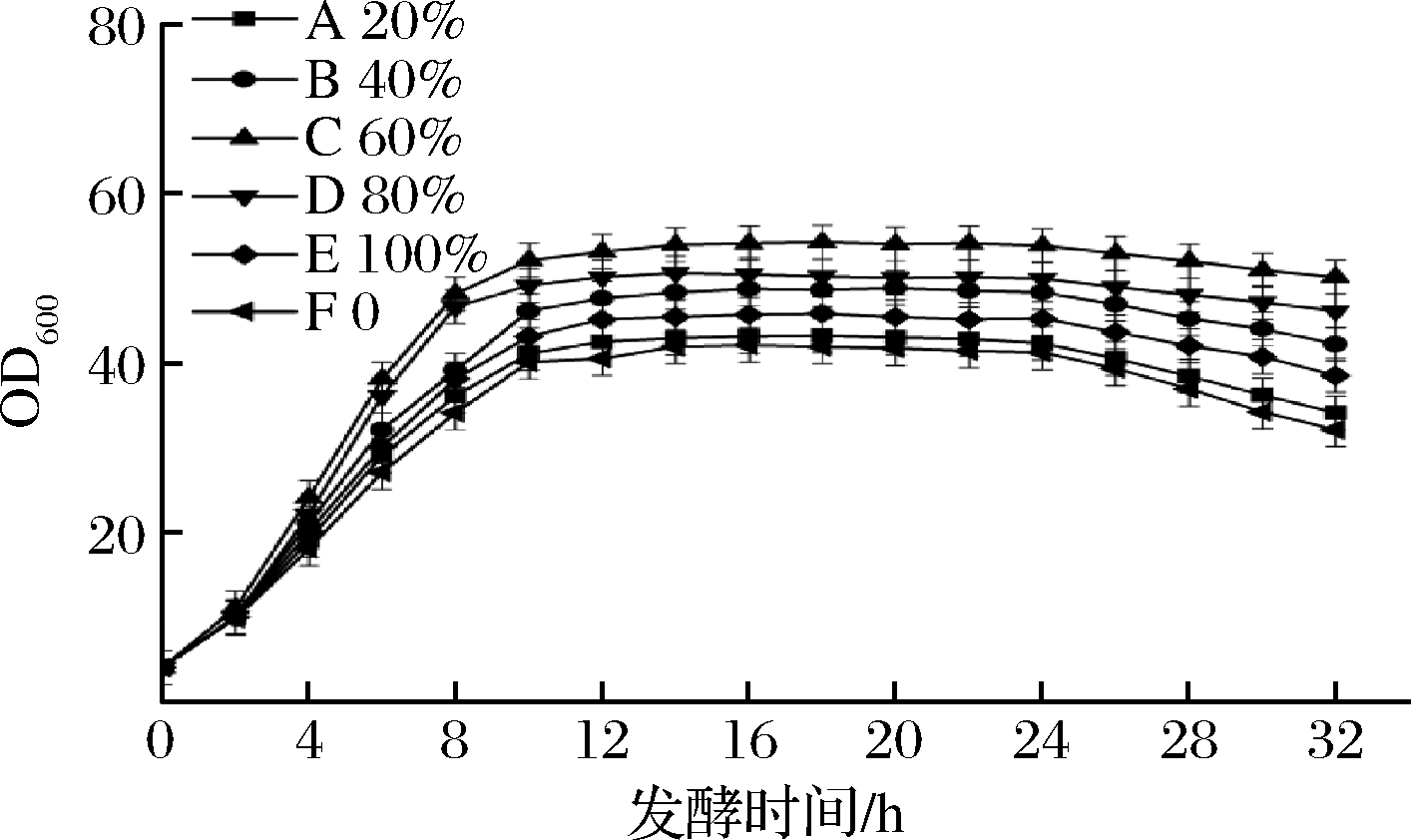
图3 不同流加浓度对于GDK-9生长的影响
Fig.3 Effect of different feed concentration on the growth of GDK-9
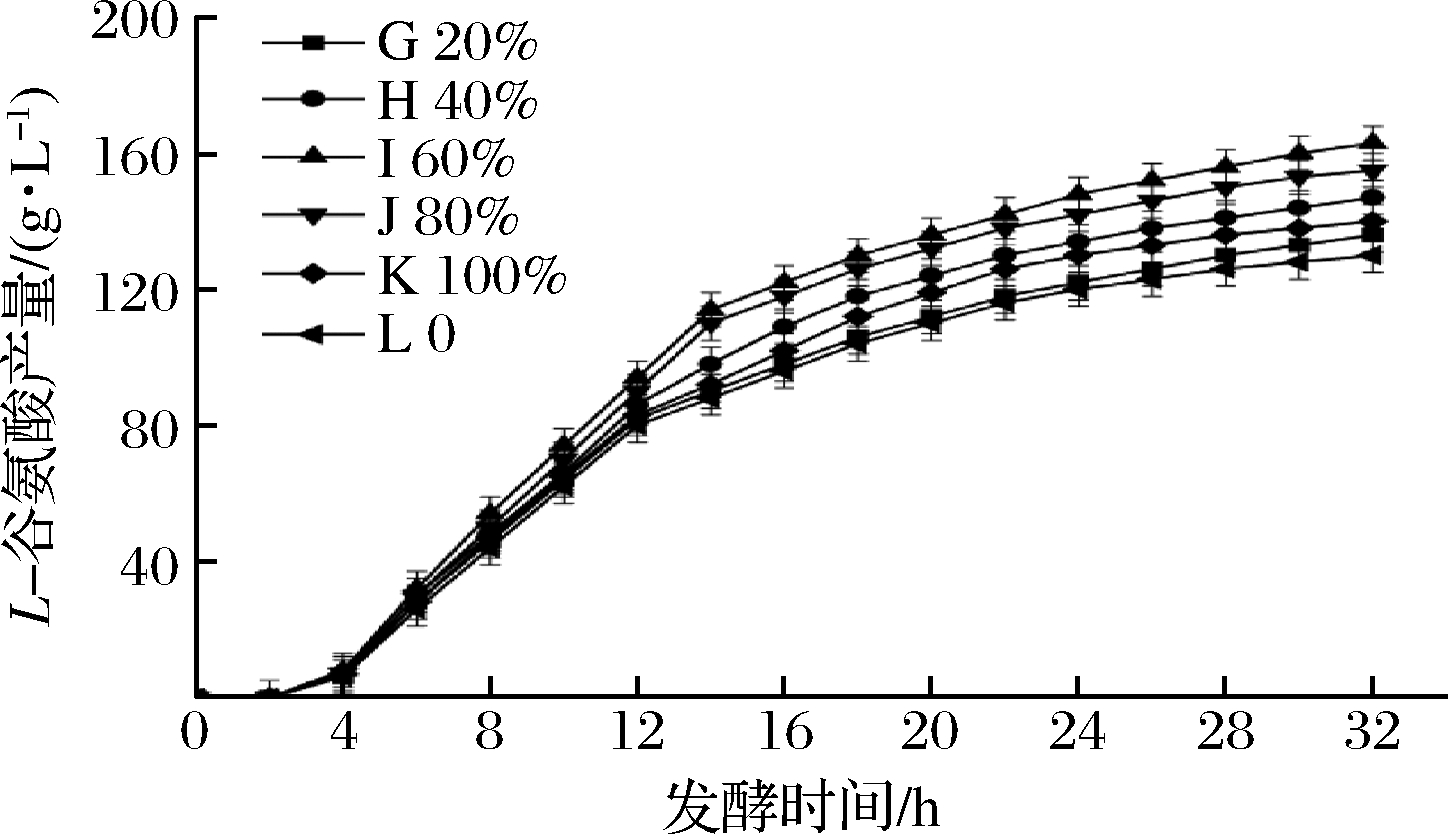
图4 不同流加浓度对于L-谷氨酸产量的影响
Fig.4 Effect of different feed concentration on L-glutamic acid production
从图3中可以看出,策略F为不流加发酵,最大菌体量为42,发酵结束的菌体量为32,菌体量下降幅度为10。采用全营养流加发酵时,随着流加体积分数的增加,菌体量和菌体增长速率先升高后下降,策略A、B、C、D、E最大菌体量分别为43.1、48.7、54.1、50.5和45.7,较策略F分别增加了2.6%、16.0%、28.8%、20.2%和8.8%;发酵结束的菌体量为34、42.1、50、46和38.4,菌体量下降幅度分别为9.1、6.6、4.1、4.5和7.3,较策略F降低了9%、34%、59%、55%和27%。由图4可知,策略L的L-谷氨酸产量为130 g/L,采用流加策略后,策略G、H、I、J、K的L-谷氨酸产量分别为136、147、163、155和140 g/L,分别提高了4.6%、13%、25.3%、19.2%和7.6%。
由上述结果可知,随着流加体积分数的提高,菌体量和L-谷氨酸产量均出现先升高后下降的现象,这是因为随着流加体积分数的提高,补充的营养物质逐渐能够弥补发酵液中营养物质的消耗,从而提高菌体活力,大幅度缓解了菌体的衰亡速率。当流加的体积分数超过60%时,底物抑制现象反而使菌体内部各种酶的活力下降,从而导致菌体自身活力下降,这时,全营养流加对于菌体的活力提升反而不明显[13-15]。综上所述,最佳流加的体积分数为60%。
2.3 不同持续流加时间对L-谷氨酸生产的影响
从2 h开始,用发酵罐自带的蠕动泵以0.1 r/min的恒定流速流加体积分数为60%的全营养培养基,分别采取持续流加8、16、24、30 h和不流加的策略,从而探究最佳持续流加时间。图5和图6为持续流加8、16、24、30 h和不流加时对发酵过程中菌体量及L-谷氨酸产量的测定结果。
如图5所示,随着流加时长的改变,不同策略间菌体量差异较大,策略E为不流加发酵,最大菌体量为51,发酵后期菌体量为38,较最大菌体量下降幅度为13;不同流加策略A、B、C、D的最大菌体量分别为63.2、66.8、67和67.3,较策略E分别提高了23.9%、30.9%、31.3%和31.9%;发酵后期的菌体量分别为53.5、58.5、61.5和62,下降幅度分别为9.7、8.3、5.5和5.3,较策略E分别降低了25.4%、36.2%、57.6%和59.2%。从图6可知,随着流加时长的增加,L-谷氨酸产量及生产速率逐渐提高,策略J(不流加发酵)的最终L-谷氨酸产量为137 g/L,策略F、G、J和I的L-谷氨酸产量分别为142、158、170、171.5 g/L,分别提高了3.6%、15.3%、24.1%和25.1%。

图5 流加时长对于GDK-9生长的影响
Fig.5 Effect of flow time on the growth of GDK-9
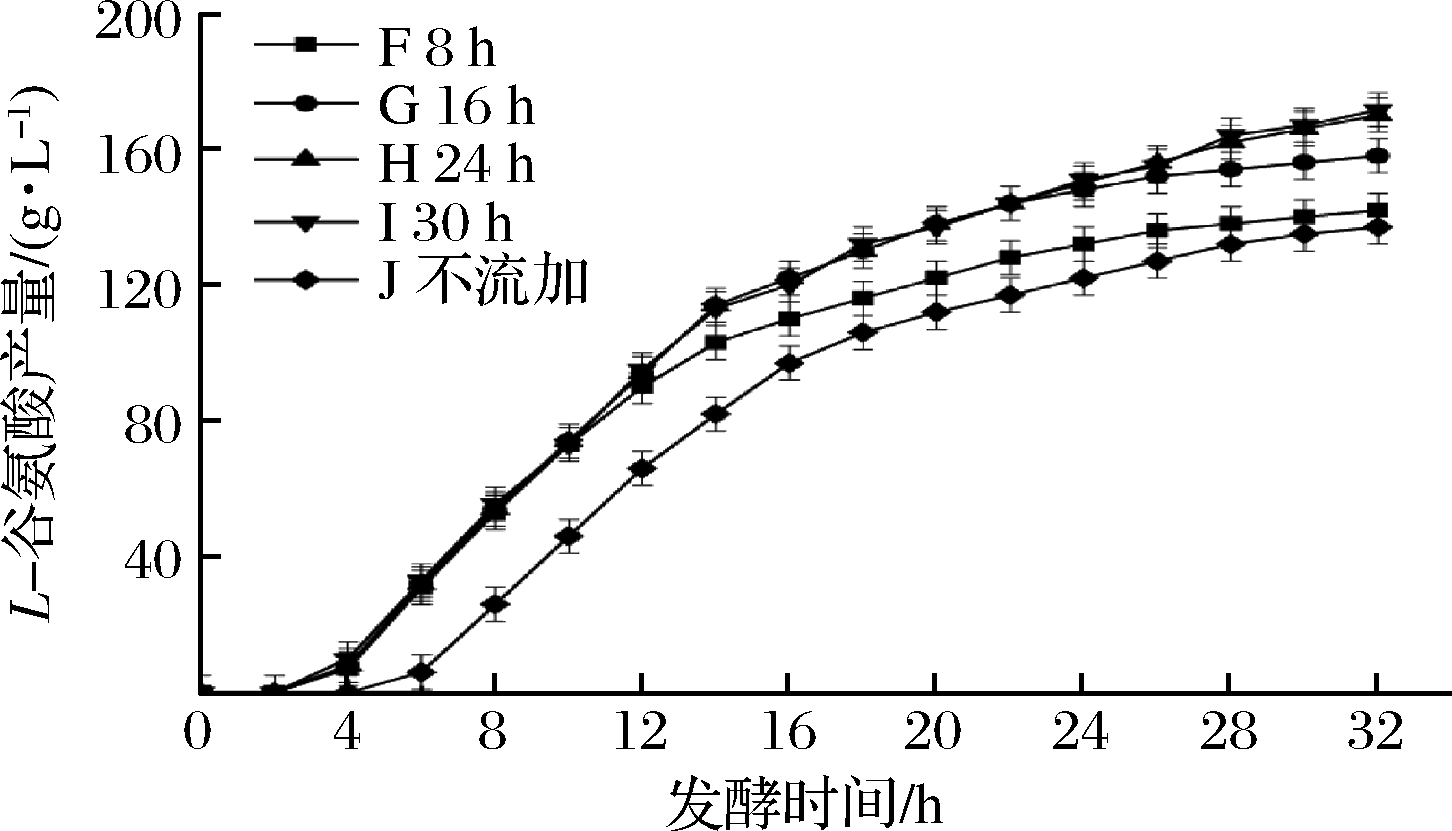
图6 流加时长对于L-谷氨酸产量的影响
Fig.6 Effect of feeding time on L-glutamic acid production
通过分析发现,流加8 h时,全营养流加对于菌体活力的提升仅能维持在对数增长期,对于稳定期的延长及菌体衰老死亡的缓解并不能起到作用;持续流加16 h时,稳定期出现延长,但衰亡期的OD600的下降速率与不流加发酵相比并没有明显下变化降;持续流加24和30 h结果差距不明显,说明当流加超过24 h后,全营养流加对于菌体发酵性能的提升效果大幅下降,继续流加反而导致成本的增加,因此基本确定流加24 h即可停止流加。
2.4 优化条件下的发酵验证
依据上述实验所得的最佳流加发酵条件为2 h开始流加,持续24 h流加体积分数为60%的全营养流加培养基,在此优化条件下进行3批次的发酵验证,结果如图7和图8所示。

图7 两种发酵方式对于GDK-9生长的影响
Fig.7 Effect of two fermentation methods on the growth of GDK-9
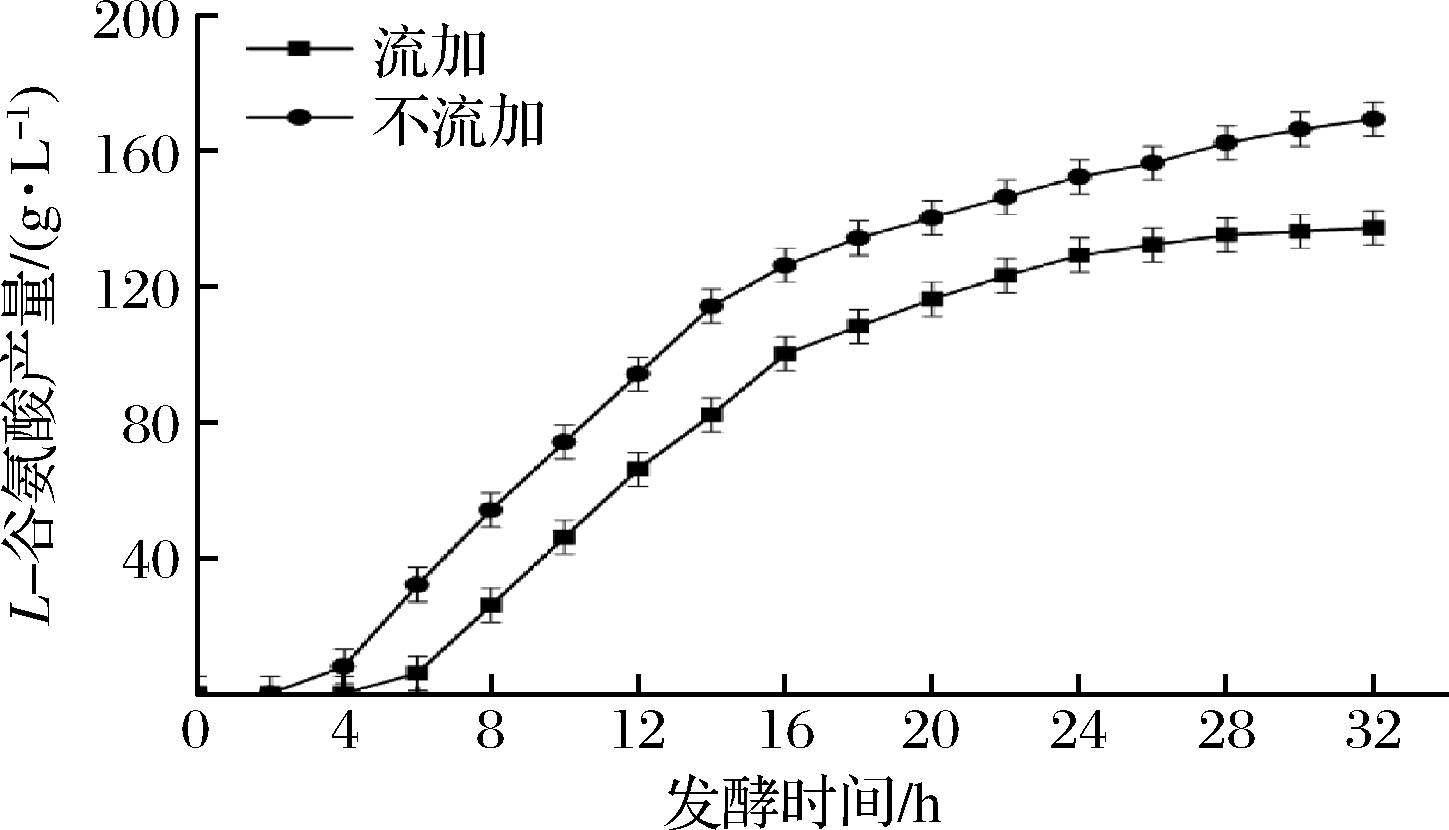
图8 两种发酵方式对于L-谷氨酸产量的影响
Fig.8 Effect of two fermentation methods on L-glutamic acid production
由图7可知,采用全营养流加策略后,2~8 h菌体增长速度加快,最大菌体量为66,相较于不流加发酵的53,提高了26.4%;菌体量出现明显下降的时间由原来的20 h推迟到了24 h;流加发酵菌体量下降幅度为8,较不流加发酵(10)降低了20%。表明全营养流加通过补充菌体消耗的必需营养物质,起到了加快菌体生长、维持菌体活力和缓解菌体衰老死亡的积极作用。由图8可知,不流加发酵开始产酸时间为4 h,而全营养流加发酵通过及时补加菌体生长代谢所消耗的营养物质,使得菌体活力提高,生长速度加快,菌体间竞争有限的生物素,从而使得菌体细胞膜通透性较不流加发酵更好,开始产酸时间提前到2 h,镜检发现此时部分菌体已经开始拉长、膨大转变为产酸型菌株,菌体的产酸速率也比不流加发酵要高。最终,流加发酵的L-谷氨酸产量为168 g/L,相较于不流加发酵的137 g/L,提高了23.4%。
在发酵过程中,代谢副产物也是影响菌体发酵性能的一大因素[16-17],因此,本研究在优化条件下对其发酵液中的乳酸、丙氨酸及糖酸转化率进行了测定分析,结果如图9和表1所示。
通过对上述结果分析发现,采用全营养流加策略,一方面及时流加的全营养培养基解决了发酵过程中必需营养物质缺乏的问题,提高了菌体活力,从而提升了TCA循环的速率和通量,使得丙酮酸不会被过多积累[18-19];另一方面,菌体活力的增加也缓解了菌体的衰老死亡,发酵后期菌体量下降幅度降低,因而产生的菌体蛋白也相对降低,经测定发酵液中的可溶性蛋白含量由18.5 g/L降低到了14.9 g/L,降低了19.4%,可溶性蛋白的减少使得泡沫不再大量产生,保证了氧气的传递效率,降低了乳酸脱氢酶等酶的活力,使得丙酮酸尽可能的流向谷氨酸[20]。因此,由丙酮酸生成的副产物乳酸和丙酮酸分别由不流加发酵的3.6和2.5 g/L降低到了3.1和2.06 g/L,糖酸转化率也从不流加发酵的61.5%提高到了流加发酵的63%。

图9 两种发酵方式对于可溶性蛋白、乳酸和丙氨酸含量的影响
Fig.9 Effect of two fermentation methods on the content of soluble protein, lactic acid and alanine
表1 两种发酵方式对糖酸转化率的影响
Table 1 Effect of two fermentation methods on the conversion rate of sugar and acid

组别发酵液体积/LL-谷氨酸产量/(g·L-1)耗糖量/g糖酸转化率/%不流加发酵413789161.5流加发酵41681 06663
3 结论
本研究通过实验分析得出,最佳流加条件为从发酵2 h开始流加,持续24 h流加体积分数为60%的流加培养基。在最佳流加条件下进行L-谷氨酸发酵验证,结果显示,在全营养流加条件下,菌体生长速率及菌体量明显提高,OD600达到了66,提升了29.4%,菌体转型时间由4 h提前到2 h,提前2 h;由于转型时间的提前及菌体活力的提升,稳定期时间延长了4 h,产酸量也得到了提高,L-谷氨酸产量为168 g/L,提高了约22.6%,副产物乳酸含量降低了13.8%,丙氨酸含量降低了17.6%,糖酸转化率为63%,提高了1.5%。因此,全营养流加在提高菌体活力、加快菌体产酸、缩短发酵周期、提高L-谷氨酸产量、降低副产物含量方面有积极作用,对于谷氨酸行业实现高效发酵具有借鉴意义。
[1] 丛泽峰,彭超,张宇,等.海藻糖酶应用于谷氨酸发酵的研究[J].中国调味品,2018,43(11):91-94.
CONG Z F,PENG C,ZHANG Y,et al.Application of trehalase in glutamic acid fermentation[J].Chinese Condiments,2018,43(11):91-94.
[2] 白长胜,韩隽,王刚,等.亚适量法L-谷氨酸发酵培养基的优化[J].中国调味品,2016,41(8):87-90.
BAI C S,HAN J,WANG G,et al.Optimization of fermentation medium for L-glutamic acid by sub-appropriate method[J].China Seasoning,2016,41(8):87-90.
[3] LEUCHTENBERGER W,HUTHMACHER K,DRAUZ K.Biotechnological production of amino acids and derivatives:Current status and prospects[J].Applied Microbiology & Biotechnology,2005,69(1):1-8.
[4] 杨阳,张苗苗,高越,等.谷氨酸棒状杆菌高效发酵谷氨酸的关键分子机理研究进展[J].食品工业科技,2019,40(5):311-315;321.
YANG Y,ZHANG M M,GAO Y,et al.Research progress on the key molecular mechanism of Corynebacterium glutamicum high-efficiency fermentation of glutamic acid[J].Science and Technology of Food Industry,2019,40(5):311-315;321.
[5] 张金玲,朱思荣,周万里,等.响应面优化生物素亚适量法生产谷氨酸工艺[J].中国调味品,2015,40(8):15-18;23.
ZHANG J L,ZHU S R,ZHOU W L,et al.Response surface optimization of biotin sub-appropriate method for producing glutamic acid[J].China Seasoning,2015,40(8):15-18;23.
[6] 李华玮,苏庆辉,李志江,等.谷氨酸生产行业现状综合分析[J].农产品加工(学刊),2005(8):65-67.
LI H W,SU Q H,LI Z J,et al.Comprehensive analysis on the current situation of glutamate production industry[J].Agricultural Product Processing (Journal),2005(8):65-67.
[7] ZHENG R,PAN F.Soft sensor modeling of product concentration in glutamate fermentation using gaussian process regression[J].American Journal of Biochemistry & Biotechnology,2016,12(3):179-187.
[8] LIU X.Effects of proteases on L-glutamic acid fermentation[J].Bioengineered,2019,10(1):646-658.
[9] 张路军,田孝俊,井金峰,等.浅析谷氨酸发酵生产中泡沫的产生及消除[J].发酵科技通讯,2004(4):16-17.
ZHANG L J,TIAN X J,JING J F,et al.Analysis of the production and elimination of foam in glutamic acid fermentation production[J].Journal of Fermentation Science and Technology,2004(4):16-17.
[10] 户红通, 徐达,徐庆阳,等.谷氨酸清洁发酵工艺研究[J].中国酿造,2018,37(10):56-61.
HU H T,XU D,XU Q Y,et al.Study on clean fermentation technology of glutamic acid[J].China Brewing,2018,37(10):56-61.
[11] 王为民,梁睿,吴国光.谷氨酸发酵液中蛋白含量的测定[J].发酵科技通讯,2006(1):13-14.
WANG W M,LIANG R,WU G G.Determination of protein content in glutamic acid fermentation broth[J].Journal of Fermentation Science and Technology,2006(1):13-14.
[12] 李江阳. 麦芽蛋白溶解对麦汁泡沫蛋白影响的研究[D].无锡:江南大学,2018.
LI J Y.Effect of maltoprotein dissolution on wort foam protein[D].Wuxi:Jiangnan University,2018.
[13] 王云龙,刘松,冯岳,等.L-天冬酰胺酶的补料分批发酵[J].食品与生物技术学报,2020,39(3):1-8.
WANG Y L,LIU S,FENG Y,et al.Fed-batch fermentation of L-asparaginase[J].Journal of Food and Biotechnology,2020,39(3):1-8.
[14] DING J,JIA L,MPOFU E,et al.An on-line adaptive glucose feeding system incorporating patterns recognition for glucose concentration control in glutamate fermentations[J].Biotechnology & Bioprocess Engineering,2016,21(6):758-766.
[15] LIU C,GONG Z,TEO K L,et al.Multi-objective optimization of nonlinear switched time-delay systems in fed-batch process[J].Applied Mathematical Modelling,2016,40(23-24):10 533-10 548.
[16] 付丙勇.谷氨酸发酵过程中乳酸的生成规律与策略[J].发酵科技通讯,2010,39(3):45-47.
FU B Y.The law and strategy of lactic acid production during glutamic acid fermentation[J].Journal of Fermentation Science and Technology,2010,39(3):45-47.
[17] 潘海亮,王灿,赵筱,等.大肠杆菌ptsG基因缺陷菌株的构建及其发酵混合糖产L-丙氨酸[J].中国酿造,2019,38(11):160-164.
PAN H L,WANG C,ZHAO X,et al.Construction and fermentation of mixed sugars to produce L-alanine in Escherichia coli by ptsG gene defect strain[J].Brewing in China,2019,38(11):160-164.
[18] HIRASAWA T,WACHI M.Glutamate fermentation-2:Mechanism of L-glutamate overproduction in Corynebacterium glutamicum[J].Adv Biochem Eng Biotechnol,2016,159:57-72.
[19] 户红通,徐达,徐庆阳,等.超声辅助细胞转型的谷氨酸发酵工艺[J].食品与发酵工业,2019,45(1):44-48.
HU H T,XU D,XU Q Y,et al.Ultrasound-assisted cell transformation of glutamic acid fermentation process[J].Food and Fermentation Industries,2019,45(1):44-48.
[20] 王震.谷氨酸棒状杆菌发酵生产L-精氨酸的溶氧条件优化[J].安徽农业科学,2019,47(7):120-123.
WANG Z.Optimization of dissolved oxygen conditions for L-arginine fermentation by Corynebacterium glutamate[J].Anhui Agricultural Science,2019,47(7):120-123.