葡萄酒的发酵主要包括两个阶段:由酵母参与的酒精发酵阶段和由乳酸菌参与的苹果酸-乳酸发酵阶段。在自然的条件下,即使不接种酵母和乳酸菌,葡萄上的野生酵母和乳酸菌也能启动和完成酒精发酵和苹乳发酵。自然酒精发酵主要是非酿酒酵母和酿酒酵母将葡萄中的糖转化为酒精并产生酯类、高级醇和醛类等风味物质的生物化学过程[1],接种酒精发酵则主要是由酿酒酵母(Saccharomyces cerevisiae)完成这一转化过程的,酒精发酵能够产生大量复杂的香气物质,尤其对果香型葡萄酒的质量有重要影响,也给陈酿型葡萄酒提供大量的香气前体物质。自然苹乳发酵是酒精发酵结束后,在多种乳酸细菌的作用下将L-苹果酸转化为L-乳酸,产生双乙酰、乙偶姻等多种风味物质的过程,接种苹乳发酵则主要由酒酒球菌(Oenococcus oeni)完成这一过程的。苹乳发酵能够改善葡萄酒的口感和香气,使葡萄酒变得更加圆润饱满,提升葡萄酒的感官品质[2]。
宁夏贺兰山东麓葡萄酒产区凭借其独特的地理优势,被业界公认为生产优质酿酒葡萄和葡萄酒的黄金地带。赤霞珠(Vitis vinifera L.Cabernet Sauvignon)是目前宁夏贺兰山东麓产区的主栽品种,该品种酿制的葡萄酒具有口感醇厚、香气浓郁的特点。然而,目前产区的葡萄酒酿造多依赖进口的商业菌株,商业菌株的广泛使用使得葡萄酒的同质化问题愈加严重,不利于本土特色葡萄酒的发展。贺兰山东麓产区多样化的葡萄种植区域蕴藏了丰富的酿酒微生物资源,这些野生的酿酒微生物在一定程度上有助于贺兰山东麓葡萄酒特色和风格的体现。有一些研究表明,自然发酵或使用分离于葡萄浆果、葡萄园和地窖的非酿酒酵母等本土菌株与酿酒酵母进行混合发酵,在复杂性和感官丰富度上对葡萄酒的感官轮廓发挥着至关重要的作用,有助于改善葡萄酒的香气、酒体,保护特定产区葡萄酒的感官典型性[3-5]。
本研究以贺兰山东麓青铜峡、红寺堡和银川3个子产区的赤霞珠为原料,采用自然和接种发酵,对酒精发酵和苹乳发酵后的葡萄酒中的挥发性化合物进行了研究分析,以探索不同子产区的原料在自然和接种条件下的发酵对葡萄酒挥发性化合物种类和含量的影响。研究有助于了解贺兰山东麓不同子产区的风土特色,为自然发酵葡萄酒和地域风土特色葡萄酒的生产提供依据。
1 材料与方法
1.1 材料与试剂
实验材料:2017年份宁夏贺兰山东麓青铜峡、红寺堡和石嘴山3个子产区的赤霞珠葡萄。
试剂:4-甲基-2-戊醇(色谱纯),日本TCI公司;NaCl,国药集团化学试剂有限公司。
1.2 仪器设备
气相色谱-质谱联用仪(Agilent 7890B-7000D)、DB-WAX色谱柱(30 mm×0.25 mm,0.25 μm),美国安捷伦科技有限公司;进样器(PAL RSI 85),瑞士CTC公司;萃取头CAR/PDMS/DVB(23 Ga,1 cm),美国Supelco公司。
1.3 实验方法
1.3.1 发酵实验设计
对采收的葡萄进行常规前处理,在该过程中不添加SO2。酒精发酵每个子产区采用2个180 L控温不锈钢发酵罐,装入约130 L除梗破碎后的葡萄醪,温度控制在25~28 ℃,每隔12 h打一次循环并测定温度和比重值。在酒精发酵结束采样后将2个罐的酒进行混合,分装满于 20 L不锈钢发酵罐中进行苹乳发酵,温度设定为18~20 ℃。其中2个进行自然苹乳发酵;另外2个接种法国诺盟生物科技有限公司的商业乳酸菌进行发酵,在此过程中,每隔48 h取一次样用于苹果酸-乳酸细菌的分离和苹果酸的测定。酒精发酵和苹乳发酵结束后的葡萄酒分别取样离心后,取上清液封装放入-20 ℃的冰箱冷冻保存待测定。
1.3.2 挥发性物质测定
(1)样品前处理
将冷冻在-20 ℃冰箱中的酒样取出放在装满冰块的盒子中自然解冻。配制内标:使用12.48 μL 4-甲基-2戊醇,定容到10 mL。解冻完成后,在20 mL顶空瓶中加1.5 g NaCl、5 mL酒样、10 μL 4-甲基-2-戊醇内标(2.01 mg/L),密封顶空瓶。
(2)HS-SPME条件
使用1 cm 23 Ga DVB/CAR/PDMS纤维(Supelco),萃取前250 ℃老化10 min。在250 r/min、40 ℃下平衡5 min,然后在40 ℃,250 r/min下萃取30 min后进样,进样口温度240 ℃,解吸10 min。
(3)GC条件
使用 DB-WAX(30 mm×0.25 mm, 0.25 μm, Agilent)色谱柱,不分流进样,载气高纯氦气(≥99.999%),起始柱温40 ℃,恒温5 min,然后依次以3 ℃/min升到97 ℃,以2 ℃/min升到120 ℃,以3 ℃/min升到150 ℃,以8 ℃/min升到220 ℃,保持10 min。
(4)MS条件
EI电离源:离子源温度230 ℃,传输线温度240 ℃,轰击电压70 eV,扫描范围40~300 u。
(5)定性与定量分析
通过NIST 2017质谱库,按文献的保留指数(retention index,RI)与计算RI对照定性。将C9-C20烷烃混合标准样品加入模拟酒,根据保留时间(retention time,RT)和对应烷烃的RI来计算未知香气物质的RI值。计算如公式(1)所示:
(1)
式中:RI,计算化合物保留指数;n,n个碳原子数的正构烷烃的峰顶保留时间,min;N,n个碳原子数的正构烷烃的峰尾保留时间,min;ti,化合物保留时间,min;t0,空气峰,平均流速下的死时间u=L/t0,min。
选用4-甲基-2-戊醇做内标,对挥发性成分进行相对面积定量分析。计算如公式(2)所示:
物质的浓度![]() 内标的浓度
内标的浓度
(2)
1.4 数据处理
采用Microsoft Office 2019进行基本图表制作,采用R(3.6.2)统计分析软件的agricolae、FactoMineR 和pheatmap程序包分别对挥发性化合物进行显著性分析、主成分分析和聚类分析。
2 结果与分析
2.1 酒精发酵及苹乳发酵过程控制
酒精发酵每隔12 h测定温度和比重值,当比重下降到0.992左右时,通过品尝和残糖含量的测定确定酒精发酵结束。苹乳发酵开始后,每2~5 d测1次苹果酸含量的变化,以此来监测苹乳发酵情况,结果如图1所示。3个子产区自然发酵和接种发酵葡萄酒的苹乳发酵均能完成,相对于接种苹乳发酵,自然苹乳发酵的启动和完成相对缓慢。
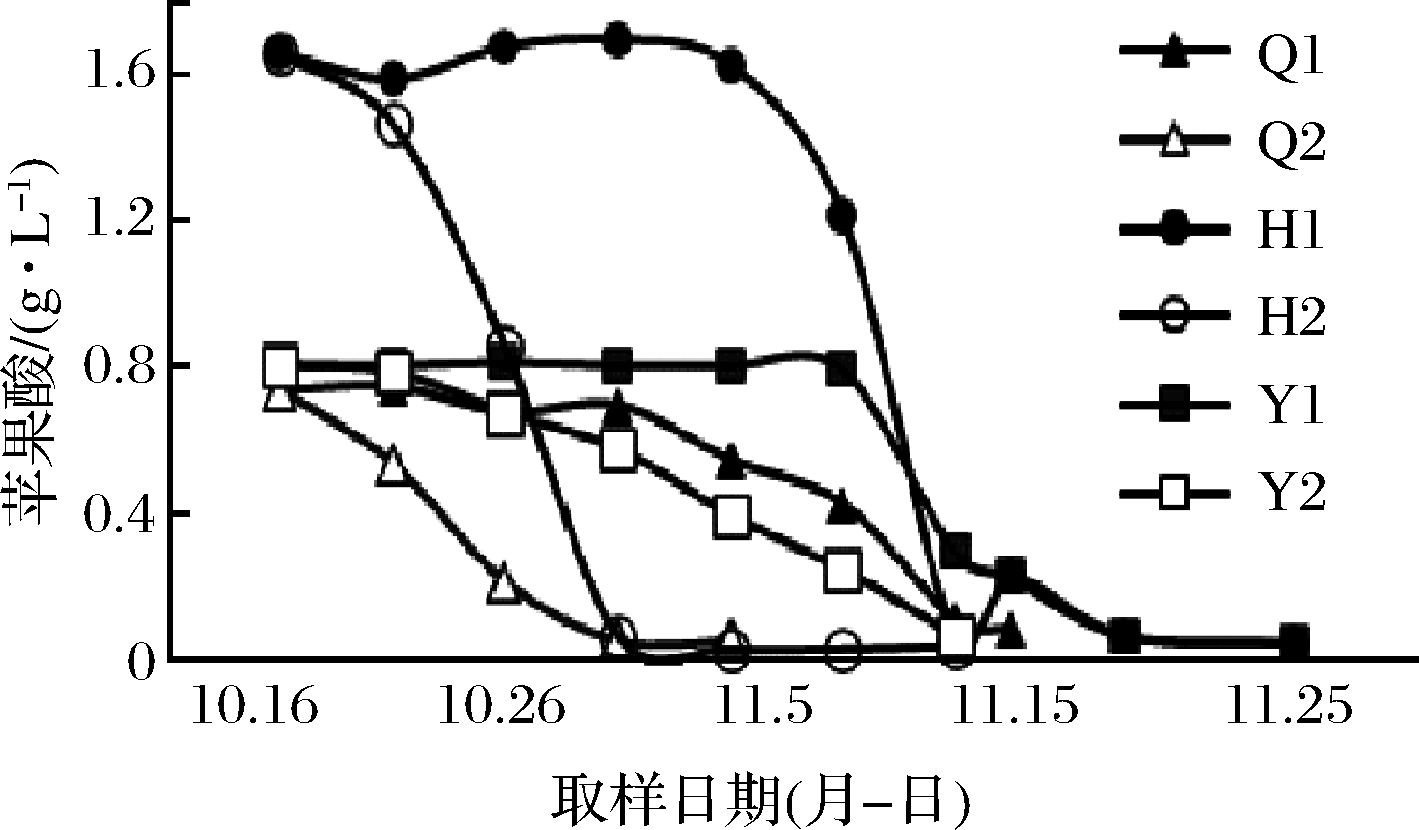
Q1-青铜峡自然发酵葡萄酒;Q2-青铜峡接种发酵葡萄酒;
H1-红寺堡自然发酵葡萄酒;H2-红寺堡接种发酵葡萄酒;
Y1-银川自然发酵葡萄酒;Y2-银川接种发酵葡萄酒
图1 不同子产区自然发酵和接种发酵葡萄酒
苹果酸值含量变化
Fig.1 Changes of malic acid during spontaneous and inoculated fermentation in different sub-regions
2.2 自然酒精发酵和接种酒精发酵对葡萄酒挥发性成分的影响
宁夏贺兰山东麓3个子产区自然和接种酒精发酵的葡萄酒中,共鉴定出42种挥发性化合物,包括酯类23种,醇类10种,萜烯类2种,醛酮类4种,3种其他挥发性化合物,仅乳酸异戊酯在红寺堡赤霞珠酒精发酵后的葡萄酒中未检出。与一些采用一种或几种经筛选的酵母[6-7]或乳酸菌[8-9]菌株发酵对葡萄酒香气进行研究的方式不同,本研究采用的是自然发酵的方式,并同接种发酵的葡萄酒进行比较。3个子产区自然酒精发酵和接种酒精发酵葡萄酒中各类挥发性化合物的含量如图2所示。

Q-青铜峡产区;H-红寺堡产区;Y-银川产区;
1-自然发酵;2-接种发酵(下同)
图2 青铜峡、红寺堡和银川产区自然和接种酒精
发酵葡萄酒中各种挥发性化合物的含量
Fig.2 Volatile composition of spontaneous and inoculated AF wines in Qingtongxia, Hongsipu and Yinchuan sub-regions
注:每个产区自然发酵与接种发酵之间不同小写字母
表示有显著性差异(P<0.05)(下同)
2.2.1 青铜峡产区自然酒精发酵和接种酒精发酵对葡萄酒中挥发性化合物的影响
青铜峡产区自然酒精发酵和接种酒精发酵的葡萄酒中的挥发性化合物在种类及含量上均以酯类为主,其次是醇类,还含有少量的萜烯类、醛酮类和其他几类挥发性化合物。由图2可知,其他含量较低的挥发性化合物以及各类挥发性化合物的总量在自然酒精发酵和接种酒精发酵的葡萄酒中均无显著性差异,仅从均值来看,自然酒精发酵葡萄酒中各类挥发性化合物(除醇类外)的含量及它们的总量均高于接种酒精发酵的葡萄酒,说明该产区可能存在有利于形成葡萄酒香气的优良酵母。
2.2.2 红寺堡产区自然酒精发酵和接种酒精发酵对葡萄酒中挥发性化合物的影响
红寺堡产区自然酒精发酵和接种酒精发酵的葡萄酒中,酯类物质在数量上虽然最多,但在含量上以醇类为主,其次是酯类,同样还含有少量的萜烯类、醛酮类和其他挥发性化合物。由图2可知,相对于另外2个产区,红寺堡产区各类挥发性化合物的含量及它们的总量均较低。可能是因为红寺堡产区的葡萄所积累的挥发性物质含量较低。
2.2.3 银川产区自然酒精发酵和接种酒精发酵对葡萄酒中挥发性化合物的影响
银川产区与红寺堡产区相似,自然酒精发酵和接种酒精发酵的葡萄酒的挥发性成分在含量上以醇类为主,其次是酯类,同样还含有少量的萜烯类、醛酮类和其他挥发性化合物。由图2可知,银川产区自然酒精发酵的葡萄酒中酯类、醇类和其他挥发性化合物以及它们的总量均低于接种酒精发酵的葡萄酒,但均无显著性差异。银川产区葡萄酒各类挥发性化合物及它们的总量仅从均值来看明显高于另外2个产区,可能是由于该产区的葡萄原料积累的挥发性物质较多。
2.3 自然苹乳发酵和接种苹乳发酵对葡萄酒挥发性成分的影响
苹乳发酵一直以来被认为是干红葡萄酒发酵过程中改善香气结构的重要发酵环节,但也有研究表明这一过程并不能对感官品质的改善起到重要作用[10]。本研究中,葡萄酒经苹乳发酵后,挥发性化合物的种类基本没变,仅含量上有所变化,此产区酒精发酵的葡萄酒中没有检出乳酸异戊酯,可能是由于该物质本身含量较低,此产区葡萄酒挥发性化合物的含量又总体相对较低,所以未检出。3个子产区自然和接种苹乳发酵后葡萄酒中各类挥发性化合物的含量如图3所示。

图3 青铜峡、红寺堡和银川产区自然和接种苹乳发酵
葡萄酒中各种挥发性化合物的含量
Fig.3 Volatile composition in spontaneous and inoculated MLF wines in Qingtongxia, Hongsipu and Yinchuan sub-regions
2.3.1 青铜峡产区自然苹乳发酵和接种苹乳发酵对葡萄酒中挥发性化合物的影响
青铜峡产区自然和接种苹乳发酵后葡萄酒中挥发性化合物在数量和含量上均以酯类为主,醇类次之,还含有少量其他挥发性化合物。由图3可知,青铜峡产区自然苹乳发酵和接种苹乳发酵葡萄酒中几类挥发性化合物含量及它们的总量均无显著性差异,但仅从均值来观察,青铜峡产区自然苹乳发酵后葡萄酒中的醇类、萜烯类、醛酮类以及各类挥发性化合物的总量均较接种苹乳发酵的葡萄酒高。此外,几种醇类物质中含量最高的苯乙醇在自然苹乳发酵葡萄酒中的含量明显高于接种苹乳发酵葡萄酒,苯乙醇是葡萄酒中一种重要的高级醇[11],它能给葡萄酒带来玫瑰、花粉和香水香气。自然苹乳发酵葡萄酒中的挥发性化合物在总量和质量上相对接种苹乳发酵葡萄酒更有优势,说明该产区可能存在利于本土葡萄酒苹乳发酵和提高葡萄酒质量的优良苹乳发酵菌株。
2.3.2 红寺堡产区自然苹乳发酵和接种苹乳发酵对葡萄酒中挥发性化合物的影响
红寺堡产区自然苹乳发酵和接种苹乳发酵葡萄酒中挥发性化合物在含量上以醇类为主,酯类次之,还含有少量其他挥发性化合物。由图3可知,红寺堡产区自然苹乳发酵的葡萄酒中的酯类(P<0.05)、萜烯类(P<0.01)及挥发性化合物的总量(P<0.05)均显著低于接种苹乳发酵的葡萄酒。
2.3.3 银川产区自然苹乳发酵和接种苹乳发酵对葡萄酒中挥发性化合物的影响
银川产区自然苹乳发酵和接种苹乳发酵葡萄酒中挥发性化合物在含量上以醇类为主,酯类次之,还含有少量其他挥发性化合物。由图3可知,仅从均值来观察,银川产区自然苹乳发酵葡萄酒中各类挥发性化合物的含量及它们的总量均低于接种苹乳发酵的葡萄酒,其中自然苹乳发酵的醇类(P<0.05)、萜烯类(P<0.05)和醛酮类(P<0.01)显著低于接种苹乳发酵葡萄酒。
2.4 各子产区葡萄酒挥发性成分的研究探讨
酯类和醇类物质在3个子产区葡萄酒中含量相对较高,其次为醛酮类和其他挥发性化合物。从3个子产区挥发性化合物的总量来看,银川产区最高(339.05~453.89 mg/L),其次为青铜峡产区(202.10~312.80 mg/L),红寺堡产区最低(134.00~175.72 mg/L)。银川产区葡萄酒中的醇类总量、醛酮类总量和其他化合物的总量较另外2个产区高,青铜峡产区的酯类总含量较另外2个产区高。为了进一步探讨产区间2种发酵方式下2个发酵阶段葡萄酒挥发性成分的差异,进一步对3个产区2种发酵方式、2个发酵阶段葡萄酒中的挥发性成分进行主成分分析和聚类分析。
2.4.1 三个子产区苹乳发酵前后挥发性成分主成分分析
分别对青铜峡、红寺堡和银川3个子产区苹乳发酵前后的挥发性成分进行主成分分析,分别提取2个主成分(Dim)。由图4可知,酒精发酵后葡萄酒中挥发性化合物的Dim1和Dim2分别为42.71%和28.80%,累计方差贡献率为71.51%,苹乳发酵后葡萄酒挥发性化合物的Dim1和Dim2分别为39.50%和29.56%,累计方差贡献率为69.06%。由葡萄酒个体因子分布图可知,3个产区的葡萄酒可实现较好的产区分布。且从挥发性成分的变量因子图和葡萄酒的个体因子图的分布来看,与苹乳发酵前相比,苹乳发酵后不同挥发性成分对不同产区葡萄酒的贡献有所变化。
青铜峡产区酒精发酵后的葡萄酒分布在第四象限,位于第四象限内的丁酸乙酯、月桂酸乙酯和葵酸乙酯等挥发性化合物对该产区葡萄酒香气的贡献较其他产区显著;红寺堡产区酒精发酵后的葡萄酒分布在第二象限,位于第二象限内的苯甲醇、异丁醇和正癸醇对该产区葡萄酒的香气贡献较其他产区显著;银川产区酒精发酵后的葡萄酒主要分布在第一象限,位于第一象限内的己酸乙酯、乙酸苯乙酯、苯乙醇等挥发性成分对该产区葡萄酒的香气贡献较其他产区显著。从酒精发酵后的主成分分析结果看,大多数挥发性化合物对银川产区和青铜峡产区的香气贡献更明显。苹乳发酵结束后,挥发性成分的变量因子图和葡萄酒的个体因子图的分布均有所变化,各类挥发性成分对不同产区葡萄酒的贡献度也产生变化,其中,苹乳发酵后对青铜峡产区葡萄酒贡献相对显著的挥发性化合物数量明显增加,青铜峡产区苹乳发酵后的葡萄酒分布在第一、二象限,位于一、二象限内的丁酸乙酯、癸醛和辛酸异戊酯等挥发性化合物对该产区葡萄酒的香气贡献较其他产区显著;与之相反,苹乳发酵后对另外2个产区葡萄酒香气贡献较为显著的挥发性化合物的数量明显减少,红寺堡产区苹乳发酵后的葡萄酒香气分布于第三象限,乙酸己酯对其贡献较其他产区显著;银川产区苹乳发酵后的葡萄酒分布在第四象限,位于第四象限内的异戊醇、苯乙醇和乙酸苯乙酯等挥发性化合物对该产区葡萄酒的香气贡献较其他产区显著。分析结果较好地体现了各类挥发性化合物在苹乳发酵前后,在几个产区葡萄酒中含量的消长变化。

a-酒精发酵(AF)后变量因子图;b-AF后个体因子图;c-苹乳发酵(MLF)后变量因子图;d-MLF后个体因子图
1-自然发酵;2-接种发酵;cf-重复
图4 酒精发酵后及苹乳发酵后挥发性成分变量因子图及个体因子图
Fig.4 Variable factor and individual factor graphs of volatile components after alcoholic and malolactic fermentation
2.4.2 三个子产区苹乳发酵前后挥发性成分聚类分析
对青铜峡、红寺堡和银川3个子产区苹乳发酵前后的挥发性成分进行聚类分析,进一步验证3个子产区在2种发酵方式下葡萄酒香气化合物的变化。实现不同发酵阶段、不同发酵方式及不同产区的聚集。由图5可知,对葡萄酒中挥发性成分影响程度由强到弱的因素依次为产区、发酵阶段、发酵方式。
挥发性化合物由上到下被聚为4大类,这4大类化合物在相对含量上的差异较好地实现了青铜峡、红寺堡和银川产区的分离,整体上,每个产区葡萄酒中的挥发性化合物的相对含量相对其他产区相近。每个产区苹乳发酵前后挥发性化合物相对含量又存在差异,可以较为直观地实现苹乳发酵前后2个发酵阶段的分离,其中,青铜峡产区酒精发酵结束后的葡萄酒中第一类以酯类为主的挥发性化合物的含量相对较高,苹乳发酵结束后的葡萄酒中第二类以醛酮类和酯类为主的化合物含量相对较高;红寺堡产区相对于青铜峡产区和银川产区而言,大部分挥发性化合物的含量均较低,仅酒精发酵后以醇类为主的第三类化合物在几个产区中含量相对较高;银川产区的葡萄酒中以酯类和醇类为主的第四类化合物的相对含量较高,此类挥发性化合物又分为两小类,可以很直观地观察到苹乳发酵前后挥发性化合物在相对含量上的区别。

图5 不同产区2种发酵方式下苹乳发酵前后挥发性化合物聚类热图
Fig.5 Cluster heat map of volatile compounds of wines before and after MLF under two fermentation treatment in three sub-regions
注:同一行代表同种物质在不同酒样中的含量,上方的聚类树根据不同酒样各类挥发性化合物含量
的相似度进行聚类,挥发性化合物含量由低到高用从蓝到红表示
由图5中各种物质颜色深浅变化可以观察到,3个产区的葡萄酒苹乳发酵结束后大部分挥发性化合物的含量降低,也有部分挥发性化合物的含量升高,其中乳酸乙酯、乳酸异戊酯、丁二酸二乙酯、正辛醇、2, 4-二甲基苯甲醛和2, 4-二叔丁基酚在3个产区自然及接种苹乳发酵后的葡萄酒中普遍升高,这与之前一些研究者的研究结果相符[12],但不同产区的部分挥发性化合物的变化会略有不同。例如,除上述物质在苹乳发酵后上升外,青铜峡产区的葡萄酒中辛酸异戊酯和异丁醇的含量在苹乳发酵后升高;红寺堡产区的葡萄酒中正己酸乙酯和正己醇在苹乳发酵后上升;银川产区的葡萄酒中3-羟基丁酸乙酯、乙酸苯乙酯、肉豆蔻酸乙酯、十六酸乙酯、正丁醇、苯甲醇、苯乙醇和香茅醇的含量升高。此外,与银川产区和红寺堡产区不同,青铜峡自然发酵的葡萄酒中苹乳发酵前后挥发性化合物的含量大多较对应阶段接种发酵葡萄酒中挥发性化合物含量高。可能是由于存在利于产生更多挥发性物质的本土优良菌株。
3 结论
本研究通过对贺兰山东麓产区3个子产区自然和接种发酵的葡萄酒中挥发性成分进行了分析,从3个子产区均鉴定出42种挥发性化合物,包括酯类23种,醇类10种,萜烯类2种,醛酮类4种,还有3种其他挥发性化合物,其中,酯类和醇类的含量相对较高。青铜峡子产区自然酒精发酵后各类挥发性化合物的含量(除醇类外)及总量均高于接种酒精发酵的葡萄酒,自然苹乳发酵后各类挥发性化合物的含量(除酯类外)及总量均较高于种苹乳发酵的葡萄酒。红寺堡子产区自然发酵和接种发酵的葡萄酒中各类挥发性化合物在3个子产区中的含量均最低,该子产区自然酒精发酵后各类挥发性化合物的含量和总量均较接种酒精发酵的葡萄酒低,自然苹乳发酵后葡萄酒中绝大多数挥发性化合物的含量均低于接种苹乳发酵的葡萄酒。银川子产区葡萄酒中各类挥发性化合物的含量是3个子产区中含量最高的,该子产区自然酒精发酵的葡萄酒中各类挥发性化合物及它们的总量均低于接种酒精发酵的葡萄酒,银川子产区自然苹乳发酵后的葡萄酒中各类挥发性化合物的含量及它们的总量均低于接种苹乳发酵的葡萄酒。通过分析苹乳发酵后葡萄酒中挥发性化合物的含量变化,发现乳酸乙酯、乳酸异戊酯、丁二酸二乙酯、正辛醇、2, 4-二甲基苯甲醛和2, 4-二叔丁基酚在3个子产区自然和接种苹乳发酵后的葡萄酒中普遍升高,但不同子产区间的其他挥发性化合物含量的变化会有所不同。总体来看,青铜峡产区自然酒精发酵与自然苹乳发酵的葡萄酒中大多数挥发性化合物的含量均高于接种发酵对应发酵阶段的葡萄酒,该产区可能存在可以产生更多挥发性化合物的本土优良菌株。此外,本研究发现对葡萄酒中挥发性化合物影响程度从高到低依次为子产区、发酵阶段和发酵方式。
[1] 金刚.苹果酸—乳酸发酵细菌的多样性及其耐酒精分析[D].杨凌:西北农林科技大学,2015.
JIN G.Study on diversity and ethanol tolerance of malolactic bacteria[D].Yangling:Northwest Agriculture and Forestry University,2015.
[2] 李华, 王华.葡萄酒工艺学[M].北京:科学出版社,2007.
LI H,WANG H.Wine technology[M].Beijing:Science Press,2007.
[3] CAPECE A,PIETRAFESA R,SIESTO G,et al.Selected indigenous Saccharomyces cerevisiae strains as profitable strategy to preserve typical traits of Primitivo wine[J].Fermentation-Basel,2019,5(4):17.
[4] GARCIN M,ESTEVE-ZARZOSO B,CRESPO J,et al.Influence of native Saccharomyces cerevisiae strains from DO “Vinos de Madrid” in the volatile profile of white wines[J].Fermentation-Basel,2019,5(4):1-11.
[5] UZKUC N M C,SISLR B,AY M,et al.Effects of spontaneous fermentation on Karalahna and Cabernet Sauvignon young red wines:Volatile compounds,sensory profiles and identification of autochthonous yeasts[J].European Food Research and Technology,2019,246(1):81-92.
[6] 尹荐, 陶永胜,孙玮璇,等.优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J].农业工程学报,2020,36(4):278-286.
YIN J,TAO Y S,SUN W X,et al.Optimizing the effect of non-Saccharomyces cerevisiae extracellular enzymes to enhance aroma for dry white wine[J].Journal of Agricultural Engineering,2020,36(4):278-286.
[7] MARTIN-GARCIA A,BALMASEDA A,BORDONS A,et al.Effect of the inoculation strategy of non-Saccharomyces yeasts on wine malolactic fermentation[J].OENO One,2020,54(1):101-108.
[8] 浩楠. 甘肃河西走廊葡萄酒产区苹乳发酵乳酸菌分离鉴定及其对葡萄酒品质的影响[D].兰州:甘肃农业大学,2019.
HAO N.Isolation and identification of lactic acid bacteria from malolactic fermentation in the Hexi Corridor wine production area in Gansu and its influence on wine quality[D].Lanzhou:Gansu Agricultural University,2019.
[9] 王诗, 王璐璐,赵丹丹,等.甘肃河西走廊产区本土酒酒球菌对赤霞珠干红葡萄酒香气品质的影响[J].食品与发酵工业,2020,46(15):245-251.
WANG S,WANG L L,ZHAO D D,et al.Analysis of the influence of the native Oeonococcus in Hexi Corridor of Gansu on the aroma quality of Cabernet Sauvignon dry red wine[J].Food and Fermentation Industries,2020,46(15):245-251.
[10] SAUVAGEOT F,VIVIER P.Effects of malolactic fermentation on sensory properties of four Burgundy wines[J].American Journal of Enology & Viticulture,1997,48(2):187-192.
[11] L.沃特豪斯 安,L.萨克斯 加,W.杰弗里 戴.葡萄酒化学[M].北京:科学出版社,2019.
ANDREW L,GAVIN L S,DAVID W J.Wine chemistry[M].Beijing:Science Press,2019.
[12] CELIK Z D,CABAROGLU T,KRIEGER-WEBER S.Impact of malolactic fermentation on the volatile composition of Turkish Kalecik karas red wines[J].Journal of the Institute of Brewing,2018.DOI:10.1002/jib.540.
red wines[J].Journal of the Institute of Brewing,2018.DOI:10.1002/jib.540.