红枣,是中国本土的鼠李目鼠李科枣属植物果实[1],富含可溶性糖[2]、蛋白质、酚酸类化合物、维生素及矿物质[3],具有一定的抗肿瘤、抗疲劳和预防心血管疾病等功能,被誉为果中补品王[4-5]。据报道,红枣中糖分质量分数达到50%~80%,蛋白质质量分数达到2.9%~4.0%,维生素C(VC)质量分数达到0.4%~0.6%[6]。乳酸菌是一类可通过发酵消耗糖类产生乳酸的细菌总称[7],具有维持胃肠道菌群平衡、调节消化免疫系统和改善胃肠道功能等作用[8]。
使用乳酸菌发酵红枣汁,可以提高发酵产物的总酚含量和抗氧化能力[9-10],而由于乳酸菌是一种营养缺陷型细菌,复合菌株发酵就成为提高产物功能的一个重要途径。将酵母菌和乳酸菌共同培养时,少量的酵母菌会促进乳酸菌的生长[11-12]。基于此理论,李佩佩等[13]用酵母菌和乳酸菌复合发酵枸杞汁,发酵产物中总酚含量、总酸度和抗氧化能力较单一乳酸菌发酵时均有所提高。
本文以陕北红枣所制得的红枣汁为原料,以酿酒酵母、发酵乳杆菌、干酪乳杆菌、短乳杆菌和植物乳杆菌为发酵菌株,探究酵母菌与乳酸菌复合发酵对红枣汁品质的影响,确定发酵工艺条件并对发酵液进行成分分析,以期开发一种新型红枣汁乳酸发酵饮品。
1 材料与仪器
1.1 试验材料
1.1.1 红枣
陕北红枣,陕西省榆林市清涧县。
1.1.2 发酵菌株
酵母菌:酿酒酵母(Saccharomyces cerevisiae,SC),法国帝伯仕公司;乳酸菌(lactic acid bacteria,LAB):发酵乳杆菌(Lactobacillus fermentum CGMCC 1.1880,LF)、干酪乳杆菌(Lactobacillus casei CGMCC 1.575,LC)、植物乳杆菌(Lactobacillus plantarum CGMCC 1.908 7,LP),中国普通微生物菌种保藏管理中心;短乳杆菌(Lactobacillus brevis YM 1301,LB),云南省微生物研究所。
1.1.3 主要试剂
麦芽汁培养基、MRS肉汤培养基、琼脂粉,北京奥博星生物技术有限责任公司;酒石酸钾钠、无水乙醇、NaCl、NaOH、KH2PO4、Na2SO3、H2O2、H3PO4(色谱级)、C2H3 N(色谱级),天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸、福林酚、2,4-二硝基苯肼、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS),美国Sigma公司。
1.2 试验仪器
Ultimate3000型高效液相色谱仪器,美国Thermo公司;SW-CJ-1F超净工作台,上海跃进医疗器械厂;GSP—9080MBE隔水式恒温培养箱,上海博迅实业有限公司;L-8900氨基酸分析仪,日本HATACHI公司;PL203电子天平,上海天呈实验仪器制造有限公司;UV752紫外分光光度仪,尤尼柯(上海)仪器有限公司。
2 实验方法
2.1 红枣汁的制备
取1 kg红枣,清洗后按m(红枣)∶m(水)=1∶3将红枣置于清水中,蒸煮使其表皮破裂,冷却至50 ℃以下后,按照红枣和水总质量的0.1%添加果胶酶,在50 ℃条件下酶解5 h[14],再经灭酶、过滤,即制得可溶性固形物含量为19%的红枣汁。
2.2 发酵菌株的活化
LAB活化[15]:将LF、LC、LB和LP这4种LAB接种在MRS固体培养基上,于37 ℃培养箱中培养24 h;之后挑一个单菌落转接到MRS肉汤中,在37 ℃培养箱中培养24 h;再将MRS肉汤中的LAB转接到红枣汁与MRS肉汤以1∶2(体积比)比例混合的培养基中,于37 ℃培养箱中再培养24 h,即得试验用LAB菌株。
SC活化:按上述方法用麦芽汁培养基对SC进行活化。
发酵菌株菌悬液制备:将上述培养菌株的液体培养基摇匀,取5 mL于无菌离心管中,在4 500 r/min离心15 min,撇去上清液后,用0.85%的无菌生理盐水清洗、离心,再用生理盐水调整菌悬液浓度为1×108 CFU/mL[16],调整后的菌悬液即作为本次试验用发酵菌株。
2.3 红枣汁发酵
取300 mL红枣汁于500 mL锥形瓶中,在105 ℃条件下湿热灭菌15 min,冷却后,分别将SC和LF、LC、LB、LP的菌悬液按照体积分数为2%的接种量接入红枣汁中,在37 ℃培养箱中培养60 h后,测定发酵液的成分。
2.4 理化指标的测定
总酸:参照GB 5009.239—2016《食品安全国家标准 食品酸度的测定》[17]的方法进行测定,结果以乳酸计。产酸率按公式(1)进行计算:
产酸率![]()
(1)
式中:m总酸,发酵液中生成的酸的质量;m还原糖消耗,发酵液中还原糖被消耗的质量。
可溶性固形物:参照GB/T 12143—2008《饮料通用分析方法》[18],用折光仪法进行测定。
还原糖:采用3,5-二硝基水杨酸比色法测定[19]。以葡萄糖溶液质量浓度为横坐标,以在540 nm波长处所测吸光值为纵坐标,绘制标准曲线,回归方程为:y=0.624 1x+0.002 1,R2=0.997 9。
总酚:采用福林酚法测定总酚的含量,总酚的含量以没食子酸计,单位为mg/L。以没食子酸标准溶液的质量浓度为横坐标,以在760 nm波长处所测吸光值为纵坐标,绘制标准曲线,回归方程为:y=0.062 8x+0.032 7,R2=0.988 5。
VC:采用2,4-二硝基苯肼比色法测定[20],以不同梯度VC的质量浓度为横坐标,以在500 nm波长处所测吸光值为纵坐标,绘制标准曲线,回归方程为:y=0.024 2x+0.004 1,R2=0.995 7,VC含量单位为mg/100 mL。
有机酸:参考GB 5009.157—2016《食品安全国家标准 食品有机酸的测定》[21]和实验室现有方法略有改进,采用高效液相色谱法测有机酸,色谱条件为:Diamonsil C18柱(250 mm×4.6 mm);柱温为30 ℃;紫外检测波长为210 nm;用磷酸调节pH至2.7的0.01 mol/L磷酸二氢钾溶液为流动相,色谱级乙腈为有机相,V(磷酸二氢钾溶液)∶V(乙腈)=96.5∶3.5;流速为0.6 mL/min;进样量为20 μL。待测样品中有机酸定量方法采用外标法。
氨基酸的测定:参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[22],用全自动氨基酸分析仪对样品中氨基酸含量进行测定。
2.5 抗氧化能力的测定
2.5.1 DPPH自由基清除能力[23]
取2 mL不同质量浓度的样品溶液,加入3 mL 0.4 mmol/L的DPPH溶液,避光静置30 min后,以无水乙醇调零,在517 nm波长下测吸光值A样。参照组用无水乙醇代替DPPH溶液,充分混匀后,在517 nm波长测吸光度A参照;对照组用2.0 mL的DPPH溶液与3.0 mL无水乙醇混匀后在517 nm波长下测吸光度A空白。按公式(2)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(2)
2.5.2 羟基自由基清除能力[23]
依次向各试管加入2 mL 0.006 mol/L FeSO4溶液,2 mL不同质量浓度样品溶液和2 mL 0.006 mol/L H2O2溶液,摇匀静置10 min,再加入2 mL 0.006 mol/L水杨酸溶液,充分反应20 min后,在510 nm处测得样品吸光度A样;把水杨酸溶液换成蒸馏水后测得在该样品浓度下的吸光度A参照;把抗氧化剂换成蒸馏水后,测得空白对照吸光度A空白。以抗坏血酸为对照,按公式(3)计算羟基自由基清除率:
羟基自由基清除率![]()
(3)
2.5.3 ABTS阳离子自由基清除能力[23]
取3 mL 7.4 mmol/L ABTS溶液和6 mL 2.6 mmol/L K2S2O7水溶液混匀,避光静置12 h,再用无水乙醇稀释40~50倍,调整734 nm波长处的吸光值为0.7±0.02。取各质量浓度下的样品0.2 mL,加入0.8 mL ABTS溶液后混匀,避光静置6 min,在734 nm波长下测吸光度A样;对照组用无水乙醇代替样品溶液后混匀,避光静置6 min,在734 nm波长下测吸光度A对照。按公式(4)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(4)
2.6 数据统计与处理
各组试验重复测定3次,结果用平均值±标准偏差表示。本试验用 Excel 2016和SPSS 23分析试验数据,采用Duncan新复极差分析法,P<0.05为显著相关,P<0.01为极显著相关。
3 结果与分析
3.1 不同菌株发酵对红枣汁品质的影响
分别用SC与单株的LAB发酵红枣汁时,对发酵液的总酸度、pH、还原糖残糖量、总酚、VC和抗氧化能力进行测定。由表1可知,与红枣汁相比,经SC和LAB发酵60 h的发酵液中总酸度、总酚含量和抗氧化能力均提高,pH、还原糖和VC含量均下降。4株LAB中LP发酵液的总酸度和VC含量最高,分别为8.715 g/L和7.19 mg/100 mL;LF发酵液的总酚含量、ABTS阳离子自由基清除率、DPPH自由基清除率和羟基自由基清除率均最高,最高值分别为251.71 mg/L、78.73%、86.19%和72.59%;LAB发酵液的总酸度、总酚含量、VC含量和抗氧化能力优于SC。LF和LP的产酸率分别为7.03%和6.99%,其产酸效果较好。
表1 不同LAB和SC发酵的红枣汁发酵液成分比较
Table 1 Components of jujube fermentation broth using different LABs and SCs

测定项目SCLFLCLBLP红枣汁总酸含量/(g·L-1)2.671±0.033e8.236±0.113b7.353±0.093d7.681±0.102c8.715±0.063a1.692±0.008fpH4.19±0.01b3.60±0.01e3.67±0.01c3.63±0.01d3.56±0.01f4.31±0.01a还原糖残糖量/(g·100 g-1)13.506±0.096b8.768±0.058e10.062±0.046c9.833±0.122d8.037±0.033f18.071±0.059a总酚/(mg·L-1)207.15±1.93e251.71±1.88a232.38±1.12d238.88±2.13c243.69±1.55b190.65±1.22fVC/(mg·100 mL-1)4.37±0.15d6.39±0.37c5.88±0.22c6.13±0.26c7.19±0.37b9.83±0.43aABTS阳离子自由基清除率/%61.59±0.27e78.73±1.08a72.34±0.63d76.23±0.35b73.88±0.41c49.62±0.65fDPPH自由基清除率/%72.76±0.69d86.19±0.95a80.37±0.64c84.45±1.22b81.86±0.53c57.18±1.18e羟基自由基清除率/%52.84±0.44e72.59±0.45a67.38±0.86d70.18±0.59b68.82±0.79c44.72±0.54f
注:a、b 小写字母表示显著水平为0.05的差异显著性,含有相同字母表示无显著差异(P>0.05),不同字母表示有显著性差异(P<0.05)(下同)
3.2 SC与不同LAB复合发酵对红枣汁品质的影响
为探究SC与不同LAB复合发酵对红枣汁品质的影响,按2%(体积分数)的接种量、1∶1(体积比)的接种比,分别用SC与LF、LB、LC、LP复合发酵红枣汁,并测定在37 ℃条件下发酵60 h的各项理化指标。
3.2.1 总酸度、pH和还原糖残糖量的比较
SC与不同LAB复合发酵对红枣汁发酵液总酸度、pH和还原糖残糖量的影响如图1所示。SC和LP的发酵液中,还原糖残糖量、总酸度和产酸率分别为6.897 g/100 g、7.877 g/L和5.54%;SC和LF的发酵液中还原糖残糖量、总酸度和产酸率分别为7.763 g/100 g、7.455 g/L和5.59%,发酵液中还原糖残糖量和产酸率均高于SC和LP的组合。

图1 SC与不同LAB的发酵产物中总酸度、pH和还原糖残糖量的比较
Fig.1 Total acidity, pH and residual sugar content of reducing sugars in different SCs and LABs fermentation products
3.2.2 总酚含量和维生素C含量的比较
SC与不同LAB复合发酵对红枣汁发酵液总酚和维生素C含量的影响如图2所示。SC和LF的发酵液中总酚含量最高,为275.71 mg/L;SC和LP的发酵液中VC含量较SC和LF的发酵液高0.5 mg/100 mL,可能由于SC和LP的发酵液中总酸度相对较高,对VC起到了一定的保护作用。

图2 SC与不同LAB的发酵产物中总酚和VC含量的比较
Fig.2 Content of total phenol and VC in fermentation products of different SCs and LABs
3.2.3 抗氧化能力的比较
SC与不同LAB复合发酵对红枣汁发酵液抗氧化能力的影响如图3所示。SC和LF的发酵液中ABTS阳离子自由基清除率、DPPH自由基清除率和羟基自由基清除率分别为82.65%、86.37%和75.26%;SC和LP的发酵液的3种自由基清除率分别为76.47%、87.19%和72.25%。就抗氧化能力而言,SC与LF的组合优于SC与LP的组合。
与表1相比,复合发酵时,发酵液的总酚含量和抗氧化能力均小幅优于单一菌株发酵。综合图1、图2和图3的结果分析,SC和LP复合发酵时,发酵液中总酸度、DPPH自由基清除率最高,VC含量相对较高;而SC和LF复合发酵时,发酵液中还原糖残糖量、总酚含量、ABTS阳离子自由基清除率和羟基自由基清除率均最高,产酸率相对较高。从还原糖利用率及发酵液抗氧化能力的角度考虑,SC和LF为本试验发酵红枣汁的最优菌株组合。
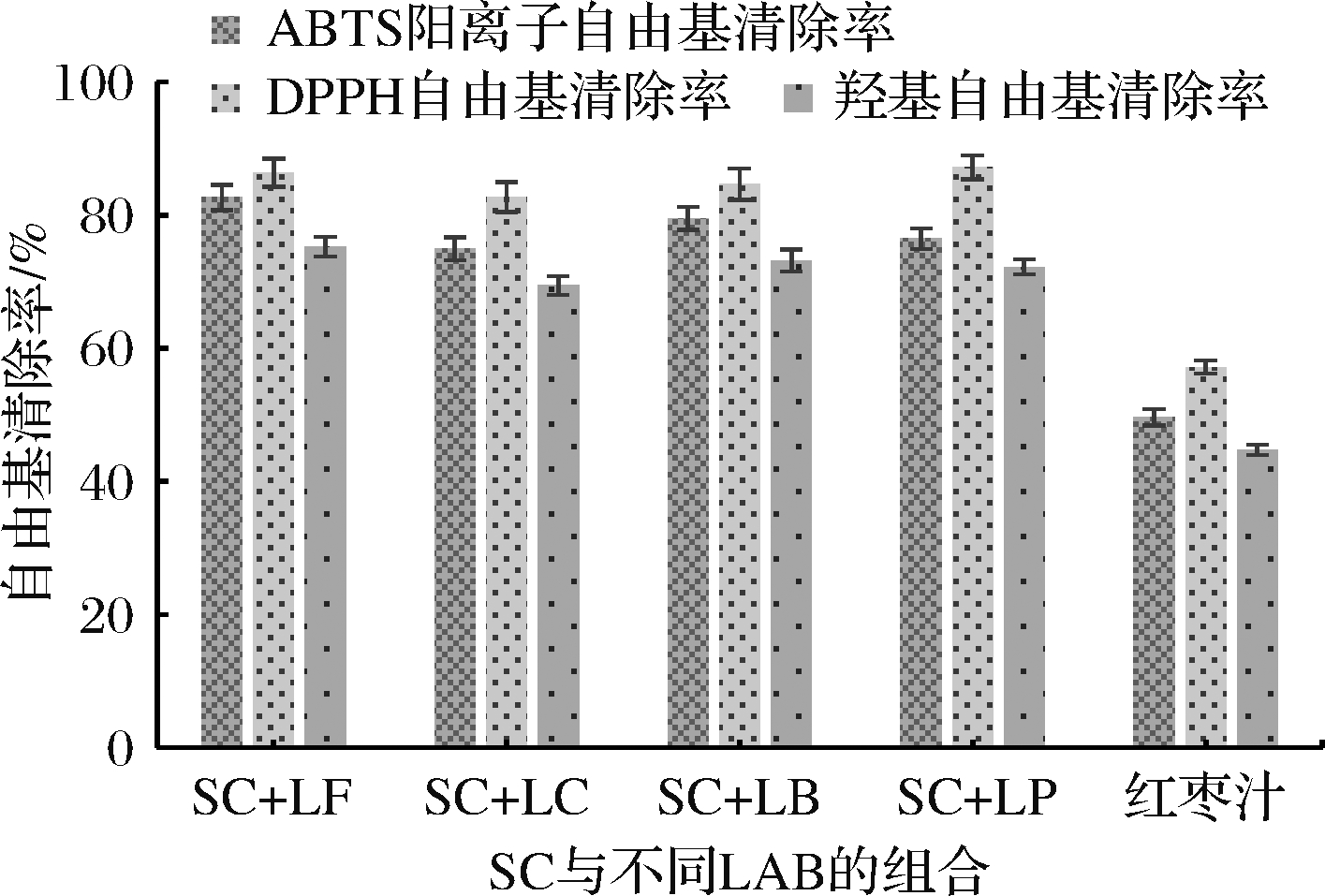
图3 SC与不同LAB发酵产物抗氧化能力的比较
Fig.3 Antioxidant capacity of fermented products from different SCs and LABs
3.3 SC和LF接种比例对红枣汁发酵液的影响
为确定SC和LF复合发酵红枣汁的最佳接种比例,按照2%(体积分数)的总接种量,7个不同的接种比,在37 ℃条件下发酵60 h,测定红枣汁发酵液的各项理化指标。
3.3.1 SC和LF接种比例对总酸度、pH和还原糖残糖量的影响
不同比例的SC和LF对发酵液总酸度、pH和还原糖残糖量的影响如图4所示。不同组发酵液中总酸度和还原糖残糖量随着SC接种比例的增加而减少,可能是因为此时酵母菌进行的酒精发酵在发酵过程中占主导,消耗了大量的还原糖,并使乳酸菌的乳酸发酵受到了抑制。当SC与LF的接种比例为1∶4(体积比)时,发酵液中总酸度、还原糖残糖量和产酸率分别为9.897 g/L、8.19 g/100 g和8.31%,可能是由于少量的酵母菌会通过促进乳酸菌的生长来加快乳酸发酵;进一步增加乳酸菌比例时,还原糖残糖量有所提高,但总酸度和产酸率均下降,因此SC与LF在本次试验中的最适接种比例为1∶4。
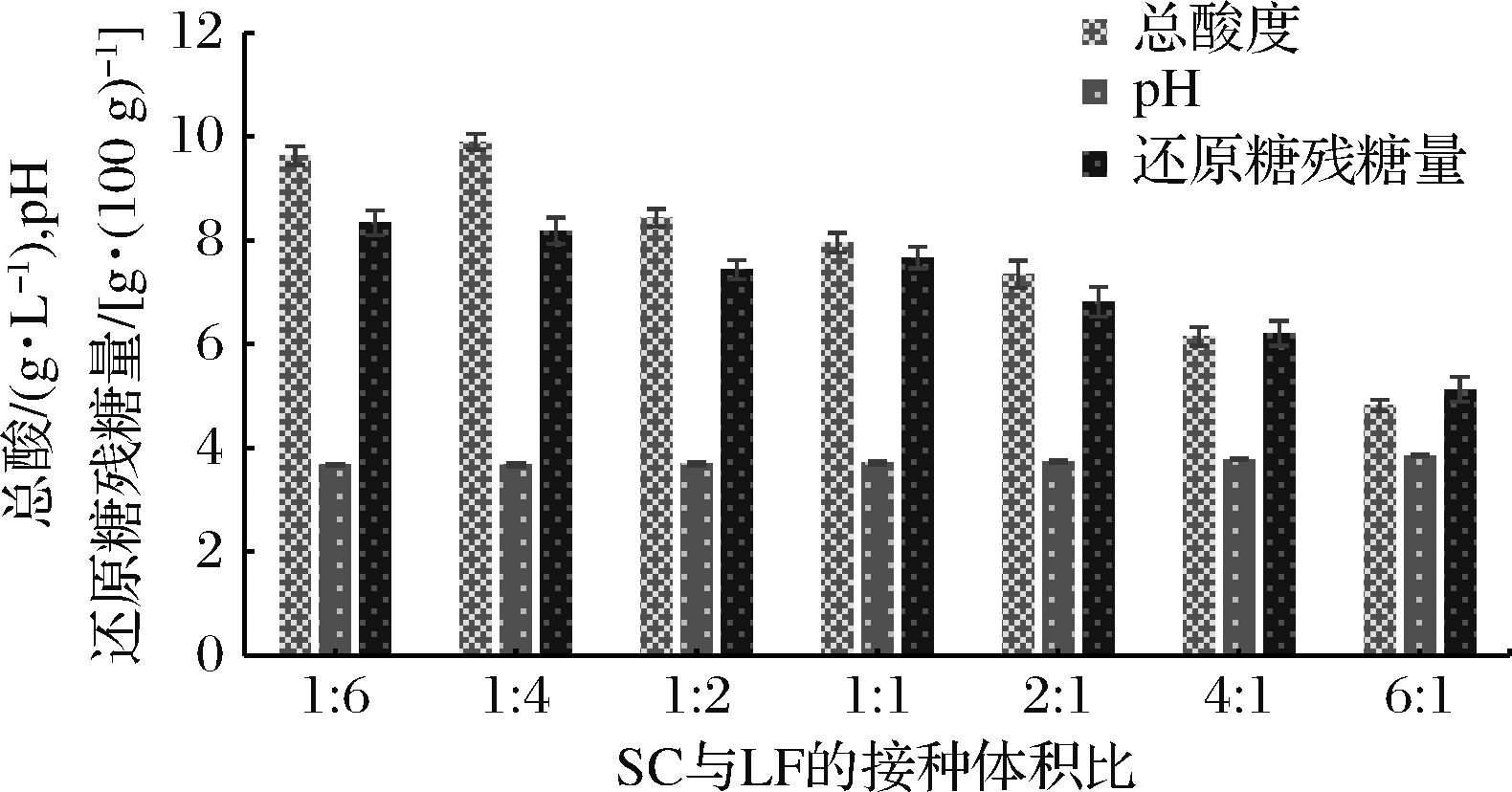
图4 SC与LF接种比例对发酵液总酸度、pH和
还原糖残糖量的影响
Fig.4 Effect of inoculation ratio of mixed SC and LF on the total acidity, pH and residual sugar content of reducing sugar in the fermentation broth
3.3.2 SC和LF接种比例对总酚含量和VC含量的影响
不同比例的SC和LF对发酵液总酚和VC含量的影响如图5所示。发酵液中总酚和VC含量均随LF接种比例的增加而增加,这是因为LF接种比例的增加加快了发酵液中有机酸的生成速率,有利于VC和游离酚的稳定。当SC和LF的接种比例由1∶4变为1∶6时,总酚含量由287.81 mg/L增长到288.67 mg/L,VC含量小幅下降,当SC与LF的接种比例达到1∶4后,LF接种比例的增加对总酚和VC的影响变小。
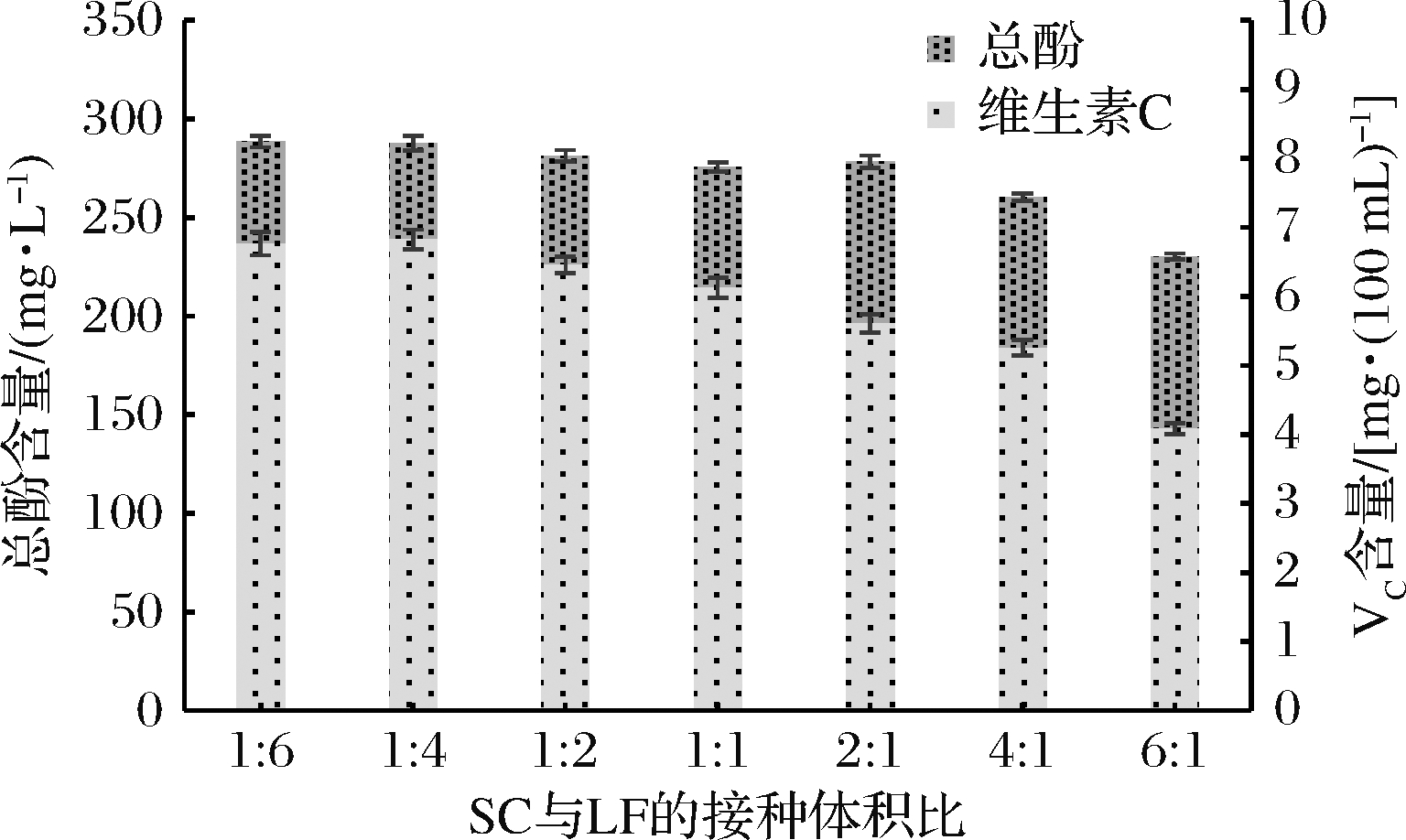
图5 SC与LF接种比例对发酵液总酚和VC含量的影响
Fig.5 Effect of the inoculation ratio of mixed SC and LF on the content of total phenol and VC in the fermentation broth
3.3.3 SC和LF接种比例对抗氧化能力的影响
不同比例的SC和LF对发酵液抗氧化能力的影响如图6所示。发酵液的ABTS阳离子自由基清除率、DPPH自由基清除率和羟基自由基清除率随LF接种比例的增加而增加,因为在此条件下红枣汁发酵液中的总酚和维生素含量均不断升高,提高了发酵液的抗氧化能力。当SC和LF的接种比例为1∶4时,发酵液的ABTS阳离子自由基清除率、DPPH自由基清除率和羟基自由基清除率分别为87.37%,89.41%和76.12%;而当SC和LF的接种比例由1∶4变为1∶6时,发酵液对各自由基的清除率上升幅度均小于1%。
再结合图4和图5,SC和LF的接种比例为1∶4时,发酵液的总酸度和复合菌株的产酸率有最大值且均大于单一LAB发酵的红枣汁,分别为9.897 g/L和10.02%,总酚含量也有最大值,为287.81 mg/L。在此条件下进一步增加复合菌株中LF的比例时,对发酵液的总酸度、产酸率、总酚含量和抗氧化能力的影响均较小,因此本次复合菌株发酵红枣汁的试验中确定的SC和LF的最佳接种比例为1∶4。
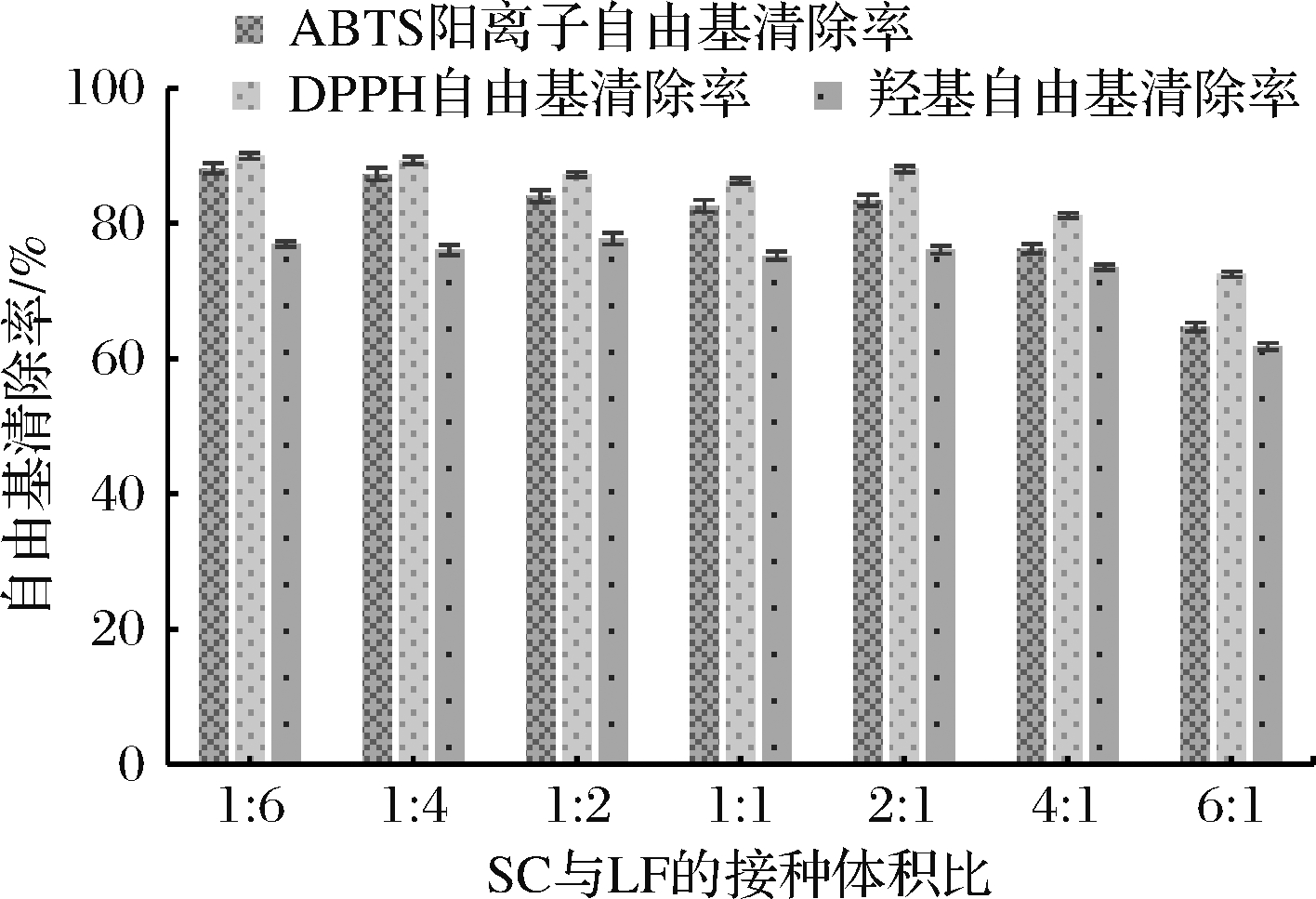
图6 SC与LF的接种比例对发酵液抗氧化能力的的影响
Fig.6 Effect of the inoculation ratio of SC and LF inoculation on the antioxidant capacity in the fermentation broth
3.4 红枣汁在SC和LF复合发酵过程中的成分分析
使用SC与LF比例为1∶4的复合菌株在37 ℃条件下发酵红枣汁60 h,每隔12 h用高效液相色谱法测定发酵液中有机酸的含量。
3.4.1 红枣汁发酵液在发酵过程中有机酸的变化
3.4.1.1 有机酸标品图及其标准曲线方程
各种有机酸出峰顺序如图7所示,保留时间、标准曲线方程及相关系数见表2。
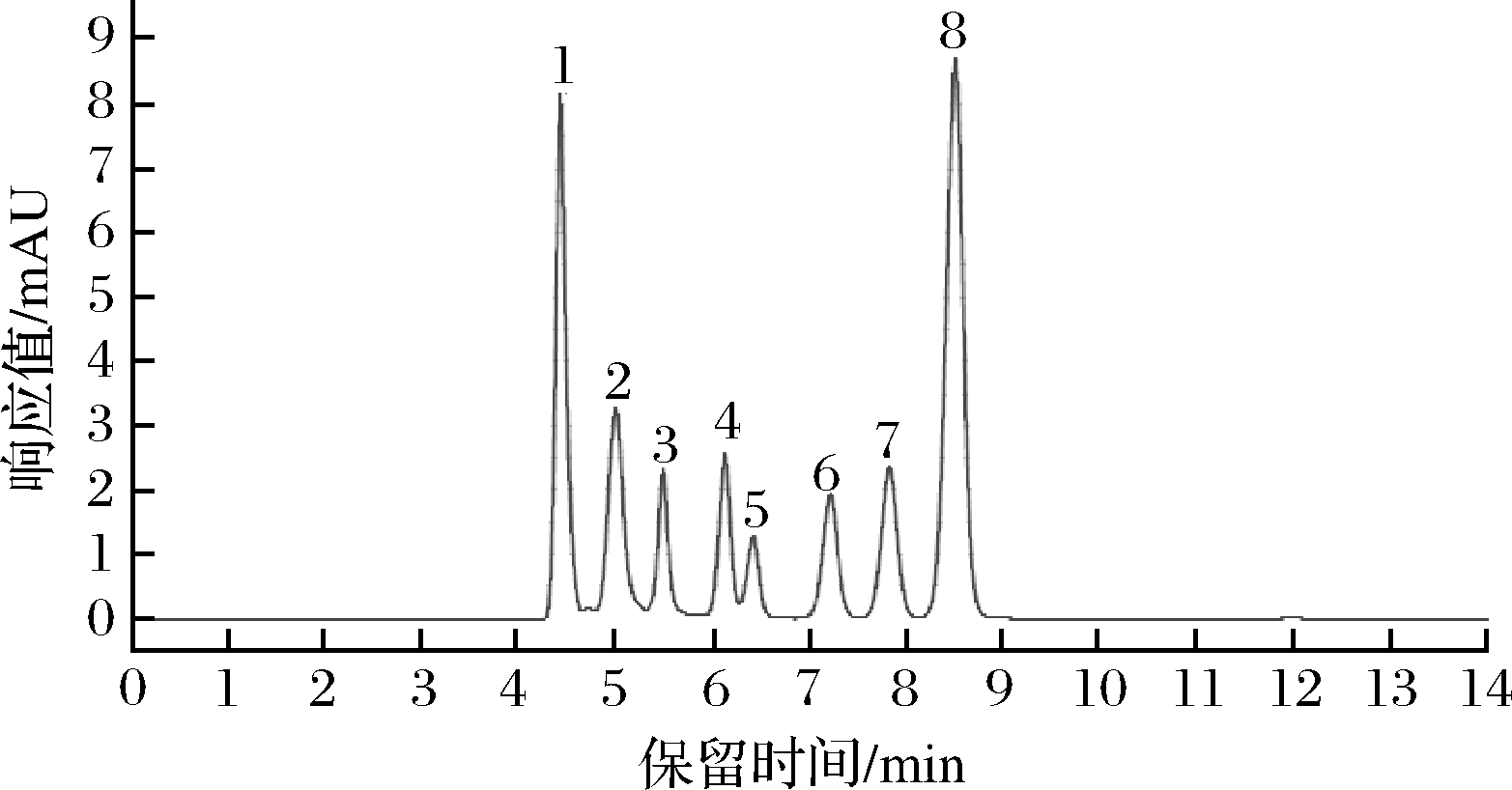
图7 有机酸高效液相标品图谱
Fig.7 HPLC chromatograph of organic acids standards
表2 有机酸标准曲线方程
Table 2 Standard curvilinear equation for organic acids

有机酸编号有机酸名称保留时间/min标准曲线方程R21草酸4.452y=2 425.108 3x+12.342 60.992 12乳酸5.124y=1 758.655 4x+191.364 50.985 73苹果酸5.495y=2 271.890 8x+3.563 00.997 14柠檬酸6.197y=85.253 6x+1.932 560.991 95乙酸6.453y=1 705.278 0x+20.442 10.990 16酒石酸7.221y=4 240.127 6x+28.914 20.982 57琥珀酸7.855y=1 729.266 4x-15.392 30.989 78富马酸8.653y=1 617.249 5x+23.091 30.998 9
3.4.1.2 红枣汁发酵过程中有机酸的动态变化
发酵过程中有机酸含量的变化如表3所示。在红枣汁中检测到6种有机酸,在发酵液中检测到8种有机酸,表明草酸和乙酸由发酵产生。苹果酸、酒石酸和琥珀酸的含量变化相对较小,表明苹果酸、酒石酸和琥珀酸在发酵过程中稳定性相对较好[24];乳酸、柠檬酸、乙酸和富马酸含量由发酵前的1.081、0.077、0和0.083 g/L分别增加到发酵后的6.923、0.368、1.016和0.311 g/L。经发酵,这4种有机酸的含量显著增加。发酵液中有机酸的变化也基本符合异型乳酸发酵的LAB在发酵过程中各类产物的生化反应机理[25]。
表3 发酵过程中红枣汁发酵液有机酸的动态变化
Table 3 Dynamic changes of organic acids in the jujube fermentation broth

类别发酵时间/h01224364860草酸/(g·L-1)0±0e0.013±0.002d0.065±0.003c0.078±0.004b0.083±0.003b0.097±0.004a乳酸/(g·L-1)1.081±0.009f1.779±0.012e3.273±0.017d4.815±0.024c6.180±0.031b6.923±0.022a苹果酸/(g·L-1)0.152±0.002e0.213±0.003d0.227±0.002c0.235±0.001b0.248±0.003a0.233±0.002b柠檬酸/(g·L-1)0.077±0.003e0.135±0.005d0.173±0.002c0.354±0.003b0.382±0.005a0.368±0.004b乙酸/(g·L-1)0±0f0.171±0.003e0.463±0.011d0.634±0.015c0.879±0.023b1.016±0.009a酒石酸/(g·L-1)0.213±0.002e0.219±0.004d0.233±0.003bc0.231±0.002c0.238±0.001a0.241±0.002ab琥珀酸/(g·L-1)0.061±0.002c0.061±0.002c0.063±0.003bc0.065±0.002abc0.067±0.003ab0.068±0.001ab富马酸/(g·L-1)0.083±0.001b0.073±0.002c0.065±0.003d0.078±0.004bc0.083±0.003b0.097±0.004a
3.4.2 红枣汁发酵液在发酵前后氨基酸的变化
3.4.2.1 发酵前后红枣汁中氨基酸含量的变化
发酵过程中氨基酸含量的变化如表4所示。在红枣汁中共检测到15种氨基酸,其中必需氨基酸有5种,分别为赖氨酸、缬氨酸、亮氨酸、苯丙氨酸和苏氨酸,含量分别是3.47、12.73、10.13、17.02和47.58 mg/kg,氨基酸总量为471.29 mg/kg。在发酵液中共检测到16种氨基酸,在发酵过程中产生了少量的异亮氨酸,总氨基酸含量为1 275.45 mg/kg,氨基酸含量在发酵前后有明显变化,其中赖氨酸、谷氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甘氨酸、丝氨酸、半胱氨酸和脯氨酸这10种氨基酸含量经发酵后均有所增加,其原因可能是发酵过程中红枣汁中的大分子蛋白质被LF和SC分解为氨基酸,以及在发酵后期LF和SC失活而被降解成氨基酸[26];精氨酸、组氨酸、天冬氨酸、酪氨酸、苯丙氨酸和苏氨酸这6种氨基酸含量均降低,其原因可能是在发酵过程中,这些氨基酸被转化为风味物质。
3.4.2.2 发酵前后呈味氨基酸的变化
根据氨基酸的呈味,对发酵前后红枣汁的氨基酸进行分析,结果如图8所示。发酵液中鲜味氨基酸和甜味氨基酸含量分别由发酵前的134.93和264.53 mg/kg增长到发酵后的564.10和655.79 mg/kg,苦味氨基酸和芳香味氨基酸含量变化较小。表明经过LF和SC发酵,一定程度上改善了红枣汁的口感。
表4 发酵前后红枣汁中氨基酸含量的变化
Table 4 Changes of amino acid content in the jujube juice before and after fermentation

名称氨基酸类别氨基酸呈味含量/(mg·kg-1)发酵前发酵后赖氨酸(Lys)碱性鲜3.47±0.249.22±0.18精氨酸(Arg)碱性苦16.56±0.7215.23±0.54组氨酸(His)碱性甜13.68±0.460.67±0.04天冬氨酸(Asp)酸性鲜125.15±1.4639.62±1.23谷氨酸(Glu)酸性鲜6.31±0.15515.26±2.88丙氨酸(Ala)脂肪族类甜9.86±0.3716.85±0.36缬氨酸(Val)脂肪族类苦12.73±0.6513.68±0.22异亮氨酸(ILe)脂肪族类苦0±02.26±0.09亮氨酸(Leu)脂肪族类苦10.13±0.4714.84±0.51甘氨酸(Gly)脂肪族类甜173.35±1.83439.86±2.68酪氨酸(Tyr)芳香族类芳香6.26±0.394.83±0.12苯丙氨酸(Phe)芳香族类芳香17.02±0.558.62±0.19苏氨酸(Thr)羟基类甜47.58±0.6312.37±0.33丝氨酸(Ser)羟基类甜2.18±0.092.53±0.18半胱氨酸(Cys)羟基类芳香14.15±0.8121.22±0.74脯氨酸(Pro)α-亚甜12.86±1.03183.51±2.15总氨基酸471.29±9.851 275.45±12.44

图8 发酵前后呈味氨基酸的变化
Fig.8 Changes of delicious amino acids before and after fermentation
4 结论
本研究以红枣汁为原料,确定了在37 ℃条件下,红枣汁经SC和LF、LC、LB、LP复合发酵60 h时的最佳组合及接种比例为V(SC)∶V(LF)=1∶4。与单一LF发酵的红枣汁相比,SC和LF复合发酵的红枣汁中,总酸度由8.236 g/L提高到9.897 g/L,产酸率由7.03% 提高到8.31%,总酚含量由251.73 mg/L提高到287.81 mg/L,ABTS阳离子自由基清除率、DPPH自由基清除率和羟基自由基清除率分别由78.73%、86.19%和72.57%提高到87.37%、89.38%和76.12%;与红枣汁相比,发酵液中各类有机酸和氨基酸含量均有所提升,表明经过SC和LF发酵的红枣汁品质得到了提高。
[1] SUN X,GU D Y,FU Q B,et al.Content variations in compositions and volatile component in jujube fruits during the blacking process[J].Food Science & Nutrition,2019,7(4):1 387-1 395.
[2] ZHANG C M,BIAN Y,HOU S H,et al.Sugar transport played a more important role than sugar biosynthesis in fruit sugar accumulation during Chinese jujube domestication[J].Planta,2018,248(5):1 187-1 199.
[3] KOU X H,CHEN Q,LI X,et al.Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J].Food Chemistry,2015,173:1 037-1 044.
[4] ABDOUL-A S.Potential benefits of jujube (Zizyphus lotus L.) bioactive compounds for nutrition and health[J].Journal of Nutrition and Metabolism,2016.DOI:10.1155/2016/2867470.
[5] 王卉. 红枣制酒/饮副产的综合利用[D].太原:山西大学,2018.
WANG H.Comprehensive utilization of jujube wine/drinking by-products[D].Taiyuan:Shanxi University,2018.
[6] ZHU Q Y,ZHANG Q Y,CAO J,et al.Cyclodextrin-assisted liquid-solid extraction for determination of the composition of jujube fruit using ultrahigh performance liquid chromatography with electrochemical detection and quadrupole time-of-flight tandem mass spectrometry[J].Food Chemistry,2016,213:485-493.
[7] 唐贤华,张崇军,隋明.乳酸菌在食品发酵中的应用综述[J].粮食与食品工业,2018,25(6):44-46;50.
TANG X H,ZHANG C J,SUI M.The application of the lactobacillus in food fermentation[J].Cereal&Food Industry,2018,25(6):44-46;50.
[8] 王刚,朱慧越,俞赟霞,等.乳酸菌合成细菌素及对肠道菌群的影响[J].食品与发酵工业,2019,45(21):264-271.
WANG G,ZHU H Y,YU Z X,et al.Bacteriocin synthesized by lactic acid bacteria and its’ effect on gut microbiota[J].Food and Fermentation Industries,2019,45(21):264-271.
[9] 梁艳花. 红枣乳酸饮料功能性研究[D].杨凌:西北农林科技大学,2015.
LIANG Y H,Function studies on jujube lactic acid drink[D].Yangling:Northwest A&F University,2015.
[10] 韩雪,王毕妮,张富新等.不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化性的影响[J].食品与发酵工业,2018,44(3):121-127.
HAN X,WANG B N,ZHANG F X,et al.Effects of lactic acid bacteria fermentation on free phenolic acid and antioxidant ability of jujube pulp[J].Food and Fermentation Industries,2018,44(3):121-127.
[11] MENDES F,SIEUWERTS S,HULSTER E,et al.Transcriptome-based characterization of interactions between Saccharomyces cerevisiae and Lactobacillus delbrueckii subsp.bulgaricus in lactose-grown chemostat cocultures[J].Applied and Environmental Microbiology,2013,79(19):5 949-5 961.
[12] CHEIRSILP B,SHIMIZU H,SHIOYA S.Enhanced kefiran production by mixed culture of Lactobacillus kefiranofaciens and Saccharomyces cerevisiae[J].Journal of Biotechnology,2003,100(1):43-53.
[13] 李佩佩,颉向红,王聪等.不同发酵方式下枸杞饮料主要成分及其抗氧化活性[J].食品与发酵工业,2019,45(24):90-97.
LI P P,XIE X H,WANG C,et al.Main components and antioxidant activities of Lycium barbarum L.beverages using two different fermentation processes[J].Food and Fermentation Industries,2019,45(24):90-97.
[14] ZHU Y,LI T,FU X,et al.The use of an enzymatic extraction procedure for the enhancement of highland barley (Hordeum vulgare L.) phenolic and antioxidant compounds[J].International Journal of Food Science & Technology,2016,51(8):1 916-1 924.
[15] AZAM M,MOHSIN M,IJAZ H,et al.Lactic acid bacteria in traditional fermented Asian foods[J].Pakistan Journal of Pharmaceutical Sciences,2017,30(5):1 803-1 814.
[16] KANTACHOTE D,RATANNABUREE A,HAYISAMA-AE,et al.The use of potential probiotic Lactobacillus plantarum DW12 for producing a novel functional beverage from mature coconut water[J].Journal of Functional Foods,2017,32:401-408.
[17] 中华人民共和国卫生部.GB 5009.239—2016食品安全国家标准 食品中总酸度的测定[S].北京:中国标准出版社,2016.
Ministry of Health of the People’s Republic of China.GB 5009.239—2016 National food safety standard determination of total acidity in food[S].Beijing:Standards Press of China,2016.
[18] 中华人民共和国卫生部.GB/T 12143—2008食品安全国家标准 饮料通用分析方法[S].北京:中国标准出版社,2008.
Ministry of Health of the People’s Republic of China.GB/T 12143—2008 National food safety standard general beverage analysis method[S].Beijing:Standards Press of China,2008.
[19] 朱莉莉,李林强,张宝善,等.橡子粉发酵柠檬酸[J].江苏农业学报,2019,35(2):445-452.
ZHU L L,LI L Q,ZHANG B S,et al.Citric acid fermentation of acorn powder[J].Jiangsu Journal of Agricultural Sciences,2019,35(2):445-452.
[20] OLIVERA B,FIDANKA T,LJUPCO M,et al.Vitamin C and total antioxidant content in pepper fruits (Capsicum annuum L.):Comparative analysis of peppers grown in conventional and organic agricultural systems[J].Annual Research & Review in Biology,2018,27(5):1-11.
[21] 中华人民共和国卫生部.GB 5009.157—2016食品安全国家标准 食品有机酸的测定[S].北京:中国标准出版社,2016.
Ministry of Health of the People’s Republic of China.GB 5009.157—2016 National food safety standard determination of food organic acids[S].Beijing:Standards Press of China,2016.
[22] 中华人民共和国卫生部.GB 5009.124—2016食品安全国家标准 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
Ministry of Health of the People’s Republic of China.GB 5009.124—2016 National food safety standard determination of amino acids in food[S].Beijing:Standards Press of China,2016.
[23] VIRGINIE D,MARIE-C K,BEATRICE L,et al.Antioxidant properties and bioactivity of Carboxymethylpullulan grafted with ferulic acid and of their hydrogels obtained by enzymatic reaction[J].Food Chemistry,2018,262:21-29.
[24] MARTINEZ S J,BRESSANI A P P,DIAS D R,et al.Effect of bacterial and yeast starters on the formation of volatile and organic acid compounds in coffee beans and selection of flavors markers precursors during wet fermentation[J].Frontiers in Microbiology,2019,10:1287.
[25] KO C Y,LIN H T V,TSAI G J.Gamma-aminobutyric acid production in black soybean milk by Lactobacillus brevis FPA 3709 and the antidepressant effect of the fermented product on a forced swimming rat model[J].Process Biochemistry,2013,48(4):559-584.
[26] 宓月光,王伟明,孙银玲等.淡豆豉和豆豉纯种发酵过程中游离氨基酸的含量变化[J].食品与发酵工业,2019,45(23): 257-261.
BI Y G,WANG W M,SUN Y L,et al.Dynamic quantity changes of free amino acids during semen sojae praeparatum and black beans fermentation using pure strain[J].Food and Fermentation Industries,2019,45(23):257-261.