鸡胸肉,脂肪含量低,蛋白质含量高,与植物蛋白相比,鸡肉蛋白具有较高的消化率(0.92)[1-2]。鸡胸肉肌原纤维蛋白(myofibrillar protein, MP)是肌肉中主要的蛋白质,约占总蛋白含量的50%~60%[3],由于在高盐溶液(0.48~0.67 mol/L NaCl)中易溶解,又被称为盐溶性蛋白[4]。过量摄入钠会增加患高血压和心血管等疾病风险。因此,如何降低加工肉制品中的钠盐含量对于人体健康尤为重要。
高强度超声波作为一种绿色的食品物理加工技术,被认为是安全、无毒、环保的。低频高强度超声波(频率16 k~100 kHz,超声强度在10~100 W/cm2)可用于改变食品的物理或化学性质,广泛应用于食品加工[5-6]。MARIANA等[7]报道了超声波处理可以弥补肉糜中磷酸盐含量降低带来的缺陷。CHO和ITO等[8-10]研究报道了应用低频(20 kHz)超声波破坏肌原纤维结构是必不可少的前处理方法。超声波处理能有效促进脊椎动物肌肉MP溶解,能使80%以上的MP在极低离子强度溶液中溶解。WANG等[11]研究了超声波对高盐浓度下鸡肉肌原纤维蛋白结构和溶解度的影响,并观察到超声波处理对鸡肉肌原纤维蛋白的表面疏水性,活性巯基和溶解度显著增加。LIU等[12]探讨了不同超声波功率对MP在水中的溶解度和分散性的影响,结果发现,超声波处理破坏和抑制肌丝组装,增加了在MP水中的溶解性。
肉品加工中至少添加一定量盐,探讨超声波处理时间和盐浓度对MP理化性质的影响十分有必要。本试验主要通过对不同NaCl浓度下鸡胸肉MP进行不同时间的超声波处理,测定MP的溶解度、浊度、粒径、电位以及二级结构,分析超声波时间对3种盐浓度下MP溶解性的影响,为超声波技术在低盐肉品加工中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜白羽鸡鸡胸肉,郑州丹尼斯超市。剔除鸡胸肉中结缔组织及多余脂肪,用真空袋分装,每袋200 g,储存于-20 ℃,贮藏时间不超过2周。
NaCl、MgCl2、NaH2PO3、Na2HPO3等均为分析纯,天津市科密欧化学试剂有限公司;乙二醇双(2-氨基乙基醚)四乙酸(EGTA),北京华迈科生物技术有限责任公司;十二烷基硫酸钠,上海源叶生物有限公司;牛血清白蛋白(纯度为98%),Sigma公司。
1.2 仪器与设备
SZ-22A绞肉机,广州旭众食品机械有限公司;XHF-D高速分散器(内切式匀浆机),宁波新芝生物科技股份有限公司;AvantiJ-26S XPI大容量高速冷冻离心机,美国Beckman Coulter 公司;VCX-750超声波细胞破碎仪,美国Sonic公司;TGL-20KR高速冷冻离心机,上海安亭科学仪器厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限公司;Nano-ZS90纳米激光粒度仪,英国马尔文仪器公司;Vertex 70傅里叶变换红外光谱仪,德国Bruker公司;PHSJ-3F pH计,上海仪电科学仪器股份有限公司;Lab-1-50冷冻干燥机,北京博医康实验仪器有限公司。
1.3 实验方法
1.3.1 MP的提取
参考ZHAO等[13]的方法提取。将鸡胸肉提前12 h在4 ℃冰箱解冻,切成l~2 cm见方的小块,3 000 r/min绞碎15 s,重复4次。在0~4 ℃条件下提取MP。均匀绞碎的鸡胸肉∶分离缓冲液(10 mmol/L Na2HPO4/NaH2PO4,0.1 mol/L NaCl,20 mmol/L MgCl2,10 mmol/L EDTA,pH 7.0)=1∶4 (g∶mL)比例均匀混合,6 000 r/min转速下均质3次,每次30 s;混合物用20目筛网(孔径0.9 mm)过滤后,2 000×g离心15 min,收集沉淀物质,重复2次,得到MP沉淀。将沉淀物按1∶4 (g∶mL)的比例均匀分散在0.1 mol/L NaCl溶液中,2 000 ×g离心15 min,重复2次,得到纯化的MP。
1.3.2 低频高强度超声波处理
将上述提取的MP分别用含0.2、0.4、0.6 mol/L NaCl的磷酸盐缓冲液(20 mmol/L Na2HPO4/NaH2PO4,pH 7.0)稀释至质量浓度为5 mg/mL的MP溶液,取70 mL溶液于100 mL烧杯中进行超声波处理。13 mm的超声波探头放入MP溶液液面下25 mm处,超声波参数为:频率20 kHz,功率450 W,工作模式:超声2 s,休息4 s,超声波时间分别设定为0、3、6和9 min。利用冰水浴控制所有样品最终温度低于12 ℃。参考JAMBRAK等[14]的方法测定,超声波强度为(30.26±2.73) W/cm2。
1.3.3 溶解度的测定
MP的溶解度参考ZHANG等[15]的方法进行测定。取10 mL离心管,加入5 mL处理后的MP,然后在4 ℃下以10 000 ×g离心20 min,用双缩脲法测定蛋白质浓度。蛋白质的溶解度以离心后的上清液中的蛋白浓度表示。
1.3.4 浊度的测定
参考LI等[16]的方法,用相应盐浓度的磷酸盐缓冲液将超声波处理后的各组MP样品稀释至1 mg/mL,在660 nm 处测定吸光度。参比溶液为相应盐浓度的磷酸盐缓冲液,平行测3次并取平均值。
1.3.5 Zeta电位的测定
参考张兴等[17]的测定方法,取1 mL样品于Zeta电位皿内,同时盖两边的盖子,保持左右液面等高,用激光粒度仪测试MP的电位。
1.3.6 平均粒径及粒径分布的测定
用相应盐浓度的磷酸盐缓冲液将超声波处理后的MP样品调整至质量浓度0.5 mg/mL,使用激光粒度仪测定样品的粒径,通过自带软件自动获取粒径,每个样品重复3次。
1.3.7 肌原纤维蛋白二级结构的测定
参考LI等[18]的方法,稍加修改。测定MP的傅里叶变化红外光谱以获取MP二级结构信息。MP悬浮液在冻干机中干燥24 h,将冻干MP粉与干燥的KBr 以1∶150的质量比充分混合研磨,再用压片机压成1 mm厚的薄片。压力为10 kPa,压片时间1 min,然后在室温下,用傅里叶变换红外光谱仪对4 000~400 cm-1区域的所有光谱进行64次扫描分析。利用Peak Fit软件提取1 700~1 600 cm-1区域的谱图进行二阶导数峰值拟合以获得蛋白质二级结构的信息。
1.4 数理统计分析
使用Origin 8作图,使用SPSS 20.0软件的方差分析(ANOVA)用于溶解度、浊度、Zeta电位、粒径数据分析,对不同处理组进行Duncan’s多重比较,P<0.05时认为存在显著差异。对二级结构数据采用独立样本t检验分析,当P<0.05时判定2组(在同一盐浓度下未超声处理对照组与超声9 min处理组)的平均值存在显著差异。每次试验重复3次。
2 结果与分析
2.1 溶解度测定
如图1所示,在不同盐浓度下,随着超声时间的增加,MP溶解度显著增大(P<0.05)。当NaCl浓度为0.2 mol/L时,随着超声时间的延长,MP溶解度从0.12 mg/mL增加到1.41 mg/mL(P<0.05)。由图1可知,超声波处理时间为9 min、0.2 mol/L NaCl浓度下MP溶解度比0.4 mol/L NaCl下未超声的溶解度高。SALEEM等[19]研究鸡肌动球蛋白在0.1 mol/L NaCl中的溶解度也随着超声时间的延长而增加。这些结果说明,在不同NaCl浓度下,超声波处理能够实现MP的增溶。在相同超声时间下,0.6 mol/L NaCl浓度下的MP与其他离子浓度(0.2、0.4 mol/L)相比,溶解度显著增大(P<0.05)。主要是因为MP是盐溶性蛋白,随着盐离子浓度(<0.8 mol/L)的增加,溶解度增大[20]。高强度超声波处理能够使蛋白质结构展开,使更多的亲水性氨基酸处在外层,从而提高蛋白质的溶解性[21-22]。MP溶解度增加的原因可能是超声空化作用产生的剪切力和冲击力破坏了高度有序的丝状肌球蛋白结构,降低了MP颗粒大小。由于MP颗粒尺寸的减小,MP颗粒比表面积的增加,可能会增加水-MP颗粒相互作用的能力,从而导致MP溶解性的增加[23]。
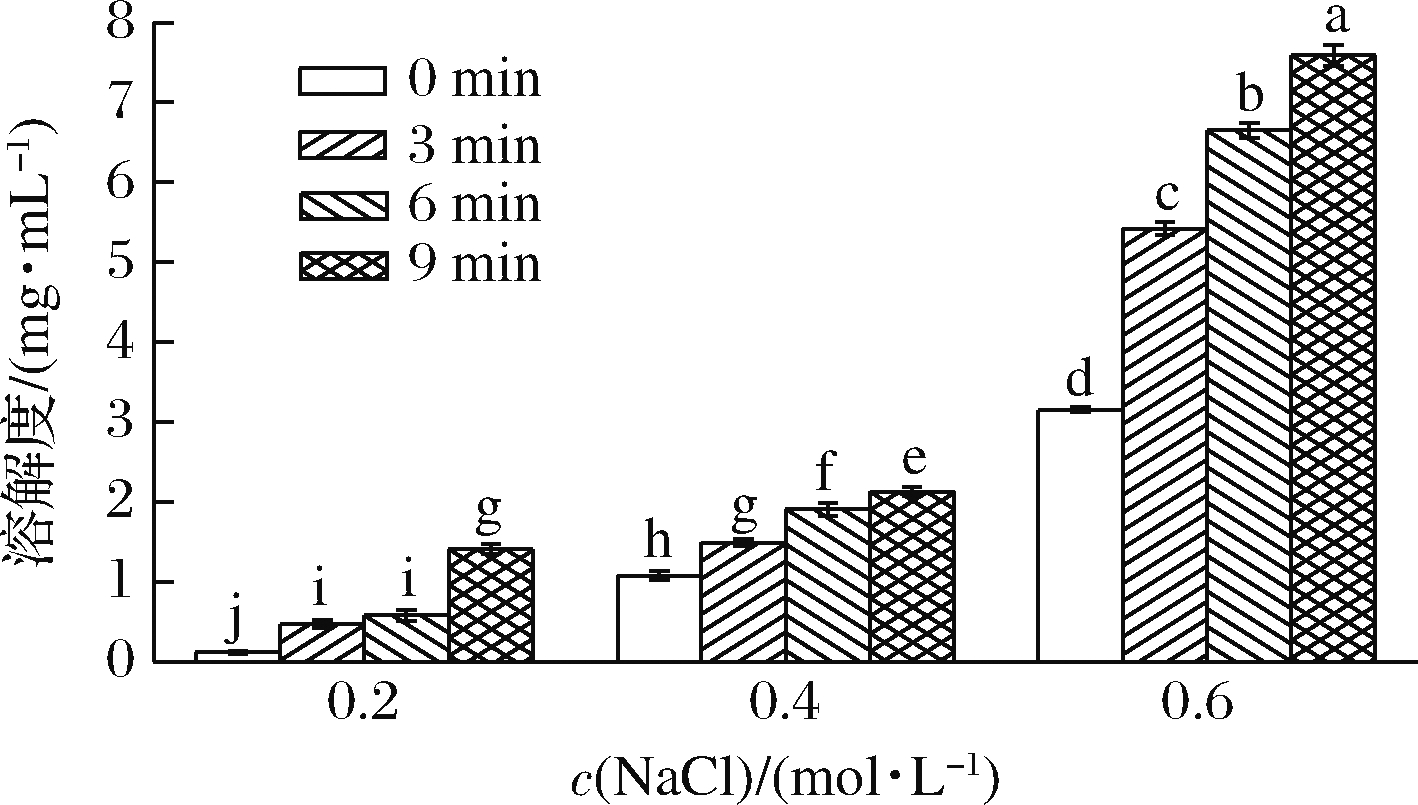
图1 超声波处理时间对不同盐浓度下MP溶解度的影响
Fig.1 Effect of ultrasonic treatment time on MP solubility at different salt concentration
注:字母不同表示不同样品间差异显著(P<0.05)(下同)
2.2 浊度测定
超声波处理时间对不同盐浓度下MP浊度的影响见图2。在相同NaCl浓度下,随着超声时间增加到3 min,不同离子浓度下的MP溶液的浊度显著降低(P<0.05)。随着超声时间继续增加,MP溶液的浊度值降低不显著(P > 0.05)。结合图2和表1可知,MP浊度与粒径变化趋势基本相同,这与SHANMMUGAM等[24]研究超声波处理脱脂牛奶结果类似。由图2可知,未经超声波处理的0.2 mol/L NaCl浓度下MP溶液A660值明显高于0.6 mol/L NaCl浓度下MP溶液的A660值。
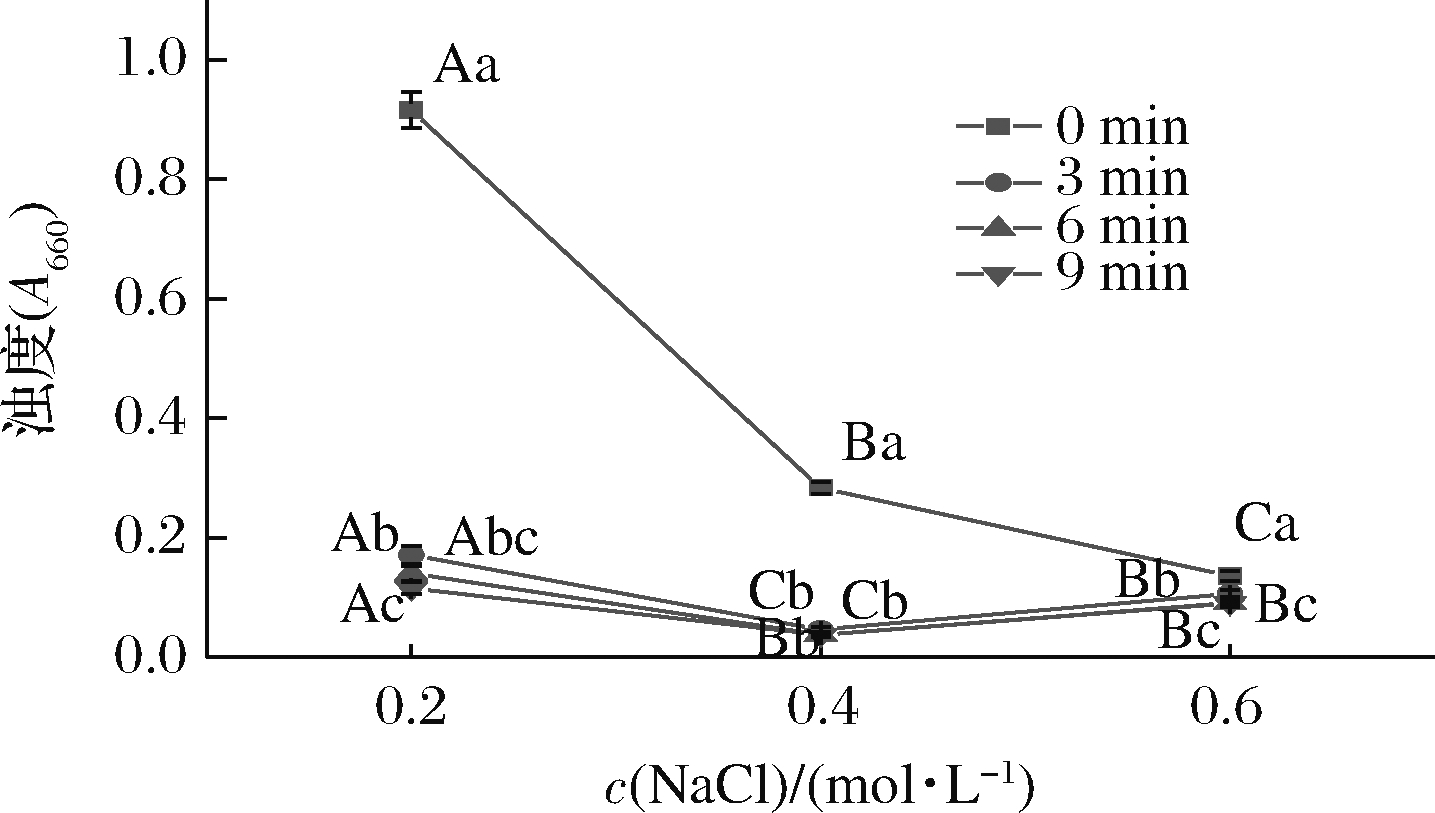
图2 超声波处理时间对不同盐浓度下MP浊度的影响
Fig.2 Effect of ultrasonic treatment time on MP turbidity at different salt concentration
注:大写字母不同表示同一超声时间、不同盐浓度组之间差异显著 (P<0.05);小写字母不同表示同一盐离子浓度组、不同超声时间差异显著 (P<0.05)(下同)
表1 超声波处理时间对不同盐浓度下MP平均粒径的影响
Table 1 Effect of different time of ultrasonic treatment on the average particle size of MP at different salt levels
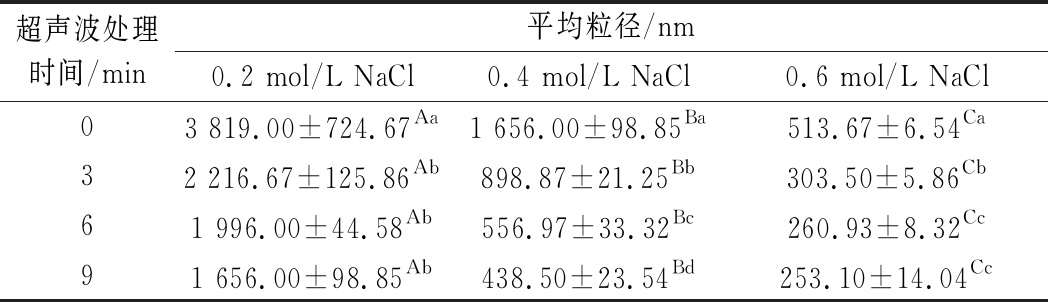
超声波处理时间/min平均粒径/nm0.2 mol/L NaCl0.4 mol/L NaCl0.6 mol/L NaCl03 819.00±724.67Aa1 656.00±98.85Ba513.67±6.54Ca32 216.67±125.86Ab898.87±21.25Bb303.50±5.86Cb61 996.00±44.58Ab556.97±33.32Bc260.93±8.32Cc91 656.00±98.85Ab438.50±23.54Bd253.10±14.04Cc
注:大写字母不同表示同行不同盐浓度差异显著(P<0.05);小写字母不同表示同列不同处理时间差异显著(P<0.05)
TANG等[25]研究超声波处理低盐浓度下罗非鱼肌动球蛋白,其浊度的变化与本研究结果相同。不同离子浓度下的MP经过超声波处理后,与未超声波处理组相比,浊度显著降低(P<0.05),表明高强度超声波能够通过“空化效应”破坏氢键和疏水相互作用,导致大的蛋白质聚集体破碎成小的蛋白质聚集体[26]。这些结果与MP溶解度增加相对应。
2.3 Zeta电位
如图3所示,在相同超声波处理时间下,较高的盐浓度(0.6 mol/L NaCl)Zeta电位的绝对值较低。这可能是由于介质的离子强度增加,导致双电层厚度减小[27]。WU等[28]报道在pH为7.5时,当NaCl浓度从0增加到0.8 mol/L时,猪肉MP的电位绝对值降低。随着超声波处理时间的增加,0.2 mol/L NaCl下MP的电位绝对值增加不显著(P > 0.05),而0.4 mol/L NaCl下MP的电位绝对值显著增加(P<0.05),电位值提升了44%,这可能是超声波处理导致MP的展开,更多带负电的氨基酸暴露到MP的表面,使蛋白质间的静电斥力增强,很难发生聚集,从而增加了MP溶液体系的稳定性。
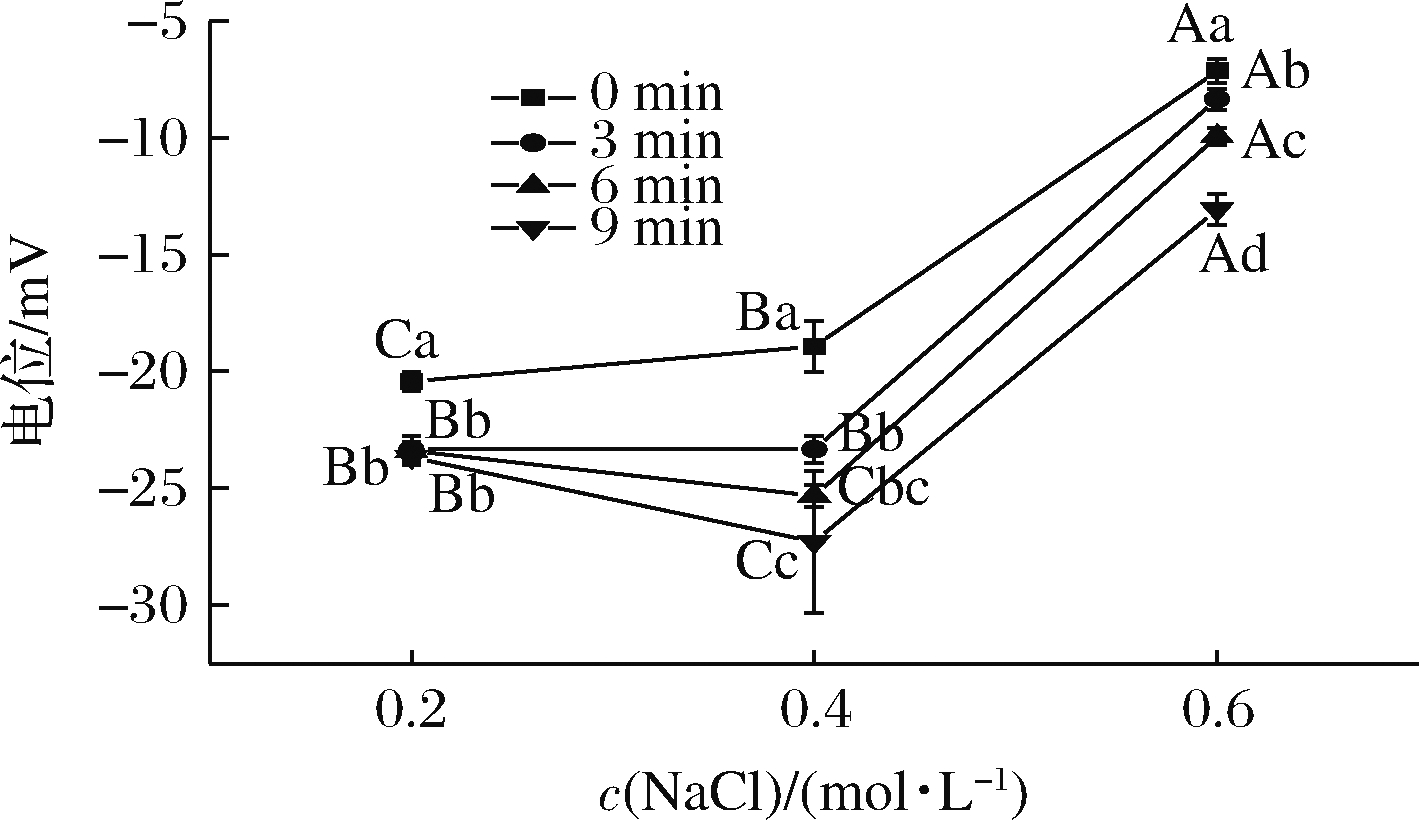
图3 超声波处理时间对不同盐浓度下MP电位的影响
Fig.3 Effect of ultrasonic treatment time on MP potential at different salt concentration
2.4 平均粒径及粒径分布
蛋白质的粒径是影响蛋白质功能特性的因素之一,也是蛋白质结构的宏观表现[29]。由表1可知,超声波处理后0.2、0.4、0.6 mol/L NaCl浓度下MP的平均粒径分别从3 819、1 656、513.67 nm降低到1 656、438.50、253.10 nm(P<0.05),而随着超声时间的增加,MP的平均粒径降低不显著(P>0.05)。粒径刚开始显著降低可能是由于超声提供的机械力使得MP之间的非共价键作用被打断。随着超声时间的增加,平均粒径变化相对缓慢,可能是因为已经打开的MP分子间的相互作用相对变弱[30]。李雨枫等[31]研究发现水洗提取的MP经过超声波处理后,蛋白质的结构被破坏,表现为较小粒径的分散颗粒。
由图4所示,超声波处理不仅减小了MP的粒径,而且提高了粒径分布的均匀性。所有样品组均表现出2个峰。随着超声波处理时间的增加,粒径分布图出现的2个峰值向小的粒径范围移动,且峰值范围变窄。表明超声波处理能够使MP溶液的粒径降低,并缩小粒径的分布范围使其更集中,更均匀。
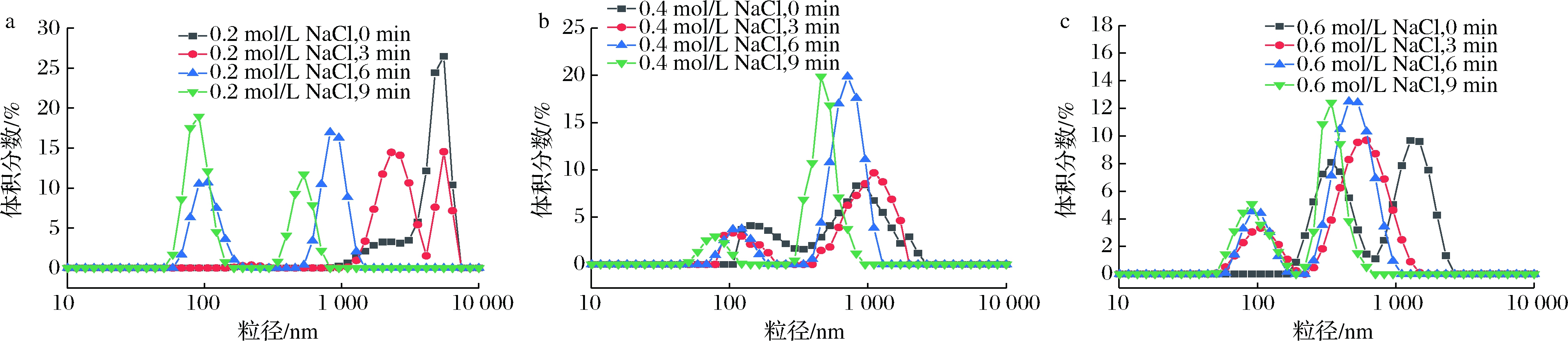
图4 超声波处理时间对不同盐浓度下MP粒径分布的影响
Fig.4 Effect of ultrasonic treatment time on MP particle size distribution at different salt concentrations
LIU等[32]研究表明超声波处理0.5 mol/L NaCl浓度的鲢鱼肌球蛋白,不仅减小了肌球蛋白聚集体的粒径,而且提高了均匀度,与本研究结果一致。
2.5 MP二级结构
傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)可用于测定蛋白质在任何物理状态下的二级结构含量[33]。该技术基于蛋白的酰胺I区(1 700~1 600 cm-1),主要来自于C![]() O基团的伸缩振动[34]。如图5所示,未经超声波处理的样品和超声波处理9 min的样品在吸收区和峰形方面没有明显的差异。但是,可以看出未超声波处理的样品组酰胺I带峰强高于超声波处理组。张坤等[35]利用FTIR研究高强度超声波处理对鹅胸肉肌动球蛋白二级结构的影响,结果显示对照组酰胺I带峰强高于超声组,峰强变化的原因之一是蛋白质的构象变化,这是氢键和诱导效应共同影响造成的。
O基团的伸缩振动[34]。如图5所示,未经超声波处理的样品和超声波处理9 min的样品在吸收区和峰形方面没有明显的差异。但是,可以看出未超声波处理的样品组酰胺I带峰强高于超声波处理组。张坤等[35]利用FTIR研究高强度超声波处理对鹅胸肉肌动球蛋白二级结构的影响,结果显示对照组酰胺I带峰强高于超声组,峰强变化的原因之一是蛋白质的构象变化,这是氢键和诱导效应共同影响造成的。

图5 超声波处理时间对不同盐浓度下MP的FTIR光谱图
Fig.5 FTIR spectrum of ultrasonic treatment time for MP at different salt concentrations
图6显示了超声波处理不同盐离子浓度下MP的二级结构含量的变化。与未超声样品相比,超声波处理9 min的样品有序的二级结构减少,不同离子浓度下α-螺旋的含量分别降低了40%、33%和29%,β-折叠、β-转角、无规卷曲的含量皆增加。ZHANG等[36]研究表明,α-螺旋结构通过肽链内部的氢键稳定,β-折叠结构由肽链间的氢键稳定。因此,α-螺旋含量降低表明,超声处理使得部分分子内氢键断裂,使蛋白有序结构被破坏,从而改变二级结构,使α-螺旋转化为β-折叠、β-转角和无规则卷曲,从而增加了MP的开放性和灵活性。张坤等[35]研究发现超声波处理使α-螺旋降低、β-折叠增加,可能是因为超声波的“空化效应”使α-螺旋肽链伸展变为线性的β-折叠,从而引起肌球蛋白结构发生变化,使得肌球蛋白与肌动蛋白结合作用发生变化,进而使肌动球蛋白的构象发生变化。
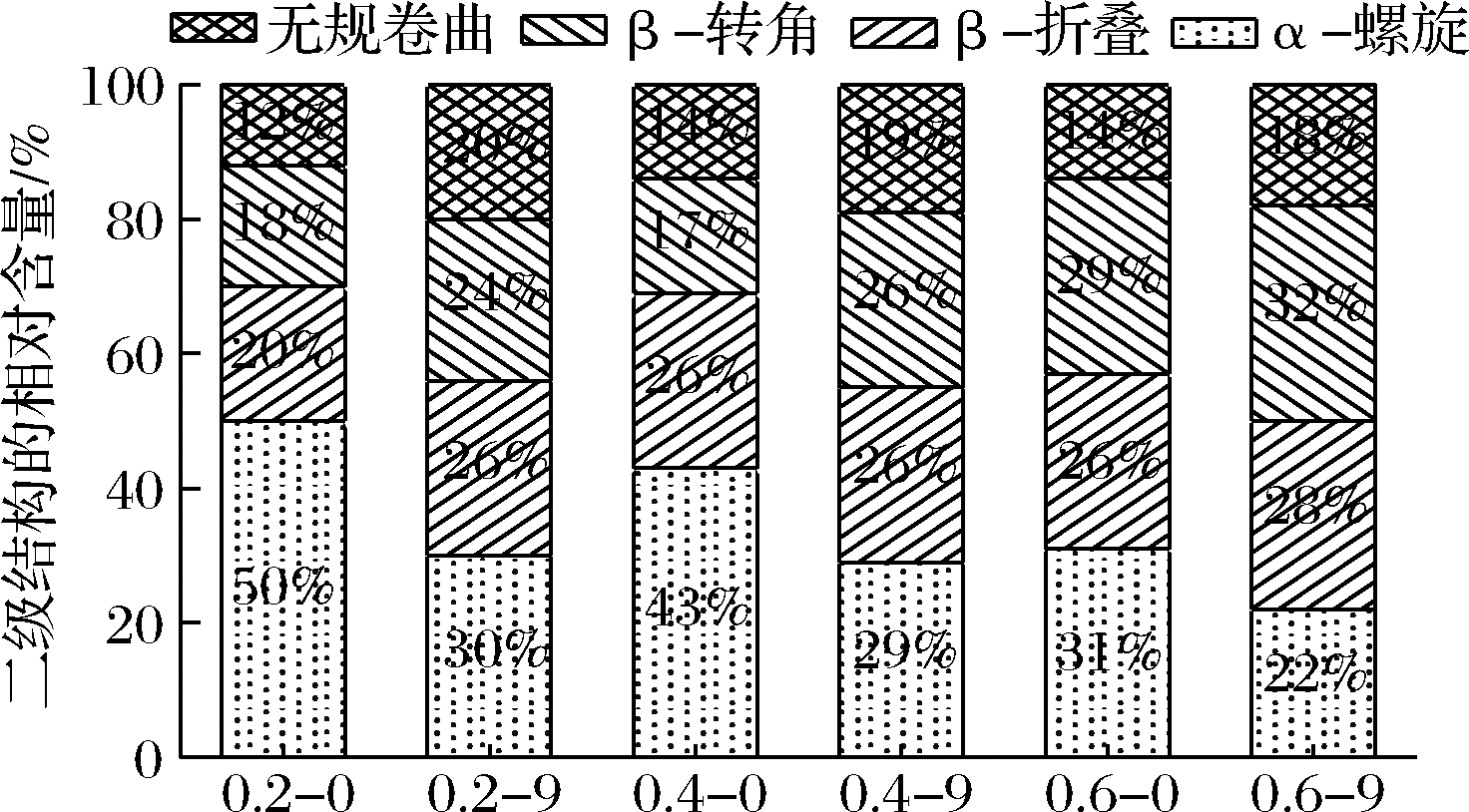
图6 MP二级结构相对百分含量变化
Fig.6 Relative content change of secondary structure in MP
注:0.2-0和0.2-9表示:0.2 mol/L NaCl条件下超声处理时间
0 min 和 9 min;0.4-0和0.4-9表示:0.4 mol/L NaCl条件下
超声处理时间0 min 和 9 min;0.6-0和0.6-9表示:
0.6 mol/L NaCl条件下超声处理时间0 min 和 9 min
3 结论
低频高强度超声波(20 kHz,450 W,30 W/cm2)处理能够有效改良不同盐浓度下MP的理化性质与溶解性。与未超声样品相比,超声波处理后MP溶液溶解度显著上升(P<0.05)、浊度显著下降(P<0.05)、粒径显著变小(P<0.05)、电位绝对值显著增大(P<0.05)、二级结构呈现由有序结构(螺旋)向无序结构(折叠等)转化的趋势。这些结果表明超声波处理促进了MP链展开,结构发生改变,使降盐水平下MP溶液更加稳定,拥有更好的理化及溶解特性,可以在一定程度上弥补低盐给肉制品带来的缺陷。因此,该结果为超声波技术在低盐肉制品中的应用提供一定理论依据和技术指导。
[1] CHOI Y S,KIM H W,HWANG K E,et al.Effects of gamma irradiation on physicochemical properties of heat-induced gel prepared with chicken salt-soluble proteins[J].Radiation Physics and Chemistry,2015,106(1):16-20.
[2] PEREIRA P M,VICENTE A.Meat nutritional composition and nutritive role in the human diet[J].Meat Science,2013,93(3):586-592.
[3] 韩敏义,刘永安,王鹏,等.低场核磁共振法研究NaCl对肌原纤维蛋白凝胶水分分布和移动性的影响[J].食品科学,2014,35(21):97-102.
HAN M Y,LIU Y A,WANG P,et al.Water-holding capacity in heat-induced gelation of myofibrillar proteins as affected by NaCl concentration:A low-field NMR study[J].Food Science,2014,35(21):97-102.
[4] KRISHNAMURTHY G,CHANG H S,HULTIN H O,et al.Solubility of chicken breast muscle proteins in solutions of low ionic strength[J].Journal of Agricultural and Food Chemistry,1996,44(2):408-415.
[5] KANG D,ZHANG W,LORENZO J M,et al.Structural and functional modification of food proteins by high power ultrasound and its application in meat processing[J].Critical Reviews in Food Science and Nutrition,2020:1-20.DOI:10.1080/10408398.2020.1767538
[6] AL-HILPHY A R,AL-TEMIMI A B,RUBAIY H H M A,et al.Ultrasound applications in poultry meat processing:A systematic review[J].Journal of Food Science,2020,85(5):1 386-1 396.
[7] MARIANA B P,LETICIA P C,MICHELLE M X F,et al.Ultrasound:A new approach to reduce phosphate content of meat emulsions[J].Meat Science,2019,152:88-95.
[8] CHO Y J,LEE N H,YANG S Y,et al.Effects of sonication on the water-solubilization of myofibrillar proteins from breast muscle of spent hen[J].Korean Journal for Food Science of Animal Resources,2007,27(4):457-462.
[9] ITO Y,TATSUMI R,WAKAMATSU J I,et al.The solubilization of myofibrillar proteins of vertebrate skeletal muscle in water[J].Animal Science Journal,2003,74(5):417-425.
[10] ITO Y,TOKI S,OMORI T,et al.Physicochemical properties of water-soluble myofibrillar proteins prepared from chicken breast muscle[J].Animal Science Journal,2004,75(1):59-65.
[11] WANG J Y,YANG Y L,TANG X Z,et al.Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein[J].Ultrasonics Sonochemistry,2017,38:225-233.
[12] LIU H,ZHANG H,LIU Q,et al.Solubilization and stable dispersion of myofibrillar proteins in water through the destruction and inhibition of the assembly of filaments using high-intensity ultrasound[J].Ultrasonics Sonochemistry,2020,67:105 160.
[13] ZHAO Y Y,WANG P,ZOU Y F,et al.Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J].Food Research International,2014,58:98-104.
[14] JAMBRAK A R,MASON T J,LELAS V,et al.Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J].Journal of Food Engineering,2014,121:15-23.
[15] ZHANG Z,REGENSTEIN J M,ZHOU P,et al.Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J].Ultrasonics Sonochemistry,2017,34:960-967.
[16] LI K,LIU J Y,FU L,et al.Comparative study of thermal gelation properties and molecular forces of actomyosin extracted from normal and pale,soft and exudative-like chicken breast meat[J].Asian-Australasian Journal of Animal Sciences,2019,32(5):721-733.
[17] 张兴, 杨玉玲,马云,等.pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J].中国农业科学,2017,50(3):564-573.
ZHANG X,YANG Y L,MA Y,et al.Effects of pH on the non-covalent forces and structure of myofibrillar protein and heat induced gel[J].Scientia Agricultura Sinica,2017,50 (3):564-573.
[18] LI K,FU L,ZHAO Y Y,et al.Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids,2020,98:105 275.
[19] SALEEM R,HASNAIN A U,AHMAD R.Solubilisation of muscle proteins from chicken breast muscle by ultrasonic radiations in physiological ionic medium[J].Cogent Food & Agriculture,2015,1(1):1 046 716.
[20] 周茹,倪渠峰,林伟伟,等.肌原纤维蛋白溶解度对盐离子浓度的依赖性[J].中国食品学报,2015,15(3):32-39.
ZHOU R,NI J F,LIN W W,et al.The dependency of the myofibrils solubility on the ion concentration[J].Chinese Journal of Food,2015,15(3):32-39.
[21] MORALES R,MARTINEZ K D,PIZONES RUIZ-HENESTROSA V M,et al.Modification of foaming properties of soy protein isolate by high ultrasound intensity:particle size effect[J].Ultrasonics Sonochemistry,2015,26:48-55.
[22] JAMBRAK A R,LELAS V,MASON T J,et al.Physical properties of ultrasound treated soy proteins[J].Journal of Food Engineering,2009,93(4):386-393.
[23] AMIRI A,MOUSAKHANI-GANJEH A,SHAFIEKHANI S,et al.Effect of high voltage electrostatic field thawing on the functional and physicochemical properties of myofibrillar proteins[J].Innovative Food Science & Emerging Technologies,2019,56:102 191.
[24] SHANMMUGAM A,CHANDRAPALA J,ASHOKKUAR M.The effect of ultrasound on the physical and functional properties of skim milk[J].Innovative Food Science and Emerging Technologies,2012,16(39):251-258.
[25] TANG L,YONGSAWATDIGUL J.Physicochemical properties of tilapia (Oreochromis niloticus) actomyosin subjected to high intensity ultrasound in low NaCl concentrations[J].Ultrasonics Sonochemistry,2020,63:104 922.
[26] 李可,李三影,扶磊,等.低频高强度超声波对鸡胸肉肌原纤维蛋白性质的影响[J].食品科学,2020,41(23):122-129.
LI K,LI S Y,FU L,et al.Effect of low-frequency and high-intensity ultrasound treatment on the characteristic of chicken breast meat myofibrillar protein[J].Food Science,2020,41(23):122-129.
[27] SALGIN S,SALGN U,BAHADR S.Zeta potentials and isoelectric points of biomolecules:The effects of ion types and ionic strengths[J].International Journal of Electrochemical Science,2013,7:12 404.
[28] WU L,WU T,WU J,et al.Effects of cations on the “salt in” of myofibrillar proteins[J].Food Hydrocolloids,2016,58:179-183.
[29] MORALES R,MARTíNEZ K D,PIEONES RUIZ-HENESTROSA V M,et al.Modification of foaming properties of soy protein isolate by high ultrasound intensity:Particle size effect[J].Ultrasonics Sonochemistry,2015,26:48-55.
[30] 王静宇,杨玉玲,周磊.超声波对肌原纤维蛋白理化和质构特性的影响[J].食品工业科技,2018,39(11):12-16;21.
WANG J Y,YANG Y L,ZHOU L,et al.Effects of ultrasound on physicochemical and texture property in myofibrillar protein[J].Science and Technology of Food Industry,2018,39(11):12-16;21.
[31] 李雨枫,薛思雯,陈星,等.高压均质处理次数对肌原纤维蛋白水溶液结构及理化特性的影响[J].食品科学,2019,40(15):127-134.
LI Y F,XUE S W,CHEN X,et al.Changes in structure and physicochemical properties of myofibrillar proteins subjected to different cycles of high pressure homogenization treatment[J].Food Science,2019,40(15):127-134.
[32] LIU R,LIU Q,XIONG S,et al.Effects of high intensity ultrasound on structural and physicochemical properties of myosin from silver carp[J].Ultrasonics Sonochemistry,2017(37):150-157.
[33] CHOI S M,MA C Y.Conformational study of globulin from common buckwheat (Fagopyrum esculentum Moench) by Fourier transform infrared spectroscopy and differential scanning calorimetry[J].Journal of Agricultural & Food Chemistry,2005,53(20):8 046-8 053.
[34] BARTH A.Infrared spectroscopy of proteins[J].Biochimica Et Biophysica Acta,2007,1767(9):1 073-1 101.
[35] 张坤,邹烨,王道营,等.高强度超声处理对鹅胸肉肌动球蛋白特性的影响[J].食品科学,2018,39(21):59-65.
ZHANG K,ZOU Y,WANG D Y,et al.Effect of high-intensity ultrasound on the characteristics of goose breast muscle actomyosin[J].Food Science,2018,39(21):59-65.
[36] ZHANG Z Y,YANG Y L,ZHOU P,et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chem,2017(217):678-686.