酿酒大曲可以为白酒的酿造提供营养物质、香味成分,以及为微生物种群提供相关的生物酶,是浓香型和酱香型白酒重要的糖化发酵动力。常用的大曲原料有小麦、大麦和豌豆[1],原料经粉碎、加水拌和,压制成块状,天然接种,多菌种混合自然发酵而成[2]。在制曲时为防止有害菌的生长,制曲原料中有时会适当添加中草药。但无论是小麦、大麦、豌豆还是中草药,在种植过程中为防治病虫害几乎都会使用到杀虫剂、除草剂等农药,虽然在制作过程中原料和辅料经过清洗可减少部分农药残留,但仍会有农药残留,而曲药中的农药残留可能会部分迁移至酒中,影响酒的质量。目前,有关酒类产品中农药残留的检测研究已有很多,检测对象多为成品白酒[3]、葡萄酒[4-5]、黄酒[6]和啤酒[7]。虽然大型酒厂已将原料农药残留作为一项严控指标,但目前对白酒曲药中的农药残留检测分析尚少见报道。
农药残留的检测方法主要有:气相色谱法[7]、气相色谱串联质谱法[6]、高效液相色谱法[9]、液相色谱串联质谱法[8]、液相色谱-电喷雾质谱法[10]、超高效液相色谱-高分辨质谱法[11]、气/液相色谱-高分辨质谱法[4]等。在农药残留检测中,样品前处理技术的选择十分重要,常用处理方法为:固相萃取法[12]、固相微萃取法[13]、液-液萃取法[14]及QuEChERS法[15-16]等。QuEChERS法具有经济环保、操作简便、适用范围广等优点,但净化效果要相比固相萃取色谱法差,尤其是多组分同时监测时,杂质净化不彻底会造成离子干扰,影响定量准确性。
因此在利用QuEChERS法作为农药残留样品的前处理技术时,十分有必要结合一种更为有效的净化方式。超滤是一种加压膜分离技术,膜孔径介于微滤和反渗透之间,通过膜表面的微孔结构对物质进行选择性分离,在食品饮料、化工电子和生物环境等领域有着广泛的应用[17-18]。在一定压力下,小分子物质可穿过一定孔径的特制薄膜,而大分子物质不能透过,从而将两者分开。农药的分子质量一般小于500 Da,将超滤管应用到农药残留检测的前处理,截留物质的分子质量范围为1×103~ 1×105 Da[19],可以满足农药与食品中蛋白质及其他大分子杂质分离的目的[20]。
本文采用QuEChERS法结合超滤净化柱对样品进行前处理,再结合气相色谱法-三重四级杆质谱法(ultrafiltration purification combined with-chromatography triple quadrupole mass spectrometry,GC-QQQ)测定酿酒大曲中23种有机磷农药残留,以期快速、简便、准确地掌握大曲中农药残留情况,为提升白酒酿造品质提供技术支撑。
1 材料与方法
1.1 材料与仪器
酿酒大曲试样,酒企提供;QuEChERS提取包、m-PFC超滤净化柱 (复杂基质),北京绿棉科技有限公司;丙酮、二氯甲烷、乙腈、乙酸乙酯 (均为色谱纯),德国默克公司;乙二胺-N-丙基硅烷化硅胶 (primary-secondary amine,PSA)、十八烷基硅烷键合硅胶(C18),天津博纳艾杰尔科技有限公司。
标准品(100 μg/mL):敌敌畏、甲胺磷、乙酰甲胺磷、灭线磷、甲拌磷、氧乐果、特丁硫磷、氯唑磷、甲基毒死蜱、乐果、甲基嘧啶磷、毒死蜱、甲基对硫磷、倍硫磷、马拉硫磷、杀螟硫磷、对硫磷、甲基异柳磷、水胺硫磷、杀扑磷、丙溴磷、硫环磷、三唑磷,环氧七氯B,农业农村部环境保护科研监测所。所有溶液均采用超纯水配制。
7890B—7000C气-质联用仪(配备Agilent7696A自动进样器),美国Agilent公司;MiLL-Q纯水机,美国Millipore公司;T10高速均质仪,德国IKA公司;TD5A-WS离心机,上海卢湘仪离心机仪器有限公司;MPEva GS平行浓缩仪,睿莱博仪器(广州)有限公司;XS204电子天平,梅特勒-托利多仪器 (上海) 有限公司;JL-721DTH数控超声波清洗器,中国南京科捷分析仪器有限公司。
1.2 实验方法
1.2.1 样品前处理
1.2.1.1 提取
振荡法提取:称取粉碎并过筛后的试样 5 g (精确至0.1 mg) 于50 mL聚丙烯具塞离心管中,加10 mL超纯水后涡旋混匀,静置 30 min,加入10 mL乙腈提取溶剂、QuEChERS提取包 (含6 g无水MgSO4、1.5 g醋酸钠) 及1颗陶瓷均质子,盖上离心管盖,剧烈振荡1 min,4 200 r/min 离心5 min,取上清液待净化[21]。
超声波法提取:称取粉碎并过筛后的试样 5 g (精确至0.1 mg) 于50 mL聚丙烯具塞离心管中,加10 mL超纯水后涡旋混匀,静置 30 min,加入10 mL乙腈提取溶剂,盖上离心管盖,超声萃取20 min,4 200 r/min离心 5 min,取上清液待净化。
均质法提取:称取粉碎并过筛后的试样 5 g (精确至0.1 mg) 于50 mL聚丙烯具塞离心管中,加10 mL超纯水后涡旋混匀,静置30 min,加入10 mL乙腈提取溶剂,均质提取1 min,4 200 r/min离心5 min,取上清液待净化。
1.2.1.2 净化
国家标准QuEChERS净化法:移取6 mL上清液加到含1 200 mg MgSO4、400 mg PSA及400 mg C18的15 mL塑料离心管中,漩涡混匀1 min,4 200 r/min离心5 min,准确吸取2 mL上清液,待用[21]。
超滤净化柱法:移取1 mL上清液,从超滤净化柱顶部加入,缓慢推动柱塞杆,使上清液缓慢通过净化材料,即净化完成,待用。
1.2.2 空白实验
除不加试样外,按照1.2.1小节中方法进行空白试验。
1.2.3 标准储备液与工作液的配制
混合标准溶液:吸取一定量的农药标准品于10 mL容量瓶中,用乙腈定容至刻度。混合标准溶液质量浓度为5、10、50、100、500、1000 μg/L。
内标溶液:将质量浓度为100 μg/mL的环氧七氯B标准溶液,用乙酸乙酯稀释成质量浓度为100 μg/L的内标溶液。
基质混合标准工作液:空白基质溶液按1.2.1小节中方法处理后于40 ℃水浴中氮气吹至近干,分别加入1 mL相应质量浓度的混合标准溶液,复溶,过滤(0.22 μm有机滤头),上机测定。基质混合标准工作溶液现用现配。
1.2.4 气相色谱-质谱条件
1.2.4.1 气相色谱条件
色谱柱为安捷伦VF1701 (30 m×250 μm,0.25 μm);程序升温:初始温度为40 ℃,保持1 min,以40 ℃/min升至120 ℃,再以5 ℃/min,升至240 ℃,再以12 ℃/min,升至300 ℃保留6 min;载气:氦气,纯度≥99.99%,流速1.0 mL/min;进样方式:2层夹层进样,气隙0.2 μL,样品进样1 μL,内标进样1 μL,脉冲不分流,0.75 min后打开隔垫吹扫阀。
1.2.4.2 质谱条件
EI源,电子能量70 eV;离子源温度 280 ℃,传输线温度 280 ℃;碰撞气为氮气,纯度≥99.999%;溶剂延迟 3 min;数据采集模式,MRM。
1.3 数据处理
利用 MassHunter(B.06.00.SP01)软件进行数据采集及处理,Excel 2016 计算测试数据回收率和相对标准偏差(relative standard deviation, RSD)。
2 结果与分析
2.1 样品前处理优化
2.1.1 提取溶剂的选择
提取溶剂是影响目标物提取效率及基质效应的重要因素。分别采用丙酮、二氯甲烷、乙腈作为酿酒大曲中23种农药残留的提取溶剂,按1.2.1小节的样品预处理方法,分别加入10 mL丙酮、二氯甲烷、乙腈,考察不同溶剂对23种目标农药的提取效率。结果表明,丙酮、二氯甲烷、乙腈溶剂均可以将样品中的农药提取出来,其中以乙腈对绝大多数目标物的提取效果较好(85%~100%),可能是因为乙腈极性较强且分子较小,受基质的干扰最小(图1-a)。因此选择乙腈为目标物提取溶剂。
2.1.2 提取方式的选择
为了提高有机溶剂对目标农药的提取效率,选用常用的振荡法、超声波法、均质法3种提取方式(按1.2.1小节进行样品前处理)。如图1-b 所示,均质法的回收率(82%~102%)高于振荡法和超声波法。但由于均质的剪切力过强[22],易将大曲试样中的色素等物质一同萃取出来,给后续净化工作增加困难。超声波提取与振荡提取回收率接近,但超声波提取需要时间较长且提取过程不易控制,振荡法操作简单。因此选择剧烈振荡的提取方式。
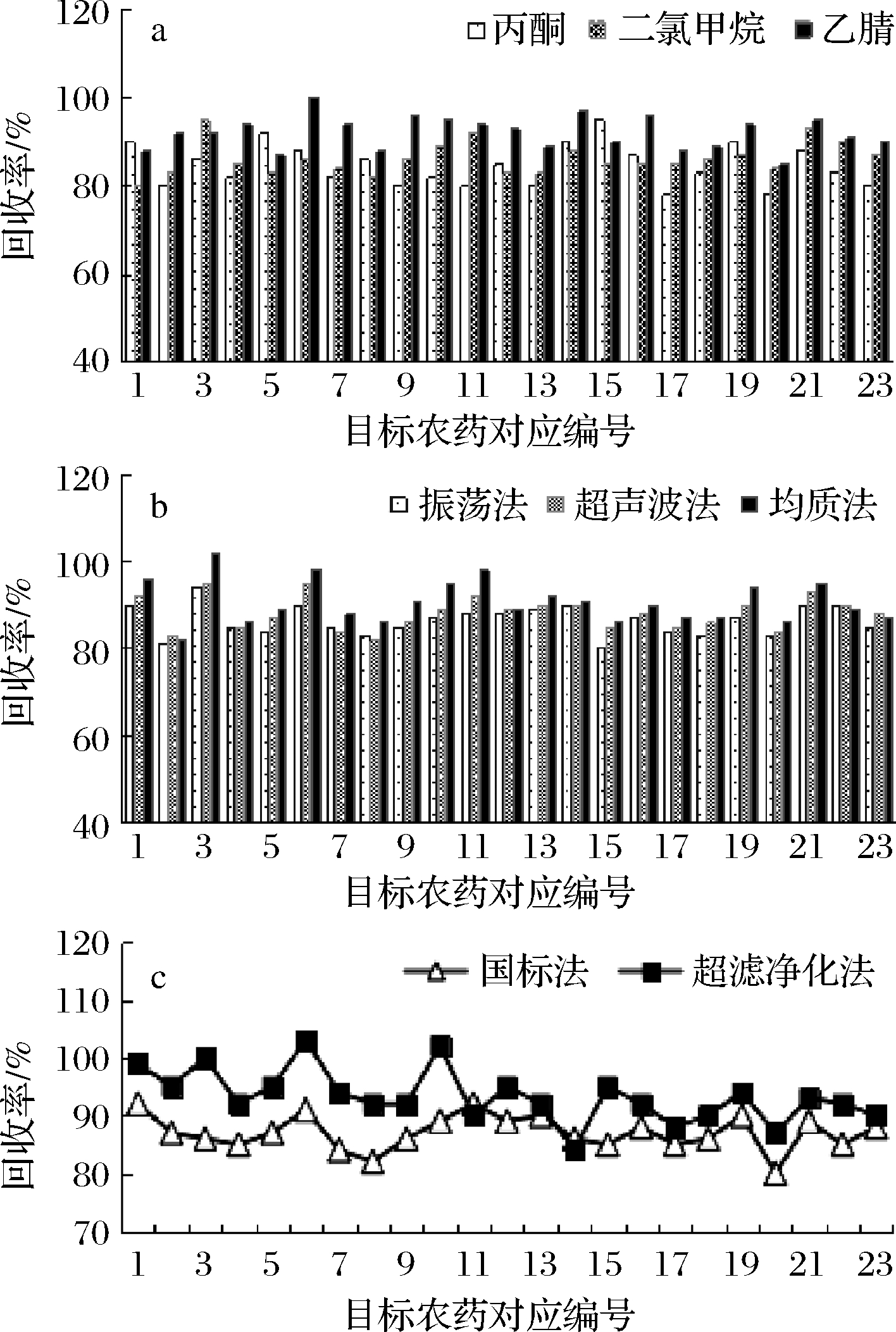
a-提取剂对回收率的影响;b-提取方式对回收率的影响;
c-净化方式对回收率的影响
图1 不同条件对提取效率的影响
Fig.1 Recoveries of 23 pesticides in Daqu with different conditions
注:各编号对应农药见表1
表1 MRM模式下各种农药保留时间、特征离子对、碰撞能量及优化条件下测得的23种农药的线性方程、回归系数(n=3)
Table 1 In MRM mode, the various pesticides’ retention time, characteristic ion pair, and collision energy; Linear equations and regression coefficients of 23 pesticides obtained under optimized conditions

编号农药名称保留时间/min特征离子对定量离子对定性离子对碰撞能量/eV线性方程 线性范围/(μg·L-1)R21敌敌畏8.493109.0/79.0184.9/93.05、10y=5.923 437x5~1 0000.999 983 912甲胺磷10.216141.0/95.0141.0/79.05、15y=3.158 751x5~1 0000.999 702 733乙酰甲胺磷15.174136.0/94.0136.0/42.010、5y=0.925 526x10~1 0000.999 157 694灭线磷15.968157.9/97.0157.9/114.015、5y=5.347 103x5~1 0000.999 475 065甲拌磷17.053260.0/75.0130.9/128.95、25y=7.208 919x5~1 0000.999 796 886氧乐果18.305155.9/110.0109.0/79.05、15y=1.350 733x10~1 0000.999 552 797特丁硫磷18.534230.9/175.0230.9/129.010、20y=4.709 122x5~1 0000.999 753 858氯唑磷20.374161.0/119.1161.0/146.05、5y=4.665 327x5~1 0000.999 538 959甲基毒死蜱20.907285.9/92.9287.9/92.920、20y=2.410 762x5~1 0000.999 482 1110乐果20.97086.9/46.0142.9/111.015、10y=2.430 968x5~1 0000.999 144 1111甲基嘧啶磷21.908290.0/125.0232.9/151.020、5y=2.744 148x5~1 0000.999 462 2712毒死蜱22.450196.9/169.0198.9/171.015、15y=3.743 108x5~1 0000.999 777 6313甲基对硫磷22.881262.9/109.0232.9/109.010、10y=1.348 361x5~1 0000.999 598 1114倍硫磷23.404278.0/109.0278.0/169.015、15y=12.399 687x5~10000.999 151 6115马拉硫磷23.406126.9/99.0172.9/99.05、15y=5.256 401x5~1 0000.99 9438 2816杀螟硫磷23.619277.0/260.0277.0/109.05、20y=1.642 481x10~1 0000.999 654 1817对硫磷24.370290.9/109.0138.9/109.010、5y=1.326 791x5~1 0000.999 512 7618甲基异柳磷24.445199.0/121.0241.1/199.110、10y=11.285 852x5~1 0000.999 878 6319水胺硫磷24.971135.9/108.0135.9/69.015、30y=5.351 115x5~1 0000.999 257 9620杀扑磷26.487144.9/85.0144.9/58.15、15y=7.660 234x5~10000.999 288 9421丙溴磷26.589207.9/63.0338.8/268.730、15y=0.685 399x10~1 0000.999 243 4622硫环磷27.646196.0/140.0168.0/140.010、5y=0.893 456x10~1 0000.999 832 6123三唑磷29.770161.2/134.2161.2/106.15、10y=1.856 967x10~1 0000.999 242 77
2.1.3 净化条件的比较
分别采用国家标准法和超滤净化柱净化2种净化方式对试样进行净化处理,考察不同净化方法对酿酒大曲中23种目标物提取效率的影响。如图1-c所示,国家标准法(80%~92%)和超滤净化柱法(84%~103%)均有较好的回收效率,但超滤净化柱法极大地简化了实验流程,批处理样品更为简便快捷。
2.2 特征离子的选择
根据丰度和质荷比优化MRM条件,优化后的特征离子及碰撞能量见表1,MRM总离子流图见图2。
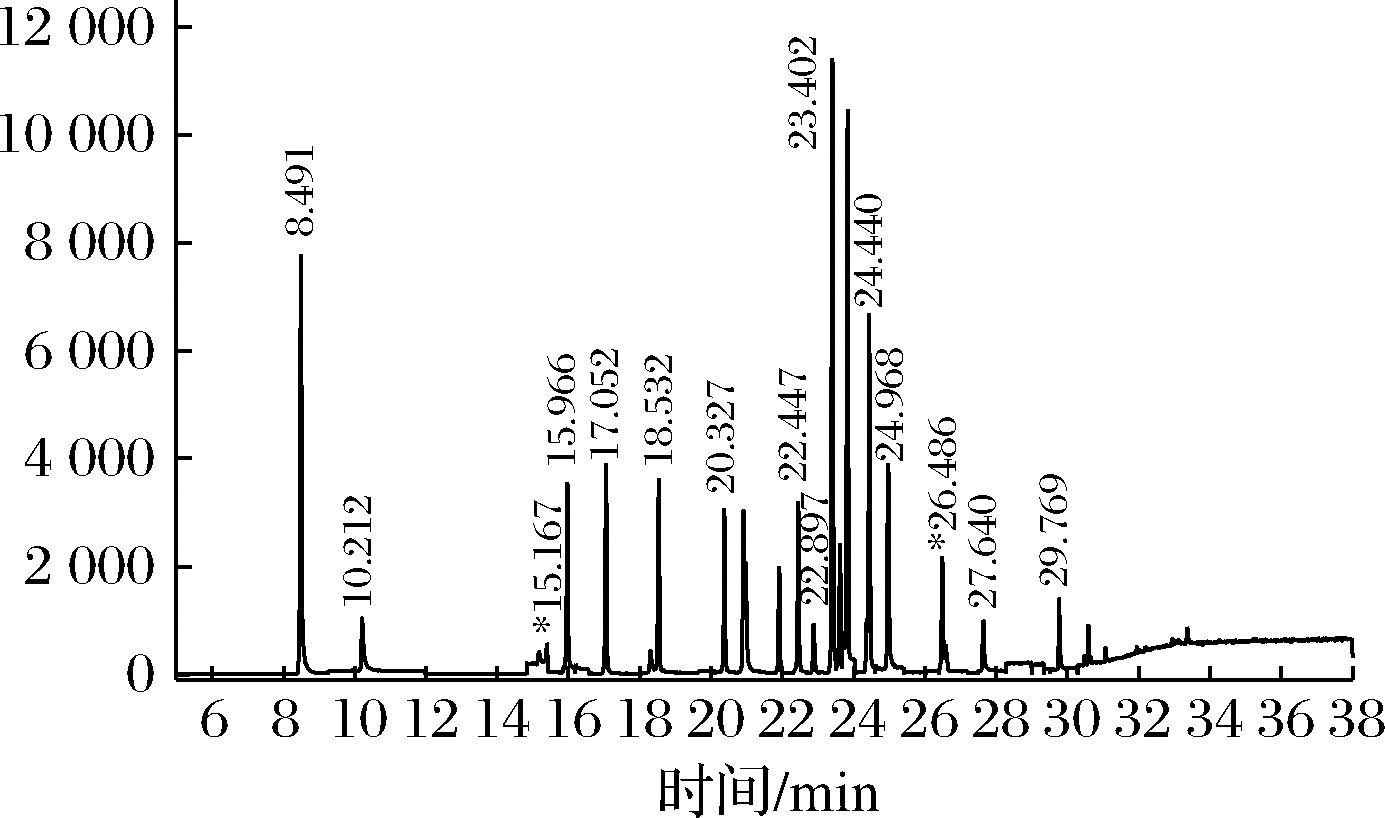
图2 大曲基质中23种有机磷农药残留混标气相色谱谱图
Fig.2 Mixed standard gas chromatogram of 23 kinds of organophosphorus pesticide residues in Daqu
2.3 方法性能指标考察
2.3.1 线性关系
在优化实验条件下,以1.2.2小节的方法配制混合标准工作溶液,上机测定。以目标物与内标物的相对质量浓度为横坐标,以目标物与内标物的相对峰面积比为纵坐标,进行线性回归,得到各目标物线性关系,以R2≥0.99为判断指标,确定各目标物的线性范围,具体参数见表1。由表1可知所有目标物的R2均达到0.999以上,表明23种农药均具有很好的线性关系,能够很好的满足分析要求。
2.3.2 回收率、检出限与定量限
目前国家未对酿酒曲药农药残留制定限量标准,但曲药大多以谷物为主要原料,本实验参照GB/T 27404—2008[23],结合GB 2763—2019中谷物类农药残留限量[24],选取3个质量浓度水平(0.05、0.1、0.2 mg/kg),以酿酒大曲为基质做加标回收试验,每个质量浓度做6次平行,计算平均回收率和相对标准偏差(RSD)。由表2可知,结果表明23种目标物的回收率在85%~106%,相对标准偏差均小于10%。以0.05 mg/kg添加水平为依据,采用特征离子质量色谱图信噪比S/N≥3计算检出限和以S/N≥10计算定量限。结果显示检测限和定量限分别在0.002~0.035 mg/kg和0.007~0.118 mg/kg,满足GB 2763—2019中对谷物类农药残留检测的要求。
表2 23种农药平均回收率、检出限和定量限(n=6)
Table 3 Average recouery rate, the limits of detection and limits of quantitation of the 23 pesticides

农药名称检出限/(mg·kg-1)定量限/(mg·kg-1)0.05 mg/kg0.1 mg/kg0.2 mg/kg回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%敌敌畏0.0040.0131006.5983.2981.0甲胺磷0.0200.066955.3942.5992.4乙酰甲胺磷0.0330.1111005.11043.21000.6灭线磷0.0070.024945.8903.3942.0甲拌磷0.0080.025947.9923.2951.6氧乐果0.0290.0961065.21021.71000.6特丁硫磷0.0070.025975.9942.9981.9氯唑磷0.0100.032936.1922.2952.2甲基毒死蜱0.0100.033975.9942.6962.3乐果0.0120.0421025.41043.4992.0甲基嘧啶磷0.0140.046944.7902.9942.0毒死蜱0.0090.029976.8944.3972.7甲基对硫磷0.0260.087909.6942.5952.3倍硫磷0.0020.007905.8903.3972.1马拉硫磷0.0100.032935.8942.11001.8杀螟硫磷0.0220.073917.4923.61002.3对硫磷0.0240.081896.1883.7951.9甲基异柳磷0.0040.014906.1903.3951.8水胺硫磷0.0070.022976.6944.51002.3杀扑磷0.0110.037916.5854.0973.2丙溴磷0.0350.118987.6944.0952.8硫环磷0.0270.089979.7906.4953.0三唑磷0.0170.058927.8905.9972.9
2.4 实际样品检测
利用优化后的实验方法检测了10组酿酒大曲,大部分曲药未检出农药残留,只有1组样品中检出毒死蜱(0.013 mg/kg)和马拉硫磷(0.020 mg/kg),检测结果见表3。
表3 实样测试结果
Table 3 Test results of actual samples
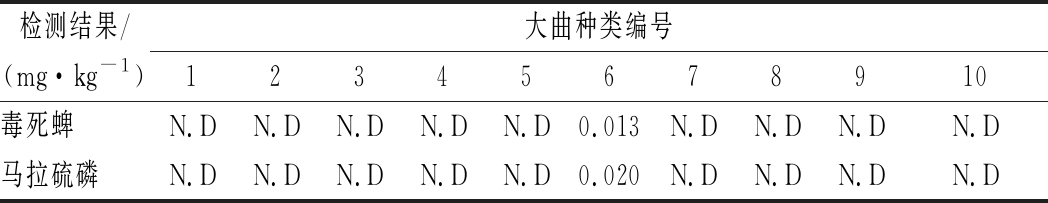
检测结果/(mg·kg-1)大曲种类编号12345678910毒死蜱N.DN.DN.DN.DN.D0.013N.DN.DN.DN.D马拉硫磷N.DN.DN.DN.DN.D0.020N.DN.DN.DN.D
注:N.D表示未检出
3 结论与讨论
采用GC-QQQ法对酿酒大曲中可能存在的23种有机磷农药进行同时检测,对样品前处理方法进行了优化,以乙腈为提取剂获得了较好的回收率;提取方式上,振荡法操作简单、快速,对23种目标农药的回收率与超声波法接近,在试样提取过程控制上优于均质法和超声波法;考查了国家标准法、超滤净化柱2种净化方式,国家标准[21]中采用的净化方式是试样经提取、离心后取上清液加入无水硫酸镁、PSA和C18。其中无水硫酸镁为干燥剂,主要目的是去除提取液中的水,以保证其他净化物的吸附效果。PSA和C18作为净化物,由于PSA中含2个氨基,提供了更大的离子交换容量,能通过氢键萃取极性化合物,经PSA净化后的样品极性化合物保留度较高,且能有效去除样品基质中的有机酸、色素和糖类杂质;C18的有效成分是硅胶键合的十八烷基,具有疏水性,主要是去除脂肪和非极性物质。2种净化方式对目标农药的回收效率接近,但超滤净化柱法批处理样品更为简便快捷。
在前处理优化方案的基础上,建立了QuEChERS-GC-QQQ对酿酒大曲中可能存在的23种有机磷农药进行同时检测的方法。方法前处理简单、快速,23种有机磷农药的检出限、定量限和回收率均能满足农药残留分析检测技术[21]要求,可用于酿酒大曲中多种农药残留检测分析。
[1] 敖宗华,陕小虎,沈才洪,等.国内主要大曲相关标准及研究进展[J].酿酒科技,2010(2):104-108.
AO Z H,SHAN X H,SHEN C H,et al.Domestic related quality standards of Daqu & its research progress[J].Liquor-making Science & Technology,2010(2):104-108.
[2] 乔宗伟,张霞,施思,等.不同感官质量曲药在培曲过程中理化指标变化规律研究[J].中国酿造,2016,35(10):116-119.
QIAO Z W,ZHANG X,SHI S,et al.Change of physicochemical indexes in the cultivation process of Daqu with different sensory quality[J].China Brewing,2016,35(10):116-119.
[3] 王春利,籍芳,孙玉慧,等.液液萃取-气相色谱-质谱联用快速检测白酒中多种农药残留[J].酿酒科技,2018(2):117-121.
WANG C L,JI F,SUN Y H,et al.Rapid determination of multiresidue pesticides in Baijiu by GC-MS coupled with liquid-liquid extraction[J].Liquor-making Science & Technology,2018(2):117-121.
[4] 徐豪, 李洋,张廷廷,等.色谱分析法在葡萄酒农药残留检测中的应用进展[J].食品安全质量检测学报,2020,11(6):1 695-1 701.
XU H,LI Y,ZHANG T T,et al.Application of chromatography in the detection of pesticide residues in wine[J].Journal of Food Safety and Quality,2020,11(6):1 695-1 701.
[5] PELAJIC M,PECEK G,MUTAVDZIC P D,et al.Novel multiresidue method for determination of pesticides in red wine using gas chromatography-mass spectrometry and solid phase extraction[J].Food Chemistry,2016,200:98-106.
[6] 李进义,闵国平,方云波,等.气相色谱-质谱测定黄酒中的敌敌畏[J].中国卫生检验杂志,2019,29(16):1 935-1 937;1 941.
LI J Y,MIN G P,FANG Y B,et al.Determination of dichlorvos in Chinese rice wine by GC-MS[J].Chinese Journal of Health Laboratory Technology,2019,29(16):1 935-1 937;1 941.
[7] 柴宗龙,钱滢文,袁彩霞,等.气相色谱检测啤酒中十六种有机磷农药残留方法的建立[J].食品工业科技,2020,41(14):204-209.
CHAI Z L,QIAN Y W,YUAN C X,et al.Establishment of gas chromatographic (GC) method for the detection of 16 kinds of organophosphorus (Ops) pesticide residues in Beer[J].Science and Technology of Food Industry,2020,41(14):204-209.
[8] GOLGE O,KOLUMAN A,KABAK B.Validation of a modified QuEChERS method for the determination of 167 pesticides in milk and milkproducts by LC-MS/MS[J].Food Analytical Methods,2018,11(4):1 122-1 148.
[9] 刘钰,庄占兴,刘军,等.高效液相色谱法检测20%噁唑酰草胺·灭草松微乳剂[J].山东化工,2020,49(12):64-66.
LIU Y,ZHUANG Z X,LIU J,et al.Analysis of Metamifop+Bentazone20% ME by HPLC[J].Shandong Chemical Industry,2020,49(12):64-66.
[10] 王蓉,付大友,李艳清,等.液相色谱-电喷雾质谱法测定白酒中5种有机磷农药残留[J].酿酒科技,2008(6):103-105.
WANG R,FU D Y,LI Y Q,et al.Determination of five kinds of organophosphorous pesticide residue in liquor by high performance liquid chromatography-electrospray ionization tandem mass spectrometry[J].Liquor-making Science & Technology,2008(6):103-105.
[11] 赵妍,杨军,辛少鲲,等.超高效液相色谱-高分辨质谱法测定牛奶中新烟碱类农药残留[J].中国食品卫生杂志,2020,32(2):139-145.
ZHAO Y,YANG J,XIN S K,et al.Determination of neonicotinoid residues in milk by ultra-high performance liquid chromatography-high resolution mass spectrometry[J].Chinese Journal of Food Hygiene,2020,32(2):139-145.
[12] HOU X,LEI S R,QIU S T,et al.A multi-residue method for the determination of pesticides in tea using multi-walled carbon nanotubes as a dispersive solid phase extraction absorbent[J].Food Chemistry,2014,153:121-129.
[13] LI J X,ZHANG Z J,SUN M Y,et al.Use of a headspace solid-phase microextraction-based methodology followed by gas chromatography-tandem mass spectrometry for pesticide multiresidue determination in teas[J].Chromatographia,2018,81(5):809-821.
[14] FANG Y,TIAN W,PEI F,et al.Simultaneous determination of pesticide residues and antioxidants in blended oil using a liquid-liquid extraction combined with dispersive solid phase extraction method[J].Food Chemistry,2017,229:347-353.
[15] KACZYNSKI P,LOZOWICKA B.One step QuEChERS-based approach to extraction and cleanup in multiresidue analysis of sulfonylurea herbicides in cereals by liquid chromatography-tandem mass spectrometry[J].Food Analytical Method.2017,10(1):147-160.
[16] BI S Y,ZHU Z Q,CHI W H,et al.Determination of eight organophosphorus pesticide residues in pepper by QuEChERS-Gas chromatography[J].Agricultural Biotechnology,2018,7(1):123-125.
[17] 黄阿根,董瑞建,葛庆丰.超滤用于茶树花多酚纯化工艺的研究[J].食品与发酵工业,2007,33(8):158-162.
HUANG A G,DONG R J,GE Q F.Studies on the purification of polyphenols from tea plant flower by ultra-filtration[J].Food and Fermentation Sciences & Technology,2007,33(8):158-162.
[18] 黄瑾辉,曾光明,方瑶瑶,等.基于复配胶团的强化超滤处理含镉废水[J].中国环境科学,2007,27(3):317-321.
HUANG J H,ZENG G M,FANG Y Y,et al.Treatment of wastewater containing cadmium ions by micellar-enhanced ultrafiltration with nonionic surfactants mixed micelles[J].China Environmental Science,2007,27(3):317-321.
[19] 宓捷波,王云凤,陈其勇,等.超滤净化-气相色谱-质谱法测定鸡肉中四种有机氯农药的残留量[J].理化检验(化学分册),2010(7):748-750;753.
MI J B,WANG Y F,CHEN Q Y,et al.GC-MS Determination of four residual organochlorine pesticides in chicken after purification by ultrafiltration[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2010(7):748-750.
[20] 鞠玲燕,宋晓华,谷婕,等.超滤管净化/高效液相色谱-串联质谱法测定动物源食品中喹诺酮类药物残留[J].分析测试学报,2016,35(1):42-47.
JU L Y,SONG X H,GU J,et al.Determination of quinolones residues in animal-originated foodstuffs by ultrafiltration tube cleaning and high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis,2016,35(1):42-47.
[21] 中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 23200.113—2018 食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法[S].北京:中国标准出版社,2018.
National Health Commission of the People’s Republic of China,Ministry of Agriculture and Rural Affairs of the People’s Republic of China,State Administration for Market Regulation.GB 23200.113—2018 National food safety standard-determination of 208 pesticides and metabolites residues in foods of plant origin Gas chromatography-tandem mass spectrometry method[S].Beijing:China Standards Press,2018.
[22] 王娟,刘兴平,王明,等.糟醅农残多联GC-MS/MS检测方法研究[J].食品与发酵科技,2015,51(4):69-74.
WANG J,LIU X P,WANG M,et al.Optimization of sample preparation of pesticides in fermented grains by GC-MS/MS[J].Food and Fermentation Sciences & Technology,2015,51(4):69-74.
[23] 中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范 食品理化检测[S].北京:中国标准出版社,2008.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 27404—2008 Criterion on quality control of laboratories[S].Beijing:China Standards Press,2009.
[24] 中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2019 食品安全国家标准 食品中农药最大残留限量[S].北京:中国标准出版社,2019.
National Health Commission of the People’s Republic of China,Ministry of Agriculture and Rural Affairs of the People’s Republic of China,State Administration for Market Regulation.GB 2763—2019 National food safety standard-Maximum residue limits for pesticides in food[S].Beijing:China Standards Press,2019.