培氟沙星(pefloxacin,PEF)是一类人工合成的氟喹诺酮类抗生素,对阴性菌和阳性菌表现出抗菌活性[1],常应用于渔业、畜牧业等[2],当其含量超过阈值时,会对人体健康造成危害[1-3]。2015年9月,我国农业农村部发布公告停止食品动物中使用PEF、洛美沙星、氧氟沙星、诺氟沙星4种兽药[4]。目前,针对PEF等氟喹诺酮类兽药残留的检测方法主要有微生物法[5]、免疫分析法[6-8]、色谱法[9-10]、色谱-质谱联用法[11-13]以及其他新型检测方法等[14-17]。但这些方法存在灵敏度低、特异性差、设备昂贵、样品预处理复杂且检测费时、成本高等缺陷,不能较好地满足现场快速检测样品的要求[18-19]。因此,建立高效、快速及可靠的检测方法,不仅有利于减少检测成本,也可满足动物食品现场快速检测的需求。
核酸适配体(aptamer,Apt)是通过指数富集筛选配体系统进化技术从人工构建的寡核苷酸文库中筛选出来的一段对靶标物质有高亲和力并能够特异性识别的单链寡核苷酸序列[20-22],因其与抗体有相似之处,又称“化学抗体”[23]。适配体可以特定的三维构象结合靶标而检测目标物质[24],具有亲和力高、特异性强、靶分子范围广、易于制备和修饰、稳定性好等显著优点[25]。近年来,基于抗体抗原的酶联免疫法检测氟喹诺酮类兽药残留的方法多有报道,樊晓博等[26]制备了恩诺沙星抗体,建立了检测多种畜禽产品中12种氟喹诺酮药物的方法。CHEN等[27]建立了间接竞争性酶联免疫分析法,可同时检测动物可食组织中的24种喹诺酮类药物。虽然,基于抗体的检测具有特异性高、操作简单、可同时处理多批样品及实现快速检测等多项优势,但依然存在靶标的抗体难以制备、无法多次重复测定、对检测操作环境要求高等问题[18]。Apt具有可体外合成、特异性高、专一性强等良好特性,可弥补基于抗原抗体的酶联免疫法检测靶标的缺陷。目前基于Apt检测恩诺沙星[28-29]、氧氟沙星[30]报道较多,其他氟喹诺酮类兽药的检测报道较少[31]。此外,核酸适配体技术结合时间分辨荧光(time-resolved fluorescence,TRF)分析技术构建检测体系,有利于消除样品及环境中荧光物质对检测的影响,进一步提高检测的灵敏性[9,24]。
因此,基于Apt和TRF的优势,即核酸适配体可特异性识别靶标PEF以及可体外合成、长期保存,TRF材料可消除样品及环境中荧光物质对检测结果影响。本文拟利用适配体生物识别PEF的特性,合成TRF纳米材料NaYF4:Ce/Tb并构建时间分辨荧光共振能量转移(time-resolved fluorescence resonance energy transfer,TR-FRET)模式,建立一种可应用于牛奶样品中准确、高效并可完成1~2 h的PEF兽药残留检测的新型荧光分析方法。
1 材料与方法
1.1 材料与试剂
Y(NO3)3·6H2O、Ce(NO3)3·6H2O、Tb(NO3)3·5H2O、环丙沙星、达氟沙星、亲和素、氨苄青霉素钠盐,西格玛奥德里奇(上海)贸易有限公司;O-磷酸乙醇胺(O-phosphorylethanolamine,AEP),梯希爱(上海)化成工业发展有限公司;氯金酸、PEF、恩诺沙星,上海市阿拉丁生化科技股份有限公司;乙二醇、戊二醛水溶液(体积分数25%)、NaCl等,国药集团化学试剂有限公司(中国上海);磺胺甲恶唑,华夏化学试剂有限公司;农业硫酸链霉素,石家庄通泰生化总厂;纯牛奶,本地超市。
PEF适配体序列参考REINEMANN等[31]的报道,为5′-biotin-ATACCAGCTTATTCAATTAGTTGTGTATTGAGGTTTGATCTAGGCATAGTCAACAGAGCAC-GATCGATCTGGCTTGTTCTACAATCGTAATCAGTTAG-3′;PEF适配体及互补链(complementary deoxyribonucleic acid,cDNA)序列均由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
激光粒度仪(ZSN3600),英国马尔文仪器有限公司;荧光光谱仪(FLUOROMAX-4CP),美国HORIBA公司;双束紫外分光光度计(SDPTOP UV2800PC),上海舜宇恒平科学仪器有限公司;小型高速离心机(5424),德国Eppendorf股份公司;真空干燥箱(BZF-50),上海博讯实业有限公司;纯水/超纯水一体机(Direct-Q),美国Millipore公司;水热合成反应釜(YH-50),上海越众仪器设备有限公司。
1.3 实验方法
1.3.1 适配体与靶标PEF分子对接分析
根据ZYKER[32]的方法,使用基于web服务器Mfold工具、3 dRNA工具、AutoDock软件和Discovery Studio软件进行分子对接分析,从而确定适配体互补链cDNA的序列。
1.3.2 制备NaYF4:Ce/Tb纳米颗粒
参考TU等[33]方法合成NaYF4:Ce/Tb的纳米材料。在圆底烧瓶中加入1.0 mmol AEP及一定化学计量比的NaCl、Y(NO3)3·6H2O、Ce(NO3)3·6H2O和Tb(NO3)3·5H2O,并与含有适量NH4F的乙二醇溶液溶解后老化30 min,转移至高压反应釜于180 ℃反应4 h,取出自然冷却至室温。洗涤后于60 ℃真空干燥箱干燥10 h,固体颗粒室温避光封闭保存。
1.3.3 亲和素修饰NaYF4:Ce/Tb纳米颗粒的制备
利用经典戊二醛法偶联亲和素与NaYF4:Ce/Tb表面的氨基[34]。称取一定量纳米颗粒分散于磷酸缓冲液(phosphate buffered saline,PBS)中与适量戊二醛水溶液反应,洗涤后加入一定量亲和素于37 ℃连续过夜,反应后用PBS洗涤3次。最后重悬于PBS中,4 ℃保存备用。
1.3.4 组装Apt-NaYF4:Ce/Tb纳米颗粒
将定量的适配体加入亲和素化纳米颗粒悬浮液中,于37 ℃缓慢振荡孵育3 h,反应结束后用PBS离心洗涤3次,重悬于PBS中,4 ℃保存备用。
1.3.5 制备纳米金
将氯金酸溶液和超纯水加入圆底烧瓶进行磁力搅拌煮沸,加入4 mL柠檬酸钠。反应保持沸腾持续搅拌20 min,得到酒红色溶液,冷却后待用。
1.3.6 构建基于TR-FRET检测PEF的方法
在检测体系中,以一定浓度荧光探针检测不同浓度的PEF溶液。在1 mL结合缓冲液(100 mmol/L NaCl,20 mmol/L Tris-HCl,2 mmol/L MgCl2,1 mmol/L CaCl2,pH 7.6)中加入靶标PEF并与荧光检测探针于21 ℃ 振摇孵育1 h,反应后测定溶液的TRF强度。设定测定条件为:激发波长252 nm,延迟时间0.1 ms,检测时间1 ms。
1.3.7 基于TR-FRET检测PEF测定牛奶样品中PEF
将此检测方法应用于实际食品样品中PEF的定量检测,并对此方法的分析性能进行探索。牛奶样品处理具体步骤如下:将PEF标准品用纯牛奶进行溶解,在室温4 000× g离心20 min,去除牛奶样品的上层脂肪层,将加标的牛奶样品用结合缓冲液进行10倍稀释,加以空白对照。
2 结果与分析
2.1 检测原理
检测PEF的原理如图1所示。首先分别将能特异性识别PEF的适配体与NaYF4∶Ce/Tb连接、将cDNA与纳米金连接获取2种材料,后将这2种材料通过核酸序列互补杂交获得检测探针。检测探针中的纳米金与NaYF4∶Ce/Tb距离靠近时引起荧光共振能量转移现象,导致检测体系中荧光信号淬灭;加入靶标PEF时,靶标PEF会与cDNA竞争结合适配体,但适配体会优先与靶标PEF特异性结合,使得纳米金与荧光材料脱离,引起检测体系中荧光信号恢复,最终通过检测时间分辨荧光强度与PEF浓度进行线性分析,测定靶标PEF的浓度。
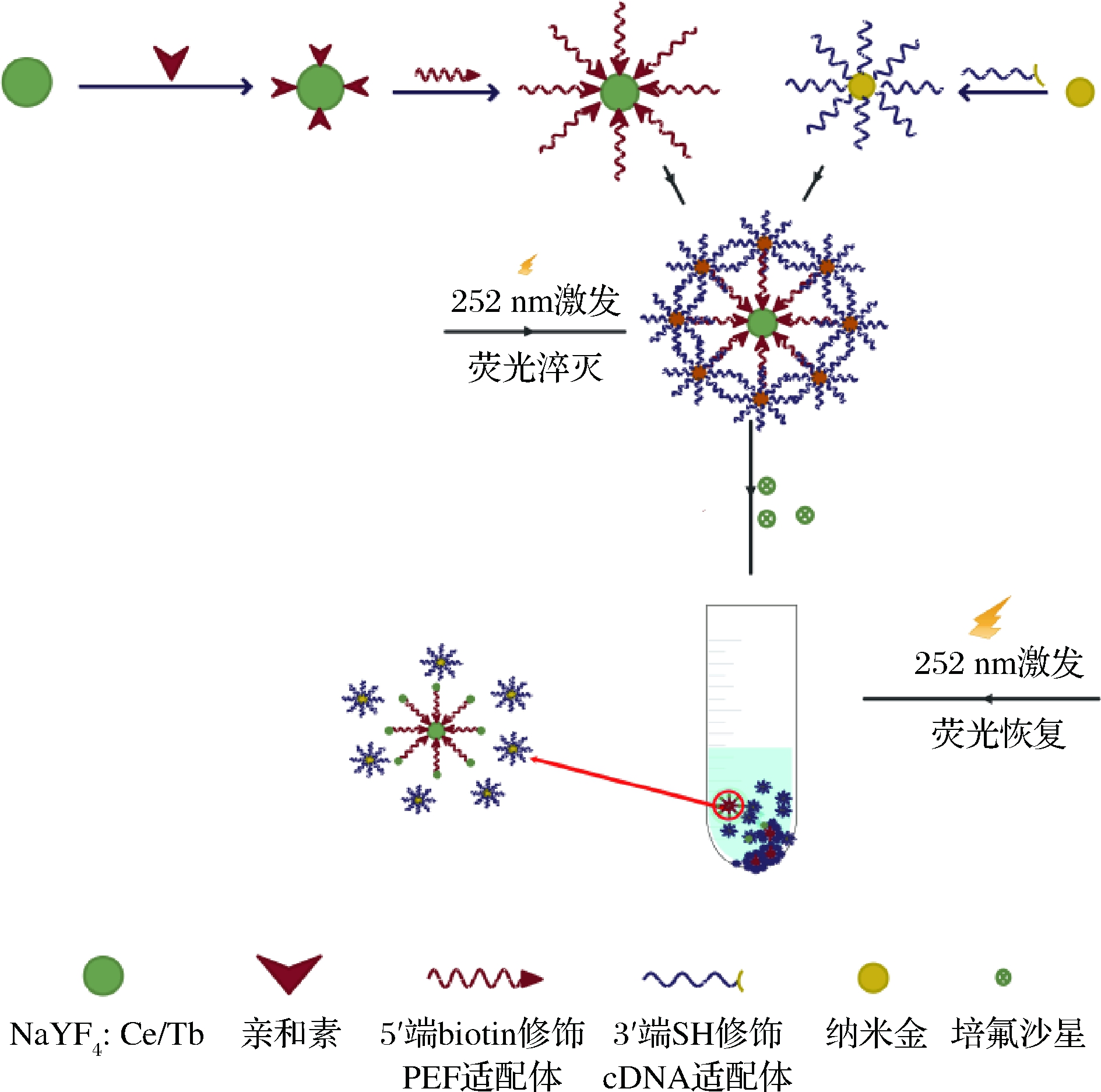
图1 基于核酸适配体识别-时间分辨荧光检测PEF原理图
Fig.1 Schematic diagram of PEF based on aptamer recognition-TRPL detection
2.2 适配体与PEF分子对接分析
根据步骤1.3.1描述的工具模拟获得PEF适配体的二级预测结构(图2-a)。利用AutoDock、Discovery Studio软件对适配体和PEF进行分子对接,其关键结合位点如图2-b所示,主要集中在适配体的茎环及长茎区域(图2-a红框示意)。因此根据碱基互补配对原理,设计得到适配体互补链cDNA序列为5′-TTA CGA TTG TAG A-3′。
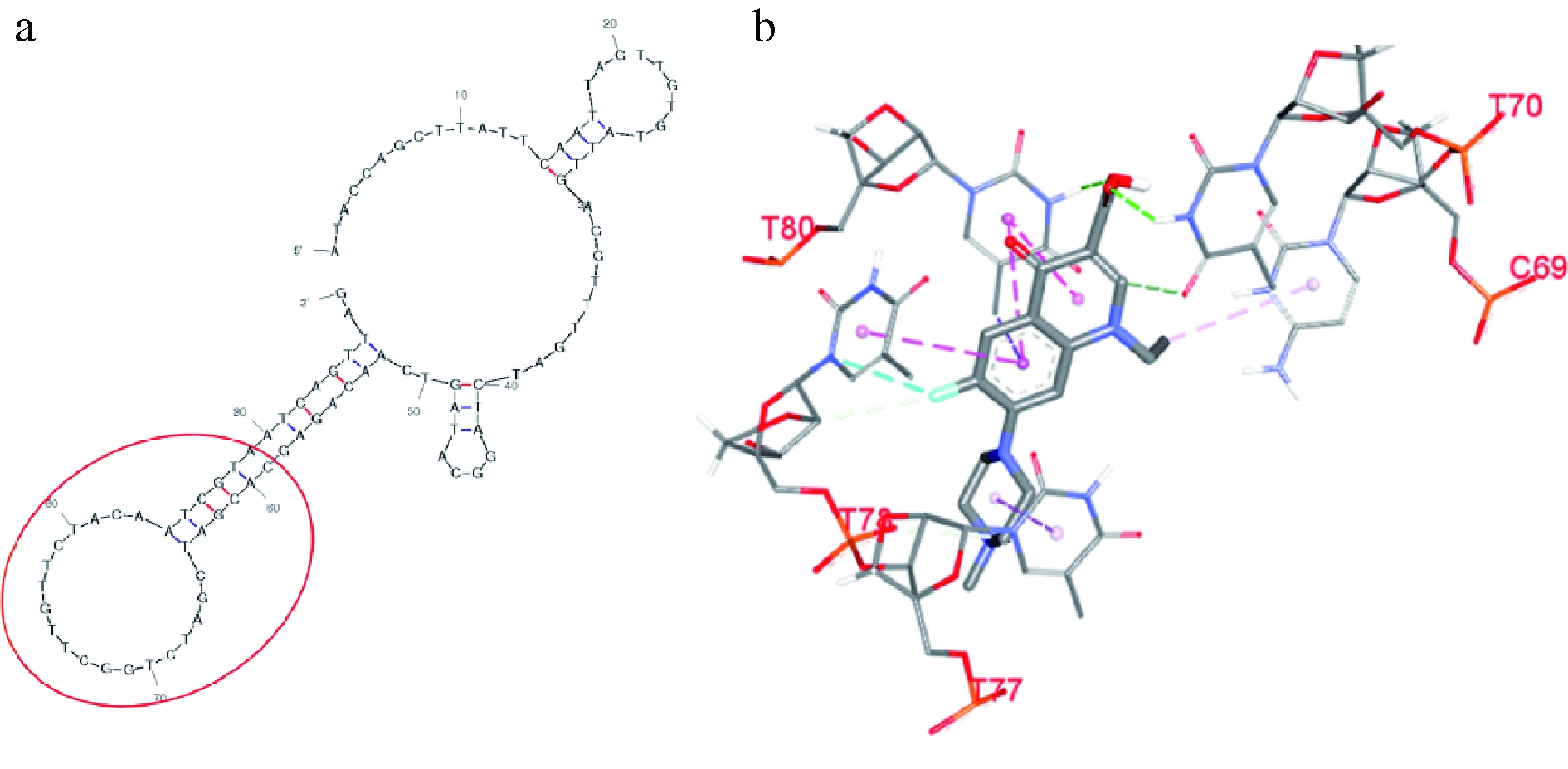
图2 适配体二级结构预测图(a)与适配体与PEF分子对接示意图(b)
Fig.2 Secondary structure prediction diagram of aptamer(a) and docking diagram of aptamer with PEF molecular(b)
2.3 纳米材料及其表面功能化的表征
本实验采用溶剂热法,以AEP为表面活性剂和封端剂,在控制纳米颗粒材料生长的同时,使纳米颗粒材料表面氨基功能化,得到TRF纳米颗粒材料NaYF4∶Ce/Tb。如图3-a所示,该荧光材料的衰减时间为(8.96±0.09) ms。在252 nm波长紫外激发下,纳米材料NaYF4∶Ce/Tb的荧光为绿色,NaYF4∶Ce/Tb的荧光光谱如图3-b所示,在543、583和620 nm处有较强发射谱峰,最大发射波长为543 nm,因此本实验选取发射波长543 nm处荧光作为检测信号。本实验采用透射电子显微镜、X射线衍射仪以及紫外分光光谱仪(UV-visible spectrophotometer,UV-vis)对荧光纳米颗粒的形貌、晶型结构以及亲和素修饰的完成度进行表征。由图3-e可知,透射电镜图表明合成的荧光纳米颗粒形貌基本呈球状,分散均匀。利用X射线衍射技术对荧光纳米颗粒结构进行分析,图3-c得出采用溶剂热法制备的荧光纳米材料具有纯立方相结构。由图3-d可看出,NaYF4∶Ce/Tb在亲和素修饰后280 nm处的吸收度较修饰前减弱,表明亲和素修饰NaYF4∶Ce/Tb完成。
2.4 实验条件优化
TRF纳米材料与纳米金因适配体与cDNA的互补配对而拉近,发生荧光共振能量转移,导致荧光淬灭,加入靶标PEF后荧光恢复,从而完成PEF目标物质的检测,因此,本实验条件优化主要针对纳米金与互补链比例以及适配体与互补链比例,结果如图4-a所示。当cDNA∶纳米金为150∶1时,NaYF4∶Ce/Tb的荧光强度在543 nm处的荧光减弱,淬灭效果最优且趋于稳定,因此选择cDNA∶纳米金最佳比例为150∶1。图4-b表明,当cDNA加入量为140 pmol时荧光淬灭最强,选择探针组装最佳用量为140 pmol。但随着cDNA浓度逐渐增大,荧光强度呈现先上升后又下降的趋势,原因可能是反应体系后期受到纳米金表面空间条件的限制,过量的cDNA会直接与适配体

a-时间分辨荧光材料寿命图;b-时间分辨荧光光谱;c-X射线衍射图;d-亲和素功能化前后UV-Vis光谱图;e-透射电镜图
图3 NaYF4∶Ce/Tb纳米材料及功能化表征
Fig.3 NaYF4∶Ce/Tb functionalized characterization
碱基互补配对结合而导致荧光强度又降低。
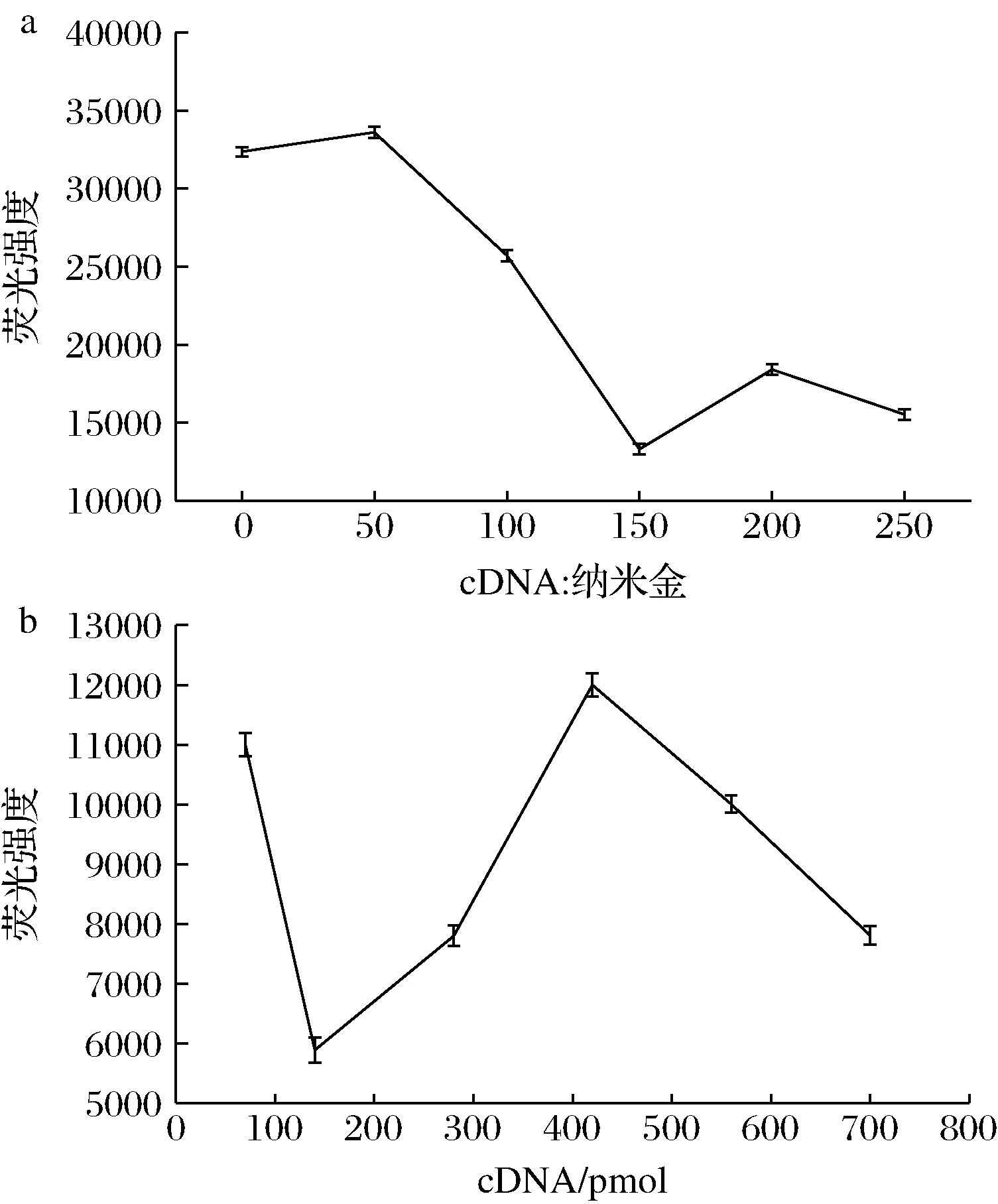
a-cDNA与纳米金比例优化;b-适配体与互补链比例优化
图4 实验条件优化
Fig.4 Optimization of experimental conditions
2.5 特异性分析
基于适配体特异性结合靶标PEF的特点,选取PEF及其他6种抗生素(质量浓度均为1 mg/mL),包括磺胺甲恶唑、农用硫酸链霉素、氨苄青霉素钠、环丙沙星、达氟沙星和恩诺沙星,离心取上清液测定其荧光强度,判断建立的基于TRF结合纳米金法检测PEF的特异性。实验结果如图5所示,在相同浓度下,7种抗生素所引起的荧光强度的变化明显不同,其中PEF的相对荧光强度远高于磺胺甲恶唑、农用硫酸链霉素和氨苄青霉素钠的强度。如果设定PEF响应值为100%,则PEF的同属氟喹诺酮类兽药环丙沙星、达氟沙星、恩诺沙星的相对荧光强度分别为PEF的9.73%、12.57%和12.71%,相较于PEF,环丙沙星、达氟沙星、恩诺沙星引起的荧光信号变化较小,基本可以忽略。实验结果表明本方法选择性良好,可应用于实际检测。

图5 本方法特异性分析
Fig.5 Specificity analysis of the present detection
2.6 建立PEF检测方法的工作曲线
在优化的最佳试验条件下,将不同质量分数的PEF加入反应体系中,如图6-a所示,随着PEF添加量的增加,相对荧光强度逐渐增加。因此可利用PEF添加量与相对荧光强度进行线性回归拟合,3倍信噪比法测得检测限。如图6-b所示,当ω(PEF)在0.2~20 μg/kg时,相对荧光强度与ω(PEF)正相关,其线性回归方程为y=1 567.3x+3 956.3,相关系数为R2=0.974 2,检测限为0.15 μg/kg。

a-PEF不同添加量体系的荧光强度;b-测定PEF的工作曲线
图6 建立检测PEF的标准曲线
Fig.6 Establishment of standard curve for detection of PEF
2.7 在纯牛奶中的PEF检测回收率
为验证本方法在实际样品中应用的准确性,将此法用于检测牛奶样品中的PEF。采用步骤1.3.7进行样品预处理后,向牛奶样品中分别加入1、5、15 μg/kg的PEF标准品液,每个添加量平行样品测定3次。实验结果如表2所示,PEF加标回收率在73.81%~99.86%,表明本法检测牛奶中PEF准确性较好,可应用于实际样品的测定。
表1 牛奶中PEF的加标回收测定结果
Table 2 Recovery of PEF added in milk
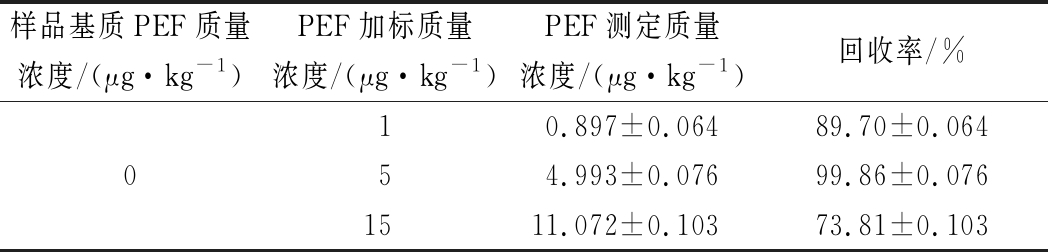
样品基质PEF质量浓度/(μg·kg-1)PEF加标质量浓度/(μg·kg-1)PEF测定质量浓度/(μg·kg-1)回收率/%010.897±0.06489.70±0.06454.993±0.07699.86±0.0761511.072±0.10373.81±0.103
2.8 与其他方法的比较
本方法构建的PEF检测体系得到的PEF检测限为0.15 μg/kg,线性范围为0.2~20 μg/kg,测得牛奶中PEF残留加标回收率为73.81%~99.86%。与表2中其他方法相比,本方法具有线性范围较宽、检测灵敏度较高的特点。同时,基于此研究基础上,可以拓宽至建立多种靶标同时检测的体系,达到现场低成本快速检测的目标,可以更加有效地应用于食品中兽药残留检测。
表2 常见检测PEF的方法
Table 2 Common methods for the detection of PEF
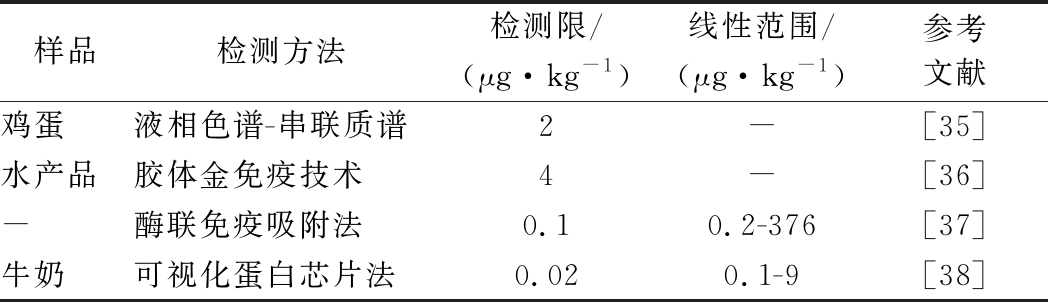
样品检测方法检测限/(μg·kg-1)线性范围/(μg·kg-1)参考文献鸡蛋液相色谱-串联质谱2-[35] 水产品胶体金免疫技术4-[36]-酶联免疫吸附法0.10.2-376[37]牛奶可视化蛋白芯片法0.020.1-9[38]
注:“-”表示引用的论文中未提及相关内容
3 结论
本文采用溶剂热法合成了氨基化的荧光纳米颗粒(NaYF4∶Ce/Tb),利用靶标PEF与cDNA竞争结合适配体的原理,使得淬灭的荧光恢复达到检测PEF的目的。在最优的实验条件下,PEF的检测线性范围为0.2~20 μg/kg,相关系数R2为0.974 2。采用本方法对实际样品牛奶中的PEF进行加标试验,PEF的加标回收率在73.81%~99.86%,结果表明本方法准确度较高。另外,利用本方法检测PEF时,从样品制备至完成检测共需1~2 h,所需检测时间短,可用于实际样品的检测。本研究建立了基于分子亲和识别的新型荧光发光检测方法,该方法的准确度较高且成本低,但本研究还有需完善和发展的空间。由于适配体具有特异性且可体外合成,在检测中可尝试改变适配体来检测多种靶标物质。本方法中利用的适配体与cDNA连接实现荧光淬灭原理可延伸到建立广谱性的适配体探针,以此拓宽本方法检测目标范围,从而达到现场低成本快速检测的目标,更好地应用于兽药残留的检测。
[1] LI S,CHOE W S.Screening of pefloxacin-binding single strand DNA aptamer[J].Journal of Biotechnology,2008,136:S86.
[2] 李宵宁,柴芸,刘明亮.喹诺酮类抗菌药的作用机制及耐药机制研究进展[J].国外医药(抗生素分册),2015,36(3):97-102.
LI X N,CHAI Y,LIU M L.Research progress on action mechanism and resistance mechanism of quinolone antimicrobials[J].World Notes on Antibiotics,2015,36(3):97-102.
[3] ZHU M F,LI R,LAI M S,et al.Copper nanoparticles incorporating a cationic surfactant-graphene modified carbon paste electrode for the simultaneous determination of gatifloxacin and pefloxacin[J].Journal of Electroanalytical Chemistry,2020,857:113 730.
[4] 中华人民共和国农业部.中华人民共和国农业部公告 第2292号[EB/OL].[2015-09-07] http://www.moa.gov.cn/gk/tzgg_1/gg/201509/t20150907_4819267.htm
Ministry of Agriculture of the People’s Republic of China.Notice No.2292 of the Ministry of Agriculture of the People’s Republic of China[EB/OL].[2015-09-07] http://www.moa.gov.cn/gk/tzgg_1/gg/201509/t20150907_4819267.htm
[5] 王远丽.对畜产品质量安全检测需求的思考[J].中国畜牧业,2019(12):68.
WANG Y L.Thoughts on the demand of quality and safety inspection of animal products[J].China Animal Husbandry,2019 (12):68.
[6] DANG P K,DEGAND G,DOUNY C,et al.Optimisation of a new two-plate screening method for the detection of antibiotic residues in meat[J].International Journal of Food Science and Technology,2011,46(10):2 070-2 076.
[7] 曹敬政,安静,蒋蔚,等.直接竞争化学发光酶免疫法检测十种氟喹诺酮类药物方法的建立[J/OL].中国动物传染病学报:1-16.http://kns.cnki.net/kcms/detail/31.2031.S.20200310.1050.004.html.
CAO J Z,AN Jing,Jiang W,et al.Establishment of a direct competitive chemiluminescence enzyme immunoassay for the detection of ten fluoroquinolones [J/OL].Chinese Journal of Animal Infectious Diseases: 1-16.http://kns.cnki.net/kcms/detail/31.2031.S.20200310.1050.004.html.
[8] YUAN M F,XIONG Q R,ZHANG G G,et al.Silver nanoprism-based plasmonic ELISA for sensitive detection of fluoroquinolones[J].Journal of Materials Chemistry.B,2020,8(16):3 667-3 675.
[9] WU Y C,GUO S,DONG Q,et al.Development of an immunochromatographic test strip for rapid simultaneous detection of enrofloxacin and ofloxacin in tissue of chicken muscle and pork[J].Food Analytical Methods,2016,9(10):2 807-2 813.
[10] 王婷,陈明涛.基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性食品中19种氟喹诺酮类抗生素残留[J].食品安全导刊,2020(7):66-70.
WANG T,CHEN M T.Detection of 19 fluoroquinolones in animal food by ultra high performance liquid chromatography-tandem mass spectrometry based on multi-reaction monitoring mode[J].China Food Safety Magazine,2020(7):66-70.
[11] TIAN Y P,JIA J H,HE J J,et al.Simultaneous detection of 46 veterinary drug residues in animal meat by UHPLC[J].Chromatographia,2016,79(7-8):457-471.
[12] 才凤,赵飞,贾宏新.超高效液相-串联质谱法测定速冻调理肉制品中18种喹诺酮类药物残留量[J].食品安全质量检测学报,2019,10(24):8 456-8 461.
CAI F,ZHAO F,JIA H X.Determination of 18 quinolones residues in quick-frozen meat products by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality,2019,10(24):8 456-8 461.
[13] 张今君,夏慧丽,高海波.分散固相萃取-超高效液相色谱-串联质谱法测定豆芽中6种喹诺酮类药物[J].食品工业科技,2020,41(23):260-265;271.
ZHANG J J,XIA H L,GAO H B.Determination of 6 kinds of fluoroquinolones in bean sprouts based on dispersed solid phase extraction UPLC-MS/MS method[J].Science and Technology of Food Industry,2020,41(23):260-265,271.
[14] HU X B,GOUD K Y,KUMAR V S,et al.Disposable electrochemical aptasensor based on carbon nanotubes-V2O5-chitosan nanocomposite for detection of ciprofloxacin[J].Sensors and Actuators B-Chemical,2018,268:278-286.
[15] PAGANI A P,IBANEZ G A.Analytical approach for the simultaneous determination of quinolones in edible animal products.Modeling pH-modulated fluorescence excitation-emission matrices four-way arrays[J].Talanta,2019,192:52-60.
[16] LU W J,JIAOY,CAO Y F,et al.Bright yellow fluorescent carbon dots as a multifunctional sensing platform for the label-free detection of fluoroquinolones and histidine[J].Acs Applied Materials & Interfaces,2018,10(49):42 915-42 924.
[17] 朱俊,李叶平,邹金汕,等.碳点与曙红B间的荧光共振能量转移效应测定培氟沙星[J].光谱学与光谱分析,2019,39(8):2 554-2 560.
ZHU J,LI Y P,ZOU J S,et al.Determination of pefloxacin by fluorescence resonance energy transfer effect between carbon point and eosin B[J].Spectroscopy and Spectral Analysis,2019,39(8):2 554-2 560.
[18] 田红静,刘通,王秀娟,等.动物源性食品中抗生素残留的快速检测方法[J].食品安全质量检测学报,2020,11(11):3 391-3 397.
TIAN H J,LIU T,WANG X J,et al.Rapid methods for the detecting of antibiotic residues in animal-derived food[J].Journal of Food Safety & Quality,2020,11(11):3 391-3 397.
[19] 李嘉慧,刘凤银,王宇,等.食品中喹诺酮类抗生素多残留同时检测研究[J].生物化工,2019,5(4):149-151.
LI J H,LIU F Y,WANG Y,et al.Progress in simultaneous detection of quinolone antibiotic residues in food[J].Biological Chemical Engineering,2019,5(4):149-151.
[20] 白文荟,陈爱亮.适配体传感器在农药残留检测中的应用[J].分析测试学报,2016,35(10):1 360-1 368.
BAI W H,CHEN A L.Applications of aptasensor in determination for pesticide residues[J].Journal of Instrumental Analysis,2016,35(10):1 360-1 368.
[21] YIN Z Q,CHAI T T,MU P Q,et al.Multi-residue determination of 210 drugs in pork by ultra-high-performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2016,1 463:49-59.
[22] XU G H,ZHAO J J,LIU N,et al.Structure-guided post-SELEX optimization of an ochratoxin A aptamer[J].Nucleic Acids Research,2019,47(11):5 963-5 972.
[23] 张敏,张先舟,李聪,等.黄曲霉毒素B1核酸适配体筛选和检测方法的建立[J].食品科学,2020,41(24):295-303.
ZHANG M,ZHANG X Z,LI C,et al.Screening of aptamers for aflatoxin B1 and establishment of a method for aflatoxin B1 detection[J].Food Science,2020,41(24):295-303.
[24] 卢军利, 葛玮东,孙建霞,等.核酸适配体技术在食品有害物检测中的研究进展[J].中国农业科技导报,2015,17(2):151-158.
LU J L,GE W D,SUN J X,et al.Research progress of aptamer in detecting harmful substances in food[J].Journal of Agricultural Science and Technology,2015,17(2):151-158.
[25] 王巍,贾凌云.适配体筛选方法研究进展[J].分析化学,2009,37(3):454-460.
WANG W,JIA L Y.Progress in aptamer screening methods[J].Chinese Journal of Analytical Chemistry,2009,37(3):454-460.
[26] 樊晓博,谢兰心.酶标抗原直接竞争ELISA检测食品中氟喹诺酮类药物多残留[J].食品科学,2015,36(24):265-269.
Fan X B,XIE L X.Detection of fluoroquinolones residues in food by enzyme-labeled antigen direct competitive ELISA [J].Food science,2015,36(24):265-269.
[27] CHEN J H,LU N,SHEN X,et al.Investigation of an immunoassay with broad specificity to quinolone drugs by genetic algorithm with linear assignment of hypermolecular alignment of data sets and advanced quantitative structure-Activity relationship analysis[J].Journal of Agricultural and Food Chemistry,2016,64(13):2 772-2 779.
[28] 赵秋伶, 张振宇,周广原,等.恩诺沙星酶联适配体分析检测试剂盒的研制[J].分析科学学报,2018,34(5):644-648.
ZHAO Q L,ZHANG Z Y,ZHOU G Y,et al.Preparation of enzyme-linked aptamer assay kit for determining enrofloxacin residues[J].Journal of Analytical Science,2018,34(5):644-648.
[29] YU W L,LIU M X,LIU R B,et al.Development of biomimetic enzyme-linked immunosorbent assay based on molecular imprinting technique for semicarbazide detection[J].Food and Agricultural Immunology,2020,31(1):17-32.
[30] 周晓彤. 基于核酸适配体的氧氟沙星检测方法研究[D].上海:上海交通大学,2019.
ZHOU X T.The detetion methods for ofloxacin based on aptamer [D].Shanghai:Shanghai Jiaotong University,2019.
[31] REINEMANN C,FREIION V F U,RUDOLPH S,et al.Generation and characterization of quinolone-specific DNA aptamers suitable for water monitoring[J].Biosensors & Bioelectronics,2016,77:1 039-1 047.
[32] ZUKER M.Mfold web server for nucleic acid folding and hybridization prediction[J]Nucleic Acids Research,2003,31(13):3 406-3 415.
[33] TU D T,LIU L Q,JU Q,et al.Time-resolved fret biosensor based on amine-functionalized lanthanide-doped NaYF4 nanocrystals[J].Angewandte Chemie-International Edition,2011,50(28):6 306-6 310.
[34] HUANG Y K,WANG C,HUO Q Y,et al.A time-resolved luminescence aptasensor of ofloxacin based on rolling circle amplification and magnetic separation[J].Analytical and Bioanalytical Chemistry,2020,412(19):4 555-4 563.
[35] 史艳艳,高琳,李俊,等.液相色谱-串联质谱法检测饲料中洛美沙星、培氟沙星、氧氟沙星、诺氟沙星残留[J].食品安全质量检测学报,2019,10(11):3 367-3 375.
SHI Y Y,GAO L,LI J,et al.Determination of lomefloxacin,pefloxacin,ofloxacin and norfloxacin residues in feed by liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality,2019,10(11):3 367-3 375.
[36] 宗婧婧,张小军,严忠雍,等.胶体金免疫层析法检测水产品中15种喹诺酮类药物[J].理化检验-化学分册,2018,54(5):591-595.
ZONG J J,ZHANG X J,YAN Z Y,et al.Detection of 15 quinolones in aquatic products by colloidal gold immunochromatography assay[J].Physical Testing and Chemical Analysis (Part B: Chemical Analysis),2018,54(5):591-595.
[37] 姜金庆,杨雪峰,王自良,等.氟喹诺酮类药物多残留间接竞争ELISA检测方法的建立[J].中国预防兽医学报,2011,33(11):887-892.
JIANG J Q,YANG X F,WANG Z L,et al.Development of indirect competitive ELISA for detection of fluoroquinolone residues[J].Chinese Journal of Preventive Veterinary Medicine,2011,33(11):887-892.
[38] 李周敏,李心爱,姚开安,等.可视化蛋白芯片法同时检测牛奶中喹诺酮类抗生素残留的含量[J].药物分析杂志,2019,39(6):1 139-1 147.
LI Z M,LI X A,YAO K A,et al.Visual protein chip method for simultaneous determination of quinolone antibiotic residues in milk[J].Chinese Journal of Pharmaceutical Analysis,2019,39(6):1 139-1 147.