糖脂代谢性疾病是一类与糖脂代谢紊乱密切相关的复杂疾病,包含Ⅱ型糖尿病、高脂血症、肥胖、高血压、动脉粥样硬化和非酒精性脂肪肝[1]。随着社会经济的发展,人们逐渐形成了过多摄入高热量食物和久坐不动的生活方式。糖脂代谢性疾病已经成为我国主要的慢性疾病。2019年数据显示,我国糖尿病患者人数高达1.164亿[2],超重和肥胖的患病率分别为28.1%和5.2%[3]。2018年数据显示,我国心血管患病人数高达2.9亿,其中高血压患者人数达2.45亿[4]。糖脂代谢性疾病的核心特征为糖和脂代谢的损伤,病理机制与神经内分泌紊乱、胰岛素抵抗、氧化应激、代谢性炎症和肠道菌群失调有关。糖脂代谢性疾病的主要防治方式包括药物、饮食、运动等。
发酵是一种古老的生产技术,在人类文明的发展过程中一直沿用至今。历史上,运用发酵技术通常是为了延长食品的保存时间。发酵导致微生物的产物(有机酸、乙醇等)增加,这些产物具有一定的抑菌作用。同时发酵过程也会改变食品的某些特性,包括外观、质地、风味等。发酵还应用于生产和炮制中药,可以达到增强药效、降低毒性和产生新功效的目的。面食、肉类、水果、牛奶、蔬菜和中药的发酵制品已有上千年的历史[5],随着现代生物技术的进步,人们开始关注发酵制品的潜在健康价值。现代发酵工业可以精准控制发酵过程,提高发酵产物中活性成分的含量和生物利用度,产生有益于人体的新化学成分和微生物的次生代谢产物。其中活性成分通常包括多酚、黄酮、生物活性肽、短链脂肪酸(short-chain fatty acids,SCFAs)等,这些活性成分有抗衰老、抗肿瘤、抗氧化、抗炎等药理作用。因此,发酵制品的应用范围也越来越广泛。
近年来,不乏有研究证实发酵制品具有改善糖脂代谢性疾病的作用[6],但是并未见到有相关系统的报道。本文对具有改善糖脂代谢性疾病作用的发酵制品进行综述,旨在分析发酵制品发挥有益作用的可能机制,评估其作为保健品或潜在药剂的潜力,期望为今后糖脂代谢性疾病的理论及临床研究提供参考。
1 糖脂代谢性疾病的病理机制
糖脂代谢性疾病的发生与神经内分泌紊乱、胰岛素抵抗、氧化应激、代谢性炎症和肠道菌群失调密切相关。中枢神经系统有特异的神经元可以感知代谢底物的变化,这些神经元能通过血脑屏障与瘦素、胰岛素等细胞因子相互作用,调节体内糖脂代谢[7]。胰岛素作用于肝脏、脂肪、肌肉、大脑等效应器官,其对糖和脂代谢均有调节作用,如果胰岛素信号通路受损或受阻,就会导致全身糖脂代谢紊乱[8]。葡萄糖和脂质毒性都可以通过氧化应激损害血管内皮细胞、胰岛细胞、肌肉和脂肪细胞的胰岛素受体,从而引起广泛的心脑血管疾病和胰岛素抵抗[9]。炎症信号分子通过广泛交织的免疫网络参与调节代谢器官,如肝脏、脂肪、肌肉等[10]。肠道菌群是一个复杂的生态系统,生理功能都与肠道菌群相关联。已有研究证实通过调整菌群结构和其产生的代谢物(如SCFAs)能综合调节肥胖、糖尿病、动脉粥样硬化等糖脂代谢性疾病[11]。糖脂代谢性疾病是全身性的慢性疾病,故其发生和发展不是单一器官或组织异常造成,而是多方面失调导致的。氧化应激会导致器官组织脂质过氧化(lipid peroxidation,LPO),从而影响胰岛素与受体结合,加重胰岛素抵抗;代谢性炎症也能通过产生的细胞因子和炎症介质加重胰岛素抵抗的程度[12];另外代谢性炎症还能通过激活巨噬细胞间接激发氧化应激[13];相对而言,氧化应激可通过增高活性氧(reactive oxygen species,ROS)水平抑制NO的生物活性,间接加重代谢性炎症反应[14];神经内分泌紊乱表现为下丘脑等调控代谢的神经系统失调,从而错误的调节外周器官受体对胰岛素的敏感程度,加重全身的胰岛素抵抗,相反胰岛素抵抗会导致胰岛素通过血脑屏障对中枢神经系统形成负反馈,造成神经内分泌系统的紊乱[15];糖脂代谢性疾病中,肠道菌群结构的改变和SCFAs的含量变化均会造成代谢性炎症、胰岛素抵抗和神经内分泌紊乱的加重[16]。由此可见,糖脂代谢性疾病的发生是上述5种机制相互作用,共同影响造成的结果,如图1所示。
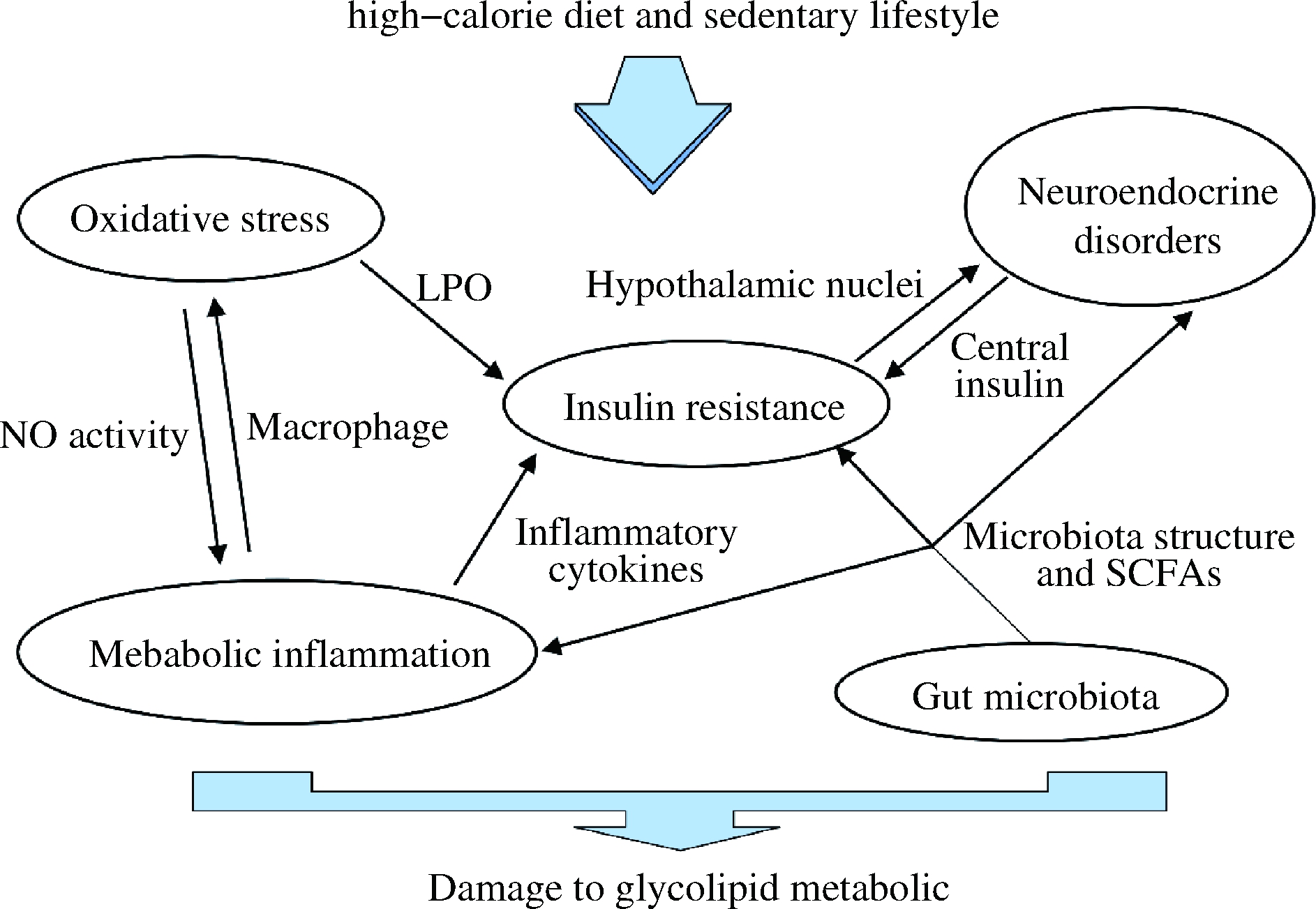
图1 糖脂代谢性疾病发病机制示意图
Fig.1 Schematic diagram of the pathogenesis of glycolipid metabolic diseases
2 发酵制品对糖脂代谢性疾病的作用机制
2.1 调节神经内分泌紊乱
中枢神经系统中存在着一种特殊的代谢感应神经元,最初被称为葡萄糖敏感神经元。大脑中的代谢感应神经元能感应微环境中葡萄糖和脂肪酸水平的变化而对机体产生相应的改变。随后的研究发现,这些神经元能对循环营养物质(葡萄糖、脂肪酸等)、激素(胰岛素、瘦素等)和外周器官(脂肪组织、胰腺、肠道等)的其他信号作出反应,通过下丘脑释放信号分子作用于各级靶器官、组织和细胞从而调节全身的糖脂代谢。糖脂代谢性疾病患者的代谢感应神经元受到破坏,大脑将无法正确感应外周与代谢有关的信号,身体的能量平衡和葡萄糖稳态也随之失衡[17]。
在宏观层面上,调节代谢感应神经元下游的相关内分泌激素、营养物质和信号靶点对调节改善糖脂代谢性疾病至关重要。如果发酵制品可以调节这些指标,则能对糖脂代谢产生积极影响。一项用食用乳酸菌饮料干预肥胖儿童的研究正好验证了这一观点,其研究发现食用乳酸菌饮料能通过的降低食欲和进食量,升高酪酪肽(peptide YY,PYY)和胰高血糖素样肽(glucagon-like peptide,GLP-1)的水平能改善肥胖儿童的肥胖程度[18]。另外,ALFEREZ等[19]研究发现发酵羊奶可以通过提高瘦素水平和降低胃饥饿素水平进而降低食欲和增加饱腹感,从而改善贫血恢复期肥胖。在微观层面上,激活中枢神经系统内与糖脂代谢相关的基因表达是改善糖脂代谢的有效途径。近期也有研究证实,发酵食品可以调节这些基因的表达改善糖脂代谢。发酵麦芽补充剂被证实可以通过上调下丘脑厌食基因原皮质醇(anorexigenic gene proopiomelanocortin,POMC)/可卡因和苯丙胺调节的转录本(cocaine and amphetamine-regulated transcript,CART)的表达,从而减少能量摄入,降低的肥胖程度[20]。
2.2 调节胰岛素抵抗
胰岛素是血糖和血脂的调节器。胰岛素的受体主要是酪氨酸激酶,信号通路包括激活PI(3)K和下游PTDINS(3,4,5)P3依赖性蛋白激酶,RAS和MAP激酶级联,以及CBL/CAP和TC10的激活。这些途径协同作用于囊泡运输、蛋白质合成、酶激活和失活以及基因表达的调控,从而调节糖、脂和蛋白质代谢,增加肌肉和脂肪中的葡萄糖摄取,并抑制肝脏葡萄糖的产生[21]。以上通路出现缺陷时就会导致机体各器官、组织对胰岛素敏感性降低从而产生胰岛素抵抗。胰岛素抵抗是糖脂代谢性疾病的共同特征之一。因此,改善胰岛素抵抗是防治糖脂代谢性疾病的目标之一。现有治疗胰岛素抵抗的药物主要是二甲双胍和噻唑烷二酮。发酵制品含有类黄酮、小分子肽等具有改善胰岛素抵抗作用的成分。研究发现发酵制品可以通过调节胰岛素抵抗改善糖脂代谢性疾病(表2)。
表1 调节神经内分泌紊乱的发酵制品
Table 1 Fermented products for regulating neuroendocrine disorders

发酵制品发酵菌种拉丁文学名模型发现参考文献酸奶饮料植物乳酸菌Lactobacillus plantarum肥胖儿童↓食欲、进食量↑PYY、GLP-1[18]发酵山羊奶保加利亚乳杆菌、嗜热链球菌Lactobacillus bulgaricus sub.Del-brueckii,Streptococcus thermophiles贫血肥胖Wistar大鼠↓食欲↓脂联素↑瘦素、虹膜素、NEFA[19]发酵大麦酿酒酵母Saccharomyces cerevisiae肥胖SD大鼠↓能量摄入、瘦素↑POMC、CART表达显著[20]
注:↑升高;↓降低(下同)
表2 调节胰岛素抵抗的发酵制品
Table 2 Fermented products for regulating insulin resistance

发酵制品发酵菌种拉丁文学名模型发现参考文献红曲发酵颗粒红曲霉菌Monascus糖尿病SD大鼠↓肝脏LPO显著↓胰岛素、血糖、胰岛素评分↓SOD、CAT、GSH-Px[22]Chungkookjang枯草芽孢杆菌Bacillus subtilis胰腺切除糖尿病SD大鼠↑异黄酮苷元和小肽↑胰岛素分泌、胰腺β细胞↑IRS2表达[23]酸奶嗜热链球菌Streptococcus thermo-philes肥胖非酒精性脂肪肝和代谢综合征女性患者↓胰岛素抵抗、↓血脂、肝内脂质↓炎症生物标志物、氧化应激、LPS[24]发酵大豆酱米曲霉Aspergillus oryzae肥胖小鼠↑制品类黄酮↓胰岛素抵抗↑骨骼肌中AMPK↓MAT通透性[25]
在宏观层面上,改善机体各器官对胰岛素的敏感性可以有效缓解胰岛素抵抗,从而改善糖脂代谢性疾病。如发酵制品可以改善各组织器官对胰岛素的敏感性,进而可以有效缓解糖脂代谢疾病。研究也证实了上述观点,PYO等[22]用富含泛醌的红曲干预高果糖高脂肪饮食诱导的Ⅱ型糖尿病大鼠,结果发现大鼠的胰岛素抵抗指数降低,高血糖的状态也得到缓解。另外该实验还显示了红曲干预还可以降低肝脏LPO,缓解氧化应激,增强了胰岛素与受体的结合,从而改善糖尿病。在微观层面上,增强胰岛素作用的相关信号转导通路可以促进胰岛β细胞增殖,促进胰岛素分泌,从而改善胰岛素分泌受损和胰岛素抵抗,达到缓解糖脂代谢性疾病的作用。实验研究也证实了发酵制品可以产生上述影响。枯草芽孢杆菌(Bacillus subtilis)发酵的Chungkookjang可以通过激活cAMP-CREB通路,提高胰岛素受体底物(insulin receptor substrate,IRS)2的表达,从而促进胰岛β细胞增殖,促进胰岛素分泌,改善胰岛素抵抗进而改善糖脂代谢性紊乱[23]。此外,由于糖脂代谢性疾病本身病理机制的复杂性,如脂质过氧化、炎症、氧化应激等均是导致胰岛素抵抗的原因之一,因此通过改善上述病理因素的指标也可以有效缓解糖脂代谢。研究也证实了发酵制品可以通过缓解炎症、氧化应激等病理因素的指标来改善胰岛素抵抗从而缓解糖脂代谢。如最近研究发现酸奶可以通过降低血脂、炎症、氧化应激和脂多糖(lipopolysaccharide,LPS)来改善胰岛素抵抗,从而改善肥胖非酒精性脂肪肝和代谢综合征[24]。另外还有一项最新研究也证实了这一观点,实验用发酵的大豆酱干预肥胖小鼠。发酵大豆酱可以分别通过改善小鼠的肠系膜脂肪组织(mesenteric adipose tissue,MAT)通透性和增强脂联素介导的AMPK通路,分别降低肝脏和肌肉中的代谢性炎症,从而缓解小鼠的胰岛素抵抗,达到改善糖脂代谢性疾病的目的[25]。
2.3 调节氧化应激
氧化应激作用的产生与高浓度的自由基有关,它可以明显破坏细胞结构,进而影响细胞的正常功能[26]。氧化应激与糖脂代谢性疾病密切相关。在糖脂代谢性疾病中,机体糖化蛋白的氧化降解和促炎脂肪因子分泌增多会诱导自由基过度产生。氧化应激会导致相关细胞器和酶的损伤,增加脂质过氧化和产生胰岛素抵抗[27]。它还会导致脂肪组织变性,产生全身低级别的炎症。研究发现,氧化应激还可以促进血管平滑肌增殖、肥大和胶原沉积导致血管壁增厚、管腔狭窄,还会损伤内皮细胞功能,从而降低血管的收缩活性[28]。REN等[29]研究发现二甲双胍通过AMP依赖的蛋白激酶(adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK)/沉默信息调节因子(silent information regulator 2,SIRT1)-FoxO1途径降低氧化应激作用,改善了糖尿病肾脏疾病,可见调节氧化应激能有效改善糖脂代谢。
补充外源性抗氧化剂可以有效改善氧化应激。常见的抗氧化剂有维生素、植物及其活性成分和具有抗氧化潜力的药物及杂合物[30]。用于生产发酵制品的果蔬、中草药等材料通常含有具有抗氧化性的活性成分,如多酚、黄酮、大豆蛋白等。这些活性成分通常存在于细胞质中,存在着提取困难的问题。研究表明发酵可以增加这些活性成分的释放,从而提高发酵制品的抗氧化活性[31-32]。发酵制品中具有抗氧化活性的成分还存在着相对分子质量较大,口服生物利用度低的问题。研究表明,发酵过程中微生物产生的酶有利于这些大分子的活性物质降解为更容易被人体吸收的小分子物质,提高生物活性[33]。实验研究也证实发酵制品可以通过提高其活性成分的含量和生物利用度增强抗氧化活性,进而增强其调节糖脂代谢的能力[6,34-35]。并且,发酵制品可以通过调节氧化应激改善糖脂代谢性疾病(表3)。
表3 调节氧化应激的发酵制品
Table 3 Fermented products that regulate oxidative stress

发酵制品发酵菌种拉丁文学名模型发现参考文献发酵非洲刺槐豆饲料芽孢杆菌Bacillus糖尿病Wistar大鼠↓AST、ALT、ALP、MDA水平↑GST、CAT、GSH、TP和维生素C含量[36]葛根发酵提取物黑曲霉菌Aspergillus niger高血脂昆明小鼠↑制品总酚酸含量↑抗氧化活性[37]发酵番木瓜制剂酵母菌Saccharomyces cerevi-siae糖尿病前期人群↓人体红细胞溶血敏感性↑糖尿病前期患者TAS↑自由基清除活性[38]泡菜植物乳酸菌L.plantarum动脉粥样硬化小鼠↑主动脉NO、BH4↓ROS、ADMA↑eNOS表达[39-40]发酵大豆提取物枯草芽孢杆菌Bacillus subtilis肥胖C57BL/6小鼠↓PEPCK、G6 Pase↓FAS、HMG-CoA和ACAT↑SOD、GSH-Px和CAT[41]
注:总蛋白(total protein,TP);血管内皮细胞一氧化氮合酶(endothelial nitric oxide synthase,eNOS);活性氧(reactive oxygen species,ROS);四氢生物蝶呤(tetrahydrobiopterin,BH4);不对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)
糖脂代谢紊乱状态下葡萄糖自动氧化以及糖基化终产物的产生引发氧化应激。氧化应激造成脂质过氧化肝脏、组织器官损害,从而有助于糖脂代谢性疾病的发生和发展。因此,通过抗氧化剂治疗改善氧化应激是改善糖脂代谢紊乱的有效策略。大量研究证实了发酵制品可以通过改善氧化应激,降低器官组织损害,从而调节糖脂代谢。其中,发酵大豆被证实可以通过提高谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)、还原型谷胱甘肽(L-glutathione,GSH)和过氧化氢酶(catalase,CAT)的活性改善大鼠的氧化应激,降低碱性磷酸酶(alkaline phosphatase,ALP)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)和丙二醛(malondialdehyde,MDA)的活性,从而改善肝损伤[36]。另外一项用发酵葛根干预高血脂小鼠的实验也得到了类似的结果,表明发酵葛根可以通过改善氧化应激,调节高脂血症引起的器官组织脂质过氧化,从而改善糖脂代谢[37]。临床研究也有得到相似的结果。一项用发酵木瓜制剂干预糖尿病前期患者的临床中,发现发酵木瓜制剂通过改善氧化应激,可显著降低人红细胞对自由基诱导溶血的敏感性,进而降低血红蛋白氧化速率,从而更好地改善糖尿病前期患者的各项生理指标[38]。还有实验研究发现发酵制品可以通过改善氧化应激从而间接地调节糖脂代谢性疾病。如从韩国泡菜中分离出3-(4-羟基-3,5-二甲氧基苯基)丙酸(3-(4-hydroxyl-3, 5-dimethoxyphenyl)propionic acid,HDMPPA)可以通过增加eNOS表达和改善氧化应激维持NO的生物利用度,从而抑制血管炎症反应来发挥其血管保护作用,调节心血管疾病[39-40]。另外,氧化应激会增强胰岛素抵抗程度,造成糖脂代谢异常,因此缓解氧化应激可以有效改善胰岛素抵抗,从而改善糖脂代谢性疾病。研究证实发酵制品可以通过改善氧化应激,间接改善胰岛素抵抗从而改善糖脂代谢性疾病。LEE等[41]研究证实发酵大豆通过上调参与抗氧化防御系统关键酶的表达,包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,并通过诱导脂质和糖代谢降低MDA水平,保护胰腺β细胞免受氧化应激影响,改善胰岛素抵抗,从而调节糖脂代谢性疾病。
2.4 调节代谢性炎症反应
炎症是机体对各种病理过程(如病原体入侵、组织损伤和刺激物)的重要生理反应。代谢性炎症具有与经典炎症反应不同的性质。代谢性炎症是由代谢细胞中营养过剩引发的慢性、低级别炎症。代谢性炎症通过肝脏、脂肪、肌肉等代谢组织或器官中的炎症激酶JNK(c-jun N-terminal kinase,JNK)、IKK(inhibitor of κ kinase,IKK)和PKR(protein kinase R,PKR)抑制胰岛素的功能,并通过这些或其他机制破坏营养和能量代谢[42]。调节代谢性炎症相关基因和通路的表达可以有效改善糖脂代谢性疾病,包括NF-κB信号通路、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPAR)、白介素(interleukin,IL)受体、肿瘤坏死因子(tumour necrosis factor,TNF)等[43]。
发酵制品中含有包括小分子活性肽、多酚、黄酮、多糖等具有抗炎作用的活性成分。研究发现,发酵制品可以通过调节代谢性炎症改善糖脂代谢性疾病(表4)。肝脏、肌肉等器官组织中的促炎症因子是加重代谢性疾病的诱因之一,降低这些炎症因子的水平对于缓解糖脂代谢性疾病至关重要。如果发酵制品可以降低这类炎症因子的水平,则表明其可以通过改善代谢性炎症调节糖脂代谢。JOUNG等[44]研究证实了上述观点,发酵油松提取物通过降低小鼠肝脏、附睾脂肪组织和股四头肌中的炎症因子(TNF-α、IL-1β、IL-6和IL-12)的表达水平,从而达到减轻代谢性炎症,调节糖脂代谢的作用。另外还有几项研究系统探索了发酵制品通过调节炎症因子的基因表达水平参与调节糖脂代谢性疾病。发酵大豆可以通过降低炎症因子C-反应蛋白(C-reactive protein,CRP)、TNF-α和IL-6表达,最终达到缓解慢性代谢性炎症改善糖脂代谢性疾病的目的[45]。推测大豆中的可溶纤维是调节肝脏基因表达和减少体内促炎细胞因子的关键降脂成分。姜黄素苹果酒可显著降低炎症基因表达,包括PPARγ、CCAT /增强子结合蛋白α(CCAT/enhancer binding protein alpha,C/EBP α)、脂肪酸结合蛋白4(fatty acid-binding protein 4,FABP4)、IL-1β、TNF和趋化因子,从而降低肌肉、肝脏、脂肪等组织中的代谢性炎症,起到缓解糖脂代谢性疾病的作用[46]。
表4 调节代谢性炎症反应的发酵制品
Table 4 Fermented products for regulating metabolic inflammation
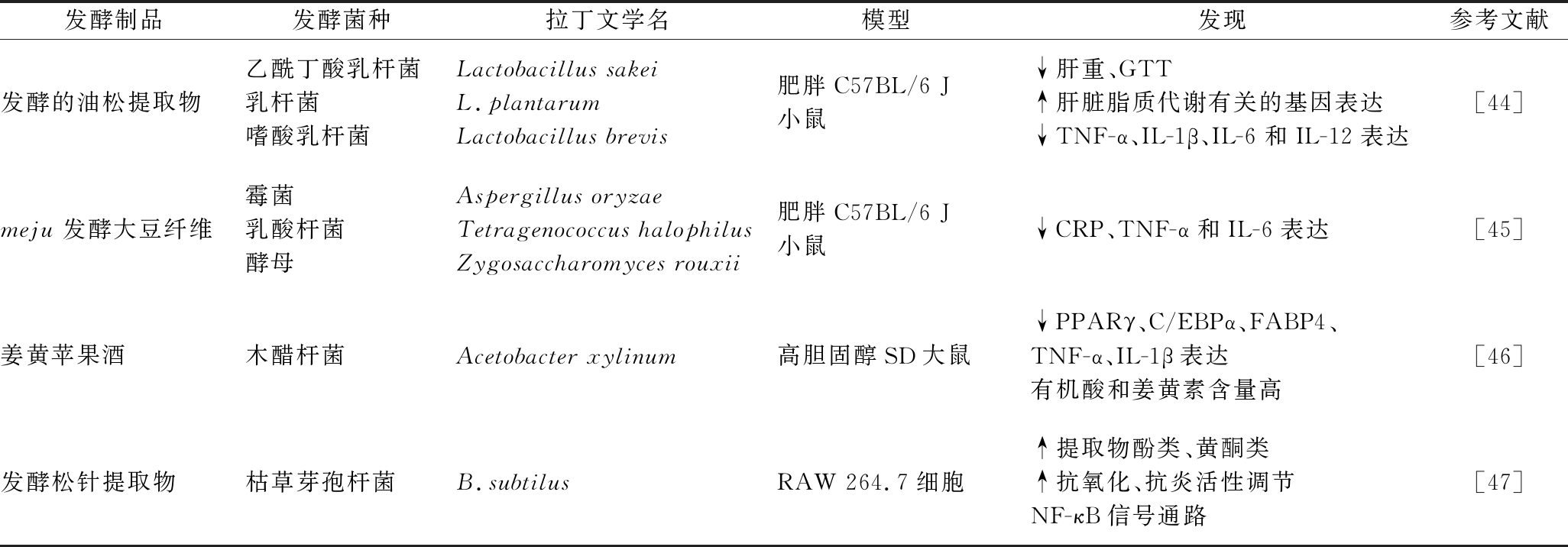
发酵制品发酵菌种拉丁文学名模型发现参考文献发酵的油松提取物乙酰丁酸乳杆菌乳杆菌嗜酸乳杆菌Lactobacillus sakeiL.plantarumLactobacillus brevis肥胖C57BL/6 J小鼠↓肝重、GTT↑肝脏脂质代谢有关的基因表达↓TNF-α、IL-1β、IL-6和IL-12表达[44]meju发酵大豆纤维霉菌乳酸杆菌酵母Aspergillus oryzaeTetragenococcus halophilusZygosaccharomyces rouxii肥胖C57BL/6 J小鼠↓CRP、TNF-α和IL-6表达[45]姜黄苹果酒木醋杆菌Acetobacter xylinum高胆固醇SD大鼠↓PPARγ、C/EBPα、FABP4、TNF-α、IL-1β表达有机酸和姜黄素含量高[46]发酵松针提取物枯草芽孢杆菌B.subtilusRAW 264.7细胞↑提取物酚类、黄酮类↑抗氧化、抗炎活性调节NF-κB信号通路[47]
分析还发现其抗肥胖效果与发酵饮料中高含量的有机酸和姜黄素有关。此外,代谢性炎症并非单独影响糖脂代谢,代谢性炎症和氧化应激能相互协同进而造成糖脂代谢紊乱。因此调节其共有的信号通路有助于改善糖脂代谢性疾病。研究证实发酵制品可以调节代谢性炎症和氧化应激改善糖脂代谢。发酵松针饮料通过调节NF-κB信号通路对脂多糖诱导的RAW 264.7巨噬细胞产生了抗氧化和抗炎特性,从而达到调节糖脂代谢的目的[47]。
2.5 调节肠道菌群
人的肠道内密集地分布着各种各样的微生物群落。肠道菌群的组成可能受到遗传因素、生活方式、饮食习惯、压力、疾病和药物使用的影响。肠道生态系统的失调与肠道相关疾病如IBS、皮肤炎症、心血管疾病、癌症、肥胖、心理健康、关节炎和2型糖尿病有关。肠道菌群参与了机体大多数生理病理过程,包括糖脂代谢。肥胖、糖尿病等糖脂代谢性疾病发病机制与肠道微生物密切相关。肠道菌群通过改变葡萄糖和脂肪酸代谢,肝脏脂肪酸储存、GLP-1、IL-22、toll-like受体和免疫系统的调节,进而改善代谢紊乱[11]。SCFAs是肠道菌群发酵膳食纤维的最终产物,包含乙酸、丙酸、丁酸等[48],其在代谢、信息传递、免疫稳态、神经通路和癌症中发挥重要作用。在糖脂代谢方面,SCFAs可为人体各组织提供能量,维持肠上皮细胞功能、葡萄糖稳态和胰岛素敏感性,影响糖、脂代谢。与此同时,作为糖异生底物的SCFAs也能增加宿主的能量收获,从而改善2型糖尿病、肥胖、高脂血症和其他代谢性疾病[49]。据此发酵制品的研究也都是基于对肠道菌群结构的影响和增加结肠内SCFAs含量进行的。也有不少研究证实了发酵食品可以通过调节肠道菌群结构和增加粪便中SCFAs的含量,从而调节糖脂代谢性疾病(表5)。
表5 调节肠道菌群的发酵制品
Table 5 Fermented products that regulate gut microbiota

发酵制品发酵菌种拉丁文学名模型发现参考文献葛根发酵液短双歧杆菌Bifidobacterium breve肥胖C57BL/6 J小鼠↓MCP-1、IL-6和TNF-α表达肠道菌群丰度改善[51]发酵苦瓜多糖植物乳酸菌NCU116L.plantarum糖尿病Wistar大鼠↑粪便SCFA肠道菌群结构改善[52]酸奶干酪乳杆菌Q14Lactobacillus casei糖尿病Wistar大鼠↑粪便醋酸盐和丁酸盐↑GLP-1、PYY表达肠道菌群结构改善[53]发酵胡萝卜汁植物乳杆菌NCU116L.plantarum糖尿病Wistar大鼠↑制品乳酸、粪便SCFA↑LDL受体、CYP7A1、GLUT-4、PPAR-α、PPAR-γ表达胰腺和肾脏的抗氧化能力恢复[54]
在宏观层面上,临床及动物实验表明糖脂代谢性疾病的肠道菌群结构发生改变,其中厚壁菌门与拟杆菌门比例增加,益生菌的比例降低,SCFAs的含量降低[50]。因此通过调节肠道菌群的机构和增加其产生SCFAs菌的含量是改善糖脂代谢性疾病的有效途径。最新研究也证实发酵食品可以通过改变肠道菌群从而调节糖脂代谢性疾病。在肥胖小鼠的模型研究中,发酵葛根被证实可以通过促进小鼠肠道中乳球菌和瘤胃球菌的富集,进而增强抗肥胖和抗炎的作用[51]。在糖尿病大鼠模型的研究中也得到了类似的结果,研究证实植物乳酸菌发酵的苦瓜多糖通过富集肠道内拟杆菌、卢氏小球藻、口状杆菌等益生菌和促进SCFAs的产生,增强了其抗糖尿病作用[52]。在微观层面上,肠道菌群是通过调节血糖水平、胰岛素抵抗、抗炎活性和GLP-1分泌等多种机制改善糖脂代谢性疾病的。发酵酸奶被证实可通过选择性富集产生 SCFAs的细菌,增加SCFAs浓度后,增加下游PYY的表达,从而改善糖尿病大鼠的糖脂代谢[53]。另外,肠道益生菌产生的SCFAs可以作用于全身,包括脑、肝、胰、肠上皮细胞、脂肪、肌肉等与糖脂代谢相关的器官组织,通过调节器官组织的氧化应激、降低代谢性炎症及脂质代谢全面调节糖脂代谢性疾病。因此发酵制品通过肠道菌群调节糖脂代谢性疾病的机制是多元的。LI等[54]发现发酵萝卜汁通过改变大鼠肠道菌群结构,进而增加肠道SCFAs的含量,影响了肠道激素释放,上调LDL受体、CYP7A1、葡萄糖转运体4(recombinant glucose transporter 4,GLUT4)、PPAR-α和PPAR-γ脂质代谢相关基因的表达,恢复胰腺和肾脏的抗氧化能力等一系列指标,最终改善了大鼠的糖尿病。
发酵制品可以调控糖脂代谢性疾病患者的肝脏、胰脏、脑、肠道、脂肪和肌肉组织的功能,在宏观上表现为增强肝脏抗氧化活性,降低脂肪组织的分化和细胞的大小,修复胰岛β细胞,增加血清胰岛素、瘦素水平,抑制食欲,增加肠道益生菌丰度和粪便SCFAs水平;微观上表现为上调参与抗氧化防御系统关键酶(CAT,GSH-Px,SOD)、代谢性炎症相关基因(TNF-α,IL-1β,PPAR-γ)、胰岛素受体底物(IRS2)、丘脑食欲调节基因(POMC,CART)和肠道能量代谢相关激素(GLP-1,PYY)的表达,进而从神经内分泌紊乱、胰岛素抵抗、氧化应激、代谢性炎症和肠道菌群失调5个方面综合调控糖脂代谢性疾病,如图2所示。
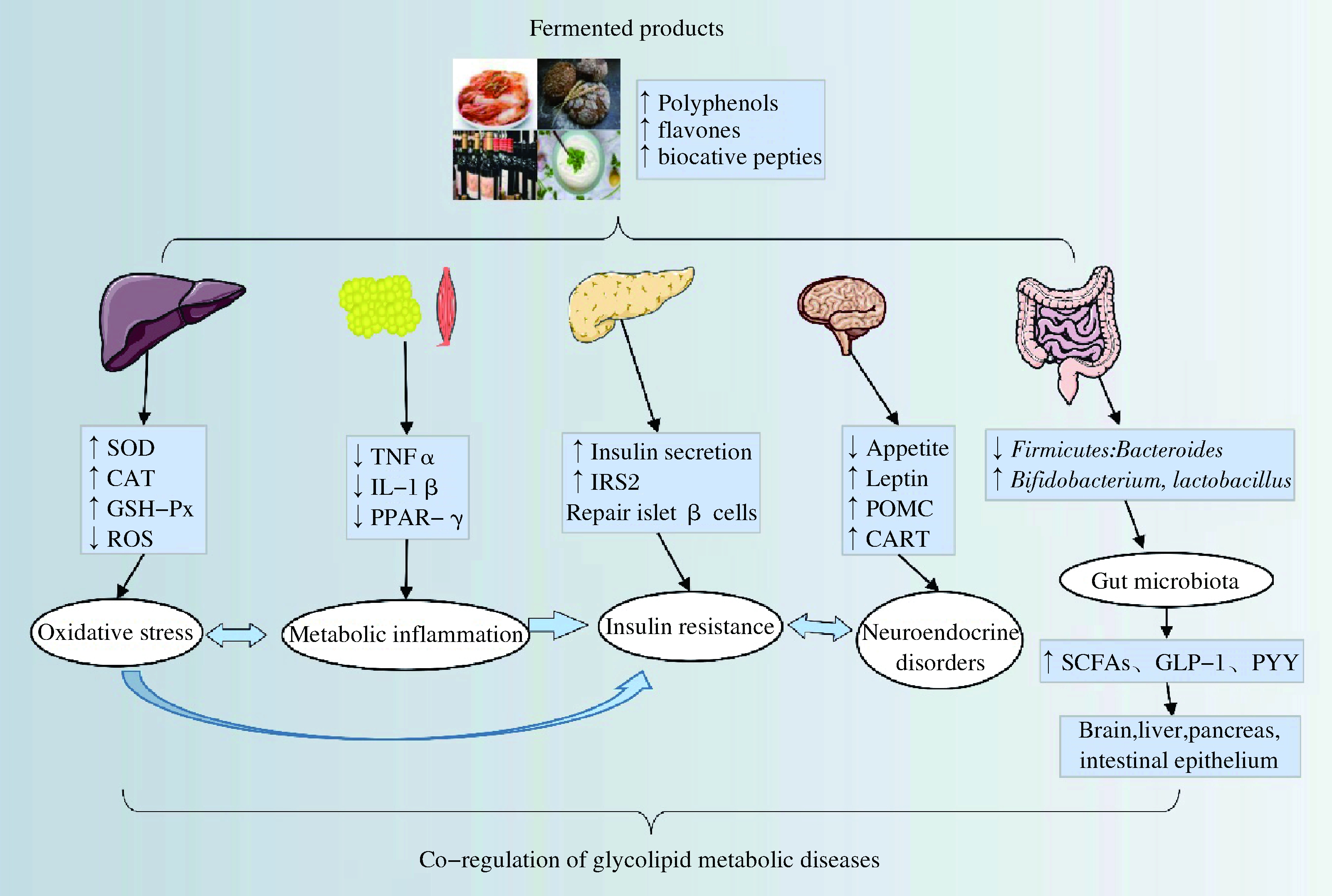
图2 发酵制品调控糖脂代谢性疾病机制示意图
Fig.2 Schematic diagram of the mechanism of fermented products regulating glycolipid metabolic diseases
3 结语
发酵制品可以改善糖脂代谢性疾病,并通过神经内分泌、胰岛素抵抗、氧化应激、代谢性炎症和肠道菌群等5个方面综合进行糖脂代谢性疾病的调控,但各机制之间的作用关系仍缺乏更多的验证。食品和中药通过发酵具有更好的抗糖脂代谢紊乱的作用,这与发酵过程中增加了多酚、黄酮、小分子活性肽、可溶性膳食纤维等活性成分的含量有关。可见,研发对糖脂代谢性疾病治疗具有预防和治疗作用的发酵制品具有很好的前景。但是现有的发酵制品成分复杂,制备工艺的可控性差,为了明确活性成分与疾病的相互作用关系,必须在细胞和分子水平上阐明发酵转化的反应机理,这也是未来发酵制品研究领域面临的挑战。
[1] GUO J.Research progress on prevention and treatment of glucolipid metabolic disease with integrated traditional Chinese and Western medicine[J].Chinese Journal of Integrative Medicine,2017,23(6):403-409.
[2] 王天歌,陆洁莉,毕宇芳,等.中国糖尿病持续攀升新解:中年肥胖相关胰岛素抵抗成为主要威胁[J].中华内分泌代谢杂志,2020,36(3):198-199;200.
WANG T G,LU J L,BI Y F,et al.New insights into the growing diabetes epidemic in China:Middle-aged obesity-related insulin resistance becomes the major threat[J].Chinese Journal of Endocrinology and Metabolism,2020,36(3):198-199;200.
[3] ZHANG L F,WANG Z W,WANG X,et al.Prevalence of overweight and obesity in China:Results from a cross-sectional study of 441 thousand adults,2012—2015[J].Obesity Research & Clinical Practice,2020,14(2):119-126.
[4] 胡盛寿,高润霖,刘力生,等.《中国心血管病报告2018》概要[J].中国循环杂志,2019,34(3):209-220.
HU S S,GAO R L,LIU L S,et al.Summary of the 2018 report on cardiovascular diseases in China[J].Chinese Circulation Journal,2019,34(3):209-220.
[5] LI L,WANG L,FAN W,et al.The application of fermentation technology in traditional Chinese medicine:A review[J].The American Journal of Chinese Medicine,2020,48(4):1-23.
[6] PARK S,SON H K,CHANG H C,et al.Effects of cabbage-apple juice fermented by Lactobacillus plantarum EM on lipid profile improvement and obesity amelioration in rats[J].Nutrients,2020,12(4):1 135.
[7] RAKA F,FARR S,KELLY J,et al.Metabolic control via nutrient sensing mechanisms:Role of taste receptors and the gut-brain neuroendocrine axis[J].AJP Endocrinology and Metabolism,2019,317(4):559-572.
[8] PARK S S,SEO Y K.Excess accumulation of lipid impairs insulin sensitivity in skeletal muscle[J].International Journal of Molecular Sciences,2020,21(6):1 949.
[9] ZHAO T,WU K,HOGSTRAND C,et al.Lipophagy mediated carbohydrate-induced changes of lipid metabolism via oxidative stress, endoplasmic reticulum (ER) stress and ChREBP/PPARγ pathways[J].Cellular and Molecular Life Sciences,2020,77(10):1 987-2 003.
[10] POZNYAK A,GRECHKO A V,POGGIO P,et al.The diabetes mellitus-atherosclerosis connection:The role of lipid and glucose metabolism and chronic Inflammation[J].International Journal of Molecular Sciences,2020,21(5):1 835.
[11] LEE C J,SEARS C L,MARUTHUR N.Gut microbiome and its role in obesity and insulin resistance[J].Annals of the New York Academy of Sciences,2020,1 461(1):37-52.
[12] YARIBEYGI H,FARROKHI F R,BUTLER A E,et al.Insulin resistance:Review of the underlying molecular mechanisms[J].Journal of Cellular Physiology,2019,234(6):8 152-8 161.
[13] OGUNTIBEJU O O.Type 2 diabetes mellitus,oxidative stress and inflammation:Examining the links[J].International Journal of Physiology,Pathophysiology and Pharmacology,2019,11(3):45-63.
[14] HALIM M,HALIM A.The effects of Inflammation, aging and oxidative stress on the pathogenesis of diabetes mellitus (type 2 diabetes)[J].Diabetes and Metabolic Syndrome Clinical Research and Reviews,2019,13(2):1 165-1 172.
[15] KULLMANN S,KLEINRIDDERS A,SMALL D M,et al.Central nervous pathways of insulin action in the control of metabolism and food intake[J].The Lancet Diabetes & Endocrinology,2020,8(6):524-534.
[16] CAVALLARI J F,SCHERTZER J D.Intestinal microbiota contributes toenergy balance, betabolic inflammation, and insulin resistance in obesity[J].Journal of Obesity & Metabolic Syndrome,2017,26(3):161-171.
[17] BERNIER L P,YORK E M,KAMYABI A,et al.Microglial metabolic flexibility supports immune surveillance of the brain parenchyma[J].Nature Communications,2020,11(1):1 559.
[18] VIEN S,LUHOVYY B L,PATEL B P,et al.Pre-and within meal effects of fluid dairy products on appetite, food intake, glycemia and regulatory hormones in children[J].Applied Physiology Nutrition & Metabolism,2017,42(3):302-310.
[19] ALFEREZ,MARIA J M,ROBLES-REBOLLO,et al.Changes in adiposity and body composition during anemia recovery with goat or cow fermented milks[J].Journal of Agricultural and Food Chemistry,2017,65(20):4 057-4 065.
[20] PICHIAH P B T,CHO S H,HAN S K,et al.Fermented barley supplementation modulates the expression of hypothalamic genes and reduces energy intake and weight gain in rats[J].Journal of Medicinal Food,2016,19(4):418-426.
[21] IMAI Y,COUSINS R S,LIU S,et al.Connecting pancreatic islet lipid metabolism with insulin secretion and the development of type 2 diabetes[J].Annals of the New York Academy of Sciences,2020,1 461(1):53-72.
[22] PYO Y H,LEE K W.Preventive Effect of Monascus-fermented products enriched with ubiquinones on type 2 diabetic rats induced by a high-fructose plus high-fat diet[J].Journal of Medicinal Food,2014,17(7):826-829.
[23] KWON D Y,JANG J S,HONG S M,et al.Long-term consumption of fermented soybean-derived Chungkookjang enhances insulinotropic action unlike soybeans in 90% pancreatectomized diabetic rats[J].European Journal of Nutrition,2007,46(1):44-52.
[24] CHEN Y,FENG R,YANG X,et al.Yogurt improves insulin resistance and liver fat in obese women with nonalcoholic fatty liver disease and metabolic syndrome:A randomized controlled trial[J].The American Journal of Clinical Nutrition,2019,109(6):1 611-1 619.
[25] KIM M,KIM B,PARK H,et al.Long-term fermented soybean paste improves metabolic parameters associated with non-alcoholic fatty liver disease and insulin resistance in high-fat diet-induced obese mice[J].Biochemical and Biophysical Research Communications, 2018, 495(2):1 744-1 751.
[26] HOURIEH A.A review on free radicals and antioxidants[J].Infectious Disorders Drug Targets,2020,20(1):16-26.
[27] CHEN Z,TIAN R,SHE Z,et al.Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease[J].Free Radical Biology and Medicine,2020,152:116-141
[28] BANKS W A.A spectrum of topics for 2019:Advances in neuroinflammation,oxidative stress, obesity,diabetes mellitus,cardiovascular disease,autism,exosomes,and central nervous system diseases foreword[J].Current Pharmaceutical Design,2020,26(1):1-5.
[29] REN H W,SHAO Y,WU C,et al.Metformin alleviates oxidative stress and enhances autophagy in diabetic kidney disease via AMPK/SIRT1-FoxO1 pathway[J].Molecular and Cellular Endocrinology,2020,500:110 628.
[30] MELINI F,MELINI V,LUZIATELLI F,et al.Health-promoting components in fermented foods:An up-to-date systematic review[J].Nutrients,2019,11(5):1 189.
[31] GULCIN I.Antioxidants and antioxidant methods:An updated overview[J].Archives of Toxicology,2020,94(3):651-715.
[32] DONG M Z,AN J Y,WANG L T.Development of fermented chestnut with Bacillus natto:Functional and sensory properties[J].Food Research International,2020,130:108 941.
[33] ADEBO O A,MEDINA-MEZA I G.Impact of fermentation on the phenolic compounds and antioxidant activity of whole cereal grains:A mini review[J] Molecules,2020,25(4):927.
[34] LEE B H,LO Y H,PAN T M.Anti-obesity activity of Lactobacillus fermented soy milk products[J].Journal of Functional Foods,2013,5(2):905-913.
[35] MARAZZA J A,LEBLANC J G,DE G,et al.Soymilk fermented with Lactobacillus rhamnosus CRL981 ameliorates hyperglycemia,lipid profiles and increases antioxidant enzyme activities in diabetic mice[J].Journal of Functional Foods,2013,5(4):1 848-1 853.
[36] ADEMILUYI A O,OBOH G.Attenuation of oxidative stress and hepatic damage by some fermented tropical legume condiment diets in streptozotocin-induced diabetes in rats[J].Asian Pacific Journal of Tropical Medicine,2012,5(9):692-697.
[37] HUANG Q,ZHANG H,XUE D.Enhancement of the antioxidant and hypolipidemic activities of Puerariae radix by fermentation with Aspergillus niger[J].Food Science and Biotechnology,2019,28(4):1 117-1 124.
[38] SOMANAH J,BOURDON E, RONDEAU P,et al.Relationship between fermented papaya preparation supplementation,erythrocyte integrity and antioxidant status in pre-diabetics[J].Food & Chemical Toxicology,2014,65(1):2-17.
[39] NOH J S,CHOI Y H,SONG O.Beneficial effects of the active principle component of Korean cabbage kimchi via increasing nitric oxide production and suppressing inflammation in the aorta of apoE knockout mice[J].British Journal of Nutrition,2013,109(1):17-24.
[40] NOH J S,KIM H J,KWON M J,et al.Active principle of kimchi,3-(4′-hydroxyl-3′,5′-dimethoxyphenyl)propionic acid,retards fatty streak formation at aortic sinus of apolipoprotein E knockout mice[J].Journal of Medicinal Food,2009,12(6):1 206-1 212.
[41] LEE,JAE Y,ARAVINTHAN,et al.Supplementation of a fermented soybean extract reduces body mass and prevents obesity in high fat diet-induced C57BL/6 J obese mice[J].Preventive Nutrition and Food Science,2016,21(3):187-196.
[42] YING W,FU W X,LEE Y S.The role of macrophages in obesity-associated islet inflammation and beta-cell abnormalities[J].Nature Reviews Endocrinology,2020,16(2):81-90.
[43] FADAEI R,BAGHERI N,HEIDARIAN E.Serum levels of IL-32 in patients with type 2 diabetes mellitus and its relationship with TNF-alpha and IL-6[J].Cytokine,2020,125:154 832.
[44] JOUNG H,KIM B,PARK H,et al.Fermented Moringa oleifera decreases hepatic adiposity and ameliorates glucose intolerance in high-fat diet-induced obese mice[J].Journal of Medicinal Food,2017,20(5):439.
[45] KIM J H,JIA Y,LEE Y G,et al.Hypolipidemic and antiinflammation activities of fermented soybean fibers from meju in C57BL/6 J mice[J].Phytotherapy Research,2014,28(9):1 335-1 341.
[46] HARDIWATI K T,SENINHA M,LAY B W,et al.Curcuminoid cider fermented from Curcuma xanthorrhiza curcuminoids attenuates gene expression related to obesity-induced inflammation in hypercholesterolaemic rats[J].International Food Research Journal,2019,26(3):859-867.
[47] CHIU H F,WANG H M,SHEN Y C,et al.Anti-inflammatory properties of fermented pine (Pinus morrisonicola Hay.) needle on lipopolysaccharide-induced inflammation in RAW 264.7 macrophage cells[J].Journal of Food Biochemistry,2019,43(11).DOI:10.1111/jfbc.12994.
[48] MARKOWIAK-KOPE P,LIEWSKA K.The effect of probiotics on the production of short-chain fatty acids by human intestinal microbiome[J].Nutrients, 2020, 12(4):1 107.
[49] LYU M,WANG, Y F,FAN G W,et al.Balancing herbal medicine and functional food for prevention and treatment of cardiometabolic diseases through modulating gut microbiota[J].Frontiers in Microbiology,2017,8:2 146.
[50] TSAFRAKIDOU P,MICHAELIDOU A M,BILIADERIS C G.Fermented cereal-based products:Nutritional aspects,possible impact on gut microbiota and health implications[J].Foods,2020,9(6):734.
[51] CHOI Y,BOSE S,SHIN N R,et al.Lactate-Fortified Puerariae radix fermented by Bifidobacterium breve improved diet-induced metabolic dysregulation via alteration of gut microbial communities[J].Nutrients,2020,12(2):276.
[52] GAO H,WEN J J,HU J,et al.Fermented Momordica charantia L. juice modulates hyperglycemia, lipid profile, and gut microbiota in type 2 diabetic rats[J].Food Research International,2019,121:367-378.
[53] QU L,REN J,HUANG L,et al.Anti-diabetic effects of Lactobacillus.casei fermented-yogurt through re-shaping gut microbiota structure in type 2 diabetic rats[J].Journal of Agricultural & Food Chemistry,2018,66(48):12 696-12 705.
[54] LI C,DING Q,NIE S P,et al.Carrot juice fermented with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats[J].Journal of Agricultural & Food Chemistry,2014, 62(49):11 884.