米酒具有蜜香清雅、入口柔绵、落口爽净的特点,深受消费者的喜爱[1]。米酒主体香气成分为乙酸乙酯、乳酸乙酯和β-苯乙醇[2],主要是由微生物在米酒酿造过程中代谢产生。用于酿酒的生香酵母具有产生芳香化合物的能力,在酒的酿造过程中发挥着重要作用。生香酵母分泌的酯酶能使酵母代谢产生的醇类和酸类物质发生反应生成多种具有香味的酯类物质[3]。β-苯乙醇则通过艾利希途径代谢调节而产生[4]。生香酵母多存在于酒曲或水果当中,其种类多样,常见的生香酵母有异常毕赤酵母(Pichia anomala)[5-6]、汉逊酵母(Hansenula)[7]、假丝酵母(Candida)[8]、异常威克汉姆酵母(Wickerhamomyces anomalus)[9]和接合酵母(Zygosaccharomyces)[10]等。优良生香酵母的筛选、研究不但可以应用于酒类酿造,对酱油[11-12]、醋[13-15]和腌菜[16]等的发酵也具有积极作用。
为得到米酒酿造中产香能力突出的酵母,通过嗅闻法初筛得到产香味明显的纯菌株,再通过测定其发酵米酒过程中乙酸乙酯、乳酸乙酯、β-苯乙醇和乙醇的积累量复筛得到产香最突出的菌株,并对其进行形态学和分子生物学鉴定,进一步探究其发酵米酒产生的风味物质,及添加前体物对其发酵米酒中风味物质形成的影响。
1 材料与方法
1.1 原料
籼米:市售,保存完好,无霉无蛀。
菌种来源:通过多种途径得到11种不同筛菌原料,如表1所示。
表1 原料样品信息
Table 1 Information of the samples of raw material

编号原料来源编号原料来源1融水重阳酒酒曲实验室保存7酿酒曲块网购2圆酒曲实验室保存8高产优质白酒曲市售3白酒曲市售9酿酒曲块实验室保存4香蜜甜酒曲市售10葡萄市售5绿衣观音土酒曲网购11香霸复合功能菌网购6甜酒曲市售
1.2 试剂
孟加拉红培养基,广东环凯生物科技有限公司;酵母粉、蛋白胨,赛默飞世尔科技有限公司;葡糖淀粉酶、α-淀粉酶,沧州夏盛酶生物技术有限公司;L-苯丙氨酸,上海阿拉丁生化科技股份有限公司。以上均为生化试剂
乙酸乙酯、乙醇、β-苯乙醇、乳酸乙酯,均为色谱纯,上海凛恩科技发展有限公司;L-乳酸(高纯),上海麦克林生化科技有限公司;乙酸(分析纯),成都市科龙化工试剂厂;葡萄糖(分析纯),天津市科密欧化学试剂有限公司。
1.3 培养基
孟加拉红培养基(g/L):蛋白胨5,葡萄糖10,KH2PO4 1,MgSO4 0.5,琼脂15,孟加拉红0.033,氯霉素0.1。115 ℃高压蒸汽灭菌30 min。
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,琼脂15,自然pH。115 ℃高压蒸汽灭菌30 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯200(去皮切块,加水煮沸20 min,收集滤液),葡萄糖20,琼脂15,自然pH。115 ℃高压蒸汽灭菌30 min。
种子培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,自然pH。每200 mL分装至500 mL三角瓶,115 ℃高压蒸汽灭菌30 min。
发酵培养基:籼米打粉,以10 U/g米添加α-淀粉酶,95 ℃液化4 h,以150 U/g米添加葡糖淀粉酶,65 ℃糖化4 h,以料液比=1∶4(g∶mL)补足水,每200 mL分装至500 mL三角瓶,105 ℃高压蒸汽灭菌30 min。
1.4 仪器与设备
BX43生物显微镜,日本奥林巴斯有限公司;Tpersonal聚合链式反应仪,德国Biometra公司;DYY-6D型电泳仪,北京市六一仪器厂;ZXSD-R1430生化培养箱、ZWYR-C2402C智城恒温培养振荡器、ZHJH-C1112C超净工作台,上海智城分析仪器制造有限公司;LDZH-100KBS立式压力灭菌器,上海申安医疗器械厂;赛里安456GC气相色谱仪(TM-930色谱柱:25 m×0.53 mm,1 μm),荷兰赛里安仪器(scion instruments)公司;TRACE 1300-ISQQD气相色谱质谱联用仪(色谱柱HP5-MS 30 m×0.25 mm,0.25 μm),赛默飞世尔科技有限公司;H2100R医用离心机,湖南湘仪实验室仪器开发有限公司。
1.5 实验方法
1.5.1 种子培养
种子液:将菌落挑取一环接入种子培养基,30 ℃、150 r/min培养18 h。
1.5.2 初筛
取5.0 g样品溶于45 mL无菌水中混匀,静置取上层菌悬液,以10倍系列稀释制备10-3、10-4、10-5、10-6、10-7菌悬液,分别移取100 μL涂布于孟加拉红平板培养基,30 ℃培养,分离、划线纯化出具有典型酵母菌菌落特征的菌株,接种于YPD斜面培养基,4 ℃保存备用。
将纯化得到的酵母划线于PDA平板培养基,30 ℃培养3~4 d,通过嗅闻法筛选出使平板具有明显香味的菌株。
1.5.3 复筛
将初筛得到的酵母以10%(体积分数)的接种量接种于发酵培养基,在30 ℃、150 r/min条件下培养7 d,利用气相色谱仪测定乙酸乙酯、乳酸乙酯、β-苯乙醇及乙醇的含量,取样平行测定3次。
样品处理:样品经11 000 r/min、4 ℃离心15 min,取上清液。
GC条件:初始温度50 ℃,3 ℃/min升至80 ℃,保持2 min,再以5 ℃/min升至180 ℃,保持2 min,进样口温度180 ℃,检测器温度210 ℃,进样量0.5 μL,分流比20∶1。
1.5.4 菌株的鉴定
1.5.4.1 形态学鉴定
将筛选出的菌株划线于YPD平板培养基,30 ℃培养3 d,观察菌落及其微观形态特征,参考《真菌鉴定手册》[17]进行形态学鉴定。
1.5.4.2 分子生物学鉴定
引物:ITS1(5′-GCATATCAATAAGCGGAGGAAAAG-3′),ITS4(5′-GGTCCGTGTTTCAAGACGG-3′)。
PCR反应体系:预混酶25 μL;引物ITS1、ITS4各2 μL;菌液2 μL;ddH2O 19 μL。扩增条件:预变性94 ℃、5 min;变性94 ℃、1 min;退火55 ℃、1 min;延伸72 ℃、1 min,循环30次;再延伸72 ℃、10 min,4 ℃保存。
取PCR扩增产物,进行1%琼脂糖凝胶电泳。电泳条带切胶回收,送至广州赛默飞世尔科技公司测序。测序结果提交于美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的GenBank数据库进行BLAST序列比对,使用软件Mega 5.0,并采用邻接法构建系统发育树。
1.5.5 菌株发酵风味物质测定
将复筛得到的菌株的发酵液进行风味物质测定。
样品处理:4 ℃、11 000 r/min离心15 min,取上清液和二氯甲烷各30 mL于250 mL三角瓶中,置于摇床(100 r/min)萃取60 min,继续加入20 mL二氯甲烷萃取30 min,最后加入10 mL二氯甲烷萃取10 min。萃取结束后使用分液漏斗分液,收集下层溶液并减压浓缩至5 mL,使用气相色谱质谱联用仪测定风味物质。
程序升温:40 ℃保持5 min,以5 ℃/min升至180 ℃保持5 min,再以5 ℃/min升至240 ℃保持2 min;进样口温度280 ℃;氦气流速1 mL/min;进样量1 μL;不分流进样。
质谱条件:离子源温度300 ℃;传输通道温度为280 ℃;电离方式为EI电离源;电子能量70 eV;质谱扫描范围40~600 amu。
1.5.6 香气前体物对菌株酿造米酒香气物质的影响
利用GC测定发酵液中乙酸乙酯、乳酸乙酯和β-苯乙醇的积累量,取样平行测定3次。
GC条件:初始温度40 ℃,3 ℃/min升温至70 ℃,保持3 min,再以10 ℃/min升至180 ℃,保持2 min,进样口温度200 ℃,检测器温度230 ℃,进样量0.5 μL,分流比20∶1。
1.5.6.1 乙酸对菌株酿造米酒乙酸乙酯积累量的影响
在发酵培养基中分别添加0%、0.1%、0.2%、0.3%、0.4%和0.5%(体积分数)的乙酸(0.22 μm滤膜过滤),以体积分数10%的接种量接种,在30 ℃、150 r/min条件下培养10 d,每天测定发酵液中乙酸乙酯积累量。
1.5.6.2 L-苯丙氨酸对菌株酿造米酒β-苯乙醇积累量的影响
在发酵培养基中分别添加0、2、4、6、8、10 g/L的L-苯丙氨酸(灭菌前添加),以体积分数10%的接种量接种、在30 ℃、150 r/min条件下培养10 d,每天测定发酵液中β-苯乙醇积累量。
1.5.6.3 L-乳酸对菌株酿造米酒乳酸乙酯积累量的影响
在发酵培养基中分别添加0%、0.1%、0.2%、0.3%、0.4%、0.5%(体积分数)的乳酸(0.22 μm滤膜过滤),以体积分数10%的接种量接种,在30 ℃、150 r/min条件下培养10 d,每天测定发酵液中乳酸乙酯积累量。
1.6 数据处理
利用Origin 2018、Excel Microsoft 365对实验数据进行统计分析,分析结果以平均值±标准差表示。
2 结果与分析
2.1 生香酵母的初筛
从11种样品中分离纯化得到20株酵母菌,如表2所示,将其分别在PDA平板划线30 ℃培养,经嗅闻初筛得到香气突出的菌株6株,分别为2Z1、10Z1、10Z2、10Z3、11Z1和11Z6。
表2 原料中酵母菌分离纯化结果
Table 2 Results of isolation and purification of strains from raw materials

来源编号菌株编号来源编号菌株编号11Z1、1Z288Z1、8Z2、8Z322Z11010Z1、10Z2、10Z3、10Z4、10Z533Z11111Z1、11Z2、11Z3、11Z4、11Z5、11Z655Z1、5Z2
2.2 生香酵母的复筛
将初筛得到的菌株以体积分数10%的接种量接种到发酵培养基,在30 ℃、150 r/min条件下培养7 d,使用气相色谱仪进行乙酸乙酯、β-苯乙醇、乳酸乙酯和乙醇积累量测定,结果见表3。
表3 初筛菌株发酵米酒香气物质及乙醇含量 单位:g/L
Table 3 Aroma components and ethanol contents produced by screened strains

香气成分2Z110Z110Z210Z311Z111Z6乙酸乙酯0.043±0.0030.041±0.0020.686±0.0680.038±0.0032.883±0.2602.010±0.129β-苯乙醇0.028±0.0020.072±0.0060.053±0.0050.084±0.0080.301±0.0280.013±0.001乳酸乙酯0.064±0.0070.075±0.0760.170±0.0150.069±0.0080.080±0.0080.128±0.012乙醇39.680±1.23036.736±2.92927.445±2.16427.561±0.53637.296±1.03627.935±2.563
由表3可知,发酵7 d的菌株11Z1发酵液中乙酸乙酯积累量最高,达到(2.833±0.260)g/L,其次为菌株11Z6和10Z2,其余菌株发酵虽产乙酸乙酯,但积累量明显较低,均低于0.05 g/L。徐丽萍[18]从沪型大曲中筛选出一株产酯汉逊酵母,经条件优化产酯积累量可达到1.479 g/L,而菌株11Z1在未优化的条件下产酯含量明显优于此菌株。与其他发酵液相比,菌株11Z1发酵液中β-苯乙醇积累量最高,达到(0.301±0.028)g/L,积累量明显突出。菌株10Z2发酵液中乳酸乙酯积累量最高,达到(0.170±0.015)g/L,其次为菌株11Z6,其余均相对较低。菌株2Z1发酵液中乙醇积累量最高,其次为菌株11Z1、10Z1、11Z6、10Z3和10Z2,最低仍可达到(27.445±2.164)g/L;乙醇既可作为香气物质的前体物,又对米酒发酵酒精度的提高有积极作用。综合分析,菌株11Z1发酵产乙酸乙酯、β-苯乙醇的能力均优于其他菌株,且产乳酸乙酯及乙醇的能力较强,因此筛选出菌株11Z1进行进一步研究。
2.3 菌株11Z1的鉴定
2.3.1 菌株11Z1的形态学鉴定
将菌株11Z1在PDA平板中划线,30 ℃培养3 d,观察菌落形态及显微形态,其结果如图1所示。菌株11Z1菌落大且厚,湿润黏稠易挑起,质地均匀,边缘整齐,呈乳白色,通过显微镜可观察细胞呈卵圆形,细胞个体较大,直径约5.53~10.57 μm,出芽生殖,无鞭毛及假丝。

图1 菌株11Z1的菌落形态及显微形态(400倍)
Fig.1 Colony morphology and micromorphology of strain 11Z1
2.3.2 菌株11Z1的分子生物学鉴定
将菌株11Z1测序结果在NCBI进行BLAST比对,并采用邻接法构建系统发育树,结果如图2所示。根据BLAST比对,菌株11Z1与Cyberlindnera fabianii AMC CF002(KU962046.1)相似性达到99.83%,且在系统发育树中聚于同一分支,可以确定菌株11Z1为Cyberlindnera fabianii。此种酵母并非常见的生香酵母,多存在于水果之中[19-23],国内外对此种酵母生香性能的研究较少,深入研究具有一定的价值。

图2 采用邻接法构建菌株11Z1与相关分类群系统发育树
Fig.2 Neighbor-joining phylogenetic tree of strain 11Z1 and related taxa constructed
注:Bar表示每单位核苷酸替换数为0.02
2.4 菌株11Z1发酵主要风味物质分析
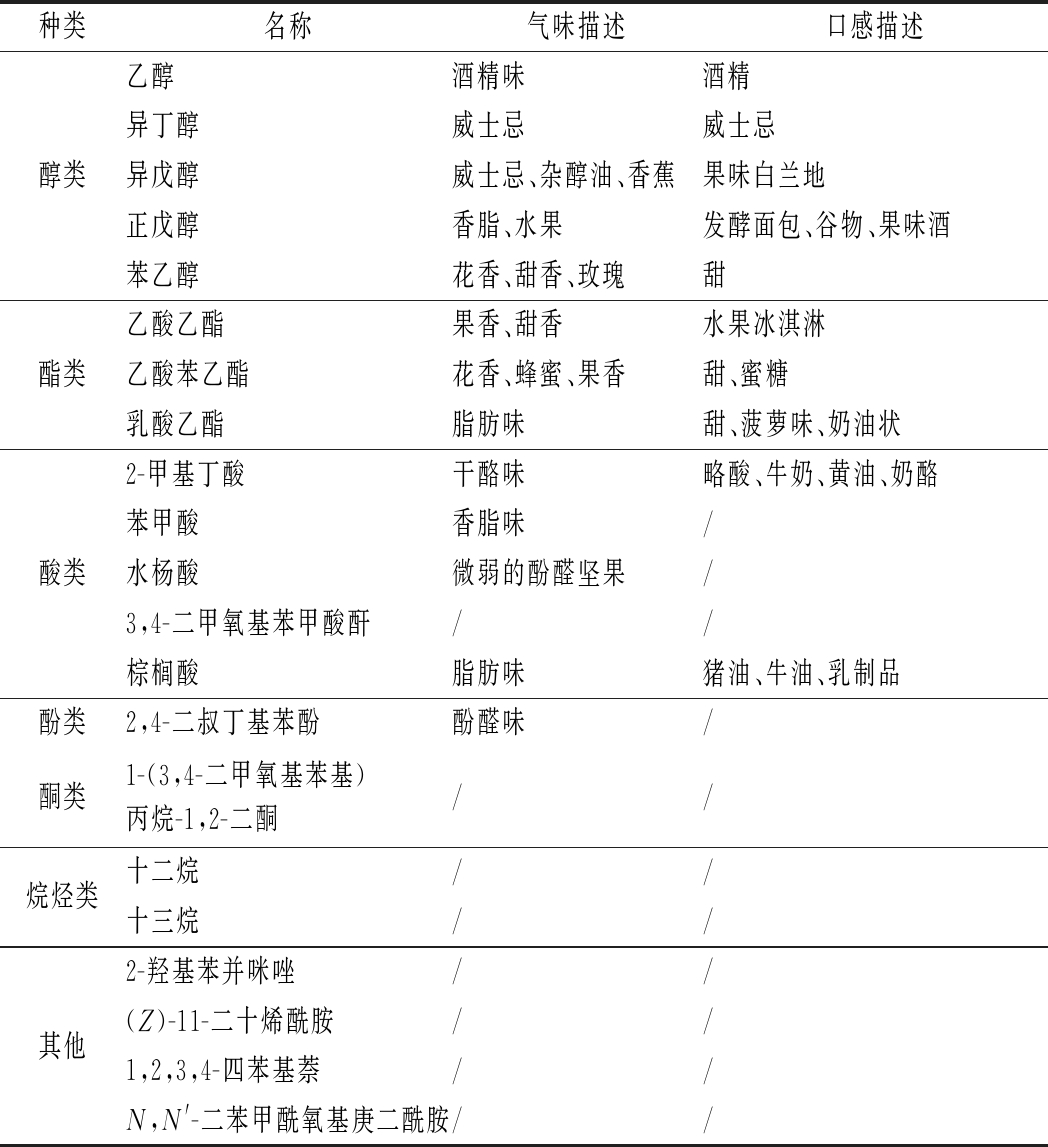
利用GC-MS对复筛得到的菌株11Z1的发酵液进行发酵代谢风味物质分析,结果如表4所示。菌株11Z1酿造米酒产生的主要风味物质共21种,包括醇类5种、酯类3种、酸类5种、酚类1种、酮类1种、烷烃类2种、其他类4种,其中异丁醇、异戊醇、正戊醇、苯乙醇、乙酸乙酯、乙酸苯乙酯、乳酸乙酯、苯甲酸和2-甲基丁酸都是酒类发酵中常见香味物质[24-25],对增加酒的香气及酒体风格的形成具有积极作用。
2.5 添加不同的前体物对菌株11Z1酿造米酒香气成分的影响
在培养基中添加不同的前体物(乙酸、L-苯丙氨酸和L-乳酸),以体积分数10%的接种量接种菌株11Z1,30 ℃、150 r/min培养10 d,研究前体物对菌株11Z1发酵米酒香气成分的影响。
2.5.1 添加乙酸对菌株11Z1酿造米酒乙酸乙酯积累量的影响
乙酸乙酯具有果香味,对酒的风味起着重要作用。可尝试通过添加乙酸乙酯前体物来增加乙酸乙酯的含量。本研究通过在发酵培养基中分别添加0%、0.1%、0.2%、0.3%、0.4%、0.5%(体积分数)的乙酸,每天测定发酵液中乙酸乙酯的积累量,研究乙酸对菌株11Z1发酵米酒香气成分的影响,结果如图3所示。
表4 C.fabianii 11Z1发酵主要风味物质
Table 4 Main flavor compounds of C.fabianii 11Z1
种类名称气味描述口感描述醇类乙醇酒精味酒精异丁醇威士忌威士忌异戊醇威士忌、杂醇油、香蕉果味白兰地正戊醇香脂、水果发酵面包、谷物、果味酒苯乙醇花香、甜香、玫瑰甜酯类乙酸乙酯果香、甜香水果冰淇淋乙酸苯乙酯花香、蜂蜜、果香甜、蜜糖乳酸乙酯脂肪味甜、菠萝味、奶油状酸类2-甲基丁酸干酪味略酸、牛奶、黄油、奶酪苯甲酸香脂味/水杨酸微弱的酚醛坚果/3,4-二甲氧基苯甲酸酐//棕榈酸脂肪味猪油、牛油、乳制品酚类2,4-二叔丁基苯酚酚醛味/酮类1-(3,4-二甲氧基苯基)丙烷-1,2-二酮//烷烃类十二烷//十三烷//其他2-羟基苯并咪唑//(Z)-11-二十烯酰胺//1,2,3,4-四苯基萘//N,N'-二苯甲酰氧基庚二酰胺//
注:“/”表示无描述
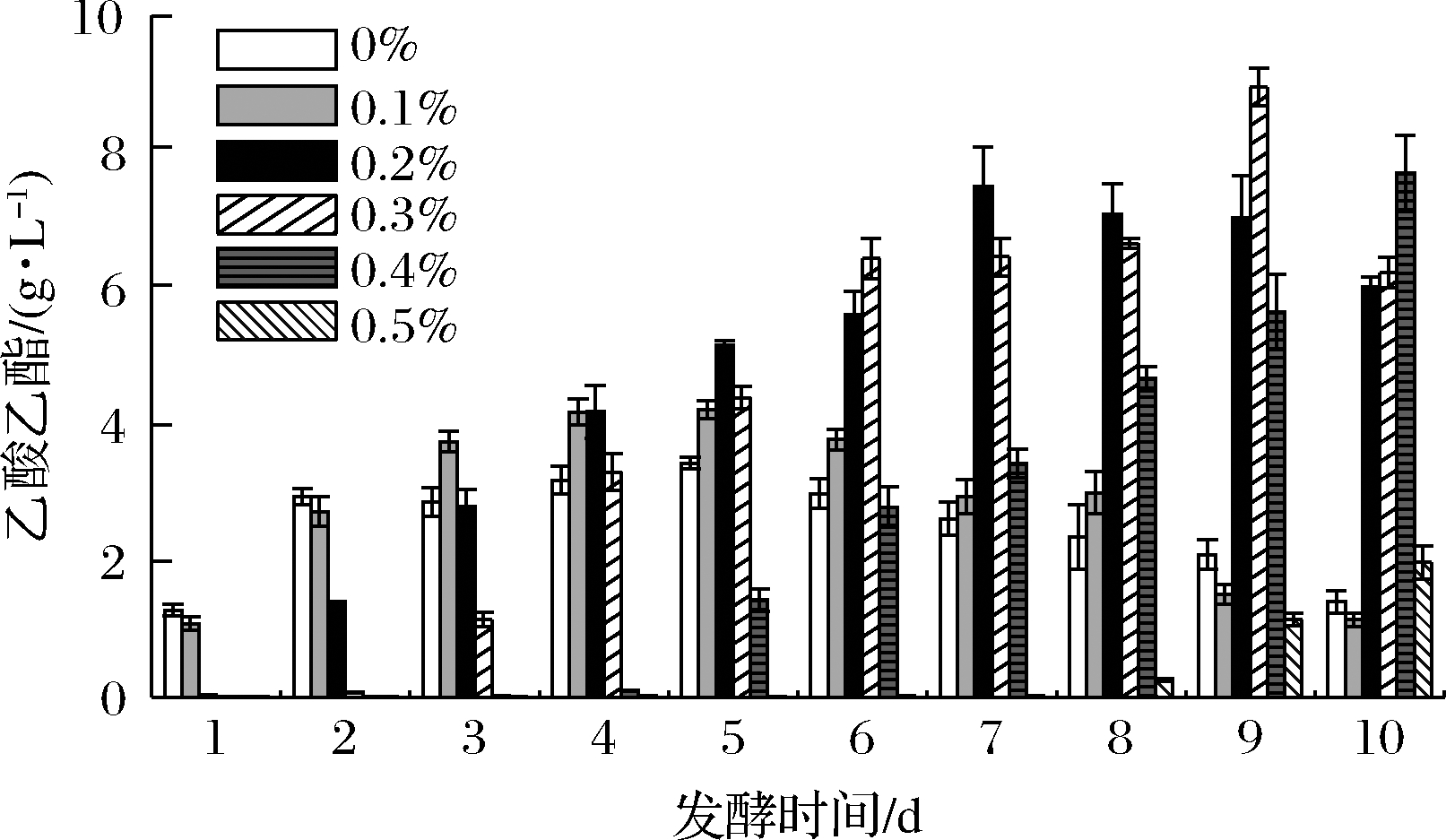
图3 外源添加乙酸酿造米酒过程中乙酸乙酯积累量
Fig.3 Accumulation of ethyl acetate during fermenting rice wine with the addition of acetic acid
由图3可知,不添加乙酸进行发酵时,发酵5 d乙酸乙酯积累量达到最大值,为(3.43±0.89)g/L。加入0.1%、0.2%、0.3%、0.4%、0.5%(体积分数)的乙酸进行发酵时,分别发酵5、7、9、10和10 d乙酸乙酯积累量达到最大值,分别为(3.78±0.15)、(7.49±0.58)、(8.95±0.28)、(7.69±0.55)和(1.98±0.24)g/L,除添加0.5%乙酸外,乙酸乙酯最高积累量均大于不添加时,依次提高了10.01%、118.06%、160.71%和123.84%。基本符合积累量逐天上升而后下降的趋势。由此可知,添加体积分数0.3%的乙酸,发酵9 d更加有利于乙酸乙酯的积累。
2.5.2 添加L-苯丙氨酸对菌株11Z1酿造米酒β-苯乙醇积累量的影响
微生物细胞中的艾利希途径可使L-苯丙氨酸通过氨基酸的转氨作用生成苯丙酮酸,再脱羧成苯乙醛,而后生成β-苯乙醇,或在脱羧酶作用下形成苯乙胺,再通过氧化形成苯乙醛,进而生成β-苯乙醇[26-28]。在发酵过程中可尝试通过添加L-苯丙氨酸,利用微生物代谢提升β-苯乙醇的含量。本研究在发酵培养基中分别添加0、2、4、6、8和10 g/L L-苯丙氨酸,每天测定发酵液中β-苯乙醇的积累量,研究L-苯丙氨酸对菌株11Z1发酵米酒香气成分的影响,结果如图4所示。

图4 外源添加L-苯丙氨酸酿造米酒过程中β-苯乙醇积累量
Fig.4 Accumulation of β-phenylethanol during fermenting rice wine with the addition of L-phenylalanine
由图4可知,不添加L-苯丙氨酸进行发酵时,β-苯乙醇积累量明显低于其他处理,最大值达到(0.36±0.015)g/L,且发酵后每天的β-苯乙醇积累量并无明显变化。当培养基中加入2、4、6、8和10 g/L的L-苯丙氨酸,分别在发酵4、4、5、4和4 d时,β-苯乙醇积累量达到最高,分别为(0.96±0.05)、(1.07±0.01)、(1.08±0.06)、(1.14±0.05)和(1.09±0.04)g/L,基本符合先增加而后减少并趋于稳定的趋势,与不添加相比,最大积累量分别提高了166.39%、197.39%、199.09%、215.48%和201.00%,由此可知,添加8 g/L的L-苯丙氨酸,发酵4 d更加有利于β-苯乙醇的积累。
2.5.3 添加L-乳酸对菌株11Z1酿造米酒乳酸乙酯积累量的影响
酒中的乳酸乙酯具有消除水味、增加浓厚感的作用,对酒的风味尤其是口感起着重要作用。可尝试添加乳酸乙酯前体物乳酸来增加乳酸乙酯的含量,本研究在发酵培养基中分别添加体积分数为0%、1%、2%、3%、4%和5%的L-乳酸,每天测发酵液中乳酸乙酯积累量,研究乳酸对菌株11Z1米酒发酵香气成分的影响,结果如图5所示。

图5 外源添加L-乳酸酿造米酒过程中乳酸乙酯积累量
Fig.5 Accumulation of ethyl lactate during fermenting rice wine with the addition of L-lactic acid
由图5可知,不添加L-乳酸进行发酵时,发酵4 d乳酸乙酯积累量达到最大值,为(0.08±0.009)g/L。加入体积分数为0.1%、0.2%、0.3%、0.4%和0.5%L-乳酸进行发酵时,分别在发酵5、5、6、8和9 d达到最大值,积累量分别为(0.13±0.014)、(0.14±0.010)、(0.16±0.014)、(0.19±0.014)和(0.16±0.008)g/L,与不添加相比最大积累量依次提高了64.21%、75.52%、107.08%、144.04%和103.78%。基本符合积累量逐天上升达到最大值而后下降的趋势。由此可知,添加体积分数0.4%的L-乳酸,发酵8 d更加有利于乳酸乙酯的积累。
目前消费者更加关注天然产品,欧洲国家法律规定,从生产原料到最终产品都是“天然的”,才可以称“天然”。当前,市场上的乙酸、L-苯丙氨酸和L-乳酸基本上都是采用微生物发酵法或酶法生产[29-31],天然且价格低,适用于生产。采用菌株11Z1发酵米酒,同时加入天然前体物或前体物产生菌,能达到提高米酒香气成分含量的效果,可同时满足消费者对产品风味及产品“天然”性的要求,具有良好的市场发展前景。
3 结论
从不同来源的酒曲及水果中通过嗅闻法初筛得到6株产香味突出的菌株,通过复筛得到产乙酸乙酯和β-苯乙醇均突出且具有产乳酸乙酯和乙醇能力的菌株11Z1,经鉴定菌株11Z1为Cyberlindnera fabianii。
对菌株11Z1进行发酵风味物质分析,主要风味物质共21种,包括醇类5种、酯类3种、酸类5种、酚类1种、酮类1种、烷烃类2种和其他类4种,对增加酒的香气,酒体风格的形成具有积极作用。
分别在培养基中添加前体物乙酸、L-乳酸及L-苯丙氨酸,研究其对菌株11Z1发酵风味物质的影响,结果表明,添加体积分数为0.3%的乙酸发酵9 d,乙酸乙酯积累量最高,达到(8.95±0.28)g/L;添加8 g/L的L-苯丙氨酸发酵4 d,β-苯乙醇积累量最高,达到(1.14±0.05)g/L;添加体积分数为0.4%的L-乳酸发酵8 d,乳酸乙酯积累量最高,达到(0.19±0.014)g/L。与不添加前体物相比,乙酸乙酯、β-苯乙醇和乳酸乙酯最高积累量分别提高了160.71%、215.48%和144.04%。
[1] 唐取来.米香型白酒新工艺的研究[D].天津:天津科技大学,2016.
TANG Q L.Research of novel technique in rice-flavour liquor[D].Tianjin:Tianjin University of Science and Technology,2016.
[2] 吴轩德. 筛选多菌种发酵提升米酒特征香气物质含量的研究[D].广州:华南理工大学,2018.
WU X D.Study on improving the content of characteristic aroma substances in rice wine by screening multi-strain fermentation[D].Guangzhou:South China University of Technology,2018.
[3] 李婷, 陈景桦,马得草,等.优选非酿酒酵母与酿酒酵母在模拟葡萄汁发酵中生长动力学及酯酶活性分析[J].食品科学,2017,38(22):60-66.
LI T,CHEN J H,MA D C,et al.Growth kinetics and esterase activities of selected non-Saccharomyces yeast and Saccharomyces cerevisiae in the fermentation of model grape juice[J].Food Science,2017,38(22):60-66.
[4] AVILA O M,S NCHEZ A,FONT X,et al.2-phenylethanol (rose aroma) production potential of an isolated Pichia kudriavzevii through solid-state fermentation[J].Process Biochemistry,2020,93:94-103.
NCHEZ A,FONT X,et al.2-phenylethanol (rose aroma) production potential of an isolated Pichia kudriavzevii through solid-state fermentation[J].Process Biochemistry,2020,93:94-103.
[5] ROJAS V,GIL J V,PI AGA F,et al.Studies on acetate ester production by non-Saccharomyces wine yeasts[J].International Journal of Food Microbiology,2001,70(3):283-289.
AGA F,et al.Studies on acetate ester production by non-Saccharomyces wine yeasts[J].International Journal of Food Microbiology,2001,70(3):283-289.
[6] 王凤梅, 张邦建,岳泰新.内蒙古西部地区野生葡萄酒相关酵母发酵及产酯能力分析[J].南方农业学报,2019,50(4):825-830.
WANG F M,ZHANG B J,YUE T X.The ability of fermentation and esters production of wild winemaking yeasts isolated from the western district of Inner Mongolia[J].Journal of Southern Agriculture,2019,50(4):825-830.
[7] GAMERO A,QUINTILLA R,GROENEWALD M,et al.High-throughput screening of a large collection of non-conventional yeasts reveals their potential for aroma formation in food fermentation[J].Food Microbiology,2016,60:147-159.
[8] 尤雅, 段长青,燕国梁.扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J].食品科学,2018,39(20):157-165.
YOU Y,DUAN C Q,YAN G L.Effects of mixed fermentation of Candida humilis and Saccharomyces cerevisiae on ethanol content and aroma of wine[J].Food Science,2018,39(20):157-165.
[9] FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnology & Biotechnological Equipment,2018:1-10.DOI:10.1080/13102818.2018.1492355.
[10] 谭才邓, 王文文,朱美娟,等.1株耐高温高盐生香酵母的选育及特性分析[J].食品与发酵工业,2016,42(3):92-96.
TAN C D,WANG W W,ZHU M J,et al.Screening and characterization of aroma yeast with thermo-tolerant and salt-tolerance[J].Food and Fermentation Industries,2016,42(3):92-96.
[11] 陈强, 朱新贵,曾小波.酱醪中产香酵母菌筛选及用于低盐固态发酵酱油增香研究[J].中国酿造,2011,30(6):137-141.
CHEN Q,ZHU X G,ZENG X B.Isolation of the aroma-producing yeast from soy sauce mash and its application for improving the flavor of low-salt solid-fermentation soy-sauce[J].China Brewing,2011,30(6):137-141.
[12] 杜雯, 王中伟,孟凡冰,等.酱油酿造用产香酵母的选育研究进展[J].中国调味品,2019,44(11):179-182.
DU W,WANG Z W,MENG F B,et al.Research progress on breeding of aroma-producing yeast for soy sauce brewing[J].China Condiment,2019,44(11):179-182.
[13] 陈嘉, 邢晓莹,冯志宏,等.山西老陈醋酿造过程中产酯酵母的筛选及产香特性分析(英文)[J].食品科学,2019,40(16):144-151.
CHEN J,XING X Y,FENG Z H,et al.Screening and aroma characteristics of ester-producing yeasts as starter cultures for Shanxi aged vinegar[J].Food Science,2019,40(16):144-151.
[14] 仇冬. 保宁醋醋曲中产香酵母鉴定及挥发性成分解析[J].食品安全导刊,2016 (15):107-108.
QIU D.Identification of aroma producing yeast and analysis of volatile components in Baoning vinegar koji[J].China Food Safety Magazine,2016 (15):107-108.
[15] SOLIERI L,GIUDICI P.Yeasts associated to traditional balsamic vinegar:Ecological and technological features[J].International Journal of Food Microbiology,2008,125(1):36-45.
[16] 唐红梅, 王浩文,吴华昌,等.川南腌菜耐盐生香酵母的筛选、鉴定及特性[J].食品科学,2020,41(12):150-157.
TANG H M,WANG H W,WU H C,et al.Screening,identification and characterization of aroma-producing and salt-tolerant yeast strains from pickles from south Sichuan,China[J].Food Science,2020,41(12):150-157.
[17] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
WEI J C.Manual of fungal identification[M].Shanghai:Shanghai Scientific & Technical Publishers,1979.
[18] 徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
XU L P.Screening and identification of ester-producing yeast in Luzhou Daqu and optimization of ester production conditions[J].China Brewing,2016,35(2):74-78.
[19] 张俊杰,尚益民,程大伟,等.河南安阳赤霞珠葡萄果表酵母菌的分离与鉴定[J].轻工学报,2018,33(3):39-44.
ZHANG J J,SHANG Y M,CHANG D W,et al.Isolation and identification of yeast strains from Cabernet Sauvignon in Anyang,He’nan province[J].Journal of Light Industry,2018,33(3):39-44.
[20] 何郁菲,刘淑娟,黄浩,等.杨梅贮藏期真菌的分离鉴定及基于ITS序列的聚类分析[J].食品安全质量检测学报,2018,9(18):85-90.
HE Y F,LIU S J,HUANG H,et al.Separation and identification of fungi from bayberry in storage period and its clustering analysis based on ITS sequence[J].Journal of Food Safety & Quality,2018,9(18):85-90.
[21] SURESH E R,ONKARAYYA H,ETHIRAJ S.A note on the yeast flora associated with fermentation of mango[J].Journal of Applied Microbiology,2008,52(1):1-4.
[22] 董凯锋, 安娜,李东乐,等.水塔老陈醋大曲酵母的分离鉴定及产乙醇和乙酸乙酯特性[J].食品工业科技,2016,37(10):213-216.
DONG K F,AN N,LI D L,et al.Isolation and identification of yeast in Daqu for aged vinegar production and their capacity for producing ethyl alcohol and ethyl acetate[J].Science and Technology of Food Industry,2016,37(10):213-216.
[23] VAN RIJSWIJCK I M H,VAN MASTRIGT O,PIJFFERS G,et al.Dynamic modelling of brewers’ yeast and Cyberlindnera fabianii co-culture behaviour for steering fermentation performance[J].Food Microbiology,2019,83(oct):113-121.
[24] 蔡际豪. 不同工艺绍兴黄酒风味比对及传统绍兴黄酒风味表征研究[D].杭州:浙江工业大学,2020.
CAI J H.Flavor comparison of Shaoxinng huangjiu with different processes and flavor characterization of traditional Shaoxing huangjiu[D].Hangzhou:Zhejiang University of Technology,2020.
[25] 胡武瑶, 杨昳津,窦慧,等.不同麦曲酿造黄酒中挥发性风味物质的代谢差异[J].食品与发酵工业,2020,46(8):226-233.
HU W Y,YANG Y J,DOU H,et al.Metabolic differences of volatile flavor compounds in Huangjiu fermented with different wheat Qu[J].Food and Fermentation Industries,2020,46(8):226-233.
[26] 杨霄, 崔志峰.酵母生物转化生产2-苯乙醇的研究进展[J].应用与环境生物学报,2006(1):140-144.
YANG X,CUI Z F.Progress in 2 phenylethanol production by biotransformation with yeast[J].Chinese Journal of Applied and Environmental Biology,2006(1):140-144.
[27] 丁东栋, 崔志峰,徐翔,等.生物转化法合成2-苯乙醇的研究进展[J].工业微生物,2017,47(2):53-60.
DING D D,CUI Z F,XV X,et al.Research progress in biotransformation production of 2-phenylethanol[J].Industrial Microbiology,2017,47(2):53-60.
[28] GU Y,MA J B,ZHU Y L,et al.Refactoring ehrlich pathway for high-yield 2-phenylethanol production in Yarrowia lipolytica[J].ACS synthetic biology,2020,9(3):623-633.
[29] TANAWUT N,POONSUK P,CHONTICHA L,et al.Bioconversion of oil palm trunk residues hydrolyzed by enzymes from newly isolated fungi and use for ethanol and acetic acid production under two-stage and simultaneous fermentation[J].Waste and Biomass Valorization,2020,11(10):1 333-1 347.
[30] 张清华, 李莎,廉政,等.利用DNA重组技术生产L-苯丙氨酸的研究[J].天津农学院学报,2020,27(2):38-43.
ZHANG Q H,LI S,LIAN Z,et al.Study on production of L-phenylalanine by DNA recombination technology[J].Journal of Tianjin Agricultural University,2020,27(2):38-43.
[31] MARTINEZ-TRUJILLO M A,BAUTISTA-RANGEL K,GARCIA-RIVERO M,et al.Enzymatic saccharification of banana peel and sequential fermentation of the reducing sugars to produce lactic acid[J].Bioprocess and Biosystems Engineering,2020,43(3):413-427.