黄曲霉毒素是一类广泛分布于自然界且具有极强致畸性、致癌性、生理代谢毒性的真菌毒素,它主要为黄曲霉(Aflatoxin flavus)和寄生曲霉(Aspergillus parasiticus)在潮湿适宜的环境中产生聚酮反应生成的次级代谢产物[1-2]。黄曲霉毒素性质稳定,裂解温度在268 ℃以上,且在酸性及中性条件下稳定,在碱性条件(pH 8.5以上)容易分解。目前发现的18种黄曲霉毒素中,以黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强,被国际癌症研究机构(International Agency for Research on Cancer,IARC)定为1类致癌物[3]。目前普遍应用于去除AFB1的方式有物理法、化学法,但设备投入成本高,破坏食品或饲料营养成分及口感,产生有毒副产物。生物去除法是目前AFB1脱毒方法的研究热点,其条件温和、特异性强、安全有效,且副产物毒性小或者无毒。今后生物降解法将逐步取代化学及物理方法,用于工业化去除饲料及食品中AFB1污染[4-6]。
生物法去除AFB1主要有降解、吸附、抑制3种模式。生物降解法去除AFB1机制是微生物代谢产生的酶或其他物质,破坏AFB1结构中的毒性位点,使AFB1难与蛋白、核酸结合,达到脱毒的效果[7-10]。国内报道,以香豆素为唯一碳源,筛选到一株对AFB1降解率为85.7%的嗜麦芽窄食单胞菌(Stenotrophomonas sp.),这是首次分离到能降解AFB1的单胞菌属菌株[11]。RAKSHARAO等[12]筛选到1株Bacillus licheniformis CFR1,AFB1降解率为93.57%,并通过检测降解产物,证明AFB1被降解为不同无荧光反应的物质,且致变性减弱。XIA等[13]通过研究1株枯草芽孢杆菌JSW-1降解机制,发现起降解作用的是菌株胞外蛋白或代谢分泌到胞外的酶类。多数降解AFB1菌株的降解机制是将AFB1转化为低毒性的AFD1、AFD2和AFD3,例如SAMUEL等[14]分离到1株恶臭假单胞菌(Pseudomonas putida)。国内目前关于生物降解AFB1的应用研究较少,生物降解AFB1的工业化应用受降解菌株本身、菌株耐受度、降解产物毒性等原因制约,生物降解AFB1代谢过程及终产物研究分析还欠缺,导致目前还未有大规模应用。
本研究团队从青藏高原极端环境中,以香豆素为唯一碳源,从易存在黄曲霉毒素降解菌的牦牛粪中筛选到耐受度好,降解率为83.5%,可以在pH 8.5条件下生长的菌株WTX1,经生理生化、核酸测序鉴定为枯草芽孢杆菌(Bacillus subtilis)。提取菌株降解后发酵液,采用超高效液相色谱串联三重四级杆质谱(ultra-performance liquid chromatography-MS/MS,UPLC-MS/MS)分析降解后副产物结构,研究菌株的代谢机制,初步探究菌株WTX1降解AFB1的终产物。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源
2019年4月~9月采集青藏高原牦牛粪,实验室前期分离出1株AFB1降解率为83.5%的芽孢杆菌属菌株WTX1,该菌株4 ℃保藏于营养琼脂斜面。
1.1.2 实验主要试剂
(1)培养基与试剂。胰蛋白胨大豆琼脂培养基TSA(CM168)、胰蛋白胨大豆肉汤TSB(CM301)、革兰氏染液(CM1001)、葡萄糖生化鉴定试剂盒(M105)、氨基酸脱羧酶系列生化鉴定试剂盒(M005)、磷酸盐缓冲液(CM1022)、硫化氢生化鉴定试剂盒(M035),北京陆桥技术公司;革兰氏阳性细菌鉴定卡(LOT:2421354203),生物梅里埃公司。
(2)基因提取、扩增试剂。细菌核酸提取试剂盒、核酸多重PCR扩增试剂盒,北京卓成惠生生物科技公司;核酸染料SYBR Gold,Thermo Fisher Scientific。
(3)质谱试剂。AFB1标准品,以色列 Fermentek;甲醇、二氯甲烷、苯、HCl,均为色谱纯(GR),Sigma;乙腈(色谱纯GR),Thermo Fisher Scientific;NaCl(分析纯AR),科密欧。
1.2 仪器与设备
VITEK 2 COMPACT 30全自动微生物生化鉴定系统,生物梅里埃美国股份有限公司;QTRAP 4500型超高效液相色谱质谱-质谱联用仪(UPLC-MS/MS),SCIEX公司;HF 1800 A2生物安全柜、2720型PCR仪、iBright CL750智能成像系统,Thermo Fisher Scientific;HF 1200 A2型生化培养箱,BD公司;CHEF Mapper XA脉冲场电泳仪,BIO-RAD公司;Allegra 64R高速冷冻离心机,贝克曼库尔特;PTY-623电子天平,梅特勒-托利多仪器上海有限公司。
1.3 实验方法
1.3.1 菌株WTX1的鉴定
1.3.1.1 形态鉴定
将实验室前期从青藏高原牦牛粪中筛选到降解AFB1率为83.5%的菌株WTX1,在TSA琼脂平板活化后,30 ℃培养36 ~72 h,观察菌株WTX1单菌落形态,用显微镜油镜观察革兰氏染色、芽孢染色后的菌株。
1.3.1.2 菌株生理生化鉴定
采用微生物全自动生化鉴定系统及传统微生物生化鉴定试剂盒,依据《伯杰氏细菌鉴定手册》[15],《常见细菌系统鉴定手册》[16],对WTX1菌株进行生理生化鉴定。
1.3.1.3 16S rRNA分析及系统发育树建立
参考唐璎等[17]的方法,采用细菌脱氧核酸提取扩增试剂盒提取WTX1菌株DNA,采用通用引物27F(5′-AGACTATGATCGTCGCACTG-3′),1541R(5′-AAGGAGGTGTACCTGCC-3′)扩增细菌16S rRNA保守序列,由北京卓成惠生生物科技公司提供。PCR反应体系见表1[17]:
表1 PCR反应体系条件
Table 1 PCR reaction system condition
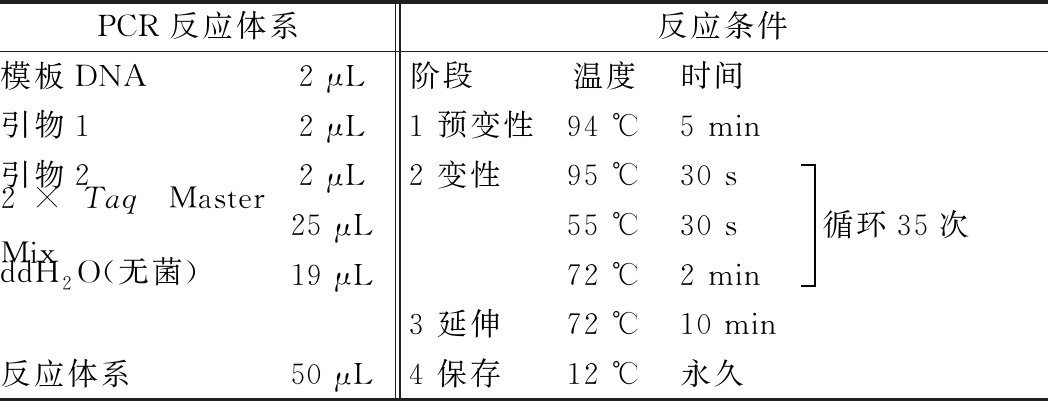
PCR反应体系反应条件模板DNA2 μL阶段温度时间引物12 μL1 预变性94 ℃5 min引物22 μL2 变性95 ℃30 s2×Taq Master Mix25 μL55 ℃30 sddH2O(无菌)19 μL72 ℃2 min3 延伸72 ℃10 min反应体系50 μL4 保存12 ℃永久循环35次
将PCR产物进行测序,测序结果提交到NCBI库进行BLAST分析,将目标序列与搜索到的同源序列在GenBank比对,用MEGA软件中的N-J法构建系统发育树。
1.3.2 发酵液中生物量测定
参考文献[17-18]的方法,取菌株WTX1以107 CFU/mL浓度接种于TSB液体培养基中,30 ℃恒温振荡培养,每隔6 h测定菌株发酵液生物量(OD600)值,以培养时间为横坐标,发酵液OD600值为纵坐标,测定发酵液中菌株生物量变化。
1.3.3 菌株WTX1各组分降解机制研究
参考GOMAA等[19]方法。取50 mL菌株WTX1发酵液,4 ℃,8 000 r/min离心15 min,分离上清液及菌体。再将菌体用无菌PBS洗涤、离心重复3次后加入50 mL无菌PBS,制备菌液浓度为107 CFU/mL的菌悬液。用上述方法制备得到的菌悬液,低温超声破碎15 min后,12 000 r/min离心10 min,收集上清液,经0.22 μm滤膜过滤得到菌株胞内液。将菌株上清液、菌悬液、胞内液分别加入AFB1-TSB溶液中(100 mL,质量浓度10 μg/mL),30 ℃避光孵育24 h后,分别检测AFB1降解率。
1.3.4 菌株WTX1降解率检测及产物分析
1.3.4.1 菌株降解率检测
将纯化的WTX1菌株,制备浓度为107 CFU/mL菌悬液(PBS,pH 7.4),取50 mL接种于10 μg/mL AFB1-TSB培养液中,30 ℃液态发酵,避光发酵72 h后,离心收集上清液(12 000 r/min,15 min,4 ℃)。取1 mL上清液,用等体积二氯甲烷涡旋振荡萃取3次,萃取液在55 ℃条件下氮吹干燥。用1 mL甲醇(GR)溶解沉淀,0.22 μm有机相滤膜过滤,涡旋混匀进样。用UPLC-MS/MS方法检测上清液中残留的AFB1含量,测量菌株AFB1降解率。按公式[17,20](1)计算:
(1)
式中:S,AFB1降解率,%;C,接种菌株发酵后样品中残留AFB1的峰面积;F,对照样品AFB1的峰面积。
1.3.4.2 菌株WTX1降解产物分析
参考李文明[21]的方法。取30 ℃避光发酵36 h菌株WTX1发酵液,离心(8 000 r/min,15 min,4 ℃)分离上清液。上清液样品前处理同1.3.4.1中步骤。采用UPLC-MS/MS方法得到发酵上清液总离子流图,再将总离子流图中峰值顶点的质谱图导入NTST MS search 2.2软件,查询菌株WTX1降解AFB1的终产物可能的结构,分析菌株的代谢过程,用AFB1-TSB标准溶液作对照。
1.3.4.3 UPLC-MS/MS条件
AFB1-TSB溶液:用V(苯)∶V(乙腈)=96∶4稀释AFB1标品,制备浓度为200 μg的溶液,加入20 mL TSB(调节pH中性)溶液中,水浴加热,挥发有机溶剂,最终AFB1-TSB溶液质量浓度为10 μg/mL。
UPLC-MS/MS条件:参考文献[17,22]的方法。色谱,C18柱(100 mm×2.1 mm,1.7 μm);柱箱温度40 ℃;流动相(乙酸铵/甲醇)液相色谱梯度洗脱,条件见表2。
表2 液相色谱梯度洗脱条件
Table 2 Gradient elution conditions for liquid chromatography
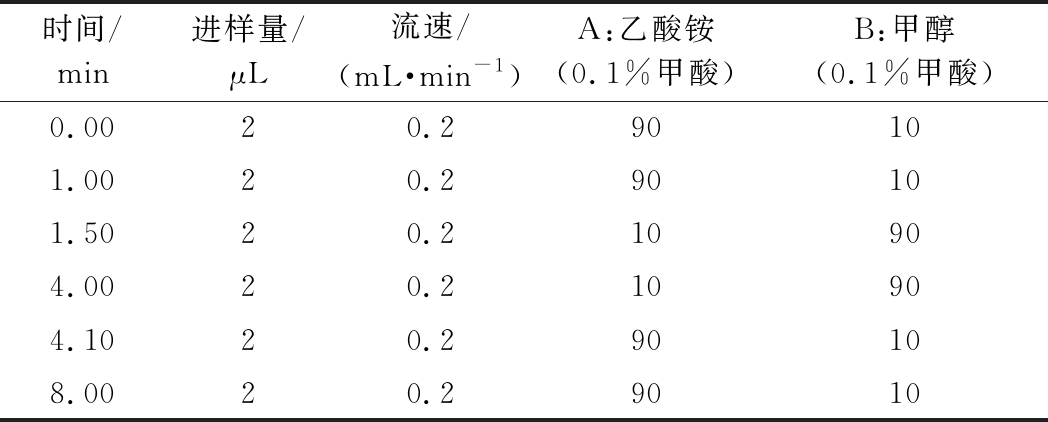
时间/min进样量/μL流速/(mL·min-1)A:乙酸铵(0.1%甲酸)B:甲醇(0.1%甲酸)0.0020.290101.0020.290101.5020.210904.0020.210904.1020.290108.0020.29010
参考唐璎等[17]等方法。质谱条件:电离方式:电喷雾电离(ESI+);检测方式:多反应监测模式(MRM);气帘气(CUR):35 psi;碰撞气(CAD):medium;离子化电压(IS):5 500 V;离子源温度:550 ℃;喷雾气(GSI):55 psi;辅助加热器(GS2):60 psi。MRM参数见表3。
表3 AFB1的质谱检测条件
Table 3 Mass spectrum parameter of AFB1

目标物保留时间/min母离子(m/z)子离子(m/z)去簇电压(DP)碰撞能量(CE)AFB14.71313.0285.1*14031240.914049
注:*为定量离子对
1.4 数据统计分析
实验重复3次,质谱图与NTST MS search 2.2软件中标准谱库比对[23]。
2 结果与分析
2.1 菌株WTX1形态学及生理生化鉴定
实验室前期分离到1株AFB1降解率为83.5%的芽孢杆菌属菌株WTX1,在TSA培养基上菌落呈乳黄色,表面粗糙不透明,褶皱隆起,菌株为革兰氏阳性菌,菌体中央或两侧有芽孢。菌株WTX1形态特征见图1,传统微生物生理生化反应及微生物全自动生化鉴定系统鉴定,菌株生理生化特征见表4。参考BA等[24]的方法,2株枯草芽孢杆菌分离鉴定结果及《伯杰氏细菌鉴定手册》,《常见细菌系统鉴定手册》、微生物全自动生化鉴定系统结果,如表5(95%置信为枯草芽孢杆菌Bacillus subtilis),初步鉴定菌株WTX1为枯草芽孢杆菌(Bacillus subtilis)。

a-菌落;b-革兰氏染色;c-芽孢染色
图1 菌株WTX1形态学特征
Fig.1 Morphological properties of WTX1
表4 菌株WTX1生理生化特征
Table 4 Physiological and biochemical characteristics of stain WTX1

项目结果项目结果GLU产酸+H2S-GLU产气-V-P实验-蛋白胨水-赖氨酸+甘露醇+鸟氨酸+苯丙氨酸-接触酶-乳糖-尿素+
表5 菌株WTX1全自动生化鉴定系统结果
Table 5 Results of automatic biochemical identification system for strain WTX1
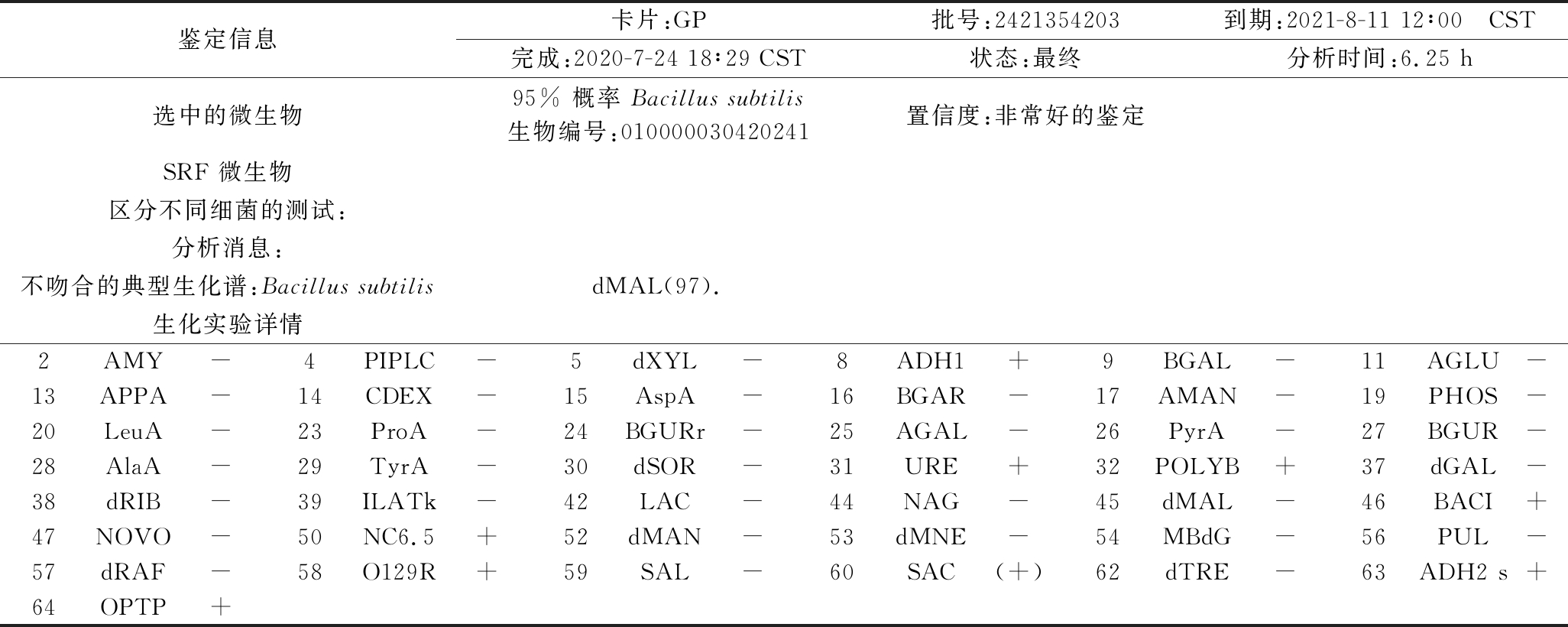
鉴定信息卡片:GP批号:2421354203到期:2021-8-11 12∶00 CST完成:2020-7-24 18∶29 CST状态:最终分析时间:6.25 h选中的微生物95% 概率 Bacillus subtilis生物编号:010000030420241置信度:非常好的鉴定SRF 微生物区分不同细菌的测试:分析消息:不吻合的典型生化谱:Bacillus subtilisdMAL(97).生化实验详情2AMY-4PIPLC-5dXYL-8ADH1+9BGAL-11AGLU-13APPA-14CDEX-15AspA-16BGAR-17AMAN-19PHOS-20LeuA-23ProA-24BGURr-25AGAL-26PyrA-27BGUR-28AlaA-29TyrA-30dSOR-31URE+32POLYB+37dGAL-38dRIB-39ILATk-42LAC-44NAG-45dMAL-46BACI+47NOVO-50NC6.5+52dMAN-53dMNE-54MBdG-56PUL-57dRAF-58O129R+59SAL-60SAC(+)62dTRE-63ADH2 s+64OPTP+
2.2 WTX1菌株16S rRNA基因序列分析及系统发育树构建
菌株16S rRNA保守基因,扩增出一条1 500 bp左右的基因片段,见图2。测序后序列运用BLAST程序比对,在GenBank中下载与WTX1菌株同源性较高的模式菌株序列。采用MEGA软件构建系统发育树,见图3。根据系统发育树结果,菌株WTX1与枯草芽孢杆菌(B.subtilis)(登录号:FJ867641.1)相似度达到99%,结合WTX1菌株形态学特征、生理生化特点,鉴定WTX1菌株为枯草芽孢杆菌(B.subtilis)。
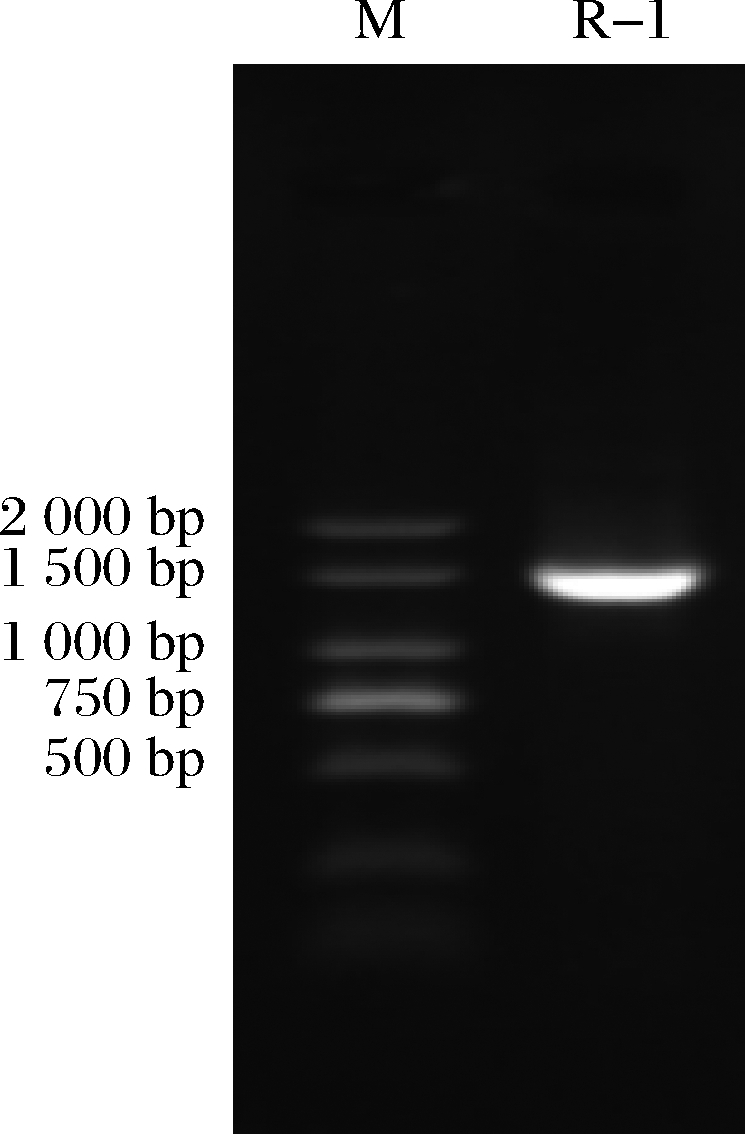
图2 WTX1菌株PCR 16SrRNA扩增产物
Fig.2 PCR amplification of 16S rRNA sequences of strain WTX1
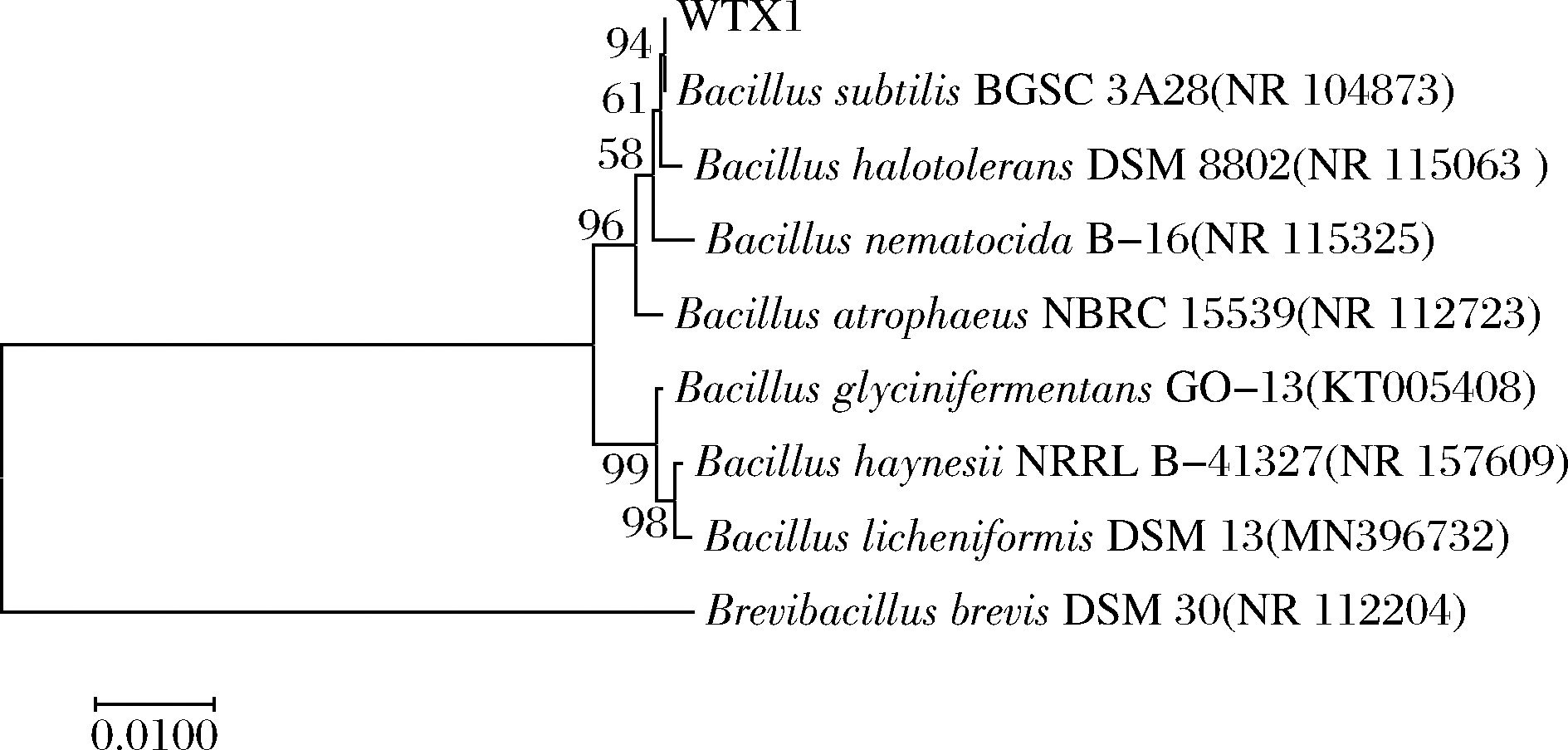
图3 菌株WTX1系统发育树
Fig.3 Phylogenetic tree of stain WTX1
2.3 菌株WTX1生物量与降解率动态变化
实验研究接种发酵72 h内菌株WTX1生物量变化与降解率之间的动态联系,结果如图4所示。菌株以107 CFU/mL浓度接种,发酵时间0~18 h,菌株生物量增长缓慢,处于延滞期,降解率处于缓慢累积的过程,发酵18 h,降解率为5.34%;发酵时间18~42 h,菌株生物量大量增长,处于对数期,降解率增长缓慢,发酵42 h,降解率为25.2%;发酵时间42~54 h,菌株生物量增长缓慢,处于平衡期,降解率迅速增长,发酵54 h,降解率为74.4%;发酵时间54~72 h,菌株生物量缓慢下降,处于衰亡期,降解率缓慢增长,发酵72 h,降解率为86.5%;菌株降解率在平衡期迅速增加,可能菌株降解AFB1是生长达到平衡时产生的次级代谢产物,研究进一步分离菌株,发酵上清液,胞内液,确定菌株降解AFB1起主要作用的组分。
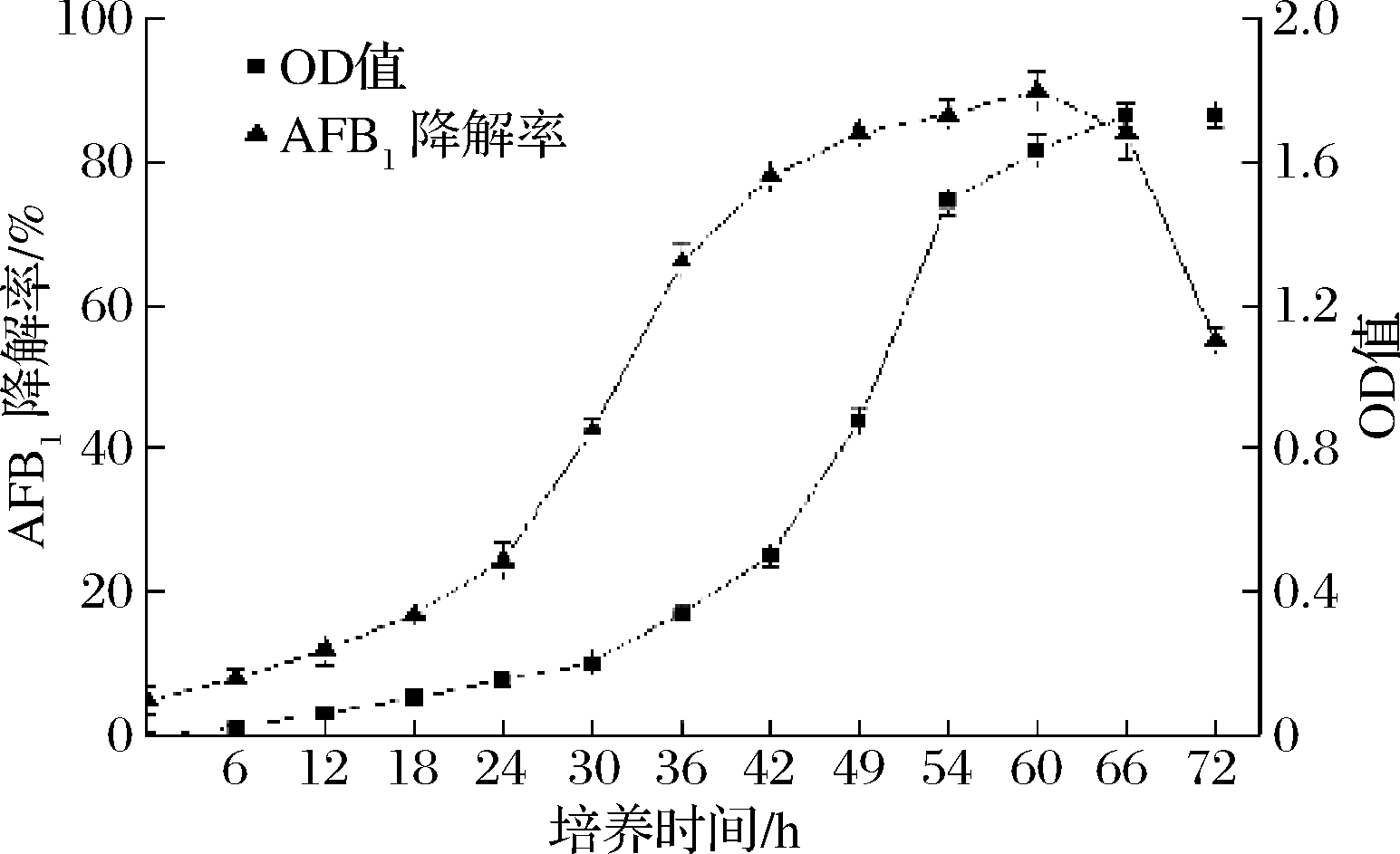
图4 菌株WTX1生物量与降解率动态变化
Fig.4 Dynamic change of biomass and degradation rate of WTX1
2.4 菌株WTX1各组分降解机制研究
通过提取活菌体、发酵上清液、胞内液,对质量浓度为10 μg/mL的AFB1溶液进行吸附实验,验证菌株WTX1吸附机制,结果如图5所示。发酵上清液的降解率最高,达到77.3%,活菌体和胞内液降解能力较弱,分别是5.3%和9.3%。由此验证,菌株AFB1降解能力主要依赖菌株代谢分泌到发酵液中的酶或其他胞外物质,不是菌体本身或者胞内代谢产物。

图5 菌株AFB1降解功能组分
Fig.5 Degradation rate of AFB1 in each component of strain
2.5 菌株WTX1降解AFB1产物分析
收集菌株降解液,通过UPLC-MS/MS方法采集降解上清液总离子流图,如图6所示,与AFB1-TSB标准溶液总离子流图及质谱图作对比(图7),扣除背景影响,总离子流图中峰度较高的有6个峰。提取降解上清液总离子流图中6个峰顶的质谱图(图8),导入NTST MS search 2.2软件作比对,根据保留时间与总离子流顶点的质谱图比较,保留时间在9.467 min的物质是AFB1。其余产物1~5质谱图与AFB1标准物质谱图比较,综合碎片离子大小,产物1~5与AFB1之间有若干碎片离子为同一物质离子,如:39,51,63,77等。由此判断,产物1~5与AFB1母体结构有着较高的同源性,可能都为菌株WTX1降解AFB1的产物。由NTST MS search 2.2软件比对结果可以得到,产物1~5可能的结构如图8所示,分别是产物1:C3H4,m/z:40.031 3;产物2:C6H6,m/z:78.046 9;产物3:C7H8O2,m/z:124.052 4;产物4:C8H6O2,m/z:134.036 77;产物5:C11H10O4,m/z:206.0579 09。WTX1将大分子AFB1降解为小分子物质,AFB1结构中导致基因突变和致癌突变的呋喃环二氢双键,以及致毒性的香兰素内脂环结构都被菌株WTX1破坏。WTX1降解AFB1产物很多,本实验只研究了总离子流图中峰值较高的5种产物,后续实验研究菌株WTX1降解AFB1产物是否具有致突变性。
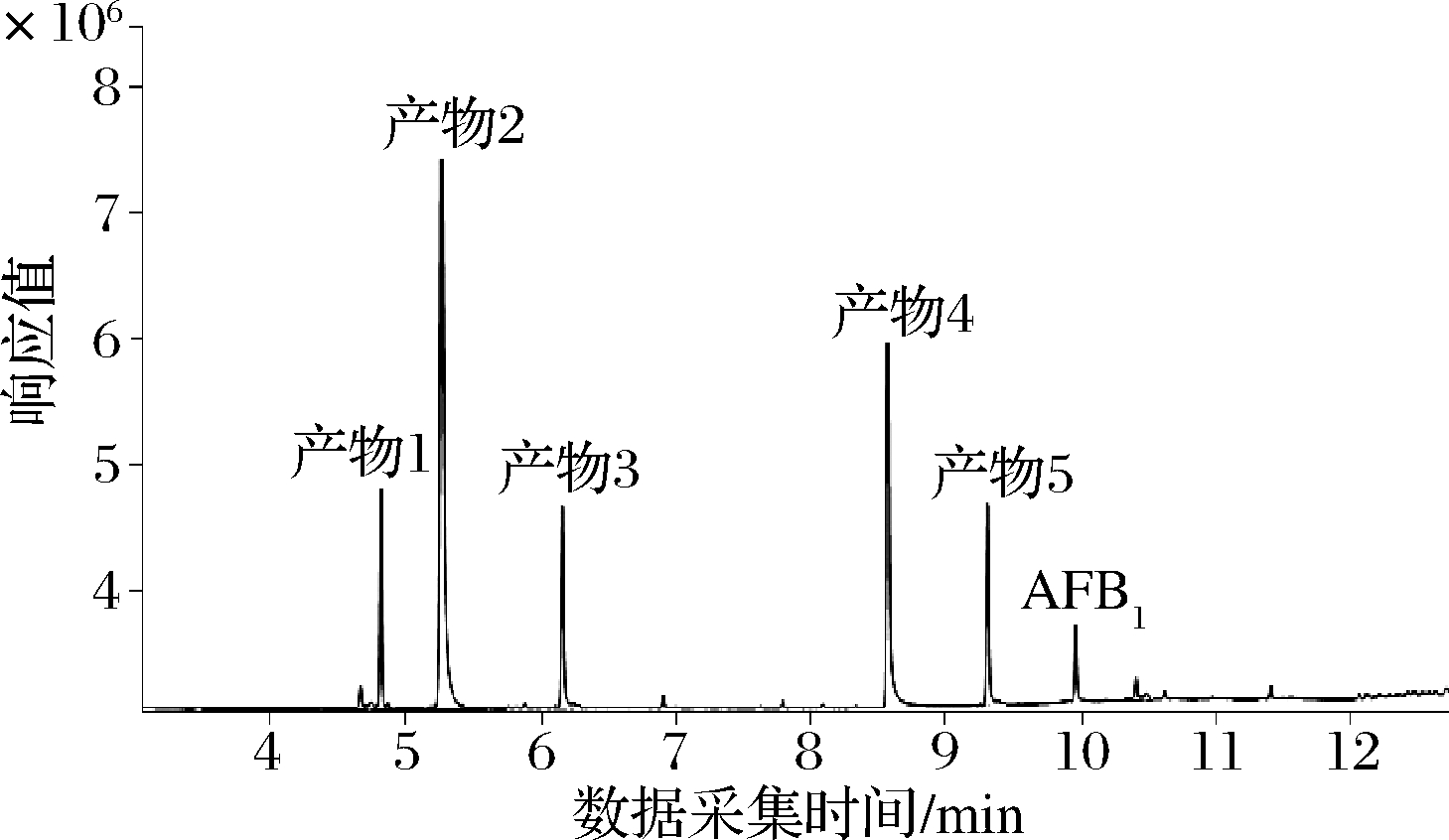
图6 菌株降解液总离子流图
Fig.6 Total ion chromatogram of strain degradation fluid
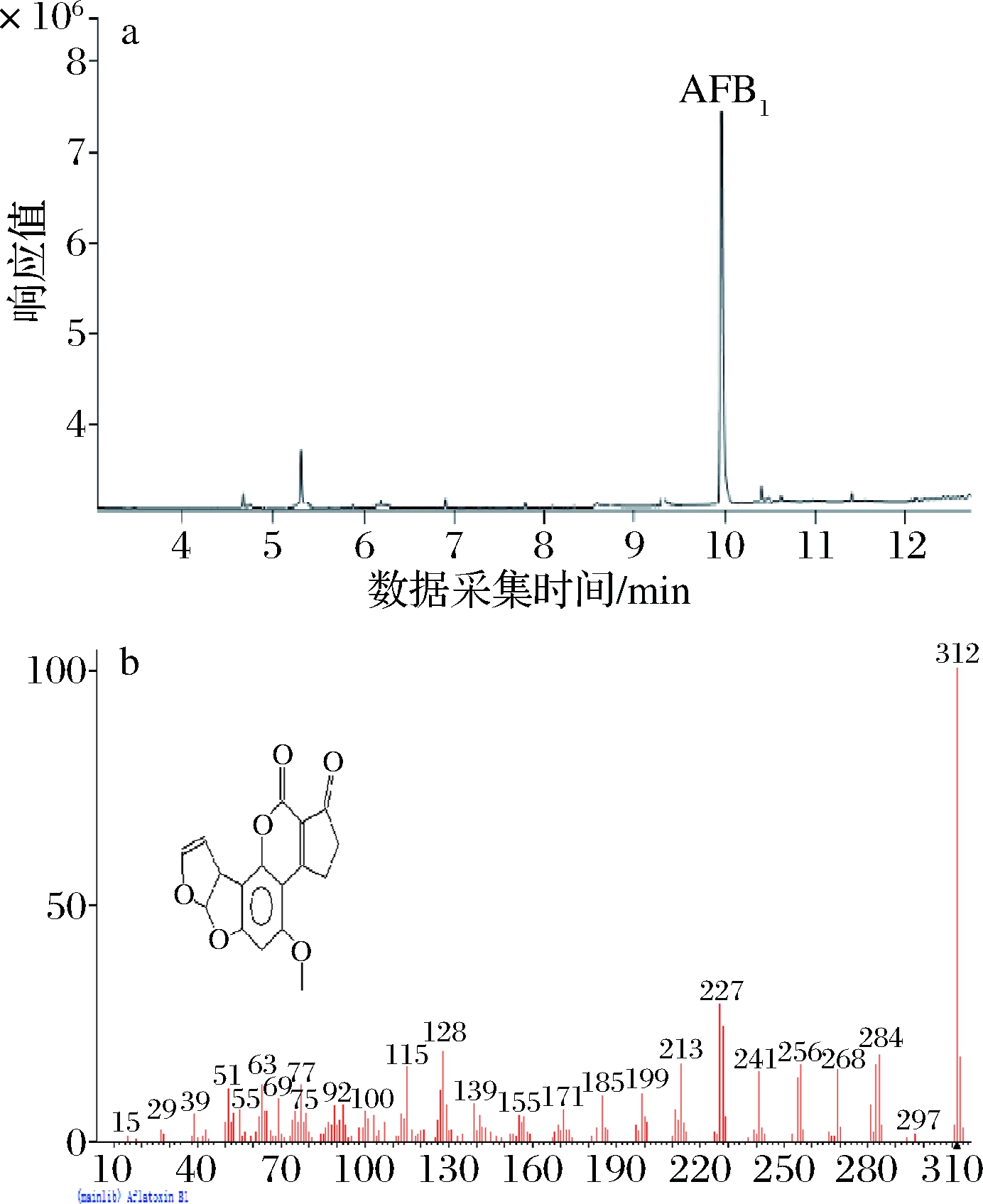
a-AFB1标准物质总离子流图;b-AFB1标准物质质谱图
图7 AFB1标准物质总离子流图及质谱图
Fig.7 Total ion chromatogram and mass spectrum of AFB1
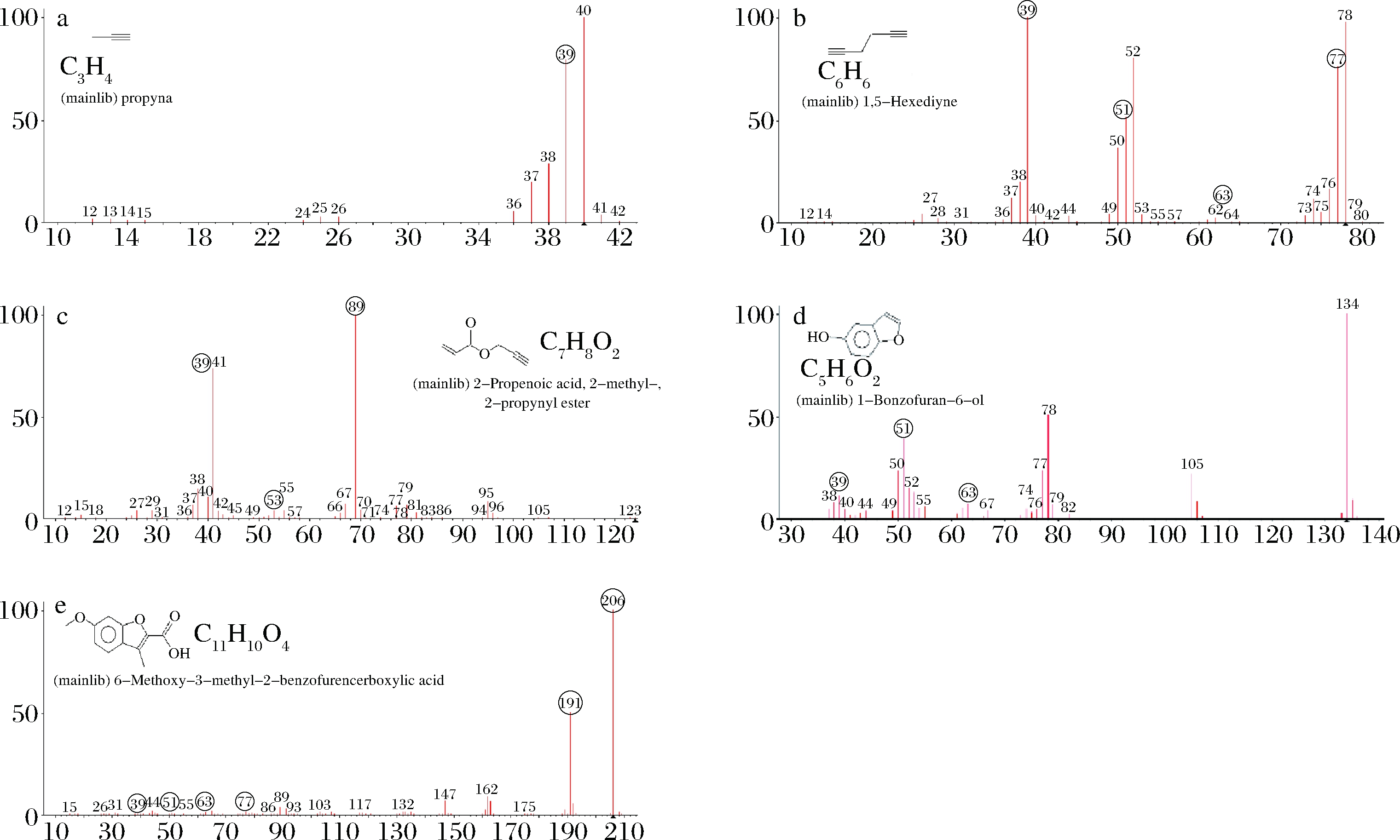
a-产物1;b-产物2;c-产物3;d-产物4;e-产物5
图8 降解上清液提取质谱图及产物结构图
Fig.8 Mass spectrogram of degradation supernatant extraction and product structure
3 结论与讨论
本研究以实验室前期筛选到的AFB1降解率高达83.5%的菌株WTX1为研究对象。通过16S rRNA及生化鉴定菌株WTX1是枯草芽孢杆菌。与ESHELLI等[25]筛选到一株降解率达96%的平红球菌菌株相比较,枯草芽孢杆菌为人及哺乳动物肠道益生菌,更具有食品安全优势。虽然菌株WTX1的降解率略低于前者,实验将进一步优化发酵条件,提高菌株降解率。
通过分析菌株各组分降解率,结合菌株生长曲线,菌株降解AFB1主要是生长过程产生的次级代谢产物作用,可能是菌株代谢到胞外的酶或其他物质。通过UPLC-MS/MS方法,采集降解液总离子流图,创新结合NTST MS search 2.2软件分析对比总离子流峰顶质谱图,得到WTX1菌株降解AFB1产生的5种产物结构。通过分析产物结构,菌株WTX1降解AFB1机制是破坏AFB1起致基因突变和致癌突变的呋喃环二氢双键结构,以及致毒性的香兰素内脂环结构,达到脱毒效果。
国内生物降解AFB1研究多数为筛选可降解AFB1菌株及优化发酵条件提高降解率,对降解产物研究较少。本研究首次利用质谱检测及NTST MS search 2.2软件分析的方法,研究菌株WTX1降解产物,分析菌株降解产物,初步探究菌株降解机制。生物降解AFB1脱毒,多数将AFB1大分子降解为小分子物质,并破坏AFB1的毒性位点结构,实验将进一步研究菌株WTX1降解产物对人及动物代谢的影响,以备工业化应用。
[1] 罗自生,秦雨,徐艳群,等.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学,2015,36(3):250-257.
LUO Z S,QIN Y,XU Y Q,et al.Recent progress in the biosynthesis,metabolism and toxicity of aflatoxins[J].Food Science,2015,36(3):250-257.
[2] KIM S,LEE H,LEE S,et al.Invited review:Microbe-mediated aflatoxin decontamination of dairy products and feeds[J].Journal of Dairy Science,2017,100(2):871-880.
[3] 赵萌,高婧,褚华硕,等.黄曲霉毒素B1的分子致毒机理及其微生物脱毒研究进展[J].食品科学,2019,40(11):235-245.
ZHAO M,GAO J,CHU H S,et al.Recent progress in research on toxicity mechanism and microbial detoxification of aflatoxin B1[J].Food Science,2019,40(11):235-245.
[4] 乔宏兴,姜亚乐,王永芬,等.黄曲霉毒素的危害及其脱毒方法研究进展[J].动物医学进展,2017,38(1):89-93.
QIAO H X,JIANG Y L,WANG Y F,et al.Progress on harm and detoxification methods of aflatoxin[J].Progress in Veterinary Medicine,2017,38(1):89-93.
[5] LIU R J,WANG R Q,LU J,et al.Degradation of AFB1 in aqueous medium by electron beam irradiation:Kinetics,pathway and toxicology[J].Food Control,2016,66:151-157.
[6] MOON Y S,KIM H M,CHUN H S,et al.Organic acids suppress aflatoxin production via lowering expression of aflatoxin biosynthesis-related genes in Aspergillus flavus[J].Food Control,2018,88:207-216.
[7] RASTEGAR H,SHOEIBI S,YAZDANPANAH H,et al.Removal of aflatoxin B1 by roasting with lemon juice and/or citric acid in contaminated pistachio nuts[J].Food Control,2017,71:279-284.
[8] 蔡俊,田尔诺,邵帅,等.黄曲霉毒素B1生物脱毒的研究进展[J].微生物学通报,2017,44(3):726-731.
CAI J,TIAN E N,SHAO S,et al.Progress in biological detoxification of aflatoxin B1[J].Microbiology China,2017,44(3):726-731.
[9] VERHEECKE C,LIBOZ T,MATHIEU F.Microbial degradation of aflatoxin B1:Current status and future advances[J].International Journal of Food Microbiology,2016,237:1-9.
[10] ADEBO O A,NJOBEH P B,GBASHI S,et al.Review on microbial degradation of aflatoxins[J].Critical Reviews in Food Science and Nutrition,2017,57(15):3 208-3 217.
[11] 李俊霞, 梁志宏,关舒,等.黄曲霉毒素B1降解菌株的筛选及鉴定[J].中国农业科学,2008,41(5):1 459-14 63.
LI J X,LIANG Z H,GUAN S,et al.Screening and identification of aflatoxin B1 degradation strains[J].Scientia Agricultura Sinica,2008,41(5):1 459-1 463
[12] RAKSHA RAO K,VIPIN A V,HARIPRASAD P,et al.Biological detoxification of aflatoxin B1 by Bacillus licheniformis CFR1[J].Food Control,2017,71:234-241.
[13] XIA X S,ZHANG Y,LI M Y,et al.Isolation and characterization of a Bacillus subtilis strain with aflatoxin B1 biodegradation capability[J].Food Control,2017,75:92-98.
[14] SAMUEL M S,SIVARAMAKRISHNA A,MEHTA A.Degradation and detoxification of aflatoxin B1 by pseudomonas putida[J].International Biodeterioration & Biodegradation,2014,86:202-209.
[15] GARRITY G M,BELL J A,LILBURN T G.Bergey’s manual of systematic bacteriology [M].Ninth Edition.New York:Springer New York Berlin Herdelberg,2004.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:318-419.
DONG X Z,CAI M Y.Manual for systematic identification of common bacteria[M].Beijing:Science Press,2001:318-419.
[17] 唐璎,孟宪刚,邓展瑞,等.西北酸菜中吸附黄曲霉毒素B1乳酸菌株的筛选鉴定及稳定性研究[J].食品与发酵工业,2020,46(15):60-65.
TANG Y,MENG X G,DENG Z R,et al.Screening and stability of an aflatoxin B1-adsorbing lactic acid bacterium isolated from pickled vegetable in northwest China[J].Food and Fermentation Industries,2020,46(15):60-65.
[18] XU L,AHMED M F E,SANGARE L,et al.Novel aflatoxin-degrading enzyme from Bacillus shackletonii L7[J].Toxins,2017,9(1):36.
[19] GOMAA E Z,ABDELALL M F,ELMAHDY O M.Detoxification of aflatoxin B1 by antifungal compounds from Lactobacillus brevis and Lactobacillus paracasei,isolated from dairy products[J].Probiotics and Antimicrobial Proteins,2018,10(2):201-209.
[20] SHUKLA S,PARK J H,CHUNG S H,et al.Ochratoxin a reduction ability of biocontrol agent Bacillus subtilis isolated from Korean traditional fermented food kimchi[J].Scientific Reports,2018,8(1):8 039.
[21] 李文明. 黄曲霉毒素B1生物降解产物的分离鉴定及其致突变性研究[D].南昌:南昌大学,2013.
LI W M.Separation and characteristics of the products derived from biodegraded aflatoxin B1 [D].Nanchang:Nanchang University,2013.
[22] 孟繁磊,宋志峰,牛红红,等.基于UPLC-MS-MS技术快速测定花生中4种黄曲霉毒素[J].中国油脂,2018,43(1):136-139.
MENG F L,SONG Z F,NIU H H,et al.Rapid determination of four kinds of aflatoxins in peanut by UPLC-MS-MS[J].China Oils and Fats,2018,43(1):136-139.
[23] 王宁.基于菌藻联合策略防控刺参圈水绵的研究[D].大连:大连理工大学,2019.
WANG N.Study on prevention and control of spirogyra in sea cucumber culture lagoon based on co-treatment strategy with mixed bacteria and microalgae[D].Dalian:Dalian University of Technology,2019.
[24] BA C,ZHANG L,ZHANG P,et al.Isolation,identification and characterization of two strains of Bacillus subtilis[J].Journal of South China Agricultural University,2017,38(3):46-51.
[25] ESHELLI M,HARVEY L,EDRADA E R,et al.Metabolomics of the bio-degradation process of aflatoxin B1 by actinomycetes at an initial pH of 6.0[J].Toxins (Basel),2015,7(2):439-456.