海参是药食同源的珍贵补品,具有高蛋白、低脂肪和低糖的特点[1]。受气候环境的影响,成熟海参的个体差异较大,较小个体的海参只能作为低值产品出售。随着海参逐年上升的消费趋势和日益扩大的养殖规模[2],小个体海参的高值化利用问题亟待解决。海参的个体大小与营养组成相关性不大[3],因此利用小个体海参开发保健食品或药品是其高值化利用的有效途径之一,如开发具备抗炎症[4]、抗凝血[5]、抗真菌[6]和增强机体免疫功能[7]等功效的口服液、功能饮料和胶囊等。
目前,关于海参促伤口愈合的研究十分有限。事实上,机体在创面愈合过程中需要大量的营养底物提供创面处细胞的合成和能量需求[8]。海参不仅富含胶原蛋白,还富含具有调节机体炎症反应[9]和免疫修复作用[10]的精氨酸、支链氨基酸以及各种微量元素,具有良好的促伤口愈合的潜力。但海参蛋白存在溶解性不佳和消化吸收性较差等问题。
本研究以小个体海参为原料,通过酶解获得较小的分子质量、易吸收的海参酶解物(sea cucumber hydrolysate,SCH),再开展动物实验对其进行功效验证,探究SCH对创面愈合的影响,以期为海参资源的综合高价值利用提供理论依据。
1 材料与方法
1.1 材料与试剂
海参,无锡天鹏海鲜市场;SD大鼠(SPF级、5周龄雄性),维通利华实验动物有限公司;风味蛋白酶(30 000 U/g)、水产蛋白酶(300 000 U/g),东恒华道生物科技有限责任公司;云南白药颗粒,云南白药集团股份有限公司;硫酸庆大霉素,敖东药业集团延吉股份有限公司;大鼠白细胞介素-8(interleukin-8,IL-8)、白细胞介素-10(interleukin-10,IL-10)、羟脯氨酸(hydroxyproline,Hyp)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮细胞生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的Elisa试剂盒,上海酶联生物科技有限公司;其他实验试剂均为分析纯,上海生物工程股份有限公司。
1.2 仪器与设备
料理机(AD-G888),德国GUGE公司;凯氏定氮仪(SKD-200),上海沛欧分析仪器有限公司;高效液相色谱仪(Agilent 1260),美国Agilent公司;冷冻离心机(Heraeus X1R)、酶标仪(Multiskan Sky),美国Thermo Scientific 公司;冷冻干燥机(BTP),美国SP Scientific公司;一次性活检打孔器(D=10 mm),圣诺图穿刺器材公司;等距平衡光拍摄支架,芯鲜数码公司;佳能单反相机(EOS 80D),日本Canon公司;生物显微镜(DM 2000),德国Leica公司。
1.3 实验方法
1.3.1 海参营养组成中有机物含量和氨基酸分析
参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》的凯氏定氮法测定粗蛋白含量;参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》的酸水解法测定粗脂肪含量;参考宋思暖等[11]方法提取海参粗多糖,并用苯酚-硫酸法[12]测定其含量;参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中酸水解法测定16种常见氨基酸的组成;参考DB 37/T 2094—2012《水产品中羟脯氨酸含量的测定 高效液相色谱法》测定羟脯氨酸的含量。
1.3.2 SCH制备
将鲜参洗净弃内脏,剪碎匀浆。匀浆物置于无菌发酵罐中,料液比为1∶4(g∶mL),加酶量10 000 U/g(水产蛋白酶和风味蛋白酶按照4∶6的酶活力比例混合形成复合酶),温度52 ℃。酶解1 h后灭酶并冷却,加入乙醇除杂[13],低温离心,保留上清液进行旋蒸浓缩和冷冻干燥,获得SCH备用。
1.3.3 SCH的分子质量分布测定
采用高效液相色谱法测定样品的分子质量分布情况,设定参数如下:色谱柱;TSK GEL 2000 SWXL (300 mm×7.8 mm);流动相,V(含体积分数0.1%三氯乙酸的乙腈)∶V(超纯水)=40∶60;流速0.5 mL/min;柱温30 ℃;检测波长220 nm;体积10 μL;样品质量浓度1 mg/mL;分析配件,2487紫外检测器和GPC分析软件。以标准品细胞色素C(Mw=12 384 Da)、抑肽酶(Mw=6 500 Da)、杆菌酶(Mw=1 422 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw=451 Da)和乙氨酸-乙氨酸-乙氨酸(Mw=189 Da)为对照。
1.3.4 动物实验分组及处理
1.3.4.1 动物实验分组
SD雄鼠90只,分为5组(n=18),包括模型组(Vehicle)、SCH低剂量(L-SCH)、中剂量(M-SCH)、高剂量(H-SCH)组和阳性组(云南白药颗粒,YNBY)[14]。将SCH用生理盐水复溶,其中低、中、高剂量按照0.25、0.50和1.00 g/kg的蛋白含量进行配制[15],过0.22 μm膜,现配现用。根据云南白药胶囊说明书推荐剂量和动物药理试验换算法则[16],阳性组的灌胃剂量为0.10 g/kg。以上5组每天的灌胃体积均为0.01 mL/g,模型组灌胃生理盐水,饲养期间对大鼠体重进行记录并观察健康状况。
1.3.4.2 全皮层切除模型的建立
检疫期结束后适应性灌胃5~7 d。大鼠造模前禁食16 h,按35 mg/kg的注射剂量腹腔注射质量分数为1%的戊巴比妥钠进行麻醉。除去大鼠背部毛发,用医用酒精消毒,在脊柱中部两侧的相同位置,用活检打孔器制作圆形伤口,制备全皮层切除伤口并视为第0天。术后,所有大鼠均接受10 000单位的硫酸庆大霉素腹腔注射避免感染,同时用拍照装置拍摄创面记录。造模后第1天起,每日对大鼠进行灌胃,于第4天、第8天和第12天分批取样(n=6)[16]。取样前进行创面拍摄,心脏取血,切取两侧新生伤口组织置于液氮中,结束取样后存于-80 ℃冰箱中备用。本次动物实验的伦理申请经过江南大学动物伦理委员会认可,审核编号为JN.No20191015S1051122。
1.3.5 伤口愈合率测定方法
采用等距平衡光拍摄装置对创面进行拍照,并用直角尺对照记录。用Adobe Photoshop 2020和 Image-Pro Plus 6.0软件计算大鼠创面面积来计算愈合率,按公式(1)计算伤口愈合率[18]:
伤口愈合率![]()
(1)
式中:S0,原始伤口面积,cm2;S,现存伤口面积,cm2。
1.3.6 组织切片染色分析
苏木精伊红染色(hematoxylin-eosin,H&E)和马森三色染色(Masson’s trichrome method,Masson)是组织病理学常用的分析方法,常用来观察皮肤中成纤维细胞增值、血管新生和胶原纤维排列等情况[19]。将皮肤组织用体积分数为4%的中性甲醛现配液固定,石蜡包埋并切片,分别进行H&E和Masson染色,在生物显微镜下观察并记录皮肤伤口的病理变化和纤维新生情况。
1.3.7 血液中炎症因子的Elisa分析
取待测血清在冰浴中解冻,根据Elisa试剂盒使用说明书进行样本预处理并测定IL-8和IL-10的含量。
1.3.8 组织中羟脯氨酸和生长因子的Elisa分析
取待测组织在冰浴中解冻,根据Elisa试剂盒使用说明书进行样本预处理,测定和计算Hyp、EGF、VEGF和bFGF的含量。
1.4 数据处理
采用SPSS 20软件里One-Way ANOVA方法下的LSD和Ducan’s multiple range test方法对试验数据进行分析,用不同的字母表示组间存在显著差异(P<0.05);用Origin 2017软件进行作图。
2 结果与分析
2.1 海参的营养组成
海参营养组成中的有机物主要是蛋白质、粗脂肪和粗多糖。通过实验测得,海参干基中蛋白质占比为(49.57±0.92)%,粗脂肪为(5.16±0.26)%,粗多糖为(4.02±0.24)%,可见海参营养物质中最主要的有机物为蛋白质,约占总有机物的85.00%,该结果与高菲[20]测得的结果相似,故海参是一种富含蛋白质的优质海产品。
海参的氨基酸组成及其含量如表1所示,海参中氨基酸含量较高的依次为谷氨酸(Glu)、甘氨酸(Gly)、天冬氨酸(Asp)、脯氨酸(Pro)、精氨酸(Arg)、羟脯氨酸(Hyp)和丙氨酸(Ala),这7种氨基酸可占总量的66.50%。其中,Pro和Hyp总占比可达14.80%,是胶原蛋白重要组成的氨基酸,且有文献报道胶原蛋白是皮肤的重要组成基质[21]。此外,Arg是条件必需氨基酸,含量为6.70%,具有调节创面愈合作用[9];缬氨酸(Val)、亮氨酸(Leu)和异亮氨酸(Ile)是支链氨基酸,总含量约为15.00%,具备免疫调节和机体修复的生理功能[10]。故海参富含多种与创面修复相关的营养物质,是一种潜在的具有促创面愈合功效的食品。
表1 海参的氨基酸组成
Table 1 Amino acid compositions of sea cucumber
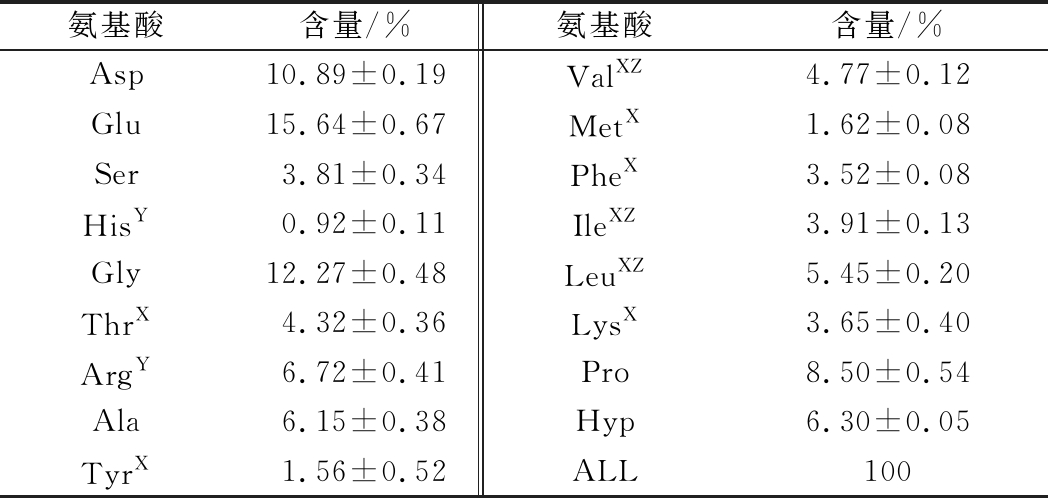
氨基酸含量/%氨基酸含量/%Asp10.89±0.19ValXZ4.77±0.12Glu15.64±0.67MetX1.62±0.08Ser3.81±0.34PheX3.52±0.08HisY0.92±0.11IleXZ3.91±0.13Gly12.27±0.48LeuXZ5.45±0.20ThrX4.32±0.36LysX3.65±0.40ArgY6.72±0.41Pro8.50±0.54Ala6.15±0.38Hyp6.30±0.05TyrX1.56±0.52ALL100
注:X-必需氨基酸;Y-条件必需氨基酸;Z-支链氨基酸
2.2 SCH的分子质量分布
SCH的分子质量分布结果如图1所示, SCH的分子质量<2 000 Da约占97.41%,其中<1 000 Da占88.70%,180~500 Da占50.80%,<180 Da占19.93%。已有研究报道,2~3个氨基酸组成的小肽吸收效率最高且生理活性最强,可通过PepT1被小肠黏膜直接吸收利用[22]。由图1可知,经酶解后的样品中180~500 Da的肽段含量最高,这其中主要为二肽和三肽[23]。因此,与未酶解的海参大分子蛋白相比,SCH更易被人体消化吸收和发挥生理功效。

图1 SCH的分子质量分布图
Fig.1 Molecular mass distribution of SCH
2.3 SCH对SD大鼠体重的影响
通过监测各组大鼠的体重变化,考察灌胃SCH的安全性。由图2可知,饲养期间各组大鼠均在自由生长,各组间体重没有显著差异(P>0.05)。同时观察到大鼠的摄食频率、粪便情况和毛发状态等,均无异常,表明SCH对大鼠的正常生长没有副影响。

图2 各组大鼠的体重变化曲线
Fig.2 Body mass changing curves of rats in each group
2.4 伤口愈合率
通过监测大鼠创面愈合率分析SCH促创面愈合的效果。由图3-a可知,大鼠皮肤创面随着时间的延长逐渐愈合,第4天创面均已结痂,在第12天时,肉眼可见SCH各组和阳性组的伤口面积均小于模型组,且部分出现了粉嫩的新生组织,尤以中剂量组最为显著。结合图3-b所示,第4天的SCH各组和阳性组愈合率均超过模型组,但不存在显著性(P>0.05);第8天中剂量组显著高于模型组(P<0.05);第12天低剂量组、中剂量组和阳性组显著高于模型组(P<0.05)。说明SCH可促进创面愈合,且愈合速度与云南白药组无显著差异,尤其以中剂量组表现效果最佳。

a-各时间段代表性图片;b-伤口愈合率
图3 SCH对大鼠创面愈合的影响
Fig.3 Effect of SCH on wound healing in rats
注:不同字母表示组间有显著性差异(P<0.05)(下同)
2.5 H&E染色病理分析
创面处炎性细胞状态、成纤维细胞增殖、血管新生和再上皮化等状况[19]可以用H&E染色结果显示,其结果如图4所示。
第4天模型组表现出炎性细胞浸润的特点,而SCH各组和阳性组的炎性细胞较少,且有大量血管新生;第8天,各组创面均上皮化,其中模型组仍有大量炎性细胞,而SCH各组和阳性组有少量毛囊和皮肤附属器生成;第12天,SCH各组和阳性组均有大量皮肤附属器和毛囊形成,而模型组中较少。其中,中剂量组的胶原纤维和皮肤附属器排列紧密有序,新生表皮较薄,重塑效果优于云南白药组。说明SCH可以调节创面处炎性细胞浸润程度,促进血管新生、成纤维细胞增殖和再上皮化。

C-炎性细胞;B-血管;F-成纤维细胞;E-表皮;G-皮肤附属器;H-毛囊
图4 第4、8、12天创面处H&E染色的代表性
显微镜图片(×100)
Fig.4 Representative micrographs of H&E-stained section of wounds on day 4, 8 and 12
图中“—”表示100 μm(图6同)
2.6 血清中炎症因子水平
通过测定大鼠血清中炎症因子的分泌量来表征机体的炎症现象,其中IL-8可以通过促进炎性细胞浸润[24]而延长炎症反应,相反的,IL-10有抗炎功能[25]。如图5所示,不同时期内SCH组的IL-8含量均显著低于模型组(P<0.05),IL-10含量显著高于模型组(P<0.05),且存在剂量依赖性,这与图4中各组的炎症细胞浸润结果一致。说明SCH可以调节大鼠机体的炎症反应,从而影响创面愈合速度。

图5 SCH对大鼠血清中炎症因子的影响
Fig.5 Effect of SCH on the inflammatory factors of serum from rats
2.7 创面胶原纤维新生情况
胶原纤维的新生是创面愈合所必须的,而Masson染色法可以将胶原纤维染成蓝紫色[19],所以对比蓝紫色的密度和深度可以判断各时间段创面处胶原纤维的含量。如图6所示,随着时间的增加,蓝色区域面积和密度越来越多,说明创面处新生了大量胶原纤维。第4天,SCH中、高剂量组和阳性组中蓝色较模型组多;第8天,SCH各组和阳性组的胶原纤维含量明显多于模型组;第12天,SCH各组和阳性组的胶原纤维大量合成,且对比3个SCH剂量组可知胶原纤维合成具有剂量依赖性,此外,SCH中剂量组表现出有序的胶原纤维排列,甚至优于高剂量组和阳性组。

图6 第4、8、12天创面处Masson染色的代表性
显微镜图片(×100)
Fig.6 Representative micrographs of Masson-stained section of wounds on day 4, 8 and 12
2.8 创面羟脯氨酸水平
Hyp是胶原蛋白的特征氨基酸[21],其含量可用于分析皮肤中胶原蛋白含量。由图7可知,在第4天,SCH各组的Hyp水平已经显著高于模型组(P<0.05),第8天和第12天也出现类似趋势,且存在剂量依赖性。此外,图7的结果和图6的结果显示相似的趋势,表明SCH可以促进创面处Hyp合成分泌,促进胶原形成。

图7 SCH对大鼠创面中羟脯氨酸含量的影响
Fig.7 Effect of SCH on the hydroxyproline content in wound of rats
2.9 组织中生长因子水平
为探讨SCH对创面愈合的作用机制,从而测定了创面处生长因子VEGF、bFGF和EGF的水平。由图8可知:3个SCH剂量组中VEGF含量在3个时间点的表达水平均显著高于模型组(P<0.05);在第4天和第8天,3组SCH的EGF和bFGF的分泌量显著高于模型组(P<0.05),其中SCH中、高剂量组在第12天的含量继续显著高于模型组(P<0.05)。此外,对比SCH中、高剂量组的数据发现,除了第8天的EGF表达水平存在差异外,其余生长因子在3个时间段的表达水平不存在显著性(P>0.05)。以上数据表明,在创面愈合过程中,SCH可以上调创面处生长因子VEGF、bFEF和EGF的表达水平,且SCH中剂量组就可以达到与高剂量组相似的效果。

图8 SCH对大鼠创面中生长因子含量的影响
Fig.8 Effect of SCH on growth factors content in wound of rats
3 讨论
皮肤的伤口愈合是一个繁杂的动态过程,需要多种组织和细胞因子协同完成,此外还需要营养底物供给来促进蛋白的合成。有文献报道,羟脯氨酸、脯氨酸和精氨酸可以促进胶原合成[26],支链氨基酸可以促进蛋白合成和机体修复[27],小分子寡肽可以调节机体炎症反应和促进生长因子分泌[28]。本研究证实SCH是一种富含蛋白质的产品,同时含有丰富的羟脯氨酸、精氨酸、脯氨酸、支链氨基酸和小分子寡肽,从理论上提示SCH可提供创面愈合的营养需求,可作进一步的功效验证探索。
云南白药是我国治疗外伤的常用药,据文献报道,云南白药可抑制炎症、加速创面凝血,还可以促进生长因子分泌加速肉芽形成和组织重塑[29]。本研究选用云南白药作为阳性对照,通过动物实验对SCH的促伤口愈合功效进行验证。创面愈合会经历4个阶段,主要涉及炎性细胞浸润、炎症因子释放、成纤维细胞增殖、胶原沉积、肉芽组织形成和创面上皮化这几个过程[30]。本研究中H&E染色和血清中IL-8、IL-10水平的结果显示,SCH可同时上调IL-10和下调IL-8的含量,以减少创面处炎性细胞的浸润。李林等[15]发现,海参胶原低聚肽可以通过调节IL-8和IL-10的分泌来减缓机体的炎症反应,这与本研究的结果一致。同时有研究表明,炎症反应主要出现在愈合前中期,且适当的炎症反应是有利于创面愈合的,因为很多生长因子来源于炎性细胞,但是过度的炎症反应会延缓伤口愈合[31]。故对比3个剂量组和阳性组的抗炎效果,结果显示均减缓了炎症反应,但高剂量组的抗炎性过于激烈,甚至超过阳性组,而中剂量组显示适中的抗炎性。此外H&E染色结果还显示,中剂量组在愈合后期的重塑效果优于高剂量组和阳性组,这可能与炎症的适度调节有关。胶原是细胞外基质的重要组分,而羟脯氨酸是胶原的特有氨基酸。WANG等[32]证实了来源于鲑鱼皮的胶原肽通过促进胶原沉积加快剖宫产大鼠的伤口愈合。本研究中检测了创面处的Hyp水平,结果可知SCH可促进胶原沉积,这可能与SCH原料中富含胶原肽有关。同时有文献报道,在伤口愈合后期,过多的胶原沉积会造成增生性疤痕的形成[33]。本研究中Masson染色结果可见,在愈合后期,高剂量组的新生表皮较厚,而中剂量组的新生表皮薄且皮肤附属器排列有序,说明高剂量组可能存在胶原沉积过度的现象,而中剂量组的胶原合成分泌量更适宜。此外,生长因子的调控是创面愈合中至关重要的,其各自发挥着不同的作用。VEGF是一种特异性作用于血管内皮细胞的生长因子,具有促进血管内皮细胞增殖和血管生成的作用[34]。EGF是促进细胞分裂的因子,可促进多种细胞分裂并形成肉芽组织,同时增加肉芽组织中胶原合成,对皮肤损伤有较好的促愈合作用[35]。bFGF是一种碱性多肽,可以刺激胶原蛋白表达和细胞增殖,从而促进损伤修复[36]。本研究显示,3个剂量组的SCH均可上调创面处VEGF、bFGF和EGF的表达,促进肉芽组织的成熟和再上皮化,从而促进创面愈合。同时对比3个剂量组促生长因子分泌的情况可知,SCH中剂量组可以获得与高剂量组相似的效果。
4 结论
综上所述,本研究制备的SCH具有促SD大鼠创面愈合的功效。此外,无论在调节炎症反应还是促胶原合成的作用上,SCH中剂量组均表现出最适性,同时在刺激生长因子分泌的效果上,SCH中剂量组已经达到与高剂量组相同的作用,故在促创面愈合功效上,SCH中剂量组(0.50 g/kg)表现最优,这为今后企业的功能食品开发提供数据支撑。对于SCH促创面愈合机制的探索发现,SCH通过调节创面处生长因子的分泌量来促进伤口愈合,这可能与生长因子VEGF、bFGF和EGF的表达水平上调有关,因此可以为进一步研究SCH促创面愈合的机制提供思路和依据。
[1] 穆琳.加工对海参营养和功能成分的研究[D].大连:大连海洋大学,2016.
MU L.Studies of processing method on nutritional and functional compositions of instant sea cucumber products[D].Dalian:Dalian Ocean University,2016.
[2] 耿瑞,岳冬冬,刘龙腾,等.产业上升期企业经营活动对海参市场扩大的影响—基于大连加工企业的调查[J].安徽农业科学,2017,45(30):229-233.
GENG R,YUE D D,LIU L T,et al.Impact of business activities on the expansion of sea cucumber industry-An investigation on the processing enterprises in Dalian[J].Journal of Anhui Agricultural Sciences,2017,45(30):229-233.
[3] 何舟.不同饲料对刺参生长、体成分、免疫相关酶和消化酶活性的影响[D].大连:大连海洋大学,2014.
HE Z.Studies on the effects of different diets on the growth,body composition,non-specific immunity and digestive enzymes activities of sea cucumber[D].Dalian:Dalian Ocean University,2014.
[4] KIANI N,HEIDARI B,RASSA M,et al.Antibacterial activity of the body wall extracts of sea cucumber (Invertebrata;Echinodermata) on infectious oral streptococci[J].Journal of Basic and Clinical Physiology and Pharmacology,2014,25(4):367-373.
[5] GUAN R,PENG Y,ZHOU L,et al.Precise structure and anticoagulant activity of fucosylated glycosaminoglycan from Apostichopus japonicus:Analysis of its depolymerized fragments[J].Marine Drugs,2019,17(4):195.
[6] 张晓羽,李楠,董秀芳,等.海参水煮液多糖提取物体外抗炎活性的研究[J].食品与药品,2018,20(2):81-85.
ZHANG X Y,LI N,DONG X F,et al.Study on anti-inflammatory activity of polysaccharide extracts from sea cucumber processing liquor[J].Food and Drug,2018,20(2):81-85.
[7] 何丽霞,陈启贺,刘睿,等.海参寡肽海参寡肽:免疫调节作用及机制研究[J].科技导报,2016,34(11):42-47.
HE L X,CHEN Q H,LIU R,et al.Sea cucumber oligopeptides:Immunomodulatory effects and its mechanism[J].Science & Technology Review,2016,34(11):42-47.
[8] BROWN K L,PHILLIPS T J.Nutrition and wound healing[J].Clinics in Dermatology,2010,28(4):432-439.
[9] HE M,SUN L,FU X,et al.Biodegradable amino acid-based poly (ester amine) with tunable immunomodulating properties and their in vitro and in vivo wound healing studies in diabetic rats’wounds[J].Acta Biomaterialia,2019,84:114-132.
[10] BONVINI A,COQUEIRO A Y,TIRAPEGUI J,et al.Immunomodulatory role of branched-chain amino acids[J].Nutrition Reviews,2018,76(11):840-856.
[11] 宋思媛,李美琪,王泽旭,等.海参多糖对小鼠肠道菌群紊乱的恢复作用[J].中国微生态学杂志,2019,31(9):1 023-1 026.
SONG S Y,LI M Q,WANG Z X,et al.Restoration effect of sea cucumber polysaccharides on intestinal microbiota disorder in mice[J].Chinese Journal of Microecology,2019,31(9):1 023-1 026.
[12] 高芮.海参加工液中蛋白及多糖的提取工艺[D].大连:大连理工大学,2019.
GAO R.Extraction process of polysaccharide and protein from waste liquor of processing[D].Dalian:Dalian University of Technology,2019.
[13] 付学军,金海珠.酶解时间对海参肽抗氧化活性影响的研究[J].食品科技,2013,38(9):193-197.
FU X J,JIN H Z.Effect of enzymatic hydrolysis time on antioxidant activity of sea cucumber peptide[J].Food Science and Technology,2013,38(9):193-197.
[14] 郑志鸿,章超桦,林海生,等.方格星虫酶解物对小鼠皮肤创伤修复的作用[J].广东海洋大学学报,2020,40(1):97-103.
ZHENG Z H,ZHANG C H,LIN H S,et al.Promoting the skin wound healing in mice using Sipunculus nudus hydrolysate[J].Journal of Guangdong Ocean University,2020,40(1):97-103.
[15] 李林,李迪,徐腾,等.海参胶原低聚肽对糖尿病小鼠术后伤口愈合的促进作用[J].中国食物与营养,2017,23(7):71-75.
LI L,LI D,XU T,et al.Effect of sea cucumber collagen oligopeptide in diabetic wound heating[J].Food and Nutrition in China,2017,23(7):71-75.
[16] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1 069-1 072.
HUANG J H,HUANG X H,CHEN Z Y,et al.Dose conversion among different animals and healthy volunteers in pharmacological study[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2004,9(9):1 069-1 072.
[17] YANG T,ZHANG K,LI B,et al.Effects of oral administration of peptides with low molecular weight from Alaska Pollock (Theragra chalcogramma) on cutaneous wound healing[J].Journal of Functional Foods,2018,48:682-691.
[18] YAN J,LIAO X,LI S,et al.Effects of carbon arc lamp irradiation on wound healing in a rat cutaneous full-thickness wound model[J].Photobiomodulation Photomedicine and Laser Surgery,2019,37(1):17-24.
[19] CHE HAMZAH N,MOHAMMED A,SIRAJUDEEN K,et al.Keladi candik (Alocasia longiloba Miq.) petiole extracts promote wound healing in a full thickness excision wound model in rats[J].Asian Pacific Journal of Tropical Biomedicine,2019,9(4):140-149.
[20] 高菲.刺参(Apostichopus japonicus)营养成分,食物来源及消化生理的季节变化[D].山东:中国科学院海洋研究所,2008.
GAO F.Seasonal variations of nutritional composition,food resources,and digestive physiology in sea cucumber (Apostichopus japonicus)[D].Shandong:Institute of Oceanology,Chinese Academy of Sciences,2008.
[21] BHUIMBAR M V,BHAGWAT P K,DANDGE P B.Extraction and characterization of acid soluble collagen from fish waste:Development of collagen-chitosan blend as food packaging film[J].Journal of Environmental Chemical Engineering,2019,7(2):102 983
[22] XU Q,HONG H,WU J,et al.Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane:A review[J].Trends in Food Science & Technology,2019,86:399-411.
[23] 王祖哲,马普,王军琦,等.刺参低聚肽的质量评价和抗疲劳作用研究[J].食品研究与开发,2019,40(18):5-11.
WANG Z Z,MA P,WANG J Q,et al.Quality evaluation and anti-fatigue effect of Apostichopus japonicus oligopeptides[J].Food Research and Development,2019,40(18):5-11.
[24] MUKAIDA N,HARADA A,MATSUSHIMA K.Interleukin-8 (IL-8) and monocyte chemotactic and activating factor (MCAF/MCP-1),chemokines essentially involved in inflammatory and immune reactions[J].Cytokine & Growth Factor Reviews,1998,9(1):9-23.
[25] COUPER K N,BLOUNT D G,RILEY E M.IL-10:The master regulator of immunity to infection[J].The Journal of Immunology,2008,180(9):5 771-5 777.
[26] LI P,WU G.Roles of dietary glycine,proline,and hydroxyproline in collagen synthesis and animal growth[J].Amino Acids,2018,50(1):29-38.
[27] SHIMOMURA Y,KITAURA Y.Physiological and pathological roles of branched-chain amino acids in the regulation of protein and energy metabolism and neurological functions[J].Pharmacological Research,2018,133:215-217.
[28] NAPAVICHAYANUN S,ARAMWIT P.Effect of animal products and extracts on wound healing promotion in topical applications:A review[J].Journal of Biomaterials Science,Polymer Edition,2017,28(8):703-729.
[29] 张梦,樊光辉,张宜,等.云南白药在创伤中的新应用[J].中国药房,2014,25(23):2 194-2 196.
ZHANG M,FAN G H,ZHANG Y,et al.New application of Yunnan Baiyao in trauma[J].China Pharmacy,2014,25(23):2 194-2 196.
[30] JANIS J E,HARRISON B.Wound Healing[J].Plastic and Reconstructive Surgery,2014,133(2):199e-207e.
[31] EMING S A,MARTIN P,TOMIC-CANIC M.Wound repair and regeneration:Mechanisms,signaling,and translation[J].Science Translational Medicine,2014,6(265):265s-266s.
[32] WANG J,XU M,LIANG R,et al.Oral administration of marine collagen peptides prepared from chum salmon (Oncorhynchus keta) improves wound healing following cesarean section in rats[J].Food & Nutrition Research,2017,59(1):26 411.
[33] SLEMP A E,KIRSCHNER R E.Keloids and scars:A review of keloids and scars,their pathogenesis,risk factors,and management[J].Current Opinion in Pediatrics,2006,18(4):396-402.
[34] CONSTANTINO ROSA SANTOS S,MIGUEL C,DOMINGUES I,et al.VEGF and VEGFR-2 (KDR) internalization is required for endothelial recovery during wound healing[J].Experimental Cell Research,2007,313(8):1 561-1 574.
[35] CHOI J K,JANG J,JANG W,et al.The effect of epidermal growth factor (EGF) conjugated with low-molecular-weight protamine (LMWP) on wound healing of the skin[J].Biomaterials,2012,33(33):8 579-8 590.
[36] 王晓,赵静,杜梦颖,等.白芨胶载外源性碱性成纤维细胞生长因子促进伤口愈合的实验研究[J].中国组织工程研究,2017,21(34):5 481-5 486.
WANG X,ZHAO J,DU M Y,et al.Experimental research on bletilla carrying exogenous basic fibroblast growth factor that promotes wound healing[J].Chinese Journal of Tissue Engineering Research,2017,21(34):5 481-5 486.