草菇(Volvariella volvacea),又名稻草菇,是世界第三大栽培的食用菌。其肉质鲜嫩、香味浓郁,有较高的营养价值和医用价值[1-2],是热带和亚热带地区广受欢迎的栽培蘑菇之一[3]。目前,草菇从传统的小农种植逐渐转向工厂化生产。据统计,我国草菇年产量约为33万t,占全球产量的80%[4]。同其他食用菌一样,菌种退化是限制草菇生产和发展的重要因素。草菇是典型的高温型食用菌,不耐低温贮藏的特性,使其退化现象尤为严重。
草菇的栽培原料一般为天然植物纤维,如稻草、棉籽壳等,其主要成分为纤维素、半纤维素、木质素等[5]。这些大分子高聚物必须在相应的降解酶作用下转化为低分子化合物才能被菌丝吸收利用,以维持菌丝生长及提供出菇的能量,因此草菇的生物学效率与其产生的降解酶活性有较大的关联性[6]。草菇在生长过程中,产生的外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶共同作用分解纤维素,产生漆酶、锰过氧化物酶等分解木质素[7],产生木聚糖酶等以分解半纤维素[8]。
组织分离是指从食用菌子实体组织中分离纯菌丝体进行繁殖的方法,常用于食用菌菌种提纯和复壮。胡中娥等[9]通过组织分离技术提高了北冬虫夏草菌种的菌丝活力和生物学效率。赵风云等[10]利用单孢分离结合组织分离技术获得了草菇高产菌株。但草菇连续多次组织分离是否会引起菌种退化,致其退化的机制是什么,目前尚未见系统报道。
本文利用连续组织分离方法获得了18代草菇继代菌株,测定分析各菌株的基质降解相关酶活力,结合转录组数据探讨草菇组织分离继代过程中的退化现象及相关酶活力变化,以期为草菇菌种退化鉴定及退化机制研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
原种(T0):草菇菌株V844保藏于甘肃农业大学食品科学与工程学院。
继代菌种(T1~T18):将T0进行栽培试验获得子实体,并经组织分离得到T1,将T1进行栽培,得子实体进行组织分离得T2,以此方法得到18株组织分离继代菌株T1~T18。
草菇原种T0和继代菌种T1~T18均于20 ℃恒温保存于液体石蜡中。
1.1.2 培养基
PDA 培养基:马铃薯 200 g,葡萄糖 20 g,KH2PO4 1.0 g,MgSO4 1.0 g,琼脂粉 2 g,去离子水1 000 mL,pH 自然。
液体发酵培养基:粉碎的棉籽壳10 g,酵母抽提物5 g,KH2PO4 0.6 g,MgSO4 0.5 g,去离子水1 000 mL,pH 自然。
1.2 实验方法
1.2.1 草菇生理性状测定
气生菌丝密度:将T0~T18共19个菌株统一活化后,放置于30 ℃的恒温培养箱中,培养3 d后观察并记录气生菌丝密度。
菌丝生长速度(mm/h):参照安学明等[11]方法测定。
菌丝生物质量(g):将统一活化好的菌株用直径6 mm的打孔器接种1个菌丝块于新鲜PDA平板上,30 ℃培养3 d,然后轻轻刮下菌丝体,用分析天平称量,记录数据。
1.2.2 相关酶活力的测定
粗酶液的制备:将统一活化好的菌株用直径6 mm的打孔器接种3个菌丝块于液体培养基中。在33 ℃,200 r/min摇床中培养8 d,定期取发酵液。将发酵液在4 ℃,11 000 r/min条件下离心10 min,吸取上清液即为粗酶液。
外切葡聚糖酶、内切葡聚糖酶、β-葡萄糖苷酶、滤纸酶和半纤维素酶活力测定均采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[12];漆酶活力测定采用ABTS法[13];锰过氧化物酶活力测定参照崔堂武等[14]的方法;木聚糖酶活力测定参考王晓丹等[15]的方法。
1.2.3 转录组学分析
将T0、T4、T8、T12和T16共5个菌株在PDA平板上统一培养3 d,收集菌丝体放入灭酶冷冻管中,迅速放入液氮中冷冻,并送至上海欧易生物医学科技有限公司进行转录组测序实验。
参照杨新等[16]的方法从转录组学数据中筛选出与基质降解相关酶的差异表达基因,并对这些数据进行统计分析。
1.3 数据处理
每个菌株的所有指标测定均设3组重复,采用Microsoft Excel 2010进行数据统计处理,采用Origin 9.0和Heatmap软件作图,用Spss 19.0统计软件对数据进行单因素方差分析。
2 结果与分析
2.1 组织分离继代对草菇生理性状的影响
2.1.1 气生菌丝密度的变化
将T0~T18在PDA平板上统一培养,第3天观察并记录气生菌丝密度,结果如图1所示。T0~T11气生菌丝密度变化不明显。从T12开始,随着继代次数增加,气生菌丝密度开始降低,菌落直径逐渐减少,菌株呈现退化趋势。
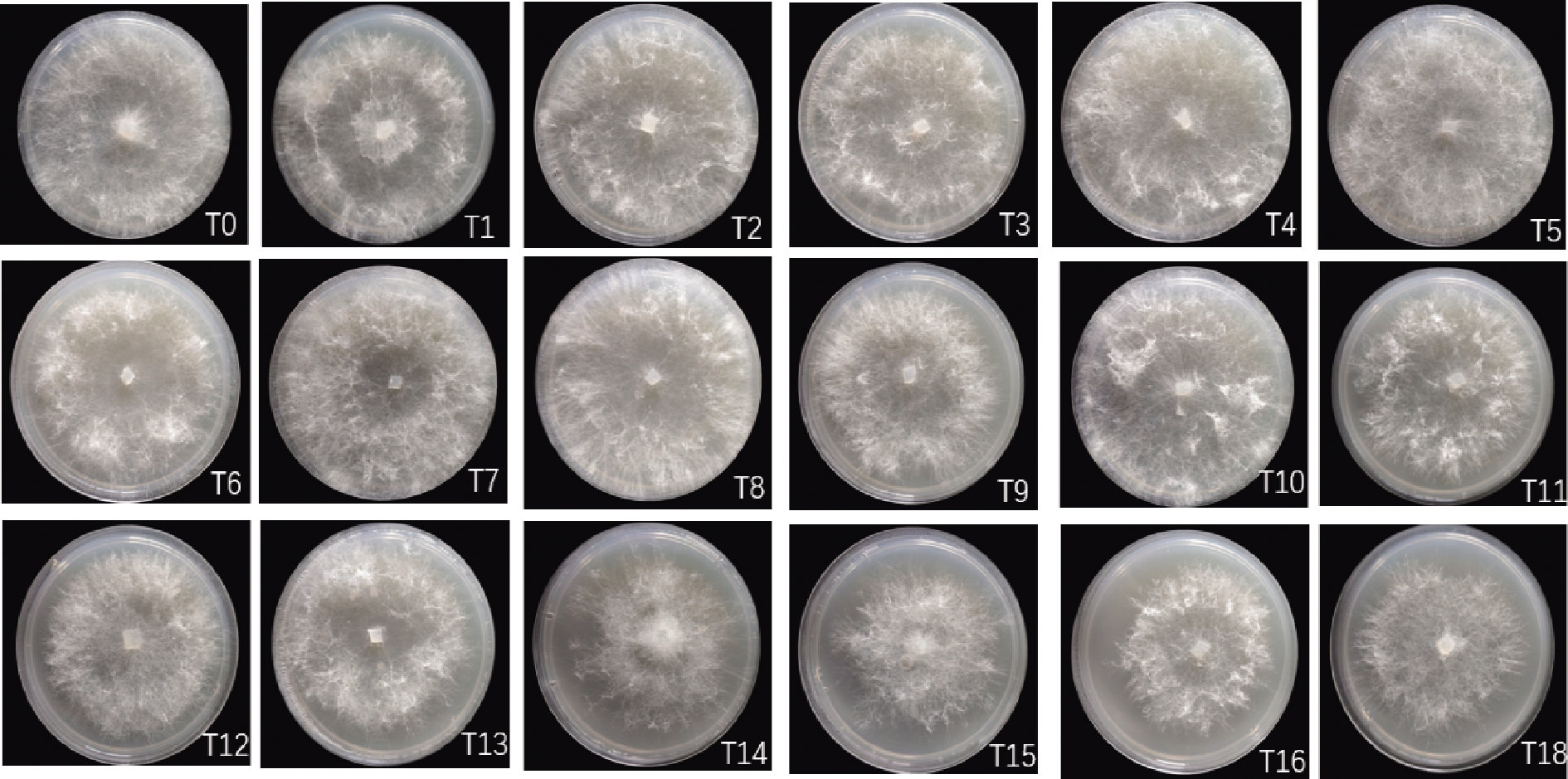
图1 草菇气生菌丝密度的变化
Fig.1 Changes of mycelial density of Volvariella volvacea
注:培养基直径90 mm
2.1.2 菌丝生长速度和菌丝生物质量的变化
由图2可知,随着继代次数的增加,菌丝生长速度和菌丝生物质量均呈现先增加后降低的变化趋势,菌丝生长速度与菌丝生物质量之间呈现明显的正相关。菌丝生长速度在T8达到峰值,而后下降,T12以后下降趋势明显加快,T18的菌丝生长速度较T0降低了14.7%。菌丝生物质量在T4达到峰值,而后下降,菌株T12~T18的生物质量均显著
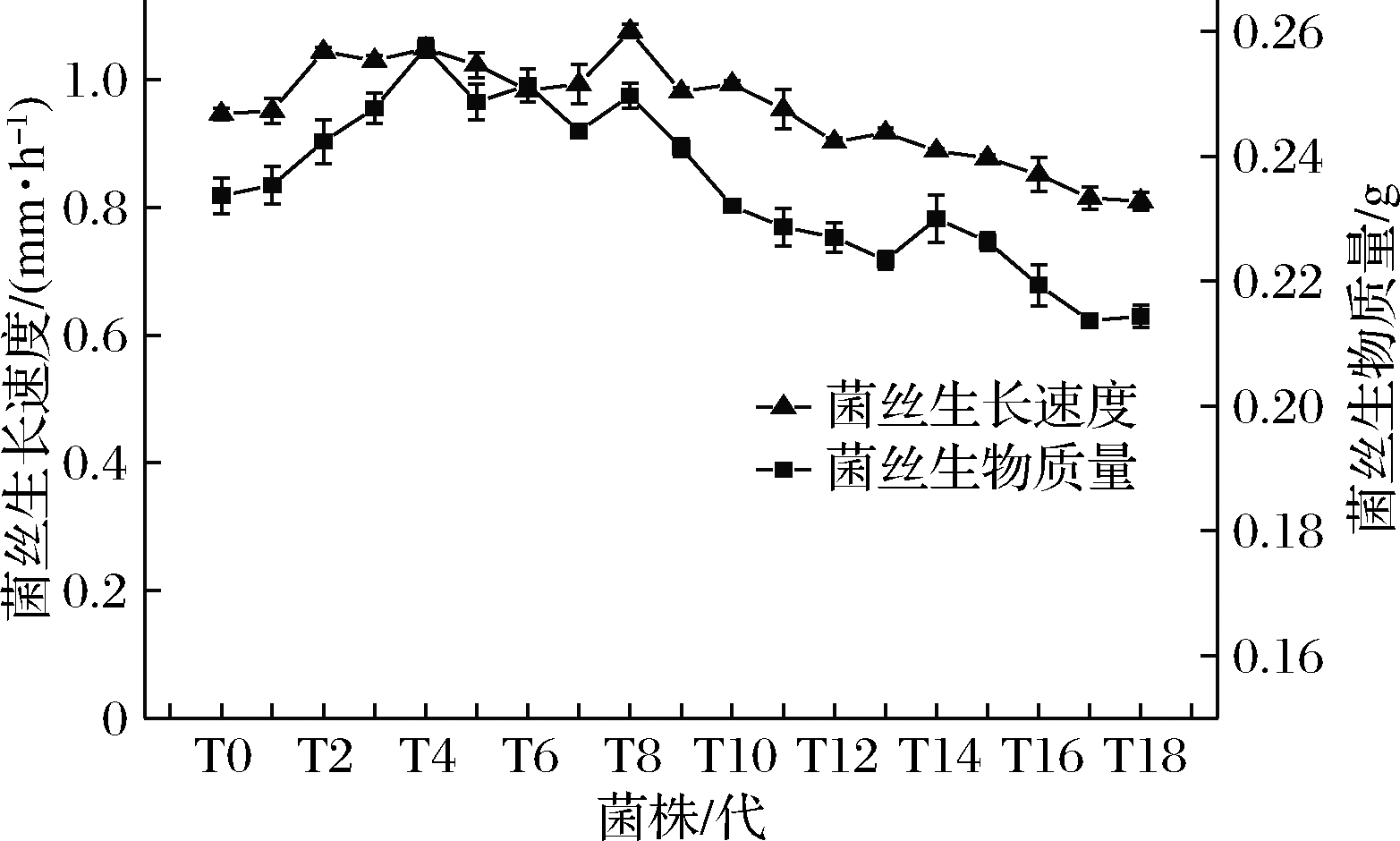
图2 草菇菌丝生长速度和菌丝生物质量的变化
Fig.2 Changes of mycelial growth rate and mycelial biological quality in Volvariella volvacea
2.2 组织分离继代对基质降解酶活力的影响
2.2.1 纤维素降解相关酶活力的变化
纤维素降解相关酶活力变化如图3所示。外切葡聚糖酶呈现先上升后下降的趋势,在T4时达到了峰值,T18的酶活力较T0降低了34.2%(图3-a)。内切葡聚糖酶活力从T0到T6差异不显著(P>0.05),从T7开始,随着继代次数的增加,呈现下降趋势,T12以后下降趋势加快,T18的酶活力较T0降低了66.7%(图3-b)。β-葡萄糖苷酶活力变化差异不显著(P>0.05)(图3-c)。滤纸酶活力从T0到T4差异不显著(P>0.05),从T5开始,随着继代次数的增加,呈现下降趋势,T18的酶活力较T0降低了86.4%(图3-d)。

a-外切葡聚糖酶;b-内切葡聚糖酶;c-β-葡萄糖苷酶;d-滤纸酶
图3 纤维素降解相关酶活力的变化
Fig.3 Changes in cellulose degradation-related enzymes activity
注:不同小写字母代表差异显著(P<0.05)(下同)
2.2.2 木质素降解相关酶活力的变化
木质素降解相关酶活力的变化如图4所示。漆酶和锰过氧化物酶活力均呈先上升后下降趋势。漆酶活力从T0到T4逐渐增高,在T4达到峰值,而后逐渐下降,T18的酶活力较T0降低了71.1%(图4-a)。锰过氧化物酶活力在T5达到峰值,而后逐渐下降,T18的酶活力较T0降低了90.0%(图4-b)。

a-漆酶;b-锰过氧化物酶
图4 木质素降解相关酶活力的变化
Fig.4 Changes in lignin degradation-related enzymes activity
2.2.3 半纤维素降解相关酶活力的变化
半纤维素降解相关酶活力的变化如图5所示。木聚糖酶活力从T0到T4差异不显著(P>0.05),从T5开始,随着继代次数的增加,呈现下降趋势,T18的酶活力较T0降低了67.9%(图5-a)。半纤维素酶活力呈先上升后下降趋势,在T8达到峰值后逐渐下降,T18的酶活力较T0降低了58.7%(图5-b)。
2.2.4 相关酶的差异表达基因分析
分析转录学组数据,筛选出34个与基质降解相关的差异表达基因。由图6可知,外切葡聚糖酶(jgi|Volvo1|118037)、β-葡萄糖苷酶(jgi|Volvo1|120086)基因先上调后下调;内切葡聚糖酶(jgi|Volvo1|115063、 jgi|Volvo1|114279)、木聚糖酶(jgi|Volvo1|120751、 jgi|Volvo1|121659)基因下调;漆酶家族的jgi|Volvo1|115448、jgi|Volvo1|115483下调, jgi|Volvo1|115484、 jgi|Volvo1|115506上调, jgi|Volvo1|115476先上调后下调;锰过氧化酶家族的 jgi|Volvo1|114735、 jgi|Volvo1|113255、 jgi|Volvo1|115023下调, jgi|Volvo1|116037上调。其余19个(8个下调,5个上调,6个先上调后下调)均为碳水化合物家族相关基因,间接参与草菇基质降解。
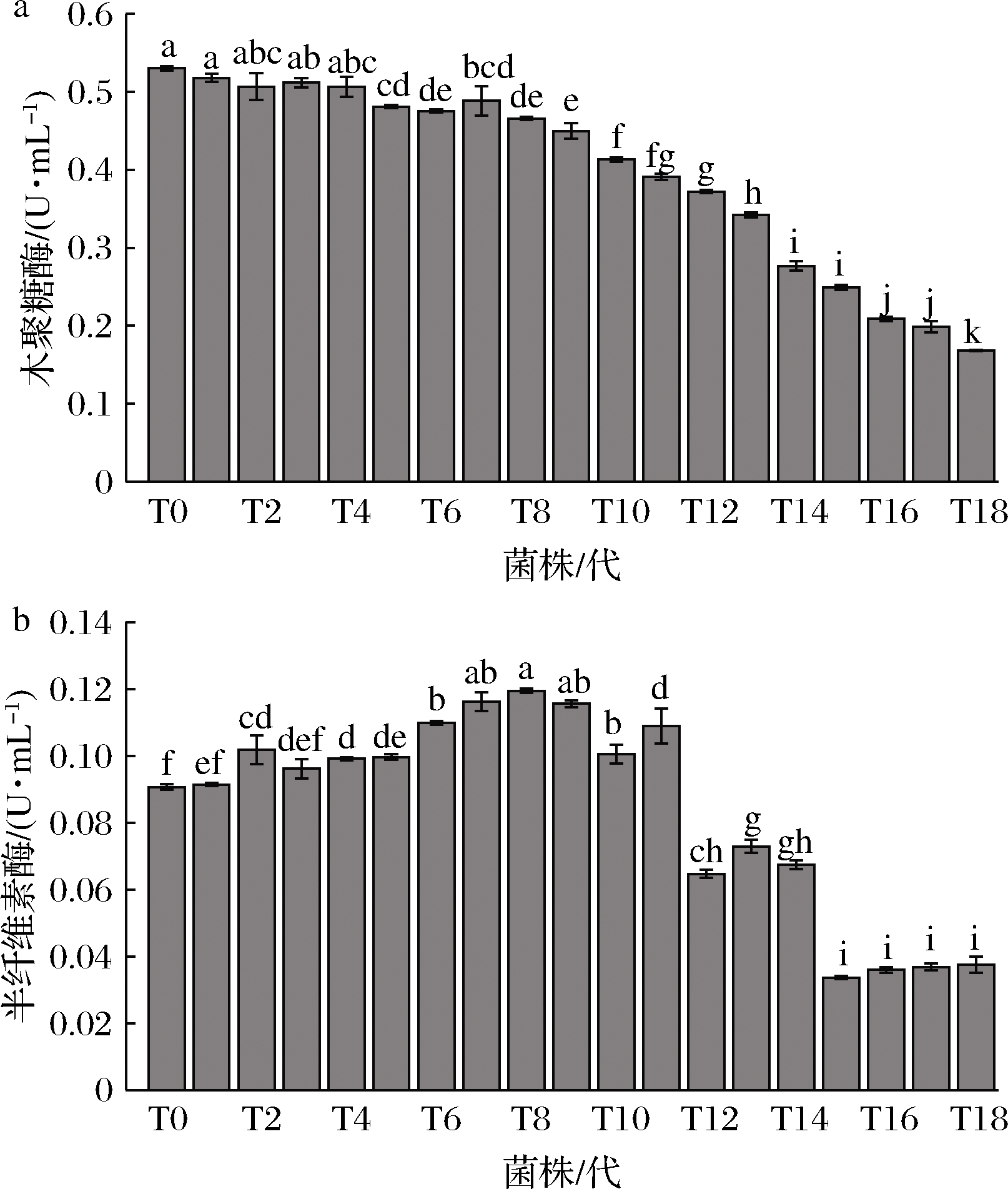
a-木聚糖酶;b-半纤维素酶
图5 半纤维素降解相关酶活力的变化
Fig.5 Changes in hemicellulose degradation-related enzymes activity

图6 基质降解相关差异表达基因的表达量变化
Fig.6 Changes of differentially expressed genes related to substrate degradation
3 讨论与结论
根据营养源不同,可将食用菌分为木腐菌和草腐菌。草菇属于典型的草腐菌,以稻草、麦秆、废棉、棉籽壳等为生长基质,这些基质中均含有大量的纤维素、半纤维素及部分木质素,为草菇的生长发育提供碳源等营养物质[17]。在生长过程中,草菇菌丝首先在纤维素的末端开始分解;再从端部进入基质内部,由内向外分泌纤维素酶(外切葡聚糖酶、内切葡聚糖酶、β-葡萄糖苷酶等)和半纤维素酶(木聚糖酶等),使其共同作用降解基质[18-20]。漆酶、锰过氧化酶可以破坏木质素结构,使较多的纤维素分子裸露出来,由纤维素酶将基质大分子降解为单分子葡萄糖[21]。测定基质降解相关酶活力可以在一定程度上反映出草菇对基质的利用效率。
转录组学是一门在整体上研究细胞中基因转录情况及转录调控规律的学科,是在mRNA水平上研究基因的表达情况[22]。本文通过转录组学分析发现与纤维素酶、半纤维素酶、木质素酶有关的差异表达基因34个,主要差异表达基因如外切葡聚糖酶、β-葡萄糖苷酶和部分漆酶基因随着继代次数的增加先上调后下调;内切葡聚糖酶、木聚糖酶和部分锰过氧化酶基因下调。基质降解相关酶活力测定表明,随着继代次数的增加,外切葡聚糖酶、半纤维素酶、漆酶和锰过氧化物酶活力先增加后下降,木聚糖酶、内切葡聚糖酶和滤纸酶呈下降趋势。生理性状指标检测表明,气生菌丝密度和菌落直径随继代次数的增加逐渐降低,菌丝生长速度和菌丝生物量先增加后下降。综上可知,转录组学、相关酶活及生理性状在连续继代过程中的变化趋势基本一致。初步推测,在草菇连续组织分离继代过程中,mRNA转录水平的差异表达导致蛋白表达即相关酶活力的变化,最终影响了草菇表观性状如气生菌丝密度、菌丝生长速度等指标的改变。
综合分析草菇组织分离继代菌株的生理性状、相关酶活及转录组学发现,当连续组织分离继代4次时,草菇菌种有明显地复壮效果,但当连续继代12次以上时,组织分离继代会导致菌种出现退化现象。
[1] HOU L J, LI Y, CHEN M J, et al.Improved fruiting of the straw mushroom (Volvariella volvacea) on cotton waste supplemented with sodium acetate[J].Applied Microbiology and Biotechnology,2017, 101(23-24):8 533-8 541.
[2] XU X D, XU R, JIA Q, et al.Identification of dihydro-β-ionone as a key aroma compound in addition to C8 ketones and alcohols in Volvariella volvacea mushroom[J].Food Chemistry, 2019, 293:333-339.
[3] YAN J J, TONG Z J, LIU Y Y, et al.The NADPH oxidase in Volvariella volvacea and its differential expression in response to mycelial ageing and mechanical injury[J].Brazilian Journal of Microbiology, 2020, 51(1):87-94.
[4] LI N, CHEN F M, CUI F J, et al.Improved postharvest quality and respiratory activity of straw mushroom (Volvariella volvacea) with ultrasound treatment and controlled relative humidity[J].Scientia Horticulturae, 2017, 225:56-64.
[5] 吴圣进, 王灿琴, 汪茜, 等.草菇生长发育过程中胞外酶活性变化[J].中国食用菌, 2015, 34(1):53-56.
WU S J, WANG C Q, WANG Q, et al.Extracellular enzyme production by Volvariella volvacea during its growth and development[J].Edible Fungi of China, 2015, 34(1):53-56.
[6] HUANG L, SUN N, BAN L T, et al.Ability of different edible fungi to degrade crop straw[J].AMB Express, 2019, 9(1).DOI.10.1186/S13568-018-0731-2.
[7] LYND L R, WWEMER P J, VANZYL W H.Microbial cellulose utilization:Fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews, 2002,66(3):506-577.
[8] ADSUL M G, BASTAWDE K B, GOKHALE D V.Biochemical characterization of two xylanases from yeast Pseudozyma hubeiensis producing only xylooligosaccharides[J].Bioresource Technology, 2009, 100(24):6 488-6 495.
[9] 胡中娥, 钟国祥, 沈爱喜, 等.北冬虫夏草组织分离及复壮菌种的试验研究[J].江西农业学报,2013,25(10):124-125;134.
HU Z E, ZHONG G X, SHEN A X, et al.Experimental research on tissue isolation and strain rejuvenation of Cordyceps militaris[J].Acta Agriculturae Jiangxi, 2013, 25(10):124-125;134.
[10] 赵风云, 林俊芳, 叶泽波, 等.草菇高产新菌种的选育[J].食用菌学报, 2009, 16(4):23-26.
ZHAO F Y, LIN J F, YE Z B, et al.Breeding of a high yielding strain of Volvariella volvacea[J].Acta Edulis Fungi, 2009, 16(4):23-26.
[11] 安学明, 陈超, 刘小霞, 等.草菇继代培养中菌种退化对子实体营养成分的影响[J].菌物学报, 2020, 39(2):390-397.
AN X M, CHEN C, LIU X X, et al.Effects of degeneration of cultivated strains on fruiting body nutrients of Volvariella volvacea during subculture[J].Mycosystema, 2020, 39(2):390-397.
[12] GHOSE T K.Measurement of cellulase activities[J].Pure and Applied Chemistry, 1987, 59(2):257-268.
[13] 玄家洁. 漆酶活力对平菇生长的影响[J].河北农业,2018(6):20-22.
XUAN J X.Effect of laccase activity on the growth of Pleurotus ostreatus[J].Hebei Agriculture, 2018(6):20-22.
[14] 崔堂武, 袁波, 凌晨, 等.木质素降解酶的酶活测试方法的评价与分析[J].化工进展, 2020,39(12):5 189-5 202.
CUI T W, YUAN B, LING C, et al.Evaluation and analysis of activity assays of ligninolytic enzymes[J].Chemical Industry and Engineering Progress, 2020,39(12):5 189-5 202.
[15] 王晓丹, 郭丽琼, 赵力超, 等.木聚糖酶酶活性测定方法及酶活性单位定义[J].食品与发酵工业, 2009, 35(9):128-131.
WANG X D, GUO L Q, ZHAO L C, et al.Assay methods and unit definitions of xylanase activity[J].Food and Fermentation Industries, 2009, 35(9):128-131.
[16] 杨新, 陈莉, 杨双全, 等.不同培养条件下酿酒酵母菌的转录组差异分析[J].食品与发酵工业,2021,47(4):102-109.
YANG X, CHEN L, YANG S Q, et al.Transcriptome analysis of saccharomyces cerevisiae under different culture conditions[J].Food and Fermentation Industries,2021,47(4):102-109
[17] 于海龙, 吕贝贝, 陈辉, 等.基于食用菌的固体有机废弃物利用现状及展望[J].中国农学通报, 2014, 30(14):305-309.
YU H L, LYU B B, CHEN H, et al.The prospect and present utilization situation based on solid organic waste of edible fungi[J].Chinese Agricultural Science Bulletin, 2014, 30(14):305-309.
[18] 陈小玲, 龙思宇, 陈英, 等.瑞氏木霉纤维素酶研究进展[J].广西科学院学报, 2015, 31(2):113-120.
CHEN X L, LONG S Y, CHEN Y, et al.Research progress on cellulase from Trichoderam reeser[J].Modern Agricultural Science and Technology, 2015, 31(2):113-120.
[19] 王红梅, 屠焰, 张乃锋, 等.饲用酶制剂在反刍动物营养中的应用进展[J].草业学报,2017,26(3):199-213.
WANG H M, TU Y, ZHANG N F, et al.Application of exogenous enzymes in ruminant nutrition[J].Acta Prataculturae Sinica, 2017, 26(3):199-213.
[20] PETR B, VENDULA V.Degradation of cellulose by basidiomycetous fungi[J].Fems Microbiology Reviews, 2008, 32(3):501-521.
[21] 邓辉, 王成, 吕豪豪, 等.堆肥过程放线菌演替及其木质纤维素降解研究进展[J].应用与环境生物学报, 2013, 19(4):581-586.
DENG H, WANG C, LYU H H, et al.Research progress in succession of actinomycetal communities and their capacity of degrading lignocellulose during composting process[J].Chinese Journal of Applied and Environmental Biology, 2013, 19(4):581-586.
[22] 薛辉, 曹尚银, 李好先, 等.转录组技术在果树研究中的应用[J].江西农业学报, 2015, 27(5):16-21.
XUE H, CAO S Y, LI H X, et al.Application of transcriptome technology in fruit tree research[J].Acta Agriculturae Jiangxi, 2015, 27(5):16-21.