酚类物质是植物中普遍存在的次生代谢产物,包括多酚、黄酮、酚酸等,绝大多数具有镇痛、抗自由基和抗肿瘤等多种生物学活性和药理作用[1]。芥菜属于十字花科、芸薹属,目前国内外研究表明芥菜及其发酵制品含有多种多酚物质[2]。NIC CIO等[3]在南美芥菜中检出了7种酚类物质,包括4种酚酸(4-羟基苯甲酸、对香豆酸、阿魏酸和芥子酸)和3种黄酮类物质(柚皮苷、芹菜素、山奈酚);HARBAUM等[4]对新鲜芥菜中的酚酸进行含量鉴定,发现芥子酸含量最高,没食子酸含量最少;LI等[5]对瘤茎芥菜进行靶向代谢组学分析,结果表明酚类物质含有黄酮醇、羟基肉桂酰衍生物、黄烷酮和黄酮。尽管如此,已报道的芥菜酚类物质占比仍不足其总酚含量的30%[6],芥菜的酚类组成仍未探明,这影响着芥菜的物质分析和功能评价。
CIO等[3]在南美芥菜中检出了7种酚类物质,包括4种酚酸(4-羟基苯甲酸、对香豆酸、阿魏酸和芥子酸)和3种黄酮类物质(柚皮苷、芹菜素、山奈酚);HARBAUM等[4]对新鲜芥菜中的酚酸进行含量鉴定,发现芥子酸含量最高,没食子酸含量最少;LI等[5]对瘤茎芥菜进行靶向代谢组学分析,结果表明酚类物质含有黄酮醇、羟基肉桂酰衍生物、黄烷酮和黄酮。尽管如此,已报道的芥菜酚类物质占比仍不足其总酚含量的30%[6],芥菜的酚类组成仍未探明,这影响着芥菜的物质分析和功能评价。
发酵蔬菜是世界传统食品,根据加工过程中是否留卤分为留卤腌渍和倒置腌渍,后者除浙江倒笃菜外[7],两广客家酸芥菜(地方俗称“客家擦菜”)是其中的典型代表。现有研究已证实,发酵过程对蔬菜中酚类物质组成产生了显著影响,进而影响其营养吸收率及生物活性。经过适当的发酵,芥菜中的酚类物质含量有所提高,如咖啡酸的含量在发酵过程中显著增加[8]。尽管目前从蔬菜总酚、总黄酮等含量上已明确发酵的作用,但由于芥菜酚类物质具有多样性,发酵过程如何引起各酚类物质变化,进而影响其生理活性,仍少有报道。
本项研究针对新鲜芥菜和客家擦菜,利用非靶向代谢组学方法,应用超高效液相色谱串联质谱技术,检测酚类物质组成,并分析其差异性变化,揭示其多酚、酚酸及黄酮物质组成,为蔬菜发酵过程中化学物质表征和功能成分研究提供参考。
1 材料与方法
1.1 样品采集
新鲜芥菜采集于广西陆川古城镇。客家擦菜取自广西陆川泓源食品有限公司,其基本加工工艺为:新鲜芥菜清洗后晒制脱水,切段(1~2 cm)后装入瓦罐中压实并倒置发酵(7~10 d);将菜取出并加2%(质量分数)食盐拌匀,装回瓦罐中压实,倒置进行二段发酵1个月以上。取新鲜芥菜和发酵成品各12个样品,分别混匀后取3个平行,收集密封后低温下运回实验室,于-80 ℃保存。
1.2 样品制备及测定
1.2.1 样品提取
样本于液氮中研磨,取100 mg加入500 μL含0.1%甲酸的80%甲醇水溶液,涡旋振荡后,冰浴静置5 min。于15 000 r/min、4 ℃下离心10 min,取一定量的上清液加质谱级水稀释至甲醇体积分数为53%,并于4 ℃,15 000 r/min离心10 min,收集上清液,用于LC-MS分析。质控样本由2组不同的样本提取物等量混合制备而成,空白样本为含0.1%甲酸的53%甲醇水溶液。该部分委托北京诺禾致源科技股份有限公司完成。
1.2.2 LC-MS/MS分析
利用超高效液相色谱和串联质谱进行物质鉴定[9-10]。液相分析条件:(1)色谱柱:Thermo Hyperil Gold column C18(2.1 nm×100 nm,1.9 μm);(2)流动相:正离子模式水相为超纯水(0.1%甲酸),有机相为甲醇;负离子模式水相为超纯水(5 mmol/L 醋酸铵、pH 9.0),有机相为甲醇;(3)洗脱梯度:0~1.5 min为V(水)∶V(甲醇)=98∶2,12.0~14.0 min为0∶100,14.1~17.0 min为98∶2;(4)流速为0.2 mL/min;柱温40 ℃。质谱条件为:质谱电压3 200 V,鞘气流速35 arb,辅助气流速10 arb,离子传输管温度320 ℃,二级扫描为数据依赖性扫描。该部分委托北京诺禾致源科技股份有限公司完成。
1.2.3 定性定量分析
将色谱数据文件导入Compound Discoverer 3.1搜库软件中,用空白样本去除背景离子,依据保留时间、质荷比等参数进行简单筛选。根据保留时间偏差0.2 min和质量偏差5×10-6 进行峰对齐。设置信号强度偏差30%、信噪比3、最小信号强度100 000、加和离子等信息进行峰提取,同时对峰面积进行定量,再整合目标离子,通过分子离子峰和碎片离子进行分子式的预测并与mzCloud、mzVault、MassList数据库和诺禾致源公司的自建数据库进行比对。
1.3 数据处理
采用多元统计分析,对2组样本进行主成分分析(principal component analysis,PCA)、聚类分析和相关性分析,根据偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)预测模型的稳定可靠性。设置阈值为:变量影响投影(variable influence on projection,VIP)>1.0,差异倍数(fold change,FC)>1.5或 FC < 0.667 且P<0.05筛选差异酚类物质。对差异酚类物质进行聚类分析,并上传至KEGG网站,进行代谢通路分析。采用Excel对下机数据进行初步分析后,利用Origin 2019软件绘制PCA图,SPSS 23进行显著性分析,云平台绘制热图及高级气泡图。
2 结果与分析
2.1 芥菜及客家擦菜中酚类物质的非靶代谢组学分析
针对新鲜芥菜和客家擦菜,结合总离子流色谱图,2种材料在正、负离子模式下均分别检出84、53种酚类物质,共136种(芥子酸在2种模式下均有检出)。其中,119种物质在芥菜及其发酵产品中首次检出,另外8种酚酸和9种黄酮类物质在芥菜研究中已有报道。具体信息见表1。
KHANAM等[11]用HPLC-二极管阵列检测器测定日本芥菜中的酚类物质,主要为芥子酸、金丝桃苷、水杨酸、对香豆酸和香兰素酸。高媛等[12]在多个品种的新鲜蔬菜及制品中发现阿魏酸、异阿魏酸和对香豆酸3种酚酸的含量最高。已有研究表明,芥菜中的主要黄酮类物质为黄酮醇、羟基肉桂酰衍生物、黄烷酮和黄酮。本实验结果基本包括前人对于芥菜等绿叶芸薹属作物及其发酵制品的靶向研究结果[4,11]。本实验结果包含已报道的酚类物质类别,并检测出更多的多酚物质,且首次在芥菜及发酵芥菜中定性检出大豆苷元及雌马酚等。
表1 新鲜芥菜与客家擦菜中鉴定出的酚类物质统计 单位:种
Table 1 Statistical table of phenolic compounds in fresh Brassica juncea and Hakka sour mustard

酚类物质分类查尔酮二氢黄酮醇花青素黄酮醇黄酮类黄烷酮类黄酮异黄酮原花青素酚酸其他多酚类总计首次报道酚类物质数量351526151513423119本次鉴定出总数量 361827281514223136
2.2 新鲜芥菜和客家擦菜中酚类物质差异性分析
2.2.1 PCA结果
图1为新鲜芥菜和客家擦菜2组样品的PCA图。其中PC1的贡献率为68.5%,PC2的贡献率为26.3%,两者累计贡献率达到94.8%。2个主成分反映的主要指标有芥子酸、山奈酚、对羟基肉桂酸、阿魏酸、异阿魏酸、2-羟基肉桂酸和水杨酸等,表明酚酸物质是新鲜芥菜和客家擦菜的主体特征组分,也是与发酵处理相关性系数最高的成分。与PARK等[13]对发酵芥菜中酚类物质组成变化的结论一致。2种样品分别在PC1、PC2表现出组内聚集趋势,且在PC1中表现出组间分离趋势,整体上表明新鲜芥菜经发酵后,酚类物质的组成发生显著改变。
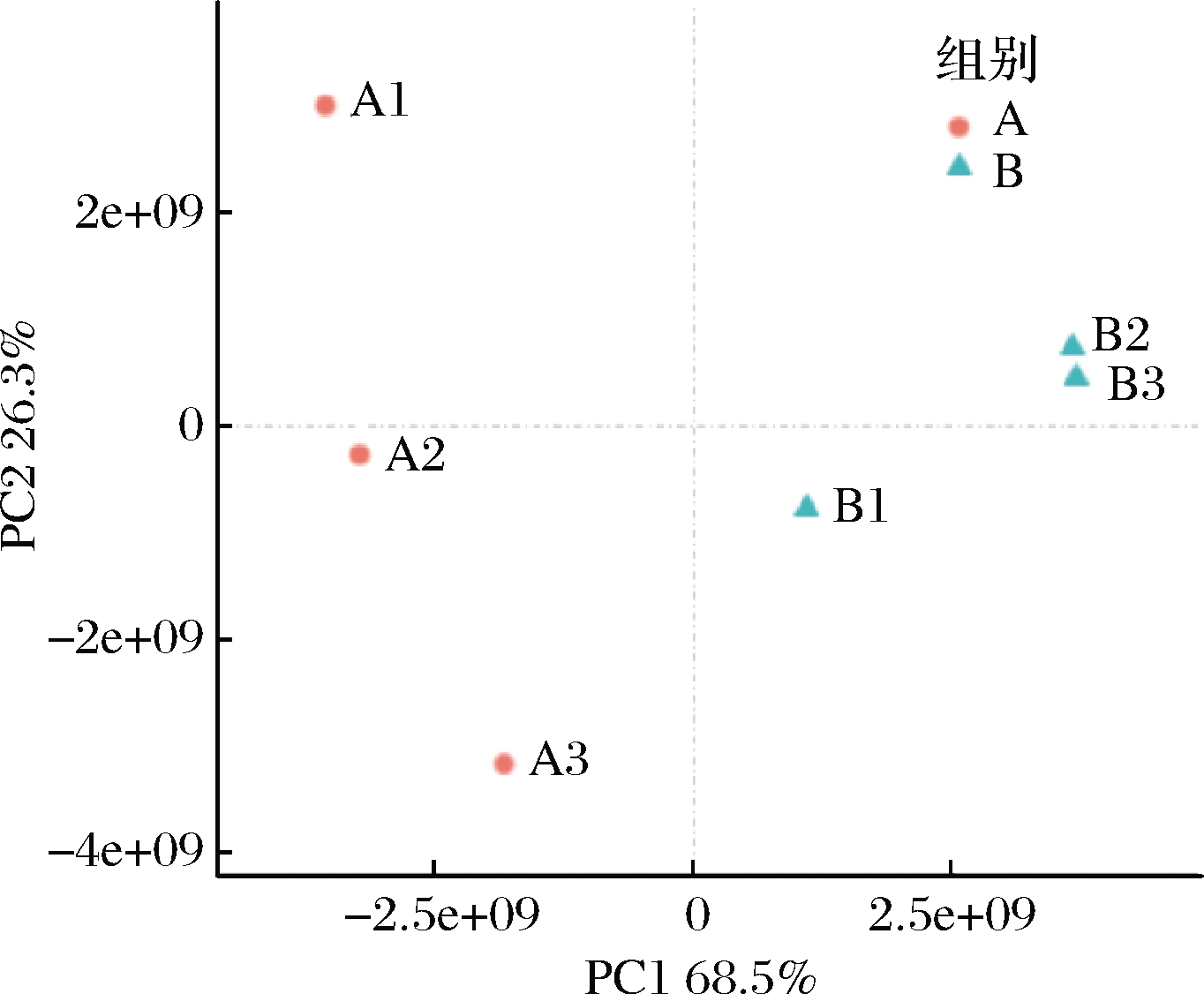
A-新鲜芥菜;B-客家擦菜
图1 酚类物质的PCA结果
Fig.1 PCA results of phenolic compounds
2.2.2 酚类物质差异性鉴定
PCA可以有效提取主要信息,但对于相关性较小的变量不敏感。而PLS-DA可使组间区分最大化,利于准确筛选差异代谢物。如表2所示,综合VIP值、FC值和P值判定发酵前后差异性酚类物质。结果表明,有29种酚类物质的含量经发酵后发生显著变化,占2种材料中所有酚类物质的21.48%,包括14种酚酸物质、8种黄酮类物质、3种异黄酮物质、2种黄酮醇物质,1种查尔酮和1种花青素。发酵后,含量差异倍数最大的为槲皮素-3-O-葡萄糖醛酸苷(FC为1 543),其次为水杨酸和对羟基肉桂酸等。
PARK等[14]评估了芥菜中酚类物质在不同发酵时期的变化,发现咖啡酸的含量在发酵前期波动,2个月后显著下降,绿原酸的含量持续降低,且成品中含量相比原料为显著下降。此外,LE等[15]报道了乳杆菌属产生的酯酶可将生咖啡中绿原酸转化为咖啡酸;发酵小麦的阿魏酸含量显著高于未发酵小麦[16];使用植物乳杆菌发酵平菇使阿魏酸的含量显著增加[17]。本实验结果发现非糖苷键键合类黄酮如芹菜素、槲皮素、柚皮素、山奈酚、橙皮素、杨梅素、川陈皮素等物质的含量在发酵后升高;糖苷键键合类黄酮例如山奈酚-3-O-双糖苷、芹苷-7-葡萄糖苷、芦丁、三叶豆苷、槲皮素-3-O-葡萄糖醛酸苷、杨梅素-3-O-半乳糖苷、木犀草素-7-葡萄糖醛酸苷等物质的含量在发酵后降低。参考现有关于芥菜及发酵芥菜研究,显著变化的酚类物质种类基本一致,但考虑到客家擦菜在发酵过程中始终有物质随水分流出,因此未表现出显著变化的物质需进一步绝对定量确认。
表2 客家擦菜和新鲜芥菜中显著性差异的酚类物质
Table 2 Significantly different phenolic compounds between fresh Brassica juncea and Hakka sour mustard
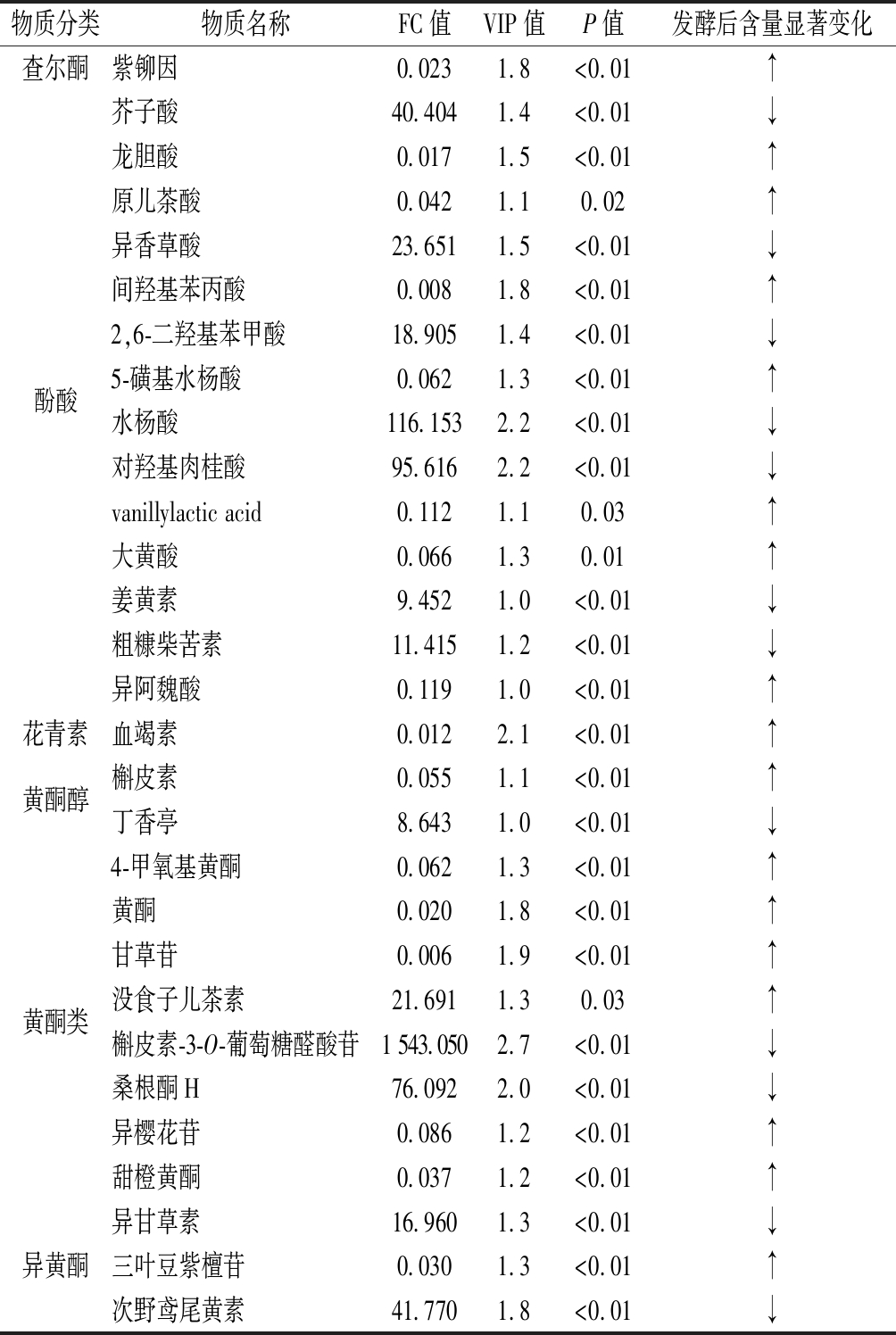
物质分类物质名称FC值VIP值P值发酵后含量显著变化查尔酮紫铆因0.0231.8<0.01↑酚酸芥子酸40.4041.4<0.01↓龙胆酸0.0171.5<0.01↑原儿茶酸0.0421.10.02↑异香草酸23.6511.5<0.01↓间羟基苯丙酸0.0081.8<0.01↑2,6-二羟基苯甲酸18.9051.4<0.01↓5-磺基水杨酸0.0621.3<0.01↑水杨酸116.1532.2<0.01↓对羟基肉桂酸95.6162.2<0.01↓vanillylactic acid0.1121.10.03↑大黄酸0.0661.30.01↑姜黄素9.4521.0<0.01↓粗糠柴苦素11.4151.2<0.01↓异阿魏酸0.1191.0<0.01↑花青素血竭素0.0122.1<0.01↑黄酮醇槲皮素0.0551.1<0.01↑丁香亭8.6431.0<0.01↓黄酮类4-甲氧基黄酮0.0621.3<0.01↑黄酮0.0201.8<0.01↑甘草苷0.0061.9<0.01↑没食子儿茶素21.6911.30.03↑槲皮素-3-O-葡萄糖醛酸苷1 543.0502.7<0.01↓桑根酮H76.0922.0<0.01↓异樱花苷0.0861.2<0.01↑甜橙黄酮0.0371.2<0.01↑异黄酮异甘草素16.9601.3<0.01↓三叶豆紫檀苷0.0301.3<0.01↑次野鸢尾黄素41.7701.8<0.01↓
注:“↑”“↓”分别代表该物质含量在发酵后呈显著性上升或下降
2.3 差异酚类物质富集通路分析
通过KEGG数据库对所有显著差异的酚类物质进行通路富集分析,得到7条代谢通路(图2),分别为(1)苯丙氨酸,酪氨酸和色氨酸的生物合成通路,包括原儿茶酸等;(2)次生代谢产物的合成通路,包括槲皮素、原儿茶酸、水杨酸、异甘草素等;(3)植物激素信号转导通路,包括反式玉米素、水杨酸;(4)酪氨酸代谢通路,包括2,5-二羟基苯甲酸;(5)代谢途径,包括2,5-二羟基苯甲酸、槲皮素、原儿茶酸等;(6)黄酮和黄酮醇的合成通路,包括丁香亭、芦丁、槲皮素、三叶豆苷、山奈酚、杨梅素等;(7)芪类、二苯基庚酮和姜酚生物合成,包括姜黄素。且由图2可知次级代谢产物合成途径通路的富集程度最高,苯丙氨酸,酪氨酸和色氨酸生物合成通路的富集最为显著。
现有研究表明,植物多酚的前体物质来源于糖代谢的中间产物,经莽草酸途径、苯丙烷代谢途径和类黄酮代谢途径合成。其中没食子酸是由莽草酸途径中间产物3-羟基莽草酸在相关酶作用下合成,其余大多数酚酸类物质都是通过苯丙烷代谢途径合成。而莽草酸代谢途径生成的4-羟基查尔酮则是类黄酮代谢途径的前体物质[18]。苯丙烷代谢途径是植物中合成木质素及类黄酮物质的重要次生代谢途径之一,而莽草酸途径在植物次生代谢途径中起到了中心作用,为其他次生代谢途径提供底物。本研究中未富集到莽草酸途径、苯丙烷代谢途径,可能是核心物质莽草酸作为非酚酸物质未被鉴定分析,苯丙氨酸及对香豆酸的含量未发生显著性变化。由于尚无对新鲜芥菜及发酵蔬菜中酚类物质的代谢通路富集,故本次富集到的7条通路可为发酵对酚类物质的影响提供参考。
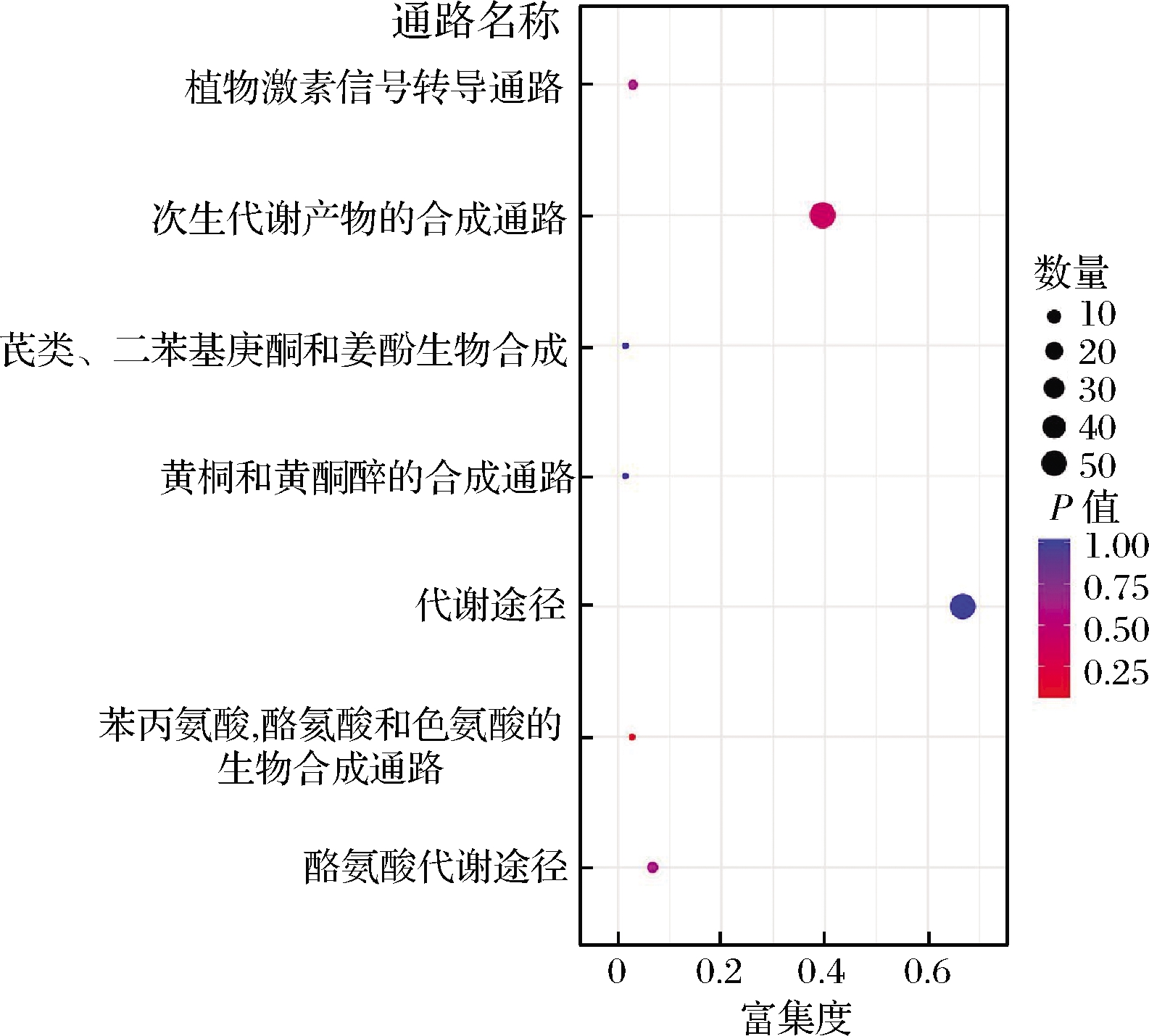
图2 新鲜芥菜与客家擦菜中显著性差异酚类物质的 KEGG富集图
Fig.2 KEGG enrichment map found in significantly different phenolic compounds between fresh Brassica juncea and Hakka sour mustard
注:点的颜色代表P值,越红表示富集越显著;点的大小代表 富集到的差异代谢物的数量
3 讨论
3.1 针对本实验未检到和非显著差异酚酸物质的讨论
本研究在新鲜芥菜和客家擦菜中检测到的42种酚酸多为苯甲酸和肉桂酸的羟化衍生物。MOCO等[19]研究发现尽管不同品种蔬菜的多酚物质有所不同,但这些代谢产物的整体分类相同。绿原酸作为咖啡酸与奎尼酸组成的缩酚酸,在植物有氧呼吸过程中可由肉桂酰酯酶经莽草酸途径转化肉桂酸和奎宁酸形成。咖啡酸的生物合成主要包括绿原酸的水解和对香豆酸的转化。已有研究发现芥菜的发酵降低了绿原酸的含量,但造成咖啡酸含量的增加,将这些变化归因于发酵的乳酸菌产酯酶活性[13]。而在本研究中,部分羟基肉桂酸类酚酸,咖啡酸、没食子酸、异绿原酸及阿魏酸未发生显著变化。此前,在橄榄发酵过程中,已证实酚类物质损失主要是由于向盐水中的扩散[20]。经过比对甲醇和水2种提取溶剂的提取结果,发现甲醇的提取效果更佳,但不乏个别酚类物质仅在水相中被检测到的现象[14]。并且有一些水溶性酚类物质在发酵过程中随水分持续流出,因此尚无法准确判断部分水溶性酚类物质的显著性变化是否仅为代谢活动导致[13]。
现有关于芥菜及其发酵制品的研究均未检测到莽草酸,但检测到有莽草酸代谢途径产物没食子酸。莽草酸作为莽草酸代谢途径的重要底物,与苯丙烷代谢途径联系密切。考虑芥菜品种、留卤与倒置无卤发酵工艺及加入食盐浓度的差异和样品处理方法的不同,可能导致类似研究中酚酸物质表现出不同的含量变化。
3.2 针对槲皮素与其糖苷物质含量变化的讨论
天然槲皮素多以糖基结合成糖苷的形式存在,相关研究表明,黄酮苷元比黄酮糖苷具有更高的生物利用率,槲皮素在体内的生物利用率及抗氧化活性优于槲皮素糖苷[21],且糖苷在摄取后几乎不被吸收。前人在芸薹属作物菜心[15]、西蓝花[6]及刺梨[21]中均有检测出槲皮素,而对芥菜利用标品靶向测定槲皮素的一些研究中,仍存在未检测到的情况[3,8]。本研究在2种材料中均检出槲皮素,并发现其含量经发酵后呈显著上升,其糖苷物质槲皮素-3-O-葡萄糖醛酸苷的含量呈显著性下降,可知发酵影响了槲皮素糖苷物质的水解转化。目前实验室多用β-葡萄糖苷酶、α-鼠李糖苷酶及α-L-鼠李糖苷酶等水解黄酮糖苷配基,而微生物则是这些酶的主要来源[22]。有研究报道乳杆菌属具有β-葡萄糖苷酶活性,可转化大豆异黄酮糖苷,表现出高效的槲皮素释放能力[23]。虽已筛选出一些具有产酶能力的乳酸菌,但不同菌种发酵转化糖苷配基的水平存在差异,且作用机制尚未彻底清晰,亟待跟进研究。
目前,二氢槲皮素的生物合成过程已经基本探明,涉及到苯丙烷和类黄酮2个阶段[24]。本研究发现,发酵后二氢槲皮素和柚皮素的含量均未呈显著性变化,并且未检到圣草酚、二氢山奈酚等。因此,在差异代谢物富集KEGG通路时,未能富集到苯丙烷和类黄酮2个途径。
3.3 乳酸菌发酵影响酚类物质
现有研究表明,参与发酵的多种乳酸菌都具有使膳食多酚脱羧、脱脂、脱甲基和脱糖基化的能力[25-27]。适当的发酵可能是改善蔬菜发酵制品的化学特性,并增强其潜在生物活性的有效途径[28]。研究报道了一些细菌和酵母可将羟基肉桂酸(例如咖啡酸、阿魏酸)脱羧为乙烯基酚[29]。肠道微生物和其他乳酸菌被证明能够通过肉桂酰酯酶将绿原酸转化为咖啡酸和奎宁酸[27]。约翰逊乳杆菌NCC 533产生的酯酶和羟肉桂酸脱羧酶,可分2步将5-咖啡酰奎尼酸完全水解为咖啡酸[28]。通过乳酸菌合成的β-葡萄糖苷酶等,可以去糖基定向修饰黄酮类物质的分子结构,发挥其特定功能[30]。此外乳酸菌具有将果蔬中游离酯、结合态酚酸分解为游离态酚酸的作用,并使其生物活性增强。乳酸菌在发酵过程中产生的水解酶可通过分解细胞壁而释放出结合的酚类物质,从而增加酚类物质的含量[31]。并且,乳酸菌可以保护某些多酚在生理条件下免受化学降解[32-33]。发酵蔬菜中存在大量的乳酸菌,并筛选出一些具有代谢多酚物质能力的菌株,但具体转化机制尚未完全清晰,可以深入探究,以期通过发酵将多酚物质转化为具有更高生物利用度和生物活性的物质。
4 结论
当前研究已对部分芥菜品种和发酵芥菜中具体酚类物质进行定性定量分析,但尚不清晰2种材料的酚类物质组成。本实验采用非靶向代谢组学,首次较系统报道了新鲜芥菜和客家擦菜中酚类物质组成。通过显著变化的酚类物质及相关代谢通路,为探索发酵对酚类物质的影响及代谢机制提供参考。现有研究更多集中于蔬菜发酵前后酚酸的变化,针对黄酮类物质的研究鲜有报道。尽管一些酚类物质在发酵后未表现出显著变化,已明确具有生物活性的酚类物质仍待进一步定量确认。对植物多酚物质代谢途径的研究已取得较大进展,但其生物合成代谢较为复杂,因此可分离发酵乳酸菌对其相关酶学特性进行代谢调控研究。
[1] 魏云潇,余作龙,韩超, 等.果蔬酚酸的研究及在保鲜中应用进展[J].安徽农业科学, 2020,48(7):22-26.
WEI Y X, YU Z L, HAN C, et al.Research progress of phenolic acids in fruit and vegetable and its application in fresh preservation[J].Journal of Anhui Agricultural Sciences, 2020, 48(7):22-26.
[2] CHEIGH H S, PARK K Y.Biochemical, microbiological, and nutritional aspects of kimchi (Korean fermented vegetable products)[J].Crit Rev Food Sci Nutr, 1994, 34(2):175-203.
[3] NIC CIO A E,RODRIGUES C A,JARDIM I C S F, et al.Modified QuEChERS method for phenolic compounds determination in mustard greens (Brassica juncea) using UHPLC-MS/MS[J].Arabian Journal of Chemistry, 2020,13(3):4 681-4 690.
CIO A E,RODRIGUES C A,JARDIM I C S F, et al.Modified QuEChERS method for phenolic compounds determination in mustard greens (Brassica juncea) using UHPLC-MS/MS[J].Arabian Journal of Chemistry, 2020,13(3):4 681-4 690.
[4] HARBAUM B, HUBBERMANN E M, ZHU Z J, et al.Free and bound phenolic compounds in leaves of pak choi (Brassica campestris L.ssp.Chinensis var.communis) and Chinese leaf mustard (Brassica juncea Coss)[J].Food Chemistry, 2008,110(4):838-846.
[5] LI W F,YANG H Y,LI C M, et al.Chemical composition, antioxidant activity and antitumor activity of tumorous stem mustard leaf and stem extracts[J].CyTA - Journal of Food, 2019,17(1):272-279.
[6] MOLLICA A, STEFANUCCI A, ZENGIN G, et al.Polyphenolic composition, enzyme inhibitory effects ex vivo and in vivo studies on two brassicaceae of north-central italy[J].Biomedicine Pharmacotherapy, 2018, 107:129-138.
[7] 江学平.低盐倒笃菜快速生产工艺研究[D].合肥:安徽农业大学, 2014.
JIANG X P.Study on the rapid fermentation technology of the low-salinity pickled potherb mustard-daodu[D].Hefei:Anhui Agricultural University, 2014.
[8] FANG Z X, HU Y X, LIU D H, et al.Changes of phenolic acids and antioxidant activities during potherb mustard (Brassica juncea Coss.) pickling[J].Food Chemistry, 2008,108(3):811-817.
[9] 李思源, 李培瑜, 刘弈彤, 等. 代谢组学在食品科学中的应用进展[J]. 食品与发酵工业, 2021,47(5):256-262.
LI S Y, LI P Y, LIU Y T, et al.Application progress of metabolomics in food science[J].Food and Fermentation Industries, 2021,47(5):256-262.
[10] 于淼, 王长远, 王霞.代谢组学在植物多酚类物质检测分析中的应用[J].食品与发酵工业, 2020,46(13):280-285.
YU M, WANG C Y, WANG X.Application of metabolomics in detection and analysis of plant polyphenols[J].Food and Fermentation Industries,2020,46(13):280-285.
[11] KHANAM U K S,OBA S,YANASE E, et al.Phenolic acids, flavonoids and total antioxidant capacity of selected leafy vegetables[J].Journal of Functional Foods, 2012,4(4):979-987.
[12] 高媛, 王蒙, 王瑶, 等.蔬菜及其制品中不同形态酚酸成分分析[J].食品科学, 2018, 39(24):189-194.
GAO Y, WANG M, WANG Y, et al.Characterization of free, conjugated, and bound phenolic acids in ten vegetables and vegetable products[J].Food Science, 2018,39(24):189-194.
[13] PARK S, JANG H, LEE J, et al.Changes in the phenolic compounds and antioxidant activities of mustard leaf (Brassica juncea) kimchi extracts during different fermentation periods[J].Food Science and Biotechnology, 2017,26(1):105-112.
[14] PARK S, SEO S, KIM E, et al.Changes of microbial community and metabolite in kimchi inoculated with different microbial community starters[J].Food Chemistry, 2019,274:558-565.
[15] LE B,ANH P T N,YANG S H.Enhancement of the anti-inflammatory effect of mustard kimchi on RAW 264.7 macrophages by the lactobacillus plantarum fermentation-mediated generation of phenolic compound derivatives[J].Foods, 2020, 9(2):181.
[16] ZHANG Z F, LYU G Y, PAN H J, et al.Production of powerful antioxidant supplements via solid-state fermentation of wheat (Triticum aestivum Linn.) by cordyceps militaris[J].Food technology and biotechnology, 2012, 50(1):32-39.
[17] ![]() A, SZWAJGIER D.Effect of lactic acid fermentation on antioxidant properties and phenolic acid contents of oyster (Pleurotus ostreatus) and chanterelle (Cantharellus cibarius) mushrooms[J].Food Science and Biotechnology, 2016,25(2):439-444.
A, SZWAJGIER D.Effect of lactic acid fermentation on antioxidant properties and phenolic acid contents of oyster (Pleurotus ostreatus) and chanterelle (Cantharellus cibarius) mushrooms[J].Food Science and Biotechnology, 2016,25(2):439-444.
[18] 高媛, 马帅, 代敏, 等.果蔬酚酸生物合成及代谢调控研究进展[J].食品科学, 2018,39(9):286-293.
GAO Y, MA S, DAI M, et al.Progress in research on the biosynthesis pathway and metabolic regulation of phenolic acids[J].Food Science,2018,39(9):286-293.
[19] MOCO S, CAPANOGLU E, TIKUNOV Y, et al.Tissue specialization at the metabolite level is perceived during the development of tomato fruit[J].Journal of Experimental Botany, 2007, 58(15-16):4 131-4 146.
[20] 沈艾彬, 刘峰娟, 秦宗权, 等.不同酸处理对哈密瓜采后生理的影响[J].食品工业, 2011,32(4):65-67.
SHEN A B, LIU F J, QIN Z Q, et al.Effect of different acid treatment on post harvest fruit physiology of hami melon[J].The Food Industry,2011,32(4):65-67
[21] 王翼, 顾苑婷, 丁筑红, 等.超高效液相色谱-串联高分辨质谱对刺梨槲皮素及其糖苷类化合物的鉴定分析[J].分析化学, 2020,48(7):955-961.
WANG Y, GU Y T, DING Z H, et al.Identification and analysis of quercetin and its glycosides in Rosa roxburghii by ultra high perform[J].Chinese Journal of Analytical Chemistry,2020,48(7):955-961.
[22] GANGADHAR G, BASAPPA K.Screening and optimization of β-glucosidase producing newly isolated lactobacillus plantarum strain lsp-24 from colostrum milk[J].Biocatalysis and Agricultural Biotechnology, 2017,11:89-96.
[23] FILHO L M M, BUSANELLO M, GARCIA S.Optimization of the fermentation parameters for the growth of lactobacillus in soymilk with okara flour[J].LWT-Food Science and Technology, 2016, 74:456-464.
[24] 董潞娜, 曹浩, 张欣宇, 等.二氢槲皮素的研究进展[J].生物技术进展, 2020,10(3):226-233.
DONG L N, CAO H, ZHANG X Y, et al.Research progress on dihydroquercetin[J].Current Biotechnology,2020,10(3):226-233.
[25] PARVEEN J, ZULKARNAIN M I, MD Z A.Effects of physicochemical parameters on the production of phenolic acids from palm oil mill effluent under liquid-state fermentation by aspergillus niger ibs-103za[J].Food Chemistry, 2010,124(4):1 595-1 602.
[26] RACHID B, DINESH T, KARIN K, et al.Biotransformation of caffeoyl quinic acids from green coffee extracts by lactobacillus johnsonii ncc 533[J].AMB Express, 2013,3(1):1-7.
[27] PASQUALE F, YUNPENG B, RAFFAELA D C,et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherry juice and broccoli puree[J].Food Microbiology, 2015, 46:272-279.
[28] RAFFAELLA D C, ROSSANA C, MARIA D A, et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology, 2013,33(1):1-10.
[29] 张志鹏.乳酸菌与植物内生菌联合发酵对黑枣多酚及其降血糖活性的影响研究[D].北京:北京林业大学, 2018.
ZHANG Z P.Polyphenol compounds and hypoglycemic effects of Diospyros lotus L.fermeented with endophyte and lactobacillus[D].Beijing:Beijing Forestry University,2018.
[30] BIASI F, ASTEGIANO M, MAINA M, et al. Polyphenol supplementation as a complementary medicinal approach to treating inflammatory bowel disease[J]. Current Medicinal Chemistry, 2011,18(31):4 851-4 865.
[31] 易建勇, 赵圆圆, 毕金峰, 等.细胞壁多糖与酚类物质相互作用研究进展[J].食品科学, 2020,41(9):269-275.
YI J Y, ZHAO Y Y, BI J F, et al.A review of interactions between cell wall polysaccharides and polyphenols in fruits and vegetables[J].Food Science,2020,41(9):269-275.
[32] LOKE W M, PROUDFOOT J M,HODGSON J M,et al.Specific dietary polyphenols attenuate atherosclerosis in apolipoprotein E-knockout mice by alleviating inflammation and endothelial dysfunction[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2010, 30(4):749-757.
[33] SANCHZ-MALDONADO A F, SCHIEBER A, GAENZLE M G.Structure-function relationships of the antibacterial activity of phenolic acids and their metabolism by lactic acid bacteria[J].Journal of Appl Microbiol, 2011,111(5):1 176-1 184.