酸浆(Physalis alkekengi L.)早在《本草纲目》中就有记载,其具有化痰、利湿除热和清肺止咳等功效。近代研究表明酸浆富含甾体类和黄酮类化合物,具有抗炎、抗菌和防治糖尿病等功效[1-3]。有关其宿萼(calyx physalis,Cps)的研究相对较少,其主要化学成分为酸浆苦素和黄酮类等化合物[4]。酸浆宿萼提取物能够抑制小鼠胃癌细胞的生长、增强小鼠免疫能力、显著降低四氧嘧啶糖尿病小鼠的血糖含量并对革兰氏阳性菌具有显著的抑菌效果。此外,酸浆宿萼总皂苷能增加抑癌相关基因caspase-3、细胞色素C、Bax的表达,促进人的SMMC-7721肝癌细胞的凋亡,体现出一定的抗肿瘤作用[5]。酸浆苦素对人前列腺癌PC-3细胞和前列腺LNcAP细胞株具有较强的细胞毒性[6-7]。然而,其在抗衰老方面的研究尚未见报道。目前,有关衰老的研究仍然处于对衰老的认识和动物实验阶段,关于衰老的学说主要有“端粒学说”、“自身免疫学说”和“自由基学说”等,其中自由基学说认为生物体内活性氧自由基含量水平过高会对细胞造成不同程度的氧化损伤,最终导致并加快衰老[8-9]。因此,通过药物合理降低衰老过程中生物机体内活性氧自由基的水平,成为抗衰老的重要途径之一。秀丽隐杆线虫(Caenorhabditis elegans,以下简称线虫),由于其具有繁殖能力强、易于保存、遗传背景清晰、与人类基因同源性高、信号通路保守等特点,被作为模式动物广泛应用于抗氧化、抗衰老等实验研究[10-13]。在已有报道中,茶多酚等多酚类物质能够通过上调线虫体内抗氧化相关基因,降低线虫体内活性氧自由基的水平,延缓线虫衰老[14-17]。本文以线虫为模式动物,系统探究酸浆宿萼水提物的抗衰老生物学活性,并以胡桃醌为氧化剂构建体内抗氧化活性检测体系,评价了不同浓度酸浆宿萼水提物的体内抗氧化生物活性,进一步阐明其作用机理。本研究数据增加了人们对酸浆宿萼生物学作用的认识,为合理利用酸浆宿萼以及抗衰老药物的研发提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 酸浆宿萼水提物的制备
酸浆宿萼采摘于长春八一水库,经长春中医药大学药学院张凤瑞教授鉴定为茄科植物酸浆的宿萼。取酸浆宿萼58.81 g,100 ℃水煮40 min,反复3次,合并水煮液,共得3 900 mL水煮液。取水煮液1 900 mL置于70 ℃ 水浴锅中浓缩,最终1 g浓缩液含1.7 g主药。将浓缩液在无菌操作台中分装于10 mL无菌离心管中,-20 ℃冻存。
1.1.2 酸浆宿萼水提物主要成分
根据已有文献中的方法对酸浆宿萼水提物中多糖、总酚和总黄酮含量进行测定[18-19]。实验结果证实1 g酸浆宿萼水提物中多糖、总酚和总黄酮含量分别为0.63 g、1.35 mg和1.22 mg。
1.1.3 秀丽隐杆线虫虫株
野生型线虫N2 (Bristol),突变体线虫clk-1(qm30)、daf-2(e1368)、eat-2(ad1116), 购于Caenorhabditis Genetics Center (CGC)。
1.1.4 试剂
蛋白胨、琼脂粉、氯化钠、酵母提取物,生工生物工程股份有限公司;DPPH、ABTS、胡桃醌(ST79990120MG-25 mg), 萨恩化学技术有限公司。
1.1.5 仪器与设备
DSPM-508生化培养箱,宁波江南仪器厂;YM-COS-100C水平恒温摇床,上海豫明仪器有限公司;SW-CJ-2F无菌双人超净台,浙江孚夏医疗科技有限公司;SMZ168体式显微镜,麦克奥迪科技有限公司;PCR max Eco 48 荧光定量PCR仪,上海睿玥实验器材有限公司。
2 结果与分析
2.1 Cps对线衰老指标的影响
寿命实验结果证实,Cps能够显著延长野生型N2线虫的寿命,质量浓度为0.1 mg/mL时效果最佳(图1-A),但对饮食限制信号通路突变体线虫eat-2的寿命无明显影响(图1-B),Cps显著增加N2线虫的虫体摆动次数(图1-C、1-D)、产卵量(图1-E、1-F)和吞咽频率(图1-G、1-H)。
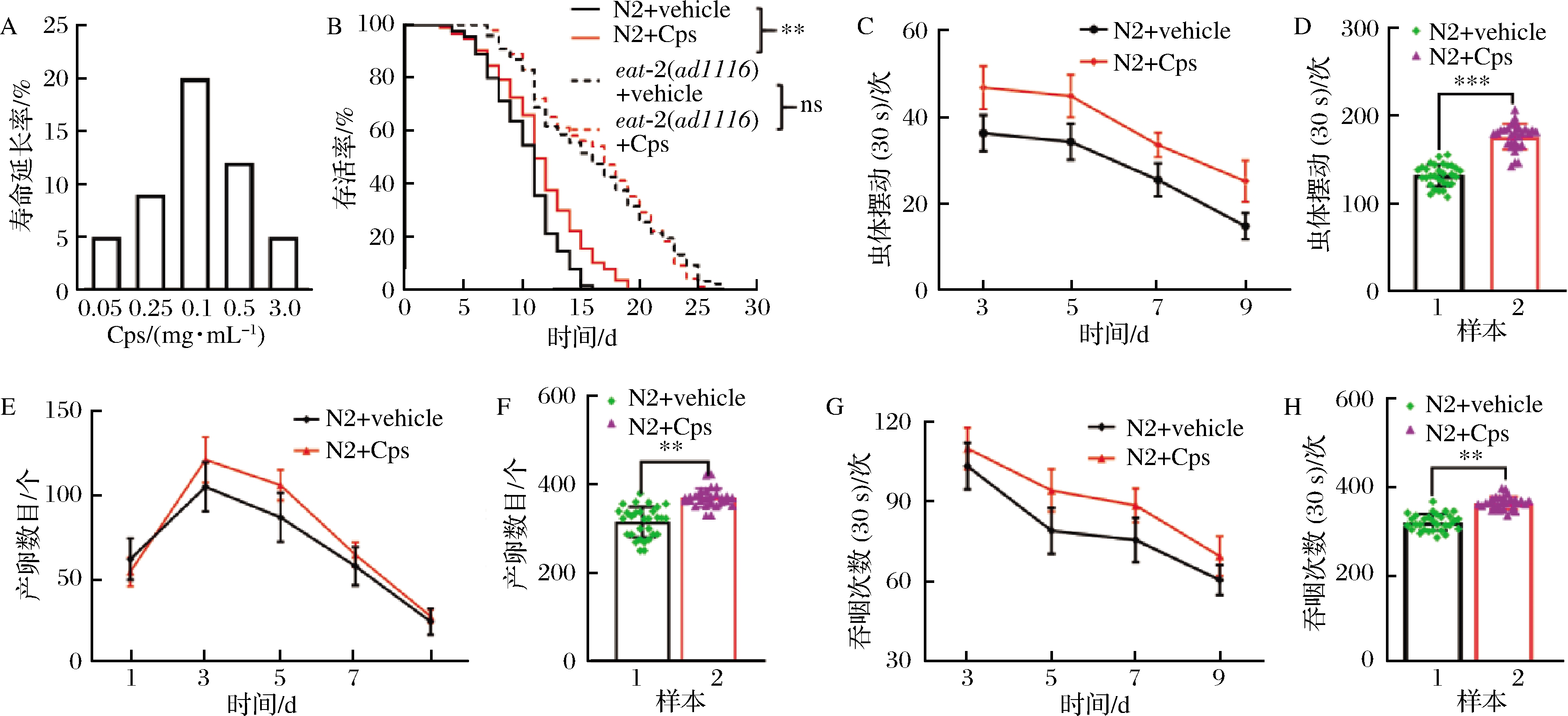
A-N2线虫寿命实验;B-突变体线虫寿命实验;C~D-线虫摆动实验;E~F-线虫生殖实验;G~H-线虫吞咽频次试验
图1 酸浆宿萼水提物对N2线虫寿命和生理功能的影响
Fig.1 Effects of Cps on the life span and physiological function of N2 worms
注:*代表P<0.05;**代表P<0.01;***P<0.001(n≥30)(下同)
2.2 Cps对野生型N2线虫应激能力的影响
线虫暴露于含有胡桃醌的培养基或者紫外辐射和高温等不利环境中时,能够导致线虫体内活性氧自由基水平急速上升,造成氧化所伤,导致线虫死亡[21]。因此,可通过观察Cps对野生型线虫N2在上述条件下存活时间的影响评价其抗氧化生物活性。实验结果表明,0.1 mg/mL Cps具有显著的抗氧化作用,能够减少200 μmol/L胡桃醌(图2-A)、紫外辐射(图2-B)和热应激(图2-C)所诱导的氧化损伤,延长N2线虫存活时间,具有显著的体内抗氧化生物活性。
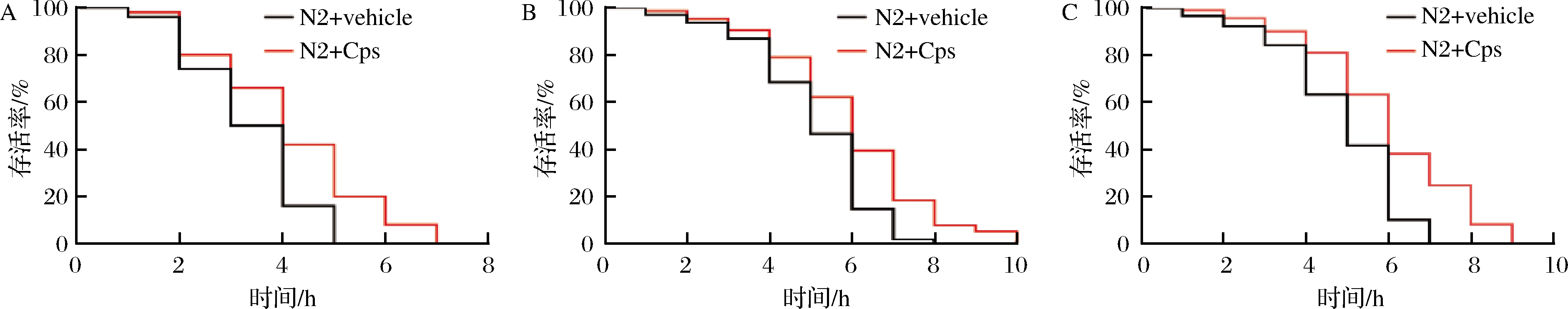
A-氧化应激实验;B-紫外辐射实验;C-热应激实验
图2 Cps对N2线虫应激能力的影响
Fig.2 Effects of Cps on stress ability of N2 worms
2.3 Cps对突变体线虫抗氧化应激能力的影响
突变体线虫氧化应激实验结果表明,Cps能够显著增加线粒体信号通路突变体线虫clk-1(图3-A)和胰岛素信号通路突变体线虫daf-2(图3-B)的抗氧化应激能力,延长其存活时间,但是对饮食限制信号通路突变体线虫eat-2的存活时间无明显影响 (图3-C)。

A-clk-1 (qm30);B-daf-2 (e1368);C-eat-2(ad1118)
图3 Cps对突变体线虫氧化应激能力的影响(n=90)
Fig.3 Effects of Cps extract on oxidative stress resistance of clk-1, daf-2 and eat-2 mutants(n=90)
2.4 Cps对线虫体内氧自由基的水平影响
为了进一步探究Cps对线虫体内氧自由基水平的影响,采用绿色荧光染料2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,H2DCFDA )对线虫体内的活性氧自由基进行染色,评价线虫体内活性氧自由基的水平。实验结果表明,给药组线虫荧光强度显著低于对照组,Cps能够显著降低线虫体内活性氧自由基的水平(图4)。
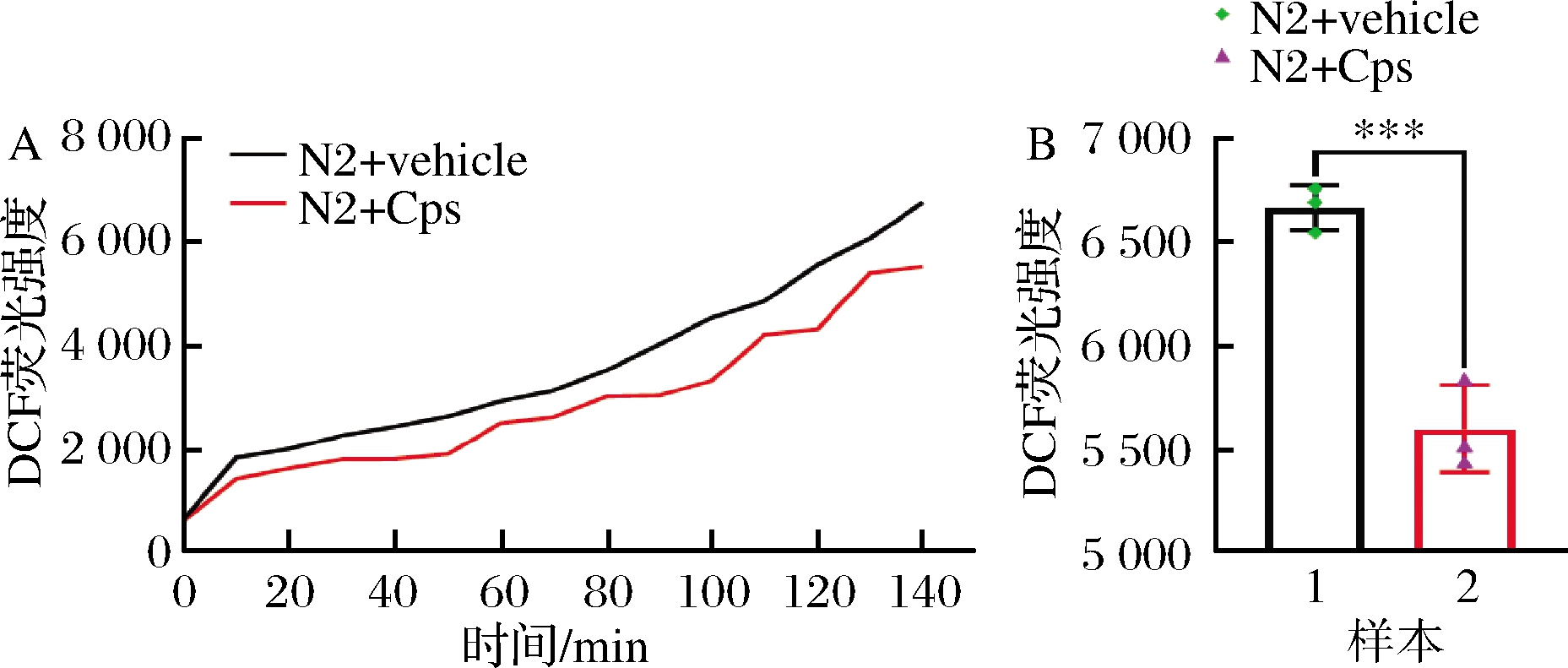
A-实时荧光检测实验;B-荧光总强度差异性分析
图4 Cps对线虫体内氧自由基水平的影响
Fig.4 Effects of Cps on the level of oxygen free radicals in the worms
2.5 Cps对经典抗氧化酶和靶基因转录水平的影响
实验结果证明,Cps能够显著提高超氧化物岐化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的活性以及经典抗氧化基因gst-4、gst-7、sod-3、 daf-16的转录水平(图5)。

A-SOD和CAT酶活力检测实验;B-qPCR实验结果
图5 Cps对抗氧化酶和基因转录水平影响
Fig.5 Effect of Cps on the antioxidant enzyme and gene of worms
2.6 Cps对大肠杆菌OP50(尿嘧啶缺陷型大肠杆菌(Escherichia coli OP50)增殖的影响
通过菌增殖实验检测了0.1 mg/mL的酸浆宿萼水提物对线虫食物大肠杆菌OP50增殖的影响,如图6所示,0.1 mg/mL的酸浆宿萼水提物对大肠杆菌OP50增殖无影响。

图6 大肠杆菌生长曲线
Fig.6 Growth curve of Escherichia coli OP50
3 讨论
高水平的活性氧是有氧代谢的副产物,会破坏许多大分子,如DNA、脂类和蛋白质。活性氧的产生和清除之间的不平衡使各种氧自由基逃逸并破坏许多大分子。这种损伤被认为会导致生理功能的加速下降和死亡风险的增加。因此,合理采用药物干预生物体内的自由基水平成为延缓衰老的途径之一。
本实验采用秀丽隐杆线虫为模式动物系统探究酸浆宿萼水提物对线虫衰老的影响。同空白对照组相比,酸浆宿萼水提物能够显著延长野生型线虫N2的寿命,增加线虫产卵数目和吞咽频率,体现出显著的抗衰老作用。同时,能够显著提高线虫抗氧化应激能力,降低来自胡桃醌、紫外辐射和热应激所诱导的氧化损伤和线虫体内活性氧自由基的水平,提高SOD和CAT活力,体现出显著的体内抗氧化生物活性。这一结果同“自由基学说”相吻合,推测其抗衰老作用源于其所具有的体内抗氧化生物活性相关。同时,在突变体线虫寿命和氧化应激实验中,Cps不影响饮食限制信号通路突变体线虫eat-2的寿命和抗氧化应激能力,进一步证明Cps的抗衰老生物活性同饮食限制信号通路相关。在已有研究中,饮食限制信号通路的激活将会上调相关抗氧化基因的转录水平,进而增强线虫的抗氧化应激能力,延长线虫的寿命[22-25]。本实验中,Cps能够显著上调经典抗氧化基因gst-4、sod-3、daf-16和热抗性基因hsp-16.2的转录水平,与已有研究结果相符。但是,已有研究表明,饮食限制信号通路的激活会导致线虫产卵数目下降,产卵周期延长。然而在本实验中,Cps显著增加了线虫产卵数目,对线虫产卵周期无显著影响,其原因可能是Cps不完全依赖于饮食限制信号通路,其他信号通路的激活导致了线虫产卵数目的增加。此外,适当的饥饿同样能够激活饮食限制信号通路[26],为此,实验检测了Cps对线虫食物大肠杆菌OP50增值的影响,发现实验浓度的Cps不影响大肠杆菌OP50的增值,证明Cps所体现出的生物活性同大肠杆菌OP50增值无关。
综上,Cps(0.1 mg/mL)能够延缓线虫衰老,具有显著的抗衰老作用,其作用机理可能通过激活饮食限制信号通路,上调相关抗氧化基因的转录水平,增强线虫抗氧化应激能力,降低线虫衰老过程中体内活性氧自由基的水平,进而减少氧化损伤,延长线虫寿命。本文为酸浆宿萼的开发利用及生物活性进一步研究提供借鉴,为抗衰老药物的研发提供数据支撑。
[1] 李璇,韩四海,李鑫玲,等.洛阳传统绿豆酸浆营养成分分析与品质多样性[J].食品与发酵工业, 2020, 46(14):228-233.
LI X, HAN S H, LI X L, et al.Nutritional components and quality diversity of Luoyang traditional mung bean sour liquid[J].Food and Fermentation Industries, 2020, 46(14):228-233.
[2] WEN X, ERSAN S, LI M, et al.Physicochemical characteristics and phytochemical profiles of yellow and red physalis (Physalis alkekengi L.and P.pubescens L.) fruits cultivated in China[J].Food Research International, 2019, 120:389-398.
[3] WEN X, HEMPEL J, SCHWEIGGERT R M, et al.Carotenoids and carotenoid esters of red and yellow physalis (Physalis alkekengi L.and P.pubescens L.) fruits and calyces[J].Journal of Agricultural and Food Chemistry, 2017, 65(30):6 140-6 151.
[4] QIU L, JIANG Z H, LIU H X, et al.Flavonoid glycosides of the Calyx Physalis[J].Journal of Shenyang Pharmaceutical University, 2007(4):21-24.
[5] 任石涛,曹虎灵,王晓闻.酸浆宿萼总皂苷对小鼠胃癌细胞(MFC)生长的影响[J].山西农业大学学报(自然科学版),2012,32(3):268-272.
REN S T, CAO H L, WANG X W.Anti-proliferation effects of total saponins (TPS) from Franchet groundcherry calyx against MFC cells[J].Journal of Shanxi Agricultural University (Natural Science Edition,2012,32(3):268-272.
[6] GUO Y, LI S J, LI J X, et al.Anti-hyperglycemic activity of polysaccharides from calyx of Physalis alkekengi var.franchetii Makino on alloxan-induced mice[J].International Journal of Biological Macromolecules, 2017, 99:249-257.
[7] WANG Y C.Antimicrobial activity and stability of physalins from calyx seu fructus physalis[J].Food Science, 2014, 35(7):68-71.
[8] KOLTOVER V K.Free radical timer of aging:From chemistry of free radicals to systems theory of reliability[J].Current Aging Science, 2017, 10(1):12-17.
[9] KHANTHAPOK P, SUKRONG S.Anti-aging and health benefits from Thai food:Protective effects of bioactive compounds on the free radical theory of aging[J].Journal of Food Health and Bioenvironmental Science, 2019, 12(1):88-117.
[10] SHEN P Y, YUE Y, PARK Y.A living model for obesity and aging research:Caenorhabditis elegans[J].Critical Reviews in Food Science and Nutrition, 2018, 58(5):741-754.
[11] ZHANG P C, ZHAI Y Y, CREGG J, et al.Stress resistance screen in a human primary cell line identifies small molecules that affect aging pathways and extend Caenorhabditis elegans′ Lifespan[J].G3:Genes, Genomes, Genetics, 2020, 10(2):849-862.
[12] VIRK B, JIA J, MAYNARD C A, et al.Folate acts in E.coli to accelerate C.elegans aging independently of bacterial biosynthesis[J].Cell Reports, 2016, 14(7):1 611-1 620.
[13] LI Y F, LI H Y, ZHAO L H, et al.Effect of anti-oxidant property of short branched-chain fatty acids in Caenorhabditis elegans[J].Chinese Journal of Biochemistry and Molecular Biology, 2019,35(4):404-412.
[14] PAPAEVGENIOU N, CHONDROGIANNI N.Anti-aging and anti-aggregation properties of polyphenolic compounds in C.elegans[J].Current Pharmaceutical Design, 2018, 24(19):2 107-2 120.
[15] MAULIK M, MITRA S, HUNTER S, et al.Sir-2.1 mediated attenuation of α-synuclein expression by Alaskan bog blueberry polyphenols in a transgenic model of Caenorhabditis elegans[J].Scientific Reports, 2018, 8(1):1-13.
[16] AMIGONI L, STUKNYTÉ M, CIARAMELLI C, et al.Green coffee extract enhances oxidative stress resistance and delays aging in Caenorhabditis elegans[J].Journal of Functional Foods, 2017, 33:297-306.
[17] PEIXOTO H, ROXO M, KRSTIN S, et al.An anthocyanin-rich extract of acai (Euterpe precatoria Mart.) increases stress resistance and retards aging-related markers in Caenorhabditis elegans[J].Journal of Agricultural and Food Chemistry, 2016, 64(6):1 283-1 290.
[18] 宗颖,王志颖,孙佳明,等.锦灯笼果实提取工艺优选及抗氧化活性考察[J].中国实验方剂学杂志,2014,20(7):15-18.
ZHONG Y, WANG Z Y, SUN J M, et al.Optimization of extraction technology for physalis calyx seu fructus fruit and investigation of its antioxidant activity[J].Chinese Journal of Experimental Traditional Medical Formulae, 2014,20(7):15-18.
[19] QUN J S, LI Z, SUN J.Extraction and determination of total flavonoids and polysaccharides from persistent calyx of Physalis alkekengil.var.francheti(Mast.) Makino[J].Food Research & Development, 2008.29(6):82-85.
[20] WANG X, LI H Y, LIU Y, et al.Velvet antler methanol extracts (MEs) protects against oxidative stress in Caenorhabditis elegans by SKN-1[J].Biomedicine & Pharmacotherapy, 2020.DOI:10.1016/j.biopha.2019.109668.
[21] WANG P, ZHANG S D, JIAO J, et al.ROS-ediated p53 activation by juglone enhances apoptosis and autophagy in vivo and in vitro[J].Toxicology and Applied Pharmacology,2019.DOI:10.1016/j.taap.2019.114647.
[22] ZHANG Y, MAIR W B.Dietary Restriction in C.elegans[M].Berlin:Springer, 2017:355-391.
[23] HEINTZ C, DOKTOR T K, LANJUIN A, et al.Splicing factor 1 modulates dietary restriction and TORC1 pathway longevity in C.elegans[J].Nature, 2017, 541(7 635):102-106.
[24] SHINTANI T, SAKOGUCHI H, YOSHIHARA A, et al.D-allulose, a stereoisomer of D-fructose, extends Caenorhabditis elegans lifespan through a dietary restriction mechanism:A new candidate dietary restriction mimetic[J].Biochemical and Biophysical Research Communications, 2017, 493(4):1 528-1 533.
[25] SHEN P Y, YUE Y R, ZHENG J, et al.Caenorhabditis elegans:A convenient in vivo model for assessing the impact of food bioactive compounds on obesity, aging, and Alzheimer′s disease[J].Annual Review of Food Science & Technology, 2017, 9(1).
[26] XING J, HE Y F, LIU Z M, et al.Lactic acid bacteria exhibit similar antioxidant capacities in Caenorhabditis elegans and Campylobacter jejuni-infected mice[J].RSC Advances, 2020, 10(6):3 329-3 342.