马铃薯(Solanum tuberosum L.)是宁夏的战略性主导产品之一,是宁夏南部山区脱贫致富的支柱产业之一[1],具有突出的区域优势和显著的经济效益。随着马铃薯产业的不断发展,马铃薯淀粉加工业也在不断壮大。调查显示,宁夏南部山区有马铃薯加工企业近3 000家,年产量50 t以上的企业近200家,马铃薯淀粉废水排放量近3 106 t[2]。由于直接还田灌溉后会自然发酵导致严重污染[3]。国内外主要采用的常规处理方法有物理法、化学法和生物法。综合国内外研究进展进行分析,采用物理化学法对马铃薯淀粉加工汁水进行处理或对汁水中的蛋白进行回收,需要大型设备的支持以及场地的提供,需要消耗大量的试剂耗材,一些中小型工厂无法承受高昂的处理费用,所以物理化学法具有一定的局限性[4]。生物处理法被广泛应用于现代污水处理,其特点为处理效率高、处理费用低等,但是大部分菌种都需要在适宜的温度环境下(30~40 ℃)进行发酵,但淀粉生产具有季节性,主要集中在9、10月份,宁夏地区的气温较低(15 ℃左右),不能满足大部分菌种的生长条件,生物活性降低或丧失。所以,研究新的菌种来处理汁水污染问题已经迫在眉睫。
实验利用微生物法,筛选1株能够低温降解马铃薯汁水中蛋白质,但产生臭味很小的菌株,用于发酵马铃薯汁水,再将其还田灌溉,避免空气污染,以达到处理废水和生产生物活性物质的双重目的。
1 材料与方法
1.1 实验材料
1.1.1 材料与仪器
土样与马铃薯汁水,宁夏彭阳县马铃薯汁水灌溉田和固原佳利源马铃薯淀粉厂;尸胺、腐胺、精胺、亚精胺(纯度≥98.0%),西格玛奥德里奇;凝胶成像仪,上海一恒科学仪器有限公司;PCR仪,太仓市实验设备厂;气相色谱-质谱联用仪、高效液相色谱仪,Agilent Technologies;全自动氨基酸分析仪,日立;氮吹仪,合肥艾本森科学仪器有限公司。
1.1.2 培养基的配制[5]
富集培养基(g/L):葡萄糖10,蛋白胨5,酵母浸粉5,MgSO4·7H2O 0.2,K2HPO4 1,NaCl 10,Na2CO310,pH 7.2;选择培养基:选用酪蛋白培养基;种子培养基(g/L):葡萄糖5,蛋白胨10,酵母浸粉5,pH 7.0。
1.2 实验方法
1.2.1 菌种的筛选
在250 mL锥形瓶中加入50 mL 0.9%(质量分数)的生理盐水和几粒玻璃珠,121 ℃灭菌15 min。称取5 g土样放入无菌生理盐水中摇匀,制成土壤悬浮液。取1 mL土壤悬浮液加入50 mL到富集培养基中,20 ℃培养48 h,得一次增殖培养液[6-7]。重复上述操作,得到二次增值培养液。
液体水样于20 ℃下恒温发酵,发酵前期每8 h取样,后期每12 h取样,涂布于选择培养基上[8]。固体土样将二次增殖培养液用倍比稀释法制成不同的稀释度[9]。将两者20 ℃培养,观察有无透明圈出现,在菌落边缘可以看到透明圈的菌株说明能够降解酪蛋白[5],即为初筛选菌株。取初筛获得的菌株分别接种到马铃薯淀粉汁水中,20 ℃发酵。测定其发酵前后蛋白质的降解情况,以及感官评价和挥发性物质分析,选择出气味较低的菌株即为复筛选菌株。
1.2.2 低温发酵实验
对复筛得到的菌种活化扩培,分别接种到马铃薯汁水中发酵,温度为15 ℃,接种量为2%,pH值自然状态进行发酵。每隔48 h取样,观察菌体生长情况,测定其蛋白质降解率,并通过感官评价和挥发性物质的检测进行验证,选择优良菌株。
1.2.3 菌株鉴定
1.2.3.1 菌株形态观察及生理生化鉴定
参考《常见细菌系统鉴定手册》[10]及《伯杰细菌鉴定手册》[11]将目标菌株进行生理生化鉴定。
1.2.3.2 目的菌株16S rDNA序列分析
细菌基因组 DNA 的提取参照试剂盒的说明书进行。利用细菌16S rDNA扩增通用引物 27F和1492R[12],以目的菌种基因组DNA为模板进行PCR扩增,用Colibri核酸纯度测定仪测定DNA-50的浓度,并用1 %(质量分数)的琼脂糖凝胶电泳检测。扩增后的PCR产物纯化后由上海生工生物工程有限公司测序,将得到的16S rDNA序列结果提交到NCBI数据库并进行BLAST比对,找到并下载典型的菌株序列与实验菌株的序列,用Clustal X 2.0软件进行同源性分析,并用 MEGA 6.0 软件构建系统发育树。
1.3 测定方法
1.3.1 生物胺的检测
参考ZARGHAMPOUR等[13]的方法,利用高效液相色谱测定腐胺、尸胺、亚精胺、精胺的含量。由图1得出3种生物胺在10 min内得到了很好的分离,出峰时间依次是腐胺7.999 min,尸胺8.461 min,亚精胺8.877 min,精胺14.459 min通过标准品的时间来确定马铃薯淀粉汁水中生物胺的出峰时间。

1-腐胺;2-尸胺;3-亚精胺;4-精胺
图1 生物胺标准物质的高效液相色谱图
Fig.1 High performance liquid chromatography of bioamines
1.3.2 蛋白质的测定
马铃薯淀粉汁水中蛋白质含量的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》采用凯氏定氮法测定[14]。
1.3.3 氨基酸含量的测定
氨基酸组成的测定参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[15],采用全自动氨基酸分析仪进行测定。
1.3.4 吲哚与3-甲基吲哚的测定
参考孙翠香等[16]的方法,利用气相色谱法快速测定马铃薯加工废水中吲哚和3-甲基吲哚含量。
1.3.5 挥发性物质测定
参考HE等[17]的方法设定固相微萃取条件。参考赵洪雷等[18]的方法设定气相色谱条件,根据离子流图计算各峰面积,按公式(1)计算挥发性物质相对含量:
(1)
式中:m,挥发性物质相对含量,%;A1,峰高,cm;A2,峰宽,cm;s,总面积,cm2。
2 结果与分析
2.1 降解酪蛋白菌株的筛选
2.1.1 初筛结果
选用酪蛋白培养基进行初筛,从土壤和马铃薯淀粉汁水中共得到51株可降解酪蛋白的菌株,编号为1、2、44的菌株水解圈直径D与菌落直径d的比值[5]大于其余48株菌,见表1。
2.1.2 复筛结果
51株菌分别进行发酵复筛,发酵后汁水的挥发性物质组成及其相对含量如表2、表3所示,虽然发酵后的汁水中均检出有吲哚、硫化氢、3-甲基吲哚,但其含量的差距较大,1号菌株发酵后的汁水4种胺类物质含量均为最小。1号菌的蛋白质降解率达65.25%,其降解能力高于22号菌跟44号菌,见图2。综合比较,1号菌较为优秀,但还需对该3株菌进行低温发酵实验,选出在低温下也能够具有良好发酵性能的最优菌株。
表1 51株蛋白质降解菌在酪蛋白培养基上的降解能力
Table 1 The degradation ability of 51 protein-degrading bacteria on casein culture medium

菌株水解圈直径(D)/mm菌落直径(d)/mmD/d14.5±0.232.3±0.051.96±0.2025.8±0.072.6±0.012.23±0.0133.7±0.032.8±0.071.32±0.0643.1±0.052.2±0.011.41±0.1153.5±0.042.1±0.121.67±0.0164.3±0.283.3±0.271.30±0.1274.5±0.022.8±0.031.61±0.0783.3±0.032.9±0.041.14±0.0692.7±0.012.5±0.281.08±0.02102.4±0.112.0±0.071.20±0.07113.6±0.073.1±0.201.16±0.03123.3±0.013.0±0.011.10±0.06134.2±0.213.1±0.011.35±0.23144.6±0.033.5±0.211.31±0.06153.3±0.072.5±0.041.32±0.05162.7±0.072.5±0.121.08±0.04173.1±0.112.6±0.071.19±0.01184.4±0.072.6±0.111.69±0.05191.6±0.011.1±0.021.45±0.03202.9±0.112.2±0.031.32±0.03213.1±0.072.6±0.021.19±0.04224.6±0.232.6±0.271.77±0.02232.7±0.282.4±0.201.13±0.06243.7±0.023.1±0.021.19±0.28253.9±0.053.2±0.111.22±0.04263.8±0.033.3±0.071.15±0.04273.3±0.272.8±0.011.18±0.03283.4±0.012.7±0.051.26±0.06293.6±0.033.1±0.281.16±0.03302.9±0.012.6±0.271.12±0.01312.6±0.282.1±0.111.24±0.03322.0<0.011.8±0.041.11±0.10333.1±0.022.7±0.271.15±0.03343.3±0.013.0±0.211.10±0.04354.1±0.303.7±0.011.11±0.20364.2±0.033.3±0.281.27±0.12373.9±0.042.8±0.051.39±0.03383.3±0.212.5±0.021.32±0.03392.9±0.112.1±0.021.38±0.20402.4±0.012.2±0.071.09±0.12412.4±0.072.1±0.031.14±0.10423.1±0.282.8±0.021.11±0.01432.8±0.052.1±0.031.33±0.04443.1±0.301.6±0.041.94±0.05452.5±0.012.2±0.011.14±0.04462.1±0.071.8±0.031.17±0.10471.3±0.041.1±0.101.18±0.04481.4±0.021.1±0.011.27±0.02492.2±0.051.9±0.071.16±0.05502.1±0.111.9±0.121.11±0.20513.1±0.012.7±0.021.15±0.04
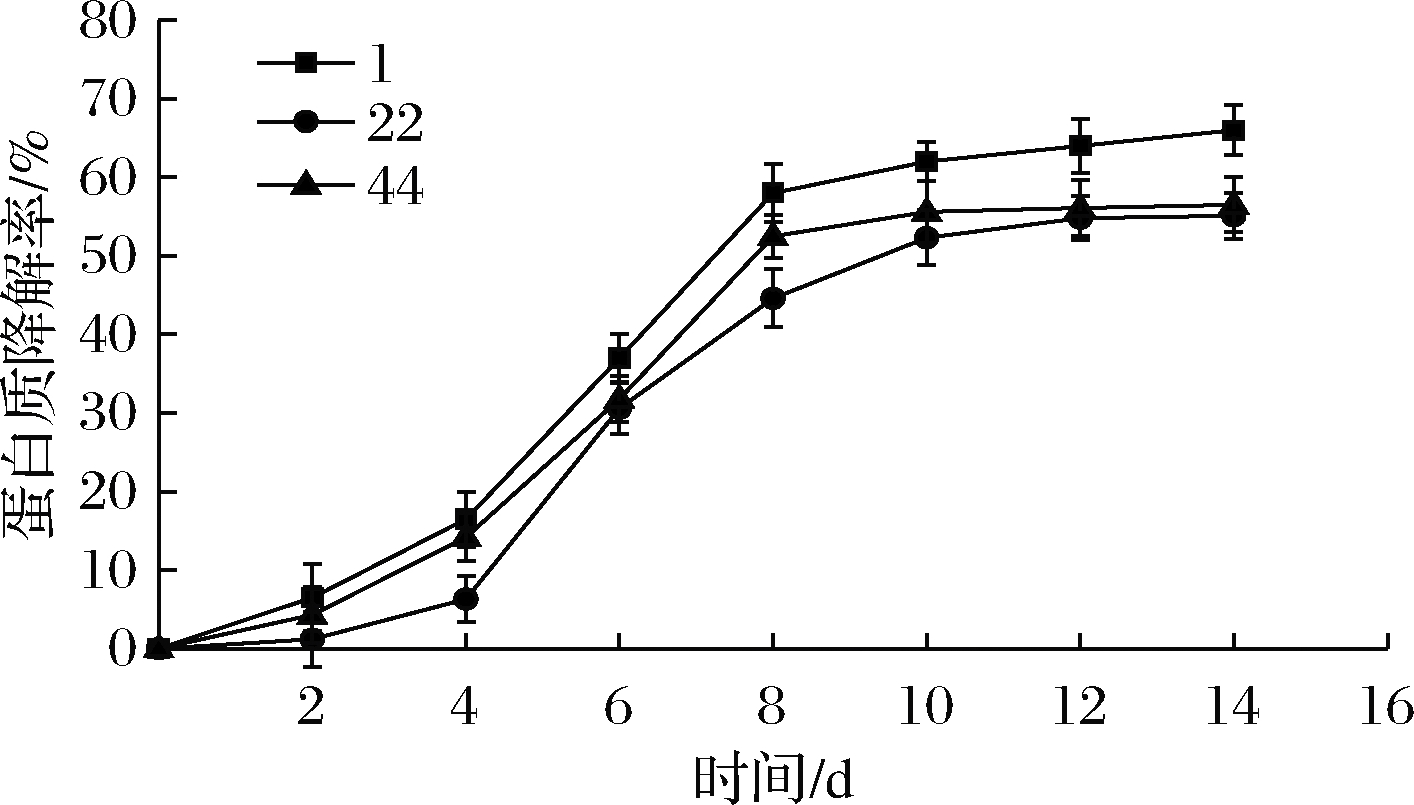
图2 不同菌种对蛋白质降解率的影响
Fig.2 Effects of different strains on protein degradation rate
2.1.3 低温发酵实验
低温发酵后,1号菌株对蛋白质仍有较强的降解能力,降解率为61.43%,高于2号菌株和44号菌株,见图3。相比复筛时20 ℃下的降解率有所降低,这是因为温度降低,菌株的活性降低[19],对其降解蛋白质的能力有抑制作用。与自然发酵状态下相比,硫化氢、吲哚、3-甲基吲哚有较大幅度的降低,见表4。各生物胺含量也比较低,尸胺最高为9.14 mg/L,亚精胺最低为2.37 mg/L,所以该菌株可用于马铃薯淀粉汁水中蛋白质的降解。
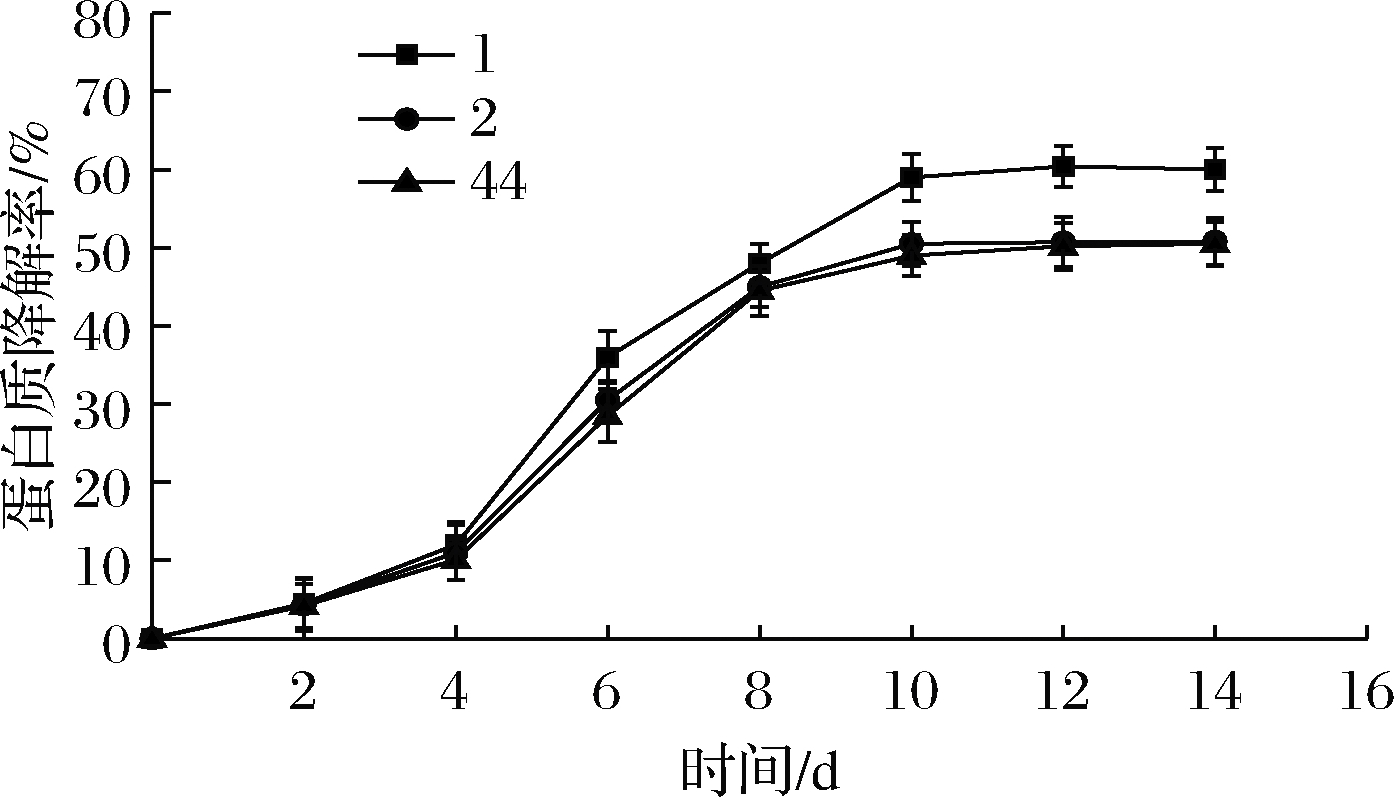
图3 不同菌株低温发酵对蛋白质降解率的影响
Fig.3 Effect of low temperature fermentation of different strains on protein degradation rate
对发酵后的马铃薯淀粉汁水中氨基酸含量进行检测,结果见表5,其含有丰富氨基酸资源,缬氨酸含量高达21.17 mg/L,苯丙氨酸含量13.14 mg/L,门冬氨酸11.798 mg/L,其中氨基酸分子可以被植物快速吸收,直接利用可以满足灌溉时作为对营养物质的需求,可使用该汁水进行还田灌溉[20],且不造成污染。
2.2 菌株鉴定
2.2.1 菌株形态学鉴定图
菌株J001在酪蛋白分离培养基上形态特征如图4-a 所示,单个菌落中间凸起,不透明,边缘不规则,大小为1~2.5 mm,呈红色。显微镜下的形态如图4-b 所示,镜检为近球型短杆状,革兰氏阴性,无荚膜,无芽孢。
表2 菌株复筛结果
Table 2 Re-screening results of strains
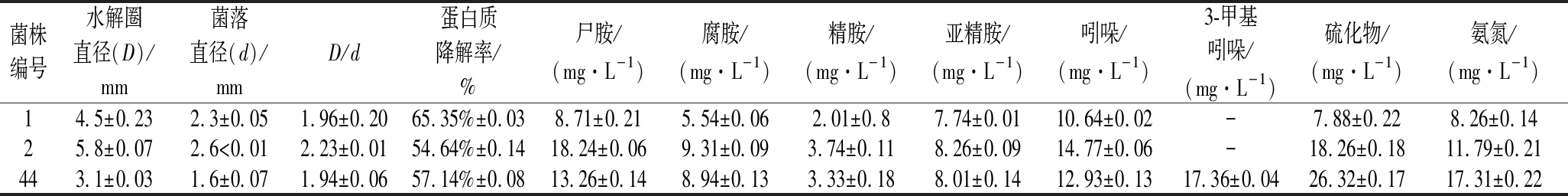
菌株编号水解圈直径(D)/mm菌落直径(d)/mmD/d蛋白质降解率/%尸胺/(mg·L-1)腐胺/(mg·L-1)精胺/(mg·L-1)亚精胺/(mg·L-1)吲哚/(mg·L-1)3-甲基吲哚/(mg·L-1)硫化物/(mg·L-1)氨氮/(mg·L-1)14.5±0.232.3±0.051.96±0.2065.35%±0.038.71±0.215.54±0.062.01±0.87.74±0.0110.64±0.02-7.88±0.228.26±0.1425.8±0.072.6<0.012.23±0.0154.64%±0.1418.24±0.069.31±0.093.74±0.118.26±0.0914.77±0.06-18.26±0.1811.79±0.21443.1±0.031.6±0.071.94±0.0657.14%±0.0813.26±0.148.94±0.133.33±0.188.01±0.1412.93±0.1317.36±0.0426.32±0.1717.31±0.22
注:“-”表示未检出(下同)
表3 不同菌种发酵后挥发性物质的相对含量 单位:%
Table 3 Relative content of volatile substances after fermentation of different strains
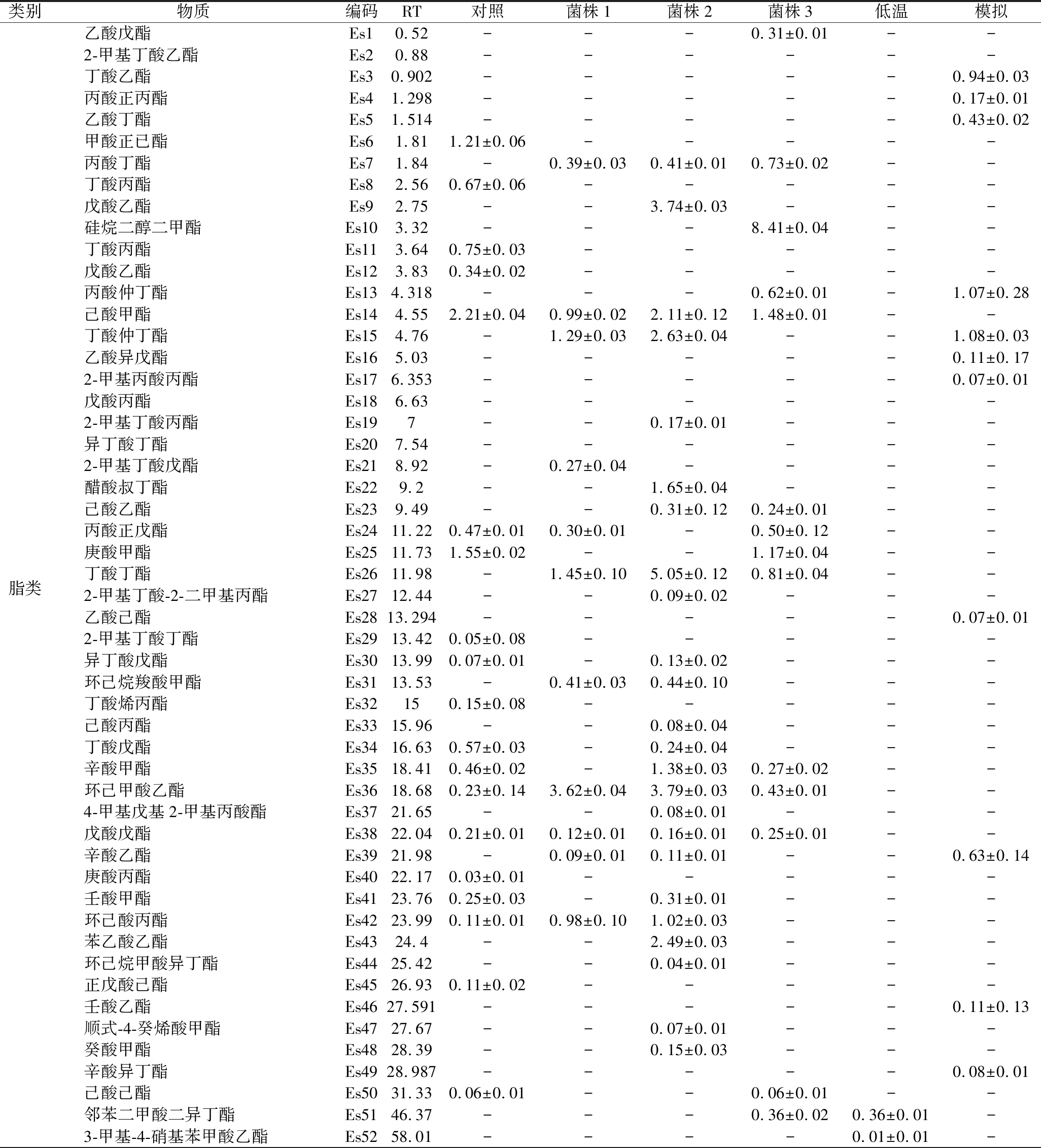
类别物质编码RT对照菌株1菌株2菌株3低温模拟乙酸戊酯Es10.52---0.31±0.01--2-甲基丁酸乙酯Es20.88------丁酸乙酯Es30.902-----0.94±0.03丙酸正丙酯Es41.298-----0.17±0.01乙酸丁酯Es51.514-----0.43±0.02甲酸正已酯Es61.811.21±0.06-----丙酸丁酯Es71.84-0.39±0.030.41±0.010.73±0.02--丁酸丙酯Es82.560.67±0.06-----戊酸乙酯Es92.75--3.74±0.03---硅烷二醇二甲酯Es103.32---8.41±0.04--丁酸丙酯Es113.640.75±0.03-----戊酸乙酯Es123.830.34±0.02-----丙酸仲丁酯Es134.318---0.62±0.01-1.07±0.28己酸甲酯Es144.552.21±0.040.99±0.022.11±0.121.48±0.01--丁酸仲丁酯Es154.76-1.29±0.032.63±0.04--1.08±0.03乙酸异戊酯Es165.03-----0.11±0.172-甲基丙酸丙酯Es176.353-----0.07±0.01戊酸丙酯Es186.63------2-甲基丁酸丙酯Es197--0.17±0.01---异丁酸丁酯Es207.54------2-甲基丁酸戊酯Es218.92-0.27±0.04----醋酸叔丁酯Es229.2--1.65±0.04---己酸乙酯Es239.49--0.31±0.120.24±0.01--丙酸正戊酯Es2411.220.47±0.010.30±0.01-0.50±0.12--庚酸甲酯Es2511.731.55±0.02--1.17±0.04--脂类丁酸丁酯Es2611.98-1.45±0.105.05±0.120.81±0.04--2-甲基丁酸-2-二甲基丙酯Es2712.44--0.09±0.02---乙酸己酯Es2813.294-----0.07±0.012-甲基丁酸丁酯Es2913.420.05±0.08-----异丁酸戊酯Es3013.990.07±0.01-0.13±0.02---环己烷羧酸甲酯Es3113.53-0.41±0.030.44±0.10---丁酸烯丙酯Es32150.15±0.08-----己酸丙酯Es3315.96--0.08±0.04---丁酸戊酯Es3416.630.57±0.03-0.24±0.04---辛酸甲酯Es3518.410.46±0.02-1.38±0.030.27±0.02--环己甲酸乙酯Es3618.680.23±0.143.62±0.043.79±0.030.43±0.01--4-甲基戊基2-甲基丙酸酯Es3721.65--0.08±0.01---戊酸戊酯Es3822.040.21±0.010.12±0.010.16±0.010.25±0.01--辛酸乙酯Es3921.98-0.09±0.010.11±0.01--0.63±0.14庚酸丙酯Es4022.170.03±0.01-----壬酸甲酯Es4123.760.25±0.03-0.31±0.01---环己酸丙酯Es4223.990.11±0.010.98±0.101.02±0.03---苯乙酸乙酯Es4324.4--2.49±0.03---环己烷甲酸异丁酯Es4425.42--0.04±0.01---正戊酸己酯Es4526.930.11±0.02-----壬酸乙酯Es4627.591-----0.11±0.13顺式-4-癸烯酸甲酯Es4727.67--0.07±0.01---癸酸甲酯Es4828.39--0.15±0.03---辛酸异丁酯Es4928.987-----0.08±0.01己酸己酯Es5031.330.06±0.01--0.06±0.01--邻苯二甲酸二异丁酯Es5146.37---0.36±0.020.36±0.01-3-甲基-4-硝基苯甲酸乙酯Es5258.01----0.01±0.01-
续表3
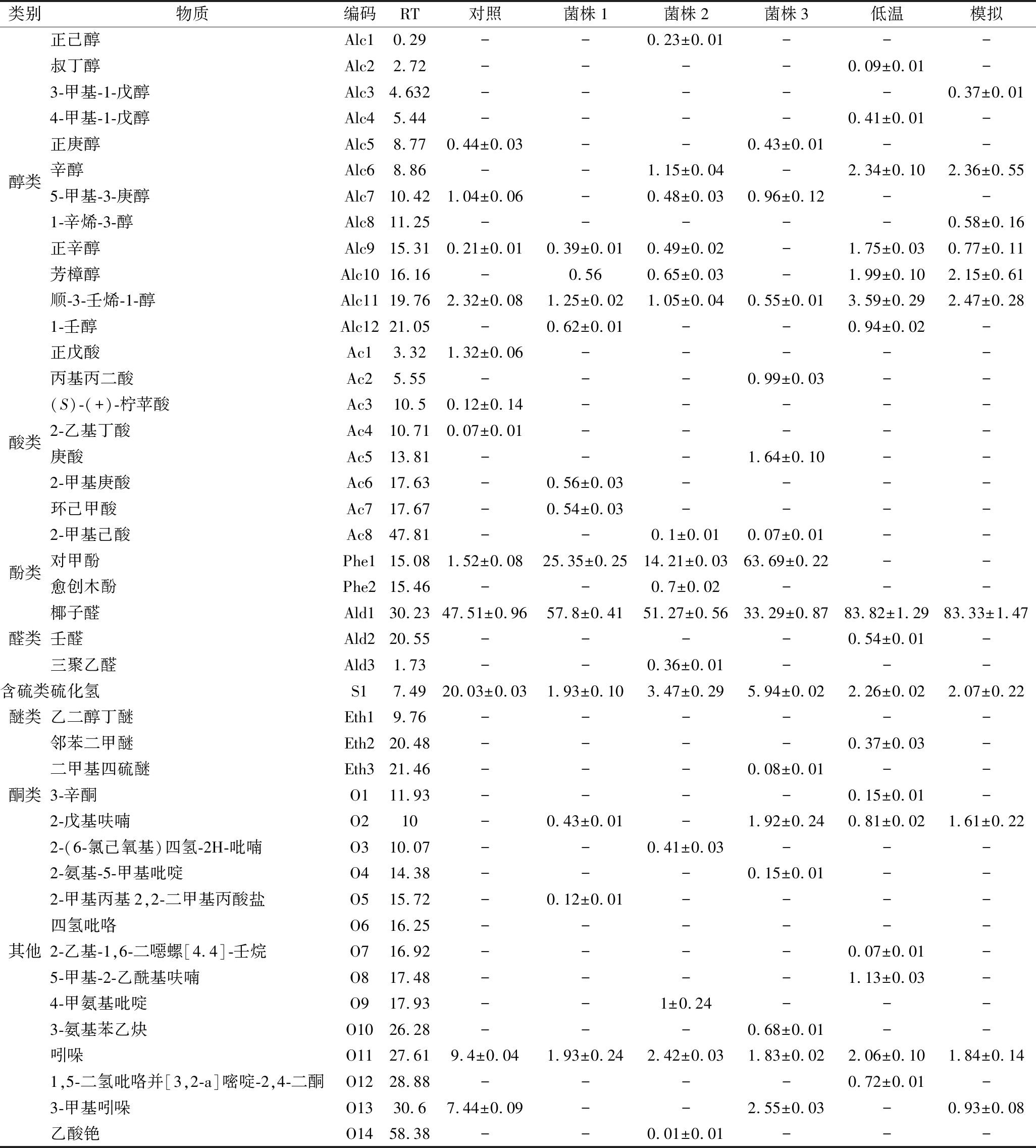
类别物质编码RT对照菌株1菌株2菌株3低温模拟正己醇Alc10.29--0.23±0.01---叔丁醇Alc22.72----0.09±0.01-3-甲基-1-戊醇Alc34.632-----0.37±0.014-甲基-1-戊醇Alc45.44----0.41±0.01-正庚醇Alc58.770.44±0.03--0.43±0.01--醇类辛醇Alc68.86--1.15±0.04-2.34±0.102.36±0.555-甲基-3-庚醇Alc710.421.04±0.06-0.48±0.030.96±0.12--1-辛烯-3-醇Alc811.25-----0.58±0.16正辛醇Alc915.310.21±0.010.39±0.010.49±0.02-1.75±0.030.77±0.11芳樟醇Alc1016.16-0.560.65±0.03-1.99±0.102.15±0.61顺-3-壬烯-1-醇Alc1119.762.32±0.081.25±0.021.05±0.040.55±0.013.59±0.292.47±0.281-壬醇Alc1221.05-0.62±0.01--0.94±0.02-正戊酸Ac13.321.32±0.06-----丙基丙二酸Ac25.55---0.99±0.03--(S)-(+)-柠苹酸Ac310.50.12±0.14-----酸类2-乙基丁酸Ac410.710.07±0.01-----庚酸Ac513.81---1.64±0.10--2-甲基庚酸Ac617.63-0.56±0.03----环己甲酸Ac717.67-0.54±0.03----2-甲基己酸Ac847.81--0.1±0.010.07±0.01--酚类对甲酚Phe115.081.52±0.0825.35±0.2514.21±0.0363.69±0.22--愈创木酚Phe215.46--0.7±0.02---椰子醛Ald130.2347.51±0.9657.8±0.4151.27±0.5633.29±0.8783.82±1.2983.33±1.47醛类壬醛Ald220.55----0.54±0.01-三聚乙醛Ald31.73--0.36±0.01---含硫类硫化氢S17.4920.03±0.031.93±0.103.47±0.295.94±0.022.26±0.022.07±0.22醚类乙二醇丁醚Eth19.76------邻苯二甲醚Eth220.48----0.37±0.03-二甲基四硫醚Eth321.46---0.08±0.01--酮类3-辛酮O111.93----0.15±0.01-2-戊基呋喃O210-0.43±0.01-1.92±0.240.81±0.021.61±0.222-(6-氯己氧基)四氢-2H-吡喃O310.07--0.41±0.03---2-氨基-5-甲基吡啶O414.38---0.15±0.01--2-甲基丙基2,2-二甲基丙酸盐O515.72-0.12±0.01----四氢吡咯O616.25------其他2-乙基-1,6-二噁螺[4.4]-壬烷O716.92----0.07±0.01-5-甲基-2-乙酰基呋喃O817.48----1.13±0.03-4-甲氨基吡啶O917.93--1±0.24---3-氨基苯乙炔O1026.28---0.68±0.01--吲哚O1127.619.4±0.041.93±0.242.42±0.031.83±0.022.06±0.101.84±0.141,5-二氢吡咯并[3,2-a]嘧啶-2,4-二酮O1228.88----0.72±0.01-3-甲基吲哚O1330.67.44±0.09--2.55±0.03-0.93±0.08乙酸铯O1458.38--0.01±0.01---
表4 低温发酵后各主要物质含量 单位:mg/L
Table4 The content of main substances after low temperature fermentation

菌株尸胺腐胺亚精胺精胺吲哚3-甲基吲哚硫化物氨氮1号菌9.14±0.196.35±0.112.37±0.087.02±0.1711.77±0.78-9.38±0.099.68±0.06CK 37.28±0.1623.55±0.0925.18±0.059.95±0.2030.17±0.8822.84±0.7147.39±0.9140.83±0.82
表5 发酵后马铃薯淀粉汁水中各氨基酸含量 单位:mg/L
Table 5 Contents of amino acids in potato starch juice after fermentation

种类含量种类含量门冬氨酸11.798蛋氨酸 0.47苏氨酸 4.48异亮氨酸9.91丝氨酸 13.13亮氨酸 8.87谷氨酸 16.64酪氨酸 7.41甘氨酸 12.13苯丙氨酸13.14丙氨酸 9.71赖氨酸 6.78半胱氨酸4.31组氨酸 8.03缬氨酸 21.17精氨酸 8.94脯氨酸 11.37
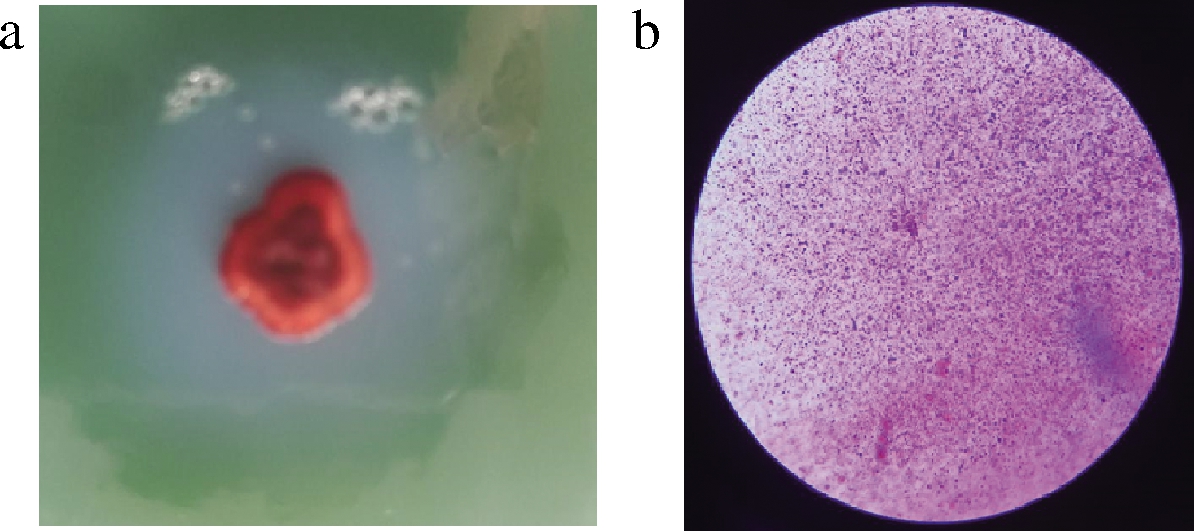
a-菌落形态;b-镜检图片
图4 菌落形态特征图
Fig.4 The mrophological characteristics of the strain
2.2.2 生理生化鉴定
由表6可知,该菌株为革兰氏阴性菌,吲哚、MR、淀粉还原实验结果为阴性;VP、过氧化氢和硫化氢实验结果为阳性。这些结果显示1号菌株的生理生化特性与粘质沙雷氏菌的各项生理生化特性都符合。
表6 生理生化鉴定表
Table 6 Physiological and biochemical identification

试验方法测定结果革兰氏染色-麦芽糖+蔗糖+甘露糖+葡萄糖+果糖-乳糖-H2O2酶试验+V-P试验+淀粉水解试验-H2S 试验+吲哚试验-
注:“+”表示阳性,“-”表示阴性
2.2.3 菌株J001的16S rDNA鉴定
1号菌株电泳结果见图5,经比对,1号菌株与标准菌株NR044385.1在同一支系,相似度达99%,见图6,故1号菌株初步鉴定为粘质沙雷氏菌(Serratia marcescens)[21],起名为NXYS-S。
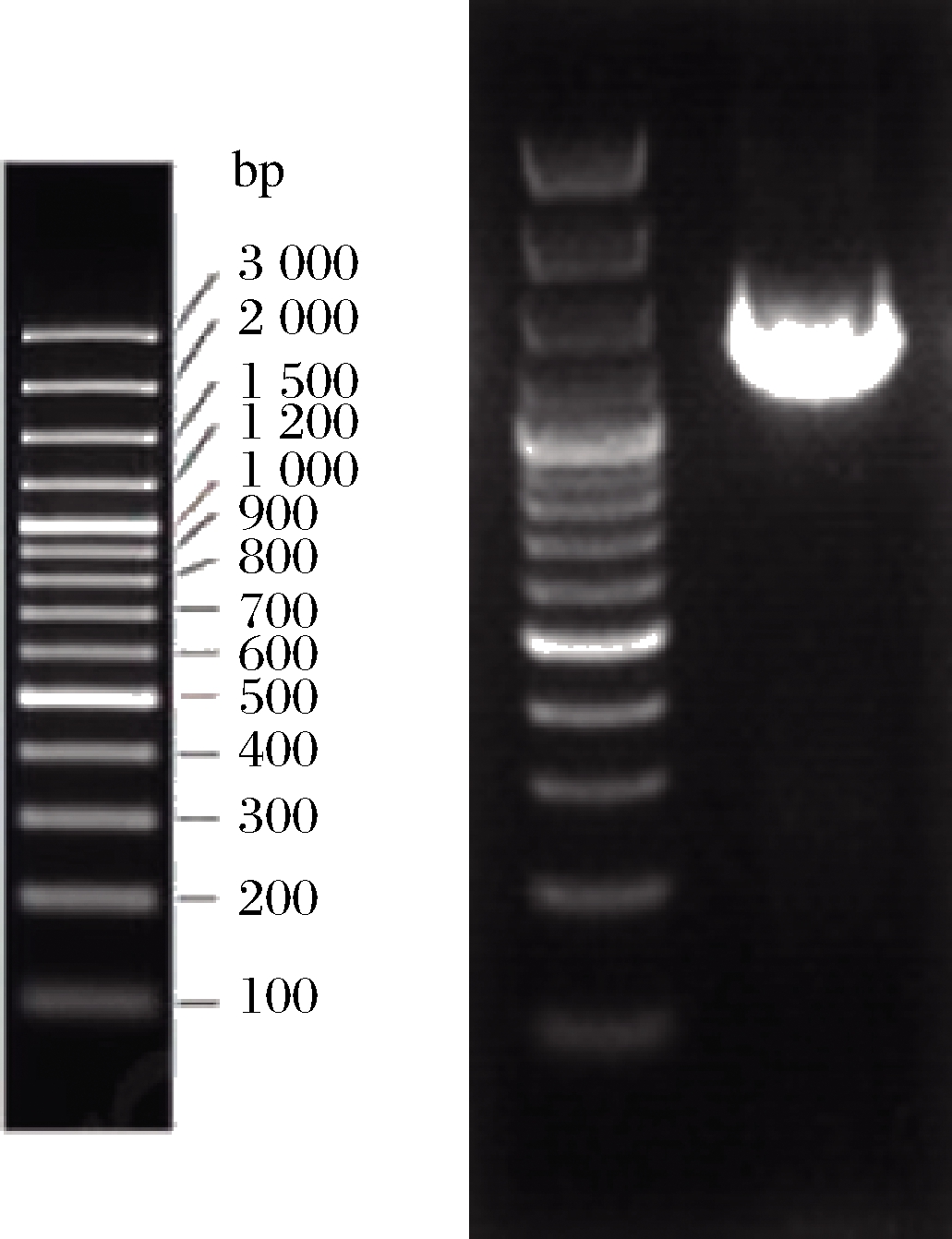
图5 1号菌电泳结果
Fig.5 J001pcr amplification electrophoresis
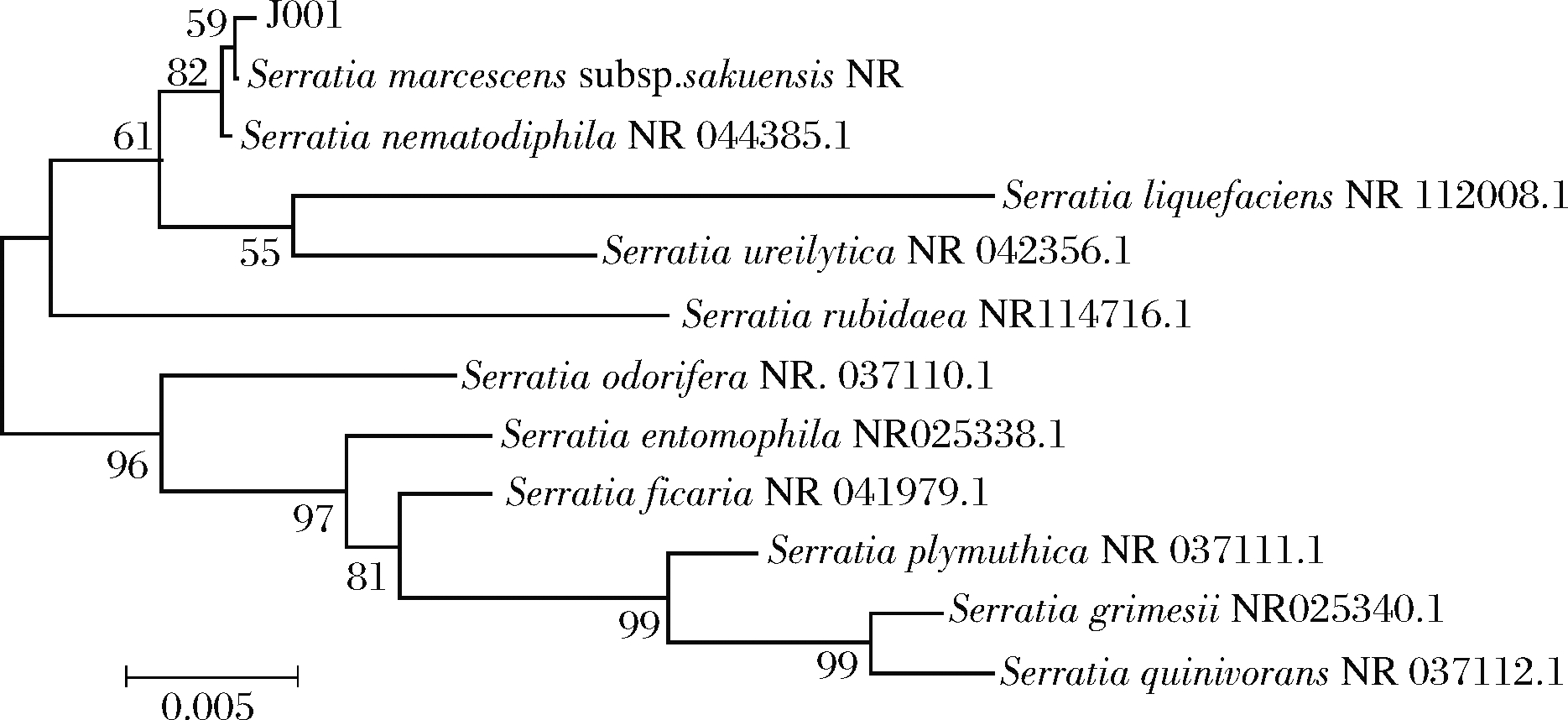
图6 1号菌株系统发育树
Fig.6 J001 strain phylogenetic tree
3 结论
实验通过初筛、复筛,以蛋白质降解率和挥发性气体中的臭味物质为指标,筛选了1株可降解马铃薯汁水的菌株,该菌株在15 ℃以下,接种量为2%,pH值保持原始状态的情况下发酵,对蛋白质还具有一定的降解作用,而且未检测到3-甲基吲哚物质,只测定到引起臭味的少量尸胺、腐胺、精胺、亚精胺等物质,并且含量较低,感官评分较好。该菌株经过生理生化实验(吲哚、MR、淀粉还原实验结果为阴性;VP、过氧化氢和硫化氢实验结果为阳性)以及16S rRNA鉴定后,初步得出该菌种为粘质沙雷氏菌(Serratia marcescens),又称灵杆菌,起名为NXYS-S。
[1] 何进勤,金建新,胡元峰,等.马铃薯淀粉加工汁水灌溉对土壤养分及重金属含量的影响[J].宁夏农林科技,2018,59(12):4-6;10.
HE J Q, JIN J X, HU Y F, et al.Effect of different potato-starch processing juice irrigation on soil nutrients and heavy metal content[J].Ningxia Agriculture and Forestry Science and Technology, 2018, 59(12):4-6;10.
[2] 杨月娇,马智玲,白英,等.提取方法对马铃薯渣果胶结构特征及特性的影响[J/OL].食品与发酵工业.2020.https://doi.org/10.13995/j.cnki.11-1802/ts.025710.
YANG Y J, MA Z L, BAI Y,et al.Extraction methods on structure and properties of pectin from potato residue[J/OL].Food and Fermentation Industry, 2020.https://doi.org/10.13995/j.cnki.11-1802/ts.025710.
[3] ANTWI P, LI J Z, BOADI P O, et al.Functionalbacterial and archaeal diversity revealed by 16S rRNA gene pyrosequencing during potato starch processing wastewater treatment in an UASB[J].Bioresource Technology, 2017, 235:348-357.
[4] 石军英.马铃薯废渣废液的综合利用[D].北京:北京化工大学, 2009.
SHI J Y.Thecomprehensive utilization of potato processing waste[D].Beijing:Beijing University of Chemical Technology, 2009.
[5] 邢晓莹,刘毅,张怀敏,等.山西老陈醋醋酸发酵过程中优良产酸菌株的筛选及鉴定[J].食品与发酵工业,2021,47(6):202-208.
XING X Y, LIU Y, ZHANG H M, et al.Screening and identification of excellent acid-producing strains in the fermentation of Shanxi aged vinegar[J].Food and Fermentation Industry,2021,47(6):202-208.
[6] ZHANG C, LI J H, WU X M, et al.Rapid degradation of dimethomorph in polluted water and soil by Bacillus cereus WL08 immobilized on bamboo charcoal-sodium alginate[J].Journal of Hazardous Materials, 2020,398:122 806.
[7] SHAFI J.Isolation, identification of antagonistic bacteria and its mode of action against gray mold disease of tomato caused by botrytis cinerea[D].2017.
[8] 田平雅.耐盐植物根际细菌多样性研究及促生菌筛选和复合菌群构建[D].银川:宁夏大学,2019.
TIAN P Y.Bacterial diversity inrhizosphere of salt-tolerantplants, PGPR screening and microflora construction[D].YinChuan:Ningxia University, 2019.
[9] SALMABI K A,LYNETTE K A, BEDE S M,et al. Response of wheat to a multiple species microbial inoculant compared to fertilizer application[J].Frontiers in Plant Science,2018.DOI:10.3389/fpls.2018.01601.
[10] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:66-95.
DONG X Z, CAI M Y.Handbook of Systematic Identification of Common Bacteria[M].Beijing:Science Press,2001:66-95.
[11] R.E.布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984:450-454.
R.E.BU K N.Berger Handbook of Bacterial Identification[M].Beijing:Science Press,1984:450-454.
[12] 鲁姗. 处理农村生活污水的复合菌剂构建及发酵条件优化[D].呼和浩特:内蒙古农业大学, 2019.
LU S. Construction of compound inoculant for treatment of rural domestic sewage and optimization of fermentation conditions[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[13] ZARGHAMPOUR F, YAMINI Y, BAHARFAR M, et al.Electromembrane extraction of biogenic amines in food samples by a microfluidic-chip system followed by dabsyl derivatization prior to high performance liquid chromatography analysis[J].Journal of Chromatography A Including Electrophoresis & Other Separation Methods, 2018, 1 556:21-28.
[14] 王金灿. GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》之5.1凯氏定氮法具体操作疑难解析[J].食品安全导刊, 2018(30):54-55.
WANG J C.GB 5009.5—2016 Determination of protein in food according to national food safety standard-5.1 analysis of the specific operation difficulties of Kjeldgren Nitrogen Determination method[J].Food Safety Guide, 2018(30):54-55.
[15] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.124—2016 食品安全国家标准 食品中氨基酸的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China, National Medical Products Administration.GB 5009.124—2016 Determination of amino aacids in food according to national standard for food safety[S].Beijing:Standards Press of China, 2016.
[16] 孙翠香, 田宇, 谢倩, 等. 气相色谱/质谱测定电子垃圾拆解区土壤中四溴双酚A的方法[J]. 生态环境学报, 2013, 22(10):1 717-1 720.
SUN C X, TIAN Y, XIE Q, et al. Determination of tetrabromobisphenol-A in electronic waste area soil by gas chromatography-mass spectrometry[J]. Ecology and Environment Sciences, 2013, 22(10):1 717-1 720.
[17] HE Z, CHEN H Y,WANG X Y, et al.Effects of different temperatures on bacterial diversity and volatile flavor compounds during the fermentation of suancai,a traditional fermented vegetable food from northeastern China[J].LWT-Food Science and Technology, 2020, 118:108 773.
[18] 赵洪雷, 尹一鸣, 陈义莹, 等.不同产地虾酱风味特征及差异分析[J].食品与发酵工业, 2019, 45(10):194-200.
ZHAO H L, YIN Y M, CHEN Y Y, et al.Flavor characteristics of shrimp pastes from different regions and variance analysis[J].Food and Fermentation Industries.2019, 45(10):194-200.
[19] DE M J, CHIAKI K, XIU W Z, et al.Phylogeographic separation of marine and soil myxobacteria at high levels of classification.2010, 4(12):1 520-1 530.
[20] KATO C, HONMA A, SATO S, et al.Poly 3-hydroxybutyrate- co -3-hydroxyhexanoate films can be degraded by the deep-sea microbes at high pressure and low temperature conditions[J].High Pressure Research, 2019.DOI:10.1080/08957959.2019.1584196.
[21] SALGADO C A,ALMEIDA F A D,BARROS E, et al.Identification and characterization of a polyurethanase with lipase activity from Serratia liquefaciens isolated from cold raw cow′s milk[J].Food Chemistry, 2021, 337:127 954.