铁皮石斛为兰科石斛属植物,药食两用,具有良好的药用价值和生理功能,如生津益胃,清热滋阴,美容养颜等[1-3]。铁皮石斛中含有大量多糖[4]、黄酮[5]、多酚[6]、生物碱[7]等,具有抗氧化[8]、降血糖[9]、抗肿瘤[10]、抗菌[11]及神经保护作用[12]等功效。铁皮石斛花是石斛属石斛草的花朵,同为食物与药物[13],每年5~7月、10~11月盛开,花期较短[14]。有研究表明,铁皮石斛花中含有多糖、黄酮、多酚以及花色苷等,对体外抗氧化以及降血糖有一定的功效[15-17]。近年来,随着铁皮石斛种植面积的不断扩大,铁皮石斛花的产量不断增加,但主要研究仍集中于石斛茎部位,对铁皮石斛花研究较少,其开发的产品形式单一,且价格昂贵,既限制了消费群体又易导致资源浪费[18]。本研究将铁皮石斛花与菊花及茉莉花进行复配,旨在得到一种兼具良好功效和口感,且价格适中,受众广泛的复合花茶产品。
超过一定范围的自由基容易诱发人体疾病,加速机体衰老,抗氧化物质通过消除自由基从而起到保护机体,减少损伤的作用[19]。目前,降血糖功效研究主要集中于体外、细胞及动物实验三方面,体外实验通过降低α-葡萄糖苷酶和α-淀粉酶的活性来阻碍食物中碳水化合物的消化吸收,抑制这些酶就可以有效控制糖尿病患者的血糖水平[20]。缪园欣等[21]发现,铁皮石斛花总黄酮对DPPH自由基、羟自由基有明显的清除作用, 当质量浓度达10 mg/mL时, 其清除率分别为89.77%和80.01%。本研究将石斛花茶与菊花、茉莉花进行混料设计,以活性成分含量结合感官评价,通过权重评分方式得出最佳配比,同时对3种复配原料及复配花茶进行了体外抗氧化及体外降血糖试验,旨在为拓展石斛花多元化产品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
铁皮石斛花茶,实验室自制;茉莉花(干花),山东才和锐生物技术有限公司;胎菊(干花),中闽飘香食品有限公司。
1.1.2 试剂
浓硫酸,重庆茂业化学试剂有限公司;芦丁标准品、α-淀粉酶、α-葡萄糖苷酶、阿卡波糖、对硝基苯基- α-D-葡萄糖吡喃苷,上海源叶生物科技有限公司;福林酚、Tris、ABTS,北京索宝来科技有限公司;DPPH,梯希爱(上海)化成工业发展有限公司。
1.1.3 仪器与设备
智能型电热恒温鼓风干燥箱,上海琅玕实验设备有限公司;智能化静态微波真空干燥机,贵阳新奇微波工业有限责任公司;SPECTRA MAX 190光吸收全波长酶标仪,美谷分子仪器(上海)有限公司;L5S紫外可见分光光度计,上海仪电分析仪器有限公司;KH-700V型超声波清洗器,昆山禾创超声仪器有限公司;VaCo5-Ⅱ-D真空冷冻干燥仪,德国Zirbus仪器公司。
1.2 试验方法
1.2.1 铁皮石斛复配花茶制作工艺筛选
1.2.1.1 铁皮石斛复配花茶工艺流程
铁皮石斛复配花茶工艺流程如图1所示。
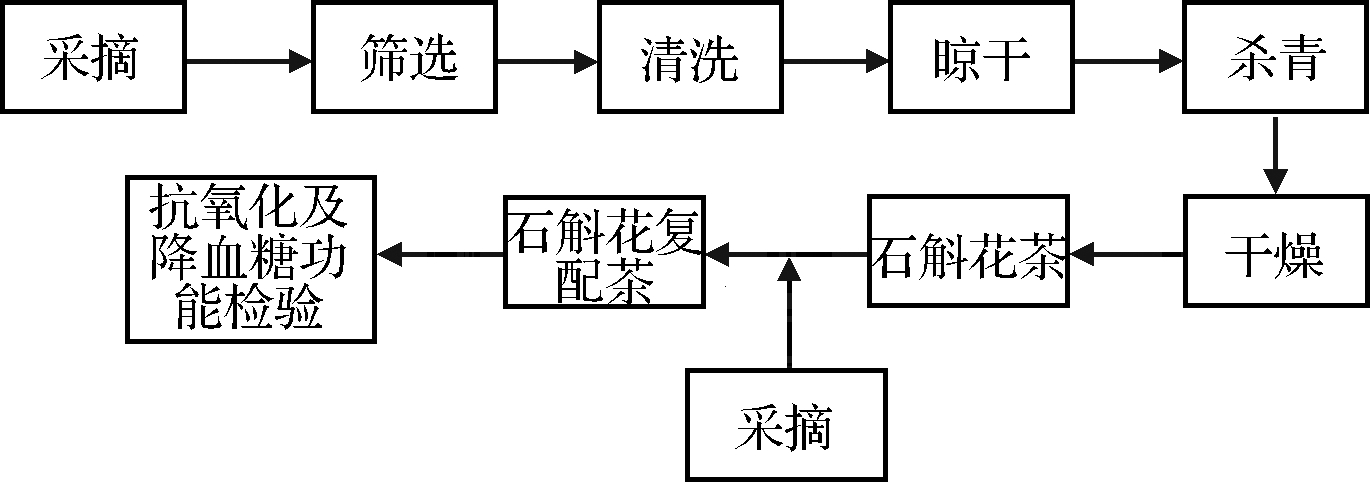
图1 工艺流程图
Fig.1 Process flow chart
1.2.2 指标测定
1.2.2.1 茶汤制备
取铁皮石斛复配花茶1 g,茶水比1∶50,用沸水冲泡2次,每次冲泡30 min,过滤,将2次所得的茶汤混合,待用。
1.2.2.2 苯酚-硫酸法测定多糖
样品测定液的制备:准确吸取2 mL茶汤至10 mL离心管中,准确加入8 mL无水乙醇溶液,摇匀,4 ℃冷藏12 h,取出后4 000 r/min离心20 min,去上清,沉淀用体积分数80%乙醇洗涤2次,每次加8 mL 80%(体积分数)乙醇,用蒸馏水将沉淀加热溶解,定容至50 mL容量瓶中,摇匀,即得样品测定液。
分别移取葡萄糖标准溶液(0、0.2、0.4、0.6、0.8、1.0 mL)、水及待测液(作空白对照)1 mL于10 mL具塞试管中,补水至1 mL,加入5%苯酚溶液1 mL,摇匀,加入5 mL 浓硫酸,摇匀,90 ℃水浴20 min,冰浴5 min,在488 nm波长处测定吸光度。根据不同浓度的葡萄糖标准溶液及其测定结果绘制标准曲线(y=9.925 7x+0.01,相关系数R2=0.999 5),依据标准曲线和茶汤稀释倍数,计算出茶汤样品中多糖的含量[22]。
1.2.2.3 硝酸铝比色法测定总黄酮
分别移取芦丁标准溶液(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL)、水(作空白对照)及茶汤各1.0 mL于试管内,补70%(体积分数)乙醇溶液至5 mL,加0.4 mL 50 g/L亚硝酸钠水溶液,混匀,静置6 min,加0.4 mL 100 g/L硝酸铝水溶液,混匀,静置6 min,加4 mL 40 g/L氢氧化钠水溶液,混匀,反应15 min,在510 nm 波长下测定其吸光度。根据不同浓度的芦丁标准溶液及其测定结果绘制标准曲线(y=0.012 5x+0.009 4,相关系数R2=0.999 1),依据标准曲线和茶汤稀释倍数,计算出茶汤样品中总黄酮的含量[23]。
1.2.2.4 福林酚法测定总酚
分别移取没食子酸标准溶液、水(作空白对照)及茶汤各1.0 mL于试管内,加入5.0 mL蒸馏水,1 mL福林-酚试剂,充分混匀后加入 3 mL 75 g/L碳酸钠溶液,振荡摇匀,于75 ℃水浴中避光反应 30 min,765 nm 波长下比色测定吸光度。根据不同浓度的没食子酸标准溶液及其测定结果绘制标准曲线(y=0.012 5x+0.009 4,相关系数R2=0.999 1),依据标准曲线和茶汤稀释倍数,计算出茶汤样品中总酚的含量[24]。
1.2.3 感官评价
参照GB/T 23776—2018《茶叶感官评审方法》进行测定。感官评分计算如公式(1)所示:
Y=A×a+B×b+...E×e
(1)
式中:Y,茶叶审评总得分;A、B...E,各品质因子审评得分;a、b...c,各品质因子评分系数。
1.2.4 石斛花复配茶复配方式筛选
利用铁皮石斛花茶与菊花、茉莉花进行混料设计中的单纯形格子设计,参照多糖、多酚、黄酮提取方法以沸水浸提方式测定其多糖、黄酮、多酚含量变化,并结合感官评价进行权重分析,得到铁皮石斛复配花茶最佳复配方式。
表1 铁皮石斛复配花茶单纯形格子设计
Table 1 Single-pure lattice design of Dendrobium candidum complex camellia
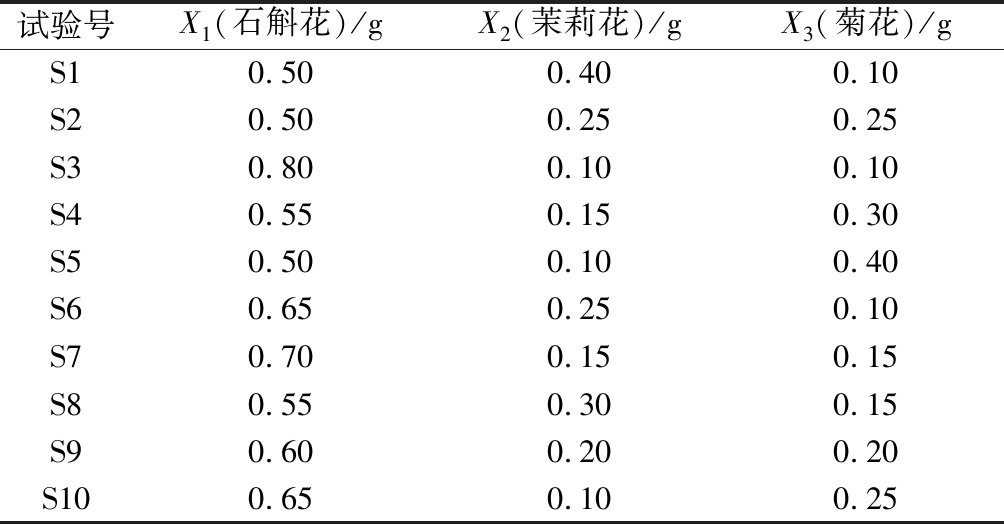
试验号X1(石斛花)/gX2(茉莉花)/gX3(菊花)/gS10.500.400.10S20.500.250.25S30.800.100.10S40.550.150.30S50.500.100.40S60.650.250.10S70.700.150.15S80.550.300.15S90.600.200.20S100.650.100.25
1.2.5 多指标权重确定[25]
本试验采用综合评价体系,各指标所占权重比例由课题组评定得出,以功能成分和感官为考核目标,产品研制的目标是以抗氧化及降血糖功能为主,同时兼具较好口感。功能成分决定了产品的食用价值及产品品质,而感官评分决定了口感及观赏性,因此功能成分权重占75%,感官占25%。有研究表明,石斛花、菊花和茉莉花中的多糖、黄酮、多酚都是与抗氧化功能及降血糖功能相关的主要功能成分,因此每项分别占25%。故得到多糖、黄酮、多酚及感官评分权重系数分别为0.25、0.25、0.25、0.25。通过SPPSAU软件进一步采用层次分析法对该权重设定进行了验证,各指标成分的评分标准见表2,建立的4项评价指标成对比较判断优先矩阵见表3。
表2 各层次评分标准
Table 2 Grading criteria at all levels

对比打分相同重要程度1同等重要3略为重要5基本重要7确实重要9绝对重要2、4、6、8两相邻程度中间值
表3 指标成对比较判断优先矩阵
Table 3 Indicator pairwise comparison judgment priority matrix

权重指标多糖黄酮多酚感官多糖1111黄酮1111多酚1111感官1111
1.2.6 体外抗氧化及体外降血糖测定方法
1.2.6.1 DPPH自由基清除能力测定
分别配制质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品水提液,参照王丽霞等[26]测定方法进行测定。对DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A0为 DPPH-乙醇溶液和蒸馏水的吸光度值;A1为 DPPH-乙醇溶液和样品溶液的吸光度值;A2为样品溶液和无水乙醇溶液的吸光度值。
1.2.6.2 超氧阴离子自由基清除率测定
分别配制质量浓度为0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的不同样品溶液,参照张娥珍等[27]测定方法进行测定。对超氧阴离子自由基的清除率计算如公式(3)所示:
超氧阴离子自由基清除率![]()
(3)
式中:A0为用蒸馏水代替样品提取液的吸光度;A1为样品提取液与试剂的吸光度;A2为样品溶液本身的吸光度,以蒸馏水代替邻苯三酚。
1.2.6.3 羟自由基清除率的测定
分别配制质量浓度为0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的不同样品溶液,参照王红静[28]测定方法进行测定。羟自由基清除率计算如公式(4)所示:
羟自由基清除率![]()
(4)
式中:A0为用蒸馏水代替样品提取液的吸光度;A1为样品提取液与试剂的吸光度;A2为样品溶液本身的吸光度,以蒸馏水代替0.3%双氧水溶液。
1.2.6.4 铁还原力的测定
分别配制质量浓度为0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的不同样品溶液,参照王炬等[24]测定方法进行测定;以VC为对照,实验重复3 次。
1.2.6.5 ABTS+自由基清除率的测定
以7 mmol/L ABTS、2.45 mmol/L K2S2O8等体积混合,室温避光反应16 h,用95%乙醇稀释至混合溶液在734 nm处吸光度为0.70(±0.02),得到ABTS+溶液。分别配制质量浓度为0.25、0.5、0.75、1.0、2.0 mg/mL的不同样品水提溶液,参照黎恩立[29]测定方法进行测定。ABTS+自由基清除率计算如公式(5)所示:
ABTS+自由基清除率![]()
(5)
式中:A0为用95%乙醇溶液代替样品提取液的吸光度;A1为样品提取液与试剂的吸光度;A2为样品溶液本身的吸光度,以95%乙醇溶液代替ABTS+工作液。
1.2.6.6 α-葡萄糖苷酶抑制活性的测定
分别配制质量浓度为0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的不同样品水提溶液,取50 μL样品提取液于试管中,加入50 μL 0.5 U/mL α-葡萄糖苷酶溶液充分混合,在37 ℃下水浴10 min,加入50 μL 2.5 mmol/L对硝基苯基-α-D-葡萄糖吡喃苷溶液和200 μL磷酸盐缓冲溶液(0.1 mol/L,pH 6.8),在37 ℃下孵育30 min,最后加入500 μL 1 mol/L的碳酸钠溶液终止反应,在405 nm处测定吸光度[30]。α-葡萄糖苷酶抑制率计算如公式(6)所示:
α-葡萄糖苷酶抑制率![]()
(6)
式中:A0为用缓冲液代替样品提取液的吸光度;A1为样品提取液与试剂的吸光度;A2为样品溶液本身的吸光度,以缓冲液代替α-葡萄糖苷酶液。
1.2.6.7 α-淀粉酶抑制活性的测定
分别配制质量浓度为0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的不同样品溶液,参照谭青云等[31]测定方法进行测定,利用公式(7)计算α-淀粉酶抑制率。
α-淀粉酶抑制率![]()
(7)
式中:A0为用去离子水代替样品提取液的吸光度;A1为样品提取液与试剂的吸光度;A2为样品溶液本身的吸光度,以去离子水代替α-淀粉酶液。
1.3 数据分析
采用Design Expert(8.0)、Excel 2010、SPSS Statistics 20和Origin 9.0软件分别进行数据分析和图表的绘制。
2 结果与分析
2.1 层次分析法确定多指标权重
通过层次分析方法公式计算,得多糖、黄酮、多酚、感官评价权重系数均为0.25,随机一致性比率CR=CI/RI,(CI为一致性指标,RI为平均随机一致性指标) 为评价计算的权重系数是否合理的指标, 本实验CR=0.000<0.1,说明权重系数有效合理,可用于铁皮石斛复配花茶复配方式综合评分,详见表4、表5。
表4 AHP层次分析结果
Table 4 AHP hierarchical analysis results
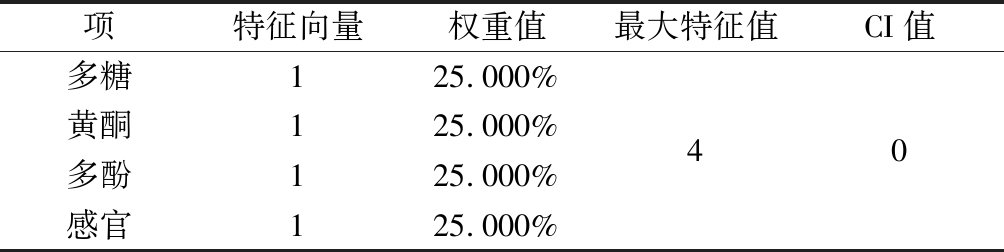
项特征向量权重值最大特征值CI值多糖125.000%黄酮125.000%40多酚125.000%感官125.000%
表5 RI值表
Table 5 RI value table
n阶34567RI值0.520.891.121.261.36
2.2 复配方式结果分析
表6列出了铁皮石斛复配花茶水提物的多糖、多酚、黄酮的含量,利用Design Expert(8.0.6)软件,对表4中的试验结果进行二次多项回归拟合,分别建立3个指标(Y多糖,Y多酚,Y黄酮)的回归模型,各回归模型的方程如下:
Y多糖=21.48X1+17.08X2+17.99X3
Y多酚=19.69X1+17.83X2+30.77 X3+13.72X1X2+2.16X1X3-2.51X2X3-56.50X1X2X3
Y黄酮=14.62X1+16.05X2+51.42X3+27.82X1X2-1.84 X1X3-11.74X2X3
表6 混料试验结果 单位:mg/100mL
Table 6 Mixing test results
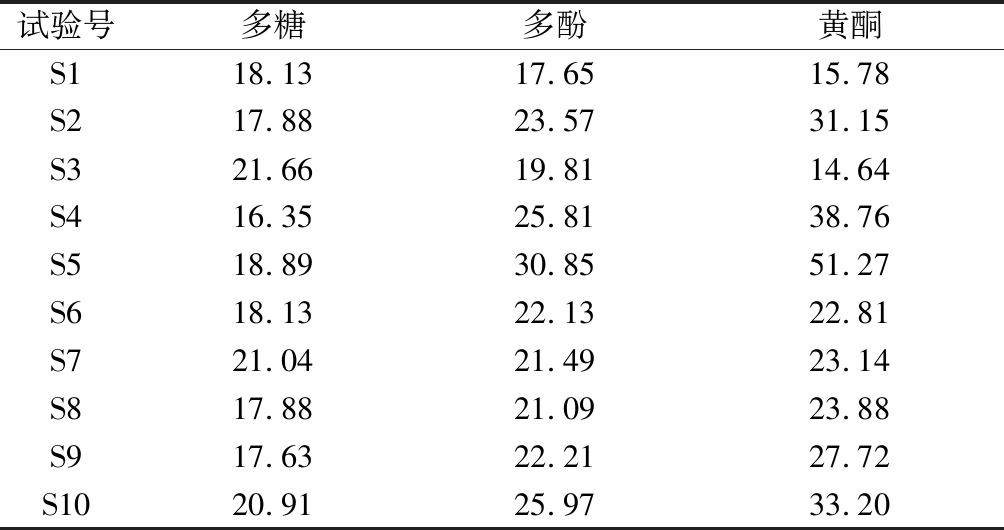
试验号多糖多酚黄酮S118.1317.6515.78S217.8823.5731.15 S321.6619.8114.64 S416.3525.8138.76 S518.8930.8551.27 S618.1322.1322.81 S721.0421.4923.14 S817.8821.0923.88 S917.6322.2127.72 S1020.9125.9733.20
对以上3个模型进行分析,其结果分别见表7~表9。由表7可知,二次模型的F值为5.03,大于F0.05(2,7)=4.74,说明P<0.05,所得回归方程在≤0.05时达到显著,多糖含量回归方程的决定系数R2=0.589 7,说明模型的拟合度较好。由表8可知,二次模型的F值为102.17,大于F0.01(6,3)=27.91,说明P<0.01,所得的回归方程极显著,多酚含量回归方程的决定系数R2=0.995 1,说明模型的拟合度很好,回归方程校正系数为R2(adj)=0.958 4。由表9可知,二次模型的F值为313.39,大于F0.01(5,4)=15.52,说明P<0.01,表明所得的黄酮含量的回归方程达到极显著,黄酮含量回归方程的决定系数R2=0.997 5,说明模型的拟合度很好,回归方程校正系数为R2(adj)=0.994 3,表明99.43%试验数据的变异性可用该回归模型进行解释。此模型在被研究的整个回归区域拟合良好,可用于响应值的预测。
表7 多糖含量回归模型方差分析
Table 7 Analysis of variance for regression model of polysaccharide content
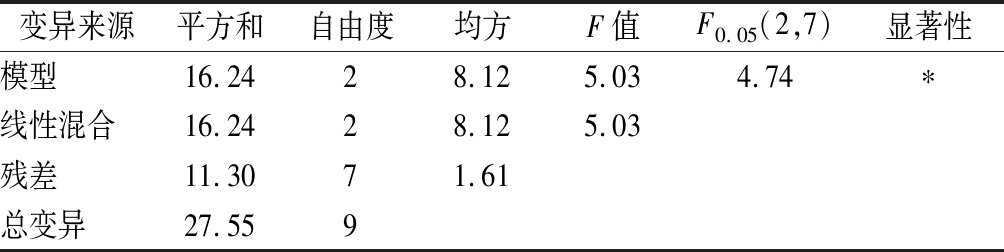
变异来源平方和自由度均方F值F0.05(2,7)显著性模型16.2428.125.034.74∗线性混合16.2428.125.03残差11.3071.61总变异27.559
注:R2=0.589 7,R2(adj)=0.472 5,*表示显著
表8 多酚含量回归模型方差分析
Table 8 Analysis of variance of polyphenol content regression model
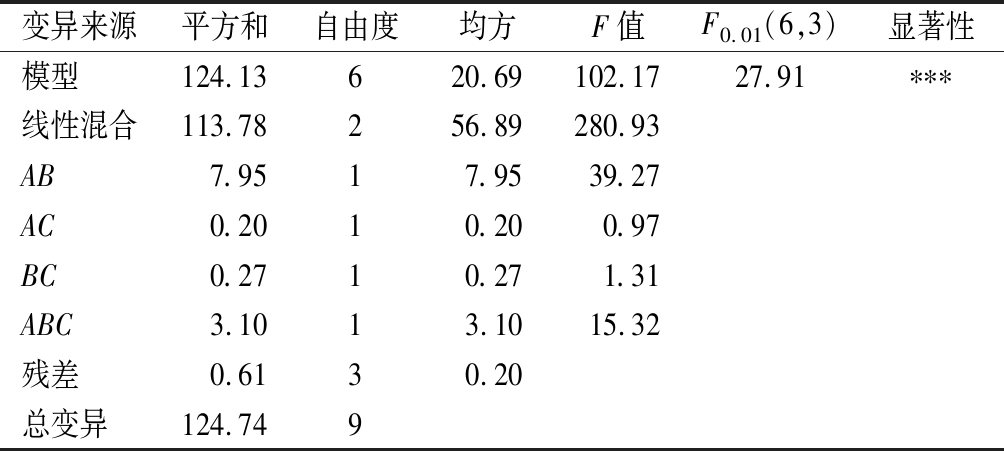
变异来源平方和自由度均方F值F0.01(6,3)显著性模型124.13620.69102.1727.91∗∗∗线性混合113.78256.89280.93AB7.9517.9539.27AC0.2010.200.97BC0.2710.271.31ABC3.1013.1015.32残差0.6130.20总变异124.749
注:R2=0.995 1,R2(adj)=0.958 4,***表示极显著
表9 黄酮含量回归模型方差分析
Table 9 Analysis of variance of flavonoid content regression model
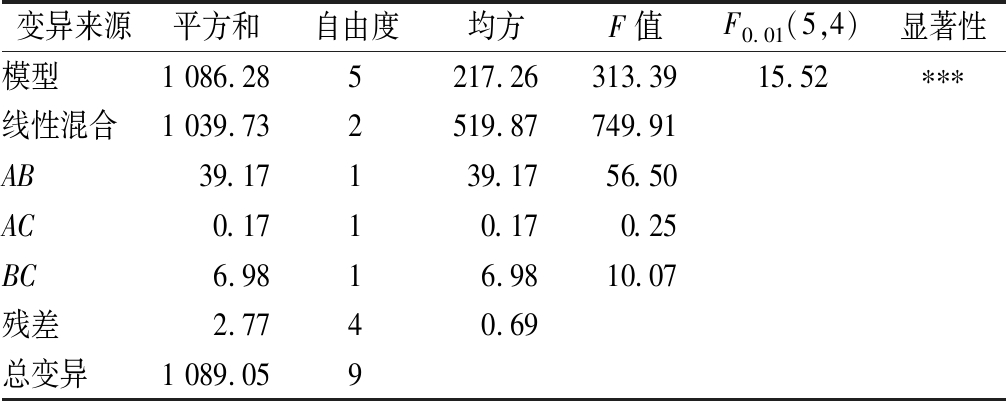
变异来源平方和自由度均方F值F0.01(5,4)显著性模型1 086.285217.26313.3915.52∗∗∗线性混合1 039.732519.87749.91AB39.17139.1756.50AC0.1710.170.25BC6.9816.9810.07残差2.7740.69总变异1 089.059
注:R2=0.997 5,R2(adj)=0.994 3,***表示极显著
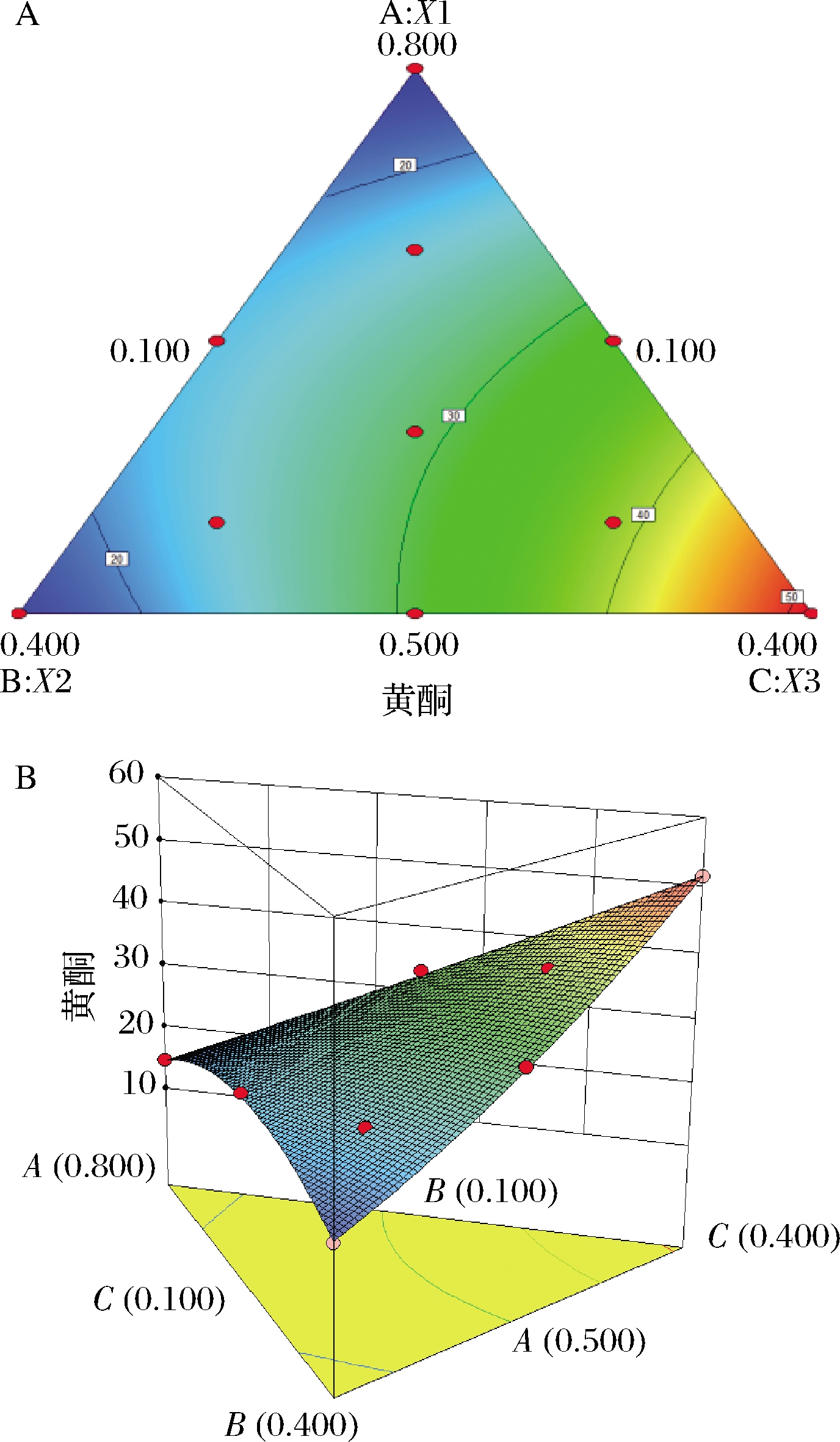
A-应响应面图;B-等高线图
图2 三种组分对黄酮含量的影响
Fig.2 Effects of three components on flavonoids content
由黄酮含量模型得到石斛花茶、茉莉花、菊花对黄酮含量响应面图及等高线图(图2)。从图2中的响应曲面图可知黄酮含量的最大值约为51.27 mg/100mL。
2.2.1 不同复配方式的感官评价结果
由表10可知,经过混料设计得到的10种配比方式对感官品质的影响较大,最大感官评分与最小感官评分差值达到7.01分,其中S5试验组评分最高,达到92.04分。
表10 不同复配方式感官评价结果分析
Table 10 Analysis of sensory evaluation results of different compound methods

因子外形汤色香气滋味叶底总分评分系数0.200.050.350.300.10S185.2587.5084.5084.2587.5085.03S287.7589.7589.2586.2588.7588.03S389.7591.7590.2589.5090.2590.00S490.5093.0091.5090.0091.7590.95S592.0093.5092.7591.0092.0092.04S687.5088.5087.2585.7588.2587.01S788.2588.7589.7586.2587.0088.08S892.2593.7592.7590.5092.7592.03S990.2591.7590.7588.7590.2590.05S1088.2590.2590.2588.0089.2589.08
2.2.2 综合分析
通过对表中11个试验组进行多糖、黄酮、多酚含量测定,结合感官评价通过权重方式得出综合结果,如表11所示。10个试验组评分相差较大,其中S5试验组评分最高,综合得分为48.25,S1实验组为最低评分试验组,综合得分为34.14,二者相差14.11分。因此,从石斛花复配茶复配方式选择中可得出结论,S5试验组为最佳复配方式试验组,其配比为m(石斛花)∶m(茉莉花)∶m(菊花)=5∶1∶4,此配比水提物多糖、多酚、黄酮含量分别为18.89、30.85、51.27 mg/100mL,按所得配比进行包装保存待用。
表11 石斛复配花茶不同复配方式综合结果分析
Table 11 Analysis of comprehensive results of different compound methods of Dendrobium officinale
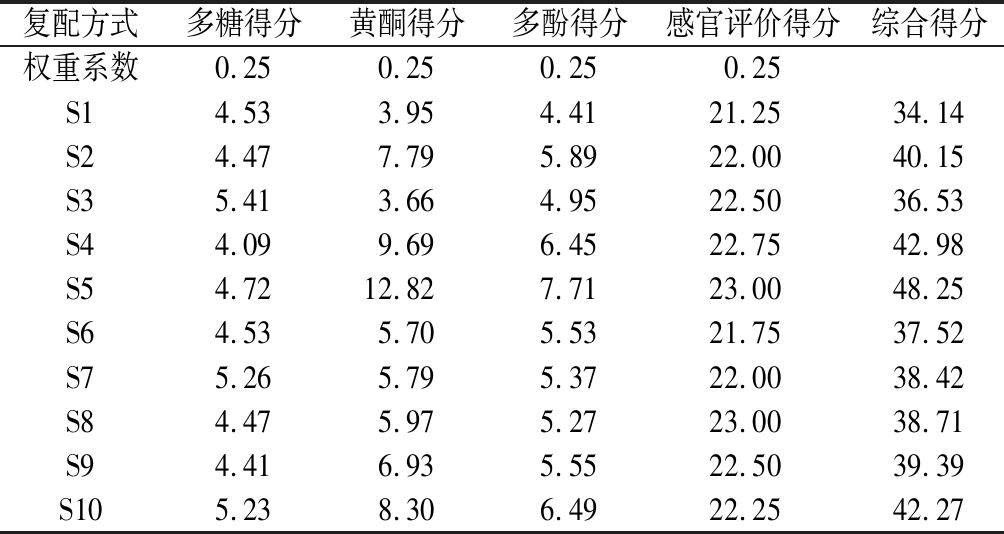
复配方式多糖得分黄酮得分多酚得分感官评价得分综合得分权重系数0.250.250.250.25S14.533.954.4121.2534.14 S24.477.795.8922.0040.15 S35.413.664.9522.5036.53 S44.099.696.4522.7542.98 S54.7212.827.7123.0048.25 S64.535.705.5321.7537.52 S75.265.795.3722.0038.42 S84.475.975.2723.0038.71 S94.416.935.5522.5039.39 S105.238.306.4922.2542.27
2.3 石斛花复配茶功能结果分析
对铁皮石斛花、菊花、茉莉花及铁皮石斛复配花茶进行沸水浸提,提取方式与铁皮石斛复配花茶茶汤提取方法相同,以VC为阳性对照对4种水浸提物进行抗氧化研究。
2.3.2 体外抗氧化试验结果分析
2.3.2.1 DPPH自由基清除率
由图3、表12可知,当质量浓度为1 mg/mL时,4种花茶水提物以及VC对DPPH自由基清除能力由大到小依次为VC、菊花、复配花茶、茉莉花、铁皮石斛花茶,清除率分别达到(94.86%、83.88%、73.38%、59.84%、53.91%,其中菊花水提物对DPPH自由基清除率与邝春林[32]的研究结果相近。通过对4种水提物与阳性对照VC的IC50值比较发现,VC的IC50值优于4种花茶水提物,由低到高的顺序是菊花、石斛复配花茶、茉莉花以及石斛花,IC50值分别为0.006、0.35、0.49、0.88、0.89 mg/mL。

图3 DPPH自由基清除率结果
Fig.3 DPPH free radical scavenging results
表12 IC50综合结果
Table 12 IC50 comprehensive results
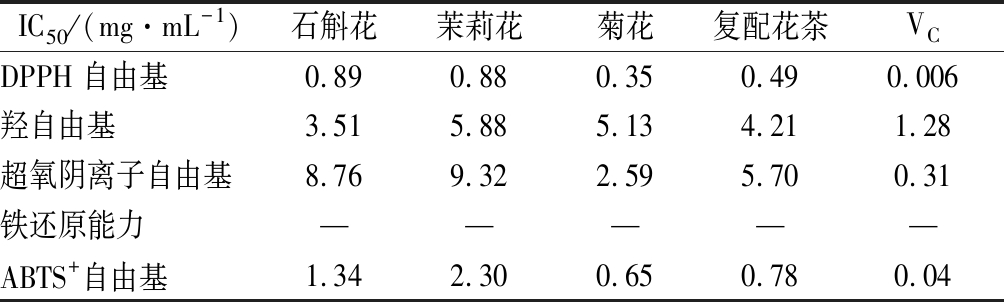
IC50/(mg·mL-1)石斛花茉莉花菊花复配花茶VCDPPH自由基0.890.880.350.490.006羟自由基3.515.885.134.211.28超氧阴离子自由基8.769.322.595.700.31铁还原能力—————ABTS+自由基1.342.300.650.780.04
注:“—”表示无IC50值(表13同)
2.3.2.2 羟自由基清除率的测定
由图4、表12可知,在质量浓度为8 mg/mL时,4种水提物以及VC对羟自由基的清除能力由大到小依次为VC、铁皮石斛花茶、石斛复配花茶、菊花茶、茉莉花茶,清除率依次为98.37%、85.87%、73.91%、66.85%、60.60%。通过对4种水提物与阳性对照VC的IC50值比较发现,VC的IC50值为1.28 mg/L,优于4种花茶水提物,由低到高的顺序是铁皮石斛花3.51 mg/L、铁皮石斛花复配茶4.21 mg/L、菊花5.13 mg/L以及茉莉花5.88 mg/mL。

图4 羟自由基清除率结果
Fig.4 Hydroxyl radical clearance results
2.3.2.3 超氧阴离子自由基清除率的测定
由图5、表12可知,4种花茶水提物以及VC对超氧阴离子自由基有较好的清除作用。在浓度为10 mg/mL时,VC对超氧阴离子自由基的清除率达到99.80%,高于4种水提物,其中菊花96.78 %、铁皮石斛复配花茶84.37%、铁皮石斛花57.24%、茉莉花51.65%。通过对4种水提物与阳性对照VC的IC50值比较发现,VC的IC50值为0.31 mg/mL,优于4种花茶水提物,由低到高的顺序是石斛复配花茶 5.70 mg/mL、菊花2.59 mg/mL、石斛花8.76 mg/mL以及茉莉花9.32 mg/mL。
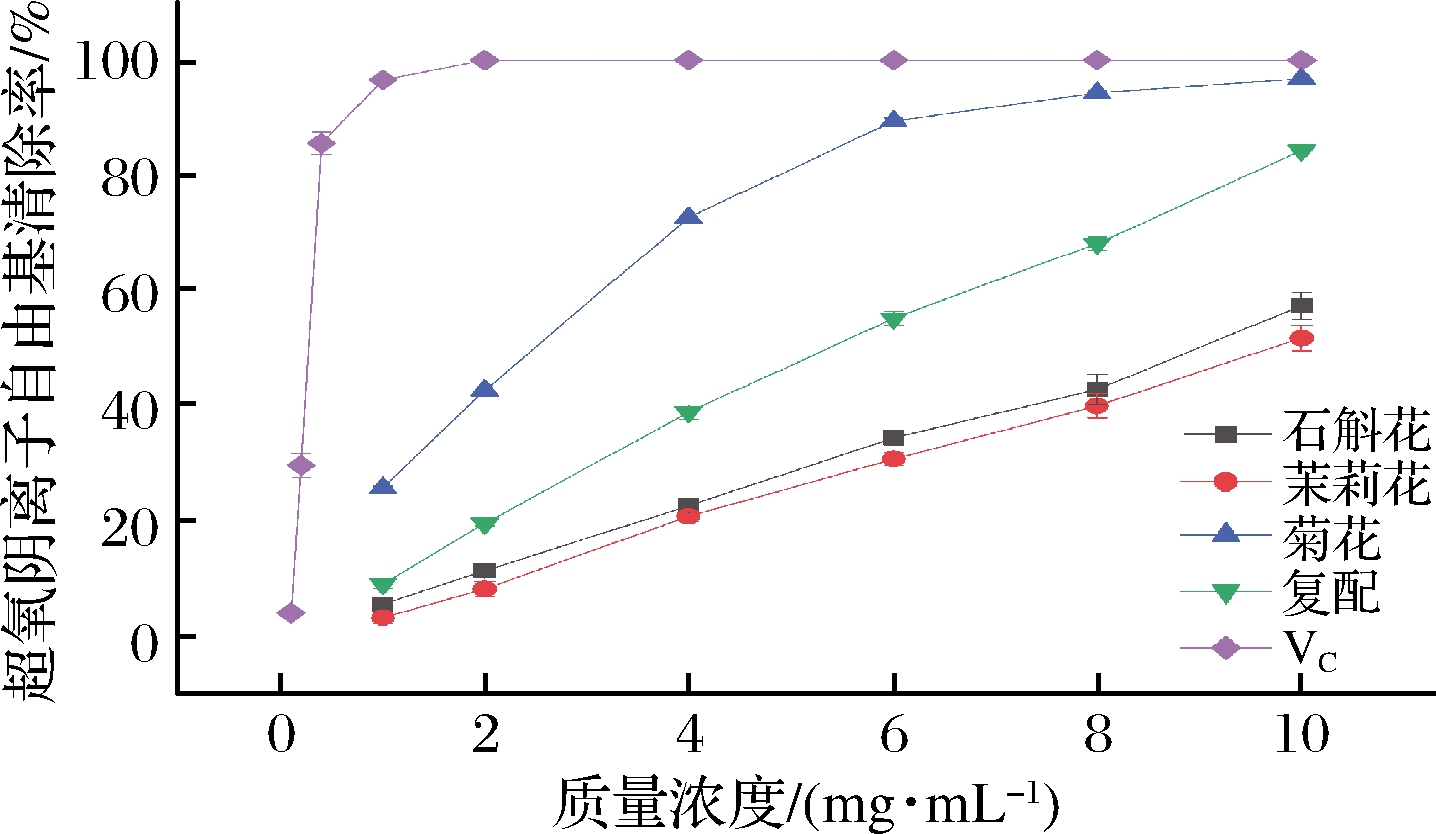
图5 超氧阴离子自由基清除率结果
Fig.5 Results of superoxide anion clearance
2.3.2.4 铁还原能力测定
在铁还原能力测定中,吸光值越高,代表还原能力越强,由图6可知,在8 mg/mL浓度时阳性对照VC的吸光值为2.06,大于4种花茶水提物吸光度,即还原能力最强,4种花茶水提物铁还原吸光值大小依次为菊花1.40、铁皮石斛复配花茶1.28、铁皮石斛花0.88、茉莉花0.51。
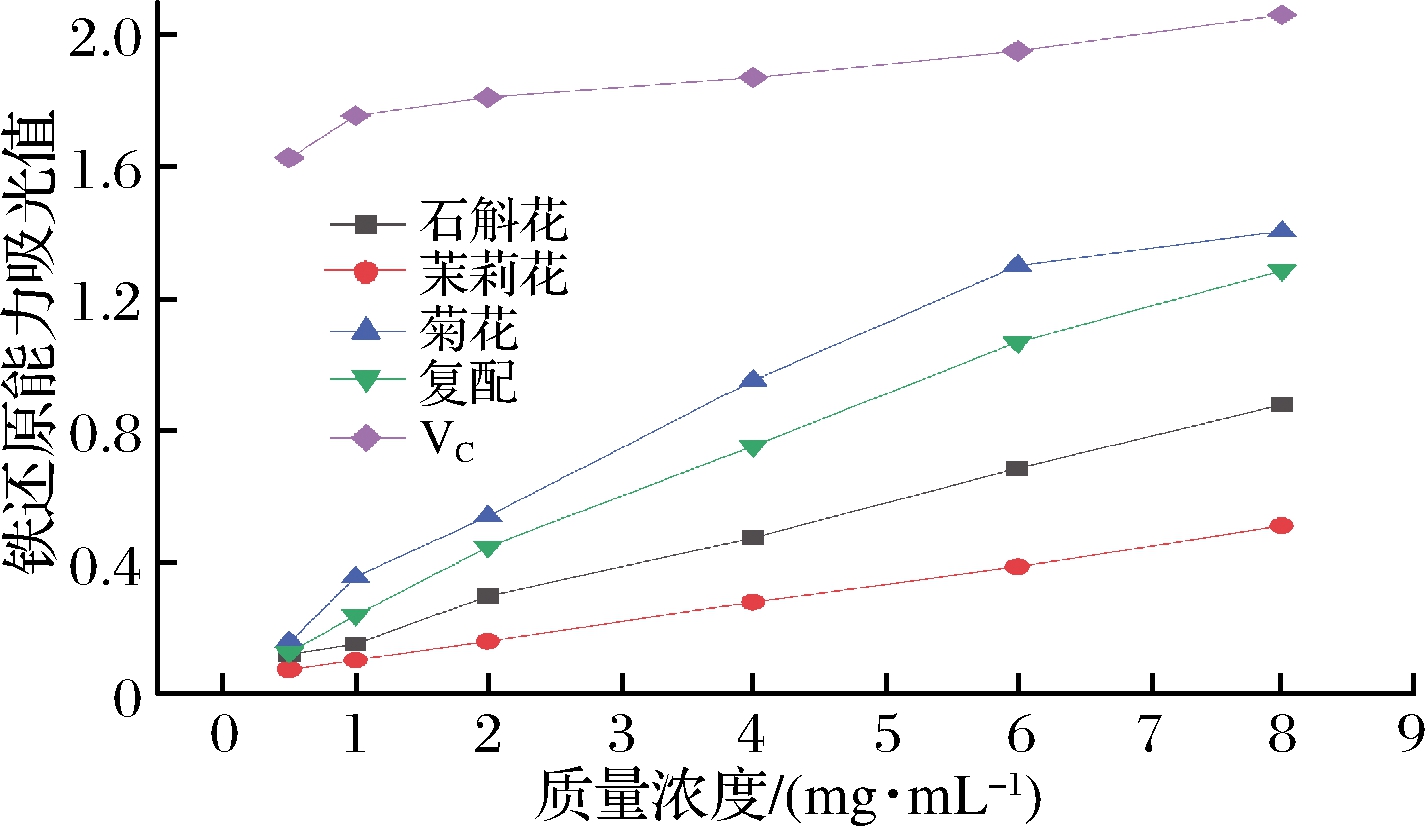
图6 铁还原能力结果
Fig.6 Results of iron reduction capability
2.3.2.5 ABTS+自由基清除率的测定
由图7、表12可知,4种花茶水提物以及VC对ABTS+自由基有较好的清除作用。在质量浓度为2 mg/mL时,VC对ABTS+自由基的清除率达到99.84%,高于4种花茶,其中菊花99.35%、铁皮石斛复配花茶96.91%、铁皮石斛花75.48%、茉莉花46.10%。通过对4种水提物与阳性对照VC的IC50值比较发现,VC的IC50值为0.04 mg/mL,低于4种花茶水提物,由低到高的顺序是菊花0.65 mg/mL、石斛复配花茶0.78 mg/mL、石斛花1.34 mg/mL以及茉莉花2.30 mg/mL。
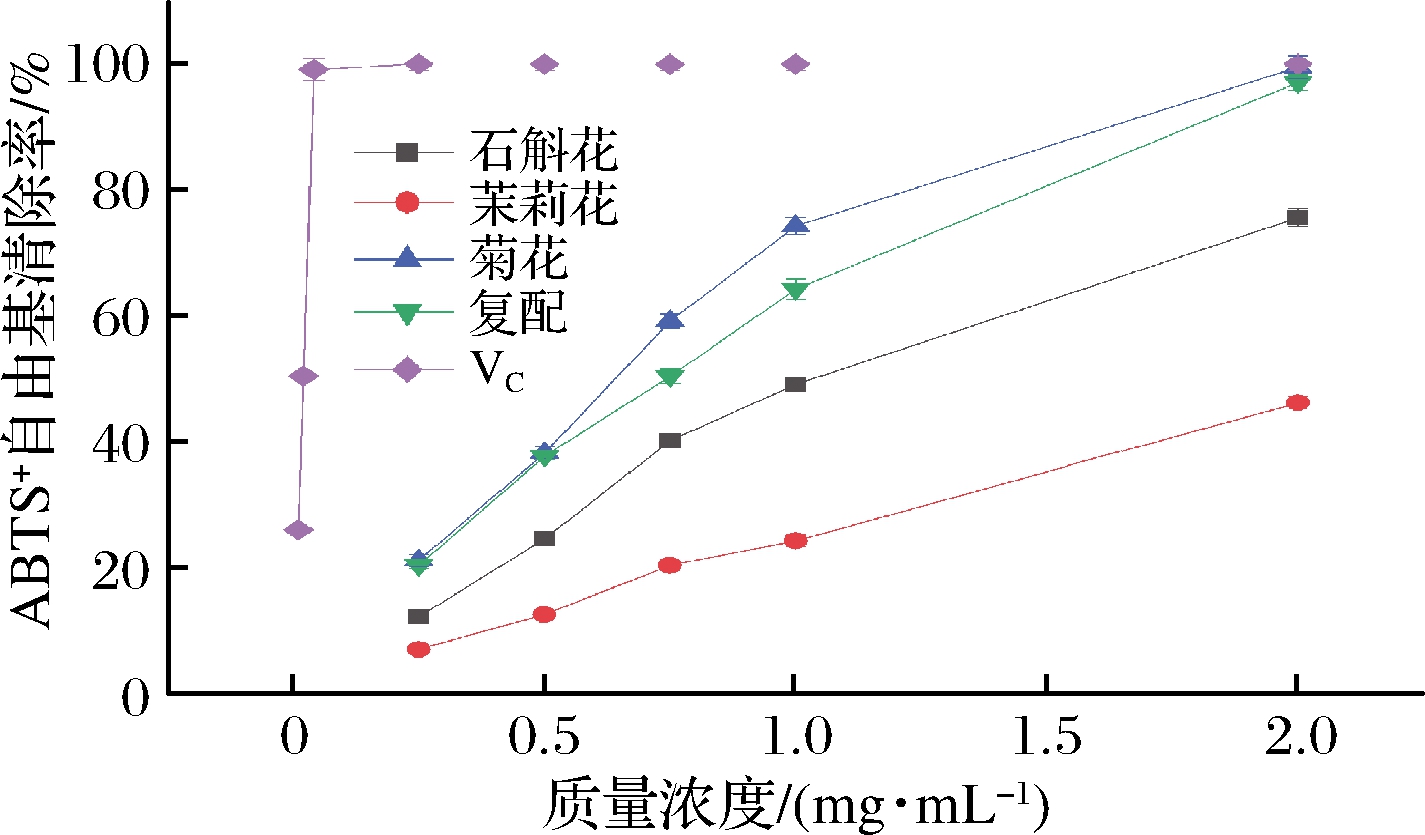
图7 ABTS+自由基清除率结果
Fig.7 ABTS+ free radical scavenging results
通过4种花茶水提物以及阳性对照VC对以上5种自由基的清除率进行测定,可以得出结论,随着样品浓度的增加,铁皮石斛花茶、复配茶对5种自由基的清除率也不断增加,直至清除率恒定。VC的抗氧化活性高于菊花、铁皮石斛复配花茶、铁皮石斛花茶以及茉莉花,且经过复配所得产品抗氧化活性明显强于铁皮石斛花茶。
2.3.3 体外降血糖试验结果分析
2.3.3.1 α-葡萄糖苷酶抑制活性试验
由图8、表13可知,铁皮石斛花茶、复配茶、菊花及阿卡波糖对α-葡萄糖苷酶有较好的抑制作用,而茉莉花对α-葡萄糖苷酶的抑制作用较弱。在质量浓度为8 mg/mL时,阿卡波糖对α-淀粉酶的抑制率达到80.90%,高于4种水提物,其中石斛花茶71.21%、石斛花复配茶63.78%、菊花57.80%、茉莉花36.52%。通过对4种花茶水提物与阳性对照阿卡波糖的IC50值比较发现,阿卡波糖的IC50值为1.60 mg/mL,低于4种花茶,由低到高的顺序是铁皮石斛花4.47 mg/mL、铁皮石斛花复配茶5.86 mg/mL、菊花6.57 mg/mL。茉莉花对α-葡萄糖苷酶抑制作用较弱,所以不计算IC50值。

图8 α-葡萄糖苷酶活性抑制结果
Fig.8 Results of inhibition of α-glucosidase activity
表13 α-葡萄糖苷酶、α-淀粉酶活性IC50
Table 13 α-glucosidase and α-amylase activity IC50

IC50/(mg·mL-1)石斛花茉莉花菊花石斛花复配茶阿卡波糖α-葡萄糖苷酶活性4.47—6.575.861.60α-淀粉酶活性3.26——5.501.39
2.3.3.2 α-淀粉酶抑制活性试验
由图9、表13可知,铁皮石斛花茶、复配茶以及阿卡波糖对α-淀粉酶有较好的抑制作用,而菊花与茉莉花对α-淀粉酶的抑制作用较弱。在质量浓度为10 mg/mL 时,阿卡波糖对α-淀粉酶的抑制率达到99.27%,高于4种花茶水提物,其中铁皮石斛花89.94%、石斛复配花茶70.85%、菊花32.79%、茉莉花10.36%。通过对4种水提物与阳性对照阿卡波糖的IC50值比较发现,阿卡波糖的IC50值为1.39 mg/mL,低于4种花茶水提物,由低到高的顺序是石斛花3.26 mg/mL、石斛花复配茶5.50 mg/mL。由于菊花与茉莉花对α-淀粉酶抑制作用较弱,所以不计算IC50值。
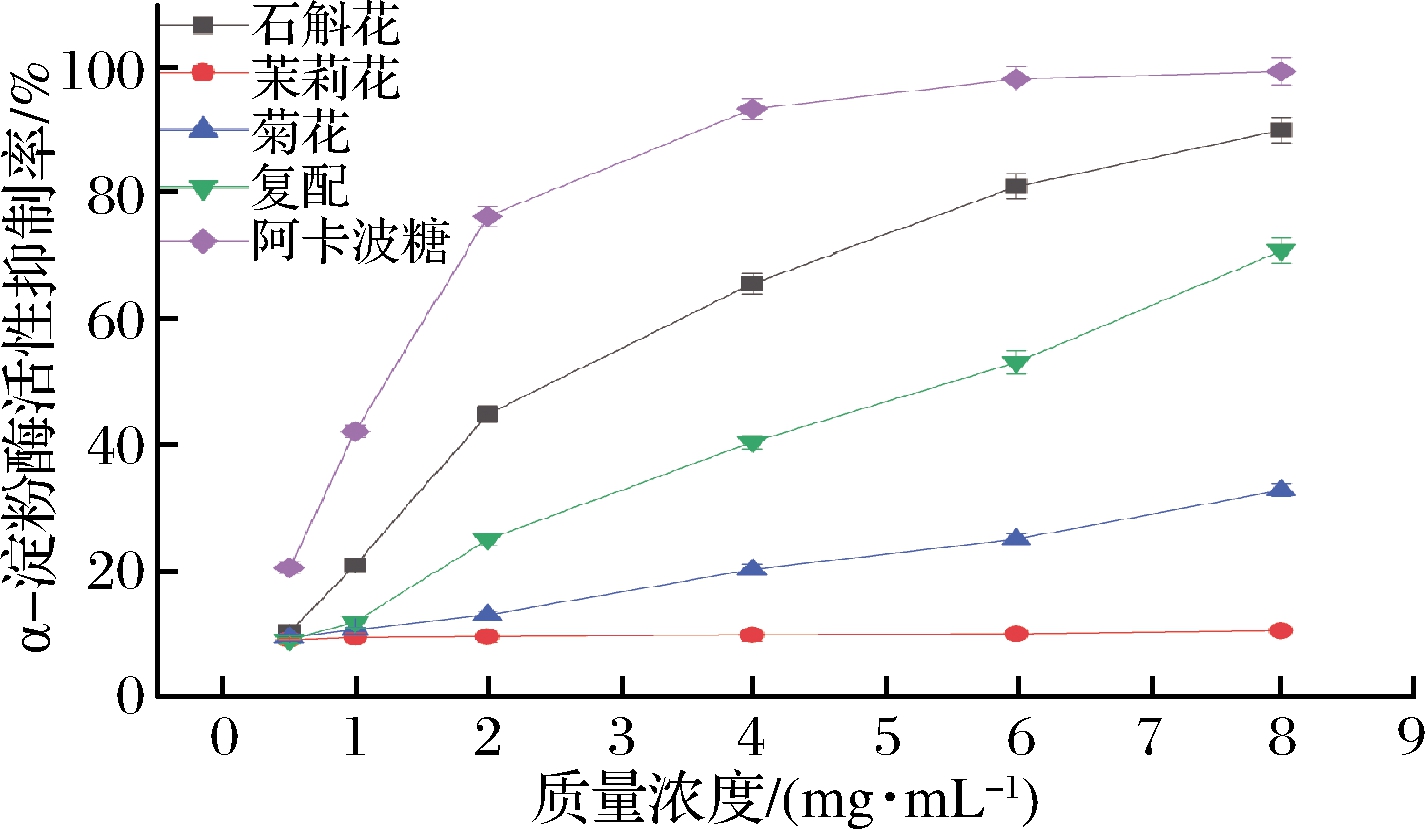
图9 α-淀粉酶活性抑制结果
Fig.9 Results of inhibition of α-amylase activity
通过3种原料与铁皮石斛复配花茶对以上2种酶进行活性抑制试验,可以得出结论,随着样品质量浓度的增加,对2种酶的活性抑制率也不同程度增加。阿卡波糖的降血糖活性优于铁皮石斛花茶、铁皮石斛花复配茶、菊花以及茉莉花,铁皮石斛花茶与铁皮石斛复配花茶降血糖效果较好,其抑制能力强于菊花及茉莉花,在一定浓度下有较好的降血糖作用。
综上所述,该复配比例能较好地提高提高花茶产品的抗氧化活性,其原因可能是在复配过程中增加了黄酮及多酚的含量,使抗氧化活性明显增强;相较于石斛花茶,该复配比例的降血糖作用有一定降低,其原因可能是在复配过程中,多糖含量有所降低,但总体来看,其降低幅度不大,且要高于菊花和茉莉花,而且复配后的花茶比单一的石斛花茶口感更丰富,价格适中。因此,对于促进石斛花资源的开发利用,拓宽消费群体具有积极意义。
3 结论
本实验将石斛花茶与茉莉花、菊花进行混料设计,以多糖、黄酮及多酚含量为筛选指标,结合感官评价通过权重方式得到石斛花复配茶的最优复配比例为,m(石斛花)∶m(茉莉花)∶m(菊花)=5∶1∶4,此配比有效成分含量综合较高,多糖为18.89 mg/100mL、多酚为 30.85 mg/100mL、黄酮为51.27 mg/100mL,且滋味最好,普遍接受度高。在功能性研究中发现,随着质量浓度的增加,铁皮石斛花茶与复配茶对体外抗氧化及降血糖的作用明显增强,同浓度条件下复配茶对5种自由基抑制率普遍高于铁皮石斛花,证明此复配比例有利于提高抗氧化活性功效;在降血糖活性研究中,铁皮石斛花复配茶降血糖效果明显高于菊花和茉莉花,略低于铁皮石斛花茶。本研究制备得到了一种兼具良好口感与功能性的铁皮石斛花复配茶产品,为其工业化生产提供了理论支持,有利于推进石斛产业的进一步发展。
[1] 韩姝葶, 王婉馨, 袁国强, 等.干燥方式对铁皮石斛品质的影响[J].食品科学, 2019, 40(3):142-148.
HAN S T, WANG W X, YUAN G Q, et al.The effect of drying methods on the quality of Dendrobium candidum[J].Food Science, 2019, 40(3):142-148.
[2] 张雅丹, 赵梦倩, 杨煜佼, 等.铁皮石斛多糖提取及对羟自由基诱导的SH-SY5Y细胞凋亡的抑制作用[J].食品科学, 2020, 41(14):286-293.
ZHANG Y D, ZHAO M Q, YANG Y J, et al.Extraction of polysaccharides from Dendrobium candidum and its inhibitory effect on SH-SY5Y cell apoptosis induced by hydroxyl free radicals[J].Food Science, 2020,41(14):286-293.
[3] 童微, 余强, 李虎, 等.铁皮石斛多糖化学修饰及其对免疫活性的影响[J].食品科学, 2017, 38(7):155-160.
TONG W, YU Q, LI H, et al.Chemical modification of Dendrobium candidum polysaccharide and its effect o-n immune activity[J].Food Science, 2017, 38(7):155-160.
[4] 秦子芳, 谭晓妍, 宁慧娟, 等.不同生长年限铁皮石斛多糖含量与特性分析[J].食品科学, 2018, 39(6):189-193.
QIN Z F, TAN X Y, NING H J, et al.Analysis of polysaccharide content and characteristics of Dendrobium candidum in different growth years[J].Food Science, 2018, 39(6):189-193.
[5] CHUN Y, YING Y, ZHOU X, et al.UHPLC-ESI-MS analysis of purified flavonoids fraction from stem of Dendrobium denneaum Paxt.and its preliminary study in inducing apoptosis of HepG2 Cells[J].Evidence-based Complementary and Alternative Medicine, 2018, 2018:1-10.
[6] MA L, ZHANG Z, ZHAO X, et al.The rapid determination of total polyphenols content and antioxidant activity in dendrobium officinale using near-infrared spectroscopy[J].Analytical Methods, 2016, 8(23):4 584-4 589.
[7] GUO X, LI Y, LI C, et al.Analysis of the Dendrobium officinale transcriptome reveals putative alkaloid bio-synthetic genes and genetic markers[J].Gene, 2013, 527(1):131-138.
[8] FAN H, MENG Q, XIAO T, et al.Partial characterization and antioxidant activities of polysaccharides seque- ntially extracted from Dendrobium officinale[J].Journal of Food Measurement and Characterization, 2018, 12(5):1 054-1 064.
[9] 王云威, 王景雪.铁皮石斛多糖对2型糖尿病小鼠降糖降脂的作用[J].食品科学,2020,41(21):127-132.
WANG Y W, WANG J X.Effects of dendrobium officinale polysaccharides on reducing blood sugar and lipids in type 2 diabetic mice[J].Food Science,2020,41(21):127-132.
[10] LIANG J, LI H, CHEN J, et al.Dendrobium officinale polysaccharides alleviate colon tumorigenesis via res-toring intestinal barrier function and enhancing antitumor immune response[J].Pharmacological Research, 2019, 148:104 417.
[11] ROSHANI S, SUJIT S, BIJAYA P.Identification of endophytic fungi from roots of two Dendrobium species and evaluation of their antibacterial property[J].African Journal of Microbiology Research, 2018, 12(29):697-704.
[12] XIAO L, HONG M.Aqueous extract of Dendrobium officinale confers neuroprotection against hypoxicische mic brain damage in neonatal rats[J].The Kaohsiung Journal of Medical ences, 2019,4:131-138.
[13] 赖燕娜. 石斛花的功效研究[J].科技风, 2020(18):277.
LAI Y N.Study on the efficacy of dendrobium flower[J].Technology Wind, 2020(18):277.
[14] 张珍林, 闵运江, 黄仁术, 等.霍山石斛和铁皮石斛干花成分含量和抗氧化性的比较[J].天然产物研究与开发, 2020, 32(7):1 104-1 110;1 155.
ZHANG Z L, MIN Y J, HUANG R S, et al.Comparison of dendrobium huoshanense and Dendrobium officinale dried flower composition content and antioxidant activity[J].Natural Products Research and Dev- elopment, 2020, 32(7):1 104-1 110;1 155.
[15] NETRAMAI S, THITISILP K, HAYATI S, et al.Data of microwave assisted extraction and conventional hot water extraction of Dendrobium sonia ′Earsakul′ orchid flower[J].Data in Brief, 2020,31:105 906.
[16] ZHANG X, ZHANG S, GAO B, et al.Identification and quantitative analysis of phenolic glycosides with antio-xidant activity in methanolic extract of dendrobium catenation flowers and selection of quality control herbmarkers[J].Food Research International, 2019, 123:732-745.
[17] WANG D, FAN B, WANG Y, et al.Optimum extraction, characterization, and antioxidant activities of polysaccharides from flowers of dendrobium devonianum[J].International Journal of Analytical Chemistry, 2018, 2018:1-8.
[18] 农彦彦, 吴子瑜, 林诗堃, 等.高效液相色谱法测定铁皮石斛花中总黄酮的含量[J].顺德职业技术学院学报, 2020, 18(1):8-11.
NONG Y Y, WU Z Y, LIN S K, et al.Determination of total flavonoids in Dendrobium officinale flowers by high performance liquid chromatography[J].Journal of Shunde Vocational and Technical College, 2020, 18(1):8-11.
[19] 栗晓庆. 裸藻多糖的提取优化及其体外抗氧化活性研究[D].太原:山西大学, 2019.
LI X Q.Extraction and optimization of euglena polysaccharide and its antioxidant activity in vitro[D].Taiyuan: Shanxi University, 2019.
[20] UYSAL S, AKTUMSEK A.A phytochemical study on potentilla anatolica:An endemic turkish plant[J].Industrial Crops & Products, 2015, 76:1 001-1 007.
[21] 缪园欣, 廖明星, 孙爱红, 等.超声-乙醇法提取铁皮石斛花总黄酮及其体外抗氧化性的研究[J].中国酿造, 2019, 38(4):155-159.
MIAO Y X, LIAO M X, SUN A H, et al.Extraction of total flavonoids from Dendrobium candidum by ultrasonic-ethanol method and its in vitro antioxidant activity[J].China Brewing, 2019, 38(4):155-159.
[22] 邱现创. 铁皮石斛多糖提取工艺优化及其抗氧化活性研究[D].太原:山西大学,2017.
QIU X C.Optimization of extraction process of polysaccharides from Dendrobium candidum and its antioxidant activity[D].Taiyuan:Shanxi University, 2017.
[23] 唐静月, 颜美秋, 齐芳芳, 等.铁皮石斛花总黄酮提取工艺优化及体外抗氧化活性研究[J].浙江中医药大学学报, 2017, 41(3):235-242.
TANG J Y, YAN M Q, QI F F, et al.Optimization of extraction process of total flavonoids from Dendrobium officinale flowers and in vitro antioxidant activity[J].Journal of Zhejiang University of Traditional Chinese Medicine, 2017, 41(3):235-242.
[24] 王炬, 张秀玲, 高宁, 等.老山芹全株及其不同部位酚类物质含量及抗氧化能力分析[J].食品科学, 2019, 40 (7):54-59.
WANG J, ZHANG X L, GAO N, et al.Analysis of phenolic substance content and antioxidant capacity of the whole plant and its different parts of Laoshanqian[J].Food Science, 2019, 40(7):54-59.
[25] 钟曼茜,黄绵佳,王斌, 等.6个不同红毛丹品种果实品质模型评价[J].热带作物学报, 2016, 37(9):1 690-1 694.
ZHONG M X, HUANG M J, WANG B, et al.Evaluation of fruit quality model of 6 different varieties of red-haired[J].Journal of Tropical Crops, 2016, 37(9):1 690-1 694.
[26] 王丽霞, 刘孟宗, 王芳, 等.铁皮石斛多糖提取及抗氧化活性研究[J].中国食品添加剂, 2019, 30(2):85-90.
WANG L X, LIU M Z, WANG F, et al. Extraction and antioxidant activity of polysaccharides from Dendrobium candidum[J].China Food Additives, 2019, 30(2):85-90.
[27] 张娥珍, 黄梅华, 辛明, 等.铁皮石斛纳米粉与超微粉的物理特性和体外抗氧化活性比较研究[J].热带作物学报, 2015, 36(12):2 184-2 191.
ZHANG E Z, HUANG M H, XIN M, et al.Comparative study on the physical properties and in vitro antioxidant activity of dendrobium officinale nanopowder and ultrafine powder[J].Chinese Journal of Tropical Crops, 2015, 36(12):2 184-2 191.
[28] 王红静. 铁皮石斛多糖的分离纯化、结构鉴定及抗氧化活性的研究[D].武汉:华中科技大学, 2017.
WANG H J.Study on isolation, purification, structure identification and antioxidant activity of polysacch arides from dendrobium officinale[D].Wuhan:Huazhong University of Science and Technology, 2017.
[29] 黎恩立. 金钗石斛抗抑郁活性及超微粉碎对其理化性质影响的初步研究[D].广州:广东药科大学, 2018.
LI E L.A preliminary study on the antidepressant activity of dendrobium nobile and the effect of ultrafine pulverization on its physical and chemical properties[D].Guangzhou:Guangdong Pharmaceutical University, 2018.
[30] 汪磊. 刺梨多糖的分离纯化、降血糖作用及其对肠道微生态的影响[D].广州:华南理工大学,2019.
WANG L.Isolation, purification, hypoglycemic effect of prickly pear polysaccharide and its effect on the intestinal microecology[D].Guangzhou:South China University of Technology, 2019.
[31] 谭青云, 袁永俊, 王丹, 等.不同提取方式对铁皮石斛多糖及体外降血糖的影响[J].食品科技, 2019, 44 (6):202-206.
TAN Q Y, YUAN Y J, WANG D, et al.Effects of different extraction methods on Dendrobium candidum polysaccharides and in vitro hypoglycemic hypoglycemia[J].Food Science and Technology, 2019, 44(6):202-206.
[32] 邝春林. 杭白菊和昆仑雪菊提取物成分分析及其抗氧化、抑菌活性研究[D].雅安:四川农业大学,2016.
KUANG C L.Analysis of the components of the extracts of Chrysanthemum and Kunlunensis and their antiox idant and antibacterial activities[D].Ya′an:Sichuan Agricultural University, 2016.