浙贝母(Fritillaria thunbergii Miq)主产于浙江及江苏地区,为百合科贝母属多年生草本植物。多以其鳞茎入药,具有清热化痰,散结消痈之疗效[1]。因其产地的不同,浙贝母会出现遗传差异性[2]。有研究表明,浙贝母含有丰富的皂苷和生物碱类成分[3-4]及氨基酸类成分[5]。近年来,随着对浙贝母药理研究的深入[6],发现其有抑制癌细胞扩散的作用,抗癌疗效显著,这方面的研究受到了广泛的关注[7]。氨基酸是蛋白质的基本组成单元,同时也是人体代谢过程中的重要物质,它是人体必需营养成分之一,对疾病的治疗和康复具有积极作用[8]。有文献报道,浙贝母花期地上部分总氨基酸含量丰富[9],测出含有17种氨基酸,其中谷氨酸和精氨酸含量较高,精氨酸在细胞增殖和分裂以及蛋白质合成方面发挥着重要的作用[10-11]。对于浙贝母氨基酸方面的研究主要集中在地上部分,但对浙贝母药用部位——鳞茎的氨基酸相关研究报道较少。
响应面分析,是指在多因素数量处理试验的分析中,分析试验指标与多个试验因素间的回归关系,因其方便快捷,结果可靠,目前在化学、生物学等领域占据重要地位[12]。陈文等[13]采用响应面分析法优化海参氨基酸提取条件。目前,氨基酸测定方法有氨基酸分析仪-柱后衍生法[14-15]、柱前衍生-蒸发光散射检测器法[16-17]和柱前衍生化-高效液相色谱法等[18-21]。氨基酸的衍生试剂较多,异硫氰酸苯酯(phenyl isothiocyanate,PITC)因其配制简单、操作方便,衍生后可直接进样,成为最常用的衍生试剂。因此,本文拟采用响应面法优化提取浙贝母鳞茎中氨基酸最优试验条件,并采用柱前衍生UPLC法测定其含有的氨基酸种类和含量,比较栽前栽后氨基酸含量的差别,以期为相关研究提供技术和理论支撑。
1 材料与方法
1.1 仪器与设备
ACQUITY UPLC H-Class超高效液相色谱仪(含PDA检测器,Empower 3色谱工作站),美国Waters公司;ACQUITY UPLC BEH C18色谱柱(2.1 mm×150 mm,1.7 μm),美国Waters公司;HDL-4型离心机,江苏省金坛市鸿科科技有限公司;Vortex Genius 3型涡旋混合器,德国IKA公司;ME204E型万分之一分析天平,梅特勒-托利多仪器上海有限公司;HN200型多功能氮吹仪,山东海能科学仪器有限公司;GZX-GF101-MBS型恒温电热干燥箱,上海跃进医疗器械有限公司;UV-2450紫外-可见分光光度计,岛津企业管理(中国)有限公司;KQ-300B型超声波清洗器,昆山市超声仪器有限公司;GM-0.33A隔膜真空泵,天津市津腾实验设备有限公司;MS105DV十万分之一分析天平,梅特勒-托利多仪器上海有限公司。
1.2 试剂
谷氨酸(Glu,批号GG202002,含量≥98%)、脯氨酸(Pro,批号PP202001,含量≥98%)、赖氨酸(Lys,批号LS201911,含量≥99%)、亮氨酸(Leu,批号LL201912,含量≥98%)、精氨酸(Arg,批号JA202005,含量≥99%)、异亮氨酸(Ile,批号YI191221,含量≥99%)、甘氨酸(Gly,批号VB202110,含量≥98%),均购自BOMEI公司;苏氨酸(Thr,批号DST191010-135,含量≥99%)、缬氨酸(Val,批号DST190906-061,含量≥99%)、苯丙氨酸(Phe,批号DST190812-136,含量≥98%)、天门冬氨酸(Asp,批号DST190806-897,含量≥98%)、丙氨酸(Ala,批号DST190908-112,含量≥98%)、组氨酸(His,批号DST190720-069,含量≥98%)、丝氨酸(Ser,批号DST190901-190,含量≥98%),购自成都德思特生物技术有限公司。
盐酸、三乙胺、乙酸钠、冰醋酸(均为分析纯),成都科龙化工试剂厂;异硫氰酸苯酯(PITC,≥99%蛋白测序级),麦克林试剂公司;乙腈(色谱纯),德国默克公司;实验用水为怡宝纯净水。
1.3 样品来源
浙贝母新鲜鳞茎采自浙江、江苏及重庆3个省种植基地同一批大小基本一致的样品,经三峡库区道地药材绿色种植与深加工重庆市工程实验室(重庆三峡学院)周浓教授鉴定为百合科贝母属浙贝母(Fritillaria thunbergia Mig.)的新鲜鳞茎,样品来源为:浙江省宁波市千祥镇、浙江省磐安县新渥镇、江苏南通市张芝山镇和重庆市奉节县冯坪乡,按照栽前与栽后依次编号为Zq-1、Zh-1;Zq-2、Zh-2;Zq-3、Zh-3;Zq-4、Zh-4。
1.4 试验方法
1.4.1 响应面优化浙贝母氨基酸提取工艺
1.4.1.1 单因素变量考察
(1)水解时间对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,超声处理30 min,密封。在110 ℃的恒温干燥箱中分别水解18、20、22和24 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(2)超声时间对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,分别超声处理20、30、40和50 min,密封。在110 ℃的恒温干燥箱中水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(3)水解温度对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,超声处理30 min,密封。分别在100、110、120和130 ℃的恒温干燥箱水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(4)盐酸用量对吸光度的影响
称取样品0.100 0 g于顶空瓶中,分别加入6 mol/L盐酸6、8、10、12和14 mL,超声处理30 min,密封。在110 ℃的恒温干燥箱中水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
1.4.1.2 Box-Behnken中心组合实验设计
经过单因素实验数据对比,每个因素选取4个对氨基酸影响较大水平。设计4因素3水平的Box-Behnken中心组合试验。采用陈文等[13]方法,在360 nm处测定样品吸光度并作为响应值,每组重复3次,取其平均值。
1.4.2 柱前衍生UPLC法浙贝母氨基酸含量测定
1.4.2.1 对照品溶液制备
精密称取Asp、Glu、Ser、Gly、His、Arg、Thr、Ala、Pro、Val、Ile、Leu、Phe、Lys对照品适量,用0.1 mol/L盐酸溶解并定容于5 mL容量瓶中,配制成质量浓度分别为0.369、0.335、0.315、0.339、1.087、1.838、1.378、0.171、0.109、0.348、0.724、1.293、1.076、0.695 mg/mL的对照品贮备溶液,即得。
1.4.2.2 供试品溶液制备
样品水解:准确称取0.100 0 g浙贝母样品粉末(过3号筛)于顶空瓶中,加入6 mol/L盐酸溶液10 mL,混合均匀,密封,放至110 ℃的电热鼓风恒温箱内水解20 h,取出,冷却至室温,过滤,滤液加蒸馏水定容至25 mL,混匀即得水解液。
样品衍生:取样品水解液400 μL于氮吹管中,放入氮吹仪中氮吹至干,除去高浓度盐酸溶液,加入纯净水400 μL复溶,加入1.0 mol/L三乙胺-乙腈溶液200 μL,涡旋混匀,再加入0.1 mol/L异硫氰酸苯酯-乙腈溶液200 μL,涡旋混匀,室温下衍生1 h,每隔20 min 涡旋振荡1次,衍生完成后加入正己烷800 μL,涡旋混匀,4 000 r/min离心5 min,弃去上清液,再重复操作2次,除去多余衍生试剂,过0.22 μm微孔滤膜即得样品溶液。
1.4.2.3 空白衍生溶液制备
取0.1 mol/L盐酸溶液400 μL于氮吹管中,按照“1.4.2.2”项下方法进行衍生萃取,即得空白衍生溶液。
1.4.2.4 色谱条件
色谱柱:ACQUITY UPLC BEH C18 (1.7 μm,2.1 mm×150 mm);流动相:A为0.1 mol/L乙酸钠溶液(冰醋酸调pH=6.5)-乙腈(体积比97∶3),B为乙腈-水(体积比4∶1),梯度洗脱见表1。检测波长为254 nm,进样体积2 μL,柱温40 ℃。
表1 流动相梯度表
Table 1 The gradient mobile phase program
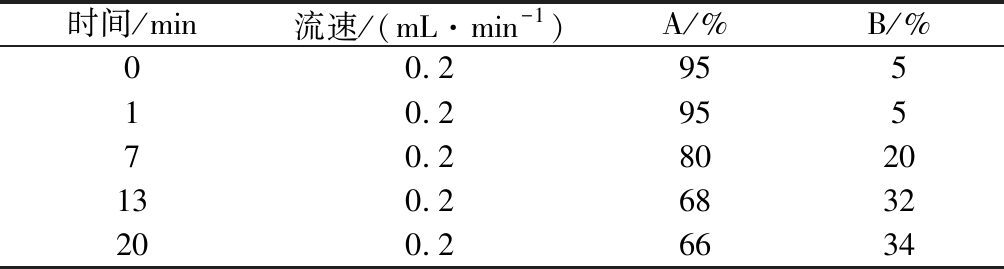
时间/min流速/(mL·min-1)A/%B/%00.295510.295570.28020130.26832200.26634
2 结果与分析
2.1 响应面优化浙贝母氨基酸提取工艺结果
2.1.1 单因素变量试验结果
2.1.1.1 水解时间对样品氨基酸吸光度的影响
吸取1.4.1.1(1)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图1所示。由图1可知,随着水解时间的延长,吸光度逐渐增大,在20 h时,吸光度达到最大。之后,随着水解时间的继续延长,吸光度明显下降,因此最佳水解时间为20 h。
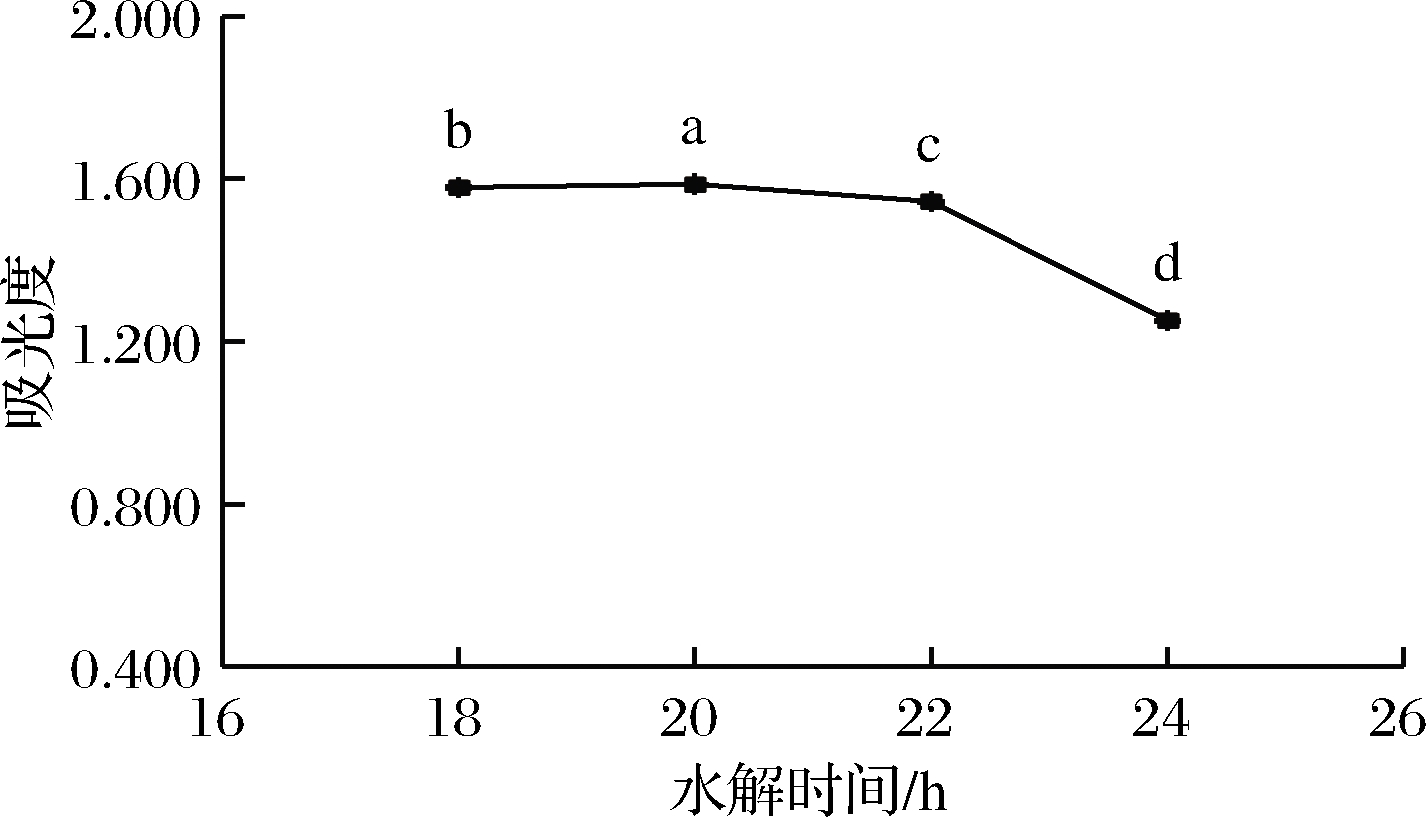
图1 水解时间对样品吸光度的影响
Fig.1 Influence of hydrolysis time on sample absorbance
2.1.1.2 超声时间对样品吸光度的影响
吸取1.4.1.1(2)滤液400 μL,按照1.4.2.2方法衍生。应用紫外-分光光度计测定其吸光度,所得结果如图2所示。由图2可知,随着超声时间的延长,吸光度逐渐增大,在30 min时,吸光度达到最大。之后,随着超声时间的继续延长,吸光度明显下降,因此最佳超声提取时间30 min。
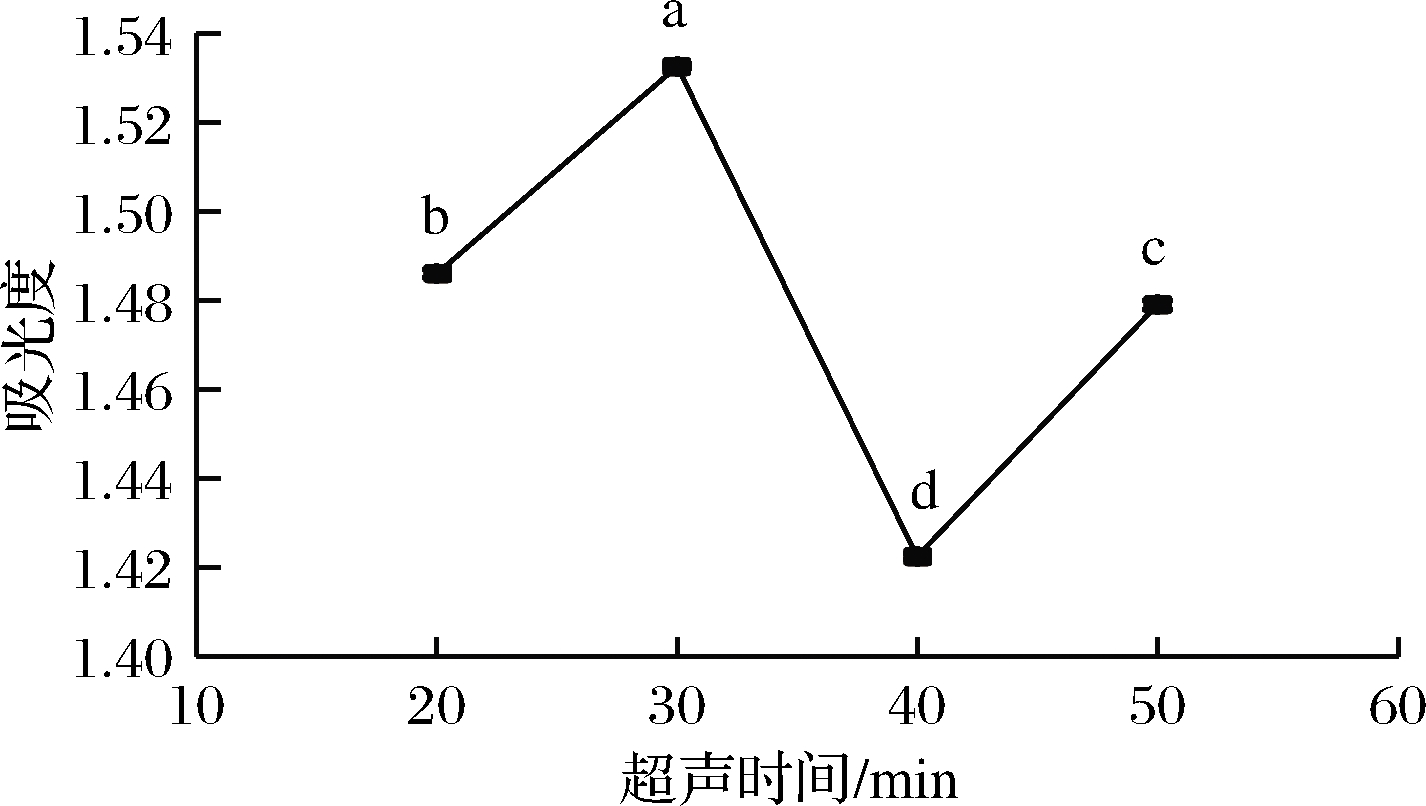
图2 超声时间对样品吸光度的影响
Fig.2 Influence of ultrasound time on sample absorbance
2.1.1.3 水解温度对样品吸光度的影响
吸取1.4.1.1(3)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图3所示。由图3可知,随着水解温度的增高,吸光度逐渐增大,在110 ℃时,吸光度达到最大。之后,随着水解温度的继续升高,吸光度明显下降,因此最佳水解温度为110 ℃。
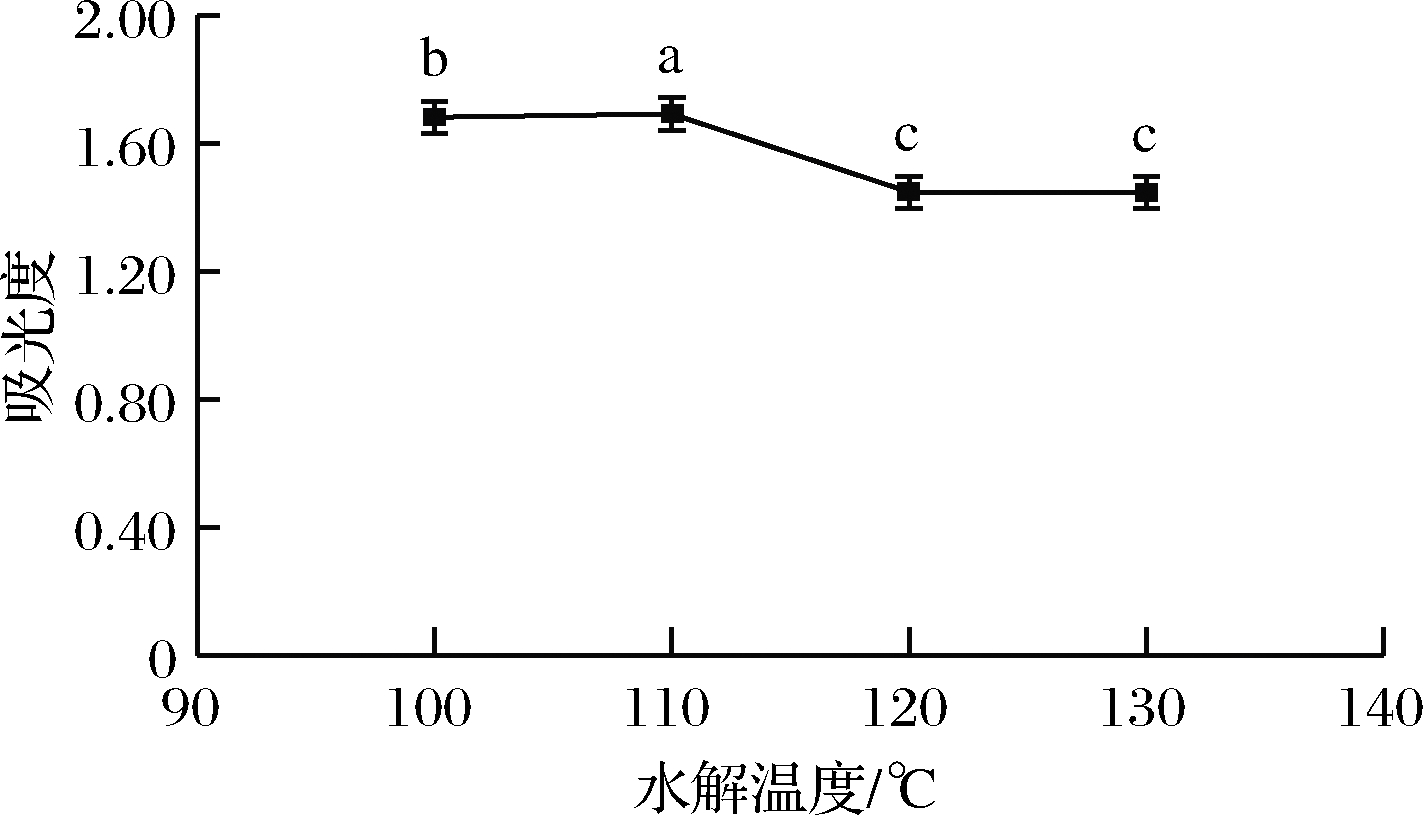
图3 水解温度对样品吸光度的影响
Fig.3 Influence of hydrolysis temperature on sample absorbance
2.1.1.4 盐酸用量对样品吸光度的影响
吸取1.4.1.1(4)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图4所示。由图4可知,随着盐酸用量的增大,吸光度逐渐增大,在8 mL时,吸光度达到最大。之后,随着盐酸用量的继续增大,吸光度明显下降,因此最佳盐酸用量为8 mL。
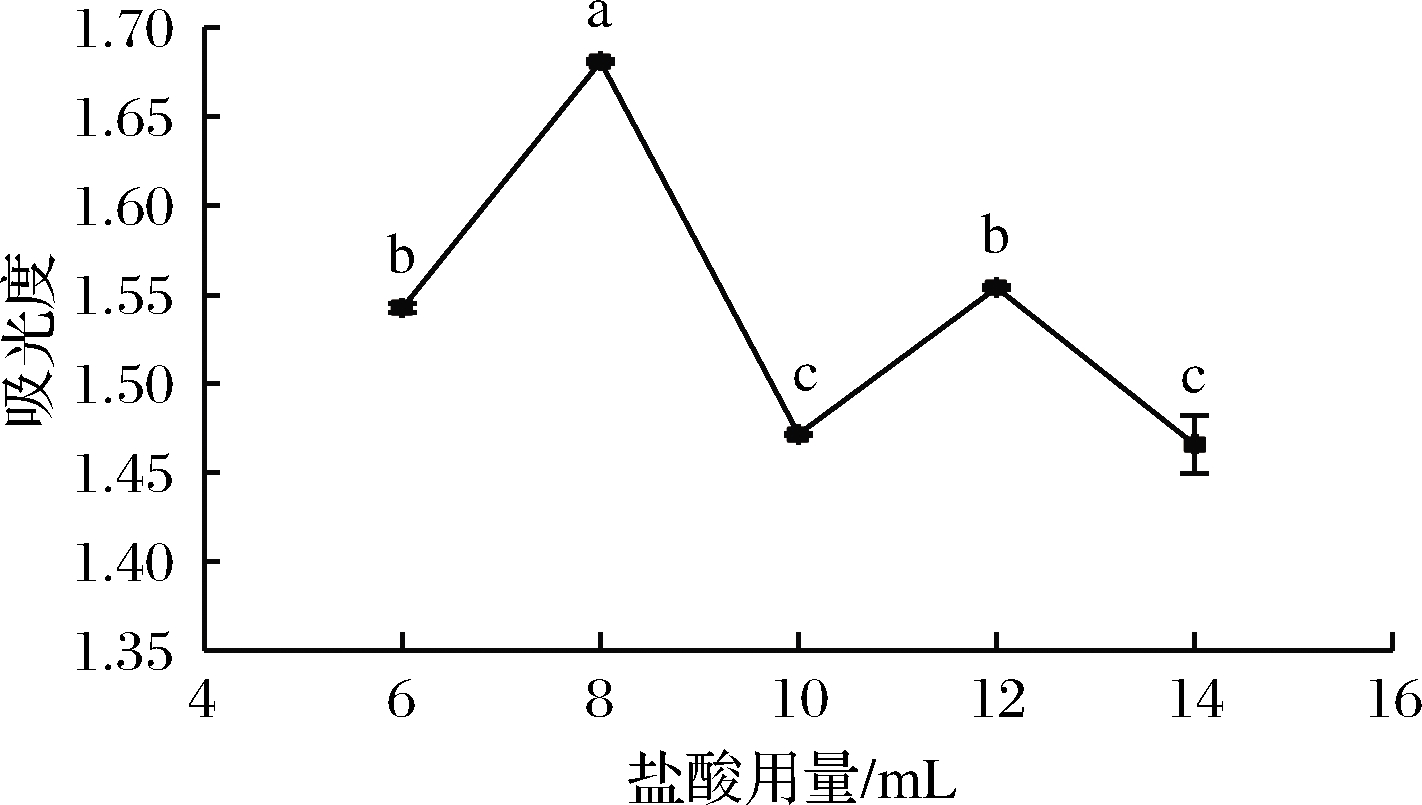
图4 盐酸用量对样品吸光度的影响
Fig.4 Influence of hydrochloric acid dosage on sample absorbance
2.1.2 响应面优化试验结果
2.1.2.1 响应面试验回归方程拟合
根据单因素试验结果,氨基酸水解的最佳条件为:水解时间20 h、超声时间30 min、水解温度110 ℃及6 mol/L盐酸8 mL。因此以最佳条件为0水平,在左右两侧取-1和1水平进行响应面试验。试验数据采用Design Expert 8.0.6.1软件进行处理分析。拟合方程为:吸光度=1.63+0.017A-0.037B-0.025C-0.027D+0.024AB-0.042AC+0.028AD-0.024BC-0.031BD+0.056CD-0.038A2-0.085B2-0.036C2-0.093D2。
其中:A、B、C、D分别代表盐酸用量(mL)、超声时间(min)、水解时间(h)和水解温度(℃)。
表2 Box-Behnken响应面分析试验设计及结果
Table 2 Box-Behnken response surface analysis test design and results
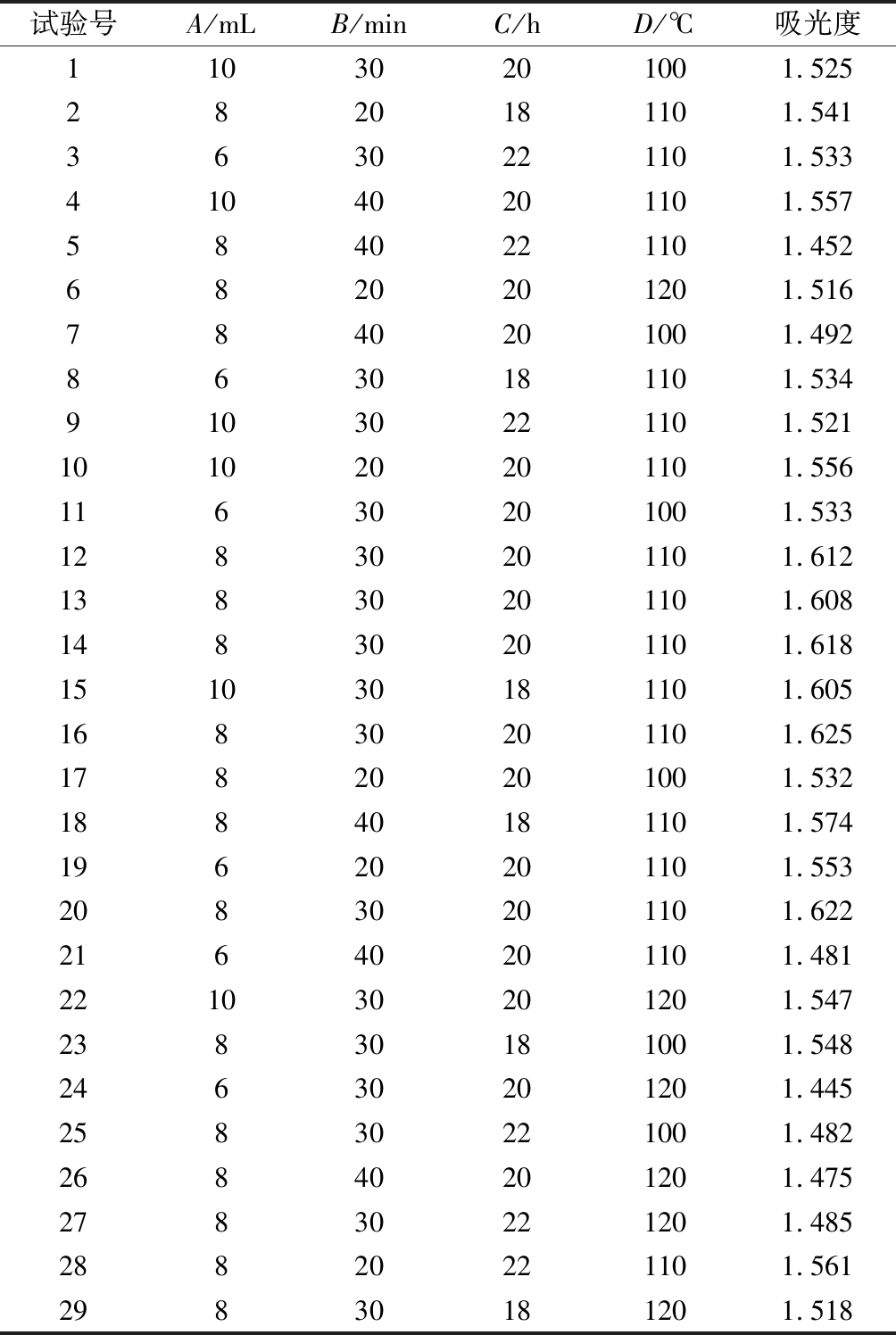
试验号A/mLB/minC/hD/℃吸光度11030201001.5252820181101.5413630221101.53341040201101.5575840221101.4526820201201.5167840201001.4928630181101.53491030221101.521101020201101.55611630201001.53312830201101.61213830201101.60814830201101.618151030181101.60516830201101.62517820201001.53218840181101.57419620201101.55320830201101.62221640201101.481221030201201.54723830181001.54824630201201.44525830221001.48226840201201.47527830221201.48528820221101.56129830181201.518
2.1.2.2 响应面试验优化分析
由图5可知,当超声时间不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AB交互作用的P值<0.01,影响极显著。
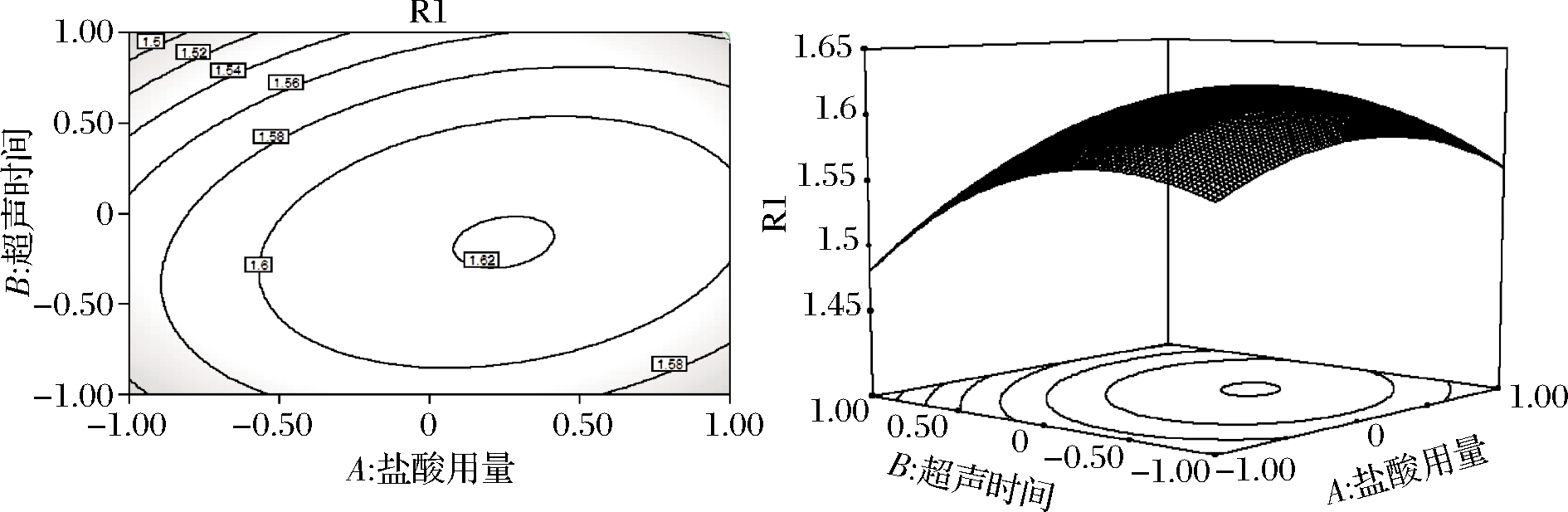
图5 盐酸用量和超声时间对吸光度影响的等高线 及响应面
Fig.5 Contour lines and response surface of the influence of hydrochloric acid dosage and ultrasound time on absorbance
表3 Design-Expert.V 8.06分析回归模型ANOVA结果
Table 3 Design-Expert.V 8.06 analysis regression model ANOVA results
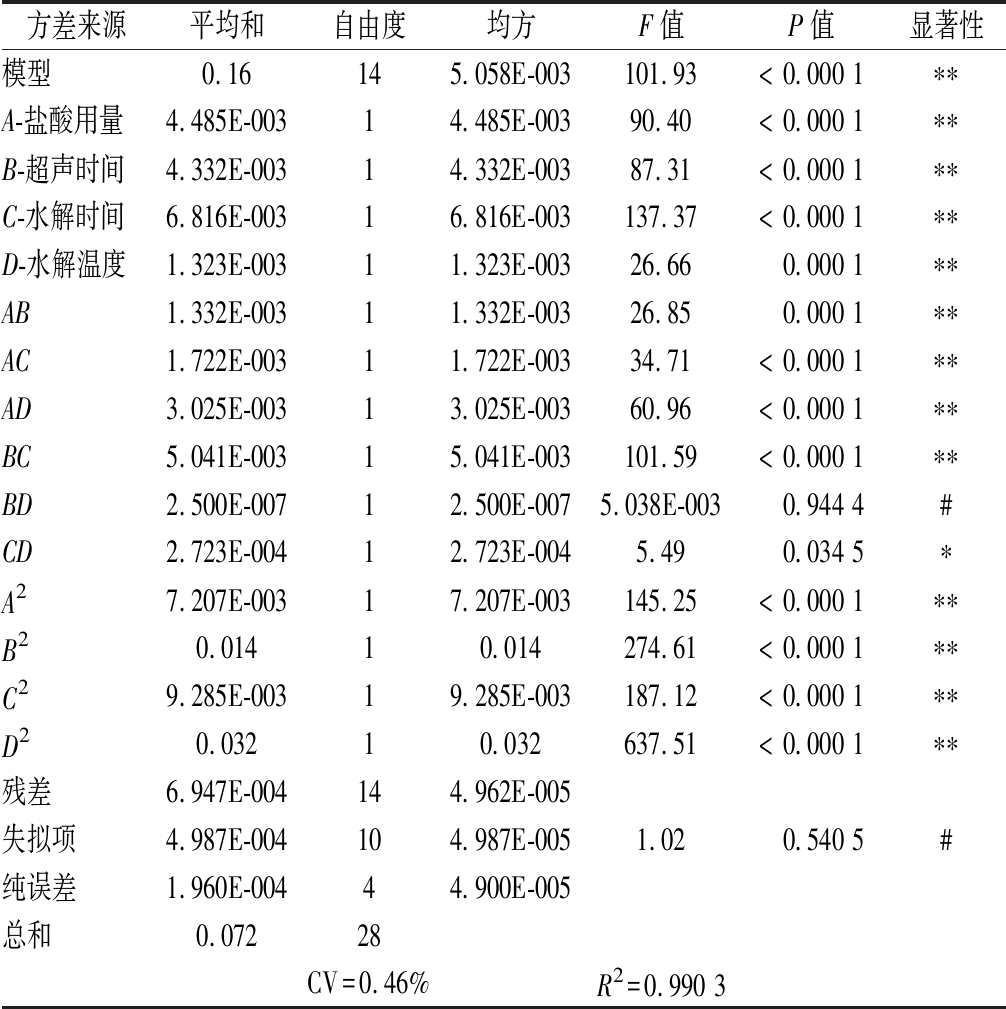
方差来源平均和自由度均方F值P值显著性模型0.16145.058E-003101.93< 0.000 1∗∗A-盐酸用量4.485E-00314.485E-00390.40< 0.000 1∗∗B-超声时间4.332E-00314.332E-00387.31< 0.000 1∗∗C-水解时间6.816E-00316.816E-003137.37< 0.000 1∗∗D-水解温度1.323E-00311.323E-00326.660.000 1∗∗AB1.332E-00311.332E-00326.850.000 1∗∗AC1.722E-00311.722E-00334.71< 0.000 1∗∗AD3.025E-00313.025E-00360.96< 0.000 1∗∗BC5.041E-00315.041E-003101.59< 0.000 1∗∗BD2.500E-00712.500E-0075.038E-0030.944 4#CD2.723E-00412.723E-0045.490.034 5∗A27.207E-00317.207E-003145.25< 0.000 1∗∗B20.01410.014274.61< 0.000 1∗∗C29.285E-00319.285E-003187.12< 0.000 1∗∗D20.03210.032637.51< 0.000 1∗∗残差6.947E-004144.962E-005失拟项4.987E-004104.987E-0051.020.540 5#纯误差1.960E-00444.900E-005总和0.07228CV=0.46%R2=0.990 3
注:**表示极显著(P<0.01),*表示显著(0.01<P<0.05),#表示不显著(P>0.05)
由图6可知,当水解时间不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着水解时间的延长,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着超声时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AC交互作用的P值<0.01,影响极显著。
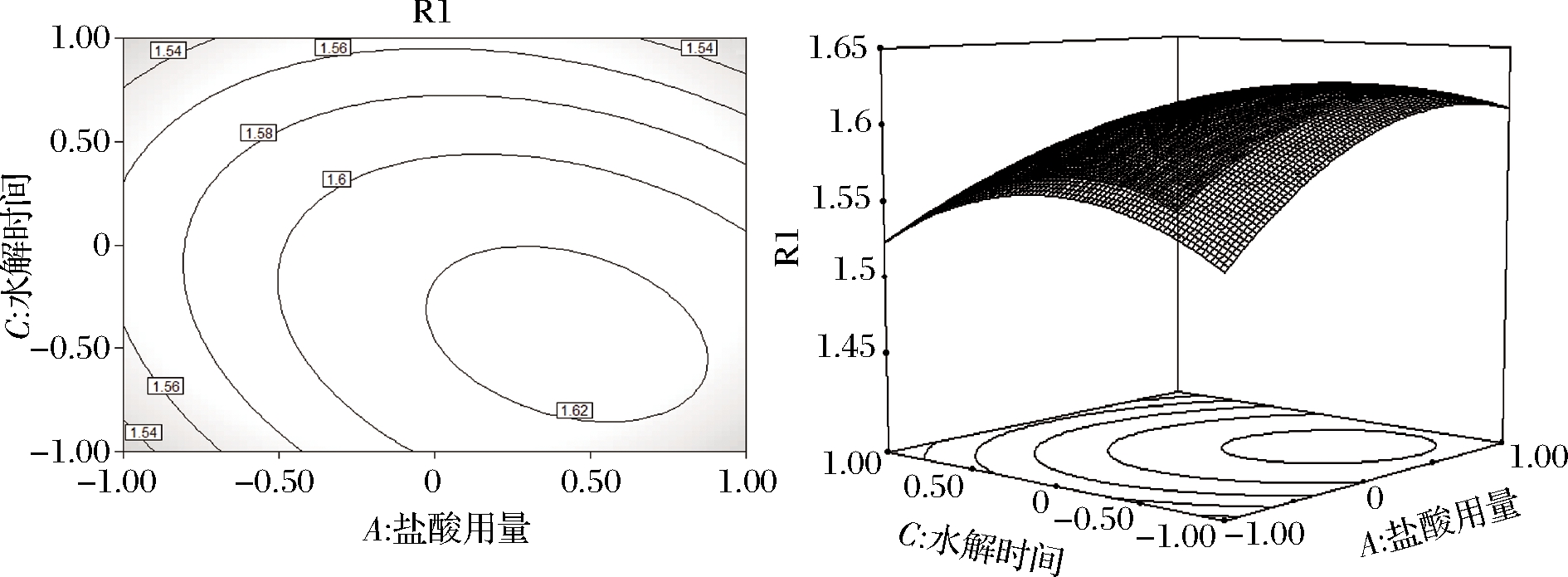
图6 盐酸用量和水解时间对吸光度影响的等高线及响应面
Fig.6 Contour and response surface of the influence of hydrochloric acid dosage and hydrolysis time on absorbance
由图7可知,当水解温度不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度为110 ℃时,吸光度达到峰值。随后随着水解温度的继续增大,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AD交互作用的P值<0.01,影响极显著。
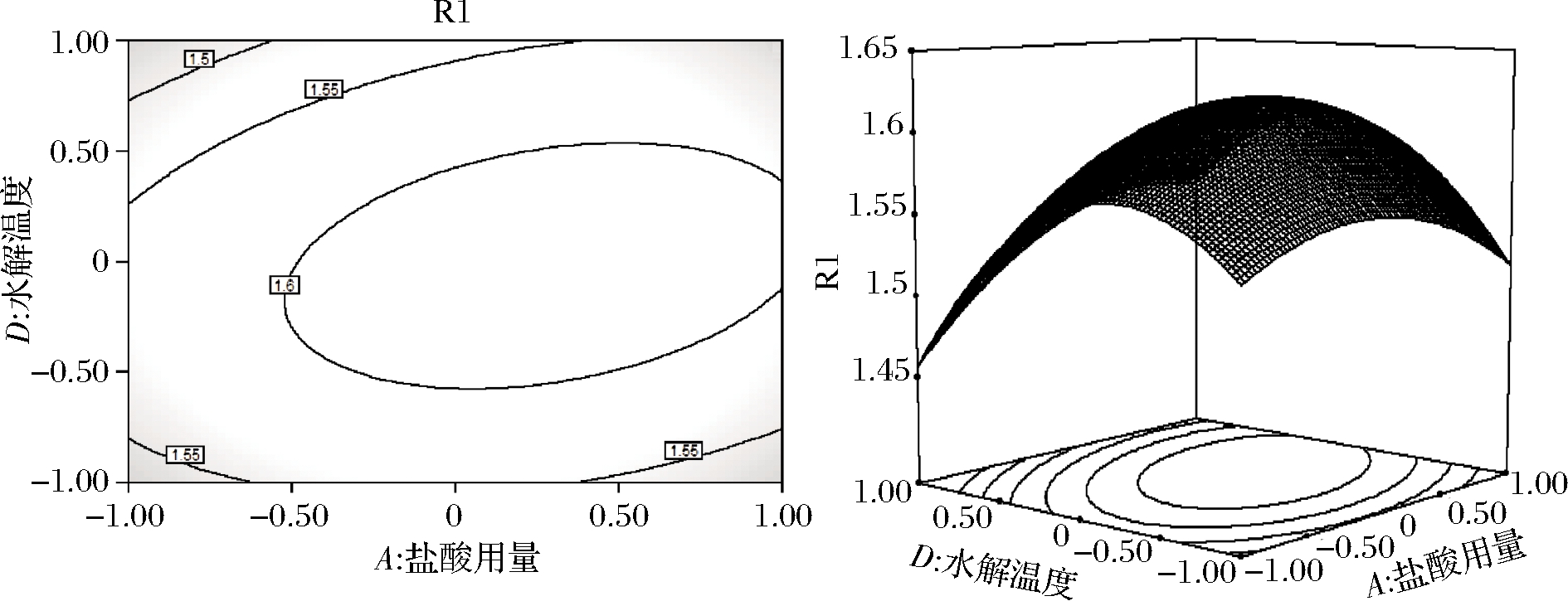
图7 盐酸用量和水解温度对吸光度影响的等高线 及响应面
Fig.7 Contour and response surface of the influence of hydrochloric acid dosage and hydrolysis temperature on absorbance
由图8可知,当水解时间不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间继续延长,吸光度又逐渐减小。同时,当超声时间不变时,随着水解时间的增高,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着水解时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,BC交互作用的P值<0.01,影响极显著。
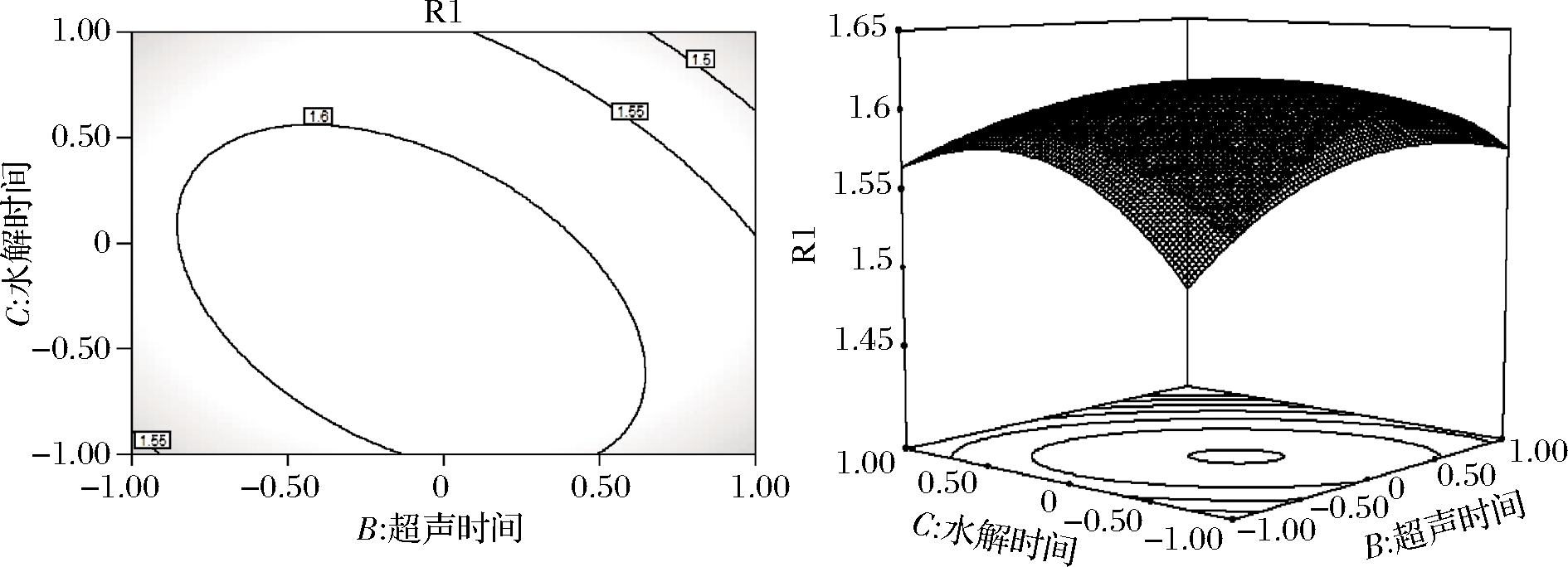
图8 水解时间和超声时间对吸光度影响的等高线及响应面
Fig.8 Contour and response surface of the influence of hydrolysis time and ultrasonic time on absorbance
由图9可知,当水解温度不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间继续延长,吸光度又逐渐减小。同时,当超声时间不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度为110 ℃时,吸光度达到峰值。随后随着水解温度的继续增高,吸光度又逐渐减小。等高线中的椭圆度较小,证明两个因素的交互作用对吸光度的影响不显著。由表3可知,BC交互作用的P值=0.944 4>0.05,影响不显著。

图9 超声时间和水解温度对吸光度影响的等高线 及响应面
Fig.9 Contour and response surface of the influence of ultrasonic time and hydrolysis temperature on absorbance
由图10可知,当水解温度不变时,随着水解时间的延长,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着水解时间继续延长,吸光度又逐渐减小。同时,当水解时间不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度110 ℃时,吸光度达到峰值。随后随着水解温度的继续增高,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可以看出,CD交互作用的P值=0.034 5,影响显著。

图10 水解时间和水解温度对吸光度影响的等高线 及响应面
Fig.10 Contour and response surface of the influence of hydrolysis time and hydrolysis temperature on absorbance
2.1.3 方差分析
由表3可知,该模型的P<0.01,证明该试验拟合方程所成模型极显著。与此同时,失拟项的P值>0.1,证明此模型与正交的结果,线性关系极好。标志着用此模型可以推断出最佳结果。R2=0.990 3,拟合度很好。CV=0.46%,置信度可观,误差较小。因此可以用此模型来预估试验结果,从而减少试验量。表3结果表明,除BD和CD的交互作用的影响不显著外,其余因素的影响都为极显著,证明这些因素及其交互作用对氨基酸提取的影响是极显著的。
2.2 柱前衍生UPLC法浙贝母氨基酸含量测定结果分析
2.2.1 方法学考察
2.2.1.1 线性关系考察
取“1.4.2.1”项下对照品储备液100、200、300、400、500 μL于5 mL容量瓶中,加0.1 mol/L盐酸溶液定容至刻度,配制成系列混合对照品溶液。取系列混合对照品溶液各400 μL,按“1.4.2.2”项下条件衍生,按“1.4.2.4”项下色谱条件进行测定,以各对照品浓度为横坐标(Y),以峰面积为纵坐标(X),绘制标准曲线,结果见表4,结果显示各个成分在线性范围内线性关系良好。
表4 14种氨基酸线性关系
Table 4 The linearity relationships of 14 amino acids
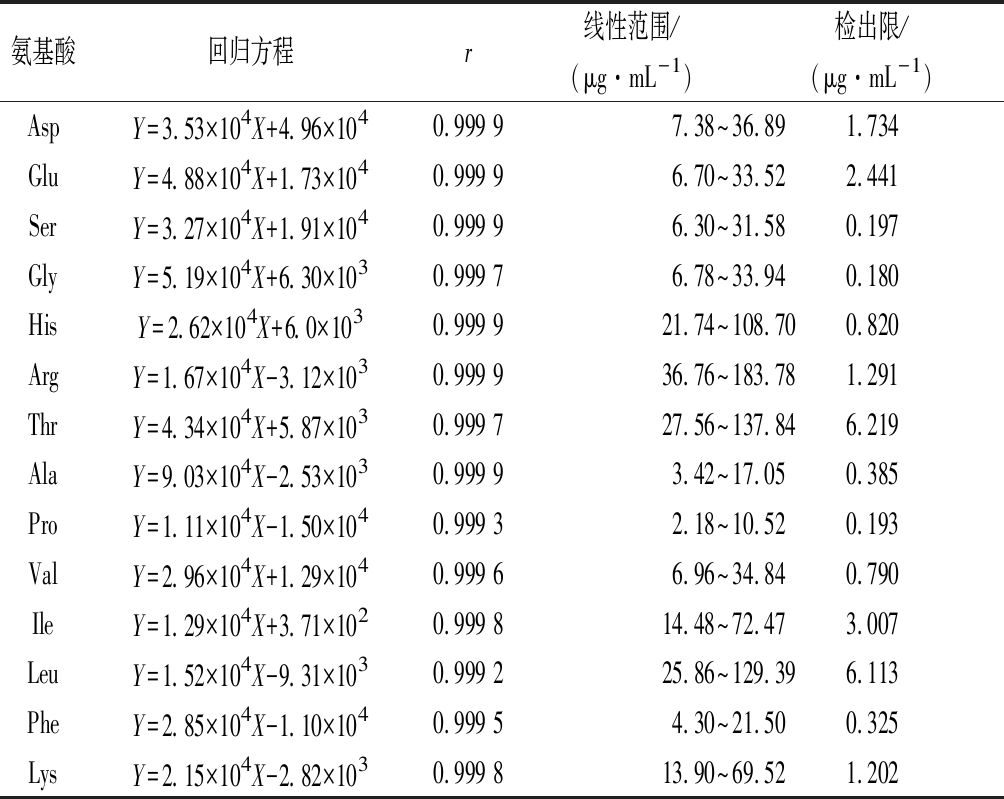
氨基酸回归方程r线性范围/(μg·mL-1)检出限/(μg·mL-1)AspY=3.53×104X+4.96×1040.999 97.38~36.891.734GluY=4.88×104X+1.73×1040.999 96.70~33.522.441SerY=3.27×104X+1.91×1040.999 96.30~31.580.197GlyY=5.19×104X+6.30×1030.999 76.78~33.940.180HisY=2.62×104X+6.0×1030.999 921.74~108.700.820ArgY=1.67×104X-3.12×1030.999 936.76~183.781.291ThrY=4.34×104X+5.87×1030.999 727.56~137.846.219AlaY=9.03×104X-2.53×1030.999 93.42~17.050.385ProY=1.11×104X-1.50×1040.999 32.18~10.520.193ValY=2.96×104X+1.29×1040.999 66.96~34.840.790IleY=1.29×104X+3.71×1020.999 814.48~72.473.007LeuY=1.52×104X-9.31×1030.999 225.86~129.396.113PheY=2.85×104X-1.10×1040.999 54.30~21.500.325LysY=2.15×104X-2.82×1030.999 813.90~69.521.202
2.2.1.2 精密度试验
取“1.4.2.1”项下混合对照品溶液衍生液400 μL,按“1.4.2.2”项下条件衍生,按“1.4.2.4”项下色谱条件连续进样6次,测得各氨基酸峰面积RSD值在1.74%~2.82%,结果表明仪器精密度良好。
2.2.1.3 重复性试验
取浙贝母鳞茎粉末(Zq-2)0.100 0 g,平行6次,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,测得各氨基酸峰面积RSD值为0.83%~2.88%,结果表明重复性良好。
2.2.1.4 稳定性试验
取浙贝母鳞茎样品(Zh-1)0.100 0 g,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件在0、2、4、6、8 h进行测定,测得各氨基酸峰面积RSD值为1.43%~2.95%,结果表明浙贝母衍生液在8 h内稳定性良好。
2.2.1.5 加样回收率试验
取6份已知氨基酸含量的滇重楼根茎粉末(Zh-2)0.050 0 g,置于顶空瓶中,加各氨基酸对照品储备液适量,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,记录各成分峰面积,计算回收率和RSD,结果见表5。结果显示,各氨基酸平均加样回收率为95%~105%,RSD值为0.97%~2.78%,表明该方法准确可靠。
表5 加样回收率(n=6)
Table 5 Recoveries (n=6)
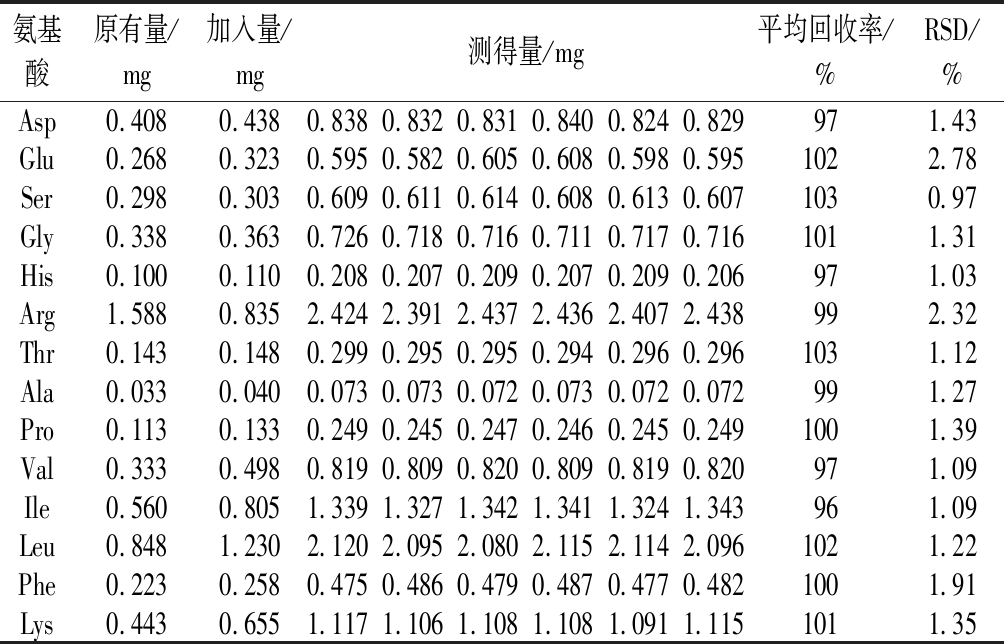
氨基酸原有量/mg加入量/mg测得量/mg平均回收率/%RSD/%Asp0.4080.4380.8380.8320.8310.8400.8240.829971.43Glu0.2680.3230.5950.5820.6050.6080.5980.5951022.78Ser0.2980.3030.6090.6110.6140.6080.6130.6071030.97Gly0.3380.3630.7260.7180.7160.7110.7170.7161011.31His0.1000.1100.2080.2070.2090.2070.2090.206971.03Arg1.5880.8352.4242.3912.4372.4362.4072.438992.32Thr0.1430.1480.2990.2950.2950.2940.2960.2961031.12Ala0.0330.0400.0730.0730.0720.0730.0720.072991.27Pro0.1130.1330.2490.2450.2470.2460.2450.2491001.39Val0.3330.4980.8190.8090.8200.8090.8190.820971.09Ile0.5600.8051.3391.3271.3421.3411.3241.343961.09Leu0.8481.2302.1202.0952.0802.1152.1142.0961021.22Phe0.2230.2580.4750.4860.4790.4870.4770.4821001.91Lys0.4430.6551.1171.1061.1081.1081.0911.1151011.35
2.2.2 样品测定
精密称取“1.3”项下的8份不同产地栽前及栽后浙贝母样品(过3号筛)0.100 0 g,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,带入标准曲线方程,计算14种氨基酸含量,结果见表6。空白衍生溶液、混合对照品及样品色谱图见图11。由图11可知,与标准品对照,样品中含有14种氨基酸。样品中各组分得到了较好的分离,进一步验证了色谱条件的可行性。
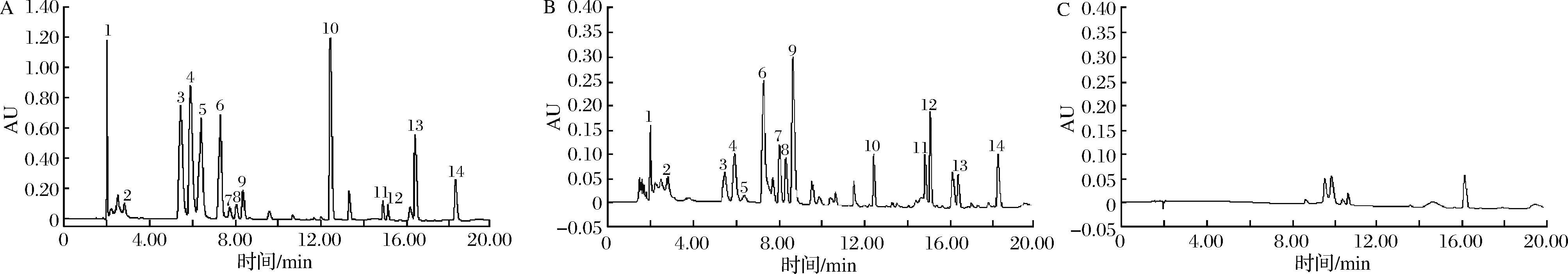
1-Asp;2-Glu;3-Ser;4-Gly;5-His;6-Arg;7-Thr;8-Ala;9-Pro;10-Val;11-Ile;12-Leu;13-Phe;14-Lys A-对照组;B-供试品;C-空白溶液
图11 混合对照品、供试品及空白溶液UPLC色谱图
Fig.11 UPLC chromatogram of amino acids of reference substances solution, sample solution and blank solution
由表6可知,不同产地浙贝母鳞茎中氨基酸含量存在一定差异,其中天门冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、缬氨酸、异亮氨酸含量、亮氨酸、苯丙氨酸、赖氨酸含量分别为2.071~8.190、2.614~7.639、4.405~6.199、4.793~6.828、1.163~2.072、12.544~37.516、1.869~2.885、2.240~3.585、14.490~19.282、3.803~6.703、6.852~16.337、11.580~18.966、2.953~4.434、5.392~11.940 mg/g。4个产地栽前与栽后浙贝母样品中,精氨酸平均含量最高;脯氨酸和异亮氨酸平均含量较高。组氨酸含量最低。
表6 不同产地栽前栽后浙贝母中14种氨基酸含量(n=3) 单位:mg/g
Table 6 Contents of 14 amino acids in Fritillaria thunbergii Miq before and after planting in different producing areas(n=3)
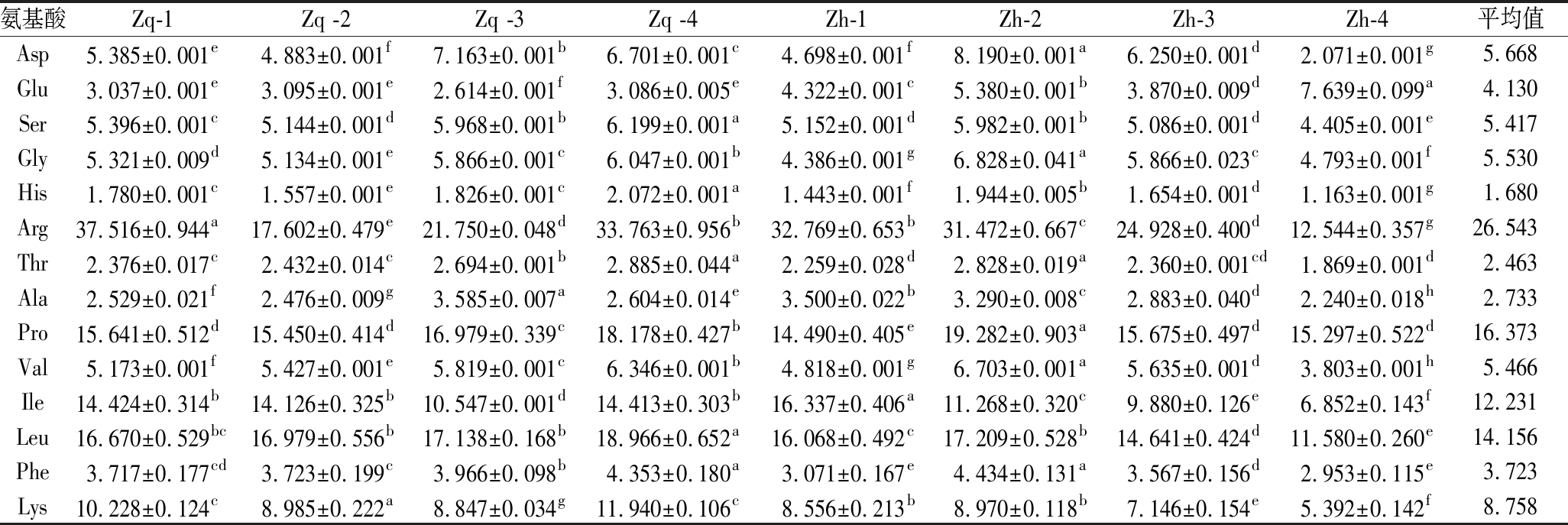
氨基酸Zq-1Zq -2Zq -3Zq -4Zh-1Zh-2Zh-3Zh-4平均值Asp5.385±0.001e4.883±0.001f7.163±0.001b6.701±0.001c4.698±0.001f8.190±0.001a6.250±0.001d2.071±0.001g5.668Glu3.037±0.001e3.095±0.001e2.614±0.001f3.086±0.005e4.322±0.001c5.380±0.001b3.870±0.009d7.639±0.099a4.130Ser5.396±0.001c5.144±0.001d5.968±0.001b6.199±0.001a5.152±0.001d5.982±0.001b5.086±0.001d4.405±0.001e5.417Gly5.321±0.009d5.134±0.001e5.866±0.001c6.047±0.001b4.386±0.001g6.828±0.041a5.866±0.023c4.793±0.001f5.530His1.780±0.001c1.557±0.001e1.826±0.001c2.072±0.001a1.443±0.001f1.944±0.005b1.654±0.001d1.163±0.001g1.680Arg37.516±0.944a17.602±0.479e21.750±0.048d33.763±0.956b32.769±0.653b31.472±0.667c24.928±0.400d12.544±0.357g26.543Thr2.376±0.017c2.432±0.014c2.694±0.001b2.885±0.044a2.259±0.028d2.828±0.019a2.360±0.001cd1.869±0.001d2.463Ala2.529±0.021f2.476±0.009g3.585±0.007a2.604±0.014e3.500±0.022b3.290±0.008c2.883±0.040d2.240±0.018h2.733Pro15.641±0.512d15.450±0.414d16.979±0.339c18.178±0.427b14.490±0.405e19.282±0.903a15.675±0.497d15.297±0.522d16.373Val5.173±0.001f5.427±0.001e5.819±0.001c6.346±0.001b4.818±0.001g6.703±0.001a5.635±0.001d3.803±0.001h5.466Ile14.424±0.314b14.126±0.325b10.547±0.001d14.413±0.303b16.337±0.406a11.268±0.320c9.880±0.126e6.852±0.143f12.231Leu16.670±0.529bc16.979±0.556b17.138±0.168b18.966±0.652a16.068±0.492c17.209±0.528b14.641±0.424d11.580±0.260e14.156Phe3.717±0.177cd3.723±0.199c3.966±0.098b4.353±0.180a3.071±0.167e4.434±0.131a3.567±0.156d2.953±0.115e3.723Lys10.228±0.124c8.985±0.222a8.847±0.034g11.940±0.106c8.556±0.213b8.970±0.118b7.146±0.154e5.392±0.142f8.758
注:数据后字母表示差异显著性(P<0.05)
2.2.3 独立样本t检验
采用SPSS 20.0软件对4个产地栽培前浙贝母和4个产地栽培后浙贝母鳞茎中14种氨基酸进行独立样本t检验分析,分析结果见表7。由表7可知,方差方程的Levene 检验可以看出,14种氨基酸方差相等(P>0.05)。均值方程的t检验可以看出,栽培前浙贝母与栽培后浙贝母鳞茎中14种氨基酸含量均无显著差异(P>0.05)。
3 结论
本文对氨基酸提取条件中的盐酸用量、超声时间、水解温度和水解时间4个因素,先进行了单因素考察。通过单因素考察初步确定了每个因素的最佳条件。为了进一步优化提取条件,我们采用了响应面法对这些因素进行深入研究。采用4因素3水平,通过Design Expert 8.0.6.1软件设计出试验组。研究发现盐酸用量、超声时间、水解温度和水解时间4个因素对氨基酸提取的影响都十分显著。最佳的浙贝母氨基酸提取条件为:6 mol/L盐酸8 mL、超声时间30 min、水解时间20 h及水解温度110 ℃。经过分析,这些因素间的交互作用,除了超声时间和水解温度的交互作用对其影响不显著外,其余交互作用对氨基酸提取的影响都十分显著。
表7 浙贝母鳞茎14种氨基酸独立样本t检验
Table 7 T test of independent samples of 14 amino acids in bulbs of Fritillaria thunbergii Miq
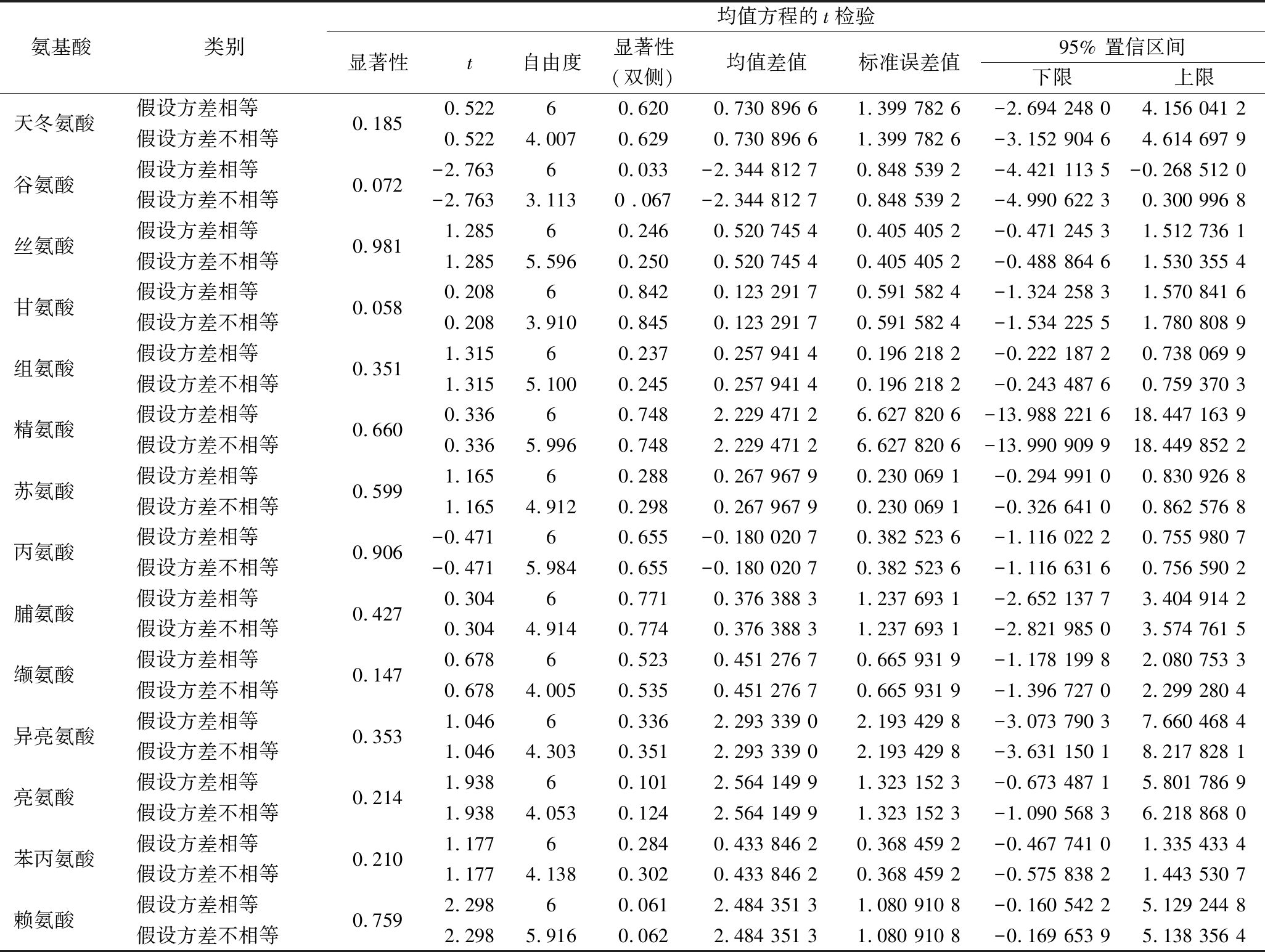
均值方程的t检验氨基酸类别显著性t自由度显著性均值差值标准误差值95% 置信区间(双侧)下限上限天冬氨酸假设方差相等0.1850.52260.6200.730 896 61.399 782 6-2.694 248 04.156 041 2假设方差不相等0.522 4.007 0.629 0.730 896 61.399 782 6-3.152 904 64.614 697 9谷氨酸假设方差相等0.072 -2.763 60.033 -2.344 812 70.848 539 2-4.421 113 5-0.268 512 0假设方差不相等-2.763 3.113 0 .067 -2.344 812 70.848 539 2-4.990 622 30.300 996 8丝氨酸假设方差相等0.981 1.285 60.246 0.520 745 40.405 405 2-0.471 245 31.512 736 1假设方差不相等1.285 5.596 0.250 0.520 745 40.405 405 2-0.488 864 61.530 355 4甘氨酸假设方差相等0.058 0.208 60.842 0.123 291 70.591 582 4-1.324 258 31.570 841 6假设方差不相等0.208 3.910 0.845 0.123 291 70.591 582 4-1.534 225 51.780 808 9组氨酸假设方差相等0.351 1.315 60.237 0.257 941 40.196 218 2-0.222 187 20.738 069 9假设方差不相等1.315 5.100 0.245 0.257 941 40.196 218 2-0.243 487 60.759 370 3精氨酸假设方差相等0.660 0.336 60.748 2.229 471 26.627 820 6-13.988 221 618.447 163 9假设方差不相等0.336 5.996 0.748 2.229 471 26.627 820 6-13.990 909 918.449 852 2苏氨酸假设方差相等0.599 1.165 60.288 0.267 967 90.230 069 1-0.294 991 00.830 926 8假设方差不相等1.165 4.912 0.298 0.267 967 90.230 069 1-0.326 641 00.862 576 8丙氨酸假设方差相等0.906 -0.471 60.655 -0.180 020 70.382 523 6-1.116 022 20.755 980 7假设方差不相等-0.471 5.984 0.655 -0.180 020 70.382 523 6-1.116 631 60.756 590 2脯氨酸假设方差相等0.427 0.304 60.771 0.376 388 31.237 693 1-2.652 137 73.404 914 2假设方差不相等0.304 4.914 0.774 0.376 388 31.237 693 1-2.821 985 03.574 761 5缬氨酸假设方差相等0.147 0.678 60.523 0.451 276 70.665 931 9-1.178 199 82.080 753 3假设方差不相等0.678 4.005 0.535 0.451 276 70.665 931 9-1.396 727 02.299 280 4异亮氨酸假设方差相等0.353 1.046 60.336 2.293 339 02.193 429 8-3.073 790 37.660 468 4假设方差不相等1.046 4.303 0.351 2.293 339 02.193 429 8-3.631 150 18.217 828 1亮氨酸假设方差相等0.214 1.938 60.101 2.564 149 91.323 152 3-0.673 487 15.801 786 9假设方差不相等1.938 4.053 0.124 2.564 149 91.323 152 3-1.090 568 36.218 868 0苯丙氨酸假设方差相等0.210 1.177 60.284 0.433 846 20.368 459 2-0.467 741 01.335 433 4假设方差不相等1.177 4.138 0.302 0.433 846 20.368 459 2-0.575 838 21.443 530 7赖氨酸假设方差相等0.759 2.298 60.061 2.484 351 31.080 910 8-0.160 542 25.129 244 8假设方差不相等2.298 5.916 0.062 2.484 351 31.080 910 8-0.169 653 95.138 356 4
采用柱前衍生法-UPLC测定8份浙贝母鳞茎栽前栽后样品中氨基酸含量,其中,精氨酸(Arg)含量最高,达到26.543 mg/g,其次是脯氨酸(Pro),组氨酸(His)含量最低,仅有1.680 mg/g。栽前鳞茎总氨基酸含量为107.01~137.55 mg/g,栽后鳞茎总氨基酸含量为82.60~133.78 mg/g。总体来看,奉节和宁波浙贝母样品栽后的氨基酸含量比起栽前有所下降,奉节下降的最为明显,从137.55 mg/g下降至80.60 mg/g,而南通和磐安的浙贝母鳞茎中,栽后样品的氨基酸含量有所上升,南通从114.76 mg/g上升至121.89 mg/g,磐安则从107.01 mg/g上升至133.78 mg/g,结果表明从不同产地移植的鳞茎栽下后,环境对氨基酸含量还是存在一定的影响,导致这种差异的原因可能跟不同产地的生长环境、土壤条件等有关[22-23]。
本研究采用响应面法优化氨基酸提取条件后,建立了PITC柱前衍生化-UPLC法同时测定浙贝母鳞茎中14种氨基酸含量的方法,此方法灵敏度高、分离效果好、结果稳定可靠,可作为浙贝母的品质评价指标含量测定方法之一。采用此方法比较了不同产地浙贝母栽前栽后氨基酸含量差异,为浙贝母品种选育,解决其资源匮乏等问题提供了理论参考。
[1] ZHONG Y C, WANG H Y, WEI Q H, et al.Combining DNA barcoding and hplc fingerprints to trace species of an important traditional chinese medicine fritillariae bulbus[J].Molecules, 2019, 24(18):3 269.
[2] 周洁, 王忠华. 浙贝母遗传多样性的ISSR分析[J]. 浙江农业科学, 2012 (2): 156-159.
ZHOU J, WANG Z H. ISSR analysis of genetic diversity of Fritillaria thunbergii Miq[J]. Zhejiang Agricultural Sciences, 2012 (2): 156-159.
[3] 吴秋丽, 嵇元烨, 董莉莉, 等.不同产地浙贝母生物碱含量及其合成相关基因表达研究[J].广西植物,2020,40(12):1 755-1 763.
WU Q L, JI Y Y, DONG L L, et al.Studies on the content of alkaloids in Fritillaria thunbergii Miq from different producing areas and the expression of their synthesis-related genes[J].Guangxi Plant,2020,40(12):1 755-1 763.
[4] RUAN X, CUI W X, YANG L, et al.Extraction of total alkaloids, peimine and peiminine from the flower of Fritillaria thunbergii Miq using supercritical carbon dioxide[J].Journal of CO2 Utilization, 2017, 18:283-293.
[5] 郭梦喆, 李建伟, 吴世华.浙贝母花的氨基酸成分分析[J].安徽农业科学, 2011, 39(10):5 782-5 783.
GUO M Z, LI J W, WU S H.Analysis of amino acid composition of Fritillaria thunbergii Miq flower[J].Journal of Anhui Agricultural Sciences, 2011, 39(10):5 782-5 783.
[6] KIM M, NGUYEN D V, HEO Y, et al.Antiviral activity of Fritillaria thunbergii extract against human influenza virus H1 N1 (PR8) in vitro, in ovo and in vivo[J].J Microbiol Biotechnol, 2020,30(2):172-177.
[7] 张明发, 沈雅琴.浙贝母药理研究进展[J].上海医药, 2007, 28(10):459-461.
ZHANG M F, SHEN Y Q.Research progress in pharmacology of Fritillaria thunbergii Miq[J].Shanghai Medicine, 2007,28(10):459-461.
[8] LI H, HUNG A D, LI M D, et al.Fritillariae thunbergii bulbus:Traditional uses, phytochemistry, pharmacodynamics, pharmacokinetics and toxicity[J].Intertational Journal of Molecular Sciences.2019 20(7):1 667.
[9] 闫精杨, 刘培, 江曙, 等.浙贝母花期地上部分核苷类、氨基酸类及无机元素类成分分析与评价[J].中国现代中药, 2016,18(8):967-973.
YAN J Y, LIU P, JIANG S, et al.Analysis and evaluation of nucleosides, amino acids and inorganic elements in the aboveground part of Fritillaria thunbergii Miq in flowering period[J].Modern Chinese Medicine, 2016, 18(8):967-973.
[10] JO O A P, MIGUEL A P, ISABEL C F R F, et al.Analysis of the oxypropylation process of a lignocellulosic material, almond shell, using the response surface methodology (RSM)[J].Industrial Crops & Products, 2020, 153:112 542.
O A P, MIGUEL A P, ISABEL C F R F, et al.Analysis of the oxypropylation process of a lignocellulosic material, almond shell, using the response surface methodology (RSM)[J].Industrial Crops & Products, 2020, 153:112 542.
[11] AMANDA C R, MELISSA M M, BLAKE B R, et al.Effect of essential amino acid supplementation and aerobic exercise on insulin sensitivity in healthy older adults:A randomized clinical trial[J].Clinical nutrition (Edinburgh, Scotland), 2020, 39(5):1 371-1 378.
[12] LEBRAZI S, FADIL M, CHRAIBI M, et al.Screening and optimization of indole-3-acetic acid production by Rhizobium sp.strain using response surface methodology[J].Journal of Genetic Engineering and Biotechnology,2020,18(7):130-136.
[13] 陈文, 王湘君, 王玉杰, 等.响应曲面法优化海参氨基酸提取工艺[J].食品工业, 2018, 39(8):154-160.
CHEN W, WANG X J, WANG Y J, et al.Response surface methodology to optimize the extraction process of sea cucumber amino acids[J].Food Industry, 2018, 39(8):154-160.
[14] 王斯维, 王栋, 陶玲玲, 等.黄酒和米酒中氨基酸态氮测定方法的比较[J].食品与发酵工业, 2019, 45(23):232-238.
WANG S W, WANG D, TAO L L, et al.Comparison of determination methods of amino acid nitrogen in rice wine and rice wine[J].Food and Fermentation Industries, 2019, 45(23):232-238.
[15] NAKAYAMA A, IMAIZUMI A, YOSHIDA H.Methods for absolute quantification of human plasma free amino acids by high-performance liquid chromatography/electrospray ionization mass spectrometry using precolumn derivatization[J].Methods Mol Biol, 2019, 2030:207-218.
[16] 宋佳, 李锦清, 李聪, 等.QuEChERS萃取-液相色谱法测定酱油和酱制品中三氯蔗糖[J].食品与发酵工业, 2019, 45(14):229-232.
SONG J, LI J Q, LI C, et al.QuEChERS extraction-liquid chromatography for the determination of sucralose in soy sauce and sauce products[J].Food and Fermentation Industries, 2019,45(14):229-232.
[17] 徐昕耘, 俞春娜, 展晓日, 等.多角度探寻提高浙贝母产量的有效途径[J].浙江农业科学, 2020, 61(4):695-696;701.
XU X Y, YU C N, ZHAN X R, et al.Exploring the effective ways to increase the yield of Fritillaria thunbergii Miq from different angles[J].Zhejiang Agricultural Sciences, 2020, 61(4):695-696;701.
[18] 李洪潮, 常征, 丁长春, 等, 32种石斛属植物的氨基酸分析及营养价值评定[J].文山学院学报, 2020, 33(3):5-11.
LI H C, CHANG Z, DING C C, et al.Amino acid analysis and nutritional value evaluation of 32 species of Dendrobium plants[J].Journal of Wenshan College, 2020,33(3):5-11.
[19] ULIANA K, VICTORIIA K, IRINA C, et al.Determination of free and bound amino acids in plant raw materials of zea mays L[J].The Method of High-Performance Liquid Chromatography,2020, 12(2):143-148.
[20] 林太凤, 赵梦柯, 王妍鸣, 等.氨基酸检测技术研究进展[J].安徽农业科学, 2015, 43(18):16-19.
LIN T F, ZHAO M K, WANG Y M, et al.Research progress of amino acid detection technology[J].Journal of Anhui Agricultural Sciences, 2015,43(18):16-19.
[21] 黄小兰,何旭峰,杨勤,等.PMP柱前衍生化HPLC法测定地参多糖的单糖组成[J].食品与发酵工业,2020,46(7):250-256.
HUANG X L, HE X F, YANG Q, et al.PMP pre-column derivatization HPLC method for determination of monosaccharide composition of ground ginseng polysaccharide[J].Food and Fermentation Industries, 2020,46(7):250-256.
[22] 张兰胜, 谷文超, 文明, 等.浙贝母栽培技术研究进展[J].中国野生植物资源, 2020,39(5):45-48.
ZHANG L S, GU W C, WEN M, et al.Research progress on the cultivation technology of Fritillaria thunbergii Miq in Zhejiang[J].Chinese Wild Plant Resources, 2020,39(5):45-48.
[23] CHI Y W, HUANG Y Y, WANG J C, et al.Two plant growth promoting bacterial Bacillus strains possess different mechanisms in adsorption and resistance to cadmium[J].Science of the Total Environment, 2020,741:140 422.