Hg2+是海洋中汞污染的主要形式,易被海洋生物转化为剧毒有机汞[1]。Hg2+会通过被污染的鱼、贝、虾、海带等海洋生物进入人体,造成有丝分裂受损、DNA损伤、中枢神经系统损害、脑损伤、严重的认知障碍、免疫系统功能障碍、肾功能衰竭等[2-3]。即使较低浓度的Hg2+ 进入人体后也会迅速与细胞内的相关分子产生反应,干扰人体细胞的正常功能,影响正常的生命活动[4]。因此,对海产品中Hg2+ 的检测是全世界备受关注的问题。
传统的Hg2+ 检测方法有原子吸收光谱法、电感耦合等离子体质谱法、高效液相色谱法等[5-7]。这些方法虽然具有灵敏度高、选择性高等优势,但检测耗时长、仪器价格昂贵、需专业人士操作、现场检测困难等缺点妨碍了其应用。为了克服这些困难,相继开发了各种检测Hg2+ 的替代方法,如荧光法、电化学法和比色法等[8-12]。其中,比色法因其检测过程简单、快速、成本低、肉眼可观察等优点被广泛应用于Hg2+ 检测。
近年来,多种纳米材料被用作Hg2+ 检测的比色传感器,如碳基纳米材料(氧化石墨烯、碳纳米管、碳点等)、金属纳米颗粒(Au、Ag、Pt)、金属氧化物纳米颗粒(CuO、Co3O4、MnO2)等[13-21]。但这些材料存在表面积小、分散性差、在低pH条件下不稳定等问题。层状双金属氢氧化物(layered double hydroxides,LDHs)是由2种金属的氢氧化物层层堆积而成的一种新兴的纳米材料。因其具有多孔性、高比表面积和均匀分布的活动中心以及前驱体层状氢氧化物的可调控性,能够将具有变价特性的过渡金属定量引入,因此被广泛应用于催化、吸附、载体等多方面[22-26]。
本文采用共沉淀法制备了Ni/Co层状氢氧化物(Ni/Co LDHs)。如图1所示,基于Ni/Co LDHs模拟类氧化物酶活性,可以催化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB)生成蓝色的氧化态TMB(oxTMB)。加入谷胱甘肽(glutathione,GSH)后,由于GSH的硫醇基团阻碍了阳离子自由基的形成,会使得蓝色oxTMB的形成变少。当Hg2+ 被引入Ni/Co LDHs/TMB/GSH体系时,由于汞-硫醇络合物的形成,释放了GSH中的TMB,使得蓝色恢复。基于这一机理,我们构建了一种海产品中Hg2+ 的快速比色检测方法,为纳米材料模拟酶在食品分析中的应用提供了新思路。
1 材料与方法
1.1 试验材料
TMB、氨水、冰乙酸、醋酸钠、无水乙醇,成都市科隆化学品有限公司;六水氯化镍,广东光华科技股份有限公司;六水氯化钴,天津市科密欧化学试剂有限公司;GSH,阿拉丁(中国上海);试验所用试剂均为分析纯,试验用水均为蒸馏水。
1.2 仪器与设备
UV-2550型紫外可见分光光度计,日本岛津;HC-3018R型高速冷冻离心机,北京仪诺科兴科技发展有限公司;DZF-6020型真空干燥箱,上海海向仪器设备厂;FE20/EL20型pH计,梅特勒-托利多仪器公司;KH-250E型超声波清洗器,深圳市得康科技有限公司;Vetex70型傅里叶变换近红外光谱(Fourier transform infrared spectrometer,FTIR),德国布鲁克公司;CP-224C型分析天平,奥豪斯仪器公司;K-Alpha型X-射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS),美国热电公司。
1.3 试验方法
1.3.1 Ni/Co LDHs的制备
将10 mL 0.1 mol/L CoCl2·6H2O和20 mL 1 mol/L NiCl2·6H2O在磁力搅拌下均匀混合,逐滴加入1 mL 35%(体积分数)的氨水,将上述溶液在50 mL 玻璃瓶中密封3 h。待反应结束后收集样品,在5 000 r/min离心10 min,分别用去离子水和无水乙醇洗涤3次。所得沉淀物放入60 ℃真空干燥箱中干燥24 h,得到产物Ni/Co LDHs。
1.3.2 Ni/Co LDHs的表征
采用场发射扫描电子显微镜观察Ni/Co LDHs的形貌;由X射线衍射仪获得Ni/Co LDHs的X射线衍射(X-ray diffraction,XRD)图谱,用于表征其晶体结构;利用FTIR进行分析,得到红外光谱,用于分析Ni/Co LDHs的表面功能基团;用XPS进一步确认Ni/Co LDHs表面的化学信息。
1.3.3 Ni/Co LDHs类氧化物模拟酶催化动力学
1.3.3.1 Ni/Co LDHs类氧化物模拟酶的活性验证
制备TMB、TMB+Ni/Co LDHs、TMB+Ni/Co LDHs+GSH、TMB+Ni/Co LDHs+GSH+Hg2+ 4种不同的反应体系,25 ℃孵育10 min后,收集反应体系在652 nm处的吸光度值。用于验证Ni/Co LDHs的氧化物酶活性。
1.3.3.2 检测条件的优化
以吸光度值变化大小为指标,检测不同孵育时间(2、4、6、8、10、12、14、16 min)、体系pH(2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0)、TMB浓度(0、0.05、0.1、0.2、0.5、1、2、5、10 mmol/L)、孵育温度(10、15、20、25、30、35、40、45、50、55 ℃)和Ni/Co LDHs浓度(0.2、0.4、0.6、0.8、1 mmol/L)条件下体系吸光度值的变化,优化检测条件。所有试验做3个平行。
1.3.3.3 Ni/Co LDHs类氧化物模拟酶催化动力学
通过UV-2550型紫外可见分光光度计以时间扫描模式,测定TMB在652 nm处吸光度随时间的变化,根据公式(1)Lineweaver-Burk曲线计算Michaelis-Menten常数。
(1)
式中:v为初始速度;vmax为最大反应速度;[S]为底物浓度;Km为米氏常数,表示底物与酶亲和力的大小,Km值越小,表明酶与底物之间的亲和力越大。
1.3.4 检测海产品中的Hg2+
1.3.4.1 标准曲线
在最优条件下,将50 μL 1 mmol/L谷胱甘肽、200 μL 0.5 mmol/L TMB、100 μL 0.8 mg/mL Ni/Co LDHs溶液与不同浓度的Hg2+ 混合,在25 ℃孵育10 min后,检测反应体系在652 nm处的吸光度值。所得数据用经验方程式(2)进行拟合,进行数据分析,并绘制标准曲线,得到相关系数R2。由公式(3)得到检测线性范围及检测限。
(2)
(3)
式中:α,β分别为对![]() 汞离子浓度[Q]拟合后的曲线的斜率和截距值;δ为空白信号的标准偏差;S为标准曲线斜率;[Q]为Hg2+ 浓度。
汞离子浓度[Q]拟合后的曲线的斜率和截距值;δ为空白信号的标准偏差;S为标准曲线斜率;[Q]为Hg2+ 浓度。
1.3.4.2 干扰试验
为了研究其他离子对检测体系的干扰性,拟以水中常见的金属离子,如Na+、Mg2+、Cu2+、Cr3+、Pb2+、Mn2+、Zn2+ 等来评价该方法的选择性。将2 mL pH 4.0的醋酸-醋酸钠缓冲液、200 μL 0.5 mmol/L的TMB、50 μL 0.8 mg/mL的Ni/Co LDHs、50 μL 1 mmol/L的GSH以及 0.1 mmol/L的不同金属离子依次加入,均匀混合。在25 ℃孵育10 min后,检测反应体系在652 nm处的吸光度值。所有试验做3个平行。
1.3.4.3 实际样品检测
为了评估Ni/Co LDHs对海产品中Hg2+ 检测的适用性,选用大黄鱼(Larimichthys crocea)和海带(Saccharina japonica)(购于当地超市)进行实际样品检测。先对海产品样品进行消解预处理[27],分别将0.5 g的鱼和海带样品放入锥形瓶中,依次滴入15 mL HNO3和2.5 mL H2SO4。混合物在室温下放置12 h,然后煮沸直到溶液变清。冷却至室温后(20 ℃ 左右),用1 mol/L NaOH溶液调pH值至4.0。用蒸馏水将所得溶液稀释至100 mL。用构建的传感器检测处理后的样品溶液。所有试验做3个平行。
2 结果与分析
2.1 Ni/Co LDHs的表征
通过扫描电子显微镜(scanning electron microscope,SEM)观察到制备的Ni/Co LDHs的形貌如图2-a和2-b所示。可以看出Ni/Co LDHs呈均匀的三维花状微球结构,这种花状结构会使结构更稳定,比表面积更大,活性位点更暴露,有利于Ni/Co LDHs与目标物的接触,从而提高催化性能[28]。为进一步验证在Ni/Co LDHs中各种元素的分布是否均匀,在一块三维花状区域上分别选取O、Ni、Co 3种元素进行mapping测试,结果如图2-c所示,O、Ni、Co元素在Ni/Co LDHs中分布均匀。通过XRD和红外光谱对制备的Ni/Co LDHs纳米微球的组成进行了分析。XRD图谱如图3-a所示,在11.4、22.6、34.3、38.7处的4个特征峰归属于(003)、(006)、(012)、(015)晶面,这与Ni/Co LDHs以前的报道一致[28]。FTIR图谱如图3-b所示,在3 354 cm-1处的峰属于—OH的伸缩振动,较宽的羟基吸收峰表明Ni/Co LDHs表面上具有多个羟基结构,赋予其更高的极性和亲水性,可以稳定的分散在水中[29]。1 391 cm-1处的谱带归因于层间CO2的振动,可能是由于大气中溶解的CO2分子吸收。523、564、637、860 cm-1处的峰归因于M—O、O—M—O和M—O—M(M代表Ni或Co)的晶格振动模式。2 928、2 820、1 620、1 457和1 053 cm-1处的峰归因于乙醇分子的C—O、C—H和C—C基团。通过XPS分析了Ni/Co LDHs中元素的价态,结果如图3-c所示,有284.73、530.72、781.70和856.98 eV 4个典型的峰,分别是C 1s、O 1s、Ni 2p和Co 2p的XPS特征峰,这说明合成的Ni/Co LDHs的表面主要由C、O、Ni和Co 4种元素组成。接着对Ni 2p、Co 2p和O 1s的扫描图谱分峰拟合,由图3-d所示的Ni 2p的高分辨图可知,除了861.83和879.94 eV处的sat外,Ni 2p谱有4个峰,其中855.75和873.25 eV表明Ni2+的存在,856.55和874.53 eV表明Ni3+的存在。由图3-e所示的Co 2p的高分辨图可知,除了785.98和803.10 eV处的sat外,Co 2p谱有4个峰在781.38、796.81和783.21、798.04 eV处,分别对应于Co3+和Co2+,Co3+的形成可能是溶解氧在合成过程中Co2+被氧化。O 1s的高分辨图如图3-f所示,有531.60、531.15和530.65 eV 3个典型的衍射峰,531.60 eV是由吸收的水分产生的,531.15 eV是由—OH产生的,530.65 eV是由金属氧键(Ni—O和Co—O)产生的。结果表明,在XPS光谱中,Ni/Co LDHs表面存在着Ni和Co的混合价态。Ni3+和Co3+阳离子通常被认为是催化活性中心,因此Ni/Co LDHs表面大量的Ni2+/Ni3+和Co2+/Co3+的氧化还原电对有利于反应过程中氧的转移[29]。

图1 比色法检测Hg2+
Fig.1 Detection of Hg2+ by colorimetric assay

a-Ni/Co LDHs的SEM图;b-Ni/Co LDHs的SEM放大图; c-Ni/Co LDHs的元素面扫描图
图2 Ni/Co LDHs的SEM图
Fig.2 The SEM images of Ni/Co LDHs
2.2 Ni/Co LDHs类氧化物模拟酶的活性验证
以4种不同的反应体系探究了Ni/Co LDHs的类氧化物活性,结果如图4所示。在加入Ni/Co LDHs之前,TMB为无色透明溶液,加入Ni/Co LDHs之后,TMB溶液逐渐变为蓝色,在652 nm处出现较强的吸收峰,这是因为无色的TMB被氧化为蓝色的oxTMB;在此体系中继续加入GSH,反应体系逐渐变浅,这是因为引入的Ni/Co LDHs能够催化氧化TMB生成TMB阳离子自由基[9];当在TMB/Ni/Co LDHs的传感体系中加入抗自由基生物分子GSH时,溶液颜色由蓝色逐渐变浅至无色,这是因为GSH的硫醇基团阻碍了阳离子自由基的形成,使TMB分子得到恢复。随后在该传感系统中加入Hg2+,Hg2+能够与GSH的硫醇基团结合,从而使得Hg2+与TMB竞争结合GSH,且Hg2+与GSH的亲和力强于TMB与GSH的亲和力,最终使得与GSH的硫醇基团结合的TMB释放,促进了传感系统的催化氧化反应,溶液呈现为蓝色。因此,Ni/Co LDHs纳米球可以作为类氧化物模拟酶检测Hg2+。

a-Ni/Co LDHs的XRD全扫描图;b-Ni/Co LDHs的FTIR全扫描图;c-Ni/Co LDHs的XPS全扫描图;d-Ni 2p;e-Co 2p; f-O 1s的高分辨扫描图
图3 Ni/Co LDHs的XRD、FTIR、XPS图谱
Fig.3 XRD, FTIR, XPS spectra of Ni/Co LDHs

图4 Ni/Co LDHs 模拟酶活性验证
Fig.4 Activity verification of Ni/Co LDHs mimetic enzyme
2.3 检测条件的优化
为了获得最佳的Hg2+ 检测性能,探究了氧化的TMB吸光值变化与体系pH、TMB浓度、孵育温度、孵育时间、LDHs浓度的变化关系。
2.3.1 体系pH
类似于天然酶,例如辣根过氧化物酶,Ni/Co LDHs的催化活性也显示出对pH和温度的依赖性。在其他条件不变的情况下,分别加入不同pH值的缓冲液进行优化,结果如图5-a所示。随着pH值由2.0逐渐增大到4.0,吸光度值逐渐增大,随着pH值由4.0逐渐增大到6.0,吸光度值逐渐减小。在pH<4.0 时,TMB的氧化产物会倾向于生成黄色的二亚胺终止反应,pH>4.0时,酶活性有所减弱。因此,选择pH 4.0用于Hg2+ 检测。
2.3.2 TMB浓度
在其他条件不变的情况下,通过改变TMB浓度,探讨TMB浓度对Ni/Co LDHs活性的影响,结果如图5-b所示。试验结果表明,随着TMB浓度的增大,吸光度值不断增大。吸光度值在0~0.5 mmol/L随着TMB浓度的增大急剧增大;在0.5~2 mmol/L随着TMB浓度的增加,吸光度值逐渐增大;在2~10 mmol/L随着TMB浓度的增加,吸光度值缓慢增大。这是因为随着TMB浓度的升高,使得底物TMB和Ni/Co LDHs模拟酶的活性位点接触机会增多,有效碰撞增加,从而提高了活性。综合考虑传感器检测的灵敏度、试验安全性,选择0.5 mmol/L的TMB用于检测水中Hg2+。
2.3.3 孵育温度
温度是影响模拟酶活性的重要因素之一。在10~55 ℃研究了Ni/Co LDHs的催化活性对温度的依赖性,结果如图5-c所示。当温度在10~25 ℃时,吸光度值逐渐增大,25~50 ℃,吸光度值明显减小,当温度在50~60 ℃时,吸光度值缓慢减小。随着温度的升高,体系中反应物分子运动更加剧烈,使得底物TMB和Ni/Co LDHs模拟酶的活性位点接触机会增多,有效碰撞增加,更容易发生催化反应,所以其活性也逐渐增强。结果表明,在25 ℃时反应体系的吸光度值最大,试验效果最佳。当反应温度低于25 ℃或高于25 ℃时,吸光度值较低,溶液所呈现出来的颜色较浅,不利于后续可视化检测。因此,选择检测温度为25 ℃用于Hg2+ 检测。
2.3.4 Ni/Co LDHs浓度
研究Ni/Co LDHs浓度以评估Ni/Co LDHs的催化活性,结果如图5-d所示,Ni/Co LDHs质量浓度在0~0.8 mg/mL时,随着浓度的增加吸光度值呈平稳上升趋势,质量浓度在0.8~1.0 mg/mL时,吸光度值缓慢平稳下降。由此可知,Ni/Co LDHs的质量浓度为0.8 mg/mL时反应体系检测效果最好。因此,选择Ni/Co LDHs质量浓度为0.8 mg/mL用于Hg2+ 检测。
2.3.5 卵育事件
研究孵育时间以评估Ni/Co LDHs的催化活性,结果如图5-e所示。随着反应时间的不断增加,吸光度值呈上升的趋势。在1~10 min时,吸光度值急剧上升,在10~16 min时,吸光度值随着时间的增加缓慢上升。实验结果表明,在10 min时,反应速率变慢,检测体系反应效果基本达到最优,过长的反应时间不利于其快速即时检测,因此选择10 min为其最优的反应时间,其检测响应效果良好。
综上所述,选择pH 4.0,0.5 mmol/L TMB,孵育温度为25 ℃,Ni/Co LDHs质量浓度为0.8 mg/mL,孵育时间10 min用于后续试验。
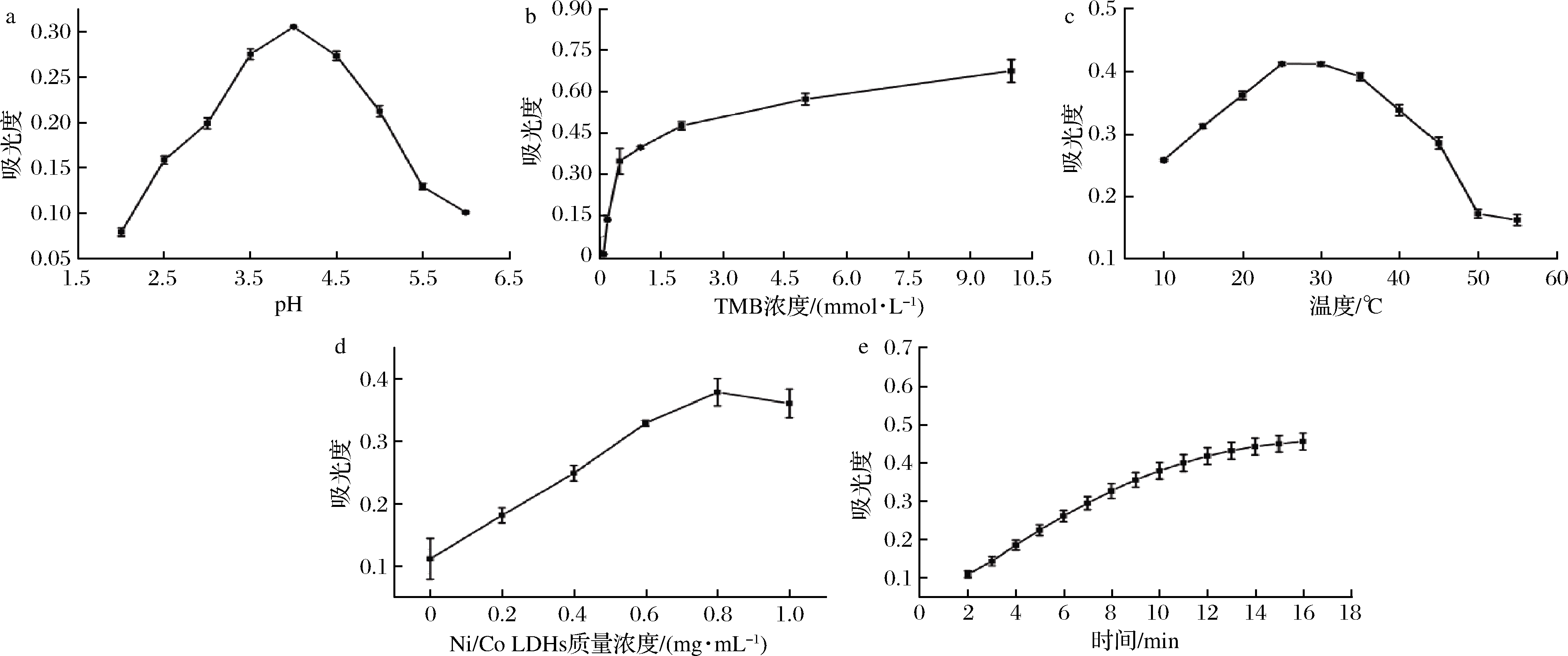
a-pH体系;b-TMB浓度;c-孵育温度;d-Ni/Co LDHs质量浓度;e-孵育时间
图5 检测条件优化
Fig.5 Optimization of detection conditions
2.4 Ni/Co LDHs类氧化物模拟酶的催化动力学
在最优条件下,通过改变TMB的浓度,测定反应溶液在652 nm处的吸光度值,计算得到相应的动力学数据。通过稳态动力学研究,发现Ni/Co LDHs纳米材料作为类氧化物模拟酶,其催化反应与天然酶的反应动力学相似。结果如图6-a所示,反应速率随着底物浓度的增加而加快,最终达到稳定状态,符合典型的米氏曲线。再通过双倒数作图法,得到如图6-b 所示的倒数图。从图6-b可以得到反应的米氏常数Km=0.945 7 mmol/L,最大反应速率vmax=2.63×10-9 mol/(L·s)。Km被认为是酶对底物亲和力的指示物。Km越小,底物与酶的亲和力越强。通过与其他纳米酶比较,Ni/Co LDHs对TMB的Km值稍大于其他纳米酶的Km,表明Ni/Co LDHs对TMB的亲和力低于其他纳米酶。
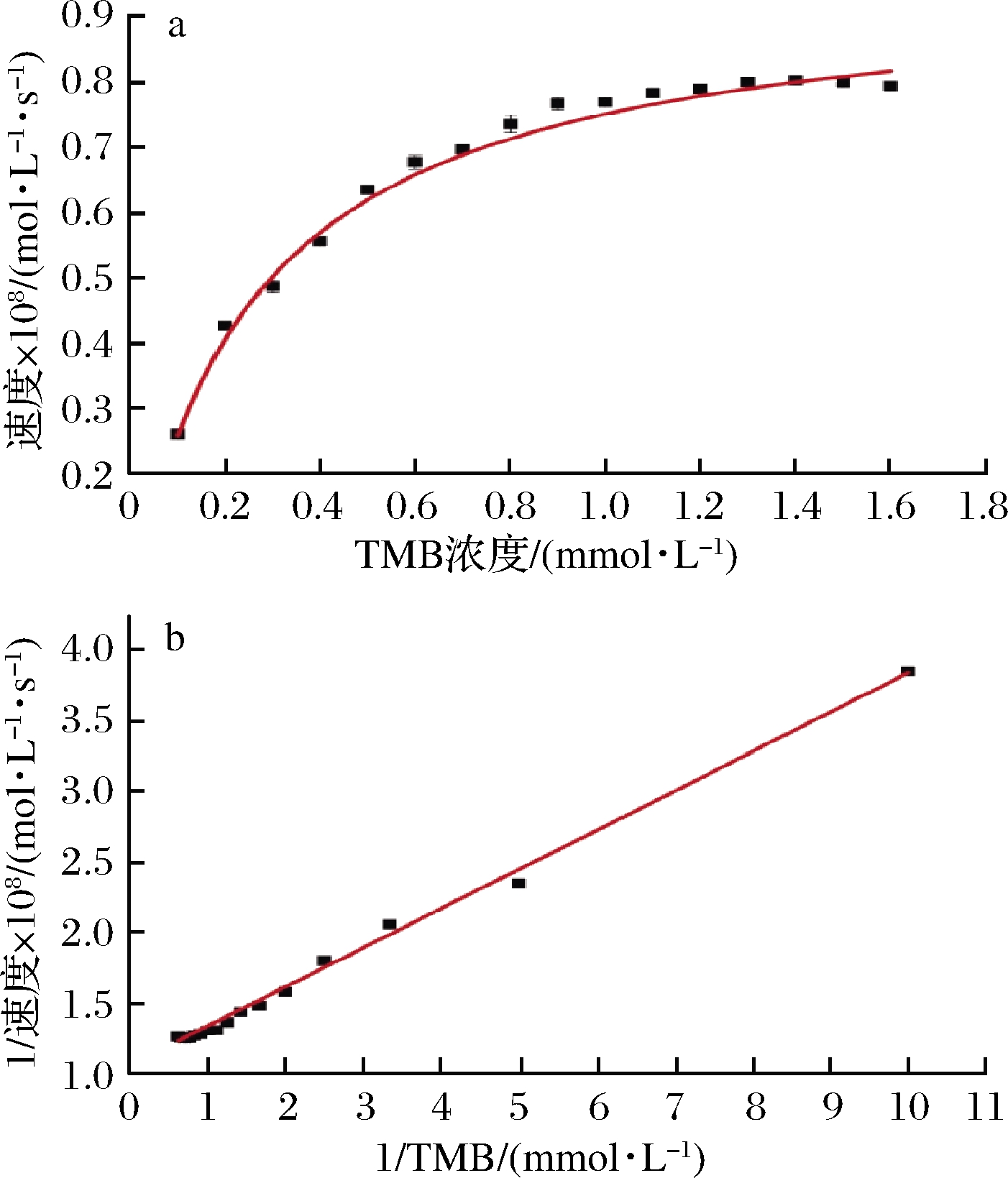
a-TMB 浓度与速率关系曲线;b-Lineweaver-Burk线性拟合
图6 Ni/Co LDHs 稳态动力学
Fig.6 Steady-state kinetic analysis of Ni/Co LDHs
2.5 标准曲线
为了构建一个比色检测水中Hg2+ 的传感器,依次将TMB(0.5 mmol/L)、GSH(1 mmol/L)、Ni/Co LDHs(0.8 mg/mL)和不同浓度的Hg2+加入到缓冲液(pH 4.0)中,并在25 ℃下孵育10 min后扫描紫外光谱,所得的紫外光谱如图7所示,随着Hg2+浓度的增大,在652 nm处的吸光度值逐渐增大,体系溶液对应的颜色变化如图7-a中图例所示。由经验方程拟合后,Hg2+ 在2.96~11.63 μmol/L具有良好的线性关系,标准曲线回归方程为y=0.020 8x-0.011 9,其中x为Hg2+ 浓度,相关系数R2=0.992 2,根据公式(3)计算检测限为30.60 nmol/L。
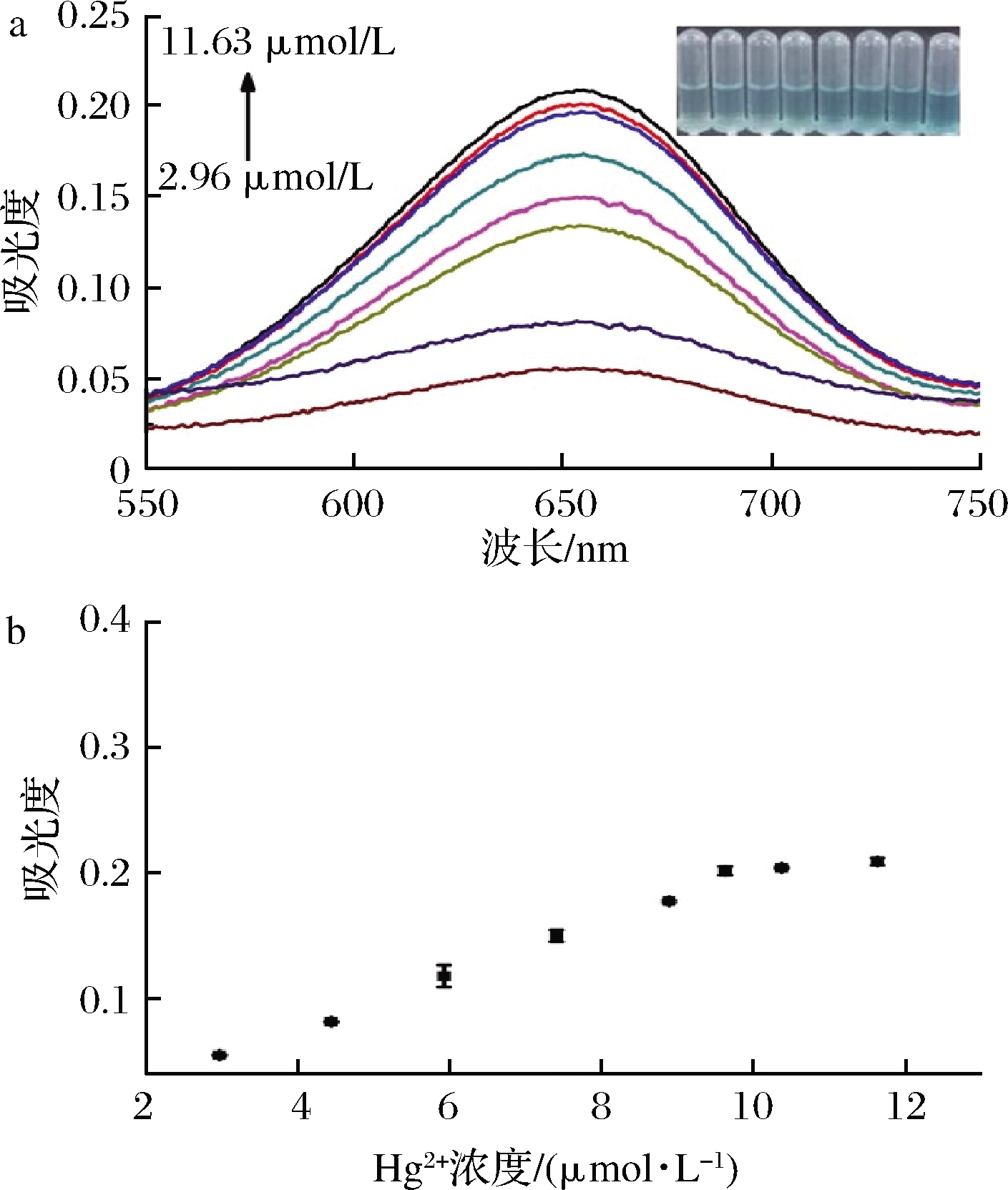
a-在加入不同浓度的Hg2+ 时,Ni/Co LDH+TMB+GSH 传感探针的紫外光谱(图例:颜色随Hg2+ 浓度的变化); b-光度值随Hg2+ 浓度变化图
图7 检测Hg2+ 的标准曲线
Fig.7 The standard curve for Hg2+ detection
2.6 干扰试验
本论文所开发的比色传感器的选择性对于实际水样中Hg2+ 含量的测定至关重要。在最佳条件下,通过对于实际水样中可能存在的其他金属离子,如Na+、Mg2+、Cu2+、Cr3+、Pb2+、Mn2+、Pb2+和Zn2+ 进行干扰性试验来评价该方法的选择性,结果如图8所示,Hg2+ 测定具有较好的选择性,Na+、Mg2+、Cu2+、Cr3+、Pb2+、Mn2+、Pb2+、Zn2+对检测的影响十分微弱(P>0.05)。因此,本比色检测方法对于水中Hg2+ 检测具有较好的选择性。

图8 Ni/Co LDH对4.16 μmol/L Hg2+ 和 相同浓度干扰离子的吸光度值
Fig.8 Absorbance value of Ni/Co LDHs to 4.16 μmol/L Hg2+ and interfering ions with the same concentration
2.7 实际样品检测
为了研究该方法在实际海产品样本中检测Hg2+ 的可行性与可靠性,实验采用空白加标回收评价方法的准确度。海产品样品中未检测到Hg2+,在消解处理后的海产品样品中加入不同浓度的Hg2+ 进行检测分析,试验结果如表1所示,加入已知不同Hg2+ 的空白加标回收率都在92.74%~114.40%,相对标准偏差为0.56%~4.37%。结果表明该方法检测海产品中的Hg2+ 具有较高的可靠性和可行性,有较好的准确度和精密度。
表1 检测海产品样品中不同浓度Hg2+ 的回收率
Table 1 Recoveries of the detection of different concentration Hg2+ in seafood samples
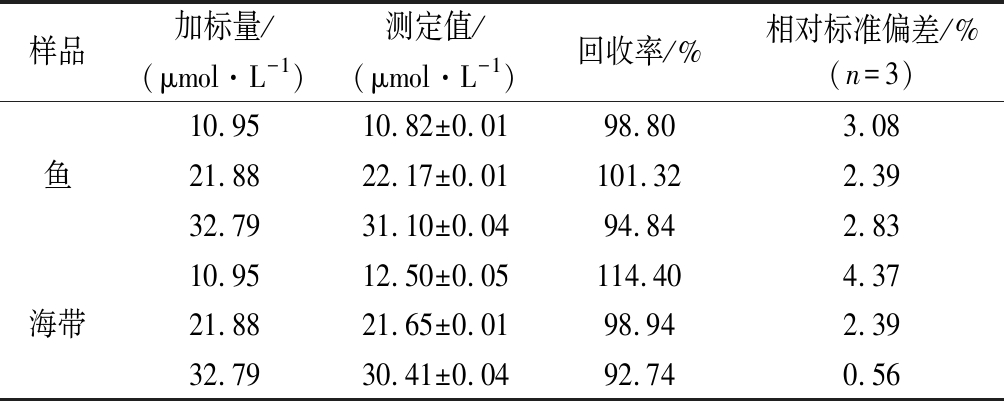
样品加标量/(μmol·L-1)测定值/(μmol·L-1)回收率/%相对标准偏差/%(n=3)10.9510.82±0.0198.803.08鱼21.8822.17±0.01101.322.3932.7931.10±0.0494.842.8310.9512.50±0.05114.404.37海带21.8821.65±0.0198.942.3932.7930.41±0.0492.740.56
3 结论
通过共沉淀法合成的Ni/Co LDHs纳米材料模拟氧化物酶,具有较高的催化活性和较好的稳定性。以检测体系pH、TMB浓度、孵育时间、孵育温度和Ni/Co LDHs浓度为单因素,优化得到检测Hg2+ 的最佳条件为pH 4.0、TMB浓度为0.5 mmol/L、温度为25 ℃、孵育时间为10 min、催化剂质量浓度为0.8 mg/mL;在最优检测条件下该传感器在2.96~11.63 μmol/L具有良好的线性响应,检测限为30.60 nmol/L。该方法的加标回收率为92.74%~114.40%,干扰试验表明可能存在的干扰物质对传感器没有显著影响,因此该传感器用于检测海产品中Hg2+ 具有可接受的选择性,可为海产品中Hg2+的比色检测提供一种新思路。
[1] 侯菊英. 基于碳量子点荧光技术快速测定果汁中的汞离子和有机磷农药残留[D].泰安:山东农业大学, 2015.
HOU J Y.Rapid detection of Hg2+ and organophosphorus pesticides in fruit juices based on carbon dots and fluorescent technique[D].Taian:Shandong Agricultural University, 2015.
[2] 张家一. 农业用水中汞离子检测的电化学发光生物传感器研究[D].镇江:江苏大学, 2019.
ZHANG J Y.Study on electrochemiluminescence biosensor for determination of mercury ion in agricultural water[D].Zhenjiang:Jiangsu University, 2019.
[3] CHRISTUS A A B, RAVIKUMAR A, PANNEERSELVAM P, et al.A novel Hg(II) sensor based on Fe3O4@ZnO nanocomposite as peroxidase mimics[J].Applied Surface Science, 2018, 449:669-676.
[4] MATOS R A M, GOMES T S R M, OLIVEIRA A B P J, et al.Assessment of transition metals toxicity in environmental matrices using potentiometric electrodes:Inorganic mercury(II) in the seawater as a case study[J].Electroanalysis, 2015, 27(8):1 932-1 938.
[5] 赵明岩. 水中汞的测定方法对比研究[J].资源节约与环保, 2013, 32(12):94.
ZHAO M Y.Comparative study on determination methods of mercury in water[J].Resources Economization and Environmental Protection, 2013, 32(12):94.
[6] 李祎萌. 食品汞含量分析预处理与测定技术的研究进展[J].广东化工, 2018, 45(24):33-34.
LI Y M.The research progress of determination method of mercury in food[J].Guangdong Chemical Industry, 2018, 45(24):33-34.
[7] ZHU S, CHEN B, HE M, et al.Speciation of mercury in water and fish samples by HPLC-ICP-MS after magnetic solid phase extraction[J].Talanta, 2017, 171:213-219.
[8] 付瑜. 石墨烯量子点在水溶液中对汞离子、碘离子和有机小分子的检测研究[D].上海:上海师范大学, 2017.
FU Y.Graphene quantum dots for the detection of mercury, iodine, organic molecules in aqueous solution[D].Shanghai:Shanghai Normal University, 2017.
[9] CHRISTUS A A B, PANNEERSELVAM P, RAVIKUMAR A, et al.Colorimetric determination of Hg(II) sensor based on magnetic nanocomposite (Fe3O4@ZIF-67) acting as peroxidase mimics[J].Journal of Photochemistry and Photobiology A:Chemistry, 2018, 364:715-724.
[10] XIONG Y, SU L, YANG H, et al.Fabrication of copper sulfide using a Cu-based metal organic framework for the colorimetric determination and the efficient removal of Hg2+ in aqueous solutions[J].New Journal of Chemistry, 2015, 39(12):9 221-9 227.
[11] KONGASSERI A, SOMPALLI N K, RAO B C V S, et al.Solid-state optical sensing of ultra-trace Hg2+ ions using chromoionophoric probe anchored silica monolithic architectures[J].Sensors and Actuators B:Chemical, 2020:321:128 558.
[12] WU C, GAO G Z, ZHAI K F, et al.A visual Hg2+ detection strategy based on distance as readout by G-quadruplex DNAzyme on microfluidic paper[J].Food Chemistry, 2020:331:127 208.
[13] ZHANG S, WEI S L, CHENG H, et al.A highly sensitive colorimetric sensor for Hg2+ detection based on the oxidative enzyme mimics-like activity of hierarchical porous carbon@chitosan-modified silver nanoparticles[J].Journal of King Saud University-Science, 2020, 32(2):1 265-1 271.
[14] YU R Z, WANG R, HE X, et al.Simulated enzyme inhibition-based strategy for ultrasensitive colorimetric biothiol detection based on nanoperoxidases[J].Chemical Communications, 2019, 55(77):11 543-11 546.
[15] SHARMA V, SAINI A K, MOBIN S M.Multicolor fluorescent carbon nanoparticle probes for live cell imaging and dual palladium and mercury sensors[J].Journal of Materials Chemistry B, 2016, 4(14):2 466-2 476.
[16] XIE Z J, BAO X Y, PENG C F.Highly sensitive and selective colorimetric detection of methylmercury based on DNA functionalized gold nanoparticles[J].Sensors, 2018, 18(8):2 679.
[17] ZHANG Y, JU P, SUN L P, et al.Colorimetric determination of Hg2+ based on the mercury-stimulated oxidase mimetic activity of Ag3PO4 microcubes[J].Microchimica Acta, 2020, 187(7):422.
[18] LI W, CHEN B, ZHANG H X, et al.BSA-stabilized Pt nanozyme for peroxidase mimetics and its application on colorimetric detection of mercury(II) ions[J].Biosensors and Bioelectronics, 2015, 66:251-258.
[19] LIAN Q, LIU H, ZHENG X F, et al.Enhanced peroxidase-like activity of CuO/Pt nanoflowers for colorimetric and ultrasensitive Hg2+ detection in water sample[J].Applied Surface Science, 2019, 483:551-561.
[20] YIN J F, CAO H Q, LU Y X.Self-assembly into magnetic Co3O4 complex nanostructures as peroxidase[J].Journal of Materials Chemistry, 2012, 22(2):527-534.
[21] YANG H G, XIONG Y H, ZHANG P, et al.Colorimetric detection of mercury ions using MnO2 nanorods as enzyme mimics[J].Analytical Methods, 2015, 7(11):4 596-4 601.
[22] 雷立旭, 张卫锋, 胡猛, 等.层状复合金属氢氧化物:结构、性质及其应用[J].无机化学学报, 2005, 21(4):452-460.
LEI L X, ZHANG W F, HU M, et al.Layered double hydroxides:Structures, properties and applications[J].Chinese Journal of Inorganic Chemistry, 2005, 21(4):452-460.
[23] FAN G, WANG H, XIANG X, et al.Co-Al mixed metal oxides/carbon nanotubes nanocomposite prepared via a precursor route and enhanced catalytic property[J].Journal of Solid State Chemistry, 2013, 197:14-22.
[24] BAI Z M, WANG Z Y, ZHANG T G, et al.Characterization and friction performances of Co-Al-layered double-metal hydroxides synthesized in the presence of dodecyl sulfate[J].Applied Clay Science, 2013, 75-76:22-27.
[25] GENTY E, BRUNET J, POUPIN C, et al.Co-Al mixed oxides prepared via LDH route using microwaves or ultrasound:Application for catalytic toluene total oxidation[J].Catalysts, 2015, 5(2):851-867.
[26] 周洁. 分级多孔层状双金属氢氧化物的水热合成及吸附性能[D].武汉:武汉理工大学, 2015.
ZHOU J.Hierarchically porous layered double hydroxides hydrothermal synthesis and adsorption performance[D].Wuhan:Wuhan University of Technology, 2015.
[27] LAN L, NIU Q, LI T.A highly selective colorimetric and ratiometric fluorescent probe for instantaneous sensing of Hg2+in water, soil and seafood and its application on test strips[J].Analytica Chimica Acta, 2018, 1 023:105-114.
[28] DONG T, ZHANG X, LI M, et al.Hierarchical flower-like Ni-Co layered double hydroxide nanostructures:Synthesis and super performance[J].Inorganic Chemistry Frontiers, 2018, 5(12):3 033-3 041.
[29] SU L, YU X, QIN W, et al.One-step analysis of glucose and acetylcholine in water based on the intrinsic peroxidase-like activity of Ni/Co LDHs microspheres[J].Journal of Materials Chemistry B, 2017, 5(1):116-122.