酵母是乙醇工业和酿造食品等领域使用最普遍的微生物之一,特别是Saccharomyces cerevisiae,因其能在培养基上被完全控制生长等优势而被广泛研究[1]。然而,S.cerevisiae是迄今为止所发现的近800种酵母菌之一,这些物种中的其他几种可能同样具有潜在价值。与S.cerevisiae相比,Pichia kudriavzevii具有更好的耐热性,40 ℃以上时仍能表现出良好的生物乙醇发酵潜力[2-3]。Cyberlindnera fabianii的发酵性能更多地体现在啤酒酿造过程中芳香物质的产生[4]。Candida tropicalis已被用于苹果醋的发酵,它可以利用苹果及其副产品(果皮、果渣等)来生产高浓度的酒精(6.56%vol)[5]。这些酵母在发酵过程中会面临诸多环境压力,例如温度的升高会抑制酵母细胞的正常生长,影响发酵效率[6-8];高浓度乙醇会影响细胞质膜的流动性,导致离子平衡的丧失、养分吸收减少和蛋白质变性等[9-10]。
发酵效率和抗逆性之间存在相关性,而抗逆性往往依赖于抗逆代谢物质的积累[11-12]。在压力条件下,S.cerevisiae在代谢水平上迅速反应,合成某些保护性物质,如海藻糖[13-14]。众多研究表明,S.cerevisiae胞内合成的海藻糖在压力环境下具有保护细胞膜和蛋白质的重要功能[15-17]。此外,补加葡萄糖对促进S.cerevisiae的生长繁殖非常重要,而且能在一定程度上促进海藻糖的合成。据SUAREZ-MENDEZ等[18]的报道,进入稳定期的S.cerevisiae在添加葡萄糖短时间内即可观察到海藻糖含量的显著上升。
基于早期的研究[19],本文分析了4种食品酵母(S.cerevisiae、P.kudriavzevii、C.fabianii、C.tropicalis)在2种不同发酵过程中(恒速补料耦合恒温热激与变速补料耦合梯度热激),面临葡萄糖和热激胁迫的生理响应,包括细胞生长、还原糖的消耗、海藻糖和乙醇积累。这项研究的结果可以为发酵工厂中酵母菌的筛选和应用提供理论基础。
1 材料与方法
1.1 菌株、培养基和培养条件
P.kudriavzevii、C.fabianii、S.cerevisiae和C.tropicalis由安琪酵母股份有限公司提供。在这项研究中,将所有酵母在YEPD培养基(2%葡萄糖,1%酵母提取物,2%蛋白胨)中30 ℃预培养24 h,然后接种到优化好的糖蜜培养基中[糖蜜38%,酵母粉0.5%,KH2PO4 1.0%,KCl 0.05%,(NH4)2SO4 0.5%,MgSO4·7H2O 0.06%]培养。初始接种量OD600保持在0.1。培养基中,除糖蜜为体积分数外,其他成分均为质量分数。
1.2 基础发酵条件
酵母发酵在20 L机械搅拌通风发酵罐(上海保兴生物设备工程有限公司)中完成。基本发酵条件如下:发酵培养基为12 L;发酵温度控制在30 ℃,设定速度为450 r/min,通气量为1.3 L/min。使用3 mol/L NaOH和3 mol/L HCl将发酵培养基的pH值保持在5.0。
1.3 分批发酵和调控策略
发酵温度的逐步升高会使酵母处在热激压力下,往往会触发一系列自适应反应。葡萄糖作为酵母生长代谢所需的营养物质,也是海藻糖合成所必需的底物,而且过量的葡萄糖往往导致更加严重的溢流代谢。本研究设计了2种不同的葡萄糖流加速率和热激耦合策略(表1)。策略1,变速进料分为2个阶段,包括8~12 h内的80 mL/h和12~20 h内200 mL/h流加葡萄糖(800 g/L),并在12~20 h梯度升温,初始温度从30 ℃提高到35 ℃,然后温度每2 h升高2 ℃直到43 ℃。策略2为10~14 h内以恒定流速为400 mL/h流加葡萄糖,并在10~16 h内温度控制在35 ℃。
表1 不同的耦合发酵策略
Table 1 Different coupling fermentation strategies
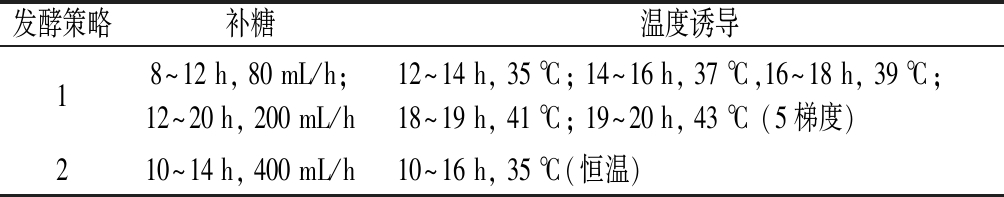
发酵策略补糖温度诱导18~12 h, 80 mL/h;12~20 h, 200 mL/h12~14 h, 35 ℃; 14~16 h, 37 ℃,16~18 h, 39 ℃;18~19 h, 41 ℃; 19~20 h, 43 ℃ (5梯度)210~14 h, 400 mL/h10~16 h, 35 ℃(恒温)
注:80、200 mL/h均为低速补糖,400 mL/h为高速补糖;<39 ℃为低压力,≥39 ℃为严重压力
1.4 还原糖、乙醇、生物量和乙醇海藻糖的测定
先将5 mL发酵液8 000 r/min 10 min离心(2份)。发酵液中还原糖使用3, 5-二硝基水杨酸法(3, 5-dinitrosalicyic acid, DNS)测定[18],乙醇含量使用生物传感器分析仪测定(SBA-90,山东省科学院生物研究所)。一份湿菌体在80 ℃干燥以评估酵母生物量;另一份湿菌体中加入三氯乙酸(4 mL,0.5 mol/L)抽提1 h,离心(3 000 r/min,5 min,4 ℃)后,在稀释的上清液(1 mL)中加入5 mL硫酸蒽酮溶液,沸水浴10 min,测量OD630的吸光度用以计算海藻糖的含量[21]。
2 结果与分析
2.1 酵母在不同发酵过程中的增长量
本研究中使用细胞生物量来评估这4种菌在2种策略条件下的生长趋势(图1)。在这2种发酵调控策略下,4种酵母的起始生物量为(6.58±0.69)g/L。表2列出了4种酵母在2种策略下非调控阶段的生物量生长(策略1为0~8 h,策略2为0~10 h)。2种情况下,C.tropicalis生物量的增长均最为显著,分别为21.95 和24.19 g/L。P.kudriavzevii生长最慢,分别为15.78和18.06 g/L。因此,在这种培养条件下,自然生长状态下的4个酵母的生长速率从快到慢依次为C.tropicalis、S.cerevisiae、C.fabianii、P.kudriavzevii。
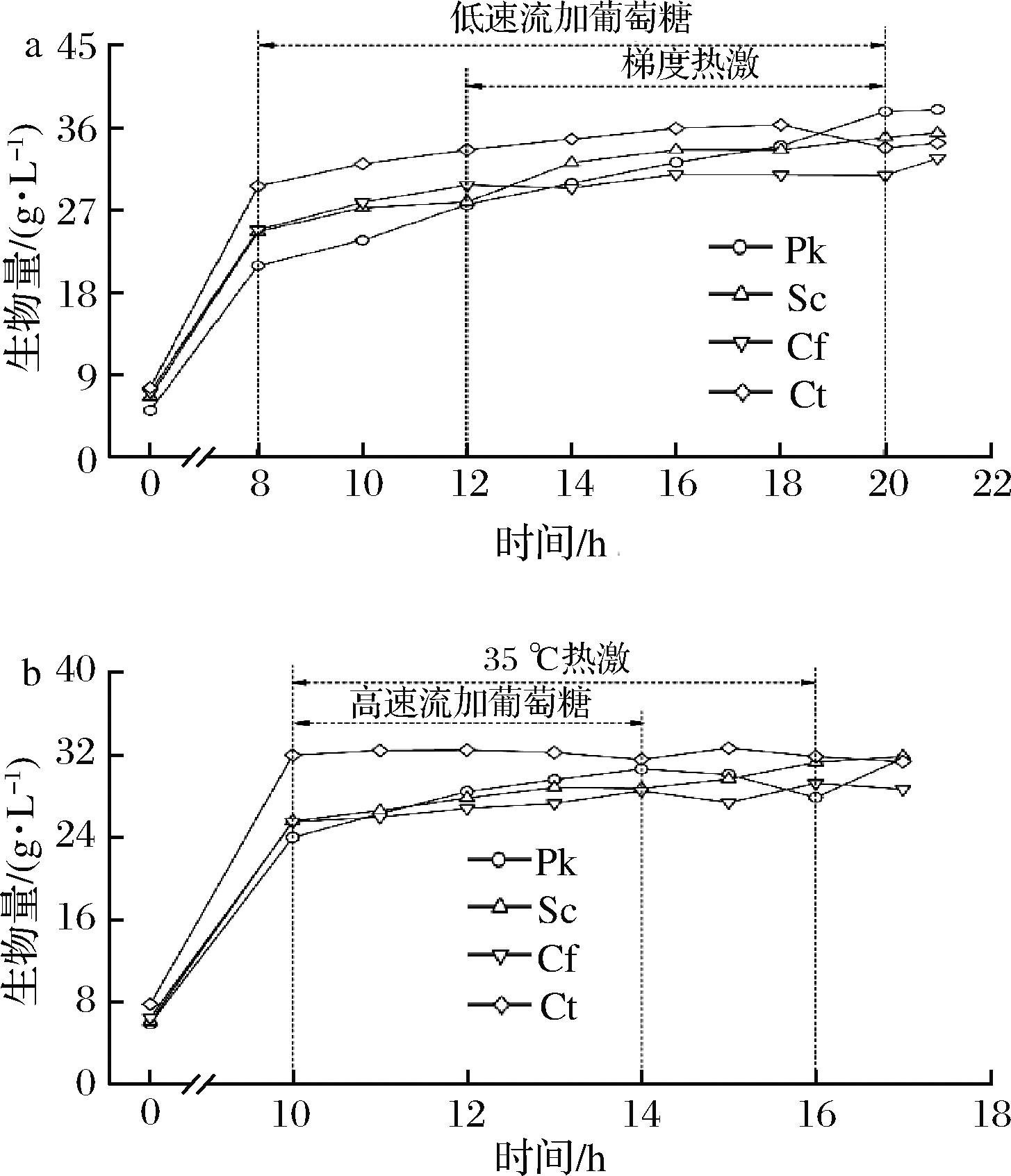
Pk-P. kudriavzevii;Sc-S. cerevisiae;Cf-C. fabianii;Ct-C. tropicalis a-策略1;b-策略2
图1 两种策略下的酵母生物量增长
Fig.1 Yeast biomass growth under two strategies
表2 非调控阶段的酵母细胞生物量增长 单位:g/L
Table 2 The increase of yeast cell biomass during the non-regulation stage
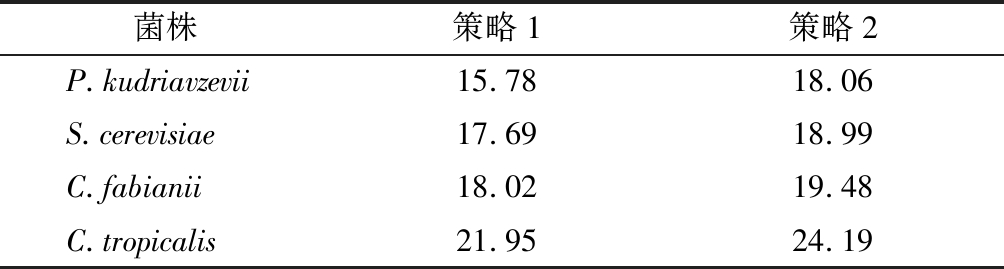
菌株策略1策略2P.kudriavzevii15.7818.06S.cerevisiae17.6918.99C.fabianii18.0219.48C.tropicalis21.9524.19
在耦合调控阶段,策略1条件下(12~20 h),P.kudriavzevii和S.cerevisiae的生物量持续增长,至调控结束达到最大值,分别为37.68和35.34 g/L。C.fabianii在整个阶段稳定在(30.39±0.82)g/L。C.tropicalis的生长趋势表现为低压力(35和37 ℃)增长,严重压力(>39 ℃)受到轻微抑制,在调控后期(16~20 h)分别稳定在(34.73±1.22)g/L(图1-a)。策略2条件下(10~14 h),S.cerevisiae和C.fabianii的生物量增长缓慢,最大值分别为31.27和29.22 g/L。C.tropicalis生物量稳定在(32.05±0.47) g/L。P.kudriavzevii的生物量表现为在耦合调控阶段略微上升,增长了6.66 g/L,而在停止补糖后的单独控温阶段(14~16 h)生物量下降(图1-b)。整体上看,P.kudriavzevii和S.cerevisiae的生长几乎没有受到梯度热激的影响,但前者的抗逆生长似乎更加依赖于葡萄糖的流加,而其他2种酵母的生长在一定程度上均受到升温压力的抑制。
2.2 酵母在不同发酵过程中还原糖平均消耗量速率
这4种酵母在2种发酵策略下非调控阶段的还原糖几乎消耗完全(数据未显示),表明所选取的调控点处于酵母生长的稳定期。
在策略1梯度控温补料阶段(表3),P.kudriavzevii、S.cerevisiae和C.tropicalis的还原糖平均消耗速率从调控开始后几乎维持稳定,分别为(13.34±0.21)、(13.06±0.38)和(13.52±0.38)g/(L·h)。C.fabianii的还原糖平均消耗速率先下降后上升,在39 ℃控温期间降至最小值,为9.16 g/(L·h),整个调控阶段的还原糖平均消耗速率为(11.63±1.12)g/(L·h)。在策略2恒温补料阶段(表4),P.kudriavzevii、S.cerevisiae和C.tropicalis还原糖平均消耗速率几乎维持稳定,分别为(30.03±0.61)、(30.05±0.83)和(29.27±1.30)g/(L·h)。C.fabianii的还原糖平均消耗速率呈现出先降后升趋势,在控温2 h后(11~12 h)降至最低值,为11.23 g/(L·h),并且整个调控阶段的还原糖平均消耗速率都表现出较低水平。
表3 策略1条件下酵母细胞的还原糖平均消耗量速率 单位:g/(L·h)
Table 3 The average reducing sugar consumption rate of yeast cells under strategy 1
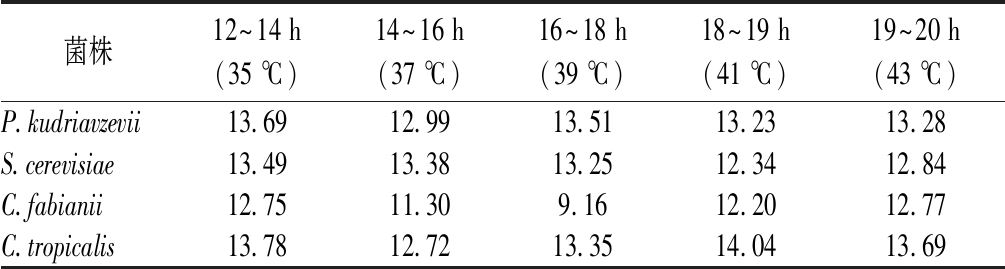
菌株12~14 h(35 ℃)14~16 h(37 ℃)16~18 h(39 ℃)18~19 h(41 ℃)19~20 h(43 ℃)P.kudriavzevii13.6912.9913.5113.2313.28S.cerevisiae13.4913.3813.2512.3412.84C.fabianii12.7511.309.1612.2012.77C.tropicalis13.7812.7213.3514.0413.69
表4 策略2条件下酵母细胞的还原糖平均消耗量速率 单位:g/(L·h)
Table 4 The average reducing sugar consumption rate of yeast cells under strategy 2

菌株10~11 h11~12 h12~13 h13~14 hP.kudriavzevii29.8431.3629.3730.03S.cerevisiae29.2930.0032.2129.71C.fabianii18.2411.2314.6616.61C.tropicalis29.9027.4430.4229.33
注:还原糖平均消耗速率公式为![]()
式中:cR,还原糖浓度,g/L;V0,发酵液体积,L;cS,流加葡萄糖的体积,L;t,时间点
以上表明不同菌株代谢糖的能力是有差异的,P.kudriavzevii、S.cerevisiae和C.tropicalis的还原糖消耗几乎没有受到热激压力和流加葡萄糖的影响,C.fabianii的还原糖消耗在2种策略下处于较低水平,说明其可能受到了热激压力和高浓度葡萄糖的双重抑制。
2.3 酵母在不同发酵过程中的海藻糖积累
海藻糖的合成代谢会受到不利环境的激活,并且其积累水平会根据生长、养分和压力条件而发生显著变化[22]。在非调控阶段(策略1为0~8 h,策略2为0~10 h),未观察到海藻糖合成,此温度和富含葡萄糖的培养基是酵母生长的理想选择,可确保细胞不受压力。
策略1调控阶段(图2-a,8~20 h),4种酵母细胞均观察到海藻糖的积累。其中在8~12 h(单独补糖阶段),P.kudriavzevii、S.cerevisiae和C.fabianii的胞内海藻糖就已经开始积累,分别增长了50.99、37.16和7.58 mg/g DCW。然而,C.tropicalis胞内海藻糖积累在该阶段并没有受到流加葡萄糖的影响。耦合调控后,这4种酵母细胞内海藻糖积累呈现出3种不同的趋势。第一种情形,酵母胞内海藻糖积累在耦合阶段的前期就几近完成,其表现为P.kudriavzevii的海藻糖在该阶段前2 h 从81.75 mg/g DCW上升到134.35 mg/g DCW,S.cerevisiae的海藻糖在该阶段前4 h 从57.77 mg/g DCW上升到115.04 mg/g DCW,2种酵母在整个发酵阶段的最大海藻糖含量分别为139.62和125.46 mg/g DCW,其中P.kudriavzevii的海藻糖含量经过发酵调控后增长了3.7倍。第二种情形,C.fabianii的胞内海藻糖含量在整个发酵阶段都表现出平稳增长,从10.93 mg/g DCW增长到最大含量91.16 mg/g DCW。第三种情形,低压力条件下并没有激发C.tropicalis海藻糖的合成,而在严重压力条件下(39 ℃),其胞内海藻糖的积累迅速增加,分别从26.86和27.06 mg/g DCW上升到最大值78.30和92.58 mg/g DCW。随着调控策略的结束,这4种酵母的胞内海藻糖含量都呈下降趋势。
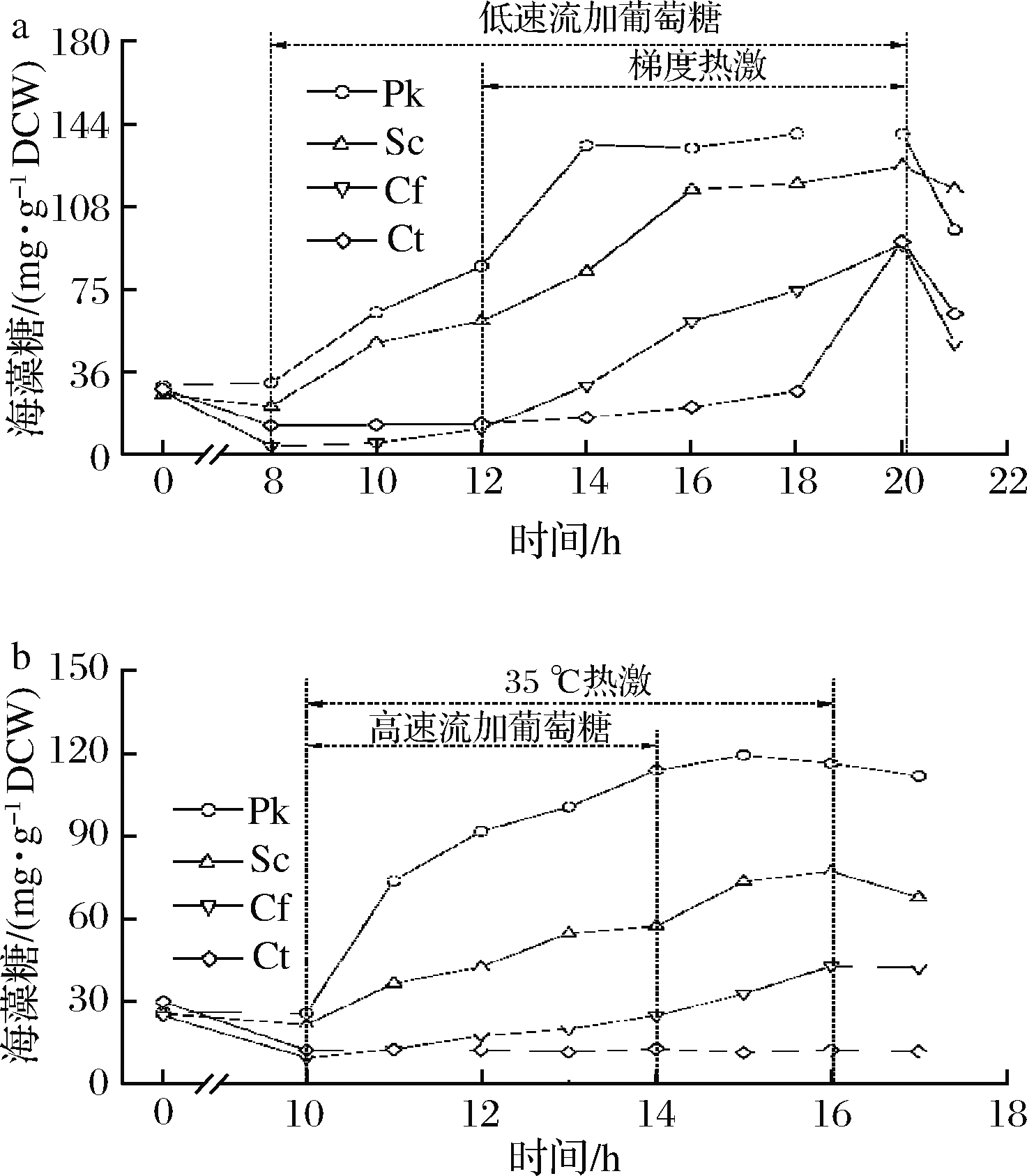
PK-P.kudriavzevii;Sc-S.cerevisaei;Cf-C.fabianii;Ct-C.tropicalis a-策略1;b-策略2
图2 两种策略下的酵母胞内海藻糖含量的变化曲线
Fig.2 The change curve of yeast intracellular trehalose content growth under two strategies
策略2调控阶段(图2-b,10~16 h),P.kudriavzevii、S.cerevisiae和C.fabianii的海藻糖合成同样从调控开始后迅速作出响应,尤其是P.kudriavzevii,在耦合调控阶段从25.66 mg/g DCW上升到113.64 mg/g DCW,而在停止补料后,P.kudriavzevii胞内海藻糖含量没有继续大量积累,其最大含量在15 h达到最大值119.19 mg/g DCW。S.cerevisiae和C.fabianii在调控过程中持续积累,其海藻糖含量最大值分别为77.05和42.76 mg/g DCW。值得注意的是,在压力恢复过程中,酵母细胞中的细胞内海藻糖会迅速降解[23]。在单独控温阶段(14~16 h),P.kudriavzevii、S.cerevisiae和C.fabianii的海藻糖含量并未降低,这表明3种酵母的细胞内海藻糖代谢均对35 ℃热激有响应。然而,C.tropicalis的海藻糖积累并没有受到耦合调控的影响。
2.4 酵母在不同发酵过程中的乙醇含量变化
这些酵母在2种策略条件下的起始乙醇含量为(0.88±0.28)g/L。策略1条件下(图3-a),经过发酵调控后,P.kudriavzevii、S.cerevisiae、C.fabianii和C.tropicalis的乙醇含量分别稳定在21.00、19.75和15.56、21.38 g/L左右。在策略2中(图3-b),P.kudriavzevii、S.cerevisiae和C.tropicalis的乙醇含量持续积累,最大乙醇含量分别为48(14 h)、38(15 h)、45.5 g/L(14 h),而停止补料后,这3种酵母的乙醇含量并没有呈现出持续增长趋势。C.fabianii的乙醇含量在耦合发酵调控前期(10~12 h)略微增长,后期稳定在13.00 g/L左右,整体上表现出较低的乙醇发酵水平。总体而言,高速流加的葡萄糖有利于P.kudriavzevii、S.cerevisiae和C.tropicalis积累乙醇,而C.fabianii的乙醇含量增长缓慢很可能源自于其还原糖消耗受到了抑制。根据此前的报道,在优化好的培养体系下,利用P.kudriavzevii进行高温乙醇发酵(40 ℃)时,乙醇含量能达到(88.60±0.75)g/L,明显高于酿酒酵母[24]。可见,P.kudriavzevii有着更强的高温乙醇发酵潜力。
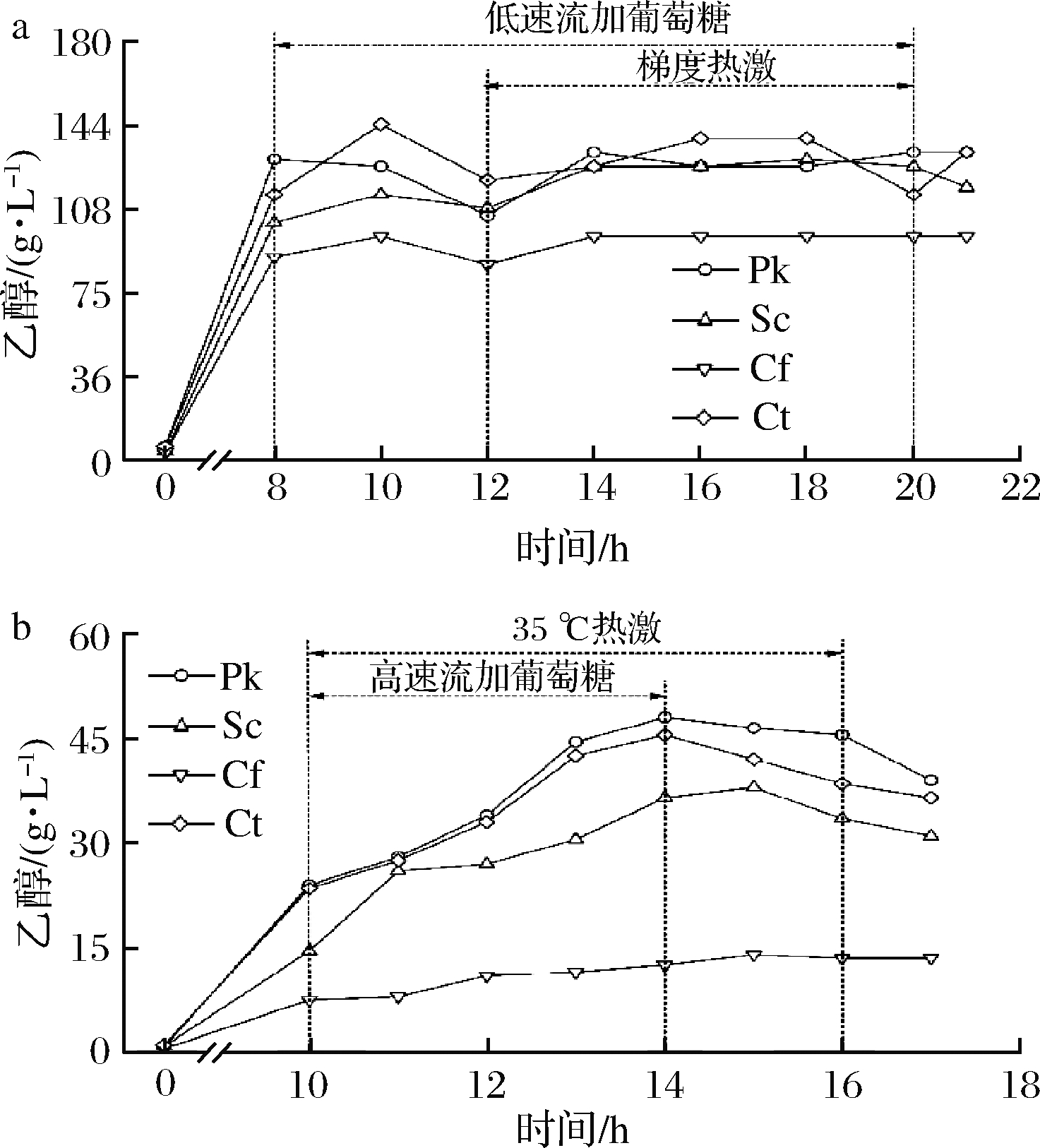
PK-P.kudriavzevii;Sc-S.cerevisaei;Cf-C.fabianii;Ct-C.tropicalis a-策略1;b-策略2
图3 酵母在不同发酵过程中的乙醇含量变化
Fig.3 The changes of ethanol content of yeast during different fermentation
3 讨论
本研究比较了P.kudriavzevii、S.cerevisiae、C.fabianii和C.tropicalis对葡萄糖的流加强度和热激压力的生理响应,结果表明这些酵母在2种调控策略下的细胞内海藻糖的积累差异最明显,下面将主要围绕海藻糖进行讨论。
目前研究酵母细胞内海藻糖的积累往往使用短时压力来处理酵母细胞,它只能反映细胞的瞬时反应特征,例如在乙醇作为碳源的培养基中,野生型S.cerevisiae(W303-1A)的胞内海藻糖水平在90 min内增加至基础水平(未添加胁迫条件)的2倍[25]。MAGALH ES等[26]将S.cerevisiae(BY4741)的培养温度从 28 ℃升至40 ℃后,观察到其胞内海藻糖水平在1 h内增长显著。然而,关于长时间压力胁迫下的酵母细胞生理特性的研究相对较少。
ES等[26]将S.cerevisiae(BY4741)的培养温度从 28 ℃升至40 ℃后,观察到其胞内海藻糖水平在1 h内增长显著。然而,关于长时间压力胁迫下的酵母细胞生理特性的研究相对较少。
如图2所示,P.kudriavzevii、S.cerevisiae和C.fabianii的胞内海藻糖在流加葡萄糖后积累,尤其是P.kudriavzevii,增长了3.4倍,而热带假丝酵母几乎无变化。葡萄糖不仅可以作为分子信号促进糖酵解途径,还可能会使酵母细胞进入不平衡状态,激活其应激代谢途径[27]。这种对于葡萄糖流加的不同响应很可能源于酵母细胞内的6-磷酸海藻糖合酶(trehalose-6-phosphate synthase gene,TPS1)和糖原合成酶对二磷酸尿苷葡萄糖(海藻糖和糖原合成的共前体物)的利用率存在着差异[28]。在梯度升温条件下,所有酵母的乙醇含量都维持稳定(图3),而海藻糖含量均呈现出上升趋势(图2-a)。研究表明,S.cerevisiae的TPS1具有强烈的温度依赖性[29-30]。当压力环境触发酵母细胞的应激代谢反应后,更多的碳被导向糖异生并进入糖酵解途径的上部,流向海藻糖合成途径[31]。值得注意的是,P.kudriavzevii、S.cerevisiae和C.fabianii在低压力(35、37 ℃)即可诱导胞内海藻糖的合成,而C.tropicalis直到严重压力(>39 ℃)才开始海藻糖的积累。这暗示着C.tropicalis海藻糖合成的激活温度较P.kudriavzevii、S.cerevisiae和C.fabianii更高。
[1] GIAEVER G, CHU A M, NI L, et al.Functional profiling of the Saccharomyces cerevisiae genome[J].Nature, 2002, 418(6 896):387-391.
[2] CHAMNIPA N, THANONKEO S, KLANRIT P, et al.The potential of the newly isolated thermotolerant yeast Pichia kudriavzevii RZ8-1 for high-temperature ethanol production[J].Brazilian Journal of Microbiology, 2018, 49(2):378-391.
[3] 杜晶, 余培斌, 苏琪, 等.杨梅果酒酿造酵母的筛选、鉴定及耐受性研究[J].食品与发酵工业, 2015, 41(9):34-39.
DU J, YU P B, SU Q, et al.Study on screening and identification of brewing yeasts for Chinese bayberry wine and its tolerance capacity[J].Food and Fermentation Industries, 2015, 41(9):34-39.
[4] RIJSWIJCK I M H V, MASTRIGT O V, PIJFFERS G, et al.Dynamic modelling of brewers′ yeast and Cyberlindnera fabianii co-culture behaviour for steering fermentation performance[J].Food Microbiology, 2019, 83:113-121.
[5] LIU Q, LI X J, SUN C C, et al.Effects of mixed cultures of Candida tropicalis and aromatizing yeast in alcoholic fermentation on the quality of apple vinegar[J].3 Biotech, 2019, 9(4):128.
[6] PONGSANAT P, JARIVA C, WITTAYA T. High temperature alcoholic fermentation by new thermotolerant yeast strains Pichia kudriavzevii isolated from sugarcane field soil[J].Agriculture and Natural Resources, 2018, 52(6):511-518.
[7] BORBALA O H, DIANA N S, NIKOLETT K, et al.Effects of high sugar content on fermentation dynamics and some metabolites of wine-related yeast species Saccharomyces cerevisiae, S.uvarum and Starmerella bacillaris[J].Food Technology and Biotechnology, 2020, 58(1):76-83.
[8] QIU X L, ZHANG J, ZHOU J W, et al.Stress tolerance phenotype of industrial yeast:Industrial cases, cellular changes, and improvement strategies[J].Applied Microbiology and Biotechnology, 2019, 103(16):6 449-6 462.
[9] BAUER F F, PRETORIUS I S.Yeast stress response and fermentation efficiency:How to survive the making of wine-A review[J].South African Journal for Enology and Viticulture, 2000, 21:27-51.
[10] PAPINI M, NOOKAEW I, UHLEN M, et al.Scheffersomyces stipitis:A comparative systems biology study with the Crabtree positive yeast Saccharomyces cerevisiae[J].Microbial Cell Factories, 2012, 11(1):136.
[11] 张明芳, 王金晶, 钮成拓, 等.高温敏感型酵母的选育及其自溶物研究[J].食品与发酵工业, 2020, 46(1):50-55.
ZHANG M F, WANG J J, NIU C T, et al.Screening of thermosensitive autolytic mutant yeasts and analysis of yeast autolysates[J].Food and Fermentation Industries, 2020, 46(1):50-55.
[12] SAINI P, BENIWAL A, VIJ S.Response and tolerance of yeast to changing environmental stress during ethanol fermentation[J].Process Biochemistry, 2018, 72:1-12.
[13] PAUL M J, PRIMAVESI L F, JHURREEA D, et al.Trehalose metabolism and signaling[J].Annual Review of Plant Biology, 2008, 59:417-441.
[14] ELEUTHERIO E C A, TREVISOL E T V, MESQUITA J F D, et al.Revisiting yeast trehalose metabolism[J].Current Genetics, 2015, 61(3):263-274.
[15] MANCINI R J, LEE J, MAYNARD H D.Trehalose glycopolymers for stabilization of protein conjugates to environmental stressors[J].Journal of the American Chemical Society, 2012, 134(20):8 474-8 479.
[16] GONG P, LIN K, ZHANG J, et al.Enhancing spray drying tolerance of Lactobacillus bulgaricus by intracellular trehalose delivery via electroporation[J].Food Research International, 2019, 127:108 725.
[17] CHENG H J, SUN Y H, CHANG H W, et al.Compatible solutes adaptive alterations in Arthrobacter simplex during exposure to ethanol, and the effect of trehalose on the stress resistance and biotransformation performance[J].Bioprocess and Biosystems Engineering, 2020, 43(4):895-908.
[18] SUAREZ-MENDEZ C A, RAS C, WAHL S A.Metabolic adjustment upon repetitive substrate perturbations using dynamic 13C-tracing in yeast[J].Microbial Cell Factories, 2017, 16(1).DOI:10.1186/S12934-017-0778-6.
[19] 刘翠翠. 鲁氏酵母胞内高海藻糖发酵调控及代谢特征研究[D].武汉:湖北工业大学,2018.
LIU C C.The regulation and metabolism characteristics of intracellular high trehalose fermentation in Zygosaccharomyces rouxii[D].Wuhan:Hubei University of Technology, 2018.
[20] LINDSAY H.A colorimetric estimation of reducing sugars in potatoes with 3, 5-dinitrosalicylic acid[J].Potato Research, 1973, 16(3):176-179.
[21] CHEN X, YAN M, XIE F L, et al.Biotin enhances salt tolerance of Torulopsis mogii[J].Annals of Microbiology, 2015, 65(1):393-398.
[22] SAKAGUCHI M.Diverse and common features of trehalases and their contributions to microbial trehalose metabolism[J].Applied Microbiology and Biotechnology, 2020, 104(5):1 837-1 847.
[23] MAGALHAES R S S, POPOVA B, BRAUS G H, et al.The trehalose protective mechanism during thermal stress in Saccharomyces cerevisiae:The roles of Ath1 and Agt1[J].FEMS Yeast Research, 2018(6):6.
[24] PONGCHAROEN P, CHAWNEUA J, TAWONG W.High temperature alcoholic fermentation by new thermotolerant yeast strains Pichia kudriavzevii isolated from sugarcane field soil[J].Agriculture and Natural Resources, 2018, 52(6):511-518.
[25] BABAZADEH R, LAHTVEE P J, ADIELS C B, et al.The yeast osmostress response is carbon source dependent[J].Scientific Reports, 2017, 7(990).DOI:10.1038/S41598-017-01141-4.
[26] MAGALH ES R S S, LIMA K C D, ALMEIDA D S G D, et al.Trehalose-6-phosphate as a potential lead candidate for the development of Tps1 inhibitors:Insights from the trehalose biosynthesis pathway in diverse yeast species[J].Applied Biochemistry and Biotechnology,2016, 181(3):1-11.
ES R S S, LIMA K C D, ALMEIDA D S G D, et al.Trehalose-6-phosphate as a potential lead candidate for the development of Tps1 inhibitors:Insights from the trehalose biosynthesis pathway in diverse yeast species[J].Applied Biochemistry and Biotechnology,2016, 181(3):1-11.
[27] TARINEJAD A.Glucose signalling in Saccharomyces cerevisiae[J].Agricultural Communications, 2015, 3(2):7-15.
[28] FRANCOIS J, LUC P J.Reserve carbohydrates metabolism in the yeast Saccharomyces cerevisiae[J].FEMS Microbiology Reviews, 2001, 25(1):125-145.
[29] GAO L M, LIU Y Q, SUN H, et al.Advances in mechanisms and modifications for rendering yeast thermotolerance[J].Journal of Bioence & Bioengineering, 2016, 121(6):599-606.
[30] AN M Z, TANG Y Q, MITSUMASU K, et al.Enhanced thermotolerance for ethanol fermentation of Saccharomyces cerevisiae strain by overexpression of the gene coding for trehalose-6-phosphate synthase[J].Biotechnology Letters, 2011, 33:1 367-1 374.
[31] CHEN Z, ZHENG Z, YI C F, et al.Intracellular metabolic changes in Saccharomyces cerevisiae and promotion of ethanol tolerance during the bioethanol fermentation process[J].RSC Advances, 2016,6(107).DOI:10.1038/C6RA19254H.