萝卜硫素(sulforaphane, SFN)又称“莱菔硫烷”,广泛存在于十字花科植物类[1],是目前防癌抗癌效果最好的植物天然产物之一,是自然界存在的诱导II型解毒酶能力最强的诱导物,可以抑制并杀死癌细胞[2],可显著降低肝癌、胃癌、肺癌、乳腺癌、宫颈癌等癌症的发生[3-7]。SFN具有抗菌、提高机体抗氧化能力和免疫力等药理作用,在预防和治疗糖尿病、心脑血管疾病等方面也具有重要的药用价值[8-9]。国内尚没有建立十字花科蔬菜中萝卜硫素检测的标准方法,文献中的提取方法仍存在一些争议,如SIVAKUMAR等[10]认为在0.1 mol/L盐酸条件下提取效果较好,随后RENATO等[11]致信编辑部,质疑pH 1.0 是否可以提高葡萄糖苷释放莱萝卜硫素的效率。NATHAN等[12]认为水解8 h可以充分获得萝卜硫素,这样提取耗时较长,ZHANG等[13]认为超声处理可提高提取效率,减少水解时间,因此,如何准确定量十字花科蔬菜中萝卜硫素的含量还有待研究。萝卜硫素的检测方法有荧光诱导毛细管电泳法、生物传感法、化学测定法和色谱方法,色谱方法包括气相色谱法、高效液相色谱法和质谱联用法[14-18]。化学法步骤繁琐,费时费力,分析结果灵敏度较低,由于萝卜硫素性质不稳定,气相色谱法高温会破坏萝卜硫素的结构,本研究在前人研究的基础上,设计单因素实验,对十字花科蔬菜中萝卜硫素的提取试剂、提取方式、水解条件进行优化处理,以萝卜硫素含量的高低作为评价指标,筛选最佳前处理条件。以西兰花、圆红萝卜为研究对象,进行方法学验证,考察方法的科学性、准确性和适用性,以期建立十字花科蔬菜中萝卜硫素的准确分析检测方法。
1 材料与方法
1.1 材料与仪器
西兰花、圆红萝卜、芥兰、花椰菜、圆白菜、紫甘蓝、大白菜、小白菜、菜心、胡萝卜、荠菜,超市购买;萝卜硫素(纯度95%,Cas:4478-93-7),大连美仑生物技术有限公司;甲醇、二氯甲烷、乙酸乙酯、乙腈(均为色谱纯),美国Fisher公司;丙酮、磷酸氢二钠、磷酸二氢钠(分析纯),国药集团化学试剂有限公司;浓盐酸(分析纯),北京化工厂。
BS224S分析天平,德国赛多利斯科学仪器(北京)有限公司;METTLER TOLEDO pH计,梅特勒-托利多国际贸易(上海)有限公司;IKA VORTEX 3涡旋振荡器,海门市其林贝尔仪器制造有限公司;ZHWY-110X30往复式恒温水浴摇床,上海智诚分析仪器制造有限公司;KQ-500DE型数控超声波清洗器,昆山市超市仪器有限公司;HITACHI CF16RXII 高速冷冻离心机,日本日立科技有限公司;安捷伦1260高效液相色谱仪(配二极管阵列检测器和ChemStation for LC systems色谱工作站),美国Agilent公司;C18色谱柱[5 μm,150 mm×4.6 mm(内径)],美国安捷伦公司。
1.2 实验方法
1.2.1 标准溶液的配制
准确称取萝卜硫素标准品20 mg,置于10 mL容量瓶中,加乙腈溶解并定容至刻度,摇匀,得到浓度为2.00 mg/mL标准储备液,现用现配。
1.2.2 提取条件的选择
1.2.2.1 提取溶剂的选择
称取2.0 g(精确至0.000 1 g)西兰花样品,置于50 mL离心管中,参考赵登奇等[19]的方法,分别加入10.0 mL pH=6.0的磷酸盐缓冲溶液,混合均匀后于45 ℃水浴2.5 h,冷却至室温后,分别加入20 mL二氯甲烷、乙酸乙酯、甲醇、丙酮、乙腈超声提取(功率为100 W,25 ℃)10 min,4 ℃条件下5 000 r/min离心5 min,有机层经无水硫酸钠滤入150 mL旋转蒸发瓶中,重复提取2次,45 ℃条件下旋转至干,5 mL乙腈定容,过0.45 μm滤膜后供液相色谱测定。
1.2.2.2 提取方式的选择
称取2.0 g(精确至0.000 1 g)西兰花样品,置于50 mL离心管中,分别加入10.0 mL pH=6.0的磷酸盐缓冲溶液,混合均匀后于45 ℃水浴2.5 h,冷却至室温后,分别加入 20 mL乙酸乙酯超声提取(功率为100 W,25 ℃)、振荡提取(180 r/min)和涡旋提取10 min,其他操作步骤同1.2.2.1。
1.2.2.3 提取时间的选择
称取2.0 g(精确至0.000 1 g)西兰花样品,置于50 mL 离心管中,分别加入10.0 mL pH=6.0的磷酸盐缓冲溶液,混合均匀后于45 ℃水浴2.5 h,冷却至室温后,分别加入 20 mL乙酸乙酯涡旋提取30 s、1、3、5、10 min,其他操作步骤同1.2.2.1。
1.2.3 水解条件的选择
1.2.3.1 水解溶液的选择
称取2.0 g(精确至0.000 1 g)西兰花样品,置于50 mL离心管中,分别加入10.0 mL pH=1.0盐酸水溶液、pH=2.0盐酸水溶液、pH=3.0盐酸水溶液、pH=4.0盐酸水溶液、pH=5.0盐酸水溶液、pH=5.0磷酸缓冲液、pH=6.0磷酸缓冲液和去离子水,混合均匀后于45 ℃水浴2.5 h,冷却至室温后,分别加入20 mL乙酸乙酯涡旋提取1 min,其他操作步骤同1.2.2.1。
1.2.3.2 水解时间的选择
称取2.0 g(精确至 0.000 1 g)西兰花样品,置于50 mL离心管中,分别加入10.0 mL pH=3.0盐酸水溶液,混合均匀后于45 ℃水浴0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0 h,冷却至室温后,分别加入20 mL乙酸乙酯涡旋提取1 min,其余步骤同1.2.2.1。
1.2.3.3 水解温度的选择
称取2.0 g(精确至0.000 1 g)西兰花样品,置于50 mL离心管中,分别加入10.0 mL pH=3.0盐酸水溶液,混合均匀后于25、35、45、55 ℃水浴0.5 h,冷却至室温后,分别加入20 mL乙酸乙酯涡旋提取1 min,其余步骤同1.2.2.1。
1.2.4 色谱测定条件
色谱柱:C18色谱柱[5 μm,150 mm×4.6 mm(内径)];柱温:30 ℃;流动相:乙腈-水(20∶80,体积比);流速:1 mL/min;检测波长201 nm;进样量:10 μL。
1.2.5 方法验证
按照GB/T 27404—2008《实验室质量控制规范 食品理化检测》[20]方法学要求,建立校准曲线及校准曲线的工作范围;逐步稀释样品上机测定,R(S/N)=3时的测定浓度作为检出限,R(S/N)=10时的测定浓度作为定量限;分别称取西兰花和圆红萝卜,按照实验优化的方法,平行测定6次,计算萝卜硫素的含量,并计算相对标准偏差,考察方法的重现性;向样品本底添加低、中、高3个浓度水平的标准溶液,进行3水平3平行加标回收实验,以回收率的高低评价方法的准确度。
1.2.6 检测方法的应用
选择具有代表性样品,包括芥兰、花椰菜、圆白菜、紫甘蓝、大白菜、小白菜、菜心、胡萝卜、荠菜等,按照实验建立方法,对萝卜硫素定量测定,所有样品平行测定3次,结果以均值±标准差表示。
1.2.7 萝卜硫素含量的计算
1.2.7.1 标准曲线的制作
取萝卜硫素标准储备液,配制成2.00、4.00、8.00、20.00、40.00、100.00 μg/mL的系列标准工作液,摇匀,现用现配。将标准系列工作液分别注入高效液相色谱仪中,测定相应的峰面积,以峰面积为纵坐标,以标准系列工作液浓度为横坐标绘制标准曲线,计算线性回归方程和相关系数。
1.2.7.2 结果计算
试样中萝卜硫素的含量按公式(1)计算:
(1)
式中:X,试样中萝卜硫素的含量,mg/100g;C,根据标准曲线计算得到的试样中萝卜硫素的质量浓度,μg/mL;m,试样的称样量,g;V,定容液的体积,mL。
1.3 数据处理
通过与仪器配套的 ChemStation for LC systems工作站软件完成数据的采集与处理。
2 结果与分析
2.1 提取条件的选择
2.1.1 提取溶剂的选择
本试验根据前人研究成果选取5种不同提取溶剂,比较不同提取溶剂对西兰花中萝卜硫素的提取效果,结果见表1。结果显示,乙酸乙酯对西兰花中萝卜硫素的提取效果最佳,实验选择乙酸乙酯作为萝卜硫素的提取试剂。
表1 不同提取溶剂的提取结果(n=3)
Table 1 Results of different extraction solvents(n=3)

提取溶剂二氯甲烷乙酸乙酯甲醇丙酮乙腈萝卜硫素含量/[mg·(100g)-1]2.46±0.092.94±0.241.99±0.161.98±0.151.99±0.16
2.1.2 提取方式的选择
超声提取、振荡提取和涡旋提取对西兰花中萝卜硫素的提取效果见表2。结果显示,涡旋提取对西兰花中萝卜硫素的提取效果最佳,这可能是因为涡旋的高速旋转可以更好地促进样品和提取溶剂的混合,使萝卜硫素的提取效率更高,故实验选择涡旋提取方式。
表2 不同提取方式的提取结果(n=3)
Table 2 Results of different extraction methods(n=3)

提取方式超声提取振荡提取涡旋提取萝卜硫素含量/[mg·(100g)-1]2.94±0.243.22±0.073.76±0.33
2.1.3 提取时间的选择
乙酸乙酯涡旋提取30 s、1、3、5、10 min的结果见表3。结果表明,提取30 s萝卜硫素含量较低,提取1、3、5、10 min结果没有显著性差异(P<0.05),可见,提取1 min即可以提取完全,实验选择涡旋提取1 min,重复提取2次的提取方式。
表3 不同提取时间的提取结果(n=3)
Table 3 Results of different extraction time(n=3)

提取时间30 s1 min3 min5 min10 min萝卜硫素含量/[mg·(100g)-1]3.16±0.063.61±0.363.35±0.323.31±0.333.76±0.33
2.2 水解条件的选择
2.2.1 水解溶液的选择
不同水解溶液对西兰花中萝卜硫素的提取效果见表4。由表4可知,pH=3.0盐酸水溶液对西兰花中萝卜硫素的提取效果最佳,这与BERTELLI等[21]和张品南等[22]研究相吻合。
表4 不同水解溶液的水解结果(n=3)
Table 4 Results of different hydrolytic solutions(n=3)

水解溶液pH=1.0盐酸水溶液pH=2.0盐酸水溶液pH=3.0盐酸水溶液pH=4.0盐酸水溶液pH=5.0盐酸水溶液pH=5.0磷酸缓冲液pH=6.0磷酸缓冲液去离子水萝卜硫素含量/[mg·(100g)-1]3.77±0.203.81±0.093.91±0.333.59±0.223.24±0.113.37±0.293.76±0.333.41±0.27
2.2.2 水解时间的选择
由表5可知,pH=3.0盐酸水溶液45 ℃水解0.5~4.0 h,所得萝卜硫素含量没有显著性差异,水解6.0 h,萝卜硫素含量明显降低,可见,水解0.5 h即可以水解完全,水解时间过长会导致萝卜硫素的降解。
表5 不同水解时间的水解结果(n=3)
Table 5 Results of different hydrolytic time(n=3)
水解时间0.5 h1.0 h1.5 h2.0 h2.5 h3.0 h4.0 h6.0 h萝卜硫素含量/[mg·(100g)-1]4.02±0.363.97±0.224.06±0.334.01±0.083.91±0.333.85±0.253.81±0.282.94±0.28
2.2.3 水解温度的选择
由表6可知,25、35和45 ℃水解0.5 h,西兰花中萝卜硫素的含量没有显著性差异,55 ℃水解0.5 h萝卜硫素含量明显降低,可见,温度过高会导致萝卜硫素的降解,西兰花中萝卜硫素25 ℃水解0.5 h 即可以水解完全。
表6 不同水解温度的水解结果(n=3)
Table 6 Results of different temperatures(n=3)
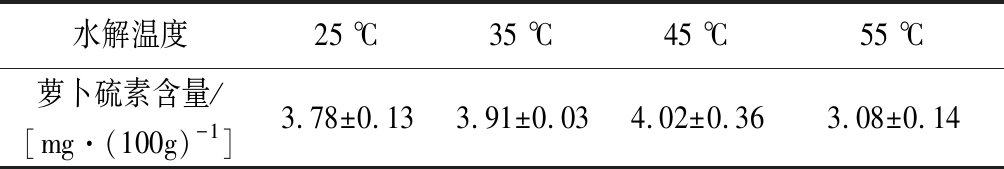
水解温度25 ℃35 ℃45 ℃55 ℃萝卜硫素含量/[mg·(100g)-1]3.78±0.133.91±0.034.02±0.363.08±0.14
2.3 方法学验证
2.3.1 线性关系、检出限及定量限
将萝卜硫素的标准工作溶液,按照实验色谱条件依次进样,根据浓度与峰面积的关系绘制标准曲线,结果表明,在2.00~100.00 μg/mL范围内,萝卜硫素的浓度与峰面积有良好线性关系,萝卜硫素的线性回归方程为y=21.168x,回归系数大于0.999,说明回归方程拟合性好,检出限为0.80 μg/g,定量限为2.50 μg/g。萝卜硫素标准溶液和西兰花样品的高效液相色谱图见图1和图2。

图1 萝卜硫素标准溶液色谱图
Fig.1 HPLC chromatograms of sulforaphane
2.3.2 方法精密度实验
按实验优化的最佳提取方式和色谱条件,平行测定6次,西兰花和圆红萝卜中萝卜硫素的含量见表7。
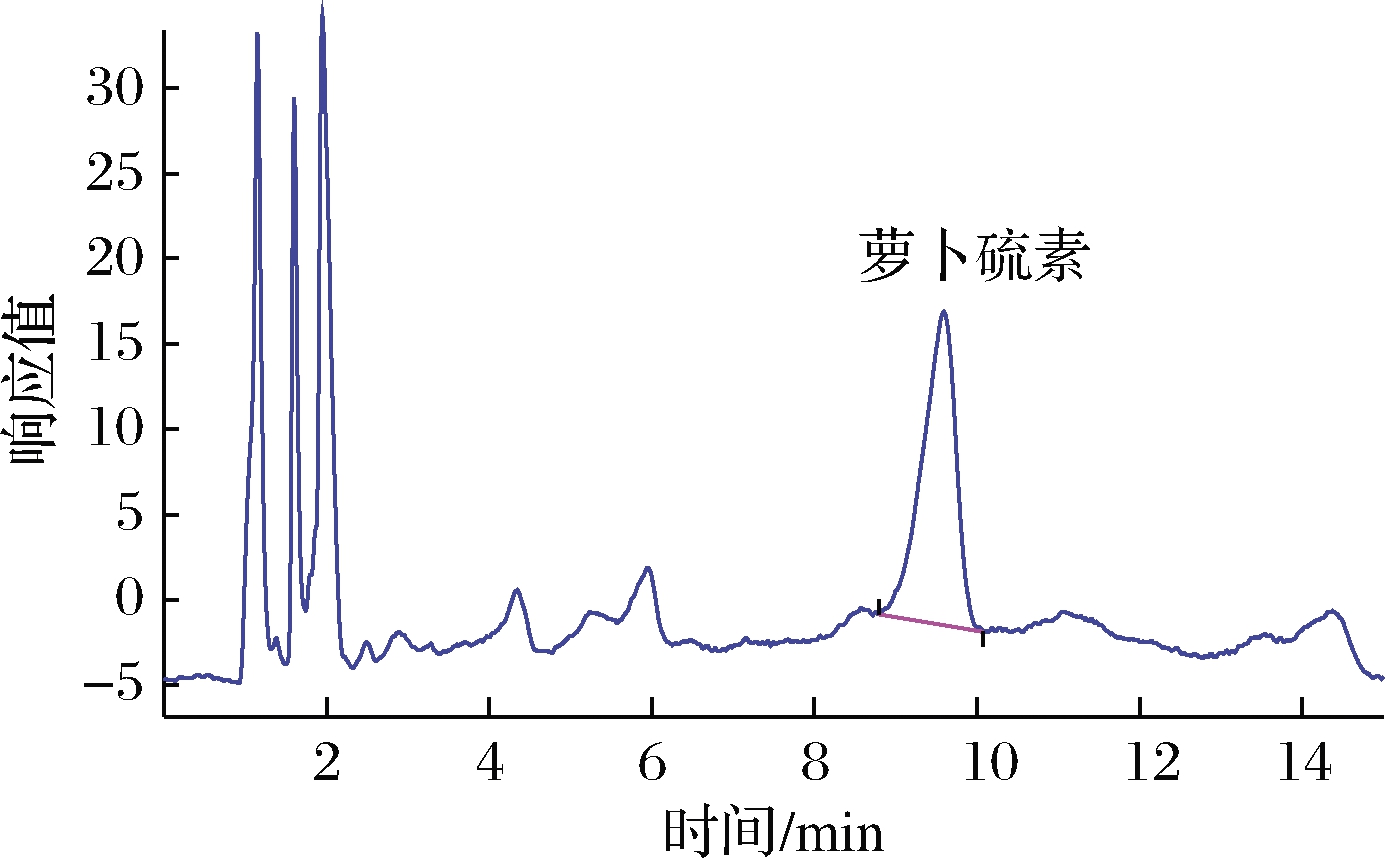
图2 西兰花中萝卜硫素色谱图
Fig2 HPLC chromatograms of sulforaphane in broccoli
由表7知,西兰花和圆红萝卜中萝卜硫素含量的相对标准偏差(RSD)均小于5%,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》[20]要求,表明方法精密度良好。
表7 方法精密度结果(n=6)
Table 7 Results of precision(n=6)
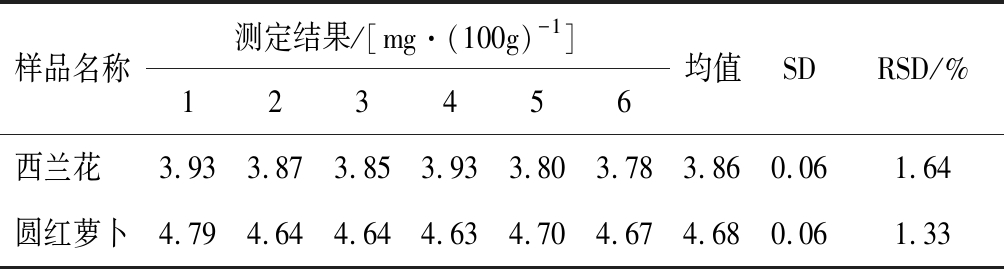
样品名称测定结果/[mg·(100g)-1]123456均值SDRSD/%西兰花 3.933.873.853.933.803.783.860.061.64圆红萝卜4.794.644.644.634.704.674.680.061.33
2.3.3 加标回收率实验
西兰花和圆红萝卜中萝卜硫素3水平3平行加标回收实验结果见表8,由表8可知,西兰花中萝卜硫素的回收率在95.23%~105.55%,平均回收率为100.09%,圆红萝卜中萝卜硫素的回收率在90.88%~99.52%,平均回收率为96.16%,RSD均小于5%,表明方法准确度良好。
表8 加标回收率实验结果(n=3)
Table 8 Results of recovery rate by standard addition(n=3)
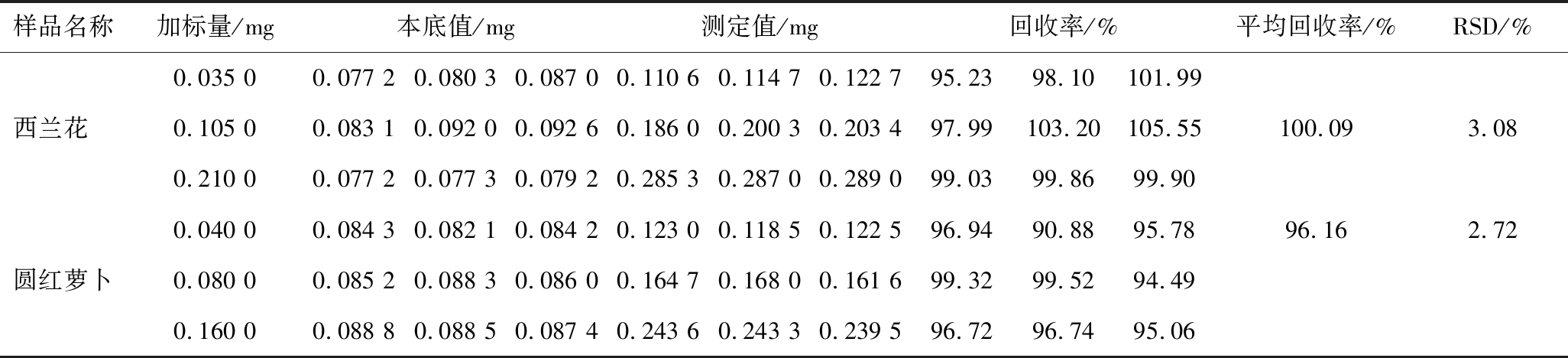
样品名称加标量/mg本底值/mg测定值/mg回收率/%平均回收率/%RSD/%0.035 00.077 20.080 30.087 00.110 60.114 70.122 795.2398.10101.99西兰花 0.105 00.083 10.092 00.092 60.186 00.200 30.203 497.99103.20105.55100.093.080.210 00.077 20.077 30.079 20.285 30.287 00.289 099.0399.8699.900.040 00.084 30.082 10.084 20.123 00.118 50.122 596.9490.8895.7896.162.72圆红萝卜0.080 00.085 20.088 30.086 00.164 70.168 00.161 699.3299.5294.490.160 00.088 80.088 50.087 40.243 60.243 30.239 596.7296.7495.06
2.4 检测方法的应用
选取9种十字花科蔬菜按照实验建立的方法进行测定,结果表明,菜心和紫甘蓝中萝卜硫素的含量较高,大白菜和小白菜中萝卜硫素含量相近,青梗菜花、荠菜和胡萝卜中未检测到萝卜硫素,结果见表9。
表9 十字花科蔬菜中萝卜硫素的含量(n=3)
Table 9 Contents of sulforaphane in cruciferous vegetables (n=3)

样品名称大白菜小白菜菜心圆白菜紫甘蓝青梗菜花芥兰荠菜胡萝卜含量/[mg·(100g)-1]0.807±0.070.811±0.061.32±0.110.488±0.021.42±0.05ND0.500±0.05NDND
注:ND表示未检测到
3 结论
本研究在前人研究的基础上,设计单因素实验,对西兰花中萝卜硫素的提取条件和酶解条件进行优化处理,以萝卜硫素得率高低作为评价指标,得到萝卜硫素的最佳前处理条件为10.0 mL pH=3.0的盐酸水溶液25 ℃水解0.5 h,冷却至室温后,加入 20 mL乙酸乙酯涡旋提取1 min,4 ℃条件下5 000 r/min离心5 min,重复提取2次,45 ℃条件下旋转至干,5 mL乙腈定容,过0.45 μm滤膜后供液相色谱测定。分别称取西兰花和圆红萝卜样品,按照实验优化的方法,平行测定6次,计算萝卜硫素的含量,结果显示,西兰花和圆红萝卜中萝卜硫素精密度的相对标准偏差分别为1.64%和1.33%,均小于5%;向西兰花和圆红萝卜中添加低、中、高3个浓度水平的标准溶液,进行3水平3平行加标回收实验,结果显示,西兰花中萝卜硫素的回收率范围在95.23%~105.55%,平均回收率为100.09%,圆红萝卜中萝卜硫素的回收率在90.88%~99.52%,平均回收率为96.16%,RSD均小于5%,表明添加回收率高,相对标准偏差小,实验建立的方法适合十字花科蔬菜中萝卜硫素的含量的测定。
[1] RONG Y, HUANG L X, YI K Z, et al.Co-administration of sulforaphane and doxorubicin attenuates breast cancer growth by preventing the accumulation of myeloid-derived suppressor cells[J].Cancer Letters, 2020, 493:189-196.
[2] HUANG B, LEI S X, WANG D, et al.Sulforaphane exerts anticancer effects on human liver cancer cells via induction of apoptosis and inhibition of migration and invasion by targeting MAPK7 signalling pathway[J].Journal of B.U.ON.:Official Journal of the Balkan Union of Oncology, 2020, 25(2):959-964.
[3] 韩玉芳, 赵延兵, 李俊, 等.萝卜硫素诱导肝癌Huh-6细胞增殖和凋亡[J].河南科技大学学报(医学版), 2017, 35(4):256-259.
HAN Y F, ZHAO Y B, LI J, et al.Proliferation and apoptosis induced by sulforaphane in cultured human hepatoblastoma Huh-6 Cell[J].Henan Univ Sci Tech(Med Sci), 2017, 35(4):256-259.
[4] GE M, ZHANG L, CAO L, et al.Sulforaphane inhibits gastric cancer stem cells via suppressing sonic hedgehog pathway[J].International Journal of Food Sciences & Nutrition, 2019, 70(5):1-9.
[5] ZHENG Z, LIN K, HU Y, et al.Sulforaphane metabolites inhibit migration and invasion via microtubule-mediated Claudins dysfunction or inhibition of autolysosome formation in human non-small cell lung cancer cells[J].Cell Death and Disease, 2019, 10(4):1 755-1 433.
[6] LUO L, ZHAO H, LUO Q.Swerchirin exerts anticancer activity on SKOV3 human ovarian cancer cells via induction of mitochondrial apoptosis, G2/M cell cycle arrest and inhibition of Raf/MEK/ERK cascade[J].Journal of Buon, 2018, 23(1):111-116.
[7] 张亚芳, 赵晓红, 王德珠, 等.萝卜硫素对宫颈癌HeLa细胞凋亡及放射敏感性的影响[J].中国药业, 2020, 29(15):22-26.
ZHANG Y F,ZHAO X H,WANG D Z,et al.Effect of sulforaphane on apoptosis and radiosensitivity of hela cells of cervical cancer[J].China Pharmaceuticals, 2020, 29(15):22-26.
[8] MA T, ZHENG Z, GUO H, et al.4-O-methylhonokiol ameliorates type 2 diabetes-induced nephropathy in mice likely by activation of AMPK-mediated fatty acid oxidation and Nrf2-mediated anti-oxidative stress[J].Toxicology and Applied Pharmacology, 2019, 370:93-105.
[9] LI Y Y, LIU Y T, YAN X, et al.Pharmacological effects and mechanisms of chinese medicines modulating NLRP3 inflammasomes in ischemic cardio/cerebral vascular disease[J].The American Journal of Chinese Medicine, 2018, 46(8):1 727-1 741.
[10] SIVAKUMAR G, ALIBONI A, BACCHETTA L.HPLC screening of anti-cancer sulforaphane from important European Brassica species[J].Food Chemistry, 2007, 104(4):1 761-1 764.
[11] RENATO I, PATRICK R.HPLC screening of anti-cancer sulforaphane from important European Brassica species[J].Food Chemistry, 2008,108(1):407-408.
[12] NATHAN V M, JOHN A J, ELIZABETH H J.Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli[J].Phytochemistry, 2004, 65(9):1 273-1 281.
[13] ZHANG Z S, WANG L J, LI D, et al.Ultrasound-assisted extraction of oil from flaxseed[J].Separation and Purification Technology, 2008, 62(1):192-198.
[14] VANDUCHOVA A, TOMANKOVA V, ANZENBACHER P, et al.Influence of sulforaphane metabolites on activities of human drug-metabolizing cytochrome P450 and determination of sulforaphane in human liver cells[J].Journal of Medicinal Food, 2016, 19(12):1 141-1 146.
[15] KOKOTOU M G, REVELOU P K, PAPPAS C, et al.High resolution mass spectrometry studies of sulforaphane and indole-3-carbinol in broccoli[J].Food Chemistry, 2017, 237:566-573.
[16] CHAU O,FAWZY E.A new validated HPLC method for the determination of sulforaphane:application to study pharmacokinetics of sulforaphane in rats[J].Biomedical Chromatography, 2016, 30(7):1 016-1 021.
[17] 何珺, 谢述琼, 杨佳年, 等.12种十字花科蔬菜种子中萝卜硫素含量研究[J].食品研究与开发, 2015, 36(4):11-13.
HE J, XIE S Q, YANG JN, et al.Determining the sulforaphane content of twelve cruciferous plants′seeds[J].Food Research And Development, 2015, 36(4):11-13.
[18] 董俊杰, 施琪浩, 张英杰, 等.拓展实验萝卜硫素质谱分析与指认[J].当代化工, 2020, 49(8):1 643-1 646;1 663.
DONG J J, SHI Q H, ZHANG Y J, et al.Mass spectroscopic analysis and identification of sulforaphane for materialsand pharmaceutical professional expansion experiments[J].Contemporary Chemical Industry, 2020, 49(8):1 643-1 646;1 663.
[19] 赵登奇, 孙亚天, 黄建颖, 等.西兰花叶中生物活性成分的测定[J].核农学报, 2020, 34(6):1 266-1 271.
ZHAO D Q, SUN Y T, HUANG J Y, et al.Determination of bioactive components in broccoli leaves[J].Journal of Nuclear Agricultural Sciences, 2020, 34(6):1 266-1 271.
[20] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 27404—2008食品安全国家标准 实验室质量控制规范 食品理化检测[S].北京:中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China.GB/T 27404—2008 Standardization Administration.Criterion on quality control of laboratories-chemical testing of food[S].Beijing:Standards Press of China, 2008.
[21] BERTELLI D, PLESSI M, BRGHIROLI D, et al.Separation by solid phase extraction and quantification by reverse phase HPLC of sulforaphane in broccoli[J].Food Chemistry, 1998, 63(3):417-421.
[22] 张品南, 马绍英, 杨海荣, 等.西兰花种子及其愈伤组织中萝卜硫素含量比较[J].天然产物研究与开发, 2013, 25(6):796-798;811.
ZHANG P N, MA SY, YANG H R, et al.Comparison of sulforaphen content in seeds and callus induced from different organs of broccoli species[J].Nat Prod Res Dev, 2013, 25(6):796-798;811.